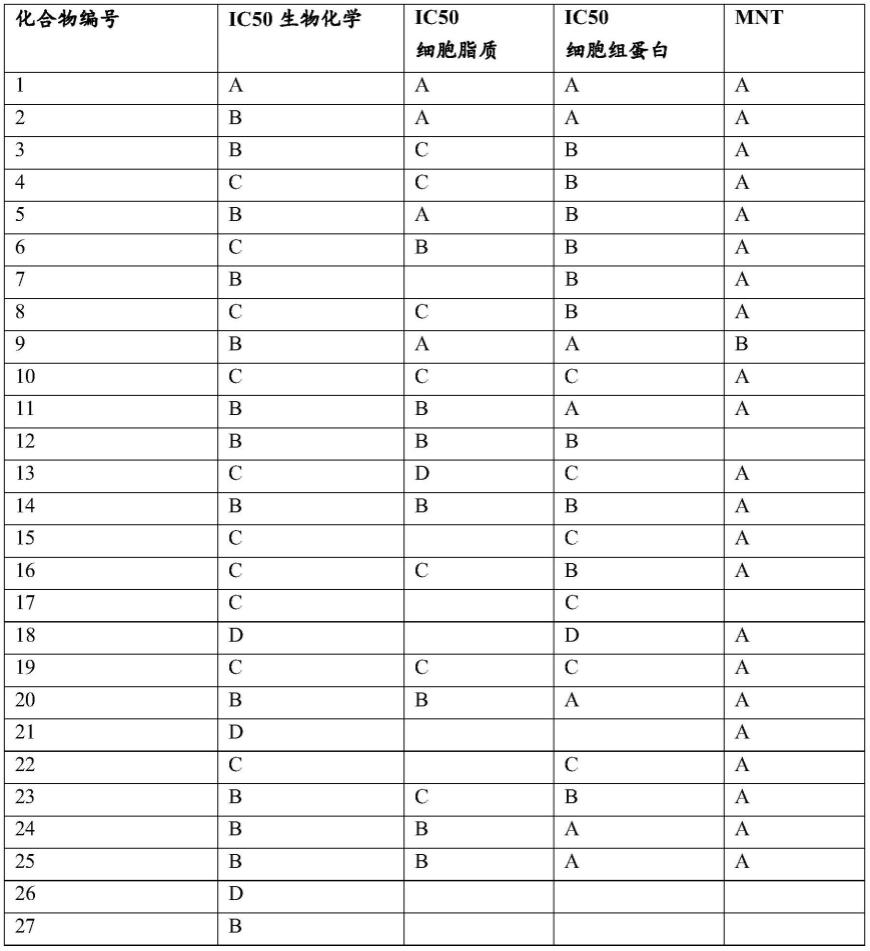
prostatectomy:implications for clinicians”(front oncol,第6卷,第117期,2016年))。rt根除前列腺床中的剩余的癌细胞是在rp后psa增大之后挽救生存率的主要处置选项之一。挽救性放疗(srt)的有效性使18%至90%的患者达到了5年的bpfs,具体取决于多种因素(参见herrera f.g.和berthold d.r.,2016年,出处同上,以及pisansky t.m.等人“salvage radiation therapy dose response for biochemical failure of prostate cancer after prostatectomy
–
a multi-institutional observational study”(int j radiat oncol biol phys,第96卷,第5期,第1046-1053页,2016年))。
6.很明显,对于某些患者组,根治性rt或挽救性rt是无效的。rt能够导致的严重副作用(例如,肠道炎症和功能障碍、尿失禁和勃起功能障碍)甚至使他们的情况更加恶化(参见resnick m.j.等人的“long-term functional outcomes after treatment for localized prostate cancer”(n engl j med,第368卷,第5期,第436-445页,2013年)和hegarty s.e.等人的“radiation therapy after radical prostatectomy for prostate cancer:evaluation of complications and influence of radiation timing on outcomes in a large,population-based cohort”(plos one,第10卷,第2期,2015年))。另外,基于医疗保险报销的一个rt疗程的成本的中位值为18000美元,该成本的差异很大,最高达到约40000美元(参见paravati a.j.等人的“variation in the cost of radiation therapy among medicare patients with cancer”(j oncol pract,第11卷,第5期,第403-409页,2015年))。这些数字不包括在根治性rt和挽救性rt后的后续护理的可观的纵向成本。
7.对每个患者的rt有效性的改进预测(无论是在根治性背景中还是在挽救性背景中)都将改进治疗选择和提高潜在生存率。这能够通过以下操作来实现:1)为那些预测rt有效的患者优化rt(例如通过剂量递增或不同的开始时间),以及2)将预测rt无效的患者引导到可能更有效的处置形式的替代方案。另外,这将减少那些免于无效治疗的患者的痛苦并减少在无效治疗上花费的成本。
8.对根治性rt的反应预测指标已经进行了大量的研究(参见hall w.a.等人的“biomarkers of outcome in patients with localized prostate cancer treated with radiotherapy”(semin radiat oncol,第27卷,第11-20页,2016年)和raymond e.等人的“an appraisal of analytical tools used in predicting clinical outcomes following radiation therapy treatment of men with prostate cancer:a systematic review”(radiat oncol,第12卷,第1期,第56页,2017年)和srt(参见herrera f.g.和berthold d.r.,2016年,出处同上))。这些指标中的许多指标取决于基于血液的生物标志物psa的浓度。为在rt(根治性以及挽救性)开始前预测反应而研究的度量包括psa浓度的绝对值、psa相对于前列腺体积的绝对值、一定时间内的绝对增大量和倍增时间。其他经常考虑的因素是gleason评分和临床肿瘤阶段。对于srt背景,其他因素是相关的,例如,手术切缘状态、rp后复发时间、手术前/围手术期psa值和临床病理参数。
9.虽然这些临床变量在各个风险组中的患者分层方面提供了有限的改进,但是仍然需要更好的预测工具。
10.已经研究了在组织和体液中种类众多的候选生物标志物,但是验证通常很有限并且通常证明预后信息并且不是预测(治疗特异性)值(参见hall w.a.等人,2016年,出处同
上)。当前,商业组织正在验证少数基因表达板。这些基因表达板中的一种或多种基因表达板可以示出对未来的rt的预测值(参见dal pra a.等人,2018年,出处同上)。
11.总之,对于原发性前列腺癌以及术后环境,仍然强烈需要对rt的反应的更好预测。
12.wo 2018/189403公开了一种用于预测患有固体癌症的患者在放疗后的癌症预测的方法。它研究了质子(p)与光子(x)辐射在头颈部鳞状细胞癌(finscc)细胞中的比较生物学作用,并且证明了在finscc细胞和mdb细胞中p辐射和x辐射在基因和蛋白水平上都诱导出vegf-c过表达以及vegf-c是经由促进淋巴管起源对finscc患者的辐照后疾病进展的主要因素。
13.wo 2015/048801a2公开了一种处置患有与cxcr8信号转导增加有关的疾病的对象的方法。该方法包括在该对象中破坏由配体cxcl17对受体cxcr8的激活。在该方法中,破坏能够包括对对象施用干扰cxcl17与cxcr8结合的物质。
技术实现要素:
14.本发明的目的是提供一种预测前列腺癌对象对放疗的反应的方法,该方法允许做出更好的处置决策。本发明的另外的目的是提供诊断试剂盒、该试剂盒在预测前列腺癌对象对放疗的反应的方法中的用途、一种或多种趋化因子基因中的每种趋化因子基因的基因表达谱在对前列腺癌对象的放疗预测中的用途,以及对应的计算机程序产品。
15.在本发明的第一方面,提出了一种预测前列腺癌对象对放疗的反应的方法,包括:
16.确定针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱或接收对针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱的确定的结果,(一个或多个)所述基因表达谱是在从所述对象获得的生物样本中确定的,
17.优选由处理器基于针对所述一种或两种趋化因子基因的(一个或多个)所述基因表达谱来确定对放疗反应的预测,并且
18.任选地,将所述预测或基于所述预测的治疗推荐提供给医护人员或所述对象。
19.近年来,免疫系统在癌症抑制以及癌症起始、促进和转移中的重要作用已经变得非常明显(参见mantovani a.等人的“cancer-related inflammation”(nature,第454卷,第7203期,第436-444页,2008年)以及giraldo n.a.等人的“the clinical role of the tme in solid cancer”(br j cancer,第120卷,第1期,第45-53页,2019年))。免疫细胞及其分泌的分子构成了肿瘤微环境的重要组成部分,并且大多数免疫细胞能够浸润肿瘤组织。免疫系统和肿瘤相互影响和塑造。因此,抗肿瘤免疫能够防止肿瘤形成,而炎症性肿瘤环境可以促进癌症的起始和增殖。同时,可能以独立于免疫系统的方式起源的肿瘤细胞将通过募集免疫细胞来塑造免疫微环境,并且能够具有促炎作用,同时也抑制抗癌免疫。
20.肿瘤微环境中的一些免疫细胞要么具有一般的肿瘤促进作用,要么具有一般的肿瘤抑制作用,而另一些免疫细胞则表现出可塑性,并且同时显示出肿瘤促进潜力和肿瘤抑制潜力。因此,肿瘤的整体免疫微环境是以下这些项目的混合物:存在的各种免疫细胞、这些免疫细胞产生的细胞因子,以及这些免疫细胞与肿瘤微环境中的肿瘤细胞和其他细胞的相互作用(参见giraldo n.a.等人,2019年,出处同上)。
21.上述关于免疫系统在癌症中的作用原理通常也适用于前列腺癌。慢性炎症与良性
和恶性前列腺组织的形成有关(参见hall w.a.等人,2016年,出处同上),并且大多数前列腺癌组织样本显示出免疫细胞浸润。具有肿瘤促进作用的特定免疫细胞的存在与较差的预后相关,而其中自然杀伤细胞更活跃的肿瘤显示出更好的对治疗的反应和更长的无复发期(参见shiao s.l.等人的“regulation of prostate cancer progression by tumor microenvironment”(cancer lett,第380卷,第1期,第340-348页,2016年))。
22.虽然治疗会受到肿瘤微环境的免疫成分的影响,但是rt本身会广泛地影响这些成分的构成(参见barker h.e.等人的“the tumor microenvironment after radiotherapy:mechanisms of resistance or recurrence”(nat rev cancer,第15卷,第7期,第409-425页,2015年))。因为抑制细胞类型对辐射不太敏感,所以它们的相对数量会增大。相反,造成的辐射损伤会激活细胞存活途径并刺激免疫系统,从而引发炎症反应和免疫细胞募集。净效应是促进肿瘤还是抑制肿瘤尚不确定,但是正在研究其增强癌症免疫治疗的潜力。
23.本发明基于这样的构思:由于免疫系统和免疫微环境的状态对治疗有效性有影响,因此识别预测这种效果的标志物的能力可能有助于能够更好地预测总体rt反应。
24.趋化因子是小的、分泌的蛋白质,其以其在介导免疫细胞运输和淋巴组织发育中的作用而闻名。趋化因子是细胞因子的最大亚科,并且能够被进一步细分成四个主要类别,这取决于其蛋白质序列中的前两个半胱氨酸(c)残基(即,cc-趋化因子、cxc-趋化因子、c趋化因子和cx3c-趋化因子)的位置。
25.趋化因子超家族中存在重要程度的冗余,其中,许多配体结合不同的受体(并且反之亦然)。在肿瘤微环境中,趋化因子能够由肿瘤细胞和其他细胞(包括免疫细胞和基质细胞)来表达。响应于特定的趋化因子,不同的免疫细胞亚群迁移到肿瘤微环境中,并且以时空的方式调节肿瘤免疫反应。此外,趋化因子能够直接靶向肿瘤微环境中的非免疫细胞(包括肿瘤细胞和血管内皮细胞),并且已经示出它们可以调节肿瘤细胞增殖、癌症干细胞样细胞特性、癌症浸润性和转移。因此,趋化因子直接和间接地影响肿瘤免疫,塑造肿瘤免疫和生物学表型,并且影响癌症进展、治疗和患者预后(参见nagarsheth n.等人的“chemokines in the cancer microenvironment and their relevance in cancer immunotherapy”(nat rev immunol,第17卷,第9期,第559-572页,2017年))。
26.趋化因子能够直接和间接地靶向肿瘤中的肿瘤干细胞样细胞和基质细胞。趋化因子-趋化因子受体信号传导通路会影响肿瘤细胞增殖、干性和血管生成,从而最终改变患者的肿瘤转移和疾病预后。该表达受癌症内在遗传和表观遗传机制和肿瘤微环境中的环境线索的调节。例如,ccl18能够通过例如促进乳腺癌、胰腺癌、卵巢癌和前列腺癌中的浸润、转移和emt来直接影响肿瘤细胞(参见nagarsheth n.等人,2017年,同上)。此外,cxcl17在乳腺癌和结肠癌中表达,并且充当单核细胞、巨噬细胞以及成熟和未成熟dc的趋化剂,从而在血管生成中起到重要作用。然而,cxcl17的确切机制和功能仍不清楚(参见heras s.c.las和mart
í
nez-balibreae.的“cxc family of chemokines as prognostic or predictive biomarkers and possible drug targets in colorectal cancer”(world journal of gastroenterology,第24卷,第42期,第4738-4749页,2018年))。
27.已经在所谓“远位效应”和rt引起的其他免疫激活方面对rt效应执行了几项研究(参见herrera f.g.等人的“radiotherapy combination opportunities leveraging immunity for the next oncology practice”(ca:a cancer journal for clinicians,
id no:3中显示的序列的相同程度为至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的核酸序列,或与seq id no:4中显示的序列的相同程度为至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的氨基酸序列,或与seq id no:4中显示的序列的相同程度为至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的编码氨基酸序列的核酸序列,或与seq id no:3中显示的序列的相同程度为至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的被核酸序列编码的氨基酸序列。
34.术语“生物样本”或“从对象获得的样本”是指经由本领域技术人员已知的合适方法从对象(例如,前列腺癌患者)获得的任何生物材料。可以以临床上可接受的方式(例如以保存核酸(特别是rna)或蛋白质的方式)收集所使用的生物样本。
35.(一个或多个)生物样本可以包括身体组织和/或体液,例如但不限于血液、汗液、唾液和尿液。此外,生物样本可以包含来源于上皮细胞或包括上皮细胞的细胞群(例如,癌性上皮细胞或来源于疑似癌性的组织的上皮细胞)的细胞提取物。生物样本可以包含来源于腺体组织的细胞群,例如,样本可以来源于男性对象的前列腺。另外,如果有必要的话,可以从获得的身体组织和体液纯化细胞,然后将经纯化的细胞用作生物样本。在一些实现方式中,样本可以是组织样本、尿液样本、尿沉渣样本、血液样本、唾液样本、精液样本、包括循环肿瘤细胞的样本、细胞外囊泡、含有前列腺分泌的外泌体的样本或细胞系或癌细胞系。
36.在一个特定的实现方式中,可以获得和/或使用活检或切除样本。这样的样本可以包括细胞或细胞裂解物。
37.还可以设想将生物样本的内容物提交给富集步骤。例如,样本可以与针对细胞膜或某些细胞类型的细胞器特异性的配体(例如,(例如用磁性颗粒功能化的)前列腺细胞)接触。通过磁性颗粒浓缩的材料随后可以用于如上文或下文所述的检测步骤和分析步骤。
38.此外,可以经由对体液或液体样本(例如,血液、尿液等)的过滤过程来富集细胞(例如,肿瘤细胞)。这种过滤过程也可以与基于如上文所述的配体特异性相互作用的富集步骤进行组合。
39.术语“前列腺癌”是指男性生殖系统中的前列腺的癌症,这种癌症是在前列腺的细胞发生突变并开始失控增殖时发生的。通常,前列腺癌与前列腺特异性抗原(psa)水平升高有关。在本发明的一个实施例中,术语“前列腺癌”是指显示出高于3.0的psa水平的癌症。在另一实施例中,该术语是指显示出高于2.0的psa水平的癌症。术语“psa水平”是指血液中psa的浓度(以ng/ml为单位)。
40.术语“非进展性前列腺癌状态”意指个体的样本并未显示出指示“生化复发”和/或“临床复发”和/或“转移”和/或“去势抵抗性疾病”和/或“前列腺癌或疾病特异性死亡”的参数值。
41.术语“进展性前列腺癌状态”意指个体的样本显示出指示“生化复发”和/或“临床复发”和/或“转移”和/或“去势抵抗性疾病”和/或“前列腺癌或疾病特异性死亡”的参数值。
42.术语“生化复发”通常是指psa升高的复发生物学值,其指示样本中存在前列腺癌细胞。然而,也可以使用能够用于检测前列腺癌细胞存在或引起对这种存在的怀疑的其他标志物。
43.术语“临床复发”是指存在指示以下信息的临床症状:通过测量(例如使用体内成
像)而指示存在肿瘤细胞。
44.术语“转移”是指在除了前列腺以外的器官中存在转移性疾病。
45.术语“去势抵抗性疾病”是指存在对激素不敏感的前列腺癌;即,前列腺中的癌症不再对雄激素阻断治疗(adt)产生反应。
46.术语“前列腺癌特异性死亡或疾病特异性死亡”是指患者死于前列腺癌。
47.优选地,一种或两种趋化因子基因都包括两种趋化因子基因。
48.优选地,对所述放疗反应的所述预测的确定包括将针对所述两种趋化因子基因的所述基因表达谱与已经从前列腺癌对象的群体中导出的回归函数进行组合。
49.cox比例风险回归允许分析若干风险因素对到测试事件的时间(如生存期)的影响。因此,风险因素可能是二分或离散变量,如风险评分或临床分期,但也可能是连续变量,如生物标志物测量结果或基因表达值。终点(例如,死亡或疾病复发)的概率被称为风险。仅次于关于患者队列中的对象是否到达测试终点的信息(例如,患者是否确实死亡),在回归分析中还考虑了到终点的时间。该风险被建模为:h(t)=h0(t)
·
exp(w1·v1
w2·v2
w3·v3
…
),其中,v1、v2、v3…
是预测变量,并且h0(t)是基线风险,而h(t)是任何时间t时的风险。风险比率(或到达事件的风险)由ln[h(t)/h0(t)]=w1·v1
w2·v2
w3·v3
…
来表示,其中,系数或权重w1、w2、w3…
是通过cox回归分析来估计的,并且能够以与逻辑回归分析类似的方式进行解读。
[0050]
在一个特定的实现方式中,放疗反应的预测被确定如下:
[0051]
(w1·
ccl2) (w2·
cxcl17)
ꢀꢀ
(1)
[0052]
其中,w1和w2是权重,并且ccl2和cxcl17是趋化因子基因的表达水平。
[0053]
在一个示例中,w1可能约为-2.0至-1.0,例如,-1.6167,并且w2可能约为1.0至2.0,例如,1.2698。
[0054]
基于放疗反应的预测的值,还可以将放疗反应的预测分类或归类到至少两个风险组之一。例如,可能有两个风险组或三个风险组或四个风险组或四个以上的预定义风险组。每个风险组覆盖放疗反应的预测的(非交叠)值的相应范围。例如,风险组可以指示特定临床事件发生的概率,其范围从0至《0.1或从0.1至《0.25或从0.25至《0.5或从0.5至1.0等。
[0055]
进一步优选地,对所述放疗反应的所述预测的所述确定还基于从所述对象获得的一个或多个临床参数。
[0056]
如上所述,已经研究了基于临床参数的各种指标。通过使对放疗反应的预测还基于(一个或多个)这样的临床参数,能够可能进一步改进预测。
[0057]
优选地,一个或多个临床参数包括以下各项中的一项或多项:(i)前列腺特异性抗原(psa)水平;(ii)病理格里森评分(pgs);iii)临床肿瘤阶段;iv)病理格里森分级组(pggg);v)病理阶段;vi)一个或多个病理变量,例如,手术边缘和/或淋巴结浸润和/或前列腺外生长和/或精囊浸润的状态;vii)capra-s;以及viii)另一临床风险评分。
[0058]
进一步优选地,对所述放疗反应的所述预测的确定包括将针对所述一种或两种趋化因子基因的所述基因表达谱和从所述对象获得的所述一个或多个临床参数与已经从前列腺癌对象的群体中导出的回归函数进行组合。
[0059]
在一个特定的实施方式中,如下确定放疗反应的预测:
[0060]
(w1·
ccl2) (w2·
cxcl17) (w3·
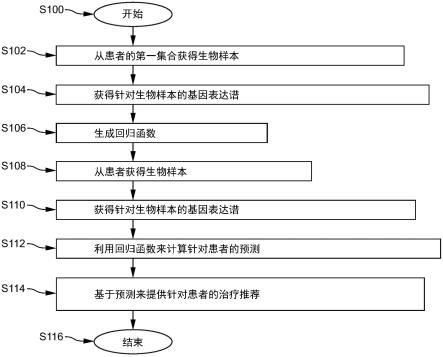
pggg)
ꢀꢀ
(2)
[0061]
其中,w1至w3是权重,ccl2和cxcl17是趋化因子基因的表达水平,并且pggg是病理格里森分级组。
[0062]
在一个示例中,w1可能约为-1.5至-0.5,例如,-1.1968,w2可能约为1.0至2.0,例如,1.3024,并且w3可能约为0.5至1.5,例如,0.8534。
[0063]
优选地,所述生物样本是在所述放疗开始之前从所述对象获得的。可以在前列腺癌的组织中以mrna或蛋白质的形式确定(一个或多个)基因表达谱。备选地,如果趋化因子以可溶性形式存在,则可以在血液中确定(一个或多个)基因表达谱。
[0064]
进一步优选的是,所述放疗为根治性放疗或挽救性放疗。
[0065]
优选的是,对所述放疗反应的所述预测是针对所述放疗的有效性为负面的或正面的,其中,治疗是基于所述预测来推荐的,并且如果所述预测是负面的,则所推荐的治疗包括以下各项中的一项或多项:(i)作为标准的较早提供的放疗;(ii)具有增大的辐射剂量的放疗;(iii)辅助治疗,例如,雄激素阻断治疗;以及iv)作为非辐射治疗的替代治疗。预测为负面的程度可以决定所推荐的治疗偏离标准形式的放疗的程度。
[0066]
在本发明的另外的方面中,提出了一种用于预测前列腺癌对象对放疗的反应的装置,包括:
[0067]
输入部,其适于接收指示针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱的数据,(一个或多个)所述基因表达谱是在从所述对象获得的生物样本中确定的,
[0068]
处理器,其适于基于针对所述一种或两种趋化因子基因的(一个或多个)所述基因表达谱来确定对放疗反应的预测,以及
[0069]
任选地,提供单元,其适于将所述预测或基于所述预测的治疗推荐提供给医护人员或所述对象。
[0070]
在本发明的另外的方面中,一种包括指令的计算机程序产品,当所述程序由计算机运行时,所述指令使所述计算机执行包括以下操作的方法:
[0071]
接收指示针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱的数据,(一个或多个)所述基因表达谱是在从对象获得的生物样本中确定的,
[0072]
基于针对所述一种或两种趋化因子基因的(一个或多个)所述基因表达谱来确定对放疗反应的预测,并且
[0073]
任选地,将所述预测或基于所述预测的治疗推荐提供给医护人员或所述对象。
[0074]
在本发明的另外的方面中,提出了一种诊断试剂盒,包括:
[0075]
至少一个引物和/或探针,其用于在从对象获得的生物样本中确定针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱,
[0076]
根据权利要求10所述的装置或根据权利要求11所述的计算机程序产品。
[0077]
在本发明的另外的方面,提出了一种根据权利要求12所述的试剂盒的用途。
[0078]
优选地,根据权利要求13所述的用途在预测前列腺癌对象对放疗的反应的方法中。
[0079]
在本发明的另外的方面,提出了一种方法,包括:
[0080]
接收从前列腺癌对象获得的生物样本,
[0081]
使用根据权利要求12所述的试剂盒来在从所述对象获得的所述生物样本中确定针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱。
[0082]
在本发明的另外的方面,一种针对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱在预测前列腺癌对象对放疗的反应的方法中的用途,包括:
[0083]
优选由处理器基于针对所述一种或两种趋化因子基因的(一个或多个)所述基因表达谱来确定对放疗反应的预测,并且
[0084]
任选地,将所述预测或基于所述预测的治疗推荐提供给医护人员或所述对象。
[0085]
应当理解,根据权利要求1所述的方法、根据权利要求10所述的装置、根据权利要求11所述的计算机程序产品、根据权利要求12所述的诊断试剂盒、根据权利要求13所述的诊断试剂盒的用途、根据权利要求15所述的方法和根据权利要求16所述的(一个或多个)基因表达曲线的用途具有相似和/或相同的优选实施例,特别是与在从属权利要求中定义的相似和/或相同的优选实施例。
[0086]
应当理解,本发明的优选实施例也能够是从属权利要求或以上实施例与相应的独立权利要求的任何组合。
[0087]
参考下文描述的实施例,本发明的这些方面和其他方面将显而易见并且得到阐述。
附图说明
[0088]
在以下附图中:
[0089]
图1示意性且示例性地示出了预测前列腺癌对象对放疗的反应的方法的实施例的流程图。
[0090]
图2示出了两个预测模型的roc曲线分析。
[0091]
图3示出了capra-s评分类别的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到发生转移(ttm)的时间。
[0092]
图4示出了趋化因子&pggg组合模型(cxc&pggg_model)的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到发生转移(ttm)的时间。
[0093]
图5示出了capra-s评分类别的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。
[0094]
图6示出了趋化因子&pggg组合模型(cxc&pggg_model)的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。
[0095]
图7示出了趋化因子1基因模型(ccl2_model)的kaplan-meier曲线。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。
[0096]
图8示出了另一趋化因子1基因模型(cxcl17_model)的kaplan-meier曲线。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。
具体实施方式
[0097]
放疗反应预测概述
[0098]
图1示意性且示例性地示出了预测前列腺癌对象对放疗的反应的方法的实施例的流程图。
[0099]
该方法开始于步骤s100。
[0100]
在步骤s102处,从被诊断患有前列腺癌的患者(对象)的第一集合中的每个患者(对象)获得生物样本。优选地,在获得生物样本后的一段时间内(例如,至少一年,或至少两年,或大约五年),对这些前列腺癌患者执行了前列腺癌监测。
[0101]
在步骤s104处,针对从患者的第一集合获得的生物样本中的每个生物样本,(例如通过对从每个生物样本中提取的rna执行rt-qpcr(实时定量pcr))获得从包括ccl2和cxcl17的组中选择的两种趋化因子基因中的每种趋化因子基因的基因表达谱。示例性基因表达谱包括针对两种趋化因子基因中的每种趋化因子基因的表达水平(例如,值)。
[0102]
在步骤s106处,基于针对患者的第一集合获得的生物样本中的至少一些生物样本获得的两种趋化因子基因(ccl2和cxcl17)的基因表达谱以及根据监测所获得的相应结果来确定用于分配对放疗反应的预测的回归函数。在一个特定的实现方式中,回归函数是根据上面的公式(1)中指定的那样确定的。
[0103]
在步骤s108处,从患者(对象或个体)获得生物样本。患者能够是新的患者或第一集合中的一个患者。
[0104]
在步骤s110处,例如通过对生物样本执行pcr来获得两种趋化因子基因中的每种趋化因子基因的基因表达谱。
[0105]
在步骤s112处,使用回归函数来确定针对患者的基于两种趋化因子基因的基因表达谱的放疗反应的预测。这将稍后在说明书中更详细地描述。
[0106]
在s114处,可以基于预测向例如患者或其监护人员、医生或另一医疗保健工作人员提供治疗建议。为此目的,可以基于预测的值将预测分类到风险组的预定义集合中的一个风险组中。在一个特定的实现方式中,对放疗反应的预测是针对放疗的有效性为负面的或正面的。如果预测是负面的,则所推荐的治疗包括以下各项中的一项或多项:(i)比标准更早提供的放疗;(ii)具有增大的辐射剂量的放疗;(iii)辅助治疗,例如,雄激素阻断治疗;以及iv)作为非辐射治疗的替代治疗。
[0107]
该方法在s116处结束。
[0108]
在一个实施例中,通过使用八个或更多个引物和/或探针和/或它们的八个或更多个集合检测mrna表达来确定在步骤s104和s110处的基因表达谱。
[0109]
在一个实施例中,步骤s104和s110还包括从患者的第一集合和该患者获得一个或多个临床参数。一个或多个临床参数可以包括以下各项中的一项或多项:(i)前列腺特异性抗原(psa)水平;(ii)病理格里森评分(pgs);iii)临床肿瘤阶段;以及iv)病理格里森分级组(pggg);v)病理阶段;vi)一个或多个病理变量,例如,手术边缘和/或淋巴结浸润和/或前
列腺外生长和/或精囊浸润的状态;vii)capra-s;以及viii)另一临床风险评分。然后,用于分配在步骤s106中确定的放疗反应的预测的回归函数还基于从患者的第一集合中的至少一些患者获得的一个或多个临床参数。在步骤s112中,对放疗反应的预测然后还基于从患者获得的一个或多个临床参数(例如,病理格里森分级组(pggg)),并且是使用回归函数对患者确定的。
[0110]
免疫系统在全身性水平和肿瘤微环境中都与前列腺癌强烈相互作用。趋化因子在介导免疫细胞运输和淋巴组织发育中起着核心作用。因此,它们在对肿瘤的免疫反应中起着重要作用。因此,趋化因子及其与肿瘤微环境中的免疫活性的链接可以提供关于rt的有效性的信息。然而,大约有100种不同的起作用的分子。由于影响趋化因子的确切功能的许多因素,因此根据现有文献弄清楚趋化因子家族中的哪些成员在该应用中可能具有预测价值是及其困难的。
[0111]
我们研究了趋化因子及其受体在前列腺癌组织中的表达与根治性rt或srt后疾病复发相关的程度。
[0112]
在超过100个趋化因子和趋化因子受体的初始列表中,我们已经专注于34个趋化因子和趋化因子受体(表1),其被包括在详细分析中。在该列表中,我们已经在151名前列腺癌患者的队列中识别出趋化因子家族的两个成员和趋化因子受体,其中,前列腺癌组织中的表达程度与srt后死亡率显著相关。此外,分子还示出与在151个患者的队列中的srt后转移的发生的显著相关性。
[0113]
表1:趋化因子被包括在详细分析中。
[0114]
[0115][0116]
基于与rt后的结果的显著相关性,我们预计所识别的分子将提供关于根治性rt和/或srt的有效性的预测价值。
[0117]
表2:在具有151个前列腺癌患者的人群中进行的单变量cox回归分析。患者人群中的测试终点是a)治疗后无转移进展生存期,以及b)在手术后疾病复发后接受挽救性放射治疗(srt)的男性的处置后疾病特异性生存期。每个端点的事件数和百分比都被指示在括号中。该表指示了针对每个测试的趋化因子基因的、在风险(危险比)和显著性(p值)方面与测试终点的关联。
[0118][0119]
已经示出,cxcl17在结肠癌组织和乳腺癌组织中更加丰富。heras s.c.las和mart
í
nez-balibrea e.(2018年,同上)暗示cxcl17的高表达可能是结肠癌预后不良的指标。然而,它们并不针对前列腺癌和辐射治疗指示cxcl17。ccl2已被示出为前列腺癌的潜在生物标志物。与邻近的正常组织相比,肿瘤组织中的ccl2(与ccr6结合)显著更高。与对照组相比,pca患者的血液样本中的ccl2也显著更高(参见tsaur i.等人,2014,同上)。然而,作者仅将ccl2表达与pca患者的潜在诊断标志物链接(类似于psa的)。他们还指出,ccl2与肿瘤阶段和分级缺乏关联性,这意味着:在他们的视角中,ccl2可能不允许评价肿瘤播散。另外,其不将ccl2与风险分层和/或辐射治疗链接。
[0120]
总之,ccl2和cxcl17的组合在前列腺癌和/或与辐射治疗结合的领域示出明显的
额外优势。
[0121]
结果
[0122]
cox回归分析
[0123]
然后,我们着手测试这两种趋化因子和趋化因子受体的组合是否会表现出更大的预后价值。利用cox回归,我们将两种趋化因子的表达水平建模为术后挽救性rt后的前列腺癌特异性死亡,在存在可变病理格里森分级组(pggg)的情况下利用(cxc&pggg_model),在不存在可变病理格里森分级组(pggg)的情况下利用(cxc_model)。我们在roc曲线分析以及kaplan-meier生存分析中测试了这两个模型。
[0124]
cox回归函数导出如下:
[0125]
cxc_model:
[0126]
(w1
·
ccl2) (w2
·
cxcl17)
[0127]
cxc&pggg_model:
[0128]
(w1
·
ccl2) (w2
·
cxcl17) (w3
·
pggg)
[0129]
权重w1至w3的详细信息如下表3所示。
[0130]
表3:两个cox回归模型(即,趋化因子模型(cxc_model)和趋化因子&pggg组合模型(cxc&pggg_model))的变量和权重;na-不可用。
[0131][0132]
roc曲线分析
[0133]
接下来,我们测试了如上面概述的超过其能力的组合的cox回归模型以预测在因手术后疾病复发而引起的挽救性辐射开始后的10年内前列腺癌特异性死亡。将模型的性能与临床风险评分capra-s进行比较(参见cooperberg m.r.等人的“the capra-s score:a straightforward tool for improved prediction of outcomes after radical prostatectomy”(cancer,第117卷,第22期,第5039-5046页,2011年))。
[0134]
图2示出了两个预测模型的roc曲线分析。cxc&pggg_model(auc=0.89)是基于两种趋化因子基因和病理格里森分级组(pggg)信息的cox回归模型。capra_s(auc=0.74)是临床capra-s评分(前列腺癌风险评估评分)。
[0135]
kaplan-meier生存分析
[0136]
对于kaplan-meier曲线分析,基于如根据cxc&pggg_model计算出的风险评分的三分位数将组合的风险模型(cxc&pggg_model)的cox回归函数归类为三个子队列。此外,分析了临床capra-s评分(前列腺癌风险评估评分)的性能。
[0137]
患者类别表示自创建的组合风险模型(cxc&pggg_model)和capra-s评分的挽救性rt开始以来经历被测试的到转移发展的时间的临床终点的增加的风险(图3和图4)或到前列腺癌特异性死亡的时间的临床终点的增加的风险(图5和图6)。
[0138]
图3示出了capra-s评分的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到发生转移(ttm)的时间。根据其经历如通过相
应逻辑回归模型预测的临床终点的风险(logrankp=0.0026;hr(中等风险与低风险)=10.1;95%;95%ci=4.8-21.2;hr(高风险与低风险)=14.9;95%ci=6.5-33.4)将患者分层为三组(1)capra-s评分0-2(低风险);(2)capra-s评分3-5(中等风险);(3)capra-s评分》5(高风险)。以下补充列表指示了针对被分析的capra-s评分类别的风险中的患者的数量,即,示出了在手术后任何时间间隔 20个月的风险中的患者:低风险:22、21、21、20、18、17、11、0、0;中等风险:68、58、53、50、42、33、31、14、2、0;高风险:45、32、29、27、22、16、15、4、1、0。
[0139]
图4示出了cxc&pggg_model的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到发生转移(ttm)的时间。根据其经历如通过cxc&pggg回归模型预测的临床终点的风险(logrankp《0.0001;hr(第二三分位数与第一三分位数)=1.1;95%ci=0.6-2.1;hr(第三三分位数与第一三分位数)=4.9;95%ci=2.3-10.5),将患者分层成三个队列(第一三分位数、第二三分位数、第三三分位数)。以下补充列表指示了针对被分析的cxc&pggg_model类别的风险中的患者的数量,即,示出了在手术后的任何时间间隔 20个月的风险患者:第一三分位数:50、45、43、43、37、30、28、20、3、0;第二三分位数:47、42、42、39、34、29、27、5、0、0;第三三分位数:38、24、18、16、13、8、8、4、0、0。
[0140]
图5示出了capra-s评分的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。根据其经历如通过相应的逻辑回归模型预测的临床终点的风险(logrankp=0.0041;hr(中等风险与低风险)=3.7;95%;95%ci=1.3-10.5;hr(高风险与低风险)=9.7;95%ci=3.1-29.8),将患者分层成三组(1)capra-s评分0-2(低风险);(2)capra-s评分3-5(中等风险);(3)capra-s评分》5(高风险)。以下补充列表指示了针对被分析的capra-s评分类别的风险中的患者的数量,即,示出了在手术后任何时间间隔 20个月的风险中的患者:低风险:23、23、23、23、23、18、16、10、1、1、0;中等风险:76、74、66、58、50、41、36、18、4、2、0;高风险:52、48、41、33、26、18、15、7、1、0、0。
[0141]
图6示出了cxc&pggg_model的kaplan-meier曲线分析。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。根据其经历如通过cxc&pggg回归模型预测的临床终点的风险(logrankp《0.0001;hr(第二三分位数与第一三分位数)=7.9;95%ci=3.2-18.7;hr(第三三分位数与第一三分位数)=32.1;95%ci=11.8-87.9),将患者分层成三个队列(第一三分位数、第二三分位数、第三三分位数)。以下补充列表指示了具有被分析的cxc&pggg_model类别的风险中的患者的数量,即,示出了在手术后的任何时间间隔 20个月的风险中的患者:第一三分位数:61、51、49、48、42、36、33、24、5、2、0;第二三分位数:54、54、48、42、36、31、24、1、1、0;第三三分位数:46、40、33、24、18、10、10、7、0、0、0。
[0142]
如图3至图6所示的kaplan-meier曲线分析证明存在不同的患者风险组。患者的风险组是通过如由风险模型capra-s评分或cxc&pggg_model计算的遭受相应临床终点(转移、前列腺癌特异性死亡)的概率来确定的。取决于患者的预测风险(即,取决于患者可能属于风险组1至3中的哪个风险组),可能指示不同类型的介入。在最低风险类别中,srt潜在与sadt(挽救性雄激素阻断治疗)相结合的护理标准(soc)递送了可接受的长期肿瘤控制。对
于中等患者风险组,施加的rt和/或与化疗组合的剂量升级可能提供改进的纵向结果。对于经历任何相关结果的最高患者风险组而言,不是这种情况。在该患者风险组中,指示介入升级。升级选项是srt(考虑更高剂量方案)、sadt和化疗的早期组合。其他选择是替代治疗,如免疫治疗(例如,sipuleucil-t)或其他实验性治疗。
[0143]
进一步的结果
[0144]
本节示出了仅基于识别出的趋化因子基因之一的cox回归模型的额外结果。总共测试了两个不同的1基因模型。ccl2_model的权重为0.1483,并且cxcl17_model的权重为-0.3174。
[0145]
对于kaplan-meier曲线分析,基于截止值将风险模型(ccl2_model和cxcl17_model)的cox回归函数归类成两个子队列(参见下图的描述),如下所述。
[0146]
患者类别表示自创建的风险模型的挽救性rt开始以来经历被测试的到前列腺癌特异性死亡的时间的临床终点的增加的风险。
[0147]
图7示出了ccl2_model的kaplan-meier曲线。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。根据其经历如由ccl2_model使用值0.0作为截止值预测的临床终点的风险(logrank p=0.03;hr=2.4;ci=1.1-5.3),将患者分层为两个队列(低与高)。以下补充列表指示了针对被分析的ccl2_model类别的风险中的患者的数量,即,示出了在手术后的任何时间间隔 20个月的风险中的患者:低风险:77、68、52、43、25、12、6、3、0;高风险:108、95、79、55、35、21、9、5、0。
[0148]
图8示出了cxcl17_model的kaplan-meier曲线。被测试的临床终点是由于手术后疾病复发而开始挽救性辐射治疗(srt)后到前列腺癌特异性死亡(pca death)的时间。根据其经历如由cxcl17_model使用值5.1作为截止值预测的临床终点的风险(logrank p=0.01;hr=0.35;ci=0.16-0.78),将患者分层为两个队列(低与高)。以下补充列表指示了针对被分析的cxcl17_model类别的风险中的患者的数量,即,示出了在手术后的任何时间间隔 20个月的风险中的患者:低风险:77、69、51、35、23、11、4、2、0;高风险:108、94、80、63、37、22、11、6、0。
[0149]
如图7和图8所示的kaplan-meier分析证明也能够使用仅基于识别出的趋化因子基因之一的风险模型来区分不同的患者风险组。
[0150]
讨论
[0151]
根治性rt和srt这两者对局限性前列腺癌的有效性是有限的,从而导致患者的疾病进展和最终死亡,特别是对于高复发风险的患者。随着许多因素在治疗有效性和疾病复发中发挥作用,对治疗的预测变得非常复杂。很可能尚未识别出重要因素,同时无法精确确定其他因素的效果。当前正在研究多种临床病理措施并将其应用于临床环境中以改进反应预测和治疗选择,从而提供一定程度的改进。尽管如此,仍然强烈需要更好的对根治性rt和srt的反应的预测,以便提高这些治疗的成功率。
[0152]
我们已经识别出一些分子,其表达显示出与根治性rt和srt后死亡具有显著关系,因此预计将改进对这些处置的有效性的预测。无论是在根治性背景中还是在挽救性背景中,改进的对rt对每个患者的有效性的预测都将改进治疗选择并将潜在地提高生存率。这能够通过以下操作来实现:1)为那些预测rt有效的患者优化rt(例如通过剂量递增或不同的开始时间),以及2)将预测rt无效的患者引导到可能更有效的处置形式的替代方案。另
外,这将减少那些免于无效治疗的患者的痛苦并减少在无效治疗上花费的成本。
[0153]
本领域技术人员通过研究附图、公开内容以及权利要求,在实践请求保护的发明时能够理解并实现对所公开的实现方式的其他变型。
[0154]
在权利要求中,“包括”一词并不排除其他元件或步骤,并且词语“一”或“一个”并不排除多个。
[0155]
图1显示的方法的一个或多个步骤可以被实施在可以在计算机上执行的计算机程序产品中。计算机程序产品可以包括在其上记录(存储)控制程序的非瞬态计算机可读记录介质,例如,磁盘、硬盘驱动器等。非瞬态计算机可读介质的常见形式包括例如软盘、软磁盘、硬盘、磁带或任何其他磁性存储介质、cd-rom、dvd或任何其他光学介质、ram、prom、eprom、flash-eprom或其他存储器芯片或盒式存储器,或计算机能够从中读取和使用的任何其他非瞬态介质。
[0156]
替代地,该方法的一个或多个步骤可以被实施在瞬态介质中,例如,可传输的载波,其中,控制程序被体现为使用传输介质(例如,(例如在无线电波和红外数据通信等期间生成的那些)声波或光波)的数据信号。
[0157]
示例性方法可以被实施在一个或多个通用计算机、(一个或多个)专用计算机、编程的微处理器或微控制器和外围集成电路元件、asic或其他集成电路、数字信号处理器、硬连线的电子或逻辑电路(例如,分立元件电路)、可编程逻辑器件(例如,pld、pla、fpga、图形卡cpu(gpu)或pal)等上。一般而言,任何能够实施有限状态机的设备(该有限状态机反过来能够实施图1显示的流程图)都能够用于实施风险分层方法的一个或多个步骤,以便提供对前列腺癌患者的治疗选择,如图显示。如将意识到的,虽然该方法的步骤都可以由计算机来实施,但是在一些实施例中,这些步骤中的一个或多个步骤也可以至少部分地手动执行。
[0158]
计算机程序指令也可以被加载到计算机、其他可编程数据处理装置或其他设备上,以引起要在计算机、其他可编程装置或其他设备上执行的一系列操作步骤,从而产生计算机实施的过程,使得在计算机或其他可编程装置上运行的指令提供用于实施在本文中指定的功能/动作的过程。
[0159]
权利要求中的任何附图标记都不应被解释为对范围的限制。
[0160]
本发明涉及一种预测前列腺癌对象对放疗的反应的方法,所述方法包括:确定从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱或接收对从包括ccl2和cxcl17的组中选择的一种或两种趋化因子基因中的每种趋化因子基因的基因表达谱的确定的结果,(一个或多个)所述基因表达谱是在从所述对象获得的生物样本中确定的;并且优选由处理器基于一种或两种趋化因子基因的(一个或多个)所述基因表达谱来确定对放疗反应的所述预测;并且任选地,将所述预测或基于所述预测的治疗推荐提供给医护人员或所述对象。由于免疫系统和免疫微环境的状态对治疗有效性有影响,因此识别预测这种效应的标志物的能力可能有助于能够更好地预测整体rt反应。趋化因子基因在免疫活性的调节中起着核心作用。发现识别的趋化因子基因与rt后的结果呈现显著相关性,因此我们预期它们将提供关于根治性rt和/或srt的有效性的预测价值。
[0161]
通过引用将所附的标题为“2020pf00063_sequence listing_st25”的序列列表整体并入本文。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。