1.本公开涉及用于处理和补充细胞培养基以改善真核重组表达系统中的过程性能的方法。
背景技术:
2.持续存在对大量治疗性重组蛋白的需求,因此,经由实施新的方法来改善细胞发育、培养基优化和过程控制参数以寻求蛋白质产量、细胞生长和生存力的持续增加。
3.l-半胱氨酸是细胞生长、维持和蛋白质生产的关键氨基酸。其作为硫的来源扮演至关重要的角色,也是合成主要的细胞内抗氧化剂谷胱甘肽(gsh)的限制因子,还是经由二硫键和三硫键进行蛋白质结构和折叠所必需的。l-半胱氨酸在中性ph下非常低的稳定性,因此可导致培养基配制物在哺乳动物细胞生长所需的中性条件(约ph 6.5至约ph 7.5)下不稳定。因此,l-半胱氨酸通常在进料批式发酵过程中以其二硫化物形式胱氨酸添加,其在中性ph下的溶解度非常低。hecklau等人,j.biotech 218(2016)53-63中证实,在批式实验中,细胞增殖在半胱氨酸耗尽的培养基中被完全抑制,但补充半胱氨酸衍生物,s-磺基半胱氨酸(s-sulphocysteine,ssc),其在培养基和进料中均为稳定,可有效替代l-半胱氨酸并增加细胞培养的持续时间和细胞滴度。还发现ssc可减少蛋白质中的三硫键形成,这在抗体生产中具有特殊价值。
4.nishiuch等人,in vitro 12(9)(1976)635-638发现(a)当将1mm半胱氨酸添加到补充有10%牛血清(mem-10bs)的eagle最低基础培养基中时,半胱氨酸对培养的细胞具有高毒性,且当在补充有10%牛血清(cmrl-10bs)的cmrl 1066中作为原始成分存在时,1.5mm半胱氨酸具有类似的毒性;且(b)当含半胱氨酸的培养基mem-10bs和cmrl-10bs在没有细胞的情况下孵育一天时,半胱氨酸的浓度降低了。培养基的预孵育减少了半胱氨酸诱导的细胞毒性。
5.kuschelewski等人,biotechnol.prog.,33(3)(2017)759-770考虑了细胞培养基产生的反应物种对培养基的整体稳定性和体外培养细胞行为的影响。细胞培养基中的l-半胱氨酸和其他含硫醇的成分很可能被氧化,形成h2o2或例如半胱氨酰残基的自由基中间体,它们本身可在金属催化剂(例如铜)的存在下形成二硫化物或与氧反应形成cys-so2h或与h2o2反应形成cys-so3h。氧化产物的产生有助于增加细胞应激水平。
6.持续需要优化培养基制剂和工艺参数以提高细胞存活力、比生产率(specific productivity)和滴度。改进培养基制剂和/或进料策略以产生所需重组蛋白表达、滴度、细胞生长和/或细胞存活力可降低与生产蛋白治疗剂相关的成本。
技术实现要素:
7.本公开的方法需要在以产生重组蛋白的真核细胞接种之前对培养基实施调节期间。在所产生的培养基中生长的真核细胞显示出增加的细胞比生产率(cell-specific productivity)。此外,改善水解活性和工艺比需氧量。同样地,经培养于所产生的培养基中
的细胞所产生的重组蛋白包含减少比例的宿主细胞蛋白杂质。
附图说明
8.图1:来自实例1的克隆2的细胞比生产率(qp)。对于每个图例,将doe案例“低tes、低cyscys”(a)、“低tes,高cyscys”(b)和“高tes,高cyscys”(c)的数据标准化为补充时间
“‑
0h”。
9.图2:来自实例1的克隆2的cho衍生的宿主细胞蛋白(cho hcp)浓度。对于每个图例,将doe案例“低tes、低cyscys”(a)、“低tes,高cyscys”(b)和“高tes,高cyscys”(c)的数据标准化为补充时间
“‑
0h”。
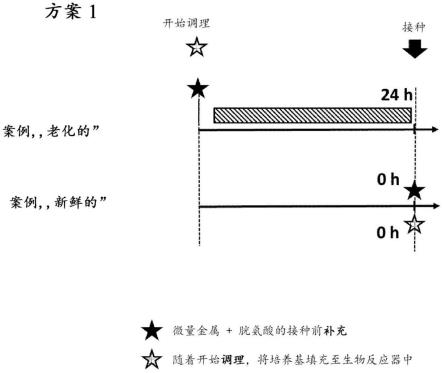
10.图3:在实例2(“方案1”)中执行的实验设置的示意图。在根据本发明的方法中,在调节开始时将痕量金属和胱氨酸添加至细胞培养基中,并在不存在细胞的情况下在接种条件下孵育24小时(在实例1中,称为“老化的”)。作为比较,将细胞培养基添加至生物反应器中,并在相同条件下孵育24小时,然后在接种细胞之前直接将痕量金属和胱氨酸添加至细胞培养基中(在实例2中,称为“新鲜的”)。
11.图4a:如实例2中针对克隆1评定的活细胞密度。
12.图4b:如实例2中针对克隆2评定的活细胞密度。
13.图4c:如实例2中针对克隆3评定的活细胞密度。
14.图4d:如实例2中针对克隆4评定的活细胞密度。
15.图5a:如实例2中针对克隆1评估的产物滴度(整体体积滴度)。
16.图5b:如实例2中针对克隆2评估的产物滴度(整体体积滴度)。
17.图5c:如实例2中针对克隆3评估的产物滴度(整体体积滴度)。
18.图6a:如实例2中针对克隆1所评估的,由细胞时间积分对滴度的斜率表示的细胞比生产率。
19.图6b:如实例2中针对克隆1所评估的,由细胞体积积分对滴度的斜率表示的生物量比生产率。
20.图6c:如实例2中针对克隆2所评估的,由细胞时间积分对滴度的斜率表示的细胞比生产率。
21.图6d:如实例2中针对克隆2所评估的,由细胞体积积分对滴度的斜率表示的生物量比生产率。
22.图6e:如实例2中针对克隆3所评估的,由细胞时间积分对滴度的斜率表示的细胞比生产率。
23.图6f:如实例2中针对克隆3所评估的,由细胞体积积分对滴度的斜率表示的生物量比生产率。
24.图7a:绝对细胞比生产率如实例2中针对克隆1、2和3评估。
25.图7b:如实例2中针对克隆1、2和3所评估的,当根据本发明调节培养基(实例2中称为“老化的”)时,相对细胞比生产率标准化成所示克隆的生产力。
26.图8a:发酵期间的需氧量如实例2中对克隆1的评估。
27.图8b:发酵期间的需氧量如实例2中对克隆2的评估。
28.图8c:发酵期间的需氧量如实例2中对克隆3的评估。
29.图8d:在发酵期间的需氧量如实例2中对宿主细胞系的评估。
30.图8e:需氧量的绝对积分如实例2中对克隆1、2、3和宿主细胞系的评估。
31.图8f:如实例2中针对克隆1、2、3和宿主细胞系所评估的,当根据比较设置调节培养基(实例2中称为“新鲜的”)时,需氧量的相对积分已标准化为所示克隆的生产率。
32.图9a:发酵上清液中的ldh(乳酸脱氢酶)活性如实例2中对于克隆1、2、3和宿主细胞系的评估。
33.图9b:如实例2中针对克隆1、2、3和宿主细胞系所评估的,当根据比较设置调节培养基(实例2中称为“新鲜的”)时,发酵上清液中的ldh(乳酸脱氢酶)活性已标准化为所示克隆的ldh活性。
34.图10a:细胞培养物中的宿主细胞蛋白(hcp)浓度如实例2中对克隆1、2、3和宿主细胞系的评估。
35.图10b:如实例2中针对克隆1、2、3和宿主细胞系所评估的,当根据比较设置调节培养基(实例2中称为“新鲜的”)时,细胞培养物中的标准化宿主细胞蛋白(hcp)浓度标准化为所示克隆的生产率。
36.图11a:细胞培养物中的plbl2(磷脂酶b样2蛋白(phospholipase b-like 2protein))浓度如实例1中对于克隆1、2、3和宿主细胞系的评估。
37.图11b:如实例2中针对克隆1、2、3和宿主细胞系所评估的,当根据比较设置调节培养基(实例2中称为“新鲜的”)时,细胞培养物中标准化plbl2(磷脂酶b样2蛋白)浓度标准化为所示克隆的生产率。
38.图12a:在接种后第14天,如实例2中通过ce-sds针对克隆1、2和3来测量所产生抗体的质量。
39.图12b:在接种后第14天,如实例2中通过sec单体含量针对克隆1、2和3来测量所产生抗体的质量。
40.图13:在实例3(“方案2”)中执行的实验设置的示意图。在根据本发明的方法中,其中在不存在细胞的情况下将培养基在接种条件下保持72小时,将痕量金属和胱氨酸在调节开始时(
“‑
72h”)、调节开始后24小时(
“‑
48h”)或调节开始后48小时(
“‑
24h”)添加至细胞培养基中。
41.图14:如实例3中针对克隆2来评估产物滴度(整体体积滴度),其中根据图13所示方案调节培养基。
42.图15:如实例3中针对克隆2来评估绝对细胞比生产率,其中根据图13所示方案调节培养基。误差线是根据测试案例
“‑
48h”(n=3)计算出的相对标准偏差。
43.图16:如实例3中针对克隆2来评估发酵罐进气中的绝对氧气质量流量,其中根据图13所示方案调节培养基。
44.图17:如实例3中针对克隆2来评估需氧量的绝对积分,其中根据图13所示方案调节培养基。误差线是根据测试案例
“‑
48小时”(n=3)计算出的相对标准偏差。
45.图18:有益于本公开的细胞发酵过程中所使用的“新鲜的”(条纹的)和“老化的”(点状的)补充培养基的组合的示意图。
46.图19:在接种前0小时(“新鲜的”)或接种前补充12、24或48小时(“老化的”)的补充胱氨酸和氧化还原活性痕量金属的培养基中设置的活细胞密度值。“新鲜的”补充培养基对
细胞生长有益。
47.图20:显示针对不同补充和接种方案的细胞比生产率。“老化的”培养基有利于细胞比生产率。
48.图21:针对不同的补充和接种方案测量滴度。胱氨酸和氧化还原活性痕量金属的补充时间并不影响产物的滴度。
49.图22:不同补充和接种方案的ce-sds主峰测量(%)。胱氨酸和氧化还原活性痕量金属的补充时间不影响ce-sds产物物种的丰度。
50.图23:对于不同的补充和接种方案的sec单体含量(%)。胱氨酸和氧化还原活性痕量金属的补充时间不影响sec产物物种的丰度。
51.图24:对于不同补充和接种方案的细胞培养上清液的宿主细胞蛋白质含量。须线(whisker)代表三个技术重复的标准偏差(n=3)
52.图25:对于不同补充和接种方案,细胞培养上清液中的聚集素(clusterin)含量。
53.图26:对于不同补充和接种方案,细胞培养上清液中的plbl2含量。须线(whisker)代表三个技术重复的标准偏差(n=3)
54.图27:接种前0小时(“新鲜的”)或48或96小时(“老化的”)的补充胱氨酸和氧化还原活性痕量金属的培养基中设置的氧气需求量。就氧气需求而言,具有“新鲜的”补充培养基的细胞培养过程效率较低。
具体实施方式
55.尽管在本技术中使用的术语是本领域中的标准术语,但本文提供某些术语的定义以确保对权利要求书的含义的明确和确定。单位,前缀和符号可用它们的国际单位(si)接受形式表示。本文叙述的数值范围包括定义范围的数值,且包括并支持所定义范围内的每个整数。除非另有说明,否则术语“一”或“一种”应解释为“至少一个”。本文使用的章节标题仅用于组织目的,而不应被解释为限制所描述的目标。除非另有说明,否则本文所述的方法和技术通常根据本领域所公知的常规方法执行,并如本说明书通篇所引用和所讨论的各种一般性和更具体的参考文献中所述。参见,例如,sambrook等人,molecular cloning:a laboratory manual,3rd ed.,cold spring harbor laboratory press,cold spring harbor,n.y.(2001)和ausubel等人,current protocols in molecular biology,greene publishing associates(1992),及harlow and lane antibodies:a laboratory manual cold spring harbor laboratory press,cold spring harbor,n.y.(1990)。本技术中所引用的所有文件或文件的部分,包括但不限于专利、专利申请、文章、书籍和论文,在此通过引用明确地并入。
56.本发明源于以下发现:在接种前适时以特定营养物补充培养基,并维持该经补充的培养基在适合接种的条件下一段定义期间,对于细胞比生产率、宿主细胞蛋白(hcp)水平和含量和过程比需氧量具有有利的结果。在适合接种的条件下,培养基补充可在培养基维持期之前和/或期间进行。
57.因此,本发明提供一种处理细胞培养基的方法,其中该方法包括:在适合于以真核细胞接种培养基的条件下,将细胞培养基保持于容器中,该真核细胞已被工程化以重组表达外源蛋白,其特征在于该培养基包含以下营养物:
58.(i)胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种;以及
59.(ii)一种或多种氧化还原活性痕量金属;
60.且在接种前不存在细胞的情况下,将包含该营养物的培养基在所述适合接种的条件下保持至少10小时。
61.在另一方面,本公开包括一种生产重组蛋白的方法,该方法包括以经工程化来重组表达外源蛋白的真核细胞接种于条件细胞培养基,其中该培养基是以通过在适合于以真核细胞接种培养基的条件下,将细胞培养基保持在容器中调节,该真核细胞已被工程化来重组表达外源蛋白,该培养基包含以下营养物:
62.(i)胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种;以及
63.(ii)一种或多种氧化还原活性痕量金属;
64.其中在其接种前不存在细胞的情况下,将包含该营养物的培养基在适合接种的条件下保持至少10小时。
65.在本发明的方法中,将细胞培养基(在本文中也简称为培养基)添加至容器中,并调节容器中的条件适于以真核细胞接种培养基来生产重组蛋白。如本文所使用,“重组蛋白”被认为与“重组表达的外源蛋白”相同。适合接种的条件的进一步描述提供于下文中。
66.如上所述,已补充并且已在适合接种的条件下在容器中保持一段时间的培养基在本文中被称为“条件”培养基。如本文所使用,“预接种”培养基涉及在接种细胞之前的细胞培养基。因此,预接种的培养基是无细胞的。预先接种的培养基可为条件培养基。“调理期”是在不存在细胞的情况下将培养基在适合接种的条件下保持在容器中的期间。
67.调理期随着培养基的接种而结束。因此,被称为“接种前”的时间点被包括在调理期内。
68.用于生长真核细胞以表达重组蛋白的培养基包含特定营养物。向培养基中添加营养物称为“补充”。补充可在调理期间和/或在调理期开始之前或开始之时进行。在补充特定营养物之前,该培养基在本文中可被称为“基础”培养基。因此,基础培养基是尚未以本文所公开的所有特定营养物的最终浓度添加的培养基。在一个实施例中,至少一种营养物(总量或要添加到培养基中以补充培养基的总量的一部分)在调理期和在该调理期结束前至少10小时添加至基础培养基中。
69.通过“接种”,本公开是指将真核细胞或真核细胞悬液导入到容器的培养基中的行为,该细胞被工程化以重组表达外源蛋白。
70.在本发明的方法中,补充有特定营养物(即胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种;及一种或多种氧化还原活性痕量金属)的培养基在适合接种的条件下保持于容器中至少约10小时。
71.发明人发现,在本发明实现的适合接种的条件下,在接种之前将经补充的培养基保持在容器中,对细胞比生产率、宿主细胞蛋白(host cell protein,hcp)含量和过程比需氧量是有益的。
72.在本发明的一个实施例中,将补充有特定营养物的培养基在适合接种的条件下保持在容器中最多约96小时的一段时间。所述期间可为整小时期间,或可包括由分钟或秒定义的期间。当给出所述期间的范围时,该范围包括两个端点,且落在该范围内的每一整小时、分钟或秒钟。在本发明的一个实施例中,将经补充的培养基在容器中保持至少约12小
时、至少约14小时、至少约16小时、至少约18小时、至少约20小时、至少约22小时、至少约24小时、至少约48小时、至少约72小时或至少约96小时。在本发明的一个实施例中,将经补充的培养基在容器中保持至少约24小时。在一个实施例中,将经补充的培养基在容器中保持约10小时至约96小时。在一个实施例中,将经补充的培养基在容器中保持约24小时至约96小时。
73.本发明的方法包括向培养基补充一种或多种选自以下的营养物:(1)胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种;及(2)一种或多种氧化还原活性痕量金属。这些在本文中可被称为“营养物”或“特定营养物”。
74.营养物可彼此独立地以一个剂量或分剂量添加到培养基中。在一个实施例中,一种营养物以一个剂量添加至培养基中。在一个实施例中,所有营养物以一个剂量添加至培养基中。
75.可在将培养基添加至容器之前或之后将营养物添加到培养基中。可在容器内达到接种条件之前或之后将营养物添加到培养基中。因此,可将经补充或未经补充的培养基添加到容器中,然后实施并达到接种条件。或者,可在添加培养基(经补充或未经补充)之前,在容器中实施接种条件,然后维持这些条件。
76.可在培养基制备期间添加营养物,然后可将培养基在典型的储存条件下(例如在4℃)储存长达3个月。
77.在本发明的一个实施例中,在将培养基添加到容器之前,将胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种添加到培养基中。在本发明的一个实施例中,在容器内达到接种条件之前,将胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种加入到容器中的培养基中。在本发明的一个实施例中,在容器内达到接种条件后,将胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种加入到容器中的培养基中。
78.在本发明的一个实施例中,在将培养基添加至容器之前,将一种或多种氧化还原活性痕量金属添加至培养基。在本发明的一个实施例中,在容器内达到接种条件之前,将一种或多种氧化还原活性痕量金属添加到容器中的培养基中。在本发明的一个实施例中,在容器内达到接种条件后,将一种或多种氧化还原活性痕量金属添加到容器中的培养基中。
79.根据本发明的方法,培养基包含胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种。胱氨酸是半胱氨酸的氧化二聚体形式,且与半胱氨酸是可相互转化的。与这些氨基酸结合的硫原子为氧化还原活性和电子转移提供了位置。半胱氨酸也称为l-半胱氨酸。
80.在一个实施例中,半胱氨酸衍生物选自以下组:s-磺基半胱氨酸、s-磺基半胱氨酰甘氨酸、n-乙酰基半胱氨酸(nac)、半胱氨酸s-连接的n-乙酰基葡萄糖胺(glcnac-cys)、同型半胱氨酸、l-半胱氨酸混合的二硫化物或l-半胱氨酸混合肽、s-烷化半胱氨酸或具有硫醇保护基的半胱氨酸,例如fmoc-保护的半胱氨酸、还原型和氧化型谷胱甘肽(gsh)、s-磺基谷胱甘肽、γ-谷氨酰半胱氨酸、半胱氨酰甘氨酸、n-丁酰基α-谷氨酰基-半胱氨酰基-甘氨酸、s-酰基-gsh和s-羧基-l-半胱氨酸。
81.在一个实施例中,半胱氨酸衍生物选自s-磺基半胱氨酸、n-乙酰基半胱氨酸(nac)、同型半胱氨酸和还原型和氧化型谷胱甘肽(gsh)。
82.在一个实施例中,培养基以胱氨酸补充。在一个实施例中,培养基以半胱氨酸补充。在一个实施例中,培养基以半胱氨酸衍生物补充。在一个实施例中,以胱氨酸和半胱氨
酸的混合物、胱氨酸和半胱氨酸衍生物的混合物或半胱氨酸和半胱氨酸衍生物的混合物补充培养基。在一个实施例中,以胱氨酸、半胱氨酸和半胱氨酸衍生物的混合物补充培养基。
83.在本发明的一个实施例中,当在适合接种的条件下保存在容器中时,培养基包含(补充后)胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种,总浓度为约0.5mm至约16mm。在一个实施例中,培养基包含约1mm至约10mm的胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种。在一个实施例中,培养基包含约2mm至约8mm的胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种。
84.在一个实施例中,该方法包括添加胱氨酸至培养基中,其中添加的胱氨酸的量为约0.25mm至约8mm,在一个实施例中为约0.5mm至约5mm,在一个实施例中为约1mm至约4mm胱氨酸。
85.在一个实施例中,该方法包括在调理期开始时向容器中的培养基添加胱氨酸。
86.在一个实施例中,该方法包括在调理期开始前或开始时,在添加培养基至容器之前或同时立即添加胱氨酸至培养基中。
87.在一个实施例中,该方法包括向容器中的培养基添加胱氨酸,其中在调理期开始时以单剂量添加胱氨酸至容器中的培养基,并在接种培养基之前,将经补充的培养基在适合接种的条件下保持在容器中至少约24小时。
88.在一个实施例中,该方法包括在向容器中添加培养基之前或同时以单一剂量的胱氨酸添加至培养基,并在接种培养基之前,将经补充的培养基在适合接种的条件下保持在容器中至少约24小时。在一个实施例中,在向容器中添加(经补充的)培养基之前,容器中的条件为适合接种。在一个实施例中,在添加(经补充的)培养基至容器后,在容器中达到适合接种的条件。
89.在本发明的一个实施例中,将胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种以固体形式添加至培养基中。在本发明的一个实施例中,将胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种以溶液添加至培养基中。
90.在本发明的一个实施例中,以胱氨酸、半胱氨酸和半胱氨酸衍生物中的一种或多种补充培养基是在:
91.(i)添加该培养基至该容器之前;
92.(ii)添加该培养基至该容器的同时;
93.(iii)添加培养基至容器之后,即在容器中,并且在容器/培养基处于适合接种真核细胞于培养基的条件下之前;或
94.(iv)在容器中,当容器和其中所含的培养基是处于适合接种真核细胞条件下的培养基。
95.根据本发明的方法,该培养基包含一种或多种氧化还原活性痕量金属。
96.氧化还原活性痕量金属可为适合培养中细胞生长和重组蛋白生产的任何氧化还原活性痕量金属。在一个实施例中,一种或多种氧化还原活性痕量金属选自铁、铜、铬、钴、硒、锰、钒和钼。
97.在一个实施例中,将氧化还原活性痕量金属以氧化还原活性痕量金属盐的形式添加至培养基中。在一个实施例中,将氧化还原活性痕量金属以氧化还原活性痕量金属盐的溶液的形式添加至培养基中。可使用适合包含在培养基中以产生重组蛋白的任何盐。在一
个实施例中,氧化还原活性痕量金属盐为金属硫酸盐、卤化物、氧化物、硝酸盐、柠檬酸盐、乙酸盐或磷酸盐的形式。在一个实施例中,氧化还原活性痕量金属盐为水合或无水形式。在一个实施例中,金属离子结合至螯合剂,例如转铁蛋白或乳铁蛋白。
98.在一个实施例中,适用于本发明的方法的铁盐为硫酸铁、卤化铁、氧化铁、硝酸铁、柠檬酸铁、乙酸铁或磷酸铁的形式,且例如选自柠檬酸铁(iii)、feso4、fecl2、fecl3、fe(no3)3和fepo4以及与转铁蛋白或乳铁蛋白结合的铁。
99.在一个实施例中,适用于本发明方法的铜盐为硫酸铜、卤化铜、氧化铜、硝酸铜、柠檬酸铜、乙酸铜或磷酸铜的形式,且例如选自cuso4、cucl2、cuco3·
cu(oh)2、cu(oh)2、cu(no3)2、cuo和乙酸铜,如cu(c2h
302
)2·
2h2o。
100.在一个实施例中,适用于本发明方法的铬盐为硫酸铬、卤化铬、氧化铬、硝酸铬、柠檬酸铬、乙酸铬或磷铬的形式,且例如选自crcl2、crcl3、crcl3·
6h2o、c
12h24
cl3cro3、crf3·
4h2o、cr(no3)3·
9h2o、cr2o3、cr2(so4)3·
xh2o、cro2cl2和k3cr(c2o4)3·
3h2o。
101.在一个实施例中,适用于本发明方法的钴盐为硫酸钴、卤化钴、氧化钴、硝酸钴、柠檬酸钴、乙酸钴或磷酸钴的形式,且例如选自cocl2、cocl2·
6h2o、co(no3)2、co(clo4)2·
6h2o、co(no3)2·
6h2o和coso4·
7h2o。
102.在一个实施例中,适用于本发明方法的硒盐为硫酸硒、卤化硒、氧化硒、硝酸硒、柠檬酸硒、乙酸硒或磷酸硒的形式,且例如选自na2seo3、na2seo4、h2seo4、h2seo3、secl4和seocl2。
103.在一个实施例中,适用于本发明方法的锰盐为硫酸锰、卤化锰、氧化锰、硝酸锰、柠檬酸锰、乙酸锰或磷酸锰的形式,且例如选自mnso4、mncl2、mnf2和mni2。
104.在一个实施例中,适用于本发明方法的钒盐为硫酸钒、卤化钒、氧化钒、硝酸钒、柠檬酸钒、乙酸钒或磷酸钒的形式,且例如选自vcl2、vcl3、vocl3、na3vo4、nh4vo3、voso4和navo3。
105.在一个实施例中,适用于本发明方法的钼盐为硫酸钼、卤化钼、氧化钼、硝酸钼、柠檬酸钼、乙酸钼或磷酸钼的形式,且例如选自(nh4)6mo7o
24
·
4h2o、h3pmo
12o40
和moo3·
h2o。
106.氧化还原活性痕量金属通常用于溶液中。
107.细胞在培养中生长和产生蛋白质所需的氧化还原活性痕量金属的量在本领域中是已知的,并且在调理期之前和/或期间添加到培养基中的这些氧化还原活性痕量金属的量将遵循那些规范。在某些情况下,例如当基础培养基已经包含根据本公开的方法所选择添加的一定量的痕量金属时,则可调整所添加的氧化还原活性痕量金属的量,以使培养基中氧化还原活性痕量金属的总量在接种时间时是本领域的标准。进一步的信息可从yuk等人,(2014)biotechnol progress 31(1):226-238 and crowell等人,(2007)biotechnol bioeng 15,96(3):538-549获得。
108.可将氧化还原活性痕量金属以例如微量元素溶液(tes)的组合的方式添加至培养基中。依据细胞在生长和蛋白质生产过程中对氧化还原活性痕量金属的需求来调配tes。tes可包含上述氧化还原活性痕量金属中的一种或多种、两种或多种、三种或多种、四种或多种、五种或多种、六种或多种、七种或多种或全部八种。在一个实施例中,将一种或多种氧化还原活性痕量金属分别添加至培养基中,并且可将其他氧化还原活性痕量金属作为tes添加至培养基中。
109.在一个实施例中,当在适合接种的条件下保存在容器中时,培养基包含以下浓度的一种或多种氧化还原活性痕量金属:1-200μm铁、0.01
–
5μm铜、0.01
–
100nm铬、0.001
–
200μm钴、0.01
–
200μm硒、0.01
–
5μm锰、0.001
–
200μm钒和/或0.001
–
200μm钼。在一个实施例中,当在适合接种的条件下保存在容器中时,培养基包含以下浓度的一种或多种氧化还原活性痕量金属:5
–
150μm铁、0.02
–
2μm铜,0.02
–
50nm铬、0.005
–
150μm钴、0.02
–
150μm硒、0.02
–
3μm锰、0.005
–
150μm钒和/或0.005-150μm钼。在一个实施例中,当在适合接种的条件下保存在容器中时,培养基包含以下浓度的一种或多种氧化还原活性痕量金属:10
–
100μm铁、0.05
–
1.5μm铜、0.1
–
30nm铬、0.01
–
100μm钴,0.05
–
100μm硒、0.1
–
3μm锰、0.01
–
100μm钒和/或0.01-100μm钼。
110.在本发明的一个实施例中,以一种或多种氧化还原活性痕量金属补充培养基是在:
111.(i)添加该培养基至该容器之前;
112.(ii)添加该培养基至该容器的同时;
113.(iii)添加培养基至容器之后,即在容器中,并且在容器处于适合接种真核细胞于培养基的条件下之前;或
114.(iv)在该容器中,当该容器处于适于该以真核细胞接种该培养基的条件下。
115.在本发明的一个实施例中,培养基被补充胱氨酸和铁和/或铜、铬、钴、硒、锰、钒和钼中的一种或多种、两种或多种、三种或多种、四种或多种、五种或多种、六种或多种或全部。在一个实施例中,以胱氨酸和铁补充培养基。在一个实施例中,培养基补充有约0.25mm至约8mm的胱氨酸,在一个实施例中,补充有约0.5mm至约5mm的胱氨酸,在一个实施例中,补充有约1mm至约4mm的胱氨酸。在一个实施例中,培养基补充有约1-200μm的铁,在一个实施例中,补充有约5至约150μm的铁,在一个实施例中,补充有约10至约100μm的铁。
116.若将铁和/或铜、铬、钴、硒、锰、钒和钼中的一种或多种作为tes添加至培养基中,则添加至培养基中的tes浓度将取决于各个成分的性质及其各自的浓度。有效氧化还原活性痕量金属浓度c
tes
根据如下公式计算:
117.(等式1)c
tes
=σn
微量元素
/v
118.其中,tes为微量元素溶液,n为以摩尔计的各痕量金属的量,v为以l计的tes体积。
119.在一个实施例中,添加至培养基的tes的量将为约6μm至约350μm。在一个实施例中,添加至培养基的tes的量将为约10μm至约250μm。在一个实施例中,添加至培养基的tes的量将为约15μm至约100μm。
120.tes在实例中进一步描述。
121.在以上实施例的一方面,在接种之前,将经补充的培养基在接种条件下保持在容器中至少24小时。
122.在本公开的方法中,在细胞发酵过程中,可将细胞接种至细胞培养基中一次以上。通常,可将细胞接种到细胞培养基中,以进行种子培养、生长阶段和生产阶段。在本公开中,如本文所述补充并调节用于生长阶段和生产阶段之一或两者所接种的细胞培养基。处理步骤中的两阶段处理阶段,例如,在生长阶段和/或生产阶段,可在该阶段使用“新鲜的”和“老化的”培养基中的一种或两种。
123.本公开的方法使得能够通过如本文所述的调节来定制发酵过程中使用的细胞培
养基,以有益于细胞生长和细胞比生产率。
124.在该实施例的一方面,当接种针对生长阶段,在适于真核细胞接种的培养基的条件下,将其所用的细胞培养基保持在容器中,该真核细胞已被工程化以重组表达外源蛋白,其中该培养基包括:
[0125]-胱氨酸、半胱氨酸及半胱氨酸衍生物中的一种或多种;及
[0126]-一种或多种氧化还原活性痕量金属
[0127]
且其中在接种前不存在细胞的情况下,将包含该营养物的培养基在所述适合接种的条件下保持至少10小时。
[0128]
在该实施例的一方面,生长阶段可以是多阶段的,对于生长阶段中的不同阶段,可选择使用经过不同处理的培养基(即“老化的”或“新鲜的”)。因此,在此方面,生长阶段的一个或多个阶段或所有阶段是处于根据本公开所调节的培养基中。在一方面,根据本公开调节用于n-1阶段的培养基。
[0129]
在该实施例的一方面,当接种针对生产阶段,在适于真核细胞接种培养基的条件下,将其所用的细胞培养基保持在容器中,该真核细胞已被工程化以重组表达外源蛋白,其中该培养基包括:
[0130]-胱氨酸、半胱氨酸及半胱氨酸衍生物中的一种或多种;及
[0131]-一种或多种氧化还原活性痕量金属
[0132]
且其中在接种前不存在细胞的情况下,将包含该营养物的培养基在所述适合接种的条件下保持至少10小时。
[0133]
在该实施例的一方面,生产阶段可为两阶段的,使得其一阶段是处于根据本公开调节的培养基中,且其一阶段处于未受根据本公开调节的培养基中。图18说明本公开的这一方面。
[0134]
在该实施例的一方面,当接种针对生长阶段和生产阶段,将用于生长阶段的细胞培养基保持在容器中,并将用于生产阶段的细胞培养基保持在容器中,该容器保持在适于真核细胞接种的培养基的条件下,该真核细胞已被工程化以重组表达外源蛋白,其中该培养基包括:
[0135]-胱氨酸、半胱氨酸及半胱氨酸衍生物中的一种或多种;及
[0136]-一种或多种氧化还原活性痕量金属
[0137]
且其中在接种前不存在细胞的情况下,将包含该营养物的培养基在所述适合接种的条件下保持至少10小时。
[0138]
在此实施例的一方面,优选在细胞发酵过程的n-1和n二个阶段都不使用“老化的”培养基。
[0139]
在这些方面,对于细胞发酵过程的每个不同阶段,在接种前的无细胞的情况下将培养基保持在适合接种的条件下的时间可以相同或不同。
[0140]
已发现,当在接种前补充和调理(“老化的”)用于生长阶段的培养基或用于生产阶段的培养基时,可在细胞发酵过程的生产阶段中提高所测量的细胞比生产率。在这方面,优选的是,当在接种前补充和调理(“老化的”)用于生长阶段的培养基时,用于生产阶段的培养基是“新鲜的”,而当在接种前补充和调理(“老化的”)用于生产阶段的培养基时,用于生长阶段的培养基是“新鲜的”。
[0141]
用于本公开的方法的细胞培养基用化学方法定义,使得该培养基的成分是已知的并且受到控制。
[0142]
细胞培养基应包含一定比例的均衡必需营养物,其比例应满足细胞对细胞增殖和药物蛋白生产的需求。近年来,细胞培养基已被广泛开发和出版,包括用于真核细胞培养的培养基。经定义的培养基的所有成分都被很好地表征,且此类培养基不含复杂的添加剂,例如血清和水解产物。通常,这些培养基包括限定量的纯化生长因子、蛋白质、脂蛋白和其他物质,否则它们可由血清或萃取物补充剂提供。产生此类培养基的唯一目的是支持高生产率的细胞培养。某些经定义的培养基可称为低蛋白培养基,或如果不包括低蛋白培养基的典型成分胰岛素和转铁蛋白,则可不含蛋白质。
[0143]
用于本公开的方法的培养基也可以是无血清的,因此将不包含任何动物来源的成分、胎牛血清、牛血清白蛋白或人类血清白蛋白。
[0144]
市售培养基的实例包括ham’s f10(sigma)、minimal essential medium(mem,sigma)、rpmi-1640(sigma)和dulbecco’s modified eagle’s medium(dmem,sigma)。设计用于培养cho细胞的化学定义的培养基特别包括cd forticho
tm
(forti或forticho)medium、cd opticho
tm
(opti或opticho)medium、cd-cho medium(所有皆获自life technologies)和acticho-p(acti或acticho)培养基(可获自ge healthcare)。这些培养基中的任何一种都可根据需要补充激素和/或其他生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐(例如氯化钠、钙、镁和磷酸盐)、缓冲液(例如hepes)、核苷酸(例如腺苷和胸苷)、氨基酸、抗生素(例如gentamycin
tm
)和葡萄糖或等效能源。该培养基可进一步包含过氧化氢去除剂。示例性的过氧化氢去除剂为酮酸,例如丙酮酸、α-酮戊二酸、草酰乙酸、乙酰乙酸和乙酰丙酸。
[0145]
对于特定细胞系的生长,培养基的必需营养物和生长因子(包括其浓度)是凭经验且无需进行过多的实验即可确定的,例如叙述于mammalian cell culture,mather(plenum press:ny 1984);barnes and sato,cell 22(1980)649或mammalian cell biotechnology:a practical approach m.butler(irl press,1991)。合适的培养基包含基础培养基成分,例如基于dmem/ham f12的制剂,具有一些成分的改良的浓度,例如氨基酸、盐、糖和维生素,并且任选地包含甘氨酸、次黄嘌呤、胸苷、重组人胰岛素、水解蛋白胨,例如,primatone hs
tm
或primatone rl
tm
(sheffield,england)或等效物、细胞保护剂,例如pluronic f68
tm
或等效的pluronic多元醇和gentamycin
tm
。此外,基础培养基中可包含或补充过氧化氢去除剂,例如丙酮酸、α-酮戊二酸、草酰乙酸、乙酰乙酸或乙酰丙酸。
[0146]
如上所述,根据本发明所使用的培养基包含特定营养物。如上文所定义,基础培养基是尚未以本文所公开的所有特定营养物的最终浓度添加的培养基。因此,在一方面,基础培养基不包含任何或基本上不含任何胱氨酸、半胱氨酸或半胱氨酸衍生物。一方面,基础培养基不包含任何或基本上不包含任何氧化还原活性痕量金属。一方面,基础培养基不包含任何或基本上不包含任何胱氨酸、半胱氨酸或半胱氨酸衍生物,或任何或基本上任何氧化还原活性痕量金属。
[0147]
在本发明的方法中,将容器中的培养基在适合接种真核细胞的条件下保持一段调理期。如本文所使用,“容器”是可在适合接种的条件下将培养基保持在其中的任何容器。容器可为多用途或单用途容器。容器可具有刚性壁、半刚性壁或其它们的组合,或者部分地或全部地由柔性材料构成。在本公开中,关于容器和/或其中容纳的培养基,使用“适合接种的
条件”。至少,“容器”应允许控制温度和/或ph和/或气体。通常,培养容器会提供污染屏障,以保护培养基免受外部环境影响,同时保持适当的内部环境。对于锚着依存性细胞,容器为细胞附着提供了合适且一致的底物。容器可用于在整个或部分接种前(调理)期间和/或接种后培养中保存培养基。在一个方面,将培养基在整个或部分调理期保持在第一容器中,然后在接种之前(对于调理期的一部分)或在接种时转移至另一容器中。在另一方面,培养基在整个调理期和在培养基接种中都保持在相同容器中。接种后容器的性质对本发明并不重要,只要其能够使培养物生长并产生重组蛋白即可。
[0148]
在一个实施例中,容器为生物反应器。如本文所使用,“生物反应器”为一种体外培养系统,其已被设计为在定义明确且严格控制的培养环境中引发、维持并引导细胞生长。通常,生物反应器是由例如不锈钢构成并且是多用途的,即被使用、清洁/消毒并重复使用。然而,本公开的方法也可在单次使用(一次性或可循环使用)的生物反应器中进行,例如部分或全部由塑料构造的袋子。生物反应器模拟自然的生化环境,以使微生物和细胞培养中的细胞或组织最佳生长。在整个发酵过程中,反应器的体积可能会有所不同,生物反应器的类型范围从小型,少于1l的桌上型装置到10,000l的大型工业应用系统。在本公开中,可通过接种摇瓶或20l生物反应器并培养约21天来建立细胞培养物。之后,可将细胞转移至80l生物反应器中约3天,将其转移至400l反应器中约3天,并转移至2,000l反应器中约2天(阶段n-1)。用于产生抗体(n期)的主要发酵可以在例如12,000l生物反应器中进行。在一个方面,将培养基在整个或部分调理期保持在第一容器中,然后在接种之前(调理期的一部分)或在接种时转移至生物反应器中。在另一方面,培养基在整个调理期和在培养基接种中都保持在生物反应器中。
[0149]
适合用真核细胞接种的条件是本领域的标准条件。这些条件可取决于选择用于蛋白表达的真核细胞。用于细胞的接种和发酵培养以产生生物量并产生重组蛋白的反应器、温度和其他条件是本领域已知的,例如氧浓度、二氧化碳和ph、搅拌、温度和湿度。
[0150]
在一些实施例中,关于容器中的培养基,适合接种经工程化以重组表达外源蛋白的真核细胞的条件包括:ph约ph 6.0至约ph 8.0,温度约20℃至约39℃,%o2为约10%至约80%;例如ph为约ph 6.5至约ph 7.5,温度为约30℃至约38℃,且%o2为约15%至约70%;在一种情况下,ph为约ph 6.8至约ph 7.2,温度为约35℃至约38℃,且%o2为约30%至约60%。依据所使用的容器,适合接种的条件也可包括培养基的搅拌,例如以约10rpm至超过1000rpm的速率。通常,依据容器的尺寸,这将通过约100-150的rpm,或约110-140的rpm或约120-130的rpm来提供。也可设想以上具体叙述的范围的任何组合。
[0151]
用于测量ph、温度和o2水平的方法是本领域所熟知的,并且如果超出上述范围,在调理期平衡ph值的方法也是已知的。一方面,可在调理期通过添加co2或碳酸钠来平衡ph,监测添加的量直至达到所需的ph。
[0152]
在另一方面,本发明涉及可通过根据本发明的细胞培养基的处理方法获得的细胞培养基。
[0153]
在另一方面,本发明关于培养基在真核细胞发酵过程中用于生产重组蛋白的用途,该培养基通过根据本发明用于处理细胞培养基的方法所获得。
[0154]
本发明的另一方面是用于改善真核细胞的细胞比生产率的方法,该真核细胞经工程化以重组表达外源蛋白,该方法包括:
[0155]-使细胞培养基进行根据本发明处理细胞培养基的方法,以获得经处理的细胞培养基,及
[0156]-在经处理的培养基中,培养经工程化以重组表达外源蛋白的真核细胞,其中与在相同细胞培养基中培养的真核细胞的细胞比生产率相比,在接种前直接向细胞培养基中补充营养物的真核细胞具有更高的细胞比生产率。
[0157]
本发明的另一方面是根据本发明用于处理细胞培养基的方法用于改善真核细胞细胞比生产率中的用途,该真核细胞经工程化以重组表达外源蛋白。
[0158]
本发明的另一方面是用于减少真核细胞发酵过程的需氧量的方法,该方法包括:
[0159]-使细胞培养基进行根据本发明处理细胞培养基的方法,以获得经处理的细胞培养基,及
[0160]-在经处理的培养基中,培养经工程化以重组表达外源蛋白的真核细胞,其中与在相同细胞培养基中培养的需氧量相比,在接种前直接向细胞培养基中补充营养物的培养具有较低的需氧量。
[0161]
本发明的另一方面是根据本发明用于处理细胞培养基的方法于降低真核细胞发酵过程的需氧量的用途。
[0162]
本发明的另一方面是用于降低细胞培养物中磷脂酶b样2蛋白(plbl2)的浓度的方法,该方法包括:
[0163]-使细胞培养基进行根据本发明处理细胞培养基的方法,以获得经处理的细胞培养基,及
[0164]-在经处理的培养基中,培养经工程化以重组表达外源蛋白的真核细胞,其中与在相同细胞培养基中培养所形成的plbl2相比,在接种前直接向细胞培养基中补充营养物的培养在培养期间形成较低量的plbl2。
[0165]
本发明的另一方面是根据本发明用于处理细胞培养基的方法于降低细胞培养物中磷脂酶b样2蛋白(plbl2)的量的用途。
[0166]
本发明的另一方面是通过重组表达从真核细胞产生外源蛋白的方法,该方法包括:
[0167]-使适合培养该真核细胞的细胞培养基进行根据本发明处理细胞培养基的方法,以获得经处理的细胞培养基,
[0168]-用经工程化以重组表达外源蛋白的真核细胞接种经处理的细胞培养基,以形成细胞培养物,
[0169]-培养该细胞培养物以产生该外源蛋白。
[0170]
培养真核细胞以允许重组产生外源蛋白的方法是本领域已知的。同样地,用于接种培养基的方法和接种量在本领域中是标准的。
[0171]
本公开提供在发酵培养条件下的细胞培养。这通常为一种多步骤的培养程序,其中将细胞在适当的培养容器中以多个步骤或阶段进行培养。根据此优选的过程,例如从新鲜的或冷冻小瓶开始的发酵培养过程通常涵盖三个不同的阶段,即:
[0172]
i)种子扩培,用于回收细胞,例如,在解冻应力并使细胞倍增时间正常化之后,该时间可持续3天至例如超过60天,取决于细胞恢复的速度和生产规模。也可设想直接解冻;
[0173]
ii)生长阶段,或接种/接种扩培,称为n-x阶段(n为生产阶段),其中x通常为1至5,
优选为1或2。这些阶段亦可称为生长阶段,其中将细胞接种到适合促进生长和生物量产生的培养基中。因此,n-x阶段通常用于扩大培养形式的培养扩展并洗出所选择的化合物;及
[0174]
iii)生产阶段或n-阶段,用于以适当的数量和/或质量生产重组蛋白。此阶段的持续时间可取决于例如重组细胞的性质以及表达的糖蛋白的数量和/或质量。
[0175]
在某些情况下,种子扩培是可选择的。
[0176]
用于本发明方法的培养基适用于真核细胞发酵过程。根据本发明,可使用容许细胞培养并表达重组蛋白的任何真核细胞。真核细胞通常是真核细胞系,当将其置于含有适当营养物和生长因子的培养基中进行悬浮培养时,能够生长并存活,且通常能够在培养基中表达和分泌大量目的重组蛋白。
[0177]
在一个实施例中,真核细胞是哺乳动物细胞、酵母细胞或昆虫细胞。在一个实施例中,该真核细胞是哺乳动物细胞。
[0178]
在一个实施例中,哺乳动物细胞选自nso鼠骨髓瘤细胞系、通过sv40(cos-7,crl 1651)转化的猴肾cvi细胞系;人胚胎肾细胞系293s(graham等人,j.gen.virol.36(1977)59);幼仓鼠肾细胞(bhk,ccl 10);小鼠塞尔托利氏(sertoli)细胞(tm4,mather,biol.reprod.23(1980)243);猴肾细胞(cvi-76,ccl 70);非洲绿猴肾细胞(vero-76,crl 1587);人宫颈癌细胞(hela,ccl 2):犬肾细胞(mdck,ccl 34);布法罗大鼠肝细胞(brl3a,crl 1442);人肺细胞(w138,ccl 75):人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤细胞(mmt 060562,ccl 5i);大鼠肝癌细胞(htc,mi.54,baumann等人,j.cell biol.,85(1980)1);和tr-1细胞(mather等人,annals n.y.acad.sci.383(1982)44),per.c6细胞系(percivia llc),杂交瘤细胞系和中国仓鼠卵巢细胞(cho,urlaub and chasin p.n.a.s.77(1980)4216)。
[0179]
在一个实施例中,哺乳动物细胞是cho细胞或其衍生物。在一个实施例中,cho细胞的衍生物选自cho/-dhfr(urlab&chasin,supra)、chok1sv(lonza)、cho-k1 duc b11(simonsen and levinson p.n.a.s.80(1983)2495-2499)和dp12 cho细胞(ep 307,247)。
[0180]
在一个实施例中,该哺乳动物细胞是cho细胞。cho细胞已成为生产治疗性抗体的黄金标准哺乳动物宿主细胞,并且大多数这些细胞系已适应于在悬浮培养中生长,且非常适合于反应器培养、大规模生产和大量生产。
[0181]
在一个实施例中,该真核细胞是酵母细胞。在一个实施例中,酵母细胞是酿酒酵母菌(saccharomyces cerevisiae)或巴斯德毕赤酵母(pichia pastoris)。
[0182]
在一个实施例中,该真核细胞为昆虫细胞。在一个实施例中,该昆虫细胞为sf-9。
[0183]
选择或操纵用于本公开的方法的真核细胞以产生重组蛋白,通常是糖基化的单克隆抗体。用于操纵真核细胞以重组产生外源蛋白的方法是本领域已知的。操纵包括一种或多种基因修饰,例如引入一种或多种编码待表达蛋白质的异源基因。异源基因可以编码在该细胞中正常表达或对于宿主细胞是异源的蛋白质。操纵可额外地或可替代地是上调或下调一个或多个内源基因。通常,例如通过引入编码蛋白质的基因和/或通过引入调节编码该蛋白质的基因的表达的控制元素来操纵细胞以产生重组蛋白。可经过由载体,例如质粒、噬菌体或病毒载体,将编码蛋白质和/或控制元素的基因引入宿主细胞。某些载体在引入它们
的宿主细胞中能够或自主复制,而其他载体可整合到宿主细胞的基因体中,从而与宿主基因体一起复制。各种载体是可公开获得的,且载体的精确性质对于本公开并非是必不可少的。一般而言,载体成分包括但不限于信号序列、复制起始序列、一个或多个标记基因、增强子元素、启动子和转录终止序列。此类成分如wo 97/25428中所述。
[0184]
如本文所使用,“蛋白质”包含通过肽键彼此连接的两个或更多个氨基酸残基的分子。蛋白质可包含修饰,包括但不限于糖基化、脂质附着、硫酸化、谷氨酸残基的γ-羧基化、羟基化和adp-核糖基化。
[0185]
在一个实施例中,重组蛋白选自抗体、酶、受体和配体,或包含抗体、受体或配体的融合蛋白。在一个实施例中,外源蛋白为抗体或其融合蛋白。在一个实施例中,外源蛋白为抗体。在一个实施例中,抗体为治疗性的抗体。在一个实施例中,抗体为多特异性抗体。在一个实施例中,该抗体为igg同种型。在一个实施例中,该抗体为igg1同种型。在一个实施例中,该抗体为全长抗体。在一个实施例中,该抗体为抗体片段。在一个实施例中,抗体为人源化抗体或人抗体。
[0186]
本文中的术语“抗体”以最广义使用且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们展示出所需抗原结合活性即可。
[0187]“抗体片段”是指除完整抗体以外的分子,其包含结合完整抗体所结合抗原的完整抗体的一部分。抗体片段的实例包括(但不限于)fv、fab、fab'、fab
’‑
sh、f(ab')2;双体抗体(diabody);线性抗体;单链抗体分子(例如scfv和scfab);单域抗体(dab);和从抗体片段所形成的多特异性抗体。关于某些抗体片段的综述,参见holliger及hudson,nature biotechnology 23:1126-1136(2005)。
[0188]“人抗体(human antibody)”为具有氨基酸序列的抗体,该氨基酸序列对应于由人或人细胞产生或自利用人抗体库(antibody repertoire)或其他人抗体编码序列的非人来源衍生的抗体的氨基酸序列。人抗体的该定义明确地排除包含非人抗原结合残基的人源化抗体。
[0189]“人源化(humanized)”抗体是指包含来自非人cdr的氨基酸残基和来自人fr的氨基酸残基的嵌合抗体。在某些实施例中,人源化抗体将包括基本上所有至少一个(且通常两个)可变结构域,其中所有或基本上所有cdr对应于非人抗体的那些,及所有或基本上所有fr对应对于人抗体的那些。人源化抗体任选地可包含衍生自人抗体的抗体恒定区的至少一部分。抗体(例如非人抗体)的“人源化形式(humanized form)”是指已经历人源化的抗体。
[0190]
在一个实施例中,重组蛋白为受体。在一个实施例中,重组蛋白为配体,且在一个实施例中为细胞因子。重组蛋白通过本领域已知的细胞培养方法产生,且也可称为“外源蛋白”。
[0191]
重组蛋白可在细胞内产生或分泌到培养基中,从该培养基中可回收和/或收集重组蛋白。
[0192]
在以工程化来重组表达外源蛋白的真核细胞接种培养基后,在发酵条件下培养该细胞。可使用适合细胞生长以用于生物量产生和重组蛋白表达的任何发酵细胞培养方法或系统。例如,细胞可以批式或批式进料培养,其中重组蛋白充分表达后终止培养,之后收获蛋白并根据需要纯化。可使用流化床生物反应器、中空纤维生物反应器、滚瓶、摇瓶或搅拌
槽生物反应器,并以批式、批式进料、连续、半连续或灌注模式操作。批式进料培养是一种广泛使用的培养方法,用于从真核细胞大规模生产蛋白质。参见例如chu and robinson(2001),current opin.biotechnol.12:180-87。如果使用批式进料培养,则培养的进料可连续进行,或在培养期间定期进行。当给予多种进料时,可每天、每隔一天、每两天等给予这些进料,每天一次以上,或每天少于一次,以此类推,每种进料使用相同或不同的进料溶液。
[0193]
在本发明生产重组蛋白的方法的一方面,该方法进一步包含从细胞培养物中回收重组蛋白的步骤。
[0194]
在一个实施例中,从细胞培养上清液中回收表达的重组蛋白。在一个实施例中,重组蛋白从细胞中回收。可使用本领域已知的方法在培养期间或通常在生产阶段的结束时回收表达的蛋白质。可根据需要使用本领域已知的技术分离和/或纯化表达的蛋白,例如蛋白a柱、离子交换柱纯化和/或尺寸排阻柱纯化。
[0195]
实例
[0196]
以下叙述是实例中所提供的信息的基础。
[0197]
活细胞密度、生存力和细胞时间积分
[0198]
为了分析活细胞密度和总细胞密度,使用了自动化的cedex hires系统(roche diagnostics,mannheim,germany)。使用台盼蓝(trypan blue)排除染色法评估活细胞和总细胞密度之间的区别,并根据制造商的说明分析每个样品每天10张以上的图片。
[0199]
分别如等式2(equ 2)和等式3(equ 3)中所述计算活细胞密度(vcd)和细胞存活力。
[0200]
(等式2)活细胞密度=n
台盼蓝阴性
×
(105个活细胞/ml)
[0201]
(等式3)细胞存活力=n
台盼蓝阴性
/(n
台盼蓝阴性
n
台盼蓝阳性
个细胞)
×
100%
[0202]
作为该过程中总体生物量产生的指标,使用公式4(equ 4)计算累积细胞时间积分(cti):
[0203]
(等式4)细胞时间积分=σ(0.5
×
(vcd
n-1
vcdn)
×
(tn–
t
n-1
))
×
(105个活细胞
×
d/ml)
[0204]
在以上等式中,n=细胞数,tn=时间点n;t
n-1
=n之前的时间点1;vdcn=在时间点n的活细胞密度;vdcn=n之前一个时间点的活细胞密度;cti=细胞时间积分;d
tn
=在时间点n的直径细胞;ml=毫升,d=天。
[0205]
毛细管电泳(ce-sds)
[0206]
根据制造商的说明,以agilent bioanalyzer 2100或perkinelmer labchip gx以及对应的蛋白质试剂盒在芯片上执行ce。
[0207]
产物滴度的定量和细胞比生产率(gp)的计算
[0208]
根据制造商的规程,使用cobas integra 400plus系统(roche,mannheim,germany)对产品的滴度进行定量。根据等式5计算总细胞比生产率(gp)以分析细胞生产能力。
[0209]
(等式5)qp=(滴度
n-滴度
n-1
)/(ctin–
cti
n-1
)
×
(pg/(活细胞
×
d))
[0210]
其中cti是细胞时间积分,n如上所述的定义,ml=毫升,d=天
[0211]
hcp测定
[0212]
过程样品中的中华仓鼠卵巢宿主细胞蛋白(cho hcp)含量是通过cobas e 411免
疫测定分析仪(roche diagnostics)上的电化学发光免疫分析(eclia)确定的。该测定基于夹心原理,使用来自绵羊的多克隆抗-cho hcp抗体。
[0213]
第一次孵育:来自15μl样品(纯净和/或稀释的)的cho hcp与生物素-缀合的多克隆cho hcp特异性抗体形成夹心络合物,该络合物经由生物素与链霉抗生物素蛋白的相互作用与链霉抗生物素蛋白包被的微粒结合。
[0214]
第二次孵育:添加了以钌络合物(三(2,2'-联吡啶基)钌(ii)络合物)标记的多克隆cho hcp特异性抗体后,在微粒上形成了三元夹心络合物。
[0215]
将反应混合物吸入测量的细胞中,其中将微粒磁性捕获到电极表面上。然后在洗涤步骤中除去未结合的物质。然后,将电压施加到电极上引起化学发光发射,其通过光电倍增器测量。
[0216]
最后,从已知浓度的cho hcp标准曲线计算出测试样品中cho hcp的浓度。
[0217]
plbl2测定
[0218]
过程样品中的cho磷脂酶b样2蛋白(plbl2)含量由eclia在cobas e 411免疫测定分析仪(roche diagnostics)上测定。该测定基于夹心原理,使用来自小鼠的单克隆抗-cho plbl2抗体。
[0219]
在第一个孵育步骤中,来自30μl样品(纯净和/或稀释的)中的cho plbl2、生物素标记的单克隆cho plbl2特异性抗体和用钌络合物(三(2,2'-联吡啶)钌(ii)-络合物)标记的cho plbl2特异性单克隆抗体形成夹心络合物。
[0220]
在添加链霉抗生物素蛋白包覆的微粒之后的第二步中,三元络合物经由生物素与链霉抗生物素蛋白的相互作用而结合到固相上。
[0221]
将反应混合物吸入测量的细胞中,其中将微粒磁性捕获到电极表面上。然后在洗涤步骤中除去未结合的物质。然后,将电压施加到电极上诱导化学发光,该化学发光通过光电倍增器测量。
[0222]
最后,从已知浓度的cho plbl2标准曲线计算出测试样品中cho plbl2的浓度。
[0223]
聚集素(clusterin)测定
[0224]
通过merck millipore的商业测定(gyromark ht kit gyrclu-37k),使用制造商的说明来确定过程样品中残留的聚集素含量。简而言之,该测定是基于以下条件的夹心elisa法:
[0225]
1)大鼠聚集素生物素化捕捉抗体结合至bioaffy 1000nl cd的链霉抗生物素蛋白包覆的亲和性柱,
[0226]
2)从样品中捕捉大鼠聚集素分子到抗聚集素抗体,
[0227]
3)第二染料标记的抗聚集素检测抗体结合至捕捉分子,及
[0228]
4)使用gyrolab evaluator定量大鼠聚集素。
[0229]
微量元素溶液
[0230]
氧化还原活性痕量金属可单独或以微量元素溶液(tes)的形式添加到基础培养基中,例如具有下列组成:
[0231]
tes1:铁、铜、铬、钴、硒、锰、钒和钼。
[0232]
tes2:铁、铜、硒、锰、钒和钼。
[0233]
tes3:铜、硒、锰、钒和钼。
[0234]
任何未包含于tes中的氧化还原活性痕量金属可单独添加到培养基中。例如,如果使用tes3,则可单独添加铁。
[0235]
使用上述公式1计算tes1、tes2和tes3的c
tes
。
[0236]
接种条件
[0237]
在实例中,接种条件为:ph为约ph 6.0至约ph 8.0,温度为约20℃至约39℃,且%o2为约10%至约80%。
[0238]
doe实验
[0239]
通过实验设计(design of experiment,doe)进行的统计实验计划是一项功能强大且众所周知的技术,特别是对于生物学和化学反应优化的目的而言,其中许多因素相互影响。例如,doe已成功用于优化细胞培养基(zhang等人,363-78)、发酵过程(fu等人,1095-105)、蛋白质纯化过程(pezzini等人,8197-208)和细胞培养条件(chen等人,1211-21)。
[0240]
基于期望的结果,可将不同的doe方法应用于本过程。例如,全因子实验非常适合以下情况:1)仅考虑很少的因子;2)我们主要对线性效应感兴趣及3)大量实验是可行的。由于在此我们目的在于二次效应,因此我们使用了以面心中心复合设计。中心复合设计通过轴向点扩展了经典设计点,以便估算二次效应的曲率。
[0241]
使用统计软件工具jmp(sas institute gmbh,germany),对此研究中所有doe方法进行计划和分析。遵循响应曲面法(response surface methodology,rsm),我们已将针对细胞比生产率qp的响应拟合至二次多项式模型,并在所有情况下均获得了显著的结果。该仿真使用jmp软件的“预测分析工具”功能。
[0242]
实例1
[0243]
筛选和评估调理期培养基处理对细胞比生产率和宿主细胞蛋白质含量的影响相互作用效应筛选添加氧化还原活性痕量金属、胱氨酸和培养基补充时机
[0244]
在第一个实验中,我们旨在筛选不同浓度的氧化还原活性痕量金属、胱氨酸和培养基添加时间对细胞培养性能和产物质量的相关性和影响,以检验我们的假设:如果在接种产生重组蛋白的细胞之前,将补充有氧化还原活性痕量金属和胱氨酸、半胱氨酸或半胱氨酸衍生物的培养基在合适的条件下放置一段时间,可提高细胞培养性能。为此,我们使用了最新的统计实验设计(doe)方法,分别使用ambr15机器人细胞培养筛选系统。我们使用痕量金属、胱氨酸和补充时点应用中心复合筛选设计doe。使用tes将氧化还原活性痕量金属添加至培养基中,c
tes
的累积量为6.39μm(称为“低tes”)至320μm(称为“高tes”)。将胱氨酸添加到培养基中,使培养基中的终浓度达到约0.5mm(称为“低cyscys”)至8mm(称为“高cyscys”)。
[0245]
所有参数在“高”和“低”水平之间的变化显示输入变量的相关性以及细胞比生产率(qp)(图1)和cho细胞衍生的宿主细胞蛋白杂质(cho hcp)的对应结果(图2)。图1显示在接种细胞之前,qp通常随培养基调节的长度增加而增加。图2显示,当延长接种前的调理期时,宿主细胞蛋白质杂质的数量减少。因此,统计实验设置显示,细胞培养性能得益于接种前对经补充的培养基的调节和增加调理期的长度。实例2和3中描述更详细的分析。
[0246]
实例2
[0247]
评估在开始调节之前向培养基中添加营养物对细胞比生产率、hcp杂质负荷和过程特异性需氧量的影响
[0248]
在该实例中,该方法包括在标准条件下使用完全受控的2l生物反应器系统以14天批式进料培养的方式培养不同的cho-k1细胞系(克隆)。在该实例中,将标准细胞培养基(化学成分经定义的基础培养基)加载至2l生物反应器中,保持在接种条件下,然后补充痕量金属和胱氨酸。然后开始调理期。基础培养基不含半胱氨酸或其衍生物,且更不含任何用于补充的痕量金属。将氧化还原活性痕量金属以c
tes
=53.9μm的累积量添加至培养基中。将胱氨酸加入培养基,使培养基中的终浓度达到约3mm。达到接种条件后,在接种前将补充培养基在接种条件下于生物反应器中放置24小时(参见图3,“老化的”)。作为比较,在相同的基础培养基中补充了相同量的相同微量元素溶液和半胱氨酸,并在保持相同接种条件之前,还同时接种了各自的克隆(参见图3,“新鲜的”)。
[0249]
为了简单起见,当在实例中使用时,术语“老化的”涉及根据该培养基根据本发明处理的实验所确定的结果;而当在本文中使用时,术语“新鲜的”涉及从实验所确定的结果,其中该培养基在各个方面都与老化的培养基相同,但是在补充营养物后直接接种。
[0250]
相同克隆的“老化的”培养物和“新鲜的”培养物均在相同条件下运作。
[0251]
在第一组实验中,使用表达不同单克隆抗体的三个cho克隆。克隆1和2表达不同的双特异性igg1抗体,克隆3表达双特异性抗体fab片段。还使用各自的宿主细胞系(hcl)。
[0252]
通过上述方法分析细胞培养物和产物特征。数据如图4a和图12b所示。
[0253]
在发酵结束时,根据本发明的培养基处理导致所有克隆和对应的hcl的细胞数减少(图4a至图4d)。培养基处理并不影响产物滴度(图5a至图5c)。
[0254]
根据本发明的培养基处理导致细胞比生产率提高18-27%(图6a、图6c、图6e和图7a、图7b)。通过绘制细胞体积积分与产物滴度的关系、可比较的生物量,因此观察到所有三个经测试克隆的可比的细胞体积-比生产率(图6b、图6d、图6f)。
[0255]
另外,在根据本发明处理的培养基中的细胞培养在该过程中表现出对氧气总体需求的降低,但生物量与在补充有相同营养物并直接接种的培养基所培养的细胞相同(图8a至图8f)。
[0256]
如通过ce-sds(毛细管电泳十二烷基硫酸钠)和尺寸排阻色谱(sec)所测量,培养基处理在第14天不会影响产物质量(图12a和图12b)。
[0257]
此外,将第14天培养物的上清液用于分析宿主细胞蛋白(hcp)的负载量,这对于后续的下游处理(dsp)效率至关重要。如此,在根据本发明处理的培养基中观察到培养基中ldh活性降低的趋势(高达26%)、死亡细胞的替代物和总体hcp水平(高达54%)(图9a、图10a和图9b、图10b)。通过使用根据本发明处理的培养基,对于更具体的hcp plbl2,观察到相同的趋势,且plbl2的负载降低17%至40%(图11a和图11b)。
[0258]
实例3
[0259]
评估调理期的持续时间对细胞比生产率和过程-比需氧量的影响
[0260]
在本实例中,使用实例2的基础培养基,并在不同时间补充痕量金属和胱氨酸,如方案2中的图13所示。在所有实验中,将基础培养基在接种条件下保持72小时。补充时点在每种设置中都不相同。在一种设置中,在开始调节之前,将基础培养基中补充痕量金属和胱氨酸。随后,在接种前将经补充的培养基在接种条件下放置72小时(参见图11,
“‑
72h”)。在另一种设置中,在开始调节后约24小时,向基础培养基中补充痕量金属和胱氨酸。随后,在接种前将经补充的培养基在接种条件下放置48小时(参见图11,
“‑
48h”)。在另一种设置中,
在开始调节后约48小时,向基础培养基补充痕量金属和胱氨酸,然后在接种前将经补充的培养基在接种条件下保持24小时(参见图11,
“‑
24h”)。在每种设置中,氧化还原活性痕量金属以tes的形式添加至培养基中,c
tes
的累积量=53.9μm;并补充胱氨酸至培养基中,使其最终浓度达到3mm。
[0261]
在此第二组实验中,以如上定义的克隆2的细胞进行接种。使用完全受控的2l生物反应器系统,在14天批式进料培养中进行实验。一式三份运行事例
“‑
24h”以分析实验的方差。相对标准偏差用于其他情况。
[0262]
通过上述方法分析细胞培养物和产物特征。结果示于图14至图17中。
[0263]
培养过程中的产物滴度如图14所示。
[0264]
经补充的培养基在接种条件下保存的时间越长,细胞比生产率就越高(图15)。
[0265]
需氧量如图16和图17所示。
[0266]
实例4
[0267]
针对n-1和n阶段的定制细胞生长和细胞比生产率调节的特定时间使用氧化还原活性痕量金属和胱氨酸培养基补充时机
[0268]
使用摇瓶接种培养物并以9个完全受控的ambr250
tm
机器人生物反应器系统的生物反应器进行14天批式进料生产培养,分析氧化还原活性痕量金属和胱氨酸培养基补充的时机的影响。补充用于n-1阶段和/或用于生产阶段的培养基,并在接种条件下保持不同的时间段。补充“老化的”培养基并在接种前调节12、24、48和96小时,而“新鲜的”培养基是在接种前直接(0小时)补充。实验的详细计划如表1中所示。可能的其他培养基定制方案描述于图18中。
[0269]
表1
[0270]
在接种前数小时前对于n-1(“生长培养基”)和n(“生产培养基”)补充和调理痕量金属及胱氨酸的时机。
[0271][0272]
将来自实施例2的选克隆2用于该研究。在摇瓶中,将细胞解冻,并以种子扩培在标准细胞培养基(专属化学性界定培养基;cdm1)中生长两周,以确保细胞生长稳定及确保一致的细胞倍增时间。在生产(n)阶段的接种前一周,将细胞转移至另一标准细胞培养基(专属化学性界定培养基;cdm2)中,以确保细胞扩增(n-2期)。n阶段接种前四天,将细胞转移至随时间不同,最终补充的cdm2培养基中,该培养基是在n-1阶段接种前(见表1),通过在0小时(新鲜的)或12小时、24小时和48小时(老化的)加入氧化还原活性痕量金属和胱氨酸所获
得的。然后将这些n-1“预培养物”用于14天生产(n)批式进料过程的接种。以在接种前0小时(新鲜的)或12小时、24小时、48小时或96小时(老化的)随时间不同地最终补充胱氨酸和氧化还原活性痕量金属(见表1),将cdm2培养基用于n阶段。为了避免在n阶段期间限制底物,细胞由连续的专属进料1(从第3天开始直至收获)进行补料,并调节葡萄糖至目标值。
[0273]
当在生长阶段使用“老化的”补充培养基时,结果是细胞数量减少,以和生长阶段使用“新鲜的”培养基相比,活细胞减少约10%来说明(图19)。这些结果表明,当在“新鲜的”培养基中进行生长阶段时,细胞的生长和生物量的产生会更好,且在任何时间段内“老化的”该用于生长期的培养基都不会有利于细胞生长。
[0274]
在随后以进料批式发酵过程的14天生产阶段中,所有情况均显示出可比较的滴度(图21),及通过ce-sds(图22)和sec(图23)所分析的产物质量。相反地,通过使用“老化的”培养基于n-1阶段及“新鲜的”培养基于n阶段(图20中的黑条)或使用“老化的”培养基于n阶段及“新鲜的”培养基于n-1阶段(图20中的虚线条),皆可提高细胞的细胞比生产率。有趣且出乎意料的是,在“新鲜的”培养基中进行的n阶段细胞从n-1培养物中继承了在“老化的”培养基中培养所产生的细胞比生产率提高的效果(仅在n期测量)。值得注意的是,在n-1和n阶段中均使用“老化的”培养基似乎对细胞比生产率具有负面影响,在n-1和n阶段中添加培养基后调节时间皆增加,导致比生产率的逐步下降(图20中的条形柱)。
[0275]
来自n阶段的上清液也用于分析培养基“老化的”宿主细胞蛋白质杂质的影响。为此,如方程式6至8中所述,分析了整体宿主细胞蛋白质、聚集素及plbl2(磷脂酶b样2)的“含量”(即,每个浓度靶蛋白的宿主细胞杂质浓度)。
[0276][0277][0278][0279]
c:浓度
[0280]
将n-1和n阶段中使用的培养基老化会导致hcp含量(图24)及聚集素负载(图25)略微减少。在此实验中未检测到对plbl2的影响(图26)。
[0281]
使用“老化的”培养基并增加补充后的调理期会减少14天批式进料培养的需氧量,由于技术上的限制,该效果不如具有较高气体流量的较大生物反应器(与2l生物反应器相比,ambr250
tm
系统中的气体流量更低)所产生的效果强。通过查看废气中的氧气量和过程中的摄氧速率(our),“老化的”过程(例如“48小时”和“96小时”)似乎在氧气利用率上更为“有效”(图27)。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。