1.本发明属于生物化学材料技术领域,具体涉及一种同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂及其制备方法和应用。
背景技术:
2.癌症已经成为严重威胁人类健康的疾病之一。化疗、手术和放疗这些传统治疗方法的效果差、毒副作用大,给患者的身心带来了极大的痛苦,并且易复发。光动力疗法(pdt)和光热疗法(ptt)具有无创性、低耐药性、局部治疗的优势,通过光对光敏剂的激发使其产生活性氧(ros)和热来杀死癌细胞,选择性好、副作用小,因此在抗癌方面得到了广泛的关注。
3.聚集诱导发光(aie)型光敏剂在聚集状态下分子内运动受到限制,非辐射减弱,辐射增强,具有荧光增强特性,同时聚集还能提高ros产生效率,为光动力抗癌应用提供了新契机。
4.光热疗法(ptt)是光敏剂吸收一定波长的光,从基态到激发态,能量通过振动弛豫转化为热,产生的热量使生物组织的温度升高从而对癌细胞起到杀伤作用。ptt可以促进免疫细胞的激活,并且随着温度的变化,生物组织的细胞形态和生存能力都会发生变化。对于肿瘤细胞而言,当温度升高到41℃时,细胞的跨膜扩散和血流速度都会加快。在温度为41~48℃时,细胞中的蛋白质会发生聚集,从而增加细胞对放化疗的敏感性,并且这种高温超过60min就会对细胞造成严重损伤。若温度升高至48-60℃,在短时间内也会对细胞造成不可逆的损伤,如蛋白质变性、dna受损等。而肿瘤组织由于存在供血差的特点,导致肿瘤组织对热的耐受性会比正常组织差,这是ptt治疗癌症的基础。
5.由于ptt具有与pdt相似的光激发特点,因此被广泛应用于与pdt作用相结合来克服单一pdt抗癌的局限性。ptt过程中产生的热量不仅能够引起癌细胞的凋亡,还能使肿瘤内血流量提高,为pdt过程提供更多的氧气。此外,pdt过程产生的ros可以抑制热休克蛋白的生成,有助于ptt更好的发挥作用。
6.目前,同时具有高效ros产生能力和光热转换效率的新型aie光敏剂还未见报道。
技术实现要素:
7.本发明的目的在于提供一种同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂及其制备方法和应用,本发明提供的光敏剂同时具有aie性质、强的ros和光热产生能力,可对癌细胞进行高效的光动力光热协同杀伤,抗癌活性高。
8.为了实现上述目的,本发明提供如下技术方案:
9.本发明提供了一种同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂,具有式i所示结构:
[0010][0011]
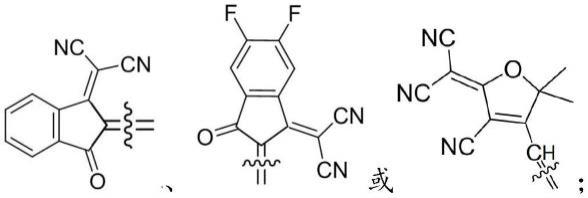
所述式i中的a为
[0012]
所述式i中的r1和r2独立的为氢、c
1~6
烷基、苯基、烷基取代的苯基或
[0013]
优选的,所述式i中的r1和r2为c
1~6
烷基。
[0014]
优选的,具有式i-1、式i-2或式i-3所示结构:
[0015][0016]
本发明提供了上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂的制备方法,包括以下步骤:
[0017]
将第一反应原料、第二反应原料和有机溶剂混合,进行knoevenagel反应,得到式i所示同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂;
[0018]
所述第一反应原料具有式ii所示结构、式iv所示结构或式v所示结构;
[0019]
所述第二反应原料具有式iii所示结构;
[0020]
将所述第一反应原料具有式iv所示结构时,所述knoevenagel反应的反应原料还包括吡啶;
[0021]
将所述第一反应原料具有式v所示结构时,所述knoevenagel反应的反应原料还包括乙酸铵,所述knoevenagel反应在保护气体氛围中进行;
[0022][0023]
优选的,所述第一反应原料具有式ii所示结构,所述第一反应原料和第二反应原料的摩尔比为1:1;所述knoevenagel反应的温度为常温。
[0024]
优选的,所述第一反应原料具有式iv所示结构,所述第一反应原料、第二反应原料与吡啶的摩尔比为1:1:1.5;所述knoevenagel反应的温度为常温。
[0025]
优选的,所述第一反应原料具有式v所示结构,所述第一反应原料、第二反应原料与乙酸铵的摩尔比为1:1:1.5;所述knoevenagel反应的温度为78℃。
[0026]
本发明提供了一种光动力诊疗和光热治疗协同抗癌的试剂,包括上述技术方案所述的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的聚集诱导发光型光敏剂。
[0027]
本发明提供了上述技术方案所述的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的聚集诱导发光型光敏剂在制备抗癌药物中的应用。
[0028]
本发明提供了一种改性光敏剂水分散液,包括水和分散于所述水中的改性光敏剂颗粒,所述改性光敏剂颗粒包括光敏剂颗粒和包覆于所述光敏剂颗粒表面的两亲性共聚物;所述光敏剂颗粒为上述技术方案所述的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的聚集诱导发光型光敏剂。
[0029]
本发明提供了一种同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂,具有式i所示结构。本发明提供的aie型光敏剂的分子结构中存在d-a相互作用,有利于光敏剂的吸收和发射波长发生红移,增加对生物组织的穿透深度,降低对生物组织的光损伤;本发明提供的光敏剂具有aie性质,在聚集状态下aie分子内运动受到限制,非辐射减弱,辐射增强,使其具有荧光增强的特性,同时,本发明提供的光敏剂能够靶向活细胞内的脂滴,进行荧光成像,具有较强的ros和光热产生能力。由实施例的结果表明,将式i-1、式i-2或式i-3所示结构的光敏剂用于光动力光热协同抗癌,本发明提供的式i-1、式i-2或式i-3所示结构的光敏剂对hela细胞具有良好的光动力光热协同杀伤效果,表明本发明提供的光敏剂有望用作荧光介导的pdt/ptt协同治疗。
[0030]
本发明还提供了上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂的制备方法,包括以下步骤:将第一反应原料、第二反应原料和有机溶剂混合,进行knoevenagel反应,得到式i所示同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂。本发明通过进行knoevenagel反应,制备得到式i所示结构的同时具有ros和光热产生能力的aie型光敏剂,制备方法步骤少,容易操作,适宜工业生产。
附图说明
[0031]
图1为2dmp3cn在不同甲苯体积分数(f
t
)dmso/甲苯混合溶液中的实时荧光强度与初始荧光强度的比值随着f
t
的变化曲线;
[0032]
图2为2dmp3cn nps与ros捕获剂dcfh-da混合溶液在530nm处的荧光强度与初始荧光强度比随光照时间的变化曲线;
[0033]
图3为2dmp3cn nps溶液不同浓度条件下随光照时间的温度变化曲线(光功率:0.5w/cm2);
[0034]
图4为2dmp3cn nps溶液(摩尔浓度:100μm)随光照时间的温度变化曲线;
[0035]
图5为2dmp3cn nps溶液在hela细胞中亚细胞器脂滴的实时荧光成像图;
[0036]
图6为不同浓度的2dmp3cn nps溶液对hela细胞的暗毒性和光毒性;
[0037]
图7为本发明实施例1制备2dmp3cn的合成路线图;
[0038]
图8为实施例2制备的式i-1所示结构的化合物在不同甲苯体积分数(f
t
)dmso/甲苯混合溶液中的实时荧光强度与初始荧光强度的比值随着f
t
的变化曲线;
[0039]
图9为实施例2制备的改性式i-1所示结构的化合物纳米颗粒溶液与ros捕获剂dcfh-da混合溶液在530nm处的荧光强度与初始荧光强度比随光照时间的变化曲线;
[0040]
图10为实施例2制备的改性式i-1所示结构的化合物纳米颗粒溶液不同浓度条件下随光照时间的温度变化曲线(光功率:0.5w/cm2);
[0041]
图11为实施例2制备的改性式i-1所示结构的化合物纳米颗粒溶液(摩尔浓度:100μm)随光照时间的温度变化曲线;
[0042]
图12为实施例2制备的改性式i-1所示结构的化合物纳米颗粒溶液在hela细胞中亚细胞器脂滴的实时荧光成像图;
[0043]
图13为实施例2制备的改性式i-1所示结构的化合物纳米颗粒溶液对hela细胞的暗毒性和光毒性;
[0044]
图14为实施例3制备的式i-2所示结构的化合物在不同甲苯体积分数(f
t
)dmso/甲苯混合溶液中的实时荧光强度与初始荧光强度的比值随着f
t
的变化曲线;
[0045]
图15为实施例3制备的改性式i-2所示结构的化合物纳米颗粒溶液与ros捕获剂dcfh-da混合溶液在530nm处的荧光强度与初始荧光强度比随光照时间的变化曲线;
[0046]
图16为实施例3制备的改性式i-2所示结构的化合物纳米颗粒溶液不同浓度条件下随光照时间的温度变化曲线(光功率:0.5w/cm2);
[0047]
图17为实施例3制备的改性式i-2所示结构的化合物纳米颗粒溶液(摩尔浓度:100μm)随光照时间的温度变化曲线;
[0048]
图18为实施例3制备的改性式i-2所示结构的化合物纳米颗粒溶液在hela细胞中亚细胞器脂滴的实时荧光成像图;
[0049]
图19为实施例3制备的改性式i-2所示结构的化合物纳米颗粒溶液对hela细胞的暗毒性和光毒性。
具体实施方式
[0050]
本发明提供了一种同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂,具有式i所示结构:
[0051][0052]
所述式i中的a为
[0053]
所述式i中的r1和r2独立的为氢、c
1~6
烷基、苯基、烷基取代的苯基或
[0054]
在本发明中,所述式i中的r1和r2优选为c
1~6
烷基。
[0055]
在本发明中,所述同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂优选具有式i-1、式i-2或式i-3所示结构:
[0056][0057]
本发明提供了上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂的制备方法,包括以下步骤:
[0058]
将第一反应原料、第二反应原料和有机溶剂混合,进行knoevenagel反应,得到式i所示同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂;
[0059]
所述第一反应原料具有式ii所示结构、式iv所示结构或式v所示结构;
[0060]
所述第二反应原料具有式iii所示结构;
[0061]
将所述第一反应原料具有式iv所示结构时,所述knoevenagel反应的反应原料还包括吡啶;
[0062]
将所述第一反应原料具有式v所示结构时,所述knoevenagel反应的反应原料还包括乙酸铵,所述knoevenagel反应在保护气体氛围中进行;
[0063][0064][0065]
在本发明中,若无特殊说明,所有制备原料/组分均为本领域技术人员熟知的市售产品。
[0066]
在本发明中,所述第一反应原料具有式ii所示结构,所述第一反应原料和第二反应原料的摩尔比优选为1:1。
[0067]
在本发明中,所述第一反应原料具有式ii所示结构,所述knoevenagel反应的温度优选为常温。
[0068]
在本发明中,所述第一反应原料具有式ii所示结构,本发明对所述knoevenagel反应使用的有机溶剂没有特殊的限定,采用本领域技术人员熟知的适用于进行knoevenagel反应的有机溶剂即可,具体如乙醇。本发明对所述有机溶剂的用量没有特殊要求,能够使反应顺利进行即可。
[0069]
在本发明中,所述第一反应原料具有式iv所示结构,所述第一反应原料、第二反应原料与吡啶的摩尔比优选为1:1:1.5。
[0070]
在本发明中,所述第一反应原料具有式iv所示结构,所述knoevenagel反应的温度优选为常温。
[0071]
在本发明中,所述第一反应原料具有式iv所示结构,本发明对所述knoevenagel反应使用的有机溶剂没有特殊的限定,采用本领域技术人员熟知的适用于进行knoevenagel反应的有机溶剂即可,具体如三氯甲烷。本发明对所述有机溶剂的用量没有特殊要求,能够使反应顺利进行即可。
[0072]
在本发明中,所述第一反应原料具有式v所示结构,所述第一反应原料、第二反应原料与乙酸铵的摩尔比优选为1:1:1.5。
[0073]
在本发明中,所述第一反应原料具有式v所示结构,所述knoevenagel反应的温度优选为78℃。
[0074]
在本发明中,所述第一反应原料具有式v所示结构,本发明对所述knoevenagel反应使用的有机溶剂没有特殊的限定,采用本领域技术人员熟知的适用于进行knoevenagel反应的有机溶剂即可,具体如乙醇。本发明对所述有机溶剂的用量没有特殊要求,能够使反应顺利进行即可。
[0075]
在本发明中,所述第一反应原料具有式v所示结构,所述knoevenagel反应在保护气体氛围中进行,本发明对所述保护气体气氛没有特殊限定,在常规的保护气体气氛中进行即可,如氮气氛围或惰性气体氛围。
[0076]
在本发明中,所述knoevenagel反应优选在搅拌条件下进行,本发明对于所述搅拌的速率没有特殊的限定,能够搅拌均匀即可。
[0077]
本发明对于所述knoevenagel反应的时间没有特殊的限定,优选通过本领域公知的薄层色谱点板(tlc板)对所述knoevenagel反应进行监控,反应至具有式iii所示结构化合物完全消失即可。
[0078]
在本发明中,knoevenagel反应后,本发明优选还包括对knoevenagel反应体系进行后处理,得到式i所示同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂。
[0079]
在本发明中,所述后处理优选包括以下步骤:
[0080]
将所述knoevenagel反应得到的反应液浓缩,得到浓缩物;
[0081]
将所述浓缩物进行柱层析,得到纯化反应液;
[0082]
将所述纯化反应和二氯甲烷和正己烷的混合溶剂混合,进行重结晶,固液分离后,得到式i所示同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂。
[0083]
本发明对所述浓缩的具体实施方式没有特殊限定,采用常规的浓缩的方式即可,如旋蒸。
[0084]
在本发明中,所述柱层析用洗脱剂优选为石油醚和乙酸乙酯的混合液,其中,石油醚和乙酸乙酯的体积比优选为3:1。
[0085]
在本发明中,对所述柱层析得到的纯化反应液进行所述重结晶时,所述二氯甲烷和正己烷的体积比优选为1:6。
[0086]
在本发明中,所述固液分离优选为过滤。
[0087]
本发明提供了一种光动力诊疗和光热治疗协同抗癌的试剂,包括上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂。
[0088]
本发明提供了上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂在制备抗癌药物中的应用。
[0089]
本发明提供了一种改性光敏剂水分散液,包括水和分散于所述水中的改性光敏剂颗粒,所述改性光敏剂颗粒包括光敏剂颗粒和包覆于所述光敏剂颗粒表面的两亲性共聚物;所述光敏剂颗粒为上述技术方案所述的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂或上述技术方案所述的制备方法制备得到的同时具有活性氧和光热产生能力的聚集诱导发光型光敏剂。
[0090]
在本发明中,所述两亲性共聚物具体优选为泊洛沙姆(f127)。
[0091]
本发明提供了上述技术方案所述改性光敏剂水分散液的制备方法,包括以下步骤:
[0092]
将式i所示结构的光敏剂和f127溶解于四氢呋喃(thf)中,得到混合溶液;
[0093]
将所述混合溶液和水进行超声混合,得到所述改性光敏剂纳米颗粒的水分散液。
[0094]
在本发明中,具有式i所示结构的光敏剂和f127的质量比优选为1:4~1:6,更优选为1:5。
[0095]
在本发明中,所述混合溶液中式i所示结构的光敏剂的质量浓度优选为0.1~0.4mg/ml更优选为0.2mg/ml。
[0096]
在本发明中,所述混合溶液中f127的质量浓度优选为0.3~0.6mg/ml更优选为0.5mg/ml。
[0097]
本发明优选将所述混合溶液滴加至所述水中进行所述超声混合。
[0098]
在本发明中,所述超声混合时,超声的功率优选为150w。
[0099]
在本发明中,所述滴加完毕后,本发明优选继续超声3~5min。
[0100]
在本发明中,所述f127为两亲性共聚物,在超声作用和亲疏水相互作用下,f127和光敏剂进行自组装,疏水的光敏剂和f127的疏水部分相互作用,形成纳米粒子的内核,而f127的亲水性部分则分散在粒子表面,形成f127包覆光敏剂纳米颗粒的形式,得到改性光敏剂颗粒,使改性后的光敏剂均匀而稳定的分散在水中,防止沉淀,最终制备成水溶性的纳米颗粒(nps)水分散液。
[0101]
在本发明中,由于改性光敏剂纳米颗粒独特的高渗透/滞留的“被动”肿瘤靶向能力,使够使改性的光敏剂纳米颗粒水分散液用于活体动物体内癌症诊断和治疗成为可能。
[0102]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0103]
实施例1
[0104]
按照图7所述的合成路线图制备:
[0105]
将第一反应原料(图7中的化合物1,135mg,0.68mmol)、第二反应原料(图7中的化合物2,200mg,0.68mmol)和乙酸铵(78mg,1.02mmol)溶于乙醇中得到混合液。将混合液在78℃条件下反应过夜,用tlc板监控反应进程直至第二反应原料完全消失,将反应完全的反应液浓缩,以石油醚(pe):乙酸乙酯(ea)=3:1(v:v)为洗脱剂进行柱层析得到纯化反应液,然后将纯化反应液与二氯甲烷:正己烷=1:6(v:v)的混合溶剂混合进行重结晶,得到深绿色固体产物,产率:92%;
[0106]
对本实施例所得固体产物进行表征,具体核磁数据如下:
[0107]1h nmr(500mhz,cdcl3)δ7.56-7.47(m,1h),7.36(d,j=9.0hz,2h),7.16(d,j=8.7hz,2h),6.82(d,j=11.8hz,1h),6.76(d,j=7.5hz,2h),6.69(d,j=9.0hz,2h),6.51(d,j=15.0hz,1h),3.10(s,12h),1.58(d,j=4.4hz,6h).
13
c nmr(126mhz,cdcl3)δ173.85,161.78,152.22,151.73,149.53,133.04,131.85,128.03,125.52,122.43,114.49,113.16,112.30,111.55,111.28,96.34,40.26,40.15,26.76.
[0108]
根据上述核磁表征数据可知得到本实施例制备的同时具有ros和光热产生能力的aie型光敏剂的结构式如式i-3所示,记为2dmp3cn。
[0109][0110]
为了使2dmp3cn能够被应用于生物环境水体系,本实施例以2dmp3cn颗粒为光敏剂颗粒,以两亲性共聚物f127为包覆基质,采用超声的方法制备改性光敏剂纳米颗粒水水分散液。制备步骤如下:
[0111]
将2dmp3cn和f127(2dmp3cn和f127质量比为1:5)分散溶解在thf中,得到混合溶液,混合溶液中,2dmp3cn的质量浓度为0.2mg/ml,f127的质量浓度为0.5mg/ml;在超声条件(超声功率为150w)下向水中缓慢滴加所得混合溶液,滴加完毕后继续超声混合3~5min,得到改性的2dmp3cn纳米颗粒(记为2dmp3cn nps),的水分散液,然后用持续的氮气吹拂浓缩后,再用pbs溶液稀释,获得指定浓度的2dmp3cn nps的pbs溶液。
[0112]
性能测试:
[0113]
(1)aie性质测试:在不同甲苯体积分数(f
t
)的dmso/甲苯混合溶液中加入2dmp3cn的dmso溶液(1mm),得到浓度为10μm的2dmp3cn溶液,以600nm为激发波长测定不同甲苯体积分数的混合溶液中在742nm处的实时荧光强度与初始荧光强度的比值变化情况,测试结果如图1所示。
[0114]
图1为2dmp3cn在不同甲苯体积分数的dmso/甲苯混合溶液中742nm处的荧光强度比随甲苯体积分数的变化情况,从低到高对应的正己烷的体积分数依次为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%和99%,激发光波长为600nm。从图1中可以看出,随着甲苯体积分数的增加,2dmp3cn荧光发射强度比逐渐增加,直至90%之后出现一定程度的下降,这说明2dmp3cn具有aie性质,甲苯体积分数90%后的荧光下降可能是由于其聚集状态的改变导致的。
[0115]
(2)ros产生能力测试:利用2
′
,7
′‑
二氯荧光黄双乙酸盐(dcfh-da)为ros捕获剂,检测改性光敏剂纳米颗粒2dmp3cn nps产生ros的效率。首先需要用无水乙醇配置浓度为1mm的dcfh-da母液,吸取500μl的dcfh-da的无水乙醇母液于naoh溶液中(2ml、10mm),混合均匀,避光条件下保存30min以活化dcfh-da得到二氯荧光素(dcfh)溶液。最后将dcfh溶液加入到10ml pbs缓冲溶液(ph=7.4、25mm)中,混合均匀后得到终浓度为40μm的dcfh溶液。在含有一定浓度光敏剂的2ml比色皿中加入50μl的dcfh溶液,用cel-pe300l-3a太阳能模拟器白光光照,此为实验组。利用荧光光谱仪收集光照时间从0s开始,一定时间间隔的荧光光谱(激发波长为489nm,发射波长范围:500-600nm),将只加dcfh后光照组做为空白对照组,结果如图2所示。
[0116]
图2为2dmp3cn nps与ros捕获剂dcfh混合溶液在530nm处的荧光强度与0s时的荧光强度比随光照时间的变化情况。从图2可以看出,随着光照时间的延长,空白dcfh组荧光强度比无明显变化,但有本实施例的光敏剂纳米颗粒存在时,dcfh的荧光强度比上升明显,说明2dmp3cn nps具有ros产生能力。
[0117]
(3)2dmp3cn nps的光热产生能力测试:将改性光敏剂纳米颗粒(2dmp3cn nps)配置成不同浓度的水溶液(0μm、12.5μm、25μm、50μm、100μm),吸取200μl上述溶液于0.5ml的pe管中,使用660nm的激光作为光源对纳米粒子进行光照,同时利用红外热成像仪监测纳米粒子温度的变化。结果如图3所示。固定2dmp3cn nps的浓度为100μm,改变激光功率,测定不同光功率下的纳米粒子的温度变化,最后用软件进行数据处理。结果如图3~4所示。
[0118]
图3为不同浓度的2dmp3cn nps水溶液随光照时间的温度变化(光功率:0.5w/cm2);图4为不同光功率下的2dmp3cn nps水溶液随光照时间的温度变化(浓度:100μm)。从图3可以看出,随着光照时间的延长,纳米粒子水溶液的温度逐渐上升,表现出一定的浓度依赖性,从图4可以看出,随着光照时间的延长,纳米颗粒水溶液的温度逐渐上升,表现出光功率依赖性。证明上述光敏剂纳米粒子有一定的光热产生能力。
[0119]
(4)改性光敏剂纳米颗粒对hela细胞的靶向荧光成像能力测试,具体步骤如下:
[0120]
将hela细胞铺在共聚焦皿中放置在二氧化碳培养箱(37℃,5%co2)中培养过夜。在hela细胞中加入商业染料bodipy 493/503(3μm),孵化30min,pbs冲洗三次后加入2dmp3cn nps水溶液(50μm)孵化7h,使用蔡司lsm 880激光扫描显微镜对细胞进行成像。2dmp3cn nps的激发波长为633nm,发射接收波长》645nm;bodipy 493/503的激发波长为488nm,发射接收波长为495~620nm,测试结果如图5所示。
[0121]
图5为2dmp3cn nps和商业脂滴染料bodipy 493/503对hela细胞的实时荧光成像图,从图5中可以看出,2dmp3cn nps可在细胞内呈现明亮的红色荧光,商业脂滴染料bodipy493/503在细胞中呈现绿色荧光,两者的叠加图可以看出,红色荧光和绿色英光可以很好的重叠,说明2dmp3cn nps具有脂滴靶向荧光成像能力。
[0122]
(5)改性光敏剂纳米颗粒对hela细胞光动力光热杀伤能力测试,具体步骤如下:
[0123]
hela细胞在含10%(体积含量)热灭活胎牛血清、100mg
·
ml-1
青霉素和100mg
·
ml-1
链霉素的dmem(含各种氨基酸和葡萄糖的培养基)中,37℃条件下,在含有5%co2(体积含量)的湿化培养箱中培养。采用mtt法测定细胞活力,mtt法是一种检测细胞存活和生长的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt(3-(4,5-二甲基-2-噻唑基)-2,5-二苯基溴化四唑)还原为水不溶性的蓝紫色结晶甲臜并沉积在细胞中,而死细胞无此功能。dmso能溶解细胞中的甲臜,用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。
[0124]
将100μl细胞悬液(5000个细胞/孔)置于96孔板中。37℃条件下,在含有5%co2的加湿培养箱中预孵育24h。孔中加入不同浓度的2dmp3cn nps水溶液,终浓度分别为0μm、0.5μm、1μm、2.5μm、5μm、10μm。细胞在培养箱中孵育16h后,用0.5w/cm2,660nm激光对hela细胞光照5min,继续在37℃条件下孵育4h后,用含20μg/ml mtt的新鲜培养基(100μl)交换细胞培养液。孵育4h后移去培养基,加入100μl的dmso溶解甲臜晶体。用酶标仪测定490nm处吸光度,作为光毒性组。未处理细胞作为对照。按照上述方法,区别在于不进行光照处理,细胞在培养箱中孵育20h后,用含20μg/ml mtt的新鲜培养基(100μl)交换细胞培养液。孵育4h后移去培养基,加入100μl的dmso溶解甲臜晶体。用酶标仪测定490nm处吸光度,作为暗毒性组,测试结果如图6所示。
[0125]
图6为不同浓度的2dmp3cn nps对hela细胞的光动力光热杀伤情况。从图6可以看出,随着2dmp3cn nps浓度的增大,光毒性组hela细胞的存活率明显下降,暗毒性组hela细胞的存活率均保持在80%左右,说明黑暗条件下,2dmp3cn nps对hela细胞具有较高的安全性,光照条件下,对hela细胞的光动力光热杀伤作用明显。
[0126]
实施例2
[0127]
与实施例1的制备方法基本相同,不同之处在于:将化合物1替换为
[0128]
将所得产物进行核磁表征,核磁数据为:1h nmr(500mhz,cdcl3)δ8.69
–
8.55(m,2h),8.39(d,j=12.6hz,1h),7.82(d,j=6.5hz,1h),7.69
–
7.60(m,2h),7.50(d,j=8.8hz,2h),7.24(s,1h),6.77(d,j=8.4hz,2h),6.68(d,j=8.8hz,2h),3.10(d,j=4.4hz,12h)
.
13
c nmr(126mhz,cdcl3)δ189.86,168.69,152.74,152.41,147.42,139.97,137.31,134.03,134.00,133.37,133.34,128.55,125.23,124.62,122.89,121.64,120.16,116.07,111.68,111.47,40.25,40.15.
[0129]
由核磁数据可知本实施例得到的同时具有ros和光热产生能力的aie光敏剂的结构式如式i-1所示。
[0130][0131]
将式i-1所示结构的化合物和f127(2dmp3cn和f127质量比为1:5)分散溶解在thf中,得到混合溶液,混合溶液中,式i-1所示结构的化合物的质量浓度为0.2mg/ml,f127的质量浓度为0.5mg/ml;在超声条件(超声功率为150w)下向水中缓慢滴加所得混合溶液,滴加完毕后继续超声混合3~5min,得到改性的式i-1所示结构的化合物纳米颗粒的水分散液,然后用持续的氮气吹拂浓缩后,再用pbs溶液稀释,获得指定浓度的改性的式i-1所示结构的化合物纳米颗粒的pbs溶液。
[0132]
按照实施例1的方法对实施例2所得式i-1的光敏剂的ros和光热产生能力进行测试,所得结果如图8~13所示,与实施例1制备的产品测试结果相似。
[0133]
实施例3
[0134]
与实施例1的制备方法基本相同,不同之处在于:将化合物1替换为
[0135]
将所得产物进行核磁表征,核磁数据为:1h nmr(500mhz,cdcl3)δ8.60(d,j=12.7hz,1h),8.43(dd,j=10.2,6.5hz,1h),8.35(d,j=12.7hz,1h),7.58(t,j=7.7hz,1h),7.52(d,j=8.7hz,2h),7.25(s,2h),6.80(s,2h),6.71(d,j=8.8hz,2h),3.13(d,j=5.9hz,12h).
13
c nmr(126mhz,cdcl3)δ189.86,168.69,152.74,152.41,147.42,139.97,137.31,134.03,134.00,133.37,133.34,128.55,125.23,124.62,122.89,121.64,120.16,116.07,111.68,111.47,40.25,40.15.
[0136]
由核磁数据可知本实施例得到的同时具有ros产生能力的aie光敏剂的结构式如式i-2所示。
[0137]
[0138]
将式i-2所示结构的化合物和f127(2dmp3cn和f127质量比为1:5)分散溶解在thf中,得到混合溶液,混合溶液中,式i-2所示结构的化合物的质量浓度为0.2mg/ml,f127的质量浓度为0.5mg/ml;在超声条件(超声功率为150w)下向水中缓慢滴加所得混合溶液,滴加完毕后继续超声混合3~5min,得到改性的式i-2所示结构的化合物纳米颗粒的水分散液,然后用持续的氮气吹拂浓缩后,再用pbs溶液稀释,获得指定浓度的改性的式i-2所示结构的化合物纳米颗粒的pbs溶液。
[0139]
按照实施例1的方法对实施例3所得式i-2的光敏剂的ros和光热产生能力进行测试,所得结果如图14~19所示,与实施例1制备的产品测试结果相似。
[0140]
由以上实施例可知,本发明提供的同时具有ros和光热产生能力的aie型光敏剂合成步骤简单,分离纯化操作简便;对hela细胞有良好的光动力光热杀伤效果;同时,本发明所述光敏剂还具有良好的aie性质,可靶向癌细胞脂滴进行荧光成像,可用于构建荧光介导的pdt/ptt抗癌药物。
[0141]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。