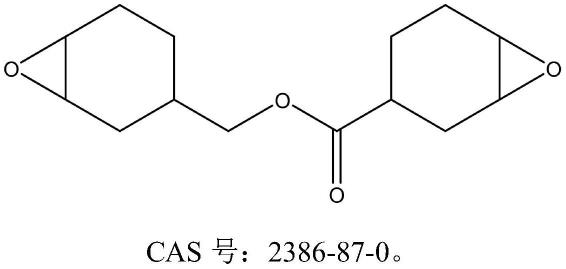
1.本发明涉及疾病模型技术领域,尤其是涉及体外动脉粥样硬化斑块模型、制备方法及应用。
背景技术:
2.据世界卫生组织统计和中国心血管病报告,动脉粥样硬化(atherosclerosis,as)引起的缺血性心脏病和中风,已成为全球非传染性疾病的首要致死原因,也正成为我国的主要疾病负担。as是一种慢性疾病,主要涉及的病理细胞类别包括与血液接触的内皮细胞和动脉粥样硬化斑块内部的单核/巨噬细胞及平滑肌细胞。
3.现有体外动脉粥样硬化细胞模型以单类细胞模型为主,细胞斑块模型的构建十分缺乏。通过氧化损伤等手段模拟病理刺激,已建立有各类细胞损伤模型(内皮细胞、平滑肌细胞、巨噬细胞、单核细胞),用于体外单因素分析研究。近年来,多细胞研究模型陆续出现,内皮细胞和平滑肌细胞(或引入炎性细胞)进行直接/间接接触培养,构建了炎性细胞浸润模型,为细胞互作研究提供了平台。早期as细胞斑块的出现也初步为as发展、药物筛选、器械评估等提供了体外类斑块环境。然而,现有各种细胞模型未考虑动脉粥样斑块内平滑肌细胞和巨噬细胞的直接作用和两者病理分布比例的影响,且仅有的斑块模型缺少主要的平滑肌层和内膜层细胞成分,均无法体现病理斑块的整体结构成分特征。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于,提供一种体外构建动脉粥样硬化斑块模型的方法,通过模拟病理环境下平滑肌细胞和巨噬细胞相互作用的数量比例,并构建最外层损伤内皮层,以建立具有动脉粥样硬化斑块病理结构成分特征的细胞斑块模型。
6.为了解决上述技术问题,实现上述目的,本发明提供以下技术方案:
7.第一方面,本发明提供体外动脉粥样硬化斑块模型的制备方法,所述制备方法包括,将平滑肌细胞和单核吞噬细胞混合后,加入细胞损伤刺激剂培养获得斑块内核,而后,在斑块内核单侧接种损伤的内皮细胞,经培养得到类病理结构的动脉粥样硬化斑块模型。
8.在可选的实施方式中,所述单核吞噬细胞与平滑肌细胞的数量比为2~10:1。
9.在可选的实施方式中,所述单核吞噬细胞包括预分化单核细胞或巨噬细胞中的至少一种。
10.在可选的实施方式中,所述细胞损伤刺激剂包括氧化低密度脂蛋白和/或葡萄糖转运蛋白抑制剂。
11.优选地,所述葡萄糖转运蛋白抑制剂包括stf31。
12.在可选的实施方式中,所述细胞损伤刺激剂加入的终浓度为10~300μg/ml。
13.在可选的实施方式中,平滑肌细胞和单核吞噬细胞混合在趋化小室或细胞球模型制备板中培养。
14.在可选的实施方式中,所述损伤的内皮细胞的制备方法包括,使用细胞损伤刺激剂预处理内皮细胞。
15.优选地,所述细胞损伤刺激剂包括氧化低密度脂蛋白和/或葡萄糖转运蛋白抑制剂。
16.进一步优选地,所述葡萄糖转运蛋白抑制剂包括stf31。
17.在可选的实施方式中,所述制备方法包括以下步骤:
18.(a)分别培养巨噬细胞和平滑肌细胞备用,将巨噬细胞与平滑肌细胞按照数量比2~10:1的比例混合接种于细胞趋化小室,利用10~300μg/ml氧化低密度脂蛋白处理12~48小时获得斑块模型内核;
19.(b)用10~300μg/ml氧化低密度脂蛋白预处理内皮细胞12~48小时后,接种于(a)步骤得到的斑块模型内核的上侧或下侧,继续培养12~72小时获得类病理结构的动脉粥样硬化斑块模型。
20.优选地,所述巨噬细胞与平滑肌细胞数量比为3~9:1。
21.优选地,所述氧化低密度脂蛋白加入后的终浓度为20~100μg/ml。
22.第二方面,本发明提供采用前述实施方式任一项所述制备方法得到的体外动脉粥样硬化斑块模型。
23.第三方面,本发明提供了前述实施方式所述体外动脉粥样硬化斑块模型在(a)~(c)任一项中的应用:
24.(a)动脉粥样硬化发生发展的研究;
25.(b)治疗动脉粥样硬化药物的筛选;
26.(c)治疗动脉粥样硬化的介入器械的功能评估。
27.在本发明提供的技术方案中,在细胞损伤刺激剂的处理下,平滑肌细胞和单核吞噬细胞混合培养形成斑块内核,而后与损伤的内皮细胞组合形成类病理结构的动脉粥样硬化斑块模型。该模型对as发生发展研究、药物筛选,及介入器械功能的针对性评估具有重大意义。
附图说明
28.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
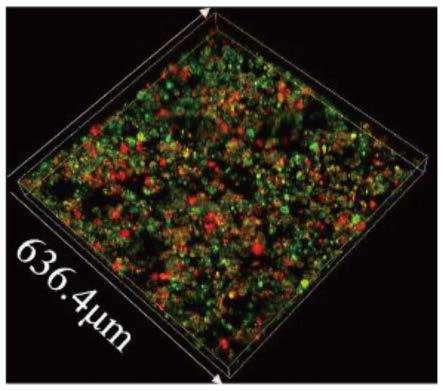
29.图1为本发明实施例1提供的斑块模型内核的细胞荧光检测结果;
30.图2为本发明实施例2提供的斑块模型内核的细胞荧光检测结果;
31.图3为本发明实施例3提供的斑块模型内核的细胞荧光检测结果;
32.图4为本发明实施例4和对比例1提供的体外动脉粥样硬化斑块模型的效果对比图。
具体实施方式
33.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例
中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
34.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
35.在具体一次实施方式中,第一方面,本发明提供体外动脉粥样硬化斑块模型的制备方法,所述制备方法包括,将平滑肌细胞和单核吞噬细胞混合后,加入细胞损伤刺激剂培养获得斑块内核,而后,在斑块内核单侧接种损伤的内皮细胞,经培养得到类病理结构的动脉粥样硬化斑块模型。
36.在可选的实施方式中,所述单核吞噬细胞与平滑肌细胞的数量比为2~10:1,包括但不限于2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1。
37.在可选的实施方式中,所述单核吞噬细胞包括预分化单核细胞或巨噬细胞中的至少一种。
38.在可选的实施方式中,所述细胞损伤刺激剂包括氧化低密度脂蛋白和/或葡萄糖转运蛋白抑制剂。
39.低密度脂蛋白是一种运载胆固醇进入外周组织细胞的脂蛋白颗粒,可被氧化成氧化低密度脂蛋白,当低密度脂蛋白,尤其是氧化修饰的低密度脂蛋白(ox-ldl)过量时,它携带的胆固醇便积存在动脉壁上,久了容易引起动脉硬化。因此低密度脂蛋白被称为“坏的胆固醇”。
40.葡萄糖转运蛋白是一类镶嵌在细胞膜上转运葡萄糖的载体蛋白,广泛分布于体内各种组织,是一个蛋白家族,包括多种蛋白质,在体内的分布及与葡萄糖分子的亲和力差异显著。其抑制剂能够降低葡萄糖转运蛋白活性,从而降低体液中葡萄糖向组织中的转运效率,不同组织葡萄糖转运蛋白对应的抑制剂具有一定区别。
41.优选地,所述葡萄糖转运蛋白抑制剂包括stf31。
42.在可选的实施方式中,所述细胞损伤刺激剂加入浓度为10~300μg/ml,包括但不限于10μg/ml、30μg/ml、50μg/ml、70μg/ml、90μg/ml、100μg/ml、120μg/ml、140μg/ml、160μg/ml、180μg/ml、200μg/ml、220μg/ml、240μg/ml、260μg/ml、280μg/ml或300μg/ml。
43.在可选的实施方式中,平滑肌细胞和单核吞噬细胞混合在趋化小室或细胞球模型制备板中培养。
44.在可选的实施方式中,所述损伤的内皮细胞的制备方法包括,使用细胞损伤刺激剂预处理内皮细胞。
45.优选地,所述细胞损伤刺激剂包括氧化低密度脂蛋白和/或葡萄糖转运蛋白抑制剂。
46.进一步优选地,所述葡萄糖转运蛋白抑制剂包括stf31。
47.在可选的实施方式中,所述制备方法包括以下步骤:
48.(a)分别培养巨噬细胞和平滑肌细胞备用,将巨噬细胞与平滑肌细胞按照数量比2~10:1的比例混合接种于细胞趋化小室,利用10~300μg/ml氧化低密度脂蛋白处理12~48小时获得斑块模型内核;
49.(b)用10~300μg/ml氧化低密度脂蛋白预处理内皮细胞12~48小时后,接种于(a)步骤得到的斑块模型内核的上侧或下侧,继续培养12~72小时获得类病理结构的动脉粥样硬化斑块模型;
50.优选地,所述巨噬细胞与平滑肌细胞数量比为3~9:1;
51.优选地,所述氧化低密度脂蛋白加入后的终浓度为20~100μg/ml。
52.第二方面,本发明提供采用前述实施方式任一项所述制备方法得到的体外动脉粥样硬化斑块模型。
53.第三方面,本发明提供了前述实施方式所述体外动脉粥样硬化斑块模型在(a)~(c)任一项中的应用:
54.(a)动脉粥样硬化发生发展的研究;
55.(b)治疗动脉粥样硬化药物的筛选;
56.(c)治疗动脉粥样硬化的介入器械的功能评估。
57.下面结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
58.实施例1
59.本实施例提供了一种体外动脉粥样硬化斑块模型的斑块模型内核的制备方法,包括如下步骤:于37℃、5%二氧化碳细胞培养箱,分别培养巨噬细胞和平滑肌细胞备用,按巨噬细胞与平滑肌细胞数量3:1的比例混合接种于细胞趋化小室,利用20μg/ml氧化低密度脂蛋白处理48小时获得斑块模型内核,按照参考文献1中第2.7节记载的细胞示踪方法对得到的斑块模型内核进行细胞荧光检测,结果如图1所示,巨噬细胞与平滑肌细胞交互(绿色荧光为巨噬细胞,红色荧光为平滑肌细胞)形成巨噬细胞在内皮下层浸润后与平滑肌相互作用的早期斑块,该斑块内巨噬细胞数量是平滑肌数量的3倍。
60.实施例2
61.本实施例提供了一种体外动脉粥样硬化斑块模型的斑块模型内核的制备方法,包括如下步骤:于37℃、5%二氧化碳细胞培养箱,分别培养巨噬细胞和平滑肌细胞备用,按巨噬细胞与平滑肌细胞数量9:1的比例混合接种于细胞趋化小室,利用100μg/ml氧化低密度脂蛋白处理48小时获得斑块模型内核,按照参考文献1中第2.7节记载的细胞示踪方法对得到的斑块模型内核进行细胞荧光检测,结果如图2所示,巨噬细胞与平滑肌细胞交互(绿色荧光为巨噬细胞,红色荧光为平滑肌细胞)形成类中晚期阶段斑块的组织块结构,大量巨噬细胞浸润到内皮下层与平滑肌相互作用并发生泡沫化,该斑块内巨噬细胞数量是平滑肌数量的9倍。
62.实施例3
63.本实施例提供了一种体外动脉粥样硬化斑块模型的斑块模型内核的制备方法,与对比例2的区别仅在于氧化低密度脂蛋白处理时间为72小时,得到的斑块模型内核形成类中晚期阶段斑块球体结构,大量巨噬细胞浸润将平滑肌包绕并发生泡沫化,该斑块巨噬细胞数量是平滑肌数量的9倍,结果如图3所示。
64.实施例4
65.本实施例提供了一种体外动脉粥样硬化斑块模型的制备方法,包括步骤:用50μg/ml氧化低密度脂蛋白预处理内皮细胞12小时,而后接种于实施例3得到的斑块模型内核上
侧,继续培养24小时获得类病理结构成分的动脉粥样硬化斑块模型,命名为model组。
66.对比例1
67.本对比例提供了一种体外动脉粥样硬化斑块模型的制备方法,与实施例4的区别仅在于,接种的内皮细胞未经过氧化低密度脂蛋白预处理,命名为control组。
68.按照如下实验方法对实施例4和对比例1提供的体外动脉粥样硬化斑块模型he染色检测、炎症因子表达检测和凋亡荧光检测,检测结果如图4所示。
69.(1)he染色检测
70.采用参考文献2第2.5小节的he染色检测方法。
71.(2)炎症因子表达检测
72.采用参考文献2第2.5小节炎症因子表达检测方法。
73.(3)凋亡荧光检测
74.采用参考文献3tunnel staining部分凋亡荧光检测方法。
75.如图4可知,模型组均呈现出了上层内皮层,下层为巨噬细胞和平滑肌细胞共存的结构,其中处理组的炎症因子表达较空白组明显升高,且模型内部出现了大量凋亡细胞,符合中晚期斑块的病理结构和特点。
76.综上,动脉粥样硬化斑块的病理特点与其结构和细胞成分息息相关,而产生慢性炎症环境与巨噬细胞和平滑肌细胞的数量状态及内皮层细胞的功能互为关联。因此,基于巨噬细胞和平滑肌细胞数量比例以及病变内皮细胞层,构建as斑块,可同时再现as斑块的主要结构成分特征,如内膜层下的巨噬平滑肌泡沫细胞脂质核心,和as斑块的主要病理特点,如斑块内部细胞大量凋亡。
77.参考文献:
78.[1]jiang,lang,et al."polydopamine-modified copper-doped titanium dioxide nanotube arrays for copper-catalyzed controlled endogenous nitric oxide release and improved re-endothelialization."acs applied bio materials 3.5(2020):3123-3136.
[0079]
[2]zou,dan,et al."preparation of a biomimetic ecm surface on cardiovascular biomaterials via a novel layer-by-layer decellularization for better biocompatibility."materials science and engineering:c 96(2019):509-521.
[0080]
[3]wang,shuang-shuang,et al."mesenchymal stem cells stabilize atherosclerotic vulnerable plaque by anti-inflammatory properties."plos one 10.8(2015):e0136026.
[0081]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。