基因工程细胞及其用途
1.交叉引用
2.本技术要求于2019年8月13日提交的中国专利申请cn201910746355.8和于2019年12月10日提交的国际专利申请pct/cn2019/124321的优先权,上述专利申请中的每一个通过引用整体并入本发明。
技术领域
3.本发明涉及基因工程细胞,并且更具体地涉及对同种异体免疫系统具有抗性的经工程改造的细胞,并且进一步涉及用于制备所述细胞的方法以及所述细胞在同种异体移植中的用途。
背景技术:
4.同种异体移植排斥反应是同种异体器官移植或细胞移植失败的主要原因。虽然t细胞在同种异体移植排斥反应中发挥重要作用,但最近的研究表明,非t细胞,如自然杀伤(nk)细胞、b细胞、巨噬细胞和肥大细胞在调节移植物结果方面表现出意想不到的作用。(li,transplantation,2010;90(10):1043-1047)。例如,nk细胞独特的自身-非自身识别系统与同种异体移植高度相关。简而言之,单个nk细胞在细胞表面同时具有刺激性受体和抑制性受体,并且需要来自这两种受体的信号来建立nk对自体细胞的耐受性。在人体中,抑制性受体包含杀伤细胞免疫球蛋白样受体(kirs)。此外,nkg2a和cd94通常在细胞表面形成异二聚体,并在nk细胞和t细胞中作为抑制性受体发挥作用。“自身”i类mhc与此类抑制性受体的结合抑制nk细胞,并阻止nk细胞攻击“自身”细胞。在移植物模型中,受体中的nk细胞可以通过“missing self”识别容易地识别mhc不相容的同种异体细胞,因为同种异体细胞缺乏用于与nk抑制性受体结合的自身i类mhc。抑制性信号的缺乏触发nk活化,包括细胞溶解活性和产生强效促炎性细胞因子。相同的机制也适用于如t细胞等其它免疫细胞的激活,并导致同种异体移植排斥反应。
5.嵌合抗原受体t细胞(car-t)疗法在如复发难治性淋巴瘤、白血病、多发性骨髓瘤等癌症中显示出了良好的疗效。然而,现有的自体car-t技术需要对细胞进行个体化制备,因此受到生产周期长、成本高、以及在很多情况下患者缺乏足够的t细胞的限制。因此,通用的car-t(ucar-t)疗法引起了极大的关注,其中,t细胞来源于健康供体,并提前制备以供任何患者使用。然而,如在任何其它同种异体移植中一样,t细胞移植物与受体之间的双向排斥需要得到解决。本发明解决了在同种异体器官移植和细胞移植中需要克服同种异体移植排斥反应的问题,并提供了相关优势。
技术实现要素:
6.本发明提供了一种融合蛋白,其包括通过连接子与β-2-微球蛋白(β2m)肽共价连接的呈递肽,其中所述融合蛋白结合主要组织相容性(mhc)重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制所述免疫细胞,并且其中所述融合蛋白(1)包括
少于500个氨基酸,或者(2)缺乏hla-e重链。
7.本发明提供的融合蛋白结合主要组织相容性(mhc)重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制所述免疫细胞。在一些实施方案中,所述免疫细胞的所述抑制性受体是nkg2a。在一些实施方案中,所述免疫细胞的抑制性受体选自由kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、kir3dl1、kir3dl2、kir3dl3和lir1组成的群组。
8.在一些实施方案中,所述mhc重链是经典i类mhc重链、非经典i类mhc重链或mhc样重链。在一些实施方案中,所述mhc重链是经典i类mhc重链,所述经典i类mhc重链选自由hla-a重链、hla-b重链和hla-c重链组成的群组。在一些实施方案中,所述mhc重链是非经典i类mhc重链,所述非经典i类mhc重链选自由以下组成的组的非经典i类mhc重链:hla-e重链、hla-f重链和hla-g重链组成的群组。在一些实施方案中,所述mhc重链是mhc样分子重链,所述mhc样分子重链选自由cd1重链、mr1重链、fcrn重链和ul18组成的群组。在一些实施方案中,所述mhc重链是hla-e重链。
9.在一些实施方案中,本发明提供了融合蛋白,其包括通过连接子与β2m肽共价连接的呈递肽,其中所述呈递肽是hla-e限制性呈递肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
10.在本发明提供的融合蛋白的一些实施方案中,所述呈递肽源自病毒、原核生物、真核生物或哺乳动物。在一些实施方案中,所述呈递肽源自人。
11.在本发明提供的融合蛋白的一些实施方案中,所述呈递肽是i类mhc分子的信号肽或其片段。
12.在一些实施方案中,本发明提供的融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中所述呈递肽是i类mhc分子的信号肽或其片段,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
13.在一些实施方案中,所述呈递肽具有5-30个氨基酸。在一些实施方案中,所述呈递肽具有7-20个氨基酸。在一些实施方案中,所述呈递肽具有8-10个氨基酸。
14.在本发明提供的融合蛋白的一些实施方案中,所述呈递肽是i类mhc分子的信号肽或其片段,其中所述i类mhc分子选自由以下各项的重链组成的群组:hla-a1、hla-a2、hla-a*3401、hla-a*80、hla-b7、hla-b*13、hla-b15、hla-cw3、hla-cw*2、hla-cw*0809、hla-cw7、hla-cw*1701、hla-g和hla-f。
15.在一些实施方案中,所述呈递肽的氨基酸序列包括x1x2x3x4x5x6x7x8l;其中x1是v或i;x2是t、a、m或l;x3是a、p、k或n;x4是p、l或t;x5是r、q或k;x6是t或a;x7是l、i、v或p;x8是v、l、i、f或t(seq id no:115)。在一些实施方案,所述呈递肽的氨基酸序列选自由seq id nos:21-73组成的群组。在一些实施方案中,所述呈递肽的氨基酸序列是vmaprtvll(seq id no:38)。
16.在一些实施方案中,本发明提供的融合蛋白包括少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,所述融合蛋白包括约120-180个氨基酸。
17.在一些实施方案中,本发明提供的融合蛋白从n端到c端包括所述呈递肽、所述连接子和所述β2m肽。
18.在本发明提供的融合蛋白的一些实施方案中,所述连接子的氨基酸序列包括(eaaak)n,其中n=3、4或5(seq id no:110),并且其中所述连接子具有5到30个氨基酸。在一些实施方案中,所述连接子的氨基酸序列包括(ggggs)n,其中n=3、4或5(seq id no:112),并且其中所述连接子具有5到30个氨基酸。在一些实施方案中,所述连接子的氨基酸序列是seq id no:1或2。
19.在本发明提供的融合蛋白的一些实施方案中,所述β2m肽的氨基酸序列与seq id no:81具有至少85%、至少90%或至少95%的同一性。在一些实施方案中,所述β2m肽的氨基酸序列是seq id no:81。
20.在一些实施方案中,本发明提供的融合蛋白由所述呈递肽、所述连接子和所述β2m肽组成。
21.在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与选自由seq id nos:5和13-18组成的群组中的氨基酸序列具有至少85%、至少90%或至少95%的同一性。在一些实施方案中,所述融合蛋白的氨基酸序列选自由seq id nos:5和13-18组成的群组。
22.本发明还提供了对本发明提供的融合蛋白进行编码的核酸。
23.在一些实施方案中,本发明提供了核酸,其包括(i)对融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链;以及(ii)对合成受体进行编码的第二片段。
24.在一些实施方案中,所述合成受体选自由嵌合抗原受体(car)、t细胞受体(tcr)、tcr受体融合构建体(truc)、t细胞抗原偶联物(tac)、抗体tcr受体(abtcr)和嵌合cd3受体组成的群组。在一些实施方案中,所述合成受体是car。
25.在一些实施方案中,所述合成受体包括特异性结合肿瘤抗原的抗原结合结构域。在一些实施方案中,所述肿瘤抗原选自由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,所述肿瘤抗原是cd19或bcma。
26.在一些实施方案中,所述合成受体包括特异性结合病毒抗原的抗原结合结构域。在一些实施方案中,所述病毒抗原是ebv或hpv。
27.在本发明提供的核酸的一些实施方案中,所述第一片段和所述第二片段通过对2a肽进行编码的多核苷酸连接。在一些实施方案中,所述2a肽是p2a肽、t2a肽、f2a肽或e2a肽。在一些实施方案中,本发明提供的核酸从n端到c端对所述合成受体、所述2a肽、所述融合蛋白进行编码。
28.在本发明提供的核酸的一些实施方案中,所述第一片段和所述第二片段通过ires序列连接。
29.本发明还提供了包括本发明所公开的核酸的载体。
30.在一些实施方案中,所述载体是病毒载体。在一些实施方案中,所述病毒载是慢病毒载体、腺病毒载体或腺相关病毒载体。
31.本发明还提供了表达本发明所公开的融合蛋白的基因工程细胞。
32.本发明还提供了包括本发明公开的所述核酸或本发明所公开的所述载体的基因工程细胞。
33.在一些实施方案中,本发明提供的细胞进一步表达合成受体。
34.在一些实施方案中,本发明提供的细胞进一步包括第二核酸,所述第二核酸对合成受体进行编码。在一些实施方案中,所述合成受体选自由car、tcr、truc、tac、abtcr和嵌合cd3受体组成的群组。在一些实施方案中,所述合成受体是car。
35.在一些实施方案中,所述合成受体包括特异性结合肿瘤抗原的抗原结合结构域。在一些实施方案中,所述肿瘤抗原选自由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,所述肿瘤抗原是cd19或bcma。
36.在一些实施方案中,所述合成受体是car,所述car具有特异性结合cd19或bcma的抗原结合结构域,其中所述car的氨基酸序列选自由seq id nos:74-80和136组成的群组。
37.在一些实施方案中,所述合成受体是tcr,所述tcr具有特异性结合ny-eso-1的抗原结合结构域,其中所述tcr的氨基酸序列是seq id no:132。
38.在一些实施方案中,所述合成受体包括特异性结合病毒抗原的抗原结合结构域。在一些实施方案中,所述病毒抗原是ebv或hpv。
39.在本发明提供的细胞的一些实施方案中,本发明提供的融合蛋白与在所述细胞表面上的内源性mhc重链形成复合物。
40.在一些实施方案中,本发明提供的细胞缺乏对所述细胞表面上的i类mhc分子或mhc样分子进行编码的至少一个基因内源性表达。在一些实施方案中,本发明提供的细胞缺乏在所述细胞表面上的i类mhc分子的内源性表达,所述i类mhc分子选自由hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链和hla-g重链组成的群组。在一些实施方案中,本发明提供的细胞缺乏在所述细胞表面上的β2m的内源性表达。在一些实施方案中,本发明提供的细胞缺乏在所述细胞表面上的mhc样分子的内源性表达,所述mhc样分子选自由cd1重链、mr1重链、fcrn重链和ul18组成的群组。
41.在一些实施方案中,本发明提供的细胞是免疫细胞。在一些实施方案中,本发明提供的细胞是白细胞。在一些实施方案中,所述白细胞选自由t细胞、nk细胞、nkt细胞、b细胞、浆细胞、树突状细胞、中性粒细胞、单核细胞、巨噬细胞和粒细胞组成的群组。在一些实施方案中,所述白细胞是nk细胞。在一些实施方案中,所述白细胞是t细胞。
42.在一些实施方案中,对tcr复合物的组分进行编码的至少一个基因在所述t细胞中被灭活。
43.本发明还提供了具有本发明提供的细胞和药学上可接受的载体的药物组合物。
44.本发明还提供了本发明提供的细胞在同种异体移植中的用途。
45.本发明还提供了本发明提供的细胞在癌症治疗中的用途。
46.本发明还提供了本发明提供的细胞在制备用于治疗癌症的药物的用途。
47.本发明还提供了本发明提供的细胞在同种异体移植中的用途,其中所述细胞包括对融合蛋白进行编码的核酸,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
48.本发明还提供了本发明提供的细胞在同种异体移植中的用途,其中所述细胞表达融合蛋白,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
49.本发明还提供了治疗需要同种异体移植的受试者的方法,所述方法包括向所述受
试者施用有效量的本发明提供的细胞。
50.本发明还提供了治疗受试者的癌症的方法,所述方法包括向所述受试者施用治疗有效量的本发明提供的细胞。
51.本发明还提供了治疗需要同种异体移植的受试者的方法,所述方法包括向所述受试者施用有效量的细胞,其中所述细胞包括对融合蛋白进行编码的核酸,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
52.本发明还提供了治疗需要同种异体移植的受试者的方法,所述方法包括向所述受试者施用有效量的细胞,其中所述细胞表达融合蛋白,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
53.本发明还提供了对细胞进行基因工程改造以用于同种异体移植物的方法,所述方法包括用对融合蛋白进行编码的核酸转导所述细胞,其中所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,并且其中所述融合蛋白(1)包括少于500个氨基酸,或者(2)缺乏hla-e重链。
54.本发明还提供了对细胞进行基因工程改造以用于同种异体移植的方法,所述方法包括用本发明提供的核酸转导所述细胞。
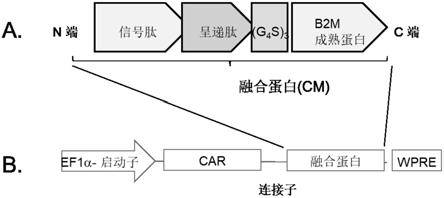
55.本发明还提供了对细胞进行基因工程改造以用于同种异体移植的方法,所述方法包括用本发明提供的载体转导所述细胞。
56.在一些实施方案中,本发明提供的方法进一步包含使所述细胞中对i类mhc分子或mhc样分子进行编码的至少一个基因灭活。在一些实施方案中,经灭活的基因对i类mhc分子进行编码,所述i类mhc分子选自由hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链和hla-g重链组成的群组。在一些实施方案中,所述经灭活的基因对β2m进行编码。在一些实施方案中,所述经灭活的基因对mhc样分子进行编码,所述mhc样分子选自由cd1重链、mr1重链、fcrn重链和ul18组成的群组。
57.在一些实施方案中,所述基因通过dna剪切、dna剪切和修复、碱基编辑、引导编辑(prime editing)、rna干扰或rna编辑来灭活。在一些实施方案中,所述基因通过dna剪切灭活,所述dna剪切使用稀有核酸内切酶,所述稀有核酸内切酶选自由rna定向核酸内切酶、tal核酸酶、归巢核酸酶、锌指核酸酶和mega-tal核酸酶组成的群组。在一些实施方案中,所述基因通过dna剪切和修复来灭活。在一些实施方案中,所述基因通过使用crispr-cas系统来灭活。在一些实施方案中,所述crispr-cas系统是crispr-cas9系统。
58.在本发明提供的方法的一些实施方案中,所述细胞是免疫细胞。在一些实施方案中,所述免疫细胞选自由t细胞、nk细胞、nkt细胞、b细胞、浆细胞、单核细胞、巨噬细胞、树突状细胞和粒细胞组成的群组。
59.本发明还提供了治疗需要同种异体移植的受试者的方法,所述方法包括:根据本发明所公开的制备方法制备基因工程细胞;以及将所述经工程改造的细胞施用于所述受试者。
附图说明
60.图1是融合蛋白的示意图和表达载体的示意图。图1的图区a是本发明提供的示例性融合蛋白(或“嵌合分子”或“cm”)的示意图。图1的图区b是具有编码融合蛋白(cm)和car的核酸片段的载体的示意图。
61.图2示出了融合蛋白(cm)和car在基因工程jurkat t细胞中的共表达。图区a示出了对照组中未经转导的细胞的结果。图区b示出了用car19-p2a-cm病毒转导的细胞的结果,其中cm包括hla-e限制性呈递肽。如箭头所指示的,通过hla-e抗体检测到hla-e在细胞表面处的表达。图区c示出了用car19-p2a-cm-c转导的细胞的结果,其中cm包括hla-c限制性呈递肽。通过hla-e抗体未检测到hla-e在细胞表面处的表达。
62.图3示出了融合蛋白(cm)在初始t细胞中的表达。图区a示出了总的ucar-t-cm细胞。图区b示出了当用cd3抗体和hla-abc抗体染色时,约80%的同时具有tcr基因和b2m基因敲除的ucar-t-cm细胞呈双阴性。图区c示出了融合蛋白(cm)在cd3和hla-abc双阴性ucar-t-cm细胞中的表达,如针对hla-e的阳性染色所示。
63.图4示出了表达融合蛋白(cm)的ucar-t细胞对nk细胞的杀伤具有抗性。
64.图5示出了表达融合蛋白(cm)的ucar-t细胞对同种异体pbmc细胞的生长抑制具有抗性并且在受到肿瘤细胞刺激后迅速扩增。
65.图6示出了表达融合蛋白(cm)的ucar-t细胞在同种异体pbmc环境中有效地阻滞了肿瘤细胞的生长并且还杀死了肿瘤细胞。
66.图7示出了流式细胞术分析结果,证明融合蛋白(cm)与hla-e重链分子在β2m敲除细胞的细胞膜上形成复合物。
67.图8a-8b示出了流式细胞术分析结果,证明不同的呈递肽与hla-e复合物在细胞膜上的不同表达水平相关联。图8a示出了来自流式细胞术分析的数据,并且图8b量化了在图8a中所示出的数据。
68.图9示出了不同融合蛋白在基因工程初始人t细胞中表达的流式细胞术分析结果。不同的融合蛋白(cm、cm12、cm13、cm14)含有不同的hla-e限制性呈递肽。所有组中的细胞均使用crispr/cas9敲除了trac和β2m,并表达靶向cd 19的car。对照ucar-t组未表达任何融合蛋白。
69.图10示出了表达不同融合蛋白(cm、cm12、cm13、cm14)的ucar-t细胞对同种异体pbmc细胞的生长抑制具有抗性并且在受到肿瘤细胞刺激后迅速扩增。
70.图11示出了靶向ny-eso-1的外源性tcr(1g4)和融合蛋白(cm)在基因工程jurkat t细胞中共表达的流式细胞术分析结果。ntc:未经转导的对照(无慢病毒转导)。图区a-d:野生型jurkat t细胞;图区e-p:具有trac和β2m双敲除,因此呈cd3和β2m双阴性的jurkat t细胞。
71.图12示出了trac和β2m双敲除初始人t细胞对同种异体pbmc细胞的生长抑制具有抗性并且在受到靶细胞刺激后持续扩增,该t细胞表达靶向ny-eso-1的tcr(1g4)和融合蛋白cm。
72.图13示出了具有或不具有trac和β2m双敲除的不同t细胞组中hla-abc和cd3的表面表达的流式细胞术分析结果。
73.图14示出了bcma car和融合蛋白cm的表达的流式细胞术分析结果,如hla-e在具
有或不具有trac和β2m双敲除的不同t细胞组中的表达所示。值得注意的是,bcma car和cm仅在bcma-cm car-t和bcma-cm ucar-t组中均呈阳性/共表达。
74.图15示出了不同t细胞组的细胞因子释放概况。值得注意的是,bcma-cm car-t和bcma-cm ucar-t在受到bcma阳性肿瘤细胞的刺激后均释放了大量的il-2。
75.图16示出了与不具有cm表达的ut细胞相比,表达cm的bcma-cm ucar-t细胞对nk细胞具有抗性。
具体实施方式
76.本发明实施方案本发明实施方案在进一步描述本发明之前,应当理解的是,本发明不限于本发明所列举的特定实施方案,并且还应当理解的是,本发明使用的术语是为了描述特定实施方案,而不是意图限制本发明。
77.本发明涉及用于提高同种异体器官移植或同种异体细胞移植(例如,通用的car-t疗法)成功率的组合物和方法。本发明的组合物和方法所提供的一个优点是克服受体的免疫系统对同种异体移植物的排斥。具体地,发现了包括β2m多肽和呈递肽的融合蛋白可以在用于移植的细胞中表达,所述融合蛋白可以与内源性表达的mhc重链在细胞表面上形成mhc复合物,使得mhc复合物可以结合受体的免疫细胞(例如,nk细胞和t细胞)的抑制性受体,并阻止受体的免疫细胞引发针对同种异体细胞的免疫应答。
78.例如,如果同种异体移植细胞缺乏hla-e在细胞表面上的表达(所述hla-e是结合免疫细胞(例如,nk细胞或t细胞)上的抑制性受体nkg2a的非经典i类mhc复合物),则同种异体移植物细胞将被受体的免疫细胞识别和杀死是已知的(saunders et al,immunological reviews(2015)267:148-166)。在一些实施方案中,本发明提供了表达具有β2m多肽和hla-e限制性呈递肽的融合蛋白的基因工程细胞。融合蛋白可以与内源性表达的hla-e重链在细胞表面上形成hla-e复合物,所述hla-e复合物与nk细胞或t细胞上的抑制性受体nkg2a结合以抑制nk细胞或t细胞的活化。与表达完整的mhc复合物(例如,β2m加hla-e重链,至少500个氨基酸)相比,本发明所公开的组合物和方法是有利的,这至少是因为本发明提供的融合蛋白可以明显更小(例如,少于300个氨基酸),这使得基因工程改造具有更高的准确性和效率。
79.6.1定义
80.除非本发明另有定义,本发明中使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非语境另有要求,单数术语应包括复数,且复数术语应包括单数。通常,本发明所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质和化学和杂交相关的术语使用和技术均为本领域中公知且常用的术语。
81.术语“多肽”、“肽”、“蛋白质”及其在本发明可互换使用的语法等同词是指任意长度的氨基酸聚合物,其可以为线性的或支链的。其可包括非天然或修饰的氨基酸,或被非氨基酸打断。多肽、肽或蛋白质也可被修饰,例入通过二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰。
82.术语“融合蛋白”是指一种蛋白质、肽或多肽,其氨基酸序列来源于两个或两个以上分离的蛋白质、肽或多肽。所述融合蛋白还包括来自分离蛋白质、肽或多肽的氨基酸部分之间的氨基酸连接区。氨基酸的这种连接区在本发明称为“连接子”。
83.术语“主要组织相容性复合物”、“mhc复合物”和“mhc”在本发明中可互换地使用,这与本领域中普遍接受的用法一致。简而言之,上述术语是指一组紧密连接的基因,这些基因编码的细胞表面蛋白对于获得性免疫系统至关重要,以识别脊椎动物的外来分子,进而决定组织相容性。mhc的主要功能是抗原呈递,并且已经观察到极其丰富的多态性。人mhc也被称为人白细胞抗原(“hla”)。mhc复合物是异二聚体并且由两个“mhc蛋白”组成。应当理解的是,“mhc基因”是指编码mhc蛋白的多核苷酸。
84.mhc复合物包含i类mhc(或mhc-i类)、ii类mhc(或mhc-ii类)和mhc样复合物(或“mhc类似物”或“mhc同源物”)。i类mhc复合物是由两条肽链组成的异二聚体糖蛋白,两条肽链通过非共价键连接,其中一条肽链为多态重链(即“i类mhc重链”,也被称为“i类mhcα链”),另一条肽链为轻链(即为β-2-微球蛋白(β2m))。i类mhc复合物将细胞内蛋白质的肽片段展示给免疫细胞,触发免疫系统对由i类mhc复合物所展示的特定非自身抗原的即时应答。在人体中,经典i类mhc(也被称为mhc ia)包含hla-a、hla-b和hla-c;并且非经典i类mhc(也称为mhc-ib)包含hla-e、hla-f和hla-g。
85.mhc样复合物,也被称为mhc类似物或mhc同源物,在结构上与i类mhc复合物相似。一些mhc样复合物也由非共价连接的重链(即“mhc样重链”)和β2m蛋白组成。示例性mhc样复合物包含但不限于cd1、mr1、新生儿fc受体(fcrn)和人巨细胞病毒(hcmv)衍生的ul18。cd1在结构上与其它i类mhc复合物相似,并由重链和β2m组成。cd1呈递脂质抗原,并进一步包含cd1a、cd1b、cd1c、cd1d和cd1e。mr1(mhc相关蛋白1)在结构上与i类mhc复合物相似,并由重链和β2m组成。mr1主要呈递小芳香族分子,这些小芳香族分子激活粘膜相关恒定t细胞(mait)。这些小芳香族分子通常比i类mhc呈递的多肽或cd1呈递的脂质小。新生儿fc受体(fcrn)跨细胞层运输免疫球蛋白g(igg),以延长igg在循环中的半衰期,并为新生儿提供体液免疫。与其它i类mhc一样,fcrn由重链和β2m组成。ul18与mhc重链具有同源性,并与β2m结合以形成在细胞表面上表达的复合物,使细胞能够逃避nk细胞介导的细胞溶解。
86.术语“β-2-微球蛋白(β2m)肽”是指β-2-微球蛋白的全长蛋白,或其功能片段或变体。β2m是i类mhc复合物的轻链。b2m基因的灭活可有效地消除细胞表面i类mhc的表达。表面不表达i类mhc的细胞被nk细胞识别并杀死。人β2m的分子量为11,800道尔顿并且由119个氨基酸(seq id no:7)组成。在n端处的前20个氨基酸形成人β2m的信号肽,该信号肽可以被剪切。人β2m的成熟形式不包含信号肽,并且由99个氨基酸(seq id no:81)组成。
87.β2m的示例性功能片段包含,例如,截短形式:δn6β2m(93个氨基酸),其缺乏成熟β2m的6个n端氨基酸;以及δn10β2m(89个氨基酸),其缺乏成熟β2m的10个n端氨基酸((sulatskaya et al.,int.j.mol.sci.(2018)19:2762).)。示例性变体包含,例如,uniprot上提供的以下同种型:条目f5h6i0(101个氨基酸)、h0ylf3(71个氨基酸)、b4e0x1(122个氨基酸)、a6xmh4(124个氨基酸)、a6xmh5(92个氨基酸)、a6xnd9(101个氨基酸)、q9um88(29个氨基酸)、q16446(51个氨基酸)和j3knu0(57个氨基酸)。
88.术语“变体”与具有特定序列特征的蛋白质或多肽(“参考蛋白”或“参考多肽”)相关,其是指与参比蛋白或参比多肽相比,包括一种或多种(例如,约1至约25、约1至约20、约1至约15、约1至约10、或约1至约5)氨基酸替换、缺失和/或添加的不同的蛋白或多肽。氨基酸序列的变化可以为氨基酸替换。氨基酸序列的变化可以为保守的氨基酸替换。蛋白质或多肽的功能片段或功能变体保持参比蛋白质或多肽的基本结构和功能特性。举例来说,人β2m
的变体可以具有一个或多个(例如,约1个至约25个、约1个至约20个、约1个至约15个、约1个至约10个或约1个至约5个)对野生型人β2m的氨基酸序列的变化。人β2m的变体具有人β2m的基本结构和功能特性。例如,与全长人β2m一样,人β2m变体也可以与mhc重链结合以形成可以被免疫细胞识别的mhc复合物。
89.术语“呈递肽”是指可以与mhc的抗原结合槽稳定结合以形成稳定的mhc复合物的短肽,以被免疫细胞上的受体识别。呈递肽通常具有7-30个氨基酸。在一些实施方案中,呈递肽具有7-20个氨基酸、7-17个氨基酸、7-15个氨基酸、7-12个氨基酸或8-10个氨基酸。
90.每个mhc都有与其匹配的呈递肽。“限制”于特定mhc分子的呈递肽意味着该呈递肽可以与该特定mhc分子形成稳定的复合物。例如,hla-c限制性呈递肽可以与hla-c在细胞表面上形成稳定的复合物,并且hla-e限制性呈递肽可以与hla-e在细胞表面上形成稳定的复合物。通过选择与hla稳定结合的呈递肽,可以鉴定出仅限于特定hla的呈递肽。限制于特定i类mhc或mhc样复合物的呈递肽可以与β2m共价连接以形成融合蛋白,该融合蛋白可以与特定mhc重链形成稳定的复合物。例如,具有与β2m共价连接的hla-c限制性呈递肽的融合蛋白可以与hla-c重链在细胞表面上形成稳定的复合物,并且具有与β2m共价连接的hla-e限制性呈递肽的融合蛋白可以与hla-e重链在细胞表面上形成稳定的复合物。
91.与免疫细胞相关的术语“抑制性受体”是指在免疫细胞表面表达的受体分子,其与其配体结合后可以抑制免疫细胞的活性。免疫系统采用多种抑制性机制来控制免疫应答并确保免疫耐受性和体内平衡,包含通过抑制性受体介导的抑制性途径。例如,nk细胞受自体i类mhc结合性受体的调节,其与自身mhc i类分子结合后对nk细胞产生显性抑制。i类mhc结合性抑制性受体不仅由nk细胞表达,还由t细胞亚群表达,尤其是cd8 t细胞。这些抑制性受体至少有两个家族,包含杀伤免疫球蛋白样受体(kir)家族和c型凝集素样家族(例如,nkg2a/b、cd94)。
92.术语“特异性结合”是指与替代物质(包括相关和不相关蛋白)相比,多肽或分子与表位、蛋白或靶分子的相互作用可以更频繁、更快速、持续时间更长、亲和力更高或上述效果的一些组合。可以通过免疫测定、elisas、spr(例如,biacore)或本领域技术人员已知的其他技术,鉴别特异性结合靶分子(例如,抗原)的结合部分(例如,抗体)。通常,特定的反应将至少是背景信号或噪声的2倍,并且可以是背景的10倍以上。特异性结合靶分子的结合部分可以以比其对不同分子的亲和力更高的亲和力结合靶分子。在一些实施方案中,“特异性结合”是指,结合部分以约0.1mm或更低kd结合分子靶标。在一些实施方案中,“特异性结合”是指,多肽或分子以约30μm或更低kd,结合靶标。在一些实施方案中,“特异性结合”是指,多肽或分子以约10μm或更低kd,或以约1μm或更低kd结合靶标。在一些实施方案中,“特异性结合”是指,多肽或分子以约0.1μm或更低kd,或以约0.01μm或更低kd,或以约1nm或更低kd结合靶标。
93.术语“多核苷酸”、“核酸”及其在本发明可互换使用的语法等同词是指任何长度的核苷酸聚合物,包括dna和rna。所述核苷酸可以为脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基,和/或它们的类似物,或可以通过dna或rna聚合酶结合到聚合物中的任何底物。
94.术语“同一性”、百分比“同一性”及其语法等同词是指当比较和对齐(必要时引入间隙)以获得最大对应时,不考虑任何保守的氨基酸替换作为序列同一性的一部分,相同或
具有特定百分比的相同核苷酸或氨基酸残基的两个或多个序列或子序列。所述序列百分比可使用序列比较软件或算法或通过目测来测量。可用于获得氨基酸或核苷酸序列比对的各种算法和软件在本领域众所周知。这些算法或软件包括但不限于blast、align、megalign、bestfit、gcg wisconsin package及其变体。在一些实施方案中,本发明提供的两种多核苷酸或多肽实质相同,这意味着当使用序列比较算法或通过目视检查进行比较和对齐以获得最大对应时,它们具有至少70%、至少75%、至少80%、至少85%、至少90%,并且在一些实施方案中至少95%、96%、97%、98%、99%的核苷酸或氨基酸残基同一性。在一些实施方案中,在长度为至少约10个残基、至少约20个残基、至少约40-60个残基、至少约60-80个残基或之间的任何整数值的氨基酸序列的区域上存在同一性。在一些实施方案中,同一性存在于比60-80个残基更长的区域,例如至少约80-100个残基,并且在一些实施方案中,这些序列与被比较的序列在全长上基本相同,例如目标蛋白或抗体的编码区域。在一些实施方案中,在长度为至少约10个碱基、至少约20个碱基、至少约40-60个碱基、至少约60-80个碱基或之间的任何整数值的核苷酸序列的区域上存在同一性。在一些实施方案中,同一性存在于比60-80个碱基更长的区域上,例如至少约80-1000个碱基或更多,并且在一些实施方案中,这些序列与被比较的序列在全长上基本相同,例如编码目标蛋白的核苷酸序列。
95.术语“抗体”及其语法等同词是指免疫球蛋白分子,所述免疫球蛋白分子通过至少一个抗原结合位点识别并特异性结合靶标,例如蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或上述任何一种的组合,其中所述抗原结合位点通常在免疫球蛋白分子的可变区内。如本发明所用,该术语包括完整的多克隆抗体、完整的单克隆抗体、单结构域抗体(sdab,例如骆驼抗体、羊驼抗体)、单链fv(scfv)抗体、重链抗体(hcabs)、轻链抗体(lcabs)、多特异性抗体、双特异性抗体、单特异性抗体、单价抗体,以及任何其他包含抗原结合位点的修饰免疫球蛋白分子(例如,双可变区免疫球蛋白分子),只要抗体表现出所需的生物活性。所述抗体还包括但不限于小鼠抗体、骆驼抗体、嵌合抗体、人源化抗体和人源抗体。抗体可以为五种主要免疫球蛋白中的任何一种:iga、igd、ige、igg和igm或其亚类(同种型)(例如,igg1、igg2、igg3、igg4、iga1和iga2),基于它们的重链恒定区的同一性被分别称为α、δ、ε、γ和μ。除非另有明确说明,否则本发明使用的术语“抗体”包括完整抗体的“抗原结合片段”。本发明所使用的术语“抗原结合片段”是指完整抗体的一部分或片段,其是完整抗体的抗原决定可变区。抗原结合片段的实例包括但不限于fab、fab'、f(ab')2,fv、线性抗体、单链抗体分子(例如,scfv)、重链抗体(hcabs)、轻链抗体(lcabs)、二硫键连接的scfv(dsscfv)、双抗体、三抗体、四抗体、小抗体、双可变区抗体(dvd)、单可变区抗体(sdab,例如骆驼抗体、羊驼抗体)和重链抗体的单可变区(vhh)。
96.术语“载体”及其及其语法等同词是指用于携带遗传物质(例如,多核苷酸序列)的载体,所述遗传物质可以被引入宿主细胞,在宿主细胞中可以被复制和/或表达。可应用的载体包括,例如,表达载体、质粒、噬菌体载体、病毒载体、附加体和人工染色体,其可包括可操作用于稳定整合到宿主细胞染色体中的选择序列或标记。此外,所述载体可以包括一个或多个可选择的标记基因和适当的表达控制序列。所述可以包括的可选择的标记基因能够,例如,提供对抗生素或毒素的耐药性、补充营养缺陷症、或提供培养基中不存在的关键营养物质。所述表达控制序列可以包括本领域公知的组成型和诱导型启动子、转录增强子、转录终止子等。当两个或多个多核苷酸要共表达时,两个多核苷酸都可以插入,例如在单个
表达载体中或在单独的表达载体中。对于单载体表达,编码的多核苷酸可以操作地连接到一个共同的表达控制序列上,也可以连接到不同的表达控制序列上,如一个诱导启动子和一个组成型启动子。宿主细胞中多核苷酸的引入可以使用本领域公知的方法来确认。本领域技术人员应当理解的是,多核苷酸表达足够的量可以产生所需的产物(例如,本发明所述的融合蛋白),并且进一步应当理解的是,可以使用本领域公知的方法优化表达水平以获得足够的表达。
97.术语“可操作连接”及其语法等同词是指调控序列(如启动子和/或增强子)与第二核酸序列之间的功能连接,其中调控序列指导第二核酸序列的转录;或者在同一阅读框中待共表达的两个核酸序列之间的连接。例如,当第一核酸序列与第二核酸序列处于功能关系时,第一核酸序列与第二核酸序列可操作连接。例如,如果启动子影响编码序列的转录或表达,则启动子与编码序列可操作连接。通常,可操作连接的dna序列是连续的,并且在需要连接两个蛋白质编码区的情况下,处于同一阅读框中。
98.术语“外源性”及其语法等同词是指提及的分子被引入到宿主细胞中。例如,可以通过将编码核酸引入到宿主遗传物质(例如,整合到宿主染色体中)或非染色体遗传物质(例如,质粒)中以引入该分子。当涉及编码核酸的表达时,该术语是指将编码核酸以可表达形式引入到细胞中。
99.术语“内源性”及其语法等同词是指提及的分子天然存在于宿主细胞中。类似地,当涉及编码核酸的表达时,该术语是指细胞中天然包含的编码核酸的表达。
100.术语“基因工程”或其语法等同词,当用于指细胞时,意指细胞遗传物质的改变,而这种改变通常在自然发生的细胞中是不存在的。遗传改变包括,例如,引入可表达核酸的修饰,核酸的其他添加、突变/改变、缺失和/或其他功能破坏。这种修饰可以在例如基因的编码区及其功能片段中进行。另外的修饰可以在例如非编码调节区域中进行,其中所述修饰改变基因的表达。
101.术语“转导”、“转染”及其语法等同词是指将外源性多核苷酸引入宿主细胞的过程。“转染”或“转导”的细胞是指已转移、转导或转染外源性多核苷酸的细胞。所述细胞包括初始受体细胞及其子代。
102.与基因相关的术语“灭活”、“破坏”及其语法等同词是指使编码的基因产物失活或减弱的基因改变。基因改变可以是,例如,整个基因的缺失,转录或翻译所需的调控序列的缺失,产生截短基因产物的基因的部分的缺失,或者是使编码的基因产物灭活或减弱的各种突变策略中的任何一种。基因破坏还包含无效突变,指的是基因或含有基因的区域内发生突变,导致该基因不能转录成rna和/或翻译成功能性基因产物。此类无效突变可以由多种类型的突变产生,包含例如灭活点突变、基因部分缺失、整个基因缺失或染色体片段缺失。
103.术语“编码”及其语法等同词是指多核苷酸或核酸中特定核苷酸序列的固有性质,所述多核苷酸或核酸如基因、cdna或mrna,其作为模板,用于在生物过程中合成具有特定核苷酸序列(即rrna、trna和mrna)或特定氨基酸序列的其他聚合物和大分子,及由此产生的生物特性。因此,如果与该基因相对应的mrna的转录和翻译产生蛋白质,则该基因编码此蛋白质。除另有说明外,“编码氨基酸序列的核苷酸序列”包括相互简并的或编码同一氨基酸序列的所有核苷酸序列。编码蛋白质和rna的核苷酸序列可以包括内含子。
104.术语“分离的”多肽、肽、蛋白质、抗体、多核苷酸、载体、细胞或组合物是自然界中所没有的多肽、肽、蛋白质、抗体、多核苷酸、载体、细胞或组合物的形式。分离的多肽、多肽、蛋白质、抗体、多核苷酸、载体、细胞或组合物包括那些已经纯化到一定程度,不再以自然界中发现的形式存在的多肽、肽、蛋白质、抗体、多核苷酸、载体、细胞或组合物。在一些实施方案中,所分离的多肽、肽、蛋白质、抗体、多核苷酸、载体、细胞或组合物是基本纯化的。
105.术语“治疗”及其语法等同词与疾病或病症,或患有疾病或病症的受试者相关,其是指抑制、消除、减轻和/或改善症状、症状严重程度和/或与正在治疗的疾病或障碍相关的症状频率的行为。例如,当提及癌症或肿瘤时,术语“治疗”及其语法等同词是指降低癌症或肿瘤的严重程度,或延缓或减缓癌症或肿瘤进展的行为,包括(a)抑制癌症或肿瘤的生长或阻止其发展,(b)导致癌症或肿瘤消退,或(c)延缓、改善或最小化与癌症或肿瘤存在相关的一种或多种症状。
106.术语“给药”、“施用”及其语法等同词是指通过本发明中描述的方法或本领域中的其他已知方法向受试者身体递送或导致递送治疗剂或药物组合物的行为。所述治疗剂可以为化合物、多肽、细胞或细胞群。给药治疗剂或药物组合物包含将一种治疗或药物组合物开处方递送至受试者体内。给药的典型形式包括口服剂型,如片剂、胶囊、糖浆、混悬剂;可注射剂型,如静脉注射(iv)、肌内注射(im)或腹膜内注射(ip);透皮剂型,包括乳膏、凝胶、粉末或贴剂;口腔剂型;吸入粉末、喷雾剂、混悬剂,和直肠栓剂。
107.术语“有效量”、“治疗有效量”和它们的语法等同物是指给受试者单独或作为药物组合物的一部分、以单剂量或作为一系列剂量的一部分给药,能够在给药时对疾病、障碍或病症的任何症状、方面或特征产生任何可检测的积极影响的给药量。治疗有效量可通过测定相关生理效应来确定。所需的确切量因受试者而异,取决于受试者的年龄、体重和一般情况、正在治疗的症状的严重程度、临床医生的判断等。在任何个体情况下,适当的“有效量”可以由本领域普通技术人员使用常规实验来确定。
108.术语“药学上可接受的载体”是指适合与活性药物一起对个体给药的材料,不会引起任何不良生物学效应或以有害方式与药物组合物的任何其他组分相互作用。
109.术语“受试者”是指任何动物(例如,哺乳动物),包括但不限于人类、非人灵长类动物、犬科动物、猫科动物、啮齿动物等,其是待接受特定治疗的动物。受试者可以为人。受试者可以为患有特定疾病或病症的患者。受试者也可以是移植物的受体。
110.范围:在整个发明中,本发明的各个方面可以范围形式呈现。应当理解的是,范围形式的描述仅仅是为了方便和简洁,并且不应当被解释为对本发明范围的不灵活的限制。因此,范围的描述应该被认为已经具体地公开了所有可能的子范围以及该范围内的单个数值。例如,描述从1到6的范围应被认为已经公开了子范围,例如从1到3、1到4、1到5、2到4、2到6、3到6等,以及该范围内的单个数字,例如,1、2、2.7、3、4、5、5.3和6。无论范围的宽度如何,都适用于此。
111.本发明参照genbank编号、gi编号和/或seq id no描述了示例性基因和多肽。应当理解的是,本领域技术人员可以通过参考序列来源容易地识别同源序列,所述序列来源包括但不限于genbank(ncbi.nlm.nih.gov/genbank/)和embl(embl.org/)。
112.6.2融合蛋白
113.研究发现,当在宿主细胞中表达时,包括通过连接子与β2m肽共价连接的呈递肽的
融合蛋白可以与内源性mhc重链在细胞表面上形成复合物,其中所述复合物可以结合免疫细胞的抑制性受体以抑制免疫细胞。例如,具有与hla-e限制性呈递肽共价连接的人β2m的融合蛋白可以在t细胞中表达,该融合蛋白可以与内源性hla-e重链在t细胞表面上形成hla-e复合物。当将基因工程t细胞作为同种异体移植物施用于受体时,t细胞表面上的hla-e复合物然后可以被受体的免疫细胞(例如,nk细胞)识别,从而抑制免疫细胞并保护t细胞免受这些免疫细胞的潜在同种异体免疫应答(例如,nk细胞介导的细胞溶解)。
114.因此,本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白具有少于500个氨基酸。在一些实施方案中,融合蛋白具有少于400个氨基酸。在一些实施方案中,融合蛋白具有少于300个氨基酸。在一些实施方案中,融合蛋白具有少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约200个氨基酸。在一些实施方案中,融合蛋白具有约120个氨基酸到约180个氨基酸。
115.在一些实施方案中,融合蛋白具有约120个氨基酸到约160个氨基酸。在一些实施方案中,融合蛋白具有约140个氨基酸到约160个氨基酸。在一些实施方案中,融合蛋白缺乏mhc重链。在一些实施方案中,融合蛋白缺乏i类mhc重链。在一些实施方案中,融合蛋白缺乏mhc样重链。在一些实施方案中,融合蛋白缺乏hla-a重链。在一些实施方案中,融合蛋白缺乏hla-b重链。在一些实施方案中,融合蛋白缺乏hla-c重链。在一些实施方案中,融合蛋白缺乏hla-e重链。在一些实施方案中,融合蛋白缺乏hla-f重链。在一些实施方案中,融合蛋白缺乏hla-g重链。在一些实施方案中,融合蛋白缺乏cd1重链。在一些实施方案中,融合蛋白缺乏mr1重链。在一些实施方案中,融合蛋白缺乏fcrn重链。在一些实施方案中,融合蛋白缺乏ul18。
116.本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞;并且本发明提供了融合蛋白,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合t细胞的抑制性受体以抑制t细胞。在一些实施方案中,免疫细胞是nk细胞;并且本发明提供了融合蛋白,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合nk细胞的抑制性受体以抑制nk细胞。
117.在一些实施方案中,免疫细胞的抑制性受体是nkg2a。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的nkg2a受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人nkg2a可以具有与如下提供的序列genbank no.aal65234.1(登录号:aal65234.1,gi:18182682;见下文)相对应的氨基酸序列。
118.1 mdnqgviysd lnlppnpkrq qrkpkgnkss ilateqeity aelnlqkasq dfqgndktyh
119.61 ckdlpsapek livgilgiic lilmasvvti vvipstliqr hnnsslntrt qkarhcghcp
120.121 eewitysnsc yyigkerrtw eesllactsk nssllsidne eemkflsiis psswigvfrn
121.181 sshhpwvtmn glafkheikd sdnaelncav lqvnrlksaq cgssiiyhck hkl(seq id no:82)
122.在一些实施方案中,免疫细胞的抑制性受体是kir受体。所述抑制性kir受体可以选自由kir2dl1、kir2dl2、kir2dl3、kir2dl4、kir2dl5、kir3dl1、kir3dl2和kir3dl3组成的群组。
123.在一些实施方案中,免疫细胞的抑制性受体是kir2dl1。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir2dl1受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir2dl1可以具有与如下提供的序列genbank no.spc71652.1(登录号:spc71652.1,gi:1373834531;见下文)相对应的氨基酸序列。
[0124][0125]
在一些实施方案中,免疫细胞的抑制性受体是kir2dl2。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir2dl2受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir2dl2可以具有如下提供的序列genbank no.aci49717.1(登录号:aci49717.1,gi:209512829;见下文)相对应的氨基酸序列。
[0126][0127]
在一些实施方案中,免疫细胞的抑制性受体是kir2dl3。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir2dl3受体以抑制免疫细胞。在一些实施方案
中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir2dl3可以具有如下提供的序列genbank no.adn34702.1(登录号:adn34702.1,gi:307141824;见下文)相对应的氨基酸序列。
[0128][0129]
在一些实施方案中,免疫细胞的抑制性受体是kir2dl4。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir2dl4受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir2dl4可以具有如下提供的序列genbank no.abw73959.1(登录号:abw73959.1,gi:158551989;见下文)相对应的氨基酸序列。
[0130][0131][0132]
在一些实施方案中,免疫细胞的抑制性受体是kir2dl5。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir2dl5受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir2dl5可以具有与如下提供的序列genbank no.sho29775.1(登录号:sho29775.1,gi:1313716695;见下文)相对应的氨基酸序列。
[0133][0134]
在一些实施方案中,免疫细胞的抑制性受体是kir3dl1。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir3dl1受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir3dl1可以具有与如下提供的序列genbank no.adm64608.1(登录号:adm64608.1,gi:305690575;见下文)相对应的氨基酸序列。
[0135][0136][0137]
在一些实施方案中,免疫细胞的抑制性受体是kir3dl2。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir3dl2受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir3dl2可以具有与如下提供的序列genbank no.cux91181.1(登录号:cux91181.1,gi:998428963;见下文)相对应的氨基酸序列。
[0138][0139]
在一些实施方案中,免疫细胞的抑制性受体是kir3dl3。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的kir3dl3受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人kir3dl3可以具有与如下提供的序列genbank no.sho29793.1(登录号:sho29793.1,gi:1313716772;见下文)相对应的氨基酸序列。
[0140][0141]
在一些实施方案中,免疫细胞的抑制性受体是白细胞免疫球蛋白样受体1“lir1”。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的lir1受体以抑制免疫细胞。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是nk细胞。人lir1可以具有与如下提供的序列genbank no.aag08984.1(登录号:aag08984.1,gi:9954210;见下文)相对应的氨基酸序列。
[0142][0143][0144]
本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,mhc重链是经典i类mhc重链、非经典i类mhc重链或mhc样重链。在一些实施方案中,本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合经典i类mhc重链形成mhc复合物,该mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。经典i类mhc重链可以选自由hla-a重链、hla-b重链和hla-c重链组成的群组。
[0145]
在一些实施方案中,经典i类mhc重链是hla-a重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的hla-a限制性呈递肽,其中,该融合蛋白结合hla-a重链形成hla-a复合物,该hla-a复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-a重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-a重链具有高度多态性。例如,人hla-a重链的一个等位基因形式具有与序列genbank no.ba b63400i(登录号:bab63400i,gl:15277272)相对应的氨基酸序列。
[0146]
在一些实施方案中,经典i类mhc重链是hla-b重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的hla-b限制性呈递肽,其中,该融合蛋白结合hla-b重链形成hla-b复合物,该hla-b复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-b重链。在一些实施方案中,融合蛋白具有少于500
个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-b重链具有高度多态性。例如,人hla-b重链的一个等位基因形式具有与序列genbank no.aaa59682.1(登录号:aaa59682.1,gi:403145)相对应的氨基酸序列。
[0147]
在一些实施方案中,经典i类mhc重链是hla-c重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的hla-c限制性呈递肽,其中,该融合蛋白结合hla-c重链形成hla-c复合物,该hla-c复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-c重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-c重链具有高度多态性。例如,人hla-c重链的一个等位基因形式具有与序列genbank no.bab63310.1(登录号:bab63310.1,gi:15277217)相对应的氨基酸序列。
[0148]
在一些实施方案中,本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合非经典i类mhc重链以形成mhc复合物,该mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。非经典i类mhc重链可以选自由hla-e重链、hla-f重链和hla-g重链组成的群组。
[0149]
在一些实施方案中,非经典i类mhc重链是hla-e重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽,其中,该融合蛋白结合hla-e重链形成hla-e复合物,该hla-e复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-e重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-e重链具有多态性。例如,人hla-e重链的一个等位基因形式具有与序列genbank no.arb08449.1(登录号:arb08449.1,gi:1168024009)相对应的氨基酸序列。
[0150]
在一些实施方案中,非经典i类mhc重链是hla-f重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的hla-f限制性呈递肽,其中,该融合蛋白结合hla-f重链形成hla-f复合物,该hla-f复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-f重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-f重链具有多态性。例如,人hla-f重链的一个等位基因形式具有与序列genbank no.bab63337.1(登录号:bab63337.1,gi:15277244)相对应的氨基酸序列。
[0151]
在一些实施方案中,非经典i类mhc重链是hla-g重链。本发明提供了融合蛋白,该
融合蛋白包括通过连接子与β2m肽共价连接的hla-g限制性呈递肽,其中,该融合蛋白结合hla-g重链形成hla-g复合物,该hla-g复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有hla-g重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人hla-g重链具有高度多态性。例如,人hla-g重链的一个等位基因形式具有与序列genbank no.bab63336.1(登录号:bab63336.1,gi:15277243)相对应的氨基酸序列。
[0152]
在一些实施方案中,本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该融合蛋白结合mhc样重链形成mhc样复合物,该mhc样复合物结合免疫细胞的抑制性受体以抑制免疫细胞。mhc样复合物可以选自由cd1、mr1、fcrn和ul18组成的群组。
[0153]
在一些实施方案中,mhc样重链是cd1重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的cd1限制性呈递分子,其中,该融合蛋白结合cd1重链形成cd1复合物,该cd1复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有cd1重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。在一些实施方案中,mhc样重链包含cd1a重链、cd1b重链、cd1c重链、cd1d重链和cd1e重链。人cd1a重链可以与ncbi参考序列:np_001754.2(登录号:np_001754.2,gi:110618224)相对应的氨基酸序列。人cd1b重链可以具有与ncbi参考序列:xp_011508421.1(登录号:xp_011508421.1,gi:767910806)相对应的氨基酸序列。人cd1c重链可以具有与ncbi参考序列:xp_005245636.1(登录号:xp_005245636.1,gi:530365569)相对应的氨基酸序列。人cd1d重链可以具有与ncbi参考序列:np_001358692.1(登录号:np_001358692.1,gi:1707918971的氨基酸序列;前体)相对应的氨基酸序列。人cd1e重链可以具有与序列genbank no.aai31694.1(登录号:aai31694.1,gi:124297103)相对应的氨基酸序列。
[0154]
在一些实施方案中,mhc样重链是mr1重链。人mr1重链可以具有与序列genbank no.aah12485.1(登录号:aah12485.1)相对应的氨基酸序列。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的mr1限制性呈递分子,其中,该融合蛋白结合mr1重链形成mr1复合物,该mr1复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有mr1重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人mr1重链可以具有与具有与序列genbank no.cab77667.1(登录号:cab77667.1,gi:7271191))相对应的氨基酸序列。
[0155]
在一些实施方案中,mhc样重链是fcrn重链。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的fcrn限制性呈递分子,其中,该融合蛋白结合fcrn重链
形成fcrn复合物,该fcrn复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有fcrn重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人fcrn重链可以具有与序列uniprotkb/swiss-prot:p55899.1(登录号:p55899.1;gi:2497331))相对应的氨基酸序列。
[0156]
在一些实施方案中,mhc样重链是ul18。本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的ul18限制性呈递分子,其中,该融合蛋白结合ul18重链形成ul18复合物,该ul18复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,融合蛋白不具有ul18多肽。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。人ul18可以具有与序列genbank no.ajy57863.1(登录号:ajy57863.1,gi:777959438)相对应的氨基酸序列。
[0157]
本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽。呈递肽可以源自病毒、原核生物、真核生物或哺乳动物。在一些实施方案中,呈递肽源自病毒。在一些实施方案中,呈递肽源自原核生物。在一些实施方案中,呈递肽源自真核生物。在一些实施方案中,呈递肽源自哺乳动物。在一些实施方案中,呈递肽源自人。呈递肽可以具有5-30个氨基酸、5-25个氨基酸、5-20个氨基酸、7-20个氨基酸、7-18个氨基酸、7-15个氨基酸、8-12个氨基酸或8-10个氨基酸。在一些实施方案中,呈递肽具有5-30个氨基酸。在一些实施方案中,呈递肽具有5-25个氨基酸。在一些实施方案中,呈递肽具有5-20个氨基酸。在一些实施方案中,呈递肽具有7-20个氨基酸。在一些实施方案中,呈递肽具有7-18个氨基酸。在一些实施方案中,呈递肽具有7-15个氨基酸。在一些实施方案中,呈递肽具有8-12个氨基酸。在一些实施方案中,呈递肽具有8-10个氨基酸。
[0158]
呈递肽可以是i类mhc分子的信号肽或其片段。在一些实施方案中,呈递肽是i类mhc分子的信号肽的片段。在一些实施方案中,本发明提供了融合蛋白,该融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,该呈递肽是i类mhc分子的信号肽或其片段。在一些实施方案中,融合蛋白不具有mhc重链。在一些实施方案中,融合蛋白不具有hla-e重链。在一些实施方案中,融合蛋白不具有hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链或hla-g重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。
[0159]
i类mhc分子的信号肽是存在于i类mhc重链的n端处的肽,其将新合成的i类mhc重链蛋白引导并定位到内质网,使得成熟重链分子,β2m和呈递肽在细胞表面上形成复合物。上述多肽在成熟蛋白中被切剪切。i类mhc分子的信号肽通常具有13-80个氨基酸。i类mhc分子的一些信号肽具有20-50个氨基酸。
[0160]
在一些实施方案中,呈递肽是i类mhc分子的信号肽或其片段。所述i类mhc分子可以选自由hla-a1、hla-a2、hla-a*3401、hla-a*80、hla-b7、hla-b*13、hla-b15、hla-cw3、hla-cw*2、hla-cw*0809、hla-cw7、hla-cw*1701、hla-g和hla-f组成的群组。在一些实施方案中,呈递肽是hla-a1的信号肽或其片段。在一些实施方案中,呈递肽是hla-a2的信号肽或其片段。在一些实施方案中,呈递肽是hla-a*3401的信号肽或其片段。在一些实施方案中,呈递肽是hla-a*80的信号肽或其片段。在一些实施方案中,呈递肽是hla-b7的信号肽或其片段。在一些实施方案中,呈递肽是hla-b*13的信号肽或其片段。在一些实施方案中,呈递肽是hla-b15信号肽或其片段。在一些实施方案中,呈递肽是hla-cw3的信号肽或其片段。在一些实施方案中,呈递肽是hla-cw*2的信号肽或其片段。在一些实施方案中,呈递肽是hla-cw*0809的信号肽或其片段。在一些实施方案中,呈递肽是hla-cw7的信号肽或其片段。在一些实施方案中,呈递肽是hla-cw*1701的信号肽或其片段。在一些实施方案中,呈递肽是hla-g的信号肽或其片段。在一些实施方案中,呈递肽是hla-f的信号肽或其片段。在一些实施方案中,这些示例性的i类mhc分子信号肽或其片段是hla-e限制性呈递肽。递呈肽是i类mhc分子的信号肽或其片段,可有5-30个氨基酸。在一些实施方案中,递呈肽是i类mhc分子的信号肽或其片段,可有5-25个氨基酸、5-20个氨基酸、7-18个氨基酸、7-15个氨基酸、8-12个氨基酸或8-10个氨基酸。在一些实施方案中,递呈肽是i类mhc分子的信号肽或其片段,可有8-10个氨基酸。
[0161]
在一些实施方案中,呈递多肽是i类mhc分子的信号肽或其片段,并且具有以下氨基酸序列:x1x2x3x4x5x6x7x8l;其中,x1是v或i;x2是t、a、m或l;x3是a、p、k或n;x4是p、l或t;x5是r、q或k;x6是t或a;x7是l、i、v或p;x8是v、l、i、f或t(seq id no:115)。
[0162]
在一些实施方案中,呈递肽是i类mhc分子的信号肽或其片段,并且呈递肽的氨基酸序列选自由(1)yllprrgprl(seq id no:21);(2)alalvrmli(seq id no:22);(3)aisprtlna(seq id no:23);(4)qmrpvsrvl(seq id no:24);(5)sqqpylqlq(seq id no:25);(6)vtaprtlll(seq id no:26);(7)vtaprtvll(seq id no:27);(8)vtaprtlvl(seq id no:28);(9)vmapqalll(seq id no:29);(10)vmapralll(seq id no:30);(11)vmaprtltl(seq id no:31);(12)vmaprtlfl(seq id no:32);(13)vmaprtlvl(seq id no:33);(14)vmaprtlil(seq id no:34);(15)imaprtlvl(seq id no:35);(16)vmaprtlll(seq id no:36);(17)vmpprtlll(seq id no:37);(18)vmaprtvll(seq id no:38);(19)vmaprslll(seq id no:39);(20)vmaprslil(seq id no:40);(21)vmtprtlvl(seq id no:41);(22)vmaprilil(seq id no:42);(23)amaprtlil(seq id no:43);(24)viaprtlvl(seq id no:44);(25)vmapqslll(seq id no:45);(26)vmaprtfvl(seq id no:46);(27)vmtprtlil(seq id no:47);(28)vtaprtlil(seq id no:48);(29)vmapwtlll(seq id no:49);(30)vmvprslil(seq id no:50);(31)amaprtlvl(seq id no:51);(32)viaprtlil(seq id no:52);(33)viaprtlll(seq id no:53);(34)vlaprtlil(seq id no:54);(35)vmalrtlil(seq id no:55);(36)vmaprglil(seq id no:56);(37)vmaprnlil(seqid no:57);(38)vmaprtlfv(seq id no:58);(39)vmaprtllm(seq id no:59);(40)vmaprtlvm(seq id no:60);(41)vmaprtsll(seq id no:61);(42)vmaprtsvl(seq id no:62);(43)vmapwtlil(seq id no:63);(44)vmapwtlvl(seq id no:64);(45)vmdprtlll(seq id no:65);(46)vmgprtlil(seq id no:66);(47)vmgprtlll(seq id no:67);(48)vmvpqtlil(seq id no:
68);(49)vmvprtlll(seq id no:69);(50)vvaprtlil(seq id no:70);(51)vvaprtlll(seq id no:71);(52)vmvprtlil(seq id no:72);以及(53)vmatrtlll(seq id no:73)组成的群组。这些例示性的呈递肽是hla-e限制性呈递肽。
[0163]
在一些实施方案中,呈递肽的氨基酸序列是(1)yllprrgprl(seq id no:21)。在一些实施方案中,呈递肽的氨基酸序列是(2)alalvrmli(seq id no:22)。在一些实施方案中,呈递肽的氨基酸序列是(3)aisprtlna(seq id no:23)。在一些实施方案中,呈递肽的氨基酸序列是(4)qmrpvsrvl(seq id no:24)。在一些实施方案中,呈递肽的氨基酸序列是(5)sqqpylqlq(seq id no:25)。在一些实施方案中,呈递肽的氨基酸序列是(6)vtaprtlll(seq id no:26)。在一些实施方案中,呈递肽的氨基酸序列是(7)vtaprtvll(seq id no:27)。在一些实施方案中,呈递肽的氨基酸序列是(8)vtaprtlvl(seq id no:28)。在一些实施方案中,呈递肽的氨基酸序列是(9)vmapqalll(seq id no:29)。在一些实施方案中,呈递肽的氨基酸序列是(10)vmapralll(seq id no:30)。在一些实施方案中,呈递肽的氨基酸序列是(11)vmaprtltl(seq id no:31)。在一些实施方案中,呈递肽的氨基酸序列是(12)vmaprtlfl(seq id no:32)。在一些实施方案中,呈递肽的氨基酸序列是(13)vmaprtlvl(seq id no:33)。在一些实施方案中,呈递肽的氨基酸序列是(14)vmaprtlil(seq id no:34)。在一些实施方案中,呈递肽的氨基酸序列是(15)imaprtlvl(seq id no:35)。在一些实施方案中,呈递肽的氨基酸序列是(16)vmaprtlll(seq id no:36)。在一些实施方案中,呈递肽的氨基酸序列是(17)vmpprtlll(seq id no:37)。在一些实施方案中,呈递肽的氨基酸序列是(18)vmaprtvll(seq id no:38)。在一些实施方案中,呈递肽的氨基酸序列是(19)vmaprslll(seq id no:39)。在一些实施方案中,呈递肽的氨基酸序列是(20)vmaprslil(seq id no:40)。在一些实施方案中,呈递肽的氨基酸序列是(21)vmtprtlvl(seq id no:41)。在一些实施方案中,呈递肽的氨基酸序列是(22)vmaprilil(seq id no:42)。在一些实施方案中,呈递肽的氨基酸序列是(23)amaprtlil(seq id no:43)。在一些实施方案中,呈递肽的氨基酸序列是(24)viaprtlvl(seq id no:44)。在一些实施方案中,呈递肽的氨基酸序列是(25)vmapqslll(seq id no:45)。在一些实施方案中,呈递肽的氨基酸序列是(26)vmaprtfvl(seq id no:46)。在一些实施方案中,呈递肽的氨基酸序列是(27)vmtprtlil(seq id no:47)。在一些实施方案中,呈递肽的氨基酸序列是(28)vtaprtlil(seq id no:48)。在一些实施方案中,呈递肽的氨基酸序列是(29)vmapwtlll(seq id no:49)。在一些实施方案中,呈递肽的氨基酸序列是(30)vmvprslil(seq id no:50)。在一些实施方案中,呈递肽的氨基酸序列是(31)amaprtlvl(seq id no:51)。在一些实施方案中,呈递肽的氨基酸序列是(32)viaprtlil(seq id no:52)。在一些实施方案中,呈递肽的氨基酸序列是(33)viaprtlll(seq id no:53)。在一些实施方案中,呈递肽的氨基酸序列是(34)vlaprtlil(seq id no:54)。在一些实施方案中,呈递肽的氨基酸序列是(35)vmalrtlil(seq id no:55)。在一些实施方案中,呈递肽的氨基酸序列是(36)vmaprglil(seq id no:56)。在一些实施方案中,呈递肽的氨基酸序列是(37)vmaprnlil(seq id no:57)。在一些实施方案中,呈递肽的氨基酸序列是(38)vmaprtlfv(seq id no:58)。在一些实施方案中,呈递肽的氨基酸序列是(39)vmaprtllm(seq id no:59)。在一些实施方案中,呈递肽的氨基酸序列是(40)vmaprtlvm(seq id no:60)。在一些实施方案中,呈递肽的氨基酸序列是(41)vmaprtsll(seq id no:61)。在一些实施方案中,呈递肽的氨基酸序列是(42)vmaprtsvl(seq id no:
62)。在一些实施方案中,呈递肽的氨基酸序列是(43)vmapwtlil(seq id no:63)。在一些实施方案中,呈递肽的氨基酸序列是(44)vmapwtlvl(seq id no:64)。在一些实施方案中,呈递肽的氨基酸序列是(45)vmdprtlll(seq id no:65)。在一些实施方案中,呈递肽的氨基酸序列是(46)vmgprtlil(seq id no:66)。在一些实施方案中,呈递肽的氨基酸序列是(47)vmgprtlll(seq id no:67)。在一些实施方案中,呈递肽的氨基酸序列是(48)vmvpqtlil(seq id no:68)。在一些实施方案中,呈递肽的氨基酸序列是(49)vmvprtlll(seq id no:69)。在一些实施方案中,呈递肽的氨基酸序列是(50)vvaprtlil(seq id no:70)。在一些实施方案中,呈递肽的氨基酸序列是(51)vvaprtlll(seq id no:71)。在一些实施方案中,呈递肽的氨基酸序列是(52)vmvprtlil(seq id no:72)。在一些实施方案中,呈递肽的氨基酸序列是(53)vmatrtlll(seq id no:73)。
[0164]
本领域还描述了另外的hla-e限制性呈递肽。参见,例如,united states patent application 20190314445;celik et al.,immunogenetics 2016.68:29-41;hannoun et al.immunology letters 2018.202:65-72;et al.cell rep 2018.14(8):1967-1976;et al.front immunol 2018.9:2410。所有这些参考文献均通过引用整体并入本发明。类似地,限制于hla-a、hla-b、hla-c、hla-f或hla-g的呈递肽也是本领域众所周知的。参见,例如,gfeller et al.front immunol 2018.9:1716;luo et al.bioinform biol insights 2015.9(suppl 3):21-9;you et al.pattern recognition in bioinformatics 2007.pp 337-348.lecture notes in computer science,vol 4774.springer,berlin,heidelberg;purcell et al.nat protoc 2019.14(6):1687-1707;rock et al.trends immunol 2016.37(11):724-737;celik et al.immunogenetics 2018.70(8):485
–
494;di marco et al.j immunol 2017.199(8):2639-2651;dulberger et al.immunity 2017.46(6):1018
–
1029.e7;ho et al.immunogenetics 2019.71(5-6):353-360;sim et al.immunity 2017.46(6):972-974;rammensee et al.annu rev immunol 1993.11:213-44;schellens et al.plos one 2015.10(9):e0136417。所有这些参考文献均通过引用将其全部并入本发明。
[0165]
在一些实施方案中,呈递多肽也可以源自病毒蛋白,如cmv、ebv、hiv等。在一些实施方案中,呈递肽是cmv的片段。在一些实施方案中,呈递肽是ebv的片段。在一些实施方案中,呈递肽是hiv的片段。
[0166]
本发明提供的融合蛋白具有通过连接子与β2m肽共价连接的呈递肽。在一些实施方案中,本发明提供的融合蛋白从n端到c端具有呈递肽、连接子和β2m肽。在一些实施方案中,本发明提供的融合蛋白从n端到c端具有β2m肽、连接子和呈递肽。在一些实施方案中,本发明所公开的融合蛋白在其n端进一步包括膜定位信号肽,该信号肽引导融合蛋白定位到细胞膜上,随后从融合蛋白上剪切下来。膜定位信号肽的长度可以介于约20-80个氨基酸之间。示例性的膜定位信号肽可以具有seq id no:3或seq id no:4的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白从n端到c端由呈递肽、连接子和β2m肽组成。在一些实施方案中,本发明提供的融合蛋白从n端到c端由β2m肽、连接子和呈递肽组成。
[0167]
本发明提供的融合蛋白具有通过连接子与β2m肽共价连接的呈递肽。连接子连接融合蛋白的呈递肽和β2m肽,并提供足够的灵活性,使得融合蛋白可以与mhc重链形成稳定的复合物。本发明提供的连接子可以具有约5到50个氨基酸,并且包含以下五种氨基酸
(gly、ala、pro、val和leu)中的至少一种,以及以下八种氨基酸(ser、thr、glu、lys、asn、gln、asp和arg)中的至少一种。在一些实施方案中,本发明提供的连接子具有5到30个氨基酸。
[0168]
在一些实施方案中,连接子的氨基酸序列是(eaaak)n,n=1、2、3、4或5(seq id no:109)。在一些实施方案中,连接子的氨基酸序列是(eaaak)n,n=3、4或5(seq id no:110)。在一些实施方案中,连接子的氨基酸序列是(ggggs)n,n=1、2、3、4或5(seq id no:111)。在一些实施方案中,连接子的氨基酸序列是(ggggs)n,n=3、4或5(seq id no:112)。
[0169]
在一些实施方案中,连接子的氨基酸序列是(g)ns,n=1、2、3、4或5(seq id no:113)。在一些实施方案中,连接子的氨基酸序列是(g)ns的m系列组合,n=1、2、3、4或5;并且m=1、2、3、4或5(seq id no:122)。例如,连接子的氨基酸序列可以是(g4s)(g2s)(gs)(g3s),即ggggsggsgsgggs(seq id no:114)。
[0170]
在一些实施方案中,连接子的氨基酸序列是(ggggs)3或(g4s)3,即ggggsggggsggggs(seq id no:1)。在一些实施方案中,连接子的氨基酸序列是(g4s)4序列,即ggggsggggsggggsggggs(seq id no:2)。
[0171]
本发明提供的融合蛋白具有通过连接子与β2m肽共价连接的呈递肽。在一些实施方案中,β2m肽是野生型β2m蛋白。在一些实施方案中,β2m肽是野生型人β2m(seq id no:7)。在一些实施方案中,β2m肽是野生型β2m蛋白的功能性片段。在一些实施方案中,β2m肽是野生型β2m蛋白的功能性变体。在一些实施方案中,β2m肽是野生型人β2m的功能性片段。在一些实施方案中,β2m肽是野生型人β2m的功能性变体。在一些实施方案中,β2m肽是野生型β2m蛋白的功能性变体,其氨基酸序列与seq id no:7具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:7具有至少85%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:7具有至少90%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:7具有至少95%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:7具有至少98%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:7具有至少99%的同一性。在一些实施方案中,β2m肽的氨基酸序列是seq id no:7。
[0172]
在一些实施方案中,β2m肽是人β2m(seq id no:81)的成熟形式,并且本发明提供的融合蛋白具有通过连接子与成熟人β2m肽共价连接的呈递肽。在一些实施方案中,β2m肽是人β2m蛋白的成熟形式的功能性片段。在一些实施方案中,β2m肽是人β2m蛋白的成熟形式的功能性变体。在一些实施方案中,β2m肽是人β2m蛋白的成熟形式的功能性变体,其氨基酸序列与seq id no:81具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:81具有至少85%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:81具有至少90%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:81具有至少95%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:81具有至少98%的同一性。在一些实施方案中,β2m肽的氨基酸序列与seq id no:81具有至少99%的同一性。在一些实施方案中,β2m肽的氨基酸序列是seq id no:81。
[0173]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与选自由seq id nos:5和13-18组成的群组中的氨基酸序列具有至少85%、至少90%、至少95%、至少98%或
至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括选自由seq id nos:5和13-18组成的群组的氨基酸序列。在一些实施方案中,融合蛋白不具有mhc重链。在一些实施方案中,融合蛋白不具有hla-e重链。在一些实施方案中,融合蛋白不具有hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链或hla-g重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。在一些实施方案中,融合蛋白具有约120个氨基酸到约180个氨基酸。
[0174]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:5或seq id no:5的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:5或seq id no:5的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:5或seq id no:5的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:5或seq id no:5的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:5或seq id no:5的21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:5。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:5的21-143位氨基酸。
[0175]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:13或seq id no:13的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:13或seq id no:13的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:13或seq id no:13的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:13或seq id no:13的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:13或seq id no:13的21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:13。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:13的21-143位氨基酸。
[0176]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:14或seq id no:14的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:14或seq id no:14的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:14或seq id no:14的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:14或seq id no:14的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:14或seq id no:14的
21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:14。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:14的21-143位氨基酸。
[0177]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:15或seq id no:15的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:15或seq id no:15的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:15或seq id no:15的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:15或seq id no:15的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:15或seq id no:15的21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:15。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:15的21-143位氨基酸。
[0178]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:16或seq id no:16的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:16或seq id no:16的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:16或seq id no:16的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:16或seq id no:16的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:16或seq id no:16的21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:16。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:16的21-143位氨基酸。
[0179]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:17或seq id no:17的21-143位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:17或seq id no:17的21-143位氨基酸具有至少90%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:17或seq id no:17的21-143位氨基酸具有至少95%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:17或seq id no:17的21-143位氨基酸具有至少98%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:17或seq id no:17的21-143位氨基酸具有至少99%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:17。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括seq id no:17的21-143位氨基酸。
[0180]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:18或seq id no:18的21-144位氨基酸具有至少85%的同一性的氨基酸序列。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括与seq id no:18或seq id no:18的21-144位
id no:14的21-143位氨基酸具有至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:14组成。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:14的21-143位氨基酸组成。
[0185]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:15或seq id no:15的21-143位氨基酸具有至少85%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:15或seq id no:15的21-143位氨基酸具有至少90%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:15或seq id no:15的21-143位氨基酸具有至少95%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:15或seq id no:15的21-143位氨基酸具有至少98%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:15或seq id no:15的21-143位氨基酸具有至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:15组成。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:15的21-143位氨基酸组成。
[0186]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:16或seq id no:16的21-143位氨基酸具有至少85%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:16或seq id no:16的21-143位氨基酸具有至少90%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:16或seq id no:16的21-143位氨基酸具有至少95%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:16或seq id no:16的21-143位氨基酸具有至少98%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:16或seq id no:16的21-143位氨基酸具有至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:16组成。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:16的21-143位氨基酸组成。
[0187]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:17或seq id no:17的21-143位氨基酸具有至少85%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:17或seq id no:16的21-143位氨基酸具有至少90%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:17或seq id no:16的21-143位氨基酸具有至少95%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:17或seq id no:16的21-143位氨基酸具有至少98%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:17或seq id no:16的21-143位氨基酸具有至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:17组成。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:17的21-143位氨基酸组成。
[0188]
在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:18或seq id no:18的21-144位氨基酸具有至少85%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:18或seq id no:18的21-144位氨基酸具有至少90%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:18或seq id no:18的21-144位氨基酸具有至少95%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:18或seq id no:18的21-144位氨基酸具有至少98%的
同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列与seq id no:18或seq id no:18的21-144位氨基酸具有至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:18组成。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列由seq id no:18的21-144位氨基酸组成。
[0189]
本发明描述的融合蛋白可以通过本领域已知的任何方法制备,包括化学合成和重组表达技术。除非另有说明,本发明的实践采用了分子生物学、微生物学、遗传分析、重组dna、有机化学、生物化学、pcr、寡核苷酸合成和修饰、核酸杂交以及本技术领域内的相关常规技术。这些技术在本发明引用的参考文献中有所描述,并在文献中进行了充分解释。参见,例如,maniatis et al.(1982)molecular cloning:a laboratory manual,cold spring harbor laboratory press;sambrook et al.(1989),molecularcloning:a laboratory manual,second edition,cold spring harbor laboratory press;sambrook et al.(2001)molecular cloning:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,ny;ausubel et al.,current protocols in molecular biology,john wiley&sons(1987and annual updates);current protocols in immunology,john wiley&sons(1987and annual updates)gait(ed.)(1984)oligonucleotides synthesis:a practical approach,irl press;eckstein(ed.)(1991)oligonucleotides and analogues:a practical approach,irl press;birren et al.(eds.)(1999)genome analysis:a laboratory manual,cold spring harbor laboratory press;borrebaeck(ed.)(1995)antibody engineering,second edition,oxford university press;lo(ed.)(2006)antibody engineering:methods and protocols(methods in molecular biology);vol.248,humana press,inc;其中的每一项通过引用将其全部并入本发明。
[0190]
本发明描述的融合蛋白可以使用本领域已知的方法制备和分离。肽可以用化学方法全部或部分合成(参见,例如,caruthers(1980).nucleic acids res.symp.ser.215;horn(1980);and banga,a.k.,therapeutic peptides and proteins,formulation,processing and delivery systems(1995)technomic publishing co.,lancaster,pa)。肽的合成可以使用各种固相技术进行(参见,例如,roberge science 269:202(1995);merrifield,methods.enzymol.289:3(1997))并且可以实现自动合成,例如,按照制造商的说明使用abi 431a肽合成仪(perkin elmer)。肽也可以使用组合方法合成。人工合成的残基和多肽可以使用本领域已知的各种程序和方法合成(参见,例如,organic syntheses collective volumes,gilman,et al.(eds)john wiley&sons,inc.,ny)。修饰过的多肽可以通过化学修饰方法产生(参见,例如,belousov,nucleic acids res.25:3440(1997);frenkel,free radic.biol.med.19:373(1995);and blommers,biochemistry 33:7886(1994))。肽序列变异、衍生物、替换和修饰也可以使用寡核苷酸介导(定点)突变、丙氨酸扫描和基于pcr的诱变等方法进行。定点诱变(carter et al.,nucl.acids res.,13:4331(1986);zoller et al.,nucl.acids res.10:6487(1987))、盒式诱变(wells et al.,gene 34:315(1985))、限制性选择诱变(wells et al.,philos.trans.r.soc.london sera 317:415(1986))以及其他技术可以在克隆的dna上进行,以产生本发明的肽序列、变体、融合和嵌合体以及其变异体、衍生物、替换和修饰。
[0191]
在一些实施方案中,重组表达载体用于扩增和表达编码本发明描述的融合蛋白的核酸。例如,重组表达载体可以是可复制的dna构建体,其包括合成的或cdna衍生的dna片段,所述dna片段编码与源自哺乳动物、微生物、病毒或昆虫基因的合适转录和/或翻译调控元件可操作连接的融合蛋白。在一些实施方案中,使用病毒载体。当dna区域在功能上相互联系时,它们就可操作连接起来。例如,如果启动子控制序列的转录,则其与编码序列可操作连接;或者如果核糖体结合位点的位置允许翻译,则其与编码序列可操作连接。在一些实施方案中,拟用于酵母表达系统的结构元件包括先导序列,该先导序列可以使宿主细胞能够在细胞外分泌翻译蛋白。在一些实施方案中,在重组蛋白的表达没有先导或转运序列的情况下,多肽可以包括n-末端蛋氨酸残基。
[0192]
可以使用多种表达宿主/载体的组合。对真核宿主有用的表达载体包括,例如,包含来自sv40、牛乳头瘤病毒、腺病毒和巨细胞病毒的表达控制序列的载体。对细菌宿主有用的表达载体包括已知的细菌质粒,例如,来自大肠杆菌的质粒,包括pcr1、pbr322、pmb9及其衍生物,以及更广泛宿主范围的质粒,如m13和其他丝状单链dna噬菌体。
[0193]
在一些实施方案中,本发明的融合蛋白由一种或多种载体表达。适合表达融合蛋白的宿主细胞包含原核细胞、酵母细胞、昆虫细胞或在适当启动子控制下的高等真核细胞。用于细菌、真菌、酵母和哺乳动物细胞宿主的适当的克隆和表达载体以及蛋白质制备方法是本领域众所周知的。
[0194]
合适的哺乳动物宿主细胞系的例子包括但不限于cos-7(来源于猴肾)、l-929(来源于鼠成纤维细胞)、c127(来源于鼠乳腺肿瘤)、3t3(来源于鼠成纤维细胞)、cho(来源于中国仓鼠卵巢)、hela(来源于人宫颈癌)、bhk(来源于仓鼠肾成纤维细胞)、hek-293(来源于人胚肾)细胞系及其变体。哺乳动物表达载体可以包括非转录元件(例如,复制起点),与待表达基因连接的合适启动子和增强子,以及其他5'或3'侧翼的非转录序列和5'或3'非翻译序列(例如,必要的核糖体结合位点、多聚腺苷酸化位点、剪接供体和受体位点,以及转录终止序列)。重组蛋白在昆虫细胞培养系统(如杆状病毒)中的表达也为生产正确折叠和生物功能的蛋白提供了强有力的方法。用于在昆虫细胞中生产异源蛋白的杆状病毒系统是本领域技术人员所熟知的。
[0195]
6.3合成受体
[0196]
在一些实施方案中,本发明提供的融合蛋白可以与细胞中的合成受体共表达。在一些实施方案中,本发明提供的融合蛋白可以与合成受体结合。本发明所使用的术语“合成受体”是指经工程改造的细胞表面蛋白或蛋白复合物,其包括(1)可特异性结合靶分子的靶标结合结构域和(2)可激活工程改造的细胞中信号转导通路的功能结构域。靶标结合结构域包括胞外结构域。功能结构域包括胞内结构域。合成受体还包含跨膜序列。合成受体是蛋白复合物,其可以包括由外源性核酸表达的蛋白质,也可以包括至少一种外源性表达的蛋白质和至少一种内源性表达的蛋白质。在一些实施方案中,工程改造的细胞可以是免疫细胞,如t细胞、自然杀伤(nk)细胞、b细胞、巨噬细胞等,并且功能结构域可以直接或间接地激活免疫细胞。合成受体可以选自由嵌合抗原受体(“car”)、t细胞受体(“tcr”)、tcr受体融合构建体(“truc”)、t细胞抗原偶联物(“tac”)、抗体tcr受体(“abtcr”)和嵌合cd3ε受体组成的群组。在一些实施方案中,合成受体是car。在一些实施方案中,合成受体是tcr。在一些实施方案中,合成受体是truc。
[0197]
在一些实施方案中,合成受体是tac。在一些实施方案中,合成受体是abtcr。在一些实施方案中,合成受体是嵌合cd3受体。
[0198]
6.3.1靶标结合结构域
[0199]
本发明提供的合成受体包含靶标结合结构域。靶标结合结构域是可以结合靶分子的胞外结构域。在一些实施方案中,靶分子是靶组织上的抗原。在一些实施方案中,靶分子是病毒抗原。在一些实施方案中,靶分子是癌抗原。在一些实施方案中,本发明提供的合成受体的靶标结合结构域也可以是能被抗体(例如,双特异性或多特异性抗体)识别的表位,所述抗体可以结合靶组织上的靶分子,如癌抗原。
[0200]
此类抗原结合结构域通常源自于抗体。在一个实施方案中,抗原结合结构域可以是scfv或fab,或抗体的任何合适的抗原结合片段(参见sadelain et al.,cancer discov.3:388-398(2013))。在一些实施方案中,胞外抗原结合结构域是scfv。许多抗体或源自与癌抗原结合的抗体的抗原结合结构域是本领域已知的。或者,可以通过常规方法制备此类抗体或抗原结合结构域。制备抗体的方法是本领域众所周知的,包含制备单克隆抗体或筛选文库以获得抗原结合多肽(包含筛选人fabs文库)的方法(winter and harris,immunol.today 14:243-246(1993);ward et al.,nature 341:544-546(1989);harlow and lane,antibodies:a laboratory manual,cold spring harbor laboratory press(1988);hilyard ef al.,protein engineering:a practical approch(irl press 1992);borrabeck,antibody engineering,2nd ed.(oxford university press 1995);huse et al.,science 246:1275-1281(1989))。
[0201]
根据需要,源自抗体的抗原结合结构域可以是人的、人源化的、嵌合的、cdr移植的等。例如,如果小鼠单克隆抗体是生成抗原结合结构域的源抗体,则可以通过将小鼠抗体的cdrs移植到人框架上使此类抗体人源化(参见borrabeck,同上,1995),这可以有益于向人类受试者施用合成受体。在优选的实施方案中,抗原结合结构域是scfv。scfvs的生成是本领域众所周知的(参见,例如,huston,et al.,proc.nat.acad.sci.usa 85:5879-5883(1988);ahmad et al.,clin.dev.immunol.2012:id980250(2012);u.s.patent nos.5,091,513,5,132,405和4,956,778;和u.s.patent publication nos.20050196754和20050196754)。
[0202]
关于获得癌抗原结合活性,本领域技术人员可以使用任何众所周知的生成和筛选与所期望的抗原结合的抗体的方法以获得合适的癌抗原结合活性,如抗体,包含生成结合癌抗原的scfv,其在本发明所公开的合成受体中特别有用。另外,许多癌抗原抗体,特别是单克隆抗体,可商购获得并且还可以用作癌抗原结合活性(如scfv)的来源,以生成合成受体。
[0203]
在一些实施方案中,靶标结合结构域可以是抗体片段、其衍生物或模拟物,其中,这些片段、衍生物和模拟物对靶分子具有必要的结合亲和力。此类抗体片段或衍生物通常至少包含受试抗体的vh和v
l
结构域,以便保留受试抗体的结合特性。本发明所使用的抗体片段是指除完整抗体以外的分子,其包括抗体的一部分并且通常的抗原结合位点。抗体片段的示例包含但不限于fab、fab'、f(ab')2、fv、单链抗体分子(例如,scfv)、二硫键连接的scfv(dsscfv)、双抗体、三抗体、四抗体、微型抗体、双可变结构域抗体(dvd)、单可变结构域抗体(例如,骆驼抗体、羊驼抗体)、重链抗体的单可变结构域(vhh)、纳米抗体和由抗体片段
形成的多特异性抗体。在一些实施方案中,靶标结合结构域是fab。在一些实施方案中,靶标结合结构域是scfv。在一些实施方案中,靶标结合结构域包括单可变结构域抗体。
[0204]
在一些实施方案中,靶标结合结构域包括抗体模拟物。抗体模拟物可以是像抗体一样能特异性结合抗原的分子,但其在结构上与抗体无关。抗体模拟物通常是摩尔质量为约2到20kda内的人工肽。核酸和小分子有时也被认为是抗体模拟物。本领域已知的抗体模拟物包含adnectins、affibodies、affilins、affimers、affitins、alphabodies、anticalins、aptamers、avimers、双环肽、centyrin(j&j)、darpins、fynomers、knottins、kunitz结构域肽、monobodies和nanoclamp。
[0205]
在一些实施方案中,靶标结合结构域包括抗体样支架(例如,owens,nature biotechnology 35:602 603(2017);simeon and chen,protein cell 9(1):3-14(2018))。
[0206]
除了使用源自抗体的抗原结合结构域,合成受体的靶标结合结构域可以包括受体的配体或胞外配体结合结构域(参见,sadelain et al.,cancer discoy.3:388-398(2013);sharpe et al.,dis model mech.8:337-350(2015))。在这种情况下,受体的配体或胞外配体结合结构域为合成受体提供了将表达合成受体的细胞靶向对应受体或配体的能力。选择配体或胞外配体结合结构域,使得表达合成受体的细胞靶向癌细胞或肿瘤(参见,sadelain et al.,cancer discov.3:388-398(2013);sharpe et al.,dis.model mech.8:337-350(2015),以及其中引用的参考文献)。在一实施方案中,选择配体或胞外配体结合结构域以与作为对应受体或配体的癌抗原结合(参见,sadelain et al.,cancer discov.3:388-398(2013))。
[0207]
另外,在一些实施方案中,合成受体的靶标结合结构域可以包括嵌合自身抗体受体(caar),即可以被b细胞受体(bcr)识别的自身抗原(参见,ellebrecht et al.science 353(6295),179-184(2016))。
[0208]
对于针对癌抗原的合成受体,选择合成受体的抗原结合结构域以与在癌细胞表达的抗原结合。此类癌抗原可以在癌细胞唯一表达,或者相对于非癌细胞或组织,此类癌抗原可以在癌细胞中过表达。选择与合成受体结合的癌抗原,以使得表达合成受体的细胞比非癌细胞或组织更有靶向性。
[0209]
在一些实施方案中,合成受体包括特异性结合病毒抗原的抗原结合结构域。在一些实施方案中,病毒抗原是ebv。在一些实施方案中,病毒抗原是hpv。应当理解的是,本发明所公开的合成受体可以靶向这些或其它病毒抗原。
[0210]
癌抗原可以是肿瘤抗原。可以基于待治疗的受试者(癌症患者)表现出的癌症类型来选择任何合适的癌抗原。应当理解的是,选择的癌抗原以能够与合成受体结合的方式表达。通常,表达合成受体的细胞所靶向的癌抗原在癌细胞的细胞表面上表达。然而,应当理解的是,任何可与合成受体结合的癌抗原都适合于将表达合成受体的细胞靶向到癌细胞。
[0211]
合适的抗原包含但不限于b细胞成熟抗原(bcma)、间皮素(msln)、前列腺特异性膜抗原(psma)、前列腺干细胞抗原(psca)、碳酸酐酶ix(caix)、癌胚抗原(cea)、cd5、cd7、cd10、cd19、cd20、cd22、cd30、cd33、cd34、cd38、cd41、cd44、cd49f、cd56、cd70、cd74、cd123、cd133、cd138、cd33、il3ra2、cs1、c-met、上皮糖蛋白2(egp 2)、上皮糖蛋白-40(egp-40)、上皮细胞黏附分子(epcam)、叶酸结合蛋白(fbp)、胎儿乙酰胆碱受体(achr)、叶酸受体-α和β(frα和β)、神经节苷脂g2(gd2)、神经节苷脂g3(gd3)、人表皮生长因子受体2(her-2/erb2)、
表皮生长因子受体(egfr)、表皮生长因子受体viii(egfrviii)、erb3、erb4、人端粒酶逆转录酶(htert)、白细胞介素-13受体α-2亚基(il-13rα2)、κ-轻链、激酶插入结构域受体(kdr)、lewis a(ca19.9)、lewis y(ley)、l1细胞黏附分子(llcam)、黑色素瘤相关抗原1(黑色素瘤抗原家族a1,mage-a1)、粘蛋白16(muc-16)、粘蛋白1(muc-1)、nkg2d配体、癌-睾丸抗原ny-eso-1、癌胚胎抗原(h5t4)、肿瘤相关糖蛋白72(tag-72)、血管内皮生长因子r2(vegf-r2)、肾母细胞瘤蛋白(wt-1)、1型酪氨酸-蛋白激酶跨膜受体(ror1)、b7-h3(cd276)、b7-h6(nkp30)、硫酸软骨素蛋白聚糖-4(cspg4)、dnax辅助分子(dnam-1)、ephrin a型受体2(epha2)、成纤维细胞相关蛋白(fap)、gp100/hla-a2、glypican3(gpc3)、ha-1h、herk-v、il-11rα、潜伏膜蛋白1(lmp1)、mag3、神经细胞黏附分子(n-cam/cd56)、ny-eso-1和trail受体(trail r)。应当理解的是,这些或其它癌抗原可以用于本发明所公开的合成受体的靶向作用。
[0212]
在一些实施方案中,本发明所公开的融合蛋白与靶向肿瘤抗原的合成受体结合,所述肿瘤抗原选自由由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,本发明提供的合成受体包含结合cd19的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd20的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd22的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd30的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd123的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd138的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd33的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cd70的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合bcma的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cs1的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合c-met的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合il13ra2的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合egfrviii的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合cea的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合her2的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合gd2的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合mage的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合gpc3的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合间皮素的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合psma的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合ror1的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合egfr的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合muc1的靶标结合结构域。在一些实施方案中,本发明提供的合成受体包含结合ny-eso-1的靶标结合结构域。
[0213]
6.3.2 cars
[0214]
在一些实施方案中,合成受体是car,并且本发明提供的融合蛋白可以在细胞中与car共表达。在一些实施方案中,本发明提供的融合蛋白可以与car结合。car是使免疫细胞
discov.3:388-398(2013))。一般而言,信号传导结构域将在转导的免疫效应细胞(例如,t细胞)中诱导持久性、转运和/或效应功能(sharpe et al.,dis.model mech.8:337-350(2015);finney et al.,j.immunol.161:2791-2797(1998);krause et al.,j.exp.med.188:619-626(1998))。在cdδ或fc受体γ的情况下,所述信号传导结构域对应于相应多肽的胞内结构域,或对应于足以进行信号传导的胞内结构域片段。下面更详细地描述示例性信号传导结构域。
[0218]
cd3δ。在非限制性实施方案中,car可包括源自cd3δ多肽的信号传导结构域,例如源自cd3δ胞内结构域的信号传导结构域,其可激活或刺激免疫细胞,例如t细胞。cd3δ包含3个免疫受体酪氨酸的激活基序(itams),并在抗原结合后将激活信号传递给细胞,例如淋巴系的细胞,如t细胞。cd3δ多肽可以具有与如下提供的序列genbank no.np_932170(np_932170.1,gi:37595565;见下文)相对应的氨基酸序列或其片段。在一个实施方案中,cd3δ多肽具有如下提供的cd3δ多肽序列的52至164位氨基酸的氨基酸序列,或其足以用于信号传导活性片段。示例性car具有包含cd3δ多肽的胞内结构域,所述cd3δ多肽包含如下提供的cd3δ多肽序列的52至164位氨基酸。另一示例性car具有包含cd3δ多肽的胞内结构域,所述cd3δ多肽包含如下提供的cd3δ多肽的52至164位氨基酸。再一个示例性car具有包含cd3δ多肽的胞内结构域,所述cd3δ多肽包含如下提供的cd3δ多肽的52至164位氨基酸。参见genbank np_932170以参考cd3δ内的结构域,如1-21位氨基酸的信号肽;22-30位氨基酸的胞外结构域;31-51位氨基酸的跨膜结构域;52-164位氨基酸的胞内结构域。
[0219]
1 mkwkalftaa ilqaqlpite aqsfglldpk lcylldgilf iygviltalf lrvkfsrsad
[0220]
61apayqqgqnq lynelnlgrr eeydvldkrr grdpemggkp qrrknpqegl ynelqkdkma
[0221]
121 eayseigmkg errrgkghdg lyqglstatk dtydalhmqa lppr(seq id no:92)
[0222]
应当理解的是,“cd3δ核酸”是指对cd3δ多肽进行编码的多核苷酸。在一个实施方案中,对car的胞内结构域中的cd3δ多肽(包含示例性的cars mz、m28z或mbbz)进行编码的cd3δ核酸包括如下所述的核苷酸序列。
[0223]
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgctaa(seq id no:93)
[0224]
在某些非限制性实施方案中,car的胞内结构域可以进一步包括至少一个共刺激信号传导结构域。在一些实施方案中,car的胞内结构域可以包括两个共刺激信号传导结构域。此类共刺激信号传导结构域可以增加免疫细胞的激活。共刺激信号传导结构域可以源自cd28多肽、4-1bb多肽、ox40多肽、icos多肽、dap10多肽、2b4多肽、cd27多肽、cd30多肽、cd40多肽等。先前已经描述了包括胞内结构域的cars,该胞内结构域包括共刺激信号区,该共刺激信号区包括4-1bb、icos或dap-10(参见,u.s.7,446,190,,通过引用将其并入本发明,其还描述了4-1bb、icos和dap-10的代表性序列)。在一些实施方案中,car的胞内结构域可以包括共刺激信号传导区,所述共刺激信号传导区包括两个共刺激分子,如cd28和4-ibb(参见,sadelain et al.,cancer discov.3:388-398(2013)),或cd28和ox40,或本发明所公开的其它共刺激配体的组合。
[0225]
cd28。分化簇28(cd28)是在t细胞上表达的蛋白,为t细胞的活化和存活提供共刺激信号。cd28是cd80(b7.1)和cd86(b7.2)蛋白的受体。在一个实施方案中,car可包括源自cd28的共刺激信号传导结构域。例如,如本发明所公开的,car可包括cd28胞内/胞质结构域的至少一部分,如可用作共刺激信号传导结构域的胞内/胞质结构域。cd28多肽可以具有与如下提供的序列genbank no.p10747(p10747.1,gi:115973)或np_006130(np_006130.1,gi:5453611)对应的氨基酸序列或其片段。如果需要,胞内结构域之外的cd28序列可以包括在本发明的car中。例如,car可以包括cd28多肽的跨膜。在一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含与cd28的180至220位氨基酸或其片段相对应的cd28的胞内结构域。在另一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含与153至179位氨基酸或其片段对应的cd28跨膜结构域。示例性car可包括对应于cd28胞内结构域的共刺激信号传导结构域。示例性car可包括源自于cd28的跨膜结构域。因此,示例性car可以包括来自cd28的两个结构域,即共刺激信号传导结构域和跨膜结构域。在一个实施方案中,car具有包括cd28的跨膜结构域和胞内结构域的氨基酸序列,并且car包括cd28的153至220位氨基酸。在另一个实施方案中,car包含cd28的117至220位氨基酸。具有cd28的跨膜结构域和胞内结构域的另一示例性car是p28z。在一个实施方案中,car可包含源自cd28多肽的跨膜结构域,该cd28多肽包含以下提供的cd28多肽的153至179位氨基酸。参见genbank np_006130以参考cd28内的结构域,例如,1-18位氨基酸的信号肽;19-152位氨基酸的胞外结构域;153-179位氨基酸的跨膜结构域;180-220位氨基酸胞的内结构域。可以理解的是,如果需要,短于或长于特定描述结构域的cd28序列可以包括在car中。
[0226][0227]
应当理解的是,“cd28核酸”是指对cd28多肽进行编码的多核苷酸。在一个实施方案中,编码包括跨膜结构域和胞内结构域(例如,共刺激信号传导区)的cd28多肽的cd28核酸,包括如下所述的核苷酸序列。
[0228]
attgaagttatgtatcctcctccttacctagacaatgagaagagcaatggaaccattatccatgtgaaagggaaacacctttgtccaagtcccctatttcccggaccttctaagcccttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctcc(seq id no:95)
[0229]
4-1bb。4-1bb又称肿瘤坏死因子受体超家族成员9,可作为肿瘤坏死因子(tnf)配体,具有刺激活性。在一个实施方案中,car可包括源自4-1bb的共刺激信号传导结构域。4-1bb多肽可以具有与如下提供的序列genbank no.p41273(p41273.1,gi:728739)或np_001552(np_001552.2,gi:5730095)对应的氨基酸序列或其片段。在一个实施方案中,car可
以具有共刺激结构域,该共刺激结构域包括对应于214至255位氨基酸或其片段的4-1bb胞内结构域。在另一个实施方案中,car可以具有对应于187至213位氨基酸或其片段的4-1bb跨膜结构域。示例性car是mbbz,其具有包含4-1bb多肽(例如,np_001552的214至255位氨基酸,seq id no:96)的胞内结构域。参见genbank np_001552以参考4-1bb内的结构域,例如,1-17位氨基酸的信号肽;18-186位氨基酸的胞外结构域;187-213位氨基酸的跨膜结构域;214-255位氨基酸的胞内结构域。可以理解的是,如果需要,短于或长于特定描述结构域的4-1bb序列可以包括在car中。还可以理解的是,“4-1bb核酸”是指编码4-1bb多肽的多核苷酸。
[0230]
1 mgnscyniva tlllvlnfer trslqdpcsn cpagtfcdnn rnqicspcpp nsfssaggqr
[0231]
61 tcdicrqckg vfrtrkecss tsnaecdctp gfhclgagcs mceqdckqgq eltkkgckdc
[0232]
121 cfgtfndqkr gicrpwtncs ldgksvlvng tkerdvvcgp spadlspgas svtppapare
[0233]
181 pghspqiisf flaltstall fllffltlrf svvkrgrkkl lyifkqpfmr pvqttqeedg
[0234]
241 cscrfpeeee ggcel(np_001552;seq id no:96)
[0235]
ox40。ox40,也称为肿瘤坏死因子受体超家族成员4前体或cd134,是tnfr-受体超家族的一员。在一个实施方案中,car可包括源自ox40的共刺激信号传导结构域。ox40多肽可以具有与如下提供的序列genbank no.p43489(p43489.1,gi:1171933)或np_003318(np_003318.1,gi:4507579)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有共刺激结构域,该共刺激结构域包括对应于236至277位氨基酸或其片段的ox40的胞内结构域。在另一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含对应于ox40的215至235位氨基酸或其片段的ox40跨膜结构域。参见genbank np_003318以参考ox40内的结构域,例如,1-28位氨基酸的信号肽;29-214位氨基酸的胞外结构域;215-235位氨基酸的跨膜结构域;236-277位氨基酸的胞内结构域。应当理解的是,如果需要,短于或长于特定描述结构域的ox40序列可以包括在car中。还应当理解的是,“ox40核酸”是指编码ox40多肽的多核苷酸。
[0236][0237]
icos。可诱导t细胞共刺激分子前体(icos)又称cd278,是在活化的t细胞上表达的cd28超家族共刺激受体。在一个实施方案中,car可包括源自icos的共刺激信号传导结构域。icos多肽可以具有与如下提供的序列genbank no.np_036224(np_036224.1,gi:15029518)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有共刺激结构域,该共刺激结构域包括与icos的162至199位氨基酸相对应的icos胞内结构域。在另一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含与icos的141至161位氨基酸或其片段相
对应的icos跨膜结构域。参见genbank np_036224以参考icos内的结构域,例如,1-20位氨基酸的信号肽;21-140位氨基酸的胞外结构域;141-161位氨基酸的跨膜结构域;162-199位氨基酸的胞内结构域。可以理解的是,如果需要,短于或长于特定描述结构域的ico序列可以包括在car中。还可以理解的是,“icos核酸”是指编码icos多肽的多核苷酸。
[0238][0239][0240]
dap10。dap10又称造血细胞信号转导子,是与造血细胞中受体大家族密切相关的信号传导亚基。在一个实施方案中,car可包括源自dap10的共刺激结构域。dap10多肽可以具有与如下提供的序列genbank no.np_055081.1(gi:15826850)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有共刺激结构域,该共刺激结构域包括对应于70至93位氨基酸或其片段的dap10胞内结构域。在另一个实施方案中,car可以具有对应于49至69位氨基酸或其片段的dap10跨膜结构域。参见genbank np_055081.1以参考dap10内的结构域,例如,1-19位氨基酸的信号肽;20-48位氨基酸的胞外结构域;49-69位氨基酸的跨膜结构域;70-93位氨基酸的胞内结构域。可以理解的是,如果需要,短于或长于特定描述结构域的dap10序列可以包括在car中。还可以理解的是,“dap10核酸”是指编码dap10多肽的多核苷酸。
[0241]
1 mihlghilfl lllpvaaaqt tpgersslpa fypgtsgscs gcgslslpll aglvaadava
[0242]
61 sllivgavfl carprrspaq edgkvyinmp grg(seq id no:99)
[0243]
cd27:cd27(tnfrsf7)是一种跨膜受体,在人cd8 和cd4 t细胞亚群、nkt细胞、nk细胞亚群和造血祖细胞上表达,并在foxp3 cd4t细胞和b细胞亚群中诱导。以前的研究发现,cd27可以在体内主动提供共刺激信号,提高人t细胞存活率和抗肿瘤活性。(参见,song和powell;oncoimmunology 1,no.4(2012):547-549)。cd27多肽可以具有与如下提供的序列uniprotkb/swiss-prot no.:p26842.2(gi:269849546)对应的氨基酸序列或其片段。
[0244][0245]
在一个实施方案中,car可以具有包含cd27或其片段的胞内结构域的共刺激结构域。在另一个实施方案中,car可以具有cd27的跨膜结构域或其片段。可以理解的是,如果需要,短于或长于特定描述结构域的cd27序列可以包括在car中。还可以理解的是,cd27核酸
是指编码cd27多肽的多核苷酸。
[0246]
cd30:cd30及其配体(cd30l)分别属于肿瘤坏死因子受体(tnfr)和肿瘤坏死因子(tnf)超家族。cd30在许多方面的行为与ox40相似,并能增强由tcr刺激诱导的增殖和细胞因子的产生。(goronzy和weyand,arthritis research&therapy 10,no.s1(2008):s3.)在一个实施方案中,car可包括源自cd30的共刺激结构域。cd30多肽可以具有与如下提供的序列genbank no.:aaa51947.1(gi:180096)对应的氨基酸序列或其片段。
[0247][0248]
在一个实施方案中,car可以具有包含cd30胞内结构域或其片段的共刺激结构域。在另一个实施方案中,car可以具有cd30的跨膜结构域或其片段。应当理解的是,如果需要,短于或长于特定描述结构域的cd30序列可以包括在car中。还应当理解的是,cd30核酸是指编码cd30多肽的多核苷酸。
[0249]
cd40:cd40及其配体cd40l或cd154首先被确认为有助于t细胞依赖性b细胞激活。该途径现在被认为是激活apcs并增强其激活t细胞的潜力的机制。cd154介导的cd40刺激为cd28-cd80/cd86的初始共刺激途径提供了重要的反馈机制。(goronzy和weyand,arthritis research&therapy 10,no.s1(2008):s3.)。在一个实施方案中,car可以包括源自cd40的共刺激结构域。cd40多肽可以具有与如下提供的序列uniprotkb/swiss-prot no.:p25942.1(gi:269849546)相对应的氨基酸序列或其片段。
[0250][0251]
在一个实施方案中,car可以具有包括cd40的胞内结构域或其片段的共刺激结构域。在另一个实施方案中,car可以具有cd40的跨膜结构域或其片段。应当理解的是,如果需要,短于或长于特定描述结构域的cd40序列可以包括在car中。还应当理解的是,cd40核酸是指编码cd40多肽的多核苷酸。
[0252]
car的胞外结构域可与引导新生蛋白进入内质网并随后转运到细胞表面的先导肽或信号肽融合。应当理解的是,一旦含有信号肽的多肽在细胞表面表达,在内质网中的多肽加工和移位到细胞表面期间,信号肽通常已经被蛋白水解去除。因此,多肽,例如car,通常在细胞表面以缺乏信号肽的成熟蛋白形式表达,而多肽的前体形式包括信号肽。如果car要糖基化和/或锚定在细胞膜上,信号肽或先导可能是必不可少的。信号序列或先导序列是一种肽序列,通常存在于新合成蛋白质的n端,指导它们进入分泌途径。该信号肽作为融合蛋白共价连接到car的胞外抗原结合域的n-端。在一个实施方案中,信号肽包括包含cd8多肽,该cd8多肽包括氨基酸malpvtalllplalllhaarp(seq id no:116)。应当理解的是,cd8信号肽的使用是示例性的。如本领域所熟知的,任何合适的信号肽都可以应用于car,以在免疫细胞中提供细胞表面表达(参见,gierasch biochem.28:923-930(1989);von heijne,j.mol.biol.184(1):99
–
105(1985))。特别有用的信号肽可以来源于在本发明提供的免疫细胞中自然表达的细胞表面蛋白,包括本发明公开的多肽中的任何一种信号肽。因此,任何合适的信号肽可以用于引导car在本发明提供的免疫细胞的细胞表面表达。
[0253]
在某些非限制性实施方案中,car的胞外抗原结合结构域可以包括连接胞外抗原结合结构域的重链可变区和轻链可变区的连接子序列或肽连接子。在一个非限制性实例中,连接子包括具有ggggsggggsggggs(seq id no:1)所示的序列的氨基酸。
[0254]
在某些非限制性实施方案中,car还可以包括将car的结构域相互连接的间隔子或序列。例如,间隔子可以被包括在信号肽和抗原结合结构域之间、在抗原结合结构域和跨膜结构域之间、在跨膜结构域和胞内结构域之间、和/或在胞内结构域内的结构域之间,例如,在刺激结构域和共刺激结构域之间。间隔子可以足够灵活以允许各种结构域与其他多肽的相互作用,例如,允许抗原结合结构域在方向上具有灵活性以促进抗原识别。间隔子可以是,例如,来自igg的铰链区、免疫球蛋白的ch2ch3(恒定)区域,和/或cd3的部分(分化簇3)或适合作为间隔子的某些其他序列。
[0255]
car的跨膜结构域通常包括跨越至少一部分膜的疏水性α螺旋。不同的跨膜结构域导致不同的受体稳定性。抗原识别后,受体聚集并将信号传递到细胞。在一个实施方案中,本发明提供的car的跨膜结构域可来源于免疫细胞中自然表达的另一种多肽。在一个实施方案中,car具有来源于cd8、cd28、cd3δ、cd4、4-1bb、ox40、icos、ctla-4、pd-1、lag-3、2b4、
btla或免疫细胞中表达的其他多肽的跨膜结构域。任选地,跨膜结构域可以来源于免疫细胞中非自然表达的多肽,只要跨膜结构域能够将信号从结合在car的抗原转导到胞内信号传导结构域和/或共刺激结构域。应当理解的是,包括多肽跨膜结构域的多肽部分可以根据需要包括来自所述多肽的附加序列,例如,邻近跨膜结构域的n端或c端的附加序列,或所述多肽的其它区。
[0256]
cd8。分化簇8(cd8)是跨膜糖蛋白,其作为t细胞受体(tcr)的共受体。cd8与主要组织相容性复合物(mhc)分子结合,并且对i类mhc蛋白具有特异性。在一个实施方案中,car可包括源自cd8的跨膜结构域。cd8多肽可以具有与如下提供的序列genbank no.:np_001139345.1(gi:225007536)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含对应于183至203位氨基酸或其片段的cd8跨膜结构域。在一个实施方案中,示例性car具有源自cd8多肽的跨膜结构域。在一个非限制性实施方案中,car可包含跨膜结构域,该跨膜结构域源自包含183至203位氨基酸的cd8多肽。此外,car可以包括铰链结构域,该铰链结构域包括下面提供的cd8多肽的137-182位氨基酸。在另一个实施方案中,car可以包括下面提供的cd8多肽的137-203位氨基酸。在另一个实施方案中,car可以包含以下提供的cd8多肽的137至209位氨基酸。参见genbank np_001139345.1以参考cd8内的结构域,例如,1-21位氨基酸的信号肽;22-182位氨基酸的胞外结构域;183-203位氨基酸的跨膜结构域;204-235位氨基酸的胞内结构域。应当理解的是,如果需要,183至203位氨基酸的跨膜结构域之外的cd8附加序列可以包括在car中。进一步应当理解的是,如果需要,短于或长于特定描述结构域的cd8序列可以包括在car中。还应当理解的是,“cd8核酸”是指编码cd8多肽的多核苷酸。
[0257][0258]
cd4。分化簇4(cd4)又称t细胞表面糖蛋白cd4,是存在于辅助性t细胞、单核细胞、巨噬细胞和树突状细胞等免疫细胞表面的糖蛋白。在一个实施方案中,car可包括源自cd4的跨膜结构域。cd4存在多种异构体。可以理解的是,可以选择任何异构体来实现所需的功能。示例性的异构体包括异构体1(np_000607.1,gi:10835167)、异构体2(np_001181943.1,gi:303522479)、异构体3(np_001181944.1,gi:303522485;或np_001181945.1,gi:303522491;或np_001181946.1,gi:303522569)等。下面提供了示例性的异构体序列,即异构体1。在一个实施方案中,car可以具有氨基酸序列,该氨基酸序列包含对应于397至418位氨基酸或其片段的cd4跨膜结构域。参见genbank np_000607.1以参考cd4内的结构域,例如,1-25位氨基酸的信号肽;26-396位氨基酸的胞外结构域;397-418位氨基酸的跨膜结构域;419-458位氨基酸的胞内结构域。应当理解的是,如果需要,397至418位基酸的跨膜结构域之外的cd4附加序列可以包括在car中。进一步应当理解的是,如果需要,短于或长于特定描述结构域的cd4序列可以包括在car中。还应当理解的是,“cd4核酸”是指编码cd4多肽的
多核苷酸。
[0259][0260][0261]
除了细胞毒性t细胞外,通过转染编码特定car(car-tregs)的病毒载体,调节性t细胞(treg)可被有效改造以具有预定的抗原特异性。以非mhc限制方式改造的car-tregs具有广泛应用的优势,尤其是在移植和自身免疫方面(zhang et al.(2018)front.immunol.9:2359)。
[0262]
除了t细胞外,car还可以被改造到其他类型的免疫细胞,如nk细胞、巨噬细胞或b细胞。在一些实施方案中,工程改造细胞是nk细胞。在一些实施方案中,合成受体是将nk细胞重新靶向到肿瘤表面抗原的car(参见,例如,hu et al.acta pharmacol sin 39,167-176(2018))。car-nk细胞可以使用含有cd3δ作为胞内信号传导结构域的第一代car构建体或者可以使用与cd3δ联合表达第二信号传导结构域(如,cd28,4-1bb)的第二代car构建体。一般来说,nk细胞中的第二代cars比第一代cars更活跃。在一些实施方案中,car构建体基于nk细胞的激活特征。例如,已知dnax-激活蛋白12(dap12)能激活nk细胞的信号传导。
[0263]
dap12。dap12存在于髓系细胞中,例如巨噬细胞和粒细胞,在这些细胞中,例如,dap12与髓系细胞成员(trem)上表达的触发受体和mdl1(髓系dap12-相关凝集素1/clec5a)相关,两者都参与对抗病原体(如病毒和细菌)的炎症反应。在淋巴系细胞中,dap12在nk细胞中表达,并分别与激活受体(如c型凝集素受体nkg2c)、自然细胞毒性受体nkp44、短尾型kir3ds1和kir2ds1/2/5相关。特别是,ngk2c是用于控制人和小鼠cmv感染的主要的激活nk细胞受体。研究发现,含dap12的car与其ag交联后,在nk细胞中产生足够的激活信号。et al.,j immunol 194:3201-12(2015)。在一个实施方案中,car可包括源自dap12的共刺激结构域。dap10多肽可以具有与如下提供的序列genbank no.aad09437.1(gi:2905996)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有包括dap12的胞内结构域或其片段的信号传导结构域。在另一个实施方案中,car可以具有dap12或其片段的跨膜结构域。应当理解的是,“dap12核酸”是指编码dap12多肽的多核苷酸。
[0264]
1 mgglepcsrl lllplllavs glrpvqaqaq sdcscstvsp gvlagivmgd lvltvliala
[0265]
61 vyflgrlvpr grgaaeaatr kqritetesp yqelqgqrsd vysdlntqrp yyk(seq id no:118)
[0266]
由于受体nkg2d对nk细胞的活性很重要,并且nkg2d配体通常在各种肿瘤上过表达,因此,开发出了一种独特的含有nkg2d的car结构,nkg2d作为胞外域并连接信号传导蛋白(例如,dap10和cd3δ),并且该car结构可以在工程改造细胞中与本发明所公开的融合蛋白共表达或偶联。这些表达car的nk细胞对多种肿瘤亚型具有增强的细胞毒性,其中,在all、骨肉瘤、前列腺癌和横纹肌肉瘤中观察到最佳反应(chang et al.,cancer res 2013;73:1777-86)。人nkg2d多肽可以具有与如下提供的序列genbank no.caa04925.1(gi:2980865)对应的氨基酸序列或其片段。应当理解的是,“nkg2d核酸”是指对nkg2d多肽进行编码的多核苷酸。
[0267][0268]
在一些实施方案中,car可以被改造成巨噬细胞。在一些实施方案中,工程改造细胞是巨噬细胞。例如,已经生成了吞噬作用嵌合抗原受体家族(car-ps),其指导巨噬细胞吞噬包含癌细胞在内的特定靶标(morrissey et al.,elife 2018;7:e36688)。具体而言,来自megf10和fcrv的胞质结构域可以独立于其原生的胞外结构域触发吞噬,并且car-ps可以驱动抗原涂覆的合成颗粒和整个人癌细胞的特定吞噬。添加串联pi3k募集结构域可以进一步增加癌细胞吞噬(morrissey et al.,elife 2018;7:e36688)。
[0269]
megf10多表皮生长因子样结构域蛋白10(megf10),也被称为emardd或sr-f3,是参与巨噬细胞和凋亡细胞的星形胶质细胞的吞噬作用的膜受体。megf10的胞内结构域具有免疫受体酪氨酸激活基序(itams),其由src家族激酶磷酸化。在一个实施方案中,car可以包括源自megf10的跨膜结构域。在一个实施方案中,car可以包括源自megf10的共刺激结构域。megf10多肽可以具有与如下提供的序列genbank no.aah20198.1(gi:18044366)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有包括megf10的胞内结构域或其片段的共刺激结构域。在另一个实施方案中,car可以具有megf10的跨膜结构域或其片段。应当理解的是,“megf10核酸”是指对megf10多肽进行编码的多核苷酸。
[0270][0271]
fcrγigg受体fcγrs的激活类型形成多聚体复合物,该多聚体复合物包括fc受体γ链(fcrγ),该链含有细胞内酪氨酸激活基序(itam),其激活触发活性氧迸发、细胞因子释放、吞噬作用、抗体依赖性细胞介导的细胞毒性和脱颗粒。在一个实施方案中,car可包括源自fcrγ的跨膜结构域。在一个实施方案中,car可包括源自fcrγ的共刺激结构域。fcrγ多肽可以具有与如下提供的ncbi参考序列:np_004097.1(gi:4758344)对应的氨基酸序列或其片段。在一个实施方案中,car可以具有包含fcrγ胞内结构域或其片段的共刺激结构域。在另一个实施方案中,car可以具有fcrγ或其片段的跨膜结构域。应当理解的是,“fcrγ核酸”是指编码fcrγ多肽的多核苷酸。
[0272]
1 mipavvllll llveqaaalg epqlcyilda ilflygivlt llycrlkiqv rkaaitsyek
[0273]
61 sdgvytglst rnqetyetlk hekppq(seq id no:121)
[0274]
本发明提供的car可以包含如上文公开的靶标结合结构域。在一些实施方案中,本发明所公开的融合蛋白可以与靶向肿瘤抗原的car共表达,所述肿瘤抗原选自细胞中的由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,本发明所公开的融合蛋白与靶向肿瘤抗原的car偶联,所述肿瘤抗原选自由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,本发明提供的融合蛋白可以与靶向cd19的car(car19)共表达或偶联。在一些实施方案中,本发明提供的融合蛋白可以与car偶联。在一些实施方案中,本发明提供的融合蛋白可以与结合cd19的car(car19)偶联。在一些实施方案中,car19的氨基酸序列是seq id no:74,其可以由例如seq id no:20的核酸序列编码。在一些实施方案中,car19的氨基酸序列是seq id no:75。在一些实施方案中,car19的氨基酸序列是seq id no:76。在一些
实施方案中,本发明提供的合成受体包含结合bcma的靶标结合结构域。在一些实施方案中,结合bcma的car的氨基酸序列是seq id no:77。在一些实施方案中,结合bcma的car的氨基酸序列是seq id no:78。在一些实施方案中,结合bcma的car的氨基酸序列是seq id no:79。在一些实施方案中,结合bcma的car的氨基酸序列是seq id no:80。在一些实施方案中,结合bcma的car的氨基酸序列是seq id no:136,其可以由例如seq id no:137的核酸序列编码。
[0275]
[0276]
[0277][0278]
6.3.3 tcrs
[0279]
本发明提供的融合蛋白可以与细胞中的合成受体共表达,或与合成受体偶联。在一些实施方案中,合成受体包括tcr,并且本发明提供的融合蛋白可以在细胞中与tcr共表达,或与tcr偶联。在一些实施方案中,合成受体可以接合并激活内源性tcr,并且本发明提供的融合蛋白可以与能够接合和激活内源性tcr的合成受体共表达或偶联。
[0280]
t细胞受体(tcrs)是抗原特异性分子,负责识别在抗原呈递细胞(apcs)表面或任何有核细胞表面的mhc产物的背景下出现的抗原肽。该系统通过其tcrs赋予t细胞识别由细胞表达的整个细胞内抗原阵列(包括病毒蛋白)的潜在能力,这些抗原被加工成短肽,结合到细胞内mhc分子上,并作为肽-mhc复合物传递到表面。该系统允许外源蛋白(例如,变异的癌抗原或病毒蛋白)或异常表达的蛋白作为t细胞的靶标(例如,davis和bjorkman(1988)nature,334,395-402;davis et al.(1998)annu rev immunol,16,523-544)。
[0281]
tcr和肽-mhc复合物的相互作用可以驱动t细胞进入不同的激活状态,这取决于结合的亲和力(或解离率)。tcr识别过程允许t细胞通过提供多样的tcrs库来区分正常、健康细胞和例如通过病毒或恶性肿瘤转化的细胞,其中很有可能存在一个或多个tcrs,其与结合在mhc分子上的外源肽的结合亲和力高于刺激t细胞活性的阈值(manning和kranz(1999)immunology today,20,417-422)。
[0282]
经体外培养鉴定的从人类或小鼠t细胞克隆中分离出的野生型tcr已被证明具有相对较低的结合亲和力(kd=1-300μμ)(davis et al.(1998)annu rev immunol,16,523-544)。这在一定程度上是因为胸腺内发育的t细胞对自身肽-mhc配体进行了阴性选择(耐受性诱导),因此使亲和力过高的t细胞被清除(starr et al.(2003)annu rev immunol,21,139-76)。为了补偿这些相对较低的亲和力,t细胞进化出一种共受体系统,其中细胞表面分
子cd4和cd8与mhc分子(分别为ii类和i类)结合,并与tcr协同介导信号传导活性。cd8在这一过程中特别有效,允许具有非常低亲和力的tcrs(例如,kd=300μm)介导强大的抗原特异性活性。
[0283]
定向进化可用于生成对特定肽-mhc复合物具有更高亲和力的tcrs。可以使用的方法包括酵母菌展示(holler et al.(2003)nat immunol,4,55-62;holler et al.(2000)proc natl acad sci u s a,97,5387-92)、噬菌体展示(li et al.(2005)nat biotechnol,23,349-54)和t细胞展示(chervin et al.(2008)j immunol methods,339,175-84)。所有三种方法都涉及改造或修饰表现出野生型tcr的正常、低亲和力的tcr,以增加对同源肽-mhc复合物(t细胞特异性的原始抗原)的亲和力。
[0284]
如此,在一些实施方案中,合成受体包括tcr,并且本发明提供的融合蛋白可以在细胞中与tcr共表达。在一些实施方案中,本发明提供的融合蛋白可以与tcr偶联。在一些实施方案中,tcr包括alpha(α)链和beta(β)链(分别由trac和trbc编码)。人trac可以具有与uniprotkb/swiss-prot no.:p01848.2(登录号:p01848.2,gi:1431906459)相对应的氨基酸序列。人trbc可以具有与genbank序列alc78509.1(登录号:alc78509.1,gi:924924895)相对应的氨基酸序列。在一些实施方案中,tcr包括gamma链(γ)和delta(δ)链(分别由trgc和trdc编码)。人trgc可以具有与uniprotkb/swiss-prot:p0cf51.1(登录号:p0cf51.1,gi:294863156)相对应的氨基酸序列,或与uniprotkb/swiss-prot:p03986.2(登录号:p03986.2,gi:1531253869)相对应的氨基酸序列。人trdc可以具有与uniprotkb/swiss-prot:b7z8k6.2(登录号:b7z8k6.2,gi:294863191)相对应的氨基酸序列。αβ链(或γδ链)的胞外区负责抗原识别和接合。抗原结合通过多聚cd3复合物刺激下游信号传导,该复合物以三种二聚体(εγ、εδ、δδ)的形式与αβ(或γδ)链的胞内结构域相结合。
[0285]
本发明提供的tcrs可以通过基因工程结合特异性抗原。在一些实施方案中,本发明公开的融合蛋白可与靶向细胞中肿瘤抗原的tcr共表达。在一些实施方案中,本发明公开的融合蛋白可以与靶向肿瘤抗原的tcr偶联。在一些实施方案中,所述肿瘤抗原选自由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。
[0286]
在一些实施方案中,本发明提供的融合蛋白可以与tcr偶联。在一些实施方案中,本发明提供的融合蛋白可以与结合ny-eso-1的tcr偶联。在一些实施方案中,结合ny-eso-1的tcr的氨基酸序列是seq id no:132,其可以由例如seq id no:133的核酸序列编码。
[0287]
在一些实施方案中,合成受体不包括tcr的αβ(或γδ)链,但可以接合并激活内源性tcr复合物。例如,在一些实施方案中,合成受体可以是tcr受体融合构建体(“truc”)(baeuerle et al.,nature communications 10:2087(2019))、t细胞抗原偶联物(“tac”)(helsen et al.,nature communications 9(1):3049(2018))、抗体tcr受体(“abtcr”)(xu et al.,cell discovery(2018)4:62)或嵌合cd3受体(wo2016/054520)。
[0288]
在一些实施方案中,合成受体是truc(baeuerle et al.,nature communications 10:2087(2019))。在一些实施方案中,本发明所公开的融合蛋白可以与truc共表达。在一些实施方案中,本发明所公开的融合蛋白可以与truc偶联。trucs包括与t细胞受体(tcr)亚基融合的基于抗体的结合结构域,并且可以有效地重编程完整tcr复合物以识别肿瘤表面抗原。与cars不同,trucs成为tcr复合物的功能组分。truc-t细胞在液体和实体瘤异种移植模
型中均表现出强效的抗肿瘤活性。为了生成truc,本发明所公开的靶标结合结构域(例如,scfv或单结构域抗体)可以通过连接子序列融合到人tcrα、tcrβ、cd3γ、cd3δ或cd3ε的n端,由此为tcr和工程改造细胞提供新的靶标特异性和hla-a非依赖性细胞溶解的潜力。在一些实施方案中,靶标结合结构域融合到全长人tcrα(α-truc)的n端。在一些实施方案中,靶标结合结构域融合到全长人tcrβ(β-truc)的n端。在一些实施方案中,靶标结合结构域融合到全长人cd3γ(γ-truc)的n端。在一些实施方案中,靶标结合结构域融合到全长人cd3δ(δ-truc)的n端。在一些实施方案中,靶标结合结构域融合到全长人cd3ε(ε-truc)的n端。
[0289]
在一些实施方案中,合成受体是tac(helsen et al.,nature communications 9(1):3049(2018))。在一些实施方案中,本发明所公开的融合蛋白可以与tac共表达。在一些实施方案中,本发明所公开的融合蛋白可以与tac偶联。tac是一种嵌合受体,通过cd3结合结构域指定初始tcr,在与肿瘤抗原结合之后触发内源性tcr的聚集和激活,与上一代car相比,它能诱导高效的抗肿瘤反应并降低毒性。tac设计模仿tcr-cd3:共受体复合物,并且具有三种组分:(1)抗原结合结构域,(2)tcr募集结构域,以及(3)共受体结构域(铰链、跨膜和胞质区)。tac受体使用可互换的抗原结合部分将tcr-cd3复合物重定向到所选择的抗原上,使用scfv募集tcr-cd3复合物,并通过包含cd4铰链、tm区和胞质尾部来整合共受体特性。抗原结合结构域可以是本发明所公开的任何靶标结合结构域。在一些实施方案中,抗原结合结构域是抗her2 darpin。在一些实施方案中,抗原结合结构域是抗cd19 scfv。在一些实施方案中,tcr募集结构域是cd3ε靶向结构域。在一些实施方案中,所述cd3ε靶向结构域选自由huucht1、ucht1、f6k、l2k和okt3组成的群组。在一些实施方案中,共受体结构域是cd4共受体结构域。在一些实施方案中,共受体结构域是cd8α共受体结构域。
[0290]
在一些实施方案中,合成受体是abtcr,其将抗体的抗原结合作用与内源性tcr激活途径相关联(xu et al.,cell discovery(2018)4:62)。在一些实施方案中,本发明所公开的融合蛋白可以与abtcr共表达。在一些实施方案中,本发明所公开的融合蛋白可以与abtcr偶联。为了生成abtcr,抗体的fab结构域与tcr的γ和δ链结合以作为效应结构域。具体而言,在abtcr受体中,fab片段的重链结构域与γδtcr的δ链的一部分融合。然而,fab片段的轻链结构域与γδtcr的γ链的一部分融合。与tcr-t细胞中的外源性表达的tcr相似,abtcr与内源性cd3复合物接合以启动t细胞激活。然而,由于γδtcr链不与αβt细胞中的tcr结合,abtcr避免了常规的基于αβtcr的合成受体的错配问题。另外,通过采用fab作为抗原结合结构域,abtcr可以通过使用tcr模拟抗体或常规抗体以分别靶向肽mhc复合物或细胞表面抗原。abtcr-t细胞可以触发抗原特异性细胞因子产生、脱颗粒和杀死癌细胞。
[0291]
在一些实施方案中,合成受体是嵌合cd3受体(wo2016/054520)。在一些实施方案中,本发明所公开的融合蛋白可以与嵌合cd3受体共表达。在一些实施方案中,本发明所公开的融合蛋白可以与嵌合cd3受体偶联。嵌合cd3受体包括胞外结构域、跨膜结构域和胞内信号传导结构域,其中,胞外结构域包含cd3表位。因此,可以通过结合cd3和癌抗原的双特异性抗体使表达嵌合cd3受体的细胞与表达癌抗原的癌细胞相接近。在一些实施方案中,cd3表位来自cd3ε胞外结构域。胞内信号传导蛋白是共刺激结构域,可以包括4-1bb信号传导结构域、cd28信号传导结构域、icos信号传导结构域、ox40信号传导结构域、cd27信号传导结构域、cd30信号传导结构域、cd150信号传导结构域、dap-10信号传导结构域、nkg2d信号传导结构域、或其中一部分或其组合。胞内结构域可以进一步包括t细胞受体δ链。嵌合
cd3受体可以进一步包含跨膜结构域。跨膜结构域可以是cd8跨膜结构域、cd28跨膜结构域、fcr跨膜结构域或cd3ε跨膜结构域。(w02016/054520)。
[0292]
6.4核酸
[0293]
本发明还提供了对本发明所公开的融合蛋白进行编码的核酸。在一些实施方案中,本发明提供了对融合蛋白进行编码的核酸,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述融合蛋白结合mhc重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。
[0294]
在一些实施方案中,本发明提供了对融合蛋白进行编码的核酸,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽。在一些实施方案中,本发明提供了对融合蛋白进行编码的核酸,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述呈递肽是i类mhc分子的信号肽或其片段。在一些实施方案中,融合蛋白不具有mhc重链。在一些实施方案中,融合蛋白不具有hla-e重链。在一些实施方案中,融合蛋白不具有hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链或hla-g重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。由本发明提供的核酸进行编码的融合蛋白的各种实施方案在上文第6.2部分中提供。
[0295]
在一些实施方案中,本发明提供的核酸包括(i)对融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,和(ii)对合成受体进行编码的第二片段。合成受体可以是本发明所公开的任何合成受体。在一些实施方案中,合成受体可以选自由嵌合抗原受体(car)、t细胞受体(tcr)、tcr受体融合构建体(truc)、t细胞抗原偶联物(tac)、抗体tcr受体(abtcr)和嵌合cd3受体组成的群组。
[0296]
在一些实施方案中,合成受体是car,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,以及对car进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。car可以是本发明所公开的或本领域已知的任何car。在一些实施方案中,car包括特异性结合肿瘤抗原的抗原结合结构域。
[0297]
在一些实施方案中,合成受体是tcr,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,以及对tcr进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。tcr可以是本发明所公开的或本领域已知的任何tcr。在一些实施方案中,tcr包括特异性结合肿瘤抗原的抗原结合结构域。
[0298]
在一些实施方案中,合成受体是truc,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,以及对truc进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。在一些实施方案中,truc包括特异性结合肿瘤抗原的抗原结合结构域。
[0299]
在一些实施方案中,合成受体是tac,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β
2m肽,以及对tac进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。在一些实施方案中,tac包括特异性结合肿瘤抗原的抗原结合结构域。
[0300]
在一些实施方案中,合成受体是abtcr,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,以及对abtcr进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。在一些实施方案中,abtcr包括特异性结合肿瘤抗原的抗原结合结构域。
[0301]
在一些实施方案中,合成受体是嵌合cd3受体,并且本发明提供的核酸包括对如本发明所公开的融合蛋白进行编码的第一片段,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽,以及对嵌合cd3受体进行编码的第二片段,其中所述第二片段与所述第一片段可操作连接。在一些实施方案中,嵌合cd3受体包括特异性结合肿瘤抗原的抗原结合结构域。
[0302]
在一些实施方案中,本发明提供的核酸包括对融合蛋白进行编码的第一片段和对合成受体进行编码的第二片段,其中,所述融合蛋白包括呈递肽和β2m肽,所述第一片段和所述第二片段通过对自裂解肽进行编码的多核苷酸连接。在一些实施方案中,所述第一片段和所述第二片段通过对2a肽进行编码的多核苷酸连接。2a肽,也被称为2a自裂解肽,其包含一类18-22个氨基酸长的肽,并且可以用于蛋白质序列的双顺反子或多顺反子表达(参见,szymczak et al.,expert opin.biol.therapy 5(5):627-638(2005);liu et al.(2017).scientific reports 7(1):2193)。2a肽包含例如p2a肽、t2a肽、f2a肽或e2a肽。示例性p2a序列是(gsg)atnfsllkqagdveenpgp(seq id no:105)。示例性t2a序列是(gsg)egrgslltcgdveenpgp(seq id no:106)。示例性e2a序列是(gsg)qctnyallklagdvesnpgp(seq id no:107)。示例性f2a序列是(gsg)vkqtlnfdllklagdvesnpgp(seq id no:108)。2a肽n端的序列“gsg”(gly-ser-gly)是任选的。
[0303]
在一些实施方案中,本发明提供的核酸包括对融合蛋白进行编码的第一片段和对合成受体进行编码的第二片段,其中,所述融合蛋白包括呈递肽和β2m肽,所述第一片段和所述第二片段通过对2a肽进行编码的多核苷酸连接,并且所述核酸从n端到c端对合成受体、2a连接子、融合蛋白进行编码。在一些实施方案中,本发明提供的核酸从n端到c端对融合蛋白、2a连接子、合成受体进行编码。
[0304]
在一些实施方案中,本发明提供的核酸包括对融合蛋白进行编码的第一片段和对car进行编码的第二片段,其中,所述融合蛋白包括呈递肽和β2m肽,所述第一片段和所述第二片段通过对2a肽进行编码的多核苷酸连接,并且所述核酸从n端到c端对car、2a连接子、融合蛋白进行编码。在一些实施方案中,本发明提供的核酸从n端到c端对融合蛋白、2a连接子、car进行编码。
[0305]
在一些实施方案中,本发明提供的核酸包括对融合蛋白进行编码的第一片段和对合成受体进行编码的第二片段,其中,所述融合蛋白包括呈递肽和β2m肽,所述第一片段和所述第二片段通过ires序列连接。“内部核糖体进入位点”或“ires”是指促进内部核糖体直接进入顺反子(蛋白编码区)的起始密码子(例如,atg),由此导致基因的非帽依赖性翻译的元件。参见,例如,jackson et al.,1990.trends biochem sci 15(12)477-83)以及jackson和kaminski.1995.rna 1(10):985-1000。本领域的技术人员通常采用的ires的实例包含在u.s.pat.no.6,692,736。本领域已知的“ires”的实例还包含,但不限于,可从小核
糖核酸病毒(picomavirus)获得的ires(jacksonet al.,1990)。在一些实施方案中,本发明提供的核酸从5'端到3'端具有第一片段、ires序列和第二片段。在一些实施方案中,本发明提供的核酸从5'端到3'端具有第二片段、ires片段和第一片段。
[0306]
在一些实施方案中,本发明提供的核酸对融合蛋白进行编码,所述融合蛋白的氨基酸序列与选自由seq id nos:5和13-18组成的群组中的氨基酸序列具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,本发明提供的融合蛋白的氨基酸序列包括选自由seq id nos:5和13-18组成的群组中的氨基酸序列。本发明还提供了与编码选自由seq id nos:5和13-18组成的群组中的氨基酸序列的核酸进行杂交的核酸。在一些实施方案中,杂交在本领域技术人员已知的高度严格条件下进行。
[0307]
在一些实施方案中,本发明提供的核酸序列与seq id no:6或12具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,本发明提供的核酸序列是seq id no:6或12。
[0308]
在一些实施方案中,本发明提供的核酸序列与seq id no:6具有至少85%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:6具有至少90%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:6具有至少95%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:6具有至少98%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:6具有至少99%的同一性。在一些实施方案中,本发明提供的核酸序列是seq id no:6。
[0309]
在一些实施方案中,本发明提供的核酸序列与seq id no:12具有至少85%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:12具有至少90%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:12具有至少95%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:12具有至少98%的同一性。在一些实施方案中,本发明提供的核酸序列与seq id no:12具有至少99%的同一性。在一些实施方案中,本发明提供的核酸序列是seq id no:12。
[0310]
本发明还考虑了本发明提供的特异性核酸的变体。变体可以在编码区、非编码区或两者处包含改变。在一些实施方案中,核酸变体包含产生沉默取代、添加或缺失的改变,但不改变编码多肽的性质或活性。在一些实施方案中,核酸变体包括导致多肽的氨基酸序列不改变的沉默替换(由于遗传密码子的简并)。核酸变体的产生有多种原因,例如,优化特定宿主的密码子表达(例如,将人类mrna中的密码子改变为各个适合细菌宿主的密码子,例如大肠杆菌)。在一些实施方案中,核酸变体在序列的非编码区或编码区中包括至少一个沉默突变。
[0311]
在一些实施方案中,制备核酸变体以调节或改变编码核酸的表达(或表达水平)。在一些实施方案中,制备核酸变体以增加编码多肽的表达。在一些实施方案中,制备核酸变体以减少编码多肽的表达。在一些实施方案中,与亲本多核酸相比,核酸变体增加了编码多肽的表达。在一些实施方案中,与亲本核酸相比,核酸变体降低了编码多肽的表达。
[0312]
如果需要,本发明提供的核酸可以进行密码子优化,以提高融合蛋白在给定细胞中的表达效率。密码子优化可用于在给定细胞中实现更高水平的表达。参与蛋白表达不同阶段的因素包括密码子适应性、mrna结构以及转录和翻译中的各种顺式元件。本领域技术人员已知的任何合适的密码子优化方法或技术可用于修饰本发明提供的核酸。这些密码子
优化方法是众所周知的,包括商业上可用的密码子优化服务,例如,optimumgene
tm
(genscript;piscataway,nj)、encor optimization(encor biotechnology;gainseville fl)、blue heron(blue heron biotech;bothell,wa)等。可选地,多个密码子优化可以基于不同的算法进行,优化结果混合以生成编码多肽的密码子得到优化的核酸。
[0313]
在一些实施方案中,所述核酸是分离的。在一些实施方案中,所述核酸为基本纯化的。
[0314]
本发明还提供了包括本发明提供的核酸的载体。所述载体可以是表达载体。所述载体可以是病毒载体。在一个实施方案中,所述载体是逆转录病毒载体,例如γ逆转录病毒载体,其用于将本发明所述的核酸引入到靶细胞中。所述载体可以是慢病毒载体。所述载体可以是腺病毒载体。所述载体可以是腺相关病毒载体。在一些实施方案中,所述载体和构建体可选地被设计为包含报道基因。
[0315]
本发明提供的核酸可以使用本领域已知和可用的各种成熟技术中的任何一种来制备、操作和/或表达。载体的例子有质粒、自主复制序列和转座元件。可以使用典型的转座子系统,如睡美人(sleeping beauty)和piggybac,它们可以被稳定地整合到基因组中(例如,ivics et al.,cell,91(4):501-510(1997);et al.,(2007)nucleic acids research.35(12):e87)。其他的示例性载体包括但不限于质粒、噬菌体、粘粒、人工染色体(如酵母人工染色体(yac)、细菌人工染色体(bac)或p1衍生的人工染色体(pac))、噬菌体(如λ噬菌体或m13噬菌体)和动物病毒。可用作载体的动物病毒种类的例子包括,但不限于,逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如,单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒和乳多空病毒(例如,sv40)。表达载体的例子有用于在哺乳动物细胞中表达的pclneo载体(promega);用于慢病毒介导的基因转导和在哺乳动物细胞中的表达的plenti4/v5-dest
tm
、plenti6/v5-dest
tm
和plenti6.2/v5-gw/lacz(invitrogen)。在特定实施方案中,本发明所公开的融合蛋白的编码序列可以连接到此类表达载体中以便其在哺乳动物细胞中表达。
[0316]
在特定实施方案中,载体是游离载体(episomal vector)或维持在染色体外的载体。本发明所使用的术语“游离”是指能够在不整合到宿主的染色体dna中且不会从分裂的宿主细胞中逐渐丢失的情况下进行复制的载体,也意味着该载体在染色体外复制或以游离形式进行复制。该载体被改造以包含编码来自淋巴营养疱疹病毒或γ疱疹病毒、腺病毒、sv40、牛乳头状瘤病毒或酵母的dna复制起点或“ori”的序列,特别是与ebv的orip相对应的淋巴疱疹病毒或γ疱疹病毒的复制起点。在一些实施方案中,淋巴疱疹病毒可以是爱泼斯坦巴尔二氏病毒(ebv)、卡波西肉瘤疱疹病毒(kshv)、松鼠猴疱疹病毒(hs)或马立克氏病病毒(mdv)。爱泼斯坦巴尔二氏病毒(ebv)和卡波西肉瘤疱疹病毒(kshv)也是γ疱疹病毒的例子。通常,宿主细胞包括激活复制的病毒复制反式激活蛋白。
[0317]
表达载体中存在的“表达控制序列”、“控制元件”或“调节序列”是指载体的非翻译区(如复制起点、选择试剂、启动子、增强子、翻译起始信号(shine dalgarno序列或kozak序列)内含子、多聚腺苷酸序列、5'和3'非翻译区),它们与宿主细胞蛋白质相互作用以进行转录和翻译。这些元件的强度和特异性各不相同。根据使用的载体系统和宿主,可以使用任意数量的合适的转录和翻译元件,包括普遍存在的启动子和诱导型启动子。
[0318]
可用于本发明的说明性的普遍的表达控制序列包括,但不限于,巨细胞病毒(cmv)
即刻早期启动子,病毒性猴病毒(sv40)启动子(例如,早期或晚期),莫洛尼鼠白血病病毒(momlv)ltr启动子,劳氏肉瘤病毒(rsv)ltr,单纯疱疹病毒(hsv)(胸苷激酶)启动子,来自痘苗病毒的h5、p7.5和p11启动子,延伸因子1-α(ef1a)启动子,早期生长反应因子1(egr1),铁蛋白h(ferh),铁蛋白l(ferl),3-磷酸甘油醛脱氢酶(gapdh),真核细胞翻译起始因子4a1(eif4a1),热休克70kda蛋白5(hspa5),热休克蛋白90kdaβ-成员1(hsp90b1),热休克蛋白70kda(hsp70),β-驱动蛋白(β-kin),人rosa 26基因位点(irions et al.,nature biotechnology 25,1477-1482(2007)),泛素c启动子(ubc),磷酸甘油酸激酶-1(pgk)启动子,巨细胞病毒增强子/鸡β-肌动蛋白(cag)启动子和β-肌动蛋白启动子。
[0319]
诱导型启动子/系统的说明性例子包括但不限于类固醇诱导型启动子(例如,编码糖皮质激素或雌激素受体的基因启动子(通过相应激素的处理进行诱导))、金属硫蛋白启动子(通过各种重金属的处理进行诱导)、mx-1启动子(通过干扰素进行诱导)、“基因开关”米非司酮-调控系统(sirin et al.,2003,gene,323:67),cumate诱导基因开关(wo 2002/088346),四环素依赖的调控系统,等等。
[0320]
6.5基因工程细胞
[0321]
本发明提供了表达本发明所公开的融合蛋白的基因工程细胞。本发明还提供了包括本发明所公开的核酸的基因工程细胞。在一些实施方案中,本发明还提供了包括本发明所公开的载体的基因工程细胞。
[0322]
在一些实施方案中,本发明提供了表达融合蛋白的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述融合蛋白结合mhc重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,本发明提供了表达融合蛋白的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽。在一些实施方案中,本发明提供了表达融合蛋白的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述呈递肽是i类mhc分子的信号肽或其片段。
[0323]
在一些实施方案中,本发明提供了包括对融合蛋白进行编码的核酸的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述融合蛋白结合mhc重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,本发明提供了包括对融合蛋白进行编码的核酸的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽。在一些实施方案中,本发明提供了包括对融合蛋白进行编码的核酸的基因工程细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述呈递肽是i类mhc分子的信号肽或其片段。
[0324]
在一些实施方案中,融合蛋白具有少于500个氨基酸。在一些实施方案中,融合蛋白具有少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。在一些实施方案中,融合蛋白缺乏mhc重链。在一些实施方案中,融合蛋白缺乏hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链或hla-g重链。在一些实施方案中,融合蛋白缺乏hla-e重链。融合蛋白的各种实施方案在上述部分中已有提供。
[0325]
本发明所公开的细胞经基因工程改造以表达融合蛋白,所述融合蛋白包括通过连
接子与β2m肽共价连接的呈递肽,其中,所述融合蛋白结合mhc重链以在细胞表面上形成稳定的mhc复合物。在一些实施方案中,融合蛋白结合内源性表达的mhc重链以在细胞表面上形成稳定的mhc复合物。在一些实施方案中,mhc复合物可以结合免疫细胞的抑制性受体以抑制免疫细胞。因此,本发明还提供了稳定的mhc复合物,包括本发明所公开的融合蛋白和mhc重链。mhc重链可以是内源性表达的。
[0326]
在一些实施方案中,本发明提供了稳定的hla-a复合物,包括本发明所公开的融合蛋白和hla-a重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-a限制性呈递肽。在一些实施方案中,本发明提供了稳定的hla-b复合物,包括本发明所公开的融合蛋白和hla-b重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-b限制性呈递肽。在一些实施方案中,本发明提供了稳定的hla-c复合物,包括本发明所公开的融合蛋白和hla-c重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-c限制性呈递肽。
[0327]
在一些实施方案中,本发明提供了稳定的hla-e复合物,包括本发明所公开的融合蛋白和hla-e重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽。在一些实施方案中,本发明提供了稳定的hla-f复合物,包括本发明所公开的融合蛋白和hla-f重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-f限制性呈递肽。在一些实施方案中,本发明提供了稳定的hla-g复合物,包括本发明所公开的融合蛋白和hla-g重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-g限制性呈递肽。
[0328]
在一些实施方案中,本发明提供了稳定的cd1复合物,包括本发明所公开的融合蛋白和cd1重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的cd1限制性呈递分子。在一些实施方案中,本发明提供了稳定的mr1复合物,包括本发明所公开的融合蛋白和mr1重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的mr1限制性呈递分子。在一些实施方案中,本发明提供了稳定的fcrn复合物,包括本发明所公开的融合蛋白和fcrn重链,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的fcrn限制性呈递分子。在一些实施方案中,本发明提供了稳定的ul18复合物,包括本发明所公开的融合蛋白和ul18蛋白,其中,所述融合蛋白包括通过连接子与β2m肽共价连接的ul18限制性呈递肽。
[0329]
mhc复合物的形成可以通过本发明所公开的或本领域已知的任何方法检测。例如,本发明所公开的融合蛋白和mhc复合物中的mhc重链的共定位可以使用β2m共免疫沉淀检测(lee et al.,j immunol 1998;160:4951-60)。又如,mhc重链与本发明所公开的融合蛋白在mhc复合物中的相互作用可以通过表面等离子共振技术(spr)检测(goodridge et al.,immunol.2010;184(11):6199-6208)。再如,融合蛋白和mhc重链可以分别用不同的荧光标记进行标记,并且mhc重链和本发明所公开的融合蛋白在mhc复合物中的共定位可以通过显微镜或流式细胞仪检测。本领域普通技术人员将理解,用于检测蛋白质-蛋白质相互作用的多种测定可以用于检测mhc复合物,包含例如拉下实验、交联、标记转移、蛋白质印迹分析(far-western blot analysis)、蛋白质亲和纯化、双杂交实验(酵母、哺乳动物)、荧光共振能量转移(fret)、凝胶迁移实验等(参见,例如,berggard et al.proteomics 2007,7,2833-2842;phizicky et al.(1995)microbiol rev.59:94-123.;golemis e(2002)protein-protein interactions:a molecular cloning manual.cold spring harbor
(ny):cold spring harbor laboratory press.p ix,682.)。
[0330]
在一些实施方案中,本发明所公开的基因工程细胞进一步表达合成受体,所述合成受体包括(1)可以特异性结合靶分子的靶标结合结构域,和(2)可以激活工程改造细胞中信号传导途径的功能结构域。合成受体可以是car、tcr、truc、tac、abtcr或嵌合cd3受体。在一些实施方案中,本发明所公开的基因工程细胞进一步表达car。在一些实施方案中,本发明所公开的基因工程细胞进一步表达tcr。在一些实施方案中,本发明所公开的基因工程细胞进一步表达truc。在一些实施方案中,本发明所公开的基因工程细胞进一步表达tac。在一些实施方案中,本发明所公开的基因工程细胞进一步表达abtcr。在一些实施方案中,本发明所公开的基因工程细胞进一步表达嵌合cd3受体。
[0331]
在一些实施方案中,合成受体是car。car可以是本发明所公开的或本领域已知的任何car。在一些实施方案中,car包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,本发明还提供了表达本发明所公开的融合蛋白和car的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对car进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对car进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0332]
在一些实施方案中,合成受体是tcr。tcr可以是本发明所公开的或本领域已知的任何tcr。在一些实施方案中,tcr包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,还提供了表达本发明所公开的融合蛋白和tcr的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对tcr进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对tcr进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0333]
在一些实施方案中,合成受体是truc。truc可以是本发明所公开的或本领域已知的任何truc。在一些实施方案中,truc包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,本发明还提供了表达本发明所公开的融合蛋白和truc的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对truc进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对truc进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0334]
在一些实施方案中,合成受体是tac。tac可以是本发明所公开的或本领域已知的任何tac。在一些实施方案中,tac包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,本发明还提供了表达本发明所公开的融合蛋白和tac的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对tac进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,
本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对tac进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0335]
在一些实施方案中,合成受体是abtcr。abtcr可以是本发明所公开的或本领域已知的任何abtcr。在一些实施方案中,abtcr包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,本发明还提供了表达本发明所公开的融合蛋白和abtcr的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对abtcr进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对abtcr进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0336]
在一些实施方案中,合成受体是嵌合cd3受体。嵌合cd3受体可以是本发明所公开的或本领域已知的任何嵌合cd3受体。在一些实施方案中,嵌合cd3受体包括特异性结合肿瘤抗原的抗原结合结构域。因此,在一些实施方案中,本发明还提供了表达本发明所公开的融合蛋白和嵌合cd3受体的基因工程细胞。在一些实施方案中,本发明提供的基因工程细胞包括核酸,所述核酸包括对融合蛋白进行编码的第一片段和对嵌合cd3受体进行编码的第二片段。核酸的第一片段和第二片段可以通过编码2a肽的多核苷酸连接。核酸的第一片段和第二片段也可以与ires序列连接。在一些实施方案中,本发明提供的基因工程细胞包括对融合蛋白进行编码的核酸,以及对嵌合cd3受体进行编码的第二核酸,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0337]
在一些实施方案中,本发明提供的细胞还经改造以减少i类mhc分子或mhc样分子在细胞表面上的内源性表达。抑制i类mhc分子和/或mhc样分子在供体细胞表面上的表达可以减少或消除供体细胞上的同种异体抗原呈递,并且有助于逃避宿主t细胞对供体细胞的识别和清除,因此有利于改善同种异体移植物的相容性。例如,在car-t疗法的背景下,有人认为从供体t细胞中去除i类mhc分子可以消除同种异体供体细胞的“非自身”抗原呈递,从而保护其免受宿主免疫系统的影响,尤其是cd8 t细胞(wo2015136001)。
[0338]
在一些实施方案中,本发明提供的细胞经改造以减少i类mhc分子或mhc样分子的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏i类mhc分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏经典i类mhc分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏非经典i类mhc分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链、hla-g重链或其任何组合在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-a重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-b重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-c重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-e重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-f重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-g重链在细胞表面上的内源性表达。在一些实施方案中,
本发明所公开的细胞缺乏hla-a重链、hla-b重链和hla-c重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-e重链、hla-f重链和hla-g重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链和hla-g重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏至少mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏cd1重链、mr1重链、fcrn重链、ul18或其任何组合在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏cd1重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏mr1重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏fcrn重链在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏ul18在细胞表面上的内源性表达。在一些实施方案中,本发明所公开的细胞缺乏cd1重链、mr1重链、fcrn重链和ul18在细胞表面上的内源性表达。
[0339]
在一些实施方案中,本发明所公开的细胞缺乏β2m在细胞表面上的内源性表达。由于β2m是具有不同重链的多种mhc复合物不可或缺的结构组分,抑制β2m表达可以减少或消除工程改造细胞表面上的i类mhc分子和一些mhc样分子。在一些实施方案中,本发明所公开的细胞经基因工程改造以(1)表达本发明所公开的融合蛋白,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,和(2)缺乏β2m的内源性表达。融合蛋白可以是本发明所公开的任何融合蛋白。在一些实施方案中,融合蛋白包括hla-e限制性呈递肽,并且与内源性hla-e重链形成复合物,从而可以被免疫细胞的抑制性受体(例如,nk细胞上的nkg2a受体)识别。
[0340]
当β2m的内源性表达被消除时,mhc复合物的形成可以通过融合蛋白和重链在细胞表面上的共定位来检测,并且mhc复合物包括本发明所公开的融合蛋白和内源性mhc重链,该融合蛋白可以通过抗-β2m抗体检测,该内源性mhc重链可以通过识别重链的抗体检测。例如,抗体克隆w6/32可以用于检测hla-abc;抗体克隆3d12可以用于检测hla-e;抗体克隆可以用于检测β2m。
[0341]
本发明所公开的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源表达,是指与未经工程改造的细胞相比,分子在细胞表面处的内源性表达水平显著降低。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少50%。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少60%。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少70%。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少80%。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少90%。在一些实施方案中,与未经工程改造的细胞相比,分子在细胞表面处的内源性表达减少了至少95%。在一些实施方案中,分子在细胞表面处的内源性表达是不可检测的。例如,在一些实施方案中,本发明所公开的细胞的细胞膜部分中,i类mhc分子或mhc样分子不能被蛋白质印迹检测到,或者不能被细胞的细胞膜上的免疫荧光检测到。在一些实施方案中,本发明提供的细胞经改造以删除(或敲除)对i类mhc分子或mhc样分子进行编码的基因。
[0342]
在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少50%
的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少60%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少75%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少80%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少85%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少90%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。在一些实施方案中,本发明提供了本发明所述的基因工程细胞群,其中,至少95%的细胞缺乏i类mhc分子或mhc样分子在细胞表面上的内源性表达。
[0343]
本发明提供的基因工程细胞可以是任何类型。在一些实施方案中,细胞适合移植。在一些实施方案中,细胞适合用于同种异体移植。在一些实施方案中,细胞选自由干细胞、多能细胞、祖细胞、造血干细胞和/或祖细胞、cd34 动员外周血细胞、cd34 脐带血细胞、cd34 骨髓细胞、肝细胞、体细胞、免疫细胞和非转化细胞组成的群组。在一些实施方案中,细胞是干细胞。在一些实施方案中,细胞是多能细胞。在一些实施方案中,细胞是祖细胞。在一些实施方案中,细胞是造血干细胞和/或祖细胞。在一些实施方案中,细胞是cd34 动员外周血细胞。在一些实施方案中,细胞是cd34 脐带血细胞。在一些实施方案中,细胞是cd34 骨髓细胞。在一些实施方案中,细胞是肝细胞。在一些实施方案中,细胞是体细胞。在一些实施方案中,细胞是非转化细胞。
[0344]
在一些实施方案中,本发明提供的细胞是干细胞。细胞可以是体细胞。细胞可以是非多能细胞。细胞可以是不完全或部分多能干细胞。细胞可以是多能细胞。细胞可以是寡能细胞。细胞可以是单能细胞。细胞可以是终末分化细胞。适用于特定实施方案的多能细胞包含但不限于天然干细胞、胚胎干细胞或诱导多能细胞(ipscs)。本发明还提供了组合上述任何细胞的混合细胞群。例如,本发明提供的细胞群可以包括经历重编程的细胞,包括多能细胞、部分多能细胞和非多能细胞,如完全分化细胞。
[0345]
在一些实施方案中,本发明提供的细胞是成体干/祖细胞。在一些实施方案中,本发明提供的细胞是新生儿干/祖细胞。在一些实施方案中,细胞是选自由中胚层干/祖细胞、内胚层干/祖细胞和外胚层干/祖细胞组成的群组。在一些实施方案中,细胞是中胚层干/祖细胞。在一些实施方案中,细胞是内胚层干/祖细胞。在一些实施方案中,细胞是外胚层干/祖细胞。
[0346]
中胚层干/祖细胞的说明性实例包含但不限于:中胚层干/祖细胞、内皮干/祖细胞、骨髓干/祖细胞、脐带干/祖细胞(umbilical cord stem cell)、脂肪组织源性干/祖细胞(adipose tissue derived stem cell)、造血干/祖细胞(hsc)、间充质干/祖细胞、肌肉干/祖细胞、肾干/祖细胞、成骨细胞干/祖细胞、软骨细胞干/祖细胞(chondrocyte stem cell)等。在一些实施方案中,细胞是中胚层干/祖细胞。在一些实施方案中,细胞是内皮干/祖细胞。在一些实施方案中,细胞是骨髓干/祖细胞。在一些实施方案中,细胞是脐带干/祖细胞。在一些实施方案中,细胞是脂肪组织源性干/祖细胞。在一些实施方案中,细胞是造血干/祖细胞(hsc)。在一些实施方案中,细胞是间充质干/祖细胞。在一些实施方案中,细胞是
肌肉干/祖细胞。在一些实施方案中,细胞是肾干/祖细胞。在一些实施方案中,细胞是成骨细胞干/祖细胞。在一些实施方案中,细胞是软骨细胞干/祖细胞。
[0347]
外胚层干/祖细胞的说明性实例包含但不限于神经干/祖细胞、视网膜干/祖细胞、皮肤干/祖细胞等。在一些实施方案中,细胞是神经干/祖细胞。在一些实施方案中,细胞是视网膜干/祖细胞。在一些实施方案中,细胞是皮肤干/祖细胞。
[0348]
内胚层干细胞或祖细胞的说明性实例包含但不限于肝干/祖细胞、胰腺干/祖细胞、上皮干/祖细胞等。在一些实施方案中,细胞是内胚层干/祖细胞。在一些实施方案中,细胞是肝干/祖细胞。在一些实施方案中,细胞是胰腺干/祖细胞。在一些实施方案中,细胞是上皮干/祖细胞。
[0349]
在某些实施方案中,本发明提供的细胞选自由胰岛细胞、cns细胞、pns细胞、心肌细胞、骨骼肌细胞、平滑肌细胞、造血细胞、骨细胞、肝细胞、脂肪细胞、肾细胞、肺细胞、软骨细胞、皮肤细胞、卵泡细胞、血管细胞、上皮细胞、免疫细胞、内皮细胞等组成的群组。在一些实施方案中,细胞是胰岛细胞。在一些实施方案中,细胞是cns细胞。在一些实施方案中,细胞是pns细胞。在一些实施方案中,细胞是心肌细胞。在一些实施方案中,细胞是骨骼肌细胞。在一些实施方案中,细胞是平滑肌细胞。在一些实施方案中,细胞是造血细胞。在一些实施方案中,细胞是骨细胞。在一些实施方案中,细胞是肝细胞。在一些实施方案中,细胞是脂肪细胞。在一些实施方案中,细胞是肾细胞。在一些实施方案中,细胞是肺细胞。在一些实施方案中,细胞是软骨细胞。在一些实施方案中,细胞是皮肤细胞。在一些实施方案中,细胞是卵泡细胞。在一些实施方案中,细胞是血管细胞。在一些实施方案中,细胞是上皮细胞。在一些实施方案中,细胞是内皮细胞。
[0350]
在一些实施方案中,本发明提供的细胞是免疫细胞。细胞可以是白细胞。白细胞是由造血干细胞发育而来的有核细胞,在造血系统和淋巴系统中发挥重要作用。白细胞包含髓样细胞(myeloid cells)、淋巴类细胞(lymphoid cells)、粒细胞(如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、淋巴细胞(如t细胞、b细胞、nk细胞、nkt细胞)、浆细胞、树突状细胞、单核细胞和由其分化的细胞(如巨噬细胞)。在一些实施方案中,本发明提供的细胞是白细胞。在一些实施方案中,本发明提供的细胞是髓样细胞。在一些实施方案中,本发明提供的细胞是淋巴类细胞。在一些实施方案中,本发明提供的细胞是粒细胞。在一些实施方案中,本发明提供的细胞是中性粒细胞。在一些实施方案中,本发明提供的细胞是嗜酸性粒细胞。在一些实施方案中,本发明提供的细胞是嗜碱性粒细胞。在一些实施方案中,本发明提供的细胞是t细胞。在一些实施方案中,本发明提供的细胞是b细胞。在一些实施方案中,本发明提供的细胞是浆细胞。在一些实施方案中,本发明提供的细胞是nk细胞。在一些实施方案中,本发明提供的细胞是nkt细胞。在一些实施方案中,本发明提供的细胞是树突细胞。在一些实施方案中,本发明提供的细胞是单核细胞。在一些实施方案中,本发明提供的细胞是巨噬细胞。
[0351]
在一些实施方案中,本发明提供的细胞是肿瘤浸润淋巴细胞(til)。
[0352]
在一些实施方案中,本发明提供了本发明所公开的细胞群。细胞群可以是同质细胞群。细胞群可以是异质细胞群。在一些实施方案中,细胞群可以是包括本发明所公开的细胞的任何组合的异质细胞群。
[0353]
本发明提供的t细胞可以用于同种异体移植。例如,本发明所公开的一些car-t细
胞可以是通用car-ts细胞,可以用于癌症治疗的同种异体移植。在一些实施方案中,本发明提供了表达本发明所公开的融合蛋白的基因工程t细胞。在一些实施方案中,本发明提供了包括本发明所公开的核酸的基因工程t细胞。在一些实施方案中,本发明提供的是car-t细胞。
[0354]
在一些实施方案中,本发明提供的基因工程细胞是通用的淋巴细胞,即可以应用于同种异体移植的淋巴细胞,其不产生或产生可控的gvhd反应。gvhd(移植物抗宿主疾病)反应是指具有免疫活性细胞的组织移植后的医疗并发症,其中,移植物组织中具有免疫活性的细胞将受体的健康组织识别为异物并启动针对受体的健康组织的免疫应答。gvhd可以通过药物干预进行临床控制并且不会威及生命;但严重的gvhd可能会危及生命。gvhd是同种异体car-t疗法的一个特别关注点,因为同种异体t细胞不仅可以识别癌症,还可以将受体的非癌变组织识别为非自身并攻击此类非癌变组织。
[0355]
t细胞受体(tcr)是t细胞上的跨膜八聚体,由tcr二聚体和cd3的各种亚基组成。tcr负责t细胞的抗原识别,这是t细胞激活所必需的。tcr受体的组分包含tcr的α和β亚基,以及cd3的δ、ε、γ、δ或ε亚基。从供体t细胞中去除功能性tcr组分可以防止供体t细胞攻击宿主细胞。因此,在一些实施方案中,本发明提供的t细胞也缺乏tcr复合物的组分的表达。在一些实施方案中,至少一种对tcr的组分进行编码的基因在本发明提供的t细胞中被灭活。在一些实施方案中,对tcr的α亚基(例如,trac)进行编码的基因在本发明提供的t细胞中被灭活。人trac可以具有与uniprotkb/swiss-prot no.:p01848.2(登录号:p01848.2,gi:1431906459)相对应的氨基酸序列。在一些实施方案中,对tcr的β亚基(例如,trbc)进行编码的基因在本发明提供的t细胞中被灭活。人trbc可以具有与genbank序列alc78509.1(登录号:alc78509.1,gi:924924895)相对应的氨基酸序列。
[0356]
在一些实施方案中,对cd3的δ亚基进行编码的基因在本发明提供的t细胞中被灭活。人cd3的δ亚基可以具有与如下提供的ncbi参考序列:np_000723.1(登录号:np_000723.1,gi:4502669;异构体a)或ncbi参考序列:np_001035741.1(登录号:np_001035741.1,gi:98985801;异构体b)相对应的氨基酸序列。在一些实施方案中,对cd3的ε亚基进行编码的基因在本发明提供的t细胞中被灭活。人cd3的ε亚基可以具有与如下提供的序列uniprotkb/swiss-prot:p07766.2(登录号:p07766.2,gi:1345708)相对应的氨基酸序列。在一些实施方案中,对cd3的γ亚基进行编码的基因在本发明提供的t细胞中被灭活。人cd3的γ亚基可以具有与如下提供的ncbi参考序列:np_000064.1(登录号:np_000064.1,gi:4557429)相对应的氨基酸序列。在一些实施方案中,对cd3的δ亚基进行编码的基因在本发明提供的t细胞中被灭活。人cd3的δ亚基可以具有与如下提供的序列uniprotkb/swiss-prot:p20963.1(登录号:p20963.1,gi:23830999)相对应的氨基酸序列。在一些实施方案中,对cd3的ε亚基进行编码的基因在本发明提供的t细胞中被灭活。人cd3的ε亚基可以具有与如下提供的序列uniprot identifier p20963-2相对应的氨基酸序列。
[0357]
出于说明性目的,在一些实施方案中,本发明提供了表达融合蛋白的基因工程t细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述t细胞进一步表达car,并且对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。融合蛋白可以是本发明所公开的任何融合蛋白。car可以是本发明所公开的或本领域已知的任何car。在一些实施方案中,融合蛋白包含通过(g4s)3连接子与呈递肽共价连接的人β2m,其中,所述呈递
肽是hla-e限制性的并且是i类mhc分子的信号肽的8-10个氨基酸片段。在一些实施方案中,car包括特异性结合肿瘤抗原(例如,cd19)的抗原结合结构域。
[0358]
在一些实施方案中,本发明提供的细胞是表达融合蛋白的基因工程t细胞,所述融合蛋白具有选自由seq id nos:5和13-18组成的群组中的氨基酸序列。在一些实施方案中,t细胞进一步表达car,其具有特异性结合cd19或bcma的抗原结合结构域。在一些实施方案中,靶向cd19的car的氨基酸序列选自由seq id nos:74-76组成的群组。在一些实施方案中,靶向bcma的car的氨基酸序列选自由seq id nos:77-80和136组成的群组。在一些实施方案中,t细胞进一步表达tcr,其具有特异性结合ny-eso-1的抗原结合结构域。在一些实施方案中,靶向ny-eso-1的tcr具有seq id no:132的氨基酸序列。在一些实施方案中,t细胞包括核酸,其包含对融合蛋白进行编码的第一片段和对car或tcr进行编码的第二片段。在一些实施方案中,t细胞包括对融合蛋白和car进行编码的核酸,所述融合蛋白具有选自由seq id nos:5和13-18组成的群组中的氨基酸序列,以及所述car具有选自由seq id nos:74-80和136组成的群组中的氨基酸序列。在一些实施方案中,t细胞包括对融合蛋白和tcr进行编码的核酸,所述融合蛋白具有选自由seq id nos:5和13-18组成的群组中的氨基酸序列,以及所述tcr具有seq id no:132的氨基酸序列。在一些实施方案中,t细胞包括对氨基酸序列进行编码的核酸,所述氨基酸序列与选自由seq id nos:11、124、126、128、130、134和138组成的群组中的氨基酸序列具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,t细胞包括对氨基酸序列进行编码的核酸,所述氨基酸序列选自由seq id nos:11、124、126、128、130、134和138组成的群组。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0359]
在一些实施方案中,t细胞包括对与seq id no:11具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:11具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:11具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:11具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:11具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:11的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:12具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:12的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0360]
在一些实施方案中,t细胞包括对与seq id no:124具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:124具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:124具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:124具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:124具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:124的氨基酸序列进行编码的核酸。在一些
实施方案中,t细胞包括与seq id no:125具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:125的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0361]
在一些实施方案中,t细胞包括对与seq id no:126具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:126具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:126具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:126具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:126具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:126的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:127具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:127的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0362]
在一些实施方案中,t细胞包括对与seq id no:128具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:128具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:128具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:128具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:128具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:128的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:129具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:129的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0363]
在一些实施方案中,t细胞包括对与seq id no:130具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:130具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:130具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:130具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:130具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:130的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:131具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:131的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0364]
在一些实施方案中,t细胞包括对与seq id no:134具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:134具有至少90%
的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:134具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:134具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:134具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:134的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:135具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:135的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0365]
在一些实施方案中,t细胞包括对与seq id no:138具有至少85%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:138具有至少90%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:138具有至少95%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:138具有至少98%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对与seq id no:138具有至少99%的同一性的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括对seq id no:138的氨基酸序列进行编码的核酸。在一些实施方案中,t细胞包括与seq id no:139具有至少85%、至少90%、至少95%、至少98%或至少99%的同一性的核酸。在一些实施方案中,t细胞包括具有seq id no:139的核苷酸序列的核酸。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被灭活。在一些实施方案中,对β2m和tcr的α亚基进行编码的内源性基因在t细胞中被敲除。
[0366]
6.6药物组合物
[0367]
本发明还提供了包括本发明所公开的细胞的药物组合物。所述药物组合物包括有效量的本发明所公开的细胞和药学上可接受的载体。本发明所公开的细胞和包括细胞的组合物可以方便地以无菌液体制剂的形式提供,例如,通常为具有细胞悬浮液的等渗水溶液,或可选地为乳液、分散体等,其通常被缓冲到指定的ph。组合物可以包括载体,例如,水、盐水、磷酸盐缓冲盐水等,其适合于细胞的完整性和活力,并有利于细胞组合物的给药。
[0368]
可以根据需要,将本发明公开的细胞掺入到适量且适当的溶剂中,并加入不同量的其他成分来制备无菌注射溶液。此类组合物可以包含药学上可接受的载体、稀释剂或赋形剂(例如,无菌水、生理盐水、葡萄糖、右旋糖(dextrose)等),,他们适合与细胞组合物一起使用,并且适于向受试者(例如,人)施用。用于细胞组合物的合适的生物缓冲液是本领域众所周知的。任何使用的媒剂、稀释剂或添加剂都与保持本发明所公开的细胞的完整性和活力相容。
[0369]
组合物通常是等渗的,即,其与血液和泪液具有相同的渗透压。本发明提供的细胞组合物的所需的等渗性可以使用氯化钠或其它药学上可接受的试剂(例如,右旋糖、硼酸、酒石酸钠、或其它无机或有机溶质)来实现。氯化钠对于含有钠离子的缓冲液是特别优选的。一种特别有用的缓冲液是盐水,例如,生理盐水。本领域技术人员应当认识到,组合物的组分应当呈化学惰性,并且将不会影响本发明所公开的细胞的活力或功效,并且是适合施用于受试者(例如,人)的。本领域技术人员可以容易地确定本发明的方法中待施用组合物中的细胞和可选的添加剂、媒剂和/或载体的量。
[0370]
本发明所公开的细胞可以在任何生理上可接受的媒剂中施用。本发明描述了合适的施用剂量。包括本发明所公开的细胞的细胞群可以包括经纯化的细胞群。如本发明所述,本领域技术人员可以使用各种众所周知的方法容易地确定细胞群中细胞的百分比。包括本发明提供的基因修饰细胞的细胞群的纯度范围可以为约20%到约25%、约25%到约30%、约30%到约35%、约35%到约40%、约40%到约45%、约45%到约50%、约55%到约60%、约65%到约70%、约70%到约75%、约75%到约80%、约80%到约85%;约85%到约90%、约90%到约95%或约95%到约100%。在一些实施方案中,包括本发明提供的基因修饰细胞的细胞群的纯度范围可以为约20%到约30%、约20%到约50%、约20%到约80%、约20%到约100%、约50%到约80%或约50%到约100%。本领域技术人员可以容易地调整剂量;例如,纯度降低可能需要增加剂量。
[0371]
本发明还提供了用于制备本发明所公开的细胞的试剂盒。在一个实施方案中,试剂盒包括一种或多种用于生成基因工程细胞(如t细胞)的载体,,所述载体表达本发明所公开的用于同种异体移植的融合蛋白。试剂盒可以用于从非自体细胞生成基因工程细胞,以施用于相容的受试者。在另一个实施方案中,试剂盒可以包括本发明所公开的细胞,例如非自体细胞,以施用于受试者。在特定实施方案中,试剂盒包括在一个或多个容器中的本发明所公开的细胞。
[0372]
6.7制备方法
[0373]
本发明提供了对细胞进行基因工程改造以用于同种异体移植的方法,包括用本发明所公开的核酸转导细胞。本发明还提供了对细胞进行基因工程改造以用于同种异体移植的方法,包括用载体转导细胞,所述载体包括本发明所公开的核酸。在一些实施方案中,核酸对本发明所公开的融合蛋白进行编码。在一些实施方案中,本发明提供的方法包括用对融合蛋白进行编码的核酸转导细胞,其中,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。
[0374]
在一些实施方案中,本发明提供了对细胞进行基因工程改造以用于同种异体移植的方法,包括用对融合蛋白进行编码的核酸转导细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述融合蛋白结合mhc重链以形成mhc复合物,所述mhc复合物结合免疫细胞的抑制性受体以抑制免疫细胞。在一些实施方案中,本发明提供了对细胞进行基因工程改造以用于同种异体移植的方法,包括用对融合蛋白进行编码的核酸转导细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的hla-e限制性呈递肽。在一些实施方案中,本发明提供了对细胞进行基因工程改造以用于同种异体移植的方法,包括用对融合蛋白进行编码的核酸转导细胞,所述融合蛋白包括通过连接子与β2m肽共价连接的呈递肽,其中,所述呈递肽是i类mhc分子的信号肽或其片段。在一些实施方案中,融合蛋白不具有mhc重链。在一些实施方案中,融合蛋白不具有hla-e重链。在一些实施方案中,融合蛋白不具有hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链或hla-g重链。在一些实施方案中,融合蛋白具有少于500个氨基酸、少于400个氨基酸、少于300个氨基酸或少于200个氨基酸。在一些实施方案中,融合蛋白具有约100个氨基酸到约300个氨基酸、约100个氨基酸到约200个氨基酸、约120个氨基酸到约180个氨基酸、约120个氨基酸到约160个氨基酸或约140个氨基酸到约160个氨基酸。由本发明提供的核酸进行编码的融合蛋白的各种实施方案在上文第6.2部分中提供。
85:6460-6464(1988))。非兼向性颗粒也适用,例如,用vsvg、rd114或galv包膜和任何其它本领域已知的假型颗粒(relander et al.,mol.therap.11:452-459(2005))。可能的转导方法还包含细胞与分泌细胞的直接共培养(例如,bregni et al.,blood 80:1418-1422(1992)),或单独与病毒上清液或浓缩载体原液(有或没有适当的生长因子和聚阳离子)培养(参见,例如,xu et al.,exp.hemat.22:223-230(1994);hughes,et al.j.clin.invest.89:1817-1824(1992))。
[0378]
通常,所选择的载体表现出高的感染效率和稳定的整合和表达(参见,例如,cayouette et al.,human gene therapy 8:423-430(1997);kido et al.,current eye research 15:833-844(1996);bloomer et al.,j.virol.71:6641-6649(1997);naldini et al.,science 272:263-267(1996);和miyoshi et al.,proc.natl.acad.sci.u.s.a.94:10319-10323(1997))。可以使用的其它病毒载体包含,例如,腺病毒、慢病毒和腺相关病毒载体、痘苗病毒、牛乳头瘤病毒衍生载体或疱疹病毒,如爱泼斯坦-巴尔二氏病毒(epstein-barr virus)(参见,例如,miller,hum.gene ther.1(1):5-14(1990);friedman,science 244:1275-1281(1989);eglitis et al.,biotechniques 6:608-614(1988);tolstoshev et al.,current opin.biotechnol.1:55-61(1990);sharp,lancet 337:1277-1278(1991);cornetta et al.,prog.nucleic acid res.mol.biol.36:311-322(1989);anderson,science 226:401-409(1984);moen,blood cells 17:407-416(1991);miller et al.,biotechnology 7:980-990(1989);le gal la salle et al.,science 259:988-990(1993);和johnson,chest 107:77s-83s(1995))。逆转录病毒载体发展得很好,并已被用于临床(rosenberg et al.,n.engl.j.med.323:370(1990);anderson et al.,u.s.pat.no.5,399,346)。
[0379]
用于表达本发明所公开的融合蛋白和/或合成受体的特别有用的载体包含已经用于人类基因疗法的载体。在一个非限制性实施方案中,载体是逆转录病毒载体。使用逆转录病毒载体在t细胞或其他免疫效应细胞(包括,工程t细胞)中表达已被描述(参见,scholler et al.,sci.transl.med.4:132-153(2012);parente-pereira et al.,j.biol.methods 1(2):e7(1-9)(2014);lamers et al.,blood 117(1):72-82(2011);reviere et al.,proc.natl.acad.sci.usa 92:6733-6737(1995))。在一个实施方案中,该载体是sgf逆转录病毒载体,例如sgfγ-逆转录病毒载体,其是基于moloney鼠白血病的逆转录病毒载体。sgf载体在前面已经描述过(参见,例如,wang et al.,gene therapy 15:1454-1459(2008))。
[0380]
本发明使用的载体采用合适的启动子以在特定宿主细胞中表达。启动子可以是诱导型启动子或组成型启动子。在一个特定实施方案中,表达载体的启动子在干细胞(例如,造血干细胞)中提供表达。在一个特定实施方案中,表达载体的启动子在免疫效应细胞(例如t细胞)中提供表达。非病毒载体也可以使用,只要载体含有适合在靶细胞中表达的表达元件。有些载体,如逆转录病毒载体,可以整合到宿主基因组中。如果需要,可以使用诸如核酸酶、转录激活因子样效应物核酸酶(talens)、锌指核酸酶(zfns)、规律成簇间隔短回文重复序列(crisprs)、同源重组、非同源末端连接、微同源介导的末端连接、同源介导的末端连接等技术来实现定点整合(gersbach et al.,nucl.acids res.39:7868-7878(2011);vasileva,et al.cell death dis.6:e1831.(jul 23 2015);sontheimer,hum.gene ther.26(7):413-424(2015);yao et al.cell research volume 27,801-814(2017))。
[0381]
载体和构建体可选地被设计成包含报道子。例如,载体可以被设计成表达报告蛋白,其可以用于识别包含所述载体或所述载体上提供的多核苷酸(例如,已整合到宿主染色体中的多核苷酸)的细胞。在一个实施方案中,报告子可与融合蛋白或合成受体作为双顺反子或多顺反子表达构建体表达。示例性报告蛋白包含但不限于荧光蛋白,如mcherry、绿色荧光蛋白(gfp)、蓝色荧光蛋白(例如ebfp、ebfp2、azurite和mkalamal)、青色荧光蛋白(例如,ecfp、cerulean和cypet)、以及黄色荧光蛋白(例如,yfp、citrine、venus和ypet)。
[0382]
可以使用常规分子生物学技术来测定本发明公开的融合蛋白或合成受体的转导效率。如果在构建体中包含了标记物(例如荧光蛋白),则可以通过facs分析来监测基因转移效率,以量化转导的(例如,gfp
)免疫效应细胞(如t细胞)的比例,和/或通过定量pcr监测基因转移效率。使用成熟的共培养系统(gade et al.,cancer res.65:9080-9088(2005);gong et al.,neoplasia 1:123-127(1999);latouche et al.,nat.biotechnol.18:405-409(2000)),可以确定表达癌抗原的成纤维细胞aapcs(与对照相比)是否引导从转导的免疫效应细胞(例如,表达car的t细胞(il-2、il-4、il-10、ifn-γ、tnf-α和gm-csf的细胞上清液luminex(austin tx)试验))释放细胞因子,t细胞增殖(通过羧基荧光素琥珀酰亚胺酯(cfse)标记)和t细胞存活(通过annexin v染色))。可以评价cd80和/或4-1bbl对t细胞存活、增殖和功效的影响。t细胞可暴露于癌抗原阳性靶细胞的重复刺激,并可确定t细胞增殖和细胞因子应答是随重复刺激保持相似还是减弱。癌抗原car构建体可以在等效试验条件下进行并排比较。可以使用铬释放试验进行多种e:t比值的细胞毒性试验。除了在免疫细胞中的用于表达的载体中提供编码本发明所公开的融合蛋白和/或合成受体的核酸之外,还可以在更适合遗传操纵的其它类型的载体中提供编码融合蛋白和/或合成受体的核酸,例如,在细菌细胞(如大肠杆菌)中的用于表达的各种构建体。此类载体可以是任何众所周知的表达载体,包含市售的表达载体(参见,sambrook et al.,molecular cloning:a laboratory manual,third ed.,cold spring harbor laboratory,new york(2001);和ausubel et al.,current protocols in molecular biology,john wiley and sons,baltimore,md(1999))。
[0383]
本发明还提供了对细胞进行基因工程改造以用于同种异体移植的方法,其包含使基因灭活。在一些实施方案中,本发明提供的方法包含使免疫细胞中对i类mhc分子或mhc样分子进行编码的至少一种基因灭活。在一些实施方案中,i类mhc分子选自由hla-a重链、hla-b重链、hla-c重链、hla-e重链、hla-f重链和hla-g重链组成的群组。在一些实施方案中,本发明提供的方法包含使编码β2m的基因灭活。在一些实施方案中,本发明提供的方法包含使编码mhc样分子的基因灭活,所述mhc样分子选自由cd1重链、mr1重链、fcrn重链和ul18组成的群组。
[0384]
基因灭可以使用本发明所公开的或本领域已知的任何方法进行。在一些实施方案中,基因灭活是通过dna剪切和修复、碱基编辑、rna干扰或rna编辑进行。在一些实施方案中,基因灭活是通过dna剪切进行,所述dna剪切使用稀有核酸内切酶,所述稀有核酸内切酶选自由rna定向核酸内切酶、tal核酸酶、归巢核酸内切酶、锌指核酸酶和mega-tal核酸酶。在一些实施方案中,基因灭活是通过dna剪切和修复进行。在一些实施方案中,通过使用crispr-cas系统进行dna剪切和修复。所述crispr-cas系统是crispr-cas9系统。
[0385]
碱基编辑
[0386]
在一些实施方案中,本发明提供的方法包括通过碱基编辑来使基因灭活。腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)或尿嘧啶(u)在核酸(dna或rna)中某些特定位点处的精确定点变化和转化导致特定位点的碱基从一个碱基变化到另一个碱基。
[0387]
引导编辑
[0388]
在一些实施方案中,本发明提供的方法包括通过引导编辑使基因灭活。引导编辑是一种“查找与替换”基因组编辑技术,介导定点插入、删除和所有可能的碱基间的转换。而且,其可以将不同类型的编辑相互结合。例如,引导编辑过程可以包含以下步骤:首先,经改造的pegrna(prime editing guide rna)与引导编辑器蛋白接合,该pegrna既指定靶位点又含有所需的编辑。此引导编辑器蛋白由与逆转录酶融合的cas9切口酶组成。蛋白质的cas9切口酶部分由pegrna引导至dna靶位点。经cas9切割后,逆转录酶结构域使用pegrna对所需编辑的模板进行逆转录,直接将dna聚合到带切口的靶dna链上。经编辑的dna链取代了原始dna链,创建了含有一条经编辑链和一条未经编辑链的异源双链。最后,编辑器引导异源双链的解体,以利于将之前的编辑复制到未经编辑的链上,从而完成所述过程(anzalone et al.nature(2019)doi:10.1038/s41586-019-1711-4)。
[0389]
rna干扰
[0390]
在一些实施方案中,本发明提供的方法包括通过rna干扰使基因灭活。rna干扰(rnai)可以用于减少靶基因的表达或使靶基因沉默。在一个实施方案中,例如,通过表达与靶基因mrna同源的双链rna或反义rna,特异性地诱导靶基因mrna的降解(或干扰其稳定性)或抑制靶基因mrna的翻译效率。
[0391]
dna剪切和修复
[0392]
在一些实施方案中,本发明提供的方法包括通过dna剪切和修复使基因灭活。dna剪切是指在双链dna靶序列位点处的一条或两条dna链断裂的方法。dna剪切可以通过使用例如核糖核酸酶、foki核酸内切酶、cas蛋白等进行。dna被剪切后,细胞修复剪切位点,例如,通过非同源末端连接(nhej)或同源重组(hr)。剪切位点附近的序列可以改变,并且可能会发生如插入和删除突变等错误。如果剪切位点在基因的外显子区或调控区,则所述基因的表达可以会减少和消除。
[0393]
锌指核酸酶(zfn)
[0394]
在一些实施方案中,本发明提供的方法包括通过使用锌指核酸酶(zfn)使基因灭活。锌指核酸酶由dna识别结构域和非特异性核酸内切酶组成。dna识别结构域由一系列串联连接的cys2-his2锌指蛋白组成,并且每个锌指单元包含约30个氨基酸用于特异性结合dna。非特异性核酸内切酶是foki核酸内切酶,其形成二聚体以切割dna。
[0395]
tal核酸酶(talen)
[0396]
在一些实施方案中,本发明提供的方法包括通过使用talen使基因灭活。talen是一种转录激活因子样效应物核酸酶。tale蛋白是dna结合结构域的核心组分,并且通常由多个串联的基本重复单元组成。经设计和经组合的系列单元可以特异性识别dna序列,并通过偶联foki核酸内切酶切割特定的dna序列。
[0397]
crispr/cas系统
[0398]
在一些实施方案中,本发明提供的方法包括通过使用crispr/cas系统使基因灭活。crispr/cas系统是一种核酸酶系统,其由规律成簇间隔短回文重复序列(crispr)和
crispr结合蛋白(即cas蛋白)组成,它可以切割真核细胞中几乎所有与原型间隔区相邻基序(pam)相邻的基因组序列(cong et al.science 2013.339:819-823)“crispr/cas系统”被用来统称涉及crispr相关(“cas”)基因的转录本,以及涉及其表达或指导其活性的其他元件,包括编码cas基因的序列、tracr(反式激活的crispr)序列(例如,tracrrna或活性部分tracrrna)、tracr配对序列(在内源性crispr系统的背景中,覆盖“直接重复”和加工的部分直接重复)、引导序列或来自crispr位点和转录本的其他序列。一般来说,crispr系统的特征是在靶序列的位点促进crispr复合物的形成的元件(在内源性crispr系统中也称为前间隔区)。
[0399]
crispr复合物(包括与靶序列杂交的引导序列并与一种或多种cas蛋白复合)的形成导致靶序列中或靠近靶序列(例如,在1、2、3、4、5、6、7、8、9、10、20、50或更多碱基对内)的一条或两条链的剪切。tracr序列(其可以包括所有或部分野生型tracr序列,或由所有或部分野生型tracr序列组成(例如,约或多于约20、26、32、45、48、54、63、67、85或更多野生型tracr序列的核苷酸)也可以形成crispr复合物的一部分,例如,将沿着至少部分tracr序列与全部或部分tracr配对序列杂交,其中,tracr配对序列与引导序列可操作连接。在一些实施方案中,tracr序列与tracr配对序列充分互补以杂交并参与crispr复合物的形成。在一些实施方案中,当进行最佳比对时,tracr序列沿tracr配对序列的长度具有至少50%、60%、70%、80%、90%、95%或99%的序列互补性。在一些实施方案中,将驱动crispr系统的一种或多种元件的表达的一种或多种载体被引入到宿主细胞中,使得crispr系统的元件的表达引导crispr复合物在一个或多个靶位点处的形成。
[0400]
一般而言,tracr配对序列与tracr序列具有足够的互补性以促进crispr复合物在靶序列处的形成,其中,所述crispr复合物包括与tracr序列杂交的tracr配对序列。通常,互补程度是指tracr配对序列和tracr序列沿两个序列中较短序列的长度的最佳比对。最佳比对可以通过任何合适的比对算法来确定,并且可以进一步考虑二级结构的影响,例如tracr序列或tracr配对序列内的自互补。在进行最佳比对时,tracr序列与tracr配对序列沿两个序列中较短序列的长度的互补程度约为或大于约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更高。tracr序列在序列中具有约或多于约5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、40个、50个或更多个核苷酸。
[0401]
cas蛋白的非限制性示例包含cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9(也被称为csn1和csxl2)、cas10、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csxl5、csf1、csf2、csf3、csf4同源物或其修饰形式。在一些实施方案中,cas蛋白是cas9蛋白。
[0402]
cas9,也被称为csn1,是一种参与crrna生物合成和破坏入侵dna的巨型蛋白。cas9已经在不同的细菌物种中得到描述,如嗜热链球菌、无害李斯特氏菌(listeria innocua)(gasiunas,barrangou et al.2012;jinek,chylinski et al.2012)以及化脓性链球菌(s.pyogenes)(deltcheva,chylinski et al.2011)。巨型cas9蛋白(超过1200个氨基酸)含有两个预测的核酸酶结构域,即位于蛋白质中间的hnh(mcra样)核酸酶结构域和分裂的ruvc样核酸酶结构域(rnaase h-折叠)(makarova,grishin et al.(2006))。cas9变体可以
是非天然存在于自然界并且通过蛋白质工程改造或通过随机突变获得的cas9核酸内切酶。例如,根据本发明的cas9变体可以通过化脓性链球菌cas9核酸内切酶(cog3513)的氨基酸序列中至少一个残基的删除、插入或取代等突变获得。在一些实施方案中,cas9蛋白是肺炎链球菌、化脓性链球菌或嗜热链球菌cas9,并且可以包含源自这些生物体的突变cas9,或将其它氨基酸序列连接到cas9的变体,例如,将foki酶连接到cas9的变体。这些cas9是已知的;例如,化脓性链球菌cas9蛋白的氨基酸序列可以在swissprot数据库中找到,登录号为q99zw2;脑膜炎奈瑟菌cas9蛋白的氨基酸序列可以在uniprot数据库中找到,登录号为a1iq68;s嗜热菌cas9蛋白的氨基酸序列可以在uniprot数据库中找到,编号为q03lf7;金黄色葡萄球菌casg蛋白的氨基酸序列可以在uniprot数据库中找到,编号为j7rua5。
[0403]
可以明确设想到,本发明所述的或本领域其它已知的各种方法的组合和排列可以用于制备本发明所公开的基因工程细胞。
[0404]
6.8治疗方法
[0405]
本发明提供的基因工程细胞可以用于同种异体移植,并且不太可能被受体的免疫系统排斥,这至少是因为在细胞上表达的融合蛋白可以形成与受体免疫细胞上的抑制性受体结合的mhc复合物,以防止其对同种异体移植的激活。
[0406]
在一些实施方案中,本发明提供了基因工程细胞在同种异体移植中的用途,其中,所述细胞表达融合蛋白,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。本发明还提供了向有需要的受试者提供同种异体细胞移植的方法,包括向受试者施用治疗有效量的基因工程细胞,其中,所述细胞表达融合蛋白,所述融合蛋白包括通过连接子共价连接的呈递肽和β2m肽。基因工程细胞可以是在本发明第6.5部分中所公开的任何基因工程细胞。融合蛋白可以是在本发明第6.2部分中所公开的任何融合蛋白。
[0407]
在一些实施方案中,本发明提供了基因工程细胞在同种异体移植中的用途,其中,所述细胞包括本发明所公开的核酸。本发明还提供了在有需要的受试者中提供同种异体细胞移植的方法,所述方法包括向受试者施用治疗有效量的基因工程细胞,其中,所述细胞包括本发明所公开的核酸。
[0408]
在一些实施方案中,接受治疗的受试者是人。在一些实施方案中,受试者是需要同种异体移植的人。
[0409]
融合蛋白、核酸、细胞以及他们的生产方法在以上部分中已经详细公开。出于说明性的目的,本发明提供了基因工程细胞在同种异体移植中的用途,其中,所述细胞包括对融合蛋白进行编码的核酸,所述融合蛋白包括通过(g4s)3连接子与人β2m共价连接的hla-e限制性呈递肽。融合蛋白可以结合内源性表达的hla-e重链以在基因工程细胞表面上形成hla-e复合物,其可以与免疫细胞(例如,nk细胞)上的抑制性受体(例如,nkg2a)结合以抑制其针对基因工程细胞的潜在细胞毒性活性。
[0410]
因此,本发明提供了将治疗有效量的本发明所公开的基因工程细胞施用于需要此类细胞作为同种异体移植物的受试者的方法。本发明还提供了本发明所公开的基因工程细胞用于制备同种异体移植物的用途。包括本发明提供的细胞的同种异体移植物不太可能被受体排斥,这至少是因为在细胞中表达的融合蛋白提供了抑制潜在同种异体免疫应答的机制。在一些实施方案中,本发明提供了通过向受试者施用治疗有效量的本发明提供的细胞来向有需要的受试者提供同种异体移植物的方法。在一些实施方案中,本发明提供了降低
向受试者施用的细胞触发受试者的同种异体免疫应答的可能性的方法。在一些实施方案中,本发明提供了降低受试者的同种异体应答的方法。在一些实施方案中,本发明提供的方法降低同种异体移植排斥的发生。
[0411]
本发明所公开的施用细胞的方法可以适用于期望施用此类细胞的任何情景。在一些实施方案中,需要施用细胞的受试者患有病症。例如,受试者可能患有特定细胞功能或数量减少的病症,因此期望施用从健康或正常个体(其中,特定细胞的功能正常)中获得的功能细胞并且向受试者施用足够数量的健康细胞以恢复由这些细胞提供的功能(例如,细胞数量或功能减少的激素产生细胞、细胞数量或功能减少的免疫细胞等)。在此类情况下,健康细胞可以如本发明所公开的那样进行改造以降低健康细胞的宿主排斥的可能性。在一些实施方案中,病症是遗传病症。在一些实施方案中,病症是感染病症。在一些实施方案中,病症是hiv感染或aids。在一些实施方案中,病症是癌症。
[0412]
本发明所公开的方法在再生医学中特别有帮助。例如,需要干细胞移植的患者可以受益于本发明所公开的基因工程细胞。在一些实施方案中,本发明提供了通过向受试者施用治疗有效量的本发明提供的干细胞来向有需要的受试者提供同种异体干细胞的方法。本发明还提供了本发明所公开的基因工程干细胞用于制备干细胞移植物的用途。在一些实施方案中,基因工程干细胞在施用于有需要的受试者之前分化成期望的细胞类型。出于说明性目的,可以从这些细胞疗法中受益的人包含患有脊髓损伤、1型糖尿病、帕金森病、肌萎缩侧索硬化、阿尔茨海默病、心脏病、中风、烧伤、癌症和骨关节炎的患者。在一些实施方案中,本发明提供了通过向受试者施用治疗有效量的本发明提供的细胞来治疗可以受益于同种异体细胞疗法的受试者的方法。在一些实施方案中,受试者可能患有脊髓损伤、1型糖尿病、帕金森病、肌萎缩侧索硬化、阿尔茨海默病、心脏病、中风、烧伤、癌症或骨关节炎。
[0413]
本发明提供了在同种异体移植中使用表达本发明所述融合蛋白的细胞(例如,t细胞)的方法。在一些实施方案中,基因工程细胞可以在被施用于有需要的受试者之前扩增。细胞可作为表达本发明所述的融合蛋白的细胞群施用。可选地,待施用的细胞可以被纯化或富集。在一些实施方案中,受试者需要器官移植,并且可以使用本发明所公开的基因工程干细胞开发同种异体器官移植物。因此,本发明还提供了在允许器官发育的适当条件下通过培养本发明所公开的基因工程干细胞来提供同种异体器官移植物的方法。
[0414]
在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的基因工程细胞来向有需要的受试者提供造血干细胞和/或祖细胞的方法,其中,所述细胞是造血干细胞和/或祖细胞。受试者可能需要骨髓移植物,并且本发明还提供了本发明所公开的基因工程细胞用于制备骨髓移植物的用途。基因工程造血干细胞和/或祖细胞可以是cd34 动员外周血细胞、cd34 脐带血细胞或cd34 骨髓细胞。
[0415]
在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的细胞来治疗癌症的方法。本发明还提供了本发明所公开的基因工程细胞在癌症治疗中的用途。本发明还提供了本发明所公开的基因工程细胞在制备用于治疗癌症的药物中的用途。细胞可以是免疫细胞。细胞可以是白细胞,包含,例如髓样细胞(myeloid cells)、淋巴样类细胞(lymphoid cells)、粒细胞(如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、淋巴细胞(如t细胞、b细胞、nk细胞、nkt细胞)、浆细胞、树突状细胞、单核细胞或由其分化的细胞(例如,巨噬细胞)。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗
有效量的本发明提供的基因工程免疫细胞来治疗癌症的方法。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的基因工程t细胞来治疗癌症的方法。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的基因工程nk细胞来治疗癌症的方法。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的基因工程巨噬细胞来治疗癌症的方法。
[0416]
在一些实施方案中,本发明还提供了本发明所公开的基因工程免疫细胞在制备用于癌症治疗的药物中的用途。在另一个实施方案中,所述方法可以包含向有需要的受试者施用癌抗原特异性免疫细胞,其中,所述细胞重组表达本发明所公开的融合蛋白和包括特异性结合癌抗原的抗原结合结构域的合成受体。癌抗原可以是本发明所公开的或本领域已知的任何癌抗原。在一些实施方案中,癌抗原选自由cd19、cd20、cd22、cd30、cd123、cd138、cd33、cd70、bcma、cs1、c-met、il13ra2、egfrviii、cea、her2、gd2、mage、gpc3、间皮素、psma、ror1、egfr、muc1和ny-eso-1组成的群组。在一些实施方案中,合成受体是car、tcr、truc、tac、abtcr或嵌合cd3受体。
[0417]
在一些实施方案中,本发明还提供了本发明所公开的基因工程t细胞在制备用于癌症治疗的药物中的用途,其中,所述基因工程t细胞表达合成受体。在一些实施方案中,基因工程t细胞表达car。例如,本发明提供的是可以用于癌症治疗的通用car-ts。在一些实施方案中,基因工程t细胞表达tcr。在一些实施方案中,基因工程t细胞表达truc。在一些实施方案中,基因工程t细胞表达tac。在一些实施方案中,基因工程t细胞表达abtcr。在一些实施方案中,基因工程t细胞表达嵌合cd3受体。
[0418]
在一些实施方案中,本发明提供的免疫细胞可以用于同种异体移植。免疫细胞可以是白细胞,包含,例如髓样细胞(myeloid cells)、淋巴样类细胞(lymphoid cells)、粒细胞(如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、淋巴细胞(如t细胞、b细胞、nk细胞、nkt细胞)、浆细胞、树突状细胞、单核细胞或由其分化的细胞(例如,巨噬细胞)。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的t细胞来治疗受试者的癌症的方法。在一些实施方案中,本发明提供了通过向有需要的受试者施用治疗有效量的本发明提供的car-t细胞来治疗受试者的癌症的方法。本发明还提供了本发明所公开的基因工程t细胞在癌症治疗中的用途。本发明还提供了本发明所公开的基因工程t细胞在制备用于癌症治疗的药物中的用途。
[0419]
例如,所述方法可以用于治疗癌症或减少受试者的肿瘤负荷。在一个实施方案中,本发明提供的方法用于治疗癌症。应当理解的是,治疗癌症的方法可以包含任何改善与癌症相关的病征或症状的效果。此类病征或症状包含,但不限于,降低肿瘤负荷,包含抑制肿瘤生长、减缓肿瘤生长速度、减小肿瘤大小、减少肿瘤数量、消除肿瘤、所有这些都可以使用本领域众所周知的常规肿瘤成像技术来测量。与癌症相关的其它病征或症状包含,但不限于,疲劳、疼痛、体重减轻以及与各种癌症相关的其它病征或症状。在一个非限制性示例中,本发明的方法可以减少肿瘤负荷。因此,施用本发明的细胞可以减少受试者的肿瘤细胞数量、减小肿瘤大小和/或根除肿瘤。
[0420]
在本发明提供的方法中,将免疫细胞施用于需要癌症治疗的受试者。所述受试者可以是哺乳动物,具体地,所述受试者是人。优选地,所述受试者是人。适合接受治疗人受试者包含那些患有临床可测量肿瘤(包括,“晚期疾病”或“高肿瘤负荷”)的受试者。临床上可
测量肿瘤是可以基于肿瘤肿块来检测的肿瘤,例如,通过触诊、cat扫描、超声、乳腺图像、x射线等。阳性生化或组织病理学标志物也可以用于鉴定这些人群。将包括本发明提供的细胞的药物组合物施用于受试者以引发抗癌应答,以缓解受试者的病状。具有肿瘤的受试者的肿瘤肿块的减少可以发生,但任何临床改善都构成益处。临床改善包括降低肿瘤的风险或进展速度或减少病理后果。
[0421]
另一组合适的受试者可以是有癌症病史但对另一种治疗模式有反应的受试者。先前的治疗可以包含,但不限于,外科手术切除、放射疗法和传统化疗。因此,这些个体没有临床可测量的肿瘤。然而,他们被怀疑有疾病进展的风险,要么是靠近原始肿瘤部位,要么是通过转移。这个组可以进一步细分为高风险和低风险个体。细分是根据在最初处理之前或之后观察到的特征进行的。这些特征在临床领域中是已知的,并且这些特征被适当地定义用于不同类型的癌症。高风险亚组的典型特征是肿瘤侵犯邻近组织,或显示淋巴结转移。可选地,可以施用本发明提供的细胞进行预防性治疗,以防止疑似有癌症易感性受试者发生癌症,例如,基于家族史和/或基因检测。
[0422]
受试者可能患有晚期疾病,在这种情况下,治疗目标可以包含减轻或逆转疾病进展,和/或减轻副作用。受试者可以有已接受治疗的疾病史,在这种情况下,治疗目标可以是降低或延迟复发的风险。此外,可以使用本发明提供的细胞治疗难治性或复发性恶性肿瘤。
[0423]
将本发明提供的细胞施用于需要癌症治疗的受试者,如人受试者。癌症可以涉及实体瘤,或不涉及实体瘤的血癌。使用本发明的细胞治疗的癌症包括通常对免疫治疗有反应的癌症。癌症的示例性类型包含,但不限于,癌、肉瘤、白血病、淋巴瘤、多发性骨髓瘤、黑色素瘤、脑和脊髓肿瘤、生殖细胞肿瘤、神经内分泌肿瘤、类癌瘤等。癌症可以是实体瘤,或不形成实体瘤的血癌。在实体瘤的情况下,肿瘤可以是原发性肿瘤或转移性肿瘤。
[0424]
可以使用本发明提供的方法治疗的其它瘤形成或癌症的实例包含骨癌、肠癌、肝癌、皮肤癌、头颈癌、黑色素瘤(皮肤或眼内恶性黑色素瘤)、肾癌(例如,透明细胞癌)(renal cancer)、咽喉癌、前列腺癌(例如,激素难治性前列腺腺癌)、血癌(例如,白血病、淋巴瘤和骨髓瘤)、子宫癌、直肠癌、肛门区癌、膀胱癌、脑癌、胃癌、睾丸癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、白血病(例如,急性白血病、急性淋巴细胞白血病、急性髓细胞白血病、急性粒细胞白血病、急性早幼粒细胞白血病、急性粒单核细胞白血病、急性单核细胞白血病、急性红白血病、慢性白血病、慢性粒细胞白血病、慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤(霍奇金病(hodgkin's disease)、非霍奇金病、瓦尔登斯特伦巨球蛋白血症(waldenstrom's macroglobulinemia))、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、淋巴细胞性淋巴瘤、肾癌或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波西肉瘤(kaposi's sarcoma)、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境因素诱发的癌症(包括由石棉诱导的癌症)、重链疾病和实体瘤(例如,肉瘤和癌),例如,纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜肉瘤、间皮瘤、尤文氏肉瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、肾母细胞瘤(wilm's tumor)、宫颈癌、子宫癌、睾丸癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管
瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质胶质瘤、神经鞘瘤、脑膜瘤、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤。
[0425]
在一个实施方案中,本发明提供的方法用于治疗选自以下的癌症:恶性胸膜疾病、间皮瘤、肺癌(例如,非小细胞肺癌)、胰腺癌、卵巢癌、乳腺癌(例如,转移性乳腺癌、转移性三阴性乳腺癌)、结肠癌、胸膜肿瘤、胶质母细胞瘤、食道癌、胃癌和滑膜肉瘤。本发明提供了特别适用于治疗实体瘤的疗法,例如恶性胸膜疾病、间皮瘤、肺癌、胰腺癌、卵巢癌、乳腺癌、结肠癌、胸膜肿瘤、胶质母细胞瘤、食道癌、胃癌和滑膜肉瘤。实体瘤可以是原发性肿瘤或处于转移状态的肿瘤。
[0426]
对于治疗而言,所施用的量是产生期望效果的有效量。有效量或治疗有效量是足以在治疗后提供有益或期望的临床结果的量。有效量可以在单次施用或一系列施用(一个或多个剂量)中提供。有效量可以以快速输注(bolus)或通过连续灌注来提供。就治疗而言,有效量是足以缓解、改善、稳定、逆转或减缓疾病进展,或以其它方式减轻疾病的病理性后果的量。有效量可以由医生为特定受试者确定。在确定实现有效量的适当剂量时,通常要考虑若干因素。这些因素包含受试者的年龄、性别和体重、正在治疗的病情、病情的严重程度以及所施用的本发明的细胞的形式和有效浓度。
[0427]
本发明提供的细胞通常可以基于被施用细胞的受试者的体重以每千克细胞(cell/kg)的剂量给药。通常,通常细胞剂量在约104到10
10
cell/kg体重,例如,约105到约109、约105到约108、约105到约107或约105到106,这取决于给药的方式和位置。通常,在全身给药的情况下,使用比区域给药更高的剂量,其中,在肿瘤区域施用本发明的免疫细胞。示例性的剂量范围包含但不限于1
×
104到1
×
108、2
×
104到1
×
108、3
×
104到1
×
108、4
×
104到1
×
108、5
×
104到1
×
108、6
×
104到1
×
108、7
×
104到1
×
108、8
×
104到1
×
108、9
×
104到1
×
108、1
×
105到1
×
108,例如,1
×
105到9
×
107、1
×
105到8
×
107、1
×
105到7
×
107、1
×
105到6
×
107、1
×
105到5
×
107、1
×
105到4
×
107、1
×
105到3
×
107、1
×
105到2
×
107、1
×
105到1
×
107、1
×
105到9
×
106、1
×
105到8
×
106、1
×
105到7
×
106、1
×
105到6
×
106、1
×
105到5
×
106、1
×
105到4
×
106、1
×
105到3
×
106、1
×
105到2
×
106、1
×
105到1
×
106、2
×
105到9
×
107、2
×
105到8
×
107、2
×
105到7
×
107、2
×
105到6
×
107、2
×
105到5
×
107、2
×
105到4
×
107、2
×
105到3
×
107、2
×
105到2
×
107、2
×
105到1
×
107、2
×
105到9
×
106、2
×
105到8
×
106、2
×
105到7
×
106、2
×
105到6
×
106、2
×
105到5
×
106、2
×
105到4
×
106、3
×
105到3
×
106cells/kg等。此类剂量范围对于区域给药特别有用。在特定实施方案中,以1
×
105到1
×
108,例如1
×
105到1
×
107、1
×
105到1
×
106、1
×
106到1
×
108、1
×
106到1
×
107、1
×
107到1
×
108、1
×
105到5
×
106,具体地,以1
×
105到3
×
106或3
×
105到3
×
106cells/kg的剂量用于区域给药,例如胸腔内给药。示例性的剂量范围还可以包含但不限于5
×
105到1
×
108,例如,6
×
105到1
×
108、7
×
105到1
×
108、8
×
105到1
×
108、9
×
105到1
×
108、1
×
106到1
×
108、1
×
106到9
×
107、1
×
106到8
×
107、1
×
106到7
×
107、1
×
106到6
×
107、1
×
106到5
×
107、1
×
106到4
×
107、1
×
106到3
×
107cells/kg等。此类剂量对于全身给药特别有用。在特定实施方案中,以1
×
106到3
×
107cells/kg的剂量提供细胞以用于全身给药。示例性的细胞剂量包含但不限于1
×
104、2
×
104、3
×
104、4
×
104、5
×
104、6
×
104、7
×
104、8
×
104、9
×
104、1
×
105、2
×
105、3
×
105、4
×
105、5
×
105、6
×
105、7
×
105、8
×
105、9
×
105、1
×
106、2
×
106、3
×
106、4
×
106、5
×
106、6
×
106、7
×
106、8
×
106、9
×
106、1
×
107、2
×
107、3
×
107、4
×
107、5
×
107、6
×
107、7
×
107、8
×
107、9
×
107、1
×
108、2
×
108、3
×
108、4
×
108、5
×
108、6
×
108、7
×
108、8
×
108、9
×
108、1
×
109的剂量并且在约104到约10
10
cells/kg的范围内。此外,还可以调整剂量,以考虑是否以单次给药或是否以多次给药。如上所述,精确确定什么是有效剂量可以基于每个受试者的个人因素,包括他们的体型、年龄、性别、体重和特定受试者的状况。本领域技术人员可以根据本发明的公开和本领域现有知识容易地确定剂量。
[0428]
本发明提供的细胞可以通过本领域已知的任何方法给药,包括但不限于胸腔给药、静脉给药、皮下给药、结内给药(intranodal administration)、瘤内给药、鞘内给药、胸膜内给药、腹膜内给药、颅内给药和胸腺直接给药。在一个实施方案中,本发明提供的细胞可以使用众所周知的方法局部递送到肿瘤,包括但不限于肝或主动脉泵;四肢、肺或肝灌注;在门静脉;通过静脉分流;在肿瘤附近的腔内或血管等。在另一个实施方案中,本发明提供的细胞可以全身给药。在一个优选实施方案中,细胞在肿瘤部位局部给药。所述细胞也可以在瘤内给药,例如,通过在肿瘤部位和/或进入肿瘤血管系统直接注射细胞。例如,在恶性胸膜疾病、间皮瘤或肺癌的情况下,最好通过胸膜内给药(参见,adusumilli et al.,science translational medicine 6(261):261ra151(2014))。本领域技术人员可以基于要治疗的肿瘤的类型和/或位置来选择合适的给药方式。所述细胞可通过注射或导管导入。在一个实施方案中,对有需要的受试者进行胸膜内给药,例如,使用胸膜内导管。可选地,可选择在细胞给药前、给药期间或给药后给予受试者扩增/或分化剂,以增加本发明提供的体内细胞生成。
[0429]
本发明提供的细胞的增殖通常在施用于受试者之前离体进行,并且在施用于受试者之后在体内可能是可取的(参见,kaiser et al.,cancer gene therapy 22:72-78(2015))。细胞增殖应该伴随着细胞存活,以允许细胞(例如,t细胞)扩增和持续存在。
[0430]
本发明提供的方法可以进一步包括在用本发明提供的细胞进行治疗之前、期间或之后组合使用的附加治疗。因此,本发明提供的细胞治疗方法可以和其它标准癌症护理和/或疗法一起使用,这些其它标准癌症护理和/或疗法与本发明提供的细胞的施用相容。
[0431]
本发明在此使用确定的语言来描述众多实施方案。本发明还具体包括完全或部分排除特定主题的实施方案,例如物质或材料、方法步骤和条件、方案、程序、测定或分析。因此,即使本发明一般不以本发明不包括的内容来表达,但在本发明中没有明确包含的方面仍然在本发明中披露
[0432]
本发明描述了本发明的特定实施方案,包括发明人已知的用于实施本发明的最佳模式。在阅读了上述描述后,于从事本领域工作的人来说,所公开的实施方案的变化将变得显而易见,并且期望那些熟练的技术人员可以适当地采用这种变化。因此,本发明旨在以不同于本发明具体描述的方式实施,并且本发明包括在适用法律允许的情况下对所附权利要求书中提到的主题的所有修改和等同物。此外,除非本发明另有说明或与上下文明显矛盾,否则本发明涵盖上述要素的所有可能变化形式的任何组合。
[0433]
在本说明书中引用的所有出版物、专利申请、登录号和其他参考文献都以全文引用的方式并入本说明书中,其程度相当于每个单独的出版物或专利申请通过引用的方式被具体和单独引入本发明。提供本发明讨论的出版物仅用于它们在本技术的申请日之前的公开。本发明一些实施方案的描述中对任何参考的引用或辨识不应解释为承认此参考可用作本发明的现有技术。此外,所提供的出版日期可能与实际出版日期不同,需要独立确认。
[0434]
已经描述了本发明的多个实施方案。然而,应当理解的是,在不脱离本发明的精神和范围的情况下可以进行各种修改。因此,实验中的描述旨在说明但不限制权利要求中描述的本发明的范围。
[0435]
7.实例
[0436]
7.1实验概述
[0437]
同种异体移植排斥是同种异体器官移植或同种异体细胞移植失败的主要原因。nk细胞介导的同种异体应答,包含移植细胞的细胞溶解,是此排斥的重要因素(li,transplantation.2010;90(10):1043-1047)。通用的car-t疗法有克服自体移植的缺点的潜力,但也面临同种异体排斥的挑战。下文所述的研究说明了本发明所公开的基因工程细胞的制备,所述基因工程细胞表达融合蛋白,所述融合蛋白包括与人β2m共价连接的呈递肽。本发明所说明的一些细胞是共表达特异性识别肿瘤抗原的car的t细胞。如下文详细描述的,本发明提供的细胞示出了在同种异体环境中更好的存活率和增强的细胞增殖。具体地,本发明提供的细胞示出了对nk细胞介导的细胞溶解具有抗性。另外,表达本发明提供的融合蛋白的car-t细胞也被证明在同种异体环境中抑制肿瘤细胞生长和促进肿瘤细胞死亡的活性大大增强。
[0438]
缩写的含义如下:“h”是指小时,“min”是指分钟,“s”是指秒,“ms”是指毫秒,“d”是指天,“μl”是指微升,“ml”是指毫升,“l”是指升,“bp”是指碱基对,“mm”是指毫摩尔每升,“μm”是指微摩尔每升。
[0439]
7.2材料与方法
[0440]
通常,用于制备工程改造细胞的方法包括以下步骤:(i)在细胞表面表达本发明所公开的融合蛋白;所述融合蛋白包括:(a)呈递肽;(b)β2m肽;以及(c)将上述(a)和(b)共价连接的连接子序列。所述方法可选地进一步包括:(ii)减少内源性i类mhc分子在细胞表面的表达。在一些实施方案中,使对i类mhc分子进行编码的基因突变或将该基因敲除。上述步骤(i)和(ii)的顺序可以互换。
[0441]
慢病毒制备:可以使用三质粒系统,包含:慢病毒靶向表达质粒(addgene id:#12252),其中gfp表达盒被各种表达盒替换以表达car和融合蛋白;以及包装辅助质粒pspax2(addgene id:#12260)和pmd2.g(addgene id:#12259)。病毒包装可以在hek293t细胞(shanghai institute of cell research,chinese academy of sciences)中进行。制备过程可以如下:将冻存的工作细胞中的hek293t细胞解冻,在10cm培养皿中用dmem培养基( 10%fbs 1%p/s)(cellgro10-013-cmr)培养,并在培养2天后更换培养基。一旦融合,细胞就可以进行传代(例如,将1个完整板的细胞重新铺设到5个板),并且可以用质粒转染第4次传代的细胞。可以使用pei作为转染试剂进行转染(例如,pei与质粒的质量比为2:1)。将质粒和pei的混合物添加到opti-mem培养基(gibco,cat#31985-070)中,然后将混合溶液添加到第4次传代的hek293t细胞中。在转染后6小时,将原来的培养基替换为含有2%fbs的新鲜培养基,然后使细胞连续培养72小时,再收集hek293t细胞的上清液。将收集的病毒上清液通过超速离心机浓缩(例如,以82200g在2℃到8℃的温度下持续2小时),然后将浓缩的病毒通过0.22μm过滤膜进行过滤来灭菌,并重新悬浮以供使用。
[0442]
载体构建:将靶基因(例如,对单独的car进行编码或对car和本发明所公开的融合蛋白进行编码)克隆到慢病毒载体中。慢病毒载体包括长末端重复的5'ltr和截短的3'ltr、
rre、rev应答元件(cppt)、中央终止序列(cts)和whv转录后调控元件(wpre)。融合蛋白可以由ef-1a(延伸因子-1a)启动子组成性表达,并通过bmhi和sali酶切克隆到慢病毒载体。
[0443]
初始t细胞激活:初始t细胞可以源自健康的人类志愿者的外周血(pbmc)。使用的培养基可以是完全培养基,即immunocult
tm-xf t细胞扩增培养基(stem cell technology,cat#10981) 300iu/ml il2(cayan,cat#heilp-0201c)。使用dynabeads(thermo,cat#11 141d)激活t细胞,并且dynabeads与细胞的比率为3:1。激活后24小时,t细胞明显团聚并增大。
[0444]
t细胞的慢病毒转导:在初始t细胞被激活后的24小时到72小时,细胞团聚并增大,并处于有丝分裂期以进行慢病毒转导。病毒转导单元与细胞数的比率可以为10:1,即,moi=10。转导后48小时即可进行蛋白表达检测。
[0445]
基因编辑:t细胞激活后4天,或用病毒转导t细胞后2天,收集细胞并用电穿孔缓冲液(thermo,试剂盒中的重悬缓冲液t cat#mpk 1096)、opti-mem(gibco,cat#31985-070)等洗涤3次。将细胞在电穿孔缓冲液中重新悬浮,并将细胞密度调整为1
×
108/ml。将所需的sgrna(总计300到400ng)和1μg cas9蛋白在体外均匀混合,并在室温下培育10分钟,然后将混合物添加到重新悬浮的细胞中。用于电穿孔的细胞的总体积可以为10μl,并且可以使用neon电穿孔系统(thermo,cat#mpk1096)进行电穿孔。电击的脉冲电压、脉冲持续时间和脉冲数可以为如下:1200到1600v、10毫秒以及3次。可以根据相关网站的预测分析设计sgrna的可行序列;cas9蛋白可以源自idt dna技术公司(idt dna technology company)的alt-r s.p.cas9核酸酶3nls蛋白(idt,cat#1074181)。
[0446]
表达融合蛋白的ucar-t细胞:t细胞激活、病毒转导和基因编辑方法如上所述。示例性的过程如下:在第0天,进行初始pbmc激活;在第2天,进行病毒转导(用于表达融合蛋白);在第4天,进行基因编辑(敲除trac和β2m),并且在第6天到第7天,通过流式细胞术检测每种蛋白的表达。
[0447]
材料:使用的示例性抗体和细胞染料:抗cd3-apc(bd,555335)、抗cd3-fitc(bd,555916)、抗β2m-pe(bd,551337)、抗β2m-fitc(bd,551338)、抗hla-abc-apc(r&d,fab7098a)、抗hla-e-pe(biolegend,342604)、抗hla-e-apc(biolegend,342606)、抗小鼠fmc63(shanghai xingwan,r19pb-100)和染料efluor
tm
670(ebioscience,65-0840-90)、抗hla-abc pe-cy7(invitrogen,25-9983-42)、抗αβ-tcr pe(biolegend,306708)。
[0448]
7.3表达融合蛋白的通用car-t细胞(“ucar-t-cm”)的制备
[0449]
car19-p2a-cm、car19-p2a-cm-c和car19慢病毒靶向表达质粒的构建:
[0450]
构建了具有单独的car19(即,包括特异性地结合肿瘤抗原cd19的抗原结合结构域的car)的慢病毒靶向表达质粒或同时具有car19和融合蛋白(或“嵌合分子”,“cm”)的慢病毒靶向表达质粒。此处使用的融合蛋白(cm)从n端到c端具有以下组分:20-a.a.信号肽(seq id no:3)、呈递肽、连接子序列ggggsggggsggggs(seq id no:1)、β2m成熟形式肽(seq id no:81)。car19和cm通过对p2a肽(atnfsllkqagdveenpgp;seq id no:105)进行编码的序列连接,p2a肽是一种自剪切多肽,通常用于同时表达来自同一载体的两个或两个以上的独立多肽。从同一质粒共表达后,p2a肽的自我剪切使与其连接的两种多肽得以分离并独立发挥作用。对于car19-p2a-cm,如seq id no:5所示的融合蛋白(cm)包括hla-e限制性呈递肽(vmaprtvll;seq id no:38)。对car19-p2a-cm进行编码的核酸序列是seq id no:12。除了
融合蛋白(cm-c)包括hla-c限制性呈递肽iidksgstv(seq id no:117)之外,car19-p2a-cm-c在其它方面与car19-p2a-cm相同。对car19-p2a-cm-c进行编码的核酸序列是seq id no:19。
[0451]
病毒表达质粒(addgene id:#12252)用bamhi/sall ahd酶切后用作主链。将car19序列(seq id no:20)、car19-p2a-cm序列(seq id no:12)或car19-p2a-cm-c序列(seq id no:19)克隆到主链中,分别形成car19-p2a-cm、car19-p2a-cm-c和car19表达质粒。如图1所示,包括对car19-p2a-cm(seq id no:12)进行编码的核苷酸序列的质粒可操作地插入到经酶切的病毒表达主链中。
[0452]
慢病毒制备:使用了三质粒系统,其由由以下组成:通过上述方法构建的慢病毒靶向表达质粒,以及包装辅助质粒pspax2(addgene id:#12260)和pmd2.g(addgene id:#12259)。病毒包装可以在hek293t细胞(shanghai institute of cell research,chinese academy of sciences)中进行。制备过程如下:将冻存的工作细胞中的hek293t细胞解冻,在10cm培养皿中用dmem培养基( 10%fbs 1%p/s)(cellgro 10-013-cmr)培养,并在培养2天后更换培养基。当达到融合时,将细胞进行传代(将1个完整板的细胞铺设到5个新的板上),并且用质粒转染第4次传代的细胞。将聚乙烯亚胺(pei)用作转染试剂,其中pei与质粒的质量比为2:1。然后将三种质粒和pei的混合物添加到opti mem培养基(gibco,cat#31985-070)中,并将混合的溶液添加到第4次传代的hek293t细胞中。在转染后6小时,将原来的培养基替换为含有2%fbs的新鲜培养基,然后将细胞连续培养持续72小时,再收集细胞培养物的上清液。通过超速离心机浓缩收集上清液中的病毒(以82200g在4℃到8℃下持续2小时),然后将浓缩的病毒通过0.22μm过滤膜进行过滤来灭菌,并重新悬浮以供使用。
[0453]
初始t细胞激活:初始t细胞源自健康的人类志愿者的外周血(pbmc)。使用完全培养基,即immunocult
tm-xf t细胞扩增培养基(stem cell technology,cat#10981) 300iu/ml il2(cayan,cat#heilp-0201c)。使用dynabeads(thermo,cat#11 141d)激活t细胞,并且dynabeads与细胞的比率为3:1。激活后24小时,t细胞明显团聚并增大。
[0454]
慢病毒基因转导:将激活持续48小时的3
×
l05个初始t细胞,或未激活的jurkat细胞(shanghai institute of cell research,chinese academy of sciences)接种于24孔培养板中,将制备的慢病毒添加到上述细胞中,其中,慢病毒的数量是细胞数量的10倍,即,moi=10(“感染复数”,病毒转导单元与细胞数量的比率),并补充培养基以使体积达到500μl(该培养基与用于激活上述初始t细胞的培养基相同)。24小时后,补充培养基以使体积达到1ml,以促进细胞生长。
[0455]
候选sgrna:设计并筛选了编辑b2m基因的sgrna和编辑trac基因的sgrna。sgrna(seq id no:8;seq id no:9)用于编辑b2m基因,并且sgrna(seq id no:10)用于编辑trac基因。
[0456]
cas9蛋白:使用来自idt dna技术公司的alt-r s.p.cas9核酸酶3nls蛋白。
[0457]
电穿孔:在用慢病毒转导初始t细胞或jurkat细胞48小时后,收集细胞,将细胞用电穿孔缓冲液(thermo,试剂盒中的重悬缓冲液t cat#mpk 1096)或opti mem(gibco,cat#31985-070)洗涤3次,并且将细胞在电穿孔缓冲液中重新悬浮。将细胞密度调整为1
×
108/ml。将β2m sgrna和trac sgrna(分别为150ng)和1μg cas9蛋白在体外均匀混合,在室温下培育10分钟,然后将混合物添加到重新悬浮的细胞中进行电穿孔。用于电穿孔的总体积为
10μl,并且使用neon电穿孔系统。电击的脉冲电压、脉冲持续时间和脉冲数如下:1200v和10毫秒,3次。
[0458]
病毒转导效率和基因编辑效率的测量:在电穿孔完成后3天,测量基因工程改造的效率。取少量细胞,用1ml pbs(gibco,cat#c10010500bt)洗涤一次。将细胞重新悬浮在100μl pbs中,并添加3μl抗fmc63抗体的一级抗体(检测car19),将混合物在4℃下培育30分钟。然后向混合物中添加1ml pbs,均匀混合后在350g下离心3分钟。收集细胞并丢弃上清液。依次向细胞中添加0.5μl二级抗体(一级抗体和二级抗体来自抗小鼠fmc63试剂盒,shanghai xingwan,r19pb-100)和3μl抗hla-e-apc抗体,均匀混合后在4℃下培育30分钟,添加1ml pbs,均匀混合,并在350g下离心3分钟。收集细胞并丢弃上清液,添加200μl pbs以将细胞重新悬浮,并通过流式细胞仪分析细胞。如图2所示,所有jurkat t细胞均使用如上文所述的crispr/cas9基因编辑敲除了trac和β2m。当用car19-p2a-cm病毒(图2,图区b)转导这些细胞时,具有hla-e特异性呈递多肽(cm)的融合蛋白在表面上表达car的细胞(右上象限的细胞)中有效表达,这是因为融合蛋白和car可操作地连接在一起。图区b中的car阳性细胞也对hla-e重链染色呈阳性,表明cm与hla-e重链结合以在细胞膜上形成复合物,这是因为cm缺乏hla-e重链。同时,在用car19-p2a-cm-c病毒转导并敲除了trac和β2m的细胞中,在细胞表面上仅检测到car表达,而未检测到hla-e重链表达,这表明表达hla-c限制性呈递多肽(cm-c)的融合蛋白未能与内源性hla-e重链形成复合物(图2,图区c)。
[0459]
为了测量初始t细胞中的基因编辑效率,取少量细胞,用1ml pbs洗涤一次,并重新悬浮在100μl pbs中。添加3μl抗hla-e-pe抗体、3μl抗hla-abc抗体和3μl抗cd3-fitc抗体。如图3的图区b所示,在如上所述的慢病毒转导和基因编辑之后,约80%的用car19-p2a-cm病毒转导并具有trac和β2m双敲除的初始t细胞(即ucar-t-cm细胞)对cd3和hla-abc呈双阴性。这些双阴性细胞还高度表达含有hla-e限制性呈递肽(cm)的融合蛋白,其通过在细胞膜处检测到cm结合的hla-e来证明(图3,图区c)。通过cd3和hla-abc双阴性细胞中的抗hla-e抗体检测到50%的hla-e阳性细胞,这表明融合蛋白的表达,因为这些细胞敲除了内源性β2m,hla-e重链必须与在细胞表面处呈递的重组cm结合并通过抗hla-e抗体来检测。因此,这些结果表明β2m的基因编辑有效地去除了内源性hla-abc复合物在细胞膜上的呈递,trac的基因编辑有效地去除了tcr-cd3复合物在细胞膜上的呈递,融合蛋白高效表达并与hla-e重链在细胞表面上形成稳定的复合物。
[0460]
7.4表达融合蛋白(cm)的ucar-t细胞对同种异体nk细胞具有抗性
[0461]
通过流式细胞术测量nk92细胞(人nk细胞系)介导的细胞溶解。
[0462]
将immunocult
tm
(stemcell)用作上述培养基。将nk92细胞(shanghai institute of cell research,chinese academy of sciences)用作效应细胞。使用三(3)种类型的靶细胞,均由源自上述健康的人类志愿者的外周血的初始t细胞产生,包含:1.car-t细胞,其是用car19病毒转导的初始t细胞;2.ucar-t细胞,其是用car19病毒转导并敲除了trac和b2m基因的初始t细胞;以及3.ucar-t-cm细胞,其是用car19-p2a-cm病毒转导并敲除了trac和b2m基因的初始t细胞。所有靶细胞的最终浓度为5
×
104/ml。
[0463]
在每组中,将作为效应细胞的nk92细胞和靶细胞以1:1(细胞数比率)的比率共培养。每组靶细胞也单独培养作为对照。将细胞接种在96孔培养板中,补充100μl培养基,并在37℃温育器中共培养24小时。在共培养之前,将nk92细胞用efluor
tm
670染色以与靶细胞区
分。在共培养48小时后,通过流式细胞术检测car阳性细胞来测量car-t细胞组、ucar-t细胞组或ucar-t-cm细胞组中的靶细胞的数量变化。如上所述,使用抗小鼠fmc63试剂盒对car阳性细胞进行染色。nk92细胞对靶细胞的杀伤率计算如下:(共培养组中的car阳性细胞数)/(在仅靶细胞组中的car阳性细胞数)。如图4所示,来自两名志愿者(供体1#和供体2#)的ucar-t-cm细胞对nk细胞介导的细胞溶解显示出了显著的抗性(
**
p《0.05,
***
p《0.01)。
[0464]
7.5表达融合蛋白(cm)的ucar-t细胞在存在同种异体pbmc的情况下快速扩增
[0465]
ucar-t细胞与同种异体pbmc细胞的共培养:
[0466]
此研究进一步模拟了体内环境。由于人体具有复杂的系统,该系统除nk细胞外还包括许多不同类型的免疫细胞,因此使用初始同种异体pbmcs来准确模拟人体中同种异体免疫系统的环境。为了测量基因工程细胞在同种异体pbmc环境中存活和生长的能力,此研究将三种类型的细胞共培养,三种类型的细胞为作为效应细胞的ucar-t细胞或ucar-t-cm细胞、作为靶细胞的raji肿瘤细胞(shanghai institute of cell research,chinese academy of sciences)以及作为同种异体免疫环境的模拟物的来自健康的人类志愿者的外周血的同种异体pbmc。用于制备ucar-t或ucar-t-cm的初始pbmc和t细胞从不同供体中获得以引发同种异体应答。raji肿瘤细胞呈cd19阳性,因此,含有car19的t细胞被raji细胞上的cd19抗原激活并开始增殖。
[0467]
将细胞按照以下比率共培养:ucar-t细胞(或ucar-t-cm细胞)中的car阳性细胞:raji肿瘤细胞:同种异体pbmc为1:5:20(细胞数比率)。将ucar-t细胞(或ucar-t-cm细胞)中的5
×
104/ml car阳性细胞接种于24孔培养板中,根据上述比率(即2.5
×
105/ml raji肿瘤细胞和1
×
106/ml同种异体pbmc)计算适当数量的raji肿瘤细胞和同种异体pbmc并将其接种。在37℃下培养细胞,并在不同时间点记录不同组中的car阳性细胞的数量。将不同时间点的car阳性细胞数除以第0天的起始car阳性细胞数以获得细胞扩增的倍数变化(图5)。使用相同的car阳性细胞染色方法(使用抗小鼠fmc63试剂盒)。
[0468]
在共培养之前,将同种异体pbmc和raji细胞用染料efluor
tm
670染色以与ucar-t细胞或ucar-t-cm细胞区分。为了对细胞染色,将细胞密度调整到1
×
107/ml,添加染料efluor
tm
e670到最终浓度为10μm,将混合物在室温下在黑暗中培育5分钟,并在使用前用培养基洗涤三次。
[0469]
图5示出了在同种异体pbmc细胞存在的情况下,ucar-t细胞在cd19阳性raji细胞的刺激下不能很好地扩增,而ucar-t-cm细胞能够快速扩增。这些结果表明,在受到癌细胞刺激后,pbmc中的同种异体免疫细胞抑制ucar-t细胞的生长,但不抑制ucar-t-cm细胞的生长,从而再次证明了经基因工程改造以表达融合蛋白(cm)的car-t细胞能够克服同种异体免疫细胞的抑制和/或排斥,并在同种异体环境中存活和生长。
[0470]
7.6表达融合蛋白(cm)的ucar-t细胞在存在同种异体pbmcs的情况下高效地引起肿瘤细胞的死亡
[0471]
实验程序与上述7.5部分中描述的相同,但测量了不同的细胞。在此实验中,在不同时间点测量了不同组中raji细胞的数量,而不是car阳性细胞的数量。在共培养之前,用染料e670对raji细胞进行染色,可以通过流式细胞术中的apc荧光通道将raji细胞与ucar-t或ucar-t-cm进行区分。流式细胞术分析可以清楚地区分raji细胞和pbmc细胞,这是因为raji细胞是肿瘤细胞并且相对于pbmc细胞具有显著不同的形态和大小,并且也是因为在共
培养期间肿瘤细胞的持续扩增导致染料e670的荧光持续降低。通过将不同时间点的raji细胞数除以第0天的起始raji细胞数来计算不同时间点raji细胞的倍数变化。如图6所示,raji单独培养组中的肿瘤细胞数量随着时间的推移而增加,并且ucar-t细胞在同种异体pbmc存在的情况下对肿瘤细胞的抑制较弱——肿瘤细胞仍然增加。相比之下,与ucar-t-cm细胞共培养的肿瘤细胞的生长受到明显抑制,并且这些肿瘤细胞逐渐被清除。这些结果证实了上述7.5部分中所述的结果,并证明当受到肿瘤细胞刺激时能够快速扩增的ucar-t-cm细胞也具有杀死肿瘤细胞的活性。
[0472]
7.7在β2m缺失细胞的细胞膜上检测融合蛋白(cm)和hla-e重链形成的复合物
[0473]
遵循上述的实验程序,并在此研究中使用jurkat t细胞。通过流式细胞术检测在细胞膜上形成的具有融合蛋白(cm)和内源性hla-e重链分子的复合物(图7)。将每组中的jurkat细胞用抗小鼠fmc63试剂盒染色以检测car,并分别用抗β2m-fitc和抗hla-e-apc染色以分别检测β2m和hla-e。取少量细胞,用1ml pbs(gibco,目录#c10010500bt)洗涤一次,并将细胞重新悬浮在100μl pbs中。向细胞混合物中添加3μl一级抗fmc63抗体(用于检测car19),在4℃下培育30分钟。然后添加1ml pbs并均匀混合,在350g下离心3分钟。收集细胞并丢弃上清液。依次添加0.5μl二级抗体(一级抗体和二级抗体来自抗小鼠fmc63试剂盒,shanghai xingwan,r19pb-100)、3μl抗β2m-fitc抗体和3μl抗hla-e-apc抗体,均匀混合,在4℃下培育30分钟。添加1ml pbs并均匀混合,然后在350g下离心3分钟。收集细胞并丢弃上清液。添加200μl pbs将细胞重新悬浮,将细胞装载到流式细胞仪中以进行检测。
[0474]
图7a-h的流式细胞术数据来自用car19-p2a-cm病毒转导并敲除了内源性trac基因和b2m基因的jurkat细胞。图7i-l的流式细胞术数据来自对照组,其中jurkat细胞的内源性trac基因和b2m基因被敲除但未用car19-p2a-cm病毒转导。
[0475]
图7的图区b示出了仅表达car的细胞呈hla-e阳性。由于对car进行编码的核酸和对融合蛋白(cm)进行编码的核酸被克隆以被可操作连接在同一病毒载体上(通过对p2a肽进行编码的核苷酸序列),所以表达car的细胞也表达cm。因此,仅表达cm的细胞呈hla-e阳性。图7的图区c示出了car和融合蛋白(cm)的共表达,因为cm包括β2m,所以可以观察到car和β2m双阳性细胞。图7的图区d示出了β2m和hla-e的共定位。由于大多数细胞缺乏β2m的内源性表达,所以抗β2m抗体实际上检测到含有重组β2m的cm。hla-e只能在表达cm的细胞的细胞表面上检测到的事实表明重组表达的cm与内源性hla-e重链在细胞表面上形成复合物。
[0476]
图7的图区f示出了car阳性细胞群r2几乎完全包含β2m和hla-e双阳性细胞,而图7的图区h示出了在car阴性细胞中未检测到β2m和hla-e双阳性细胞。这些结果进一步证明β2m信号是由与car共表达的cm分子产生的,并且cm(含有重组β2m和hla-e限制性肽)在β2m和hla-e双阳性细胞中与hla-e重链形成复合物。hla-e重链的膜呈递需要β2m表达。当cm不表达时(在car阴性细胞中),在β2m被敲除的jurkat细胞的细胞表面上无法检测到hla-e。在那些β2m被敲除的jurkat细胞中,当cm表达时(在car定位细胞中),cm和hla-e重链形成复合物,以恢复hla-e重链在细胞膜上的呈递,使得在细胞表面可以检测到hla-e重链分子。
[0477]
图7的图区i-l示出了在对照组的细胞中,在细胞表面未检测到car或hla-e。少量β2m阳性细胞代表了β2m未被基因编辑完全敲除的细胞。
[0478]
7.8不同呈递肽的表达与在细胞膜上hla-e分子的不同表达相关联
[0479]
呈递肽影响融合蛋白(cm)与hla-e重链之间的结合,进而影响hla-e复合物在细胞
膜上的表达。选择了18种不同的呈递肽(p1-p18;seq id nos:21-38),并将其克隆到慢病毒表达载体中作为gfp-p2a-cmx(x代表不同肽区段编号p1-p18)。此处使用的融合蛋白cmx从n端到c端具有以下组分:20-a.a.信号肽(seq id no:3)、选自p1-p18(seq id nos:21-38)的呈递肽x、连接子序列ggggsggggsggggs(seq id no:1)和β2m成熟形式肽(seq id no:81)。慢病毒靶向表达质粒的构建方法如上所述,使用bamhi/sall将gfp-p2a-cmx克隆到慢病毒载体中。将病毒转导到敲除了β2m的jurkat细胞中。慢病毒制备和病毒制备的方法如上所述。
[0480]
用抗hla-e-apc抗体(biolegend,342606)并通过测量指示慢病毒转导效率的gfp来检测细胞膜上hla-e复合物的表达。如图8a所示(在图8b中量化),不同呈递肽的表达与hla-e复合物在细胞膜上的不同表达水平相关(ntc,阴性对照;未经转导的组)。
[0481]
7.9多种融合蛋白在ucar-t细胞中高效表达,并且在同种异体pbmc存在的情况下,ucar-t细胞的扩增随着融合蛋白的表达而增加
[0482]
cjp-p2a-cm、cjp-p2a-cm12、cjp-p2a-cm13、cjp-p2a-cm14和cjp慢病毒靶向表达质粒的构建,以及具有或不具有融合蛋白的ucar-t细胞的制备
[0483]
构建慢病毒靶向表达质粒、制备表达不同融合蛋白的ucar-t细胞以及使用流式细胞术测量细胞表面表达的程序与上文7.2部分和7.3部分中所述的相同。cjp是抗cd19 car(seq id no:75)。融合蛋白与上文7.8部分所述的那些融合蛋白相同。这些构建体的氨基酸序列总结如下。核苷酸序列可以在序列表中找到。
[0484][0485]
分别通过细胞表面上cd3和hla-abc表达的流式细胞术分析表明trac和b2m基因的高效敲除(图9,图区b、e、h、k、n)。所有组都具有》85%的cd3和hla-abc双阴性细胞。在ucar-t-cm、ucar-t-cm12、ucar-t-cm13和ucar-t-cm14的细胞表面上共检测到hla-e和car,ucar-t-cm、ucar-t-cm12、ucar-t-cm13和ucar-t-cm14细胞各自含有如在上表中示出的不同的呈递肽(图9,图区c、f、i、l、o,对gated cd3和hla-abc双阴性细胞进行的分析)。结果表明,与不具有任何融合蛋白的对照ucar-t组相比,所有这些具有不同hla-e限制性肽的融合蛋白均能恢复trac和β2m双敲除t细胞中hla-e复合物的表面表达,但不能恢复hla-abc复合物的表面表达。
[0486]
在同种异体pbmcs存在的情况下具有不同融合蛋白(cm、cm12、cm13、cm14)的ucar-t细胞的扩增
[0487]
实验程序与上述7.5部分中所述的相同。图10a-10c表明,在同种异体pbmc细胞存在的情况下,不具有融合蛋白表达的ucar-t细胞在cd19阳性raji细胞的刺激下不能随时间的推移很好地扩增。相比之下,ucar-t-cm、ucar-t-cm12、ucar-t-cm13、ucar-t-cm14细胞即
使在同种异体pbmc细胞存在的情况下也能够快速扩增。在平行实验中使用不同的pbmc细胞群,包含pbmc(图10)。这些结果表明,同种异体pbmc中的免疫细胞抑制了ucar-t细胞的生长,但不抑制ucar-t-cm/cm12/cm13/cm14细胞的生长,从而再次证明经基因工程改造以表达本发明所公开的各种形式的融合蛋白的t细胞能够克服同种异体免疫细胞的抑制和/或排斥,并在同种异体环境中存活和生长。
[0488]
7.10靶向ny-eso-1的外源性tcr与融合蛋白在基因工程细胞中共表达
[0489]
构建含有靶向ny-eso-1的外源性tcr(1g4,seq id no:132)和融合蛋白cm(seq id no:5)的慢病毒靶向表达质粒,并使用此慢病毒载体和crispr/cas9基因编辑制备细胞。构建具有通过p2a肽连接的1g4和cm的慢病毒质粒的程序与上文7.2部分和7.3部分所述的相同。将慢病毒质粒主链(addgene id:#12252)用bamhi/sali酶切。构建体1g4-p2a-cm具有seq id no:135的核苷酸序列和seq id no:134的氨基酸序列。
[0490]
如上文7.2部分和7.3部分所述的那样,用慢病毒转导和crispr/cas9基因编辑制备细胞,并且对免疫荧光染色后的细胞进行流式细胞术分析。对于流式细胞术分析,取少量细胞,用1ml pbs(gibco,cat#c10010500bt)洗涤一次。将细胞重新悬浮在100μl pbs中,并添加3μl以下抗体中的每种抗体:抗cd3-fitc、抗αβ-tcr pe、抗hla-abc pe-cy7、抗hla-e-apc。在4℃下培育30分钟后,向混合物中添加1ml pbs,均匀混合,并在350g下离心3分钟。收集细胞团块并丢弃上清液。然后添加200μl pbs将细胞重新悬浮,并通过流式细胞仪分析细胞。
[0491]
不同分子在所得细胞上的表面表达在图11中示出:图区a-d示出了来自野生型jurkat t细胞的结果;图区e-p示出了来自具有trac和β2m双敲除(dko)的jurkat t细胞的结果,因此呈cd3和β2m双阴性。在图11的图区e-p中:图区e-h示出了来自具有trac和b2m dko而无慢病毒转导的jurkat t细胞的结果;图区i-l示出了来自具有trac和b2m dko且用携带1g4 tcr(seq id no:132)的慢病毒载体转导的jurkat t细胞的结果;图区m-p示出了来自具有trac和b2m dko且用慢病毒载体1g4-p2a-cm(1g4 tcr和融合蛋白cm通过p2a肽连接;seq id no:134)转导的jurkat t细胞的结果。
[0492]
如图11所示,野生型jurkat t细胞示出了对cd3、αβ-tcr、hla-abc和hla-e染色呈阳性(图区a-d)。trac和β2m敲除jurkat t细胞具有91.8%的cd3和αβ-tcr双阴性细胞(图区f,左下),并且由于缺乏β2m,因此在细胞表面上无法检测到hla-abc和hla-e(图区g、h)。用1g4 tcr转导的双敲除jurkat t细胞示出了42.8%的cd3和αβ-tcr双阳性细胞(图区j,右上),表明此外源性tcr(即1g4)的表达恢复了cd3/tcr复合物的表面呈递;但在此组中hla-abc和hla-e仍然呈阴性(图区k、l)。用1g4-p2a-cm转导的双敲除jurkat t细胞示出了40.2%的cd3和αβ-tcr双阳性细胞(图区n,右上),这与单独表达1g4的组相当(图区j,右上);融合蛋白cm的表达恢复了hla-e复合物的表面呈递(图区p,右上,36.3%的hla-e和αβ-tcr双阳性),但未恢复hla-abc复合物的表面呈递(图区o)。
[0493]
7.11在同种异体pbmcs存在的情况下,具有或不具有融合蛋白的经基因工程改造的靶向ny-eso-1的tcr-t细胞的扩增
[0494]
具有或不具有融合蛋白cm的经基因工程改造的靶向ny-eso-1的tcr-t细胞的制备
[0495]
构建慢病毒靶向表达质粒、激活初始t细胞、基因编辑、慢病毒介导的基因转导和使用流式细胞术测量细胞表面表达的程序与上文7.2部分、7.3部分和7.10部分中所述的相
同。使用的慢病毒与上文7.10部分所述的相同。简而言之,初始t细胞源自健康的人类志愿者的外周血(pbmc)。使用dynabeads(thermo,cat#11141d)激活t细胞,并且dynabeads与细胞的比率为3:1。在激活后72小时,收集t细胞,用电穿孔缓冲液(thermo,试剂盒中的重悬浮缓冲液t,cat#mpk1096)或opti-mem(gibco,cat#31985-070)将t细胞洗涤3次,然后将t细胞在电穿孔缓冲液(去除dynabeads)中重新悬浮。将细胞密度调整为1
×
108/ml。为了制备β2m/tcr双敲除t细胞,将β2m sgrna和trac sgrna(分别为150ng)和1μg cas9蛋白在体外均匀混合,在室温下培育10分钟,然后将混合物添加到重新悬浮的细胞中进行电穿孔。用于电穿孔的总体积为10μl,并且使用neon电穿孔系统。电击的脉冲电压、脉冲持续时间和脉冲数如下:1200v和10毫秒,3次。在电穿孔24小时后,将3
×
l05个初始t细胞接种于24孔培养板中,将制备的慢病毒添加到上述细胞中,其中,慢病毒的数量是细胞数量的10倍即,moi=10(“感染复数”,病毒转导单元与细胞数量的比率),并补充培养基以使体积达到500μl(该培养基与用于激活上述初始t细胞的培养基相同)。对于1g4细胞,使用携带1g4的慢病毒进行转导;对于1g4-p2a-cm细胞,使用携带1g4-p2a-cm的慢病毒进行转导;24小时后,补充培养基以使体积达到1ml,以促进细胞生长。
[0496]
基因工程tcr-t细胞与同种异体pbmc细胞的共培养
[0497]
实验程序基本上与上述7.5部分中所述的实验程序相同。在图12中,1g4细胞是trac和β2m均被敲除的初始人t细胞,并且1g4细胞表达1g4 tcr(seq id no:132);1g4-p2a-cm细胞是trac和β2m均被敲除的初始人t细胞,并且1g4-p2a-cm细胞共表达通过p2a肽连接的1g4-tcr和融合蛋白cm(seq id no:134)。为了测量基因工程tcr-t细胞(具有或不具有cm)在同种异体pbmc环境中的存活和生长,此研究共培养了三种类型的细胞:作为效应细胞的1g4细胞或1g4-p2a-cm细胞;作为靶细胞的表达单链三聚体(hla-a0201重链、ny-eso-1衍生肽
‘
sllmwitqc
‘
(seq id no:140)和β2m)的k562细胞,该细胞被命名为k562-a02-ny-eso-1;以及作为同种异体免疫环境的模拟物的来自健康的人类志愿者的外周血的同种异体pbmc。用于制备tcr-t或tcr-t-cm的初始pbmc和t细胞从不同供体中获得以引发同种异体应答。将细胞按照以下比率共培养:1g4或1g4-p2a-cm细胞中的tcr阳性细胞:k562-a02-ny-eso-1-肿瘤细胞:同种异体pbmcs=1:5:20(细胞数比率)。将同种异体pbmcs和k562-a02-ny-eso-1细胞在共培养前用染料efluor tm 670染色以与1g4细胞或1g4-p2a-cm细胞区分。在37℃下培养细胞,并在不同时间点记录不同组中的hla-abc阴性、tcr阳性细胞的数量。
[0498]
图12示出了在同种异体pbmc细胞存在的情况下,1g4细胞不能在k562-a02-ny-eso-1细胞的刺激下持续扩增。在短时间(3天)的扩增后,1g4细胞的数量迅速减少,而1g4-p2a-cm细胞能够在整个共培养时间段(7天)持续扩增。这些结果表明,同种异体pbmcs中的免疫细胞抑制了1g4细胞的生长,但没有遏制1g4-p2a-cm细胞的生长,从而表明融合蛋白cm有助于tcr-t细胞克服同种异体免疫细胞的生长抑制和/或排斥,并有助于在同种异体环境中存活和生长。
[0499]
7.12表达融合蛋白的bcma ucar-t细胞对同种异体nk细胞具有抗性
[0500]
表达bcma car和融合蛋白(cm)的t细胞的制备
[0501]
将上述7.2部分和7.3部分中描述的程序用于制备此研究中使用的慢病毒构建体和基因工程t细胞。首先,合成通过p2a与编码融合蛋白cm(seq id no:5)的核酸序列连接的编码bcma car序列(seq id no:136)的核酸,并将该核酸克隆到慢病毒载体中,所述慢病毒
载体被命名为plenti-bcma-cm(bcma car-cm:seq id no:138)。将car-t细胞(不具有β2m/trac双敲除)和ucar-t细胞(具有β2m/trac双敲除)激活并用plenti-bcma-cm转导。所得t细胞分别被命名为bcma-cm car-t和bcma-cm ucar-t。均未进行慢病毒转导的对照t(不具有β2m/trac双敲除)和ut(具有β2m/trac双敲除)作为对照细胞。
[0502]
在t细胞扩增后,根据上述7.3部分所述的程序,使用荧光标记的抗体染色和流式细胞术分析评估bcma car和融合蛋白cm表达水平。如图13所示,在ut和bcma-cm ucar-t细胞中hla-abc和cd3表达被消除。如图14所示,除了对照t细胞和ut细胞外,bcma car在所有组中均稳定表达,根据hla-e表达所显示的,融合蛋白cm仅在bcma-cm car-t和bcma-cm ucar-t细胞中表达,其中,cm表达分别为29.6%和27.5%。
[0503]
bcma-cm car-t和bcma-cm ucar-t细胞的ifn-γ释放
[0504]
靶细胞(mmis.luc细胞和k562.bcma.luc细胞)各自分别与效应细胞(对照t、ut、bcma-cm car-t和bcma-cm ucar-t细胞)以1:1的比率共培育20小时。收集来自共培养的上清液,以通过使用市售的elisa试剂盒(thermo fisher scientific;目录号:88-7316)评估干扰素γ(ifn-γ)的含量。根据试剂盒提供的说明来进行测定。如图15所示,bcma-cm car-t和bcma-cm ucar-t细胞在与表达bcma的靶细胞共培养时释放高水平的ifn-γ。
[0505]
表达融合蛋白的bcma ucar-t细胞对同种异体nk细胞具有抗性
[0506]
根据上述7.4部分所述的程序进行nk-92细胞毒性测定。在进行流式细胞术分析前,将不同组的t细胞(对照t、ut、bcma-cm car-t和bcma-cm ucar-t细胞)与nk-92细胞共培育20小时。如图16所示,与不具有cm表达的ut细胞相比,bcma ucar-t-cm细胞对nk细胞介导的细胞毒性表现出明显更高水平的抗性,这再现了先前的结果(注:将细胞溶解率相对于对照t细胞进行归一化;***p《0.01)。
[0507]
8.以电子方式提交的序列表参考
[0508]
本技术通过引用并入已作为ascii文本文件且以电子方式提交的序列表。序列表被命名为“102a001wo02_seqlist.txt”,创建于2020年8月7日,并且大小为210,210字节。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
