1.本发明涉及细胞治疗应用及免疫隔离领域,具体涉及一种液晶改造工程化海藻酸水凝胶、细胞免疫隔离胶囊及其制备方法。
背景技术:
2.免疫隔离是一种提供物理屏障进而保护移植细胞或组织免受宿主免疫系统伤害的手段,因此,它从根本上不同于传统的药物免疫抑制方法。免疫隔离的工作原理是将胰岛或间充质干细胞等细胞包裹在半透膜内。免疫隔离消除了对药物免疫抑制治疗的需要并克服了人类供体短缺的问题,因为它可能允许异种移植和包括干细胞在内的其他类型细胞的移植。膜的半透性允许氧气和营养物质的运输,帮助被包裹的细胞生存,同时半透性膜保护被包裹的细胞免受与宿主免疫系统的相互作用。免疫分离是一种即将成功临床应用的安全方法,其初步疗效已在人类身上得到证实。
3.为了实现免疫分离的目的,可以将细胞封装在两种不同的装置中——大胶囊和微胶囊。在宏封装装置中,细胞用平板、中空纤维或圆盘几何形状封装在大型装置中。这种大封装装置可以容纳许多细胞,可被植入体内(皮肤下或腹腔内),并允许对膜参数进行更大的控制,如孔隙大小和孔隙率。
4.海藻酸盐是应用最广泛、研究最详细的包封聚合物,在宏、微包封装置中均有应用。由于海藻酸盐具有良好的生物相容性、低毒性、相对低廉的成本、制备海藻酸盐衍生物的修饰简单、添加二价阳离子(如ca
2
)的温和凝胶化等特性,海藻酸盐是制造封装装置的理想生物材料,在生物医学科学和工程中有许多应用。海藻酸盐水凝胶在许多生物医学应用中具有巨大的实用性和潜力,特别是到目前为止在伤口愈合、药物应用、体外3d培养系统和组织工程应用中,因为这些凝胶保持着组织中细胞外基质的结构相似性,并具有一些良好的功能。
5.现有技术中,大胶囊的空间的主要问题是不利的表面体积比;因此,必需营养素和氧气的扩散缓慢而有限,因此,胶囊内的细胞争夺这些营养素,最终导致细胞坏死。由于海藻酸凝胶的孔径大约为5nm,因此通过扩散可以释放出的试剂的尺寸受到限制。
6.大多数蛋白质和小分子很容易从海藻酸水凝胶中扩散出去,尽管降解可以加速凝胶的释放;如果分子(如浓缩质粒dna、免疫球蛋白和细胞因子)太大而不能有显著的扩散释放,则只有在凝胶降解时才能释放。
7.海藻酸水凝胶本身缺乏哺乳动物细胞受体,加之蛋白吸附和细胞粘附能力较低,因此适当的配体对于促进和调节细胞相互作用至关重要,尤其是在体外三维细胞培养和组织工程应用中;包含精氨酸-甘氨酸-天冬氨酸-rgd序列的多肽被广泛用作模型粘附配体,因为rgd配体的整合素受体(如αvβ3和α5β1)广泛存在于各种哺乳动物细胞中;含有rgd的多肽可以与海藻酸盐骨架进行化学偶联,rgd配体的存在增强了细胞粘附;然而,海藻酸盐凝胶的共价交联会导致水迁移、应力松弛和显著的弹性变形,同时,反应试剂可能是有毒的,
需要从凝胶中彻底去除未反应的化学物质。
技术实现要素:
8.本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种具有更大的孔径和孔隙率、免疫细胞不能通过、被包封的细胞存活率高的液晶改造工程化海藻酸水凝胶、细胞免疫隔离胶囊及其制备方法。
9.本发明的目的可以通过以下技术方案来实现:
10.发明人了解到,物质的液晶状态存在于固相和各向同性的液相之间,因此被定义为“物质的第四态”。在液晶相中,液晶同时具有固体和液体的部分特性。对于热致液晶,液晶是通过加热固体介晶样品获得的。在熔点,由于分子的热运动增加,材料从固相过渡到液晶相。在进一步加热到清除点时,热致液晶可以转变为各向同性的透明液体。一般来说,液晶显示器被电子工业广泛用于手表、计算器、仪表以及个人电脑和宽屏电视中显示数字信息的材料,因为它们具有许多显著而有益的光学和物理特性。近年来,液晶在生物学和医学上的多种应用越来越受到重视,如癌症、肝病等的检测和治疗。
11.本发明利用热致液晶-十二烷基磺酸钠液晶具有温度敏感性、良好的形状记忆和尺寸选择性的特点,制备了工程海藻酸盐水凝胶,并引入了更大的孔径和孔隙率。同时,本发明设计了由工程化海藻酸盐凝胶制成的细胞免疫隔离胶囊,以保证被包封的细胞存活率高,不与宿主免疫细胞相互作用,不进行营养物质竞争,但共享体内植入位置的非细胞微环境。在本发明中,首次将十二烷基磺酸钠液晶引入藻酸盐水凝胶中,并通过热水浴去除晶体,使得十二烷基磺酸钠晶体的结构完全保持在凝胶中。凝胶中的结构允许小分子、大分子、囊泡等自由扩散,但免疫细胞不能通过。因此,免疫细胞隔离胶囊内的细胞不仅具有结构和机械支持,而且在体内不与免疫细胞相互作用的情况下共享非细胞微环境,具体方案如下:
12.一种液晶改造工程化海藻酸水凝胶,该凝胶的原材料包括海藻酸盐溶液、热致液晶和成胶剂。
13.进一步地,所述的海藻酸盐溶液包括浓度为1-5%(质量/体积)的海藻酸钠溶液,优选2%。
14.进一步地,所述的热致液晶包括十二烷基磺酸钠液晶。所述的热致液晶可以为宽小于3μm的长棒状十二烷基磺酸钠液晶片段。
15.进一步地,所述的成胶剂包括浓度为100-150mm的氯化钙溶液。
16.一种如上所述的液晶改造工程化海藻酸水凝胶的制备方法,该方法包括以下步骤:
17.(1)热致液晶的制备:将热致液晶前驱体溶液加热,然后冷却至室温,放置一段时间后变为混浊溶液,即热致液晶;
18.(2)工程化海藻酸水凝胶制备:热致液晶与海藻酸盐溶液混合,同时加入成胶剂,形成水凝胶,并在水浴中孵育以去除热致液晶或者热致液晶片段,形成液晶改造工程化海藻酸水凝胶。
19.为了制备晶体的消失(但晶型保留)的工程水凝胶,与热致液晶混合的凝胶在水浴中孵育一定时间以去除晶体,并在凝胶中保持晶体的形状。
20.进一步地,所述加热的温度高于热致液晶澄清点温度;
21.所述的热致液晶与海藻酸盐溶液的体积比为(0.8-1.2):1,优选1:1,所述水浴的温度高于热致液晶澄清点温度。
22.一种在如上所述的液晶改造工程化海藻酸水凝胶基础上的细胞免疫隔离胶囊,该胶囊的原材料还包括扩囊剂。
23.进一步地,所述的扩囊剂包括浓度为1-5%(质量/体积)的明胶溶液。
24.一种如上所述的细胞免疫隔离胶囊的制备方法,该方法包括以下步骤:
25.(1)将扩囊剂冷冻后形成胶状物质,再将其分割;
26.(2)将热致液晶与海藻酸盐溶液混合,缓慢加入到模具中,同时放入分割好的胶状扩囊剂;使胶状扩囊剂块被混合液包围;
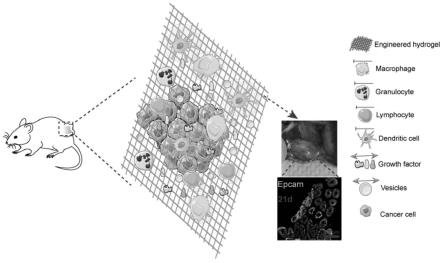
27.(3)再向模具中加入成胶剂,形成水凝胶,并在水浴中孵育后去除热致液晶和扩囊剂,形成细胞免疫隔离胶囊。
28.不难看出,细胞免疫隔离胶囊与液晶改造工程化海藻酸水凝胶的区别就在于,隔离胶囊在制备过程中由于中间包裹了可最终去除的扩囊剂,因而形成了空心的囊状结构。
29.进一步地,所述冷冻的温度为2-15℃,时间为50-70min;
30.所述的热致液晶与海藻酸盐溶液的体积比为(0.8-1.2):1,优选1:1,所述水浴的温度高于热致液晶澄清点温度。
31.本发明中,十二烷基磺酸钠液晶具有温度敏感性,良好的形状记忆和尺寸选择性的特点,将液晶引入到海藻酸凝胶中并通过加热制备了工程海藻酸盐水凝胶,使得胶的孔径和孔隙率增大。由工程海藻酸盐水凝胶制作的免疫细胞隔离胶囊包裹大量细胞,并使得小分子、大分子、囊泡等自由扩散,但免疫细胞不能进而囊内细胞共享移植点非细胞微环境。为多种疾病的有效细胞治疗提供了可能。同时免疫细胞隔离胶囊使得内部细胞恢复极性并形成官腔,为肿瘤治疗提供新思路和方法。并可以通过将肿瘤病人样本引入囊内形成pdx或pdo模型,进行体外机理及耐药性研究。
32.与现有技术相比,本发明具有一下优点:
33.(1)由于海藻酸盐具有良好的生物相容性、低毒性、相对低廉的成本、制备海藻酸盐衍生物的修饰简单等优点,可广泛应用于实现细胞免疫分离;其优良的光学透明度和温和的凝胶添加二价阳离子(如ca
2
)。
34.然而,海藻酸凝胶为纳米孔,孔径约为5nm,分子大小和扩散速度受到限制。在海藻酸盐水凝胶中引入sds热致液晶,使凝胶的孔径和孔隙率增大,从而加速了分子的迁移。由于sds液晶屏对温度敏感,用热水浴将其完全去除。
35.发明人认为,lcs可在生物学和医学上的多种应用,如癌症、肝病的检测和治疗等,选择sds lc来扩大海藻酸盐水凝胶的孔径有几个原因。首先,sds-lcs对温度敏感,而藻酸盐对二价阳离子敏感。因此,热水浴可以去除lcs,但不影响藻酸盐的凝胶化;其次,lcs呈片状和棒状,经过超声波处理后可以裂解成更小的晶体碎片。可以根据需要选择不同尺寸的晶体碎片,不仅可以得到片状的晶片,还可以得到棒状的晶片。宽小于3μm的棒状晶体碎片保留的微孔允许大分子、小分子和细胞通信囊泡通过,但免疫细胞不能通过;液晶既具有液体的流动性和粘度,又具有晶体的各向异性和光学特性,因此sds液晶可以均匀地引入水凝胶中。由于囊包细胞在体内需要的营养物质和氧气的竞争,增大的孔径和孔隙率非常重要,
具有显著的优势;
36.(2)细胞疗法在各种疾病中都有很大的潜力。然而,移植细胞在病区由于异物反应而存活率较低,从而限制了细胞治疗的效果。
37.免疫隔离是一种提供物理屏障保护移植细胞或组织免受宿主免疫系统伤害的手段,因此,它从根本上不同于传统的药物免疫抑制方法。免疫隔离允许异种移植和移植其他表型的细胞,包括干细胞、多能干细胞、诱导多能干细胞(ipscs)等。免疫分离技术具有治疗多种疾病的潜力,包括糖尿病、血友病、贫血、甲状旁腺疾病、慢性疼痛、帕金森病、亨廷顿病、肾功能衰竭和肌萎缩性侧索硬化症。治疗细胞可装入大胶囊和微胶囊进行免疫分离。大胶囊可以容纳更多的细胞,可以植入皮下或腹腔内。虽然一些成功已经被证实,但是大胶囊的空间的主要问题是不利的表面体积比。
38.因此,必需营养素和氧气的扩散缓慢而有限,因此,胶囊内的细胞争夺这些营养素,最终导致细胞坏死。本发明展示了一种方法,可以扩大海藻酸水凝胶的孔隙和孔隙率,并由工程水凝胶制成的无细胞免疫胶囊,可以轻松快速地运输氧气、必需营养素和膀胱。因此,被包裹的细胞具有充足的营养和氧气,存活率高,同时共享局部的非细胞微环境。因此,对于可以通过细胞分泌蛋白治疗的疾病,具有巨大的潜力,可用于不同细胞来源的细胞替代和高细胞存活率;
39.(3)多种基因改变导致正常细胞向肿瘤细胞的转变。细胞表型转换也是正常细胞的基本特征,在发育过程中对细胞和组织的分化至关重要。然而,单个肿瘤细胞获得了新的特性,如增加的迁移潜能或通过表型切换的化学抗性能力。肿瘤细胞的状态开关受基因表达和微环境信号控制。多年来,人们一直在不同的背景下研究肿瘤细胞的正常化现象。许多类型的肿瘤细胞通过将癌细胞移植到正常的成人组织环境中,如裸鼠胚胎癌细胞、小鼠乳腺肿瘤病毒驱动的erbb2表达细胞等,具有表型逆转。本研究首次在c57bl/6j小鼠体内,通过物理支持和皮下非细胞微环境,将pc3前列腺癌细胞包封于无免疫囊内,恢复了正常极化上皮细胞与细胞之间的相互作用,并形成了前列腺导管。该结果对未来抗癌疗法的发展和研究具有重要意义。同时,该细胞无免疫胶囊在免疫功能小鼠中形成pdx或pdo模型,用于药物筛选和患者疾病机制研究具有很大的潜力。
附图说明
40.图1为sds液晶的表征;
41.图2为具有理想孔径和孔隙率的工程化海藻酸水凝胶的表征;
42.图3为海藻酸盐凝胶和工程海藻酸盐凝胶不同分子和细胞的释放表征;
43.图4为细胞免疫隔离胶囊的制备及穿透能力检测;
44.图5为细胞免疫隔离胶囊内细胞体外培养情况;
45.图6为细胞免疫隔离胶囊确保癌细胞在c57bl/6小鼠中长时间存活情况图;
46.图7为免疫细胞隔离以及前列腺细胞pc3极性化并形成管腔结构图;
47.图8为本发明实验流程图。
具体实施方式
48.下面结合附图和具体实施例对本发明进行详细说明。本实施例在以本发明技术方
案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
49.实施例
50.1、sds液晶的制备及工程化海藻酸盐水凝胶
51.一种液晶改造工程化海藻酸水凝胶的制备方法,该方法包括以下步骤:
52.(1)热致液晶的制备:将热致液晶前驱体溶液加热(加热的温度高于热致液晶澄清点温度),然后冷却至室温,放置一段时间后变为混浊溶液,即热致液晶;
53.(2)工程化海藻酸水凝胶制备:热致液晶与海藻酸盐溶液混合(体积比为(0.8-1.2):1),同时加入成胶剂,形成水凝胶,并在水浴(水浴的温度高于热致液晶澄清点温度)中孵育以去除热致液晶或者热致液晶片段,形成液晶改造工程化海藻酸水凝胶。
54.总之,该凝胶的原材料包括海藻酸盐溶液、热致液晶和成胶剂,海藻酸盐溶液包括海藻酸钠溶液,热致液晶包括十二烷基磺酸钠液晶,成胶剂包括氯化钙溶液。
55.实验材料:sds,2%(w/v)海藻酸钠溶液,115mm氯化钙溶液。
56.sds液晶制备:5%(w/v)sds水溶液加热至65℃并维持10分钟,然后冷却至室温,30分钟后变为混浊溶液,即sds液晶;
57.工程化海藻酸水凝胶制备:sds液晶与2%(w/v)海藻酸钠溶液按1:1(v/v)的比例混合,同时加入115mm氯化钙溶液形成水凝胶。为了制备消失的sds晶体工程水凝胶,将与sds晶体混合的凝胶在50℃的水浴中孵育一定时间以去除晶体并在凝胶中保持晶体的形状。
58.同时,将相同试验条件下,不使用液晶制作出的水凝胶作为对照水凝胶。
59.图1为sds液晶的表征,具体而言,
60.a为十二烷基磺酸钠(sds)的结构式
61.b为sds水溶液(5%,w/v)对温度敏感,在65℃水中孵育10min后为透明液体,温度冷却至rt后变为液晶。
62.c为液晶的蓝色纹理。
63.d为当热sds水溶液冷却到室温时,晶体从中心像烟花一样展开。
64.e为晶体中心没有紧密相连,经移液枪吹打后,不规则地扩散排列。
65.f为sds晶体的sem结果。
66.g为超声20min(脉冲10 06amp 1 50%)后sds lc碎片图像(比例尺,50μm)。h为500rpm离心30s后分离出片状sds lc片段。
67.i为超声20分钟(脉冲10 06amp 1 50%)以及离心500rpm,7分钟后分离出的棒状晶体碎片。
68.j为超声后20分钟(脉冲10 06amp 1 50%)和离心7分钟分离出的棒状晶体碎片的宽度定量分析结果。数据给出平均值
±
标准偏差(sd)。
69.研究结果证实:十二烷基磺酸钠具有温度敏感性及光学特征(图1a,b,c),液晶是从中心向周围扩散,中心部分没有紧密紧密连接在一起(图1d,e),液晶形状为棒状或者薄片状(图1f),通过超声可将液晶断裂成小的片段,并进行分离(图1g,h,i,j)。
70.图2为具有理想孔径和孔隙率的工程化海藻酸水凝胶,具体而言,
71.a为海藻酸凝胶制成的sjtu字母。
72.b为工程化海藻酸水凝胶制成的sjtu字母(sds lcs和alginate的比例为1:1)。
73.c和d分别为保留sds晶体和去除sds晶体的工程化海藻酸水凝胶字母sjtu。
74.e和f分别为甲基绿和伊红在85℃水浴55小时过程中逐渐从工程藻酸盐凝胶中去除。
75.g和h分别为对照藻酸盐凝胶与工程藻酸盐凝胶在50℃水浴2天后的sem结果。
76.进而,将液晶引入到海藻酸凝胶中。正常的海藻酸凝胶为无色透明凝胶(对照水凝胶),加入sds lcs后,凝胶变成白色,经过热水浴,液晶去除,凝胶又变成无色透明状(图2a,b,c,d)。lcs去除过程中,凝胶内的甲基绿和伊红也逐渐从凝胶内渗出,最终变成无色透明状(图2e,2f)。通过扫描电镜发现,lcs的加入确实可以将自身的形状保留在凝胶上,进而人为的扩大了凝胶的孔径和孔隙率(图2g,h)。
77.图3为海藻酸盐凝胶和工程海藻酸盐凝胶不同分子和细胞的释放,具体而言,a为海藻酸凝胶中bca缓释曲线。
78.b为琼脂糖凝胶验证了质粒htert pm-gfp(13166bp)从工程藻酸凝胶中穿透,其中1号通道包含15kb 2kb标准marker;2号通道和3号通道分别为将质粒htert pm-gfp(13166bp,2μg)加入2%海藻酸与ddh2o[比例(v/v)为1:1和1:2]的水凝胶中,4号通道和5号通道分别为质粒htert pm-gfp[(13166bp,2μg)2μg]加入2%海藻酸盐与sds-lcs的比例为1:1和1:2的工程水凝胶中。在装入琼脂糖凝胶(120v 30分钟)之前,将第2道至第5道中每个样品的含量在45℃水浴中放置6小时。
[0079]
c为琼脂糖凝胶验证了从工程藻酸盐水凝胶中释放的细菌裂解质粒htert pm-gfp(13166bp),其中lane 1含有10kb 2kb marker;对照巷2中含有1μg质粒htert pm-gfp;控制线3包含对照样品和线4验证质粒dna从工程藻酸盐水凝胶释放。对照样品为2%的海藻酸、ddh2o和大肠杆菌裂解液的混合溶液,比例(v/v)为1:1:1;第4道样品为2%的海藻酸、sds、lcs和大肠杆菌裂解液的混合溶液,比例(v/v)为1:1:1。第3道和第4道中每个样品的含量在装入琼脂糖凝胶(120v 30分钟)之前,在45℃水浴6小时。
[0080]
d和e分别为lenti cmv-mche(8869bp)和plv3-gfp-rfp-nluc puro(12557bp)与质粒htert pm-gfp(13166bp)相同,并且3和4lane互换了位置。
[0081]
f来自对照和无细胞免疫胶囊的细菌克隆在固体培养基上生长。对照组仅观察到几个克隆,而无细胞免疫胶囊中观察到无数克隆。
[0082]
g为用mcherry(红色)标记的pc3细胞被困在无细胞免疫胶囊中。
[0083]
在此基础上,检测改造后的凝胶的物质通过能力以及尺寸变化。正常的海藻酸囊胶可以使大部分蛋白通过(图3a),但是质粒不能通过。改造后的海藻酸凝胶可以使质粒,大肠杆菌通过(图3b,c,d,e,f),但是细胞却不能通过(图3g)。
[0084]
2、细胞免疫隔离胶囊的制备
[0085]
一种细胞免疫隔离胶囊的制备方法,该方法包括以下步骤:
[0086]
(1)将扩囊剂冷冻(温度为2-15℃,时间为50-70min)后形成胶状物质,再将其分割;
[0087]
(2)将热致液晶与海藻酸盐溶液混合(体积比为(0.8-1.2):1),缓慢加入到模具中,同时放入分割好的胶状扩囊剂;
[0088]
(3)再向模具中加入成胶剂,形成水凝胶,并在水浴(水浴的温度高于热致液晶澄
清点温度)中孵育后去除热致液晶和扩囊剂,形成细胞免疫隔离胶囊。总之,该胶囊的原材料还包括扩囊剂,扩囊剂包括明胶溶液。
[0089]
实验材料:2%(w/v)海藻酸钠,2%(w/v)明胶溶液,5%(w/v)sds水溶液制作的液晶,115mm氯化钙溶液。
[0090]
首先,用琼脂做圆柱形的模型,然后以1:1(v/v)比例制备海藻酸盐和sds-lcs的混合物,并准备2%(w/v)的明胶溶液。
[0091]
将明胶溶液倒入6cm培养皿中,将培养皿放入4℃冰箱中放置1小时,以确保明胶溶液成胶,进而将明胶分成多个片状圆形。
[0092]
接下来,将混合物添加到模型中至1/3的柱子高度,并放入圆形明胶片,然后继续添加混合物,直到填充整个模型。
[0093]
最后,向模型中多次少量加入氯化钙溶液,对胶囊进行50℃水浴,直至将明胶和sds晶体全部去除。
[0094]
同时,将相同试验条件下,不使用液晶制作出的胶囊作为对照囊。
[0095]
3、细胞免疫隔离胶囊内细胞活性检测
[0096]
材料:标记了mcherry的前列腺癌细胞pc3,matrigel,24孔板。
[0097]
所有动物实验均按照上海交通大学道德规范进行。动物实验方案经上海交通大学实验动物使用与护理委员会批准。
[0098]
用pbs调节mcherry标记的pc3细胞至5
×
106/ml,细胞悬液与基质胶matrigel按1:1(v/v)的比例混合,用胰岛素注射器将细胞混合物注射到细胞免疫隔离胶囊中。
[0099]
接下来,胶囊被放置在24孔板的孔的中心。将平板置于37℃、5%co2气氛下的细胞培养箱中培养24h。
[0100]
然后,对包裹了细胞的胶囊进行成像,以测量细胞的荧光强度。
[0101]
成像后,每个胶囊于第二天被埋入6周龄雄性免疫系统正常的c57小鼠(上海实验动物中心,中国上海)的皮下。分别于移植后第4、7、14、21、37和60天采集移植胶囊,进行荧光强度分析、流式细胞术分析和免疫荧光分析等。
[0102]
4、免疫组化
[0103]
实验材料:6例新鲜胶囊样本(配对不加胶囊的细胞团块);一抗为兔源epcam抗体(abcam,货号ab69639)以及鼠源cd45抗体,二抗为jackson immunoresearch(pa,usa)alexa fluor 488donkey anti-rabbit igg(711-545-152;1:600)与alexa fluor 594donkey anti-mouse igg(715-585-151;1:500)
[0104]
实验方法:
[0105]
1、取出组织切片,置于60℃孵箱中烘烤60分钟。将石蜡切片浸于二甲苯中10分钟,两次。取出切片置于100%无水乙醇中5分钟两次;依次置入95%,90%,80%,70%各级酒精各3分钟。用pbs冲洗3次,每次3分钟。
[0106]
2、抗原修复:用ph=9.0的抗原修复溶液暴露抗原决定簇。加热至修复液沸腾,放入芯片并继续加热20分钟。关闭电源将修复液冷却至室温,pbs洗5分钟。
[0107]
3、封闭非特异性蛋白
[0108]
1)3%h2o
2-甲醇(30%h2o
2 10ml 甲醇90ml)室温浸泡30分钟,消除内源性氧化还原酶。
[0109]
2)自来水冲洗10分钟,pbs清洗两次。
[0110]
3)pbs配制10%山羊血清。
[0111]
4)免疫组化笔圈出切片有效部分(防止加入的液体流出,染色不均匀),向组织切片上滴加10%山羊血清(用pbs配制),放置于湿盒中封闭非特异性抗原(200微升/玻片),室温1小时(用pbs配置的1%山羊血清1:400配好一抗反应液)。
[0112]
4、一抗孵育
[0113]
甩去切片上的10%山羊血清封闭液,用无尘纸擦干组织周围,直接加入已稀释的cd45及epcam抗体(约100μl),置于湿盒中4℃过夜。第二天从冰箱中取出。
[0114]
5、二抗孵育
[0115]
1)将一抗洗掉,将切片插入塑料玻片架,然后整个放入塑料盒中,加pbs浸泡洗5分钟3次。
[0116]
2)用无尘纸将玻片周围的pbs吸去,加入荧光二抗,室温30分钟。孵育完毕,将切片置入pbs缓冲液中,冲洗3次,每次3分钟,取出切片,甩掉并擦干组织周围的液体(组织切勿干燥),平放于湿盒中。
[0117]
3)在玻片上滴管滴加含dapi的中性树脂,然后盖上盖玻片,用镊子轻轻挤压,并赶走气泡,显微镜观察。
[0118]
5、大肠杆菌穿透免疫细胞隔离胶囊的检测
[0119]
将免疫细胞隔离胶囊中注射大肠杆菌溶液,并用pbs洗涤3次,然后将胶囊置于24孔板孔中心并加入2ml pbs。室温孵育1小时后,每孔收集20μlpbs,加入200μl lb液体培养基中,置于37℃培养箱中,200rpm摇匀1小时。然后将200μl的细菌稀释10倍调整细菌密度,分散于平板上,盖上培养皿,37℃孵育12h,计数克隆数。以海藻酸盐为原料制备的对照胶囊不含sds-lc。
[0120]
图4为细胞免疫隔离胶囊的制备及穿透能力检测,具体而言,
[0121]
a为基于温度敏感性和良好形状记忆的sds液晶的细胞免疫隔离胶囊制备工艺示意图。
[0122]
b为无sds晶体和明胶的细胞免疫隔离胶囊。
[0123]
c为注射胎牛血清5小时后对照胶囊和细胞免疫隔离胶囊的胎牛血清释放曲线。y轴表示胶囊外胎牛血清浓度与5小时内胎牛血清最终浓度的百分比。
[0124]
d为用mcherry标记的pc3细胞可以通过荧光信号的强度进行定量。
[0125]
e为pc3细胞在细胞培养液中孵育6小时后显微镜图片。
[0126]
用改造后的凝胶制作免疫细胞隔离胶囊(图4a,b),囊内fbs渗透速度明显比对照囊快(图4c),同时囊内细胞可以通过显微镜观察以及用小鼠成像对囊内细胞进行定量分析(图4d,e)。
[0127]
图5为细胞免疫隔离胶囊内细胞体外培养,具体而言,
[0128]
a为pc3细胞体外培养1d、3d、7d、12d、25d、43d后荧光强度定量分析。
[0129]
b为体外培养43天后,基质胶和pc3细胞混合物在24孔板中的图像。c)pc3细胞包裹在囊内96h间,mcherry活性的荧光图像。
[0130]
d为pc3细胞体外培养24h、48h、72h、96h后荧光强度定量分析。
[0131]
e和f分别为pc3细胞在无细胞免疫囊内培养96h后的荧光图像和明亮视野图像。
[0132]
g、h、i和j分别为pc3细胞体外培养30d、50d、75d、90d后,细胞免疫隔离胶囊内的mcherry荧光图像和明亮视野图像。
[0133]
matrigel基质胶可以长期为细胞提供物理支撑,但受机械力会损坏原有状态(图5a,b),而海藻酸钙不能吸附哺乳动物细胞,因此,将细胞与matrigel混合后加入到免疫细胞隔离胶囊中,囊内细胞具有了物理支撑,在体外,短期内以及长期内都可以很好的生长(图5c,d,e,f,g,h,i,j)。
[0134]
图6为皮下注射标记有荧光素酶和基质胶的pc3细胞混合物后,细胞免疫隔离胶囊确保癌细胞在c57bl/6小鼠中长时间存活情况图,具体而言,
[0135]
a和b分别为第1天和第13天获得荧光素酶活性的生物发光图像(bli)。
[0136]
c为体内注射1d、4d、7d、13d后的pc3细胞生物发光信号定量分析。用荧光素酶标记pc3细胞,并与基质胶按1:1(v/v)的比例混合。
[0137]
d为在体内,细胞免疫隔离胶囊内癌细胞生长分析程序示意图。
[0138]
e、f、g和h分别为皮下移植后第0天和第14天,第0天和第21天,第0天和第37天,第0天和第60天,胶囊内pc3细胞mcherry活性的荧光图像。
[0139]
i,j,k,l,m和n分别为用mcherry标记pc3细胞,并与基质胶按1:1(v/v)的比例混合。在体内皮下移植后的第4天、第7天、第14天、第21天、第37天和第60天对细胞免疫隔离胶囊内的pc3细胞荧光信号进行定量分析。
[0140]
在免疫系统正常的小鼠体内,皮下注射的细胞很快被免疫系统清除(图6a,b,c)。而包裹在免疫细胞隔离胶囊内的细胞,可以在免疫系统正常的黑鼠中存活至少60天,而且细胞不断地增殖(图6d,e,f,g,h,i,j,k,l,m,n)。
[0141]
图7为免疫细胞隔离以及前列腺细胞pc3极性化并形成管腔结构,具体而言,
[0142]
a为没有免疫细胞隔离胶囊保护的pc3细胞皮下注射到c57黑鼠8天后的免疫荧光结果;
[0143]
b为免疫细胞隔离胶囊包裹的pc3细胞皮下转移到c57黑鼠21天后的免疫荧光结果;
[0144]
c为没有免疫细胞隔离胶囊保护的pc3细胞皮下注射到c57黑鼠8天后的h&e染色结果;
[0145]
d为免疫细胞隔离胶囊包裹的pc3细胞皮下转移到c57黑鼠21天后的h&e染色结果。
[0146]
不被囊保护地细胞团内有很多免疫细胞出现,而免疫细胞隔离胶囊内基本没有观察到免疫细胞出现(图7a,b)。并且,囊内的前列腺肿瘤细胞pc3具有极性并形成了前列腺官腔结构(图7c,d)。
[0147]
综上所述,本发明制作了孔径和孔隙率增加的工程化海藻酸凝胶以及能够共享移植点非细胞微环境的免疫细胞隔离胶囊,工程化凝胶可以使得小分子,大分子,氧气及细胞交流囊泡自由通过,囊内细胞有充足的营养物质,氧气,囊泡等并隔离细胞免疫反应进而具有高的生存率并能长期体内生长。为多种疾病,如糖尿病,肾功能衰竭等治疗提供可能。
[0148]
目前尚无报道可将热致液晶引入到水凝胶中增加凝胶孔径及孔隙率。据发明人发现,免疫细胞隔离胶囊可能成为重要的细胞治疗工具,能够有效的治疗多种疾病并且可以用肿瘤病人样本制作pdx或pdo模型,对肿瘤发生机制及耐药性进行研究。
[0149]
本发明中,热致液晶可以增加海藻酸凝胶的孔径及孔隙率,使得小分子,大分子,
氧气及囊泡快速的通过凝胶,同时由改造后的凝胶制作的免疫细胞隔离胶囊可以在体内外长期培养细胞。因此,免疫细胞隔离胶囊可以有效地治疗多种疾病,并成功建立肿瘤病人pdx或pdo模型,对肿瘤形成机理及治疗进行研究。
[0150]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。