用于抑制cd73免疫检查点的单克隆抗体及其抗原结合片段以及其用途
相关申请的交叉引用
1.本技术根据35u.s.c.
§
119要求于2020年4月9日提交的韩国专利申请第10-2020-0043607号以及于2020年11月2日提交的韩国专利申请第10-2020-0144595号的优先权,其通过引用合并于此用于所有目的,如同在此完全阐述一样。参照以电子方式提交的序列表
2.随本技术一起提交的ascii文本文件(名称:2662-0003wo01-sequencelisting_st25.txt;大小:48kb;以及创建日期:2021年4月7日)中的以电子方式提交的序列表内容通过引用合并于此用于所有目的,如同在此完全阐述一样。
技术领域
3.本公开涉及一种用于抑制cd73免疫检查点的单克隆抗体及其抗原结合片段以及其用途。
背景技术:
4.传统的癌症治疗方法包括放射治疗、化学疗法以及抗癌剂治疗,且这些方法可以通过直接抑制癌症的生长来治疗癌症。然而,癌细胞对抗癌剂表现出耐药性,并且抗癌剂的使用也可以通过攻击癌细胞以外的细胞而引起副作用。为了克服这些问题,已开发出免疫治疗剂作为新的癌症治疗方法。免疫治疗剂靶向免疫细胞,而不是癌细胞,且诱导免疫细胞攻击癌细胞。
5.在免疫治疗剂中,免疫检查点抑制剂(immune checkpoint blockade)最近引起了人们的关注。免疫检查点(immune checkpoint)是促进或抑制免疫反应的受体。免疫检查点对于调节免疫反应是必须的,且由于免疫检查点也作用于癌症,因此,癌症通过免疫检查点显示出免疫逃避。最近,据报道,许多研究使用免疫检查点治疗癌症。首先,开发了使用与细胞毒性淋巴细胞相关的抗原4(ctla-4;cytotoxic t-lymphocyte-associated antigen 4)和程序性细胞死亡蛋白1(pd-1;programmed cell death protein 1)免疫检查点的抗体,并已显示可以提高黑色素瘤患者的存活率。ctla-4和pd-1免疫检查点抑制剂已用于多种癌症,并已在多种癌症中显示出效能。然而,在一些患者中,使用ctla-4和pd-1的免疫检查点抑制剂在治疗中并没有出现效果。因此,已经对新的免疫检查点进行了许多研究,并且已知癌症的免疫逃避机制之一是由高浓度的免疫抑制腺苷引起的。
6.另一方面,“分化簇73(cd73;cluster of differentiation 73)是催化5'核苷酸的去磷酸化的外部核苷酸酶(ecto-nucleotidase),其主要将单磷酸腺苷(amp;adenosine monophosphate)转化为腺苷。cd73通过gpi锚(anchor)以同源二聚体(homodimer)形式存在于细胞膜中,其中单体(monomer)为65kda,且具有其中n末端和c末端域通过柔性螺旋接头连接的结构。换言之,cd73涉及腺苷的生成,在癌细胞中过表达,并诱导免疫抑制作用。因此,需要研究针对于免疫抑制腺苷的浓度的新的免疫检查点治疗剂。
发明摘要
7.本说明书公开一种单克隆抗体或其抗原结合片段,包括重链可变区,其包括:包括seq id no:1、4、7、10、14或17的氨基酸序列的重链互补决定域1(cdrh1)、包括seq id no:2、5、8、11、15或18的氨基酸序列的cdrh2、以及包括seq id no:3、6、9、12、13、16或19的氨基酸序列的cdrh3;以及轻链可变区,其包括:包括seq id no:20、23、26或29的氨基酸序列的轻链互补决定域1(cdrl1)、包括seq id no:21、24、27或30的氨基酸序列的cdrl2、以及包括seq id no:22、25、28或31的氨基酸序列的cdrl3。
8.在一具体实施例中,所述单克隆抗体或其抗原结合片段包括:重链可变区,包括:包括seq id no:1的氨基酸序列的cdrh1、包括seq id no:2的氨基酸序列的cdrh2、以及包括seq id no:3的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:20的氨基酸序列的cdrl1、包括seq id no:21的氨基酸序列的cdrl2、以及包括seq id no:22的氨基酸序列的cdrl3;重链可变区,包括:包括seq id no:4的氨基酸序列的cdrh1、包括seq id no:5的氨基酸序列的cdrh2、以及包括seq id no:6的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:23的氨基酸序列的cdrl1、包括seq id no:24的氨基酸序列的cdrl2、以及包括seq id no:25的氨基酸序列的cdrl3;重链可变区,包括包括seq id no:7的氨基酸序列的cdrh1、包括seq id no:8的氨基酸序列的cdrh2、以及包括seq id no:9的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:26的氨基酸序列的cdrl1、包括seq id no:27的氨基酸序列的cdrl2、以及包括seq id no:28的氨基酸序列的cdrl3;重链可变区,包括:包括seq id no:10的氨基酸序列的cdrh1、包括seq id no:11的氨基酸序列的cdrh2、以及包括seq id no:12或13的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:20的氨基酸序列的cdrl1、包括seq id no:21的氨基酸序列的cdrl2、以及包括seq id no:22的氨基酸序列的cdrl3;重链可变区,包括:包括seq id no:14的氨基酸序列的cdrh1、包括seq id no:15的氨基酸序列的cdrh2、以及包括seq id no:16的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:20的氨基酸序列的cdrl1、包括seq id no:21的氨基酸序列的cdrl2、以及包括seq id no:22的氨基酸序列的cdrl3;或者重链可变区,包括:包括seq id no:17的氨基酸序列的cdrh1、包括seq id no:18的氨基酸序列的cdrh2、以及包括seq id no:19的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:29的氨基酸序列的cdrl1、包括seq id no:30的氨基酸序列的cdrl2、以及包括seq id no:31的氨基酸序列的cdrl3。
9.在一具体实施例中,所述抗体或其抗原结合片段包括:重链可变区,包括与seq id no:32、33、34、35、36、37或38的氨基酸序列具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸;以及轻链可变区,包括与seq id no:39、40、41或42的氨基酸序列具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸。在一具体实施例中,所述抗体或其抗原结合片段包括:重链可变区,包括seq id no:32、33、34、35、36、37或38的氨基酸序列;以及轻链可变区,包括seq id no:39、40、41或42的氨基酸序列。
10.并且,提供一种单克隆抗体或其抗原结合片段,包括:重链可变区,包括:包括seq id no:66、69、72、75或78的氨基酸序列的cdrh1、包括seq id no:67、70、73、76或79的氨基
酸序列的cdrh2、以及包括seq id no:68、71、74、77或80的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:81、84、87、90或93的氨基酸序列的cdrl1、包括seq id no:82、85、88、91或94的氨基酸序列的cdrl2、以及包括seq id no:83、86、89、90或95的氨基酸序列的cdrl3。
11.在一具体实施例中,所述抗体或其抗原结合片段包括:重链可变区,包括:包括seq id no:66的氨基酸序列的cdrh1、包括有seq id no:67的氨基酸序列的cdrh2、以及包括seq id no:68的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:81的氨基酸序列的cdrl1、包括seq id no:82的氨基酸序列的cdrl2、以及包括seq id no:83的氨基酸序列的cdrl3;重链可变区,包括包括seq id no:69的氨基酸序列的cdrh1、包括seq id no:70的氨基酸序列的cdrh2、以及包括seq id no:71的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:84的氨基酸序列的cdrl1、包括seq id no:85的氨基酸序列的cdrl2、以及包括seq id no:86的氨基酸序列的cdrl3;重链可变区,包括:包括seq id no:72的氨基酸序列的cdrh1、包括seq id no:73的氨基酸序列的cdrh2、以及包括seq id no:74的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:87的氨基酸序列的cdrl1、包括seq id no:88的氨基酸序列的cdrl2、以及包括seq id no:89的氨基酸序列的cdrl3;重链可变区,包括:包括seq id no:75的氨基酸序列的cdrh1、包括seq id no:76的氨基酸序列的cdrh2、以及包括seq id no:77的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:90的氨基酸序列的cdrl1、包括seq id no:91的氨基酸序列的cdrl2、以及包括seq id no:92的氨基酸序列的cdrl3;或者重链可变区,包括:包括seq id no:78的氨基酸序列的cdrh1、包括seq id no:79的氨基酸序列的cdrh2、以及包括seq id no:80的氨基酸序列的cdrh3;以及轻链可变区,包括:包括seq id no:93的氨基酸序列的cdrl1、包括seq id no:94的氨基酸序列的cdrl2、以及包括seq id no:95的氨基酸序列的cdrl3。
12.另一方面提供一种编码所述抗体或其抗原结合片段的核酸、包括所述核酸的表达载体、以及用所述表达载体进行转化的细胞。
13.本说明书提供核酸,其编码包括与seq id no:32、33、34、35、36、37或38具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的重链可变区;以及核酸,其编码包括与seq id no:39、40、41或42具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的轻链可变区。此外,本说明书提供核酸,其编码包括seq id no:32、33、34、35、36、37或38的氨基酸序列的重链可变区;以及核酸,其编码包括seq id no:39、40、41或42的氨基酸序列的轻链可变区。
14.本说明书提供编码seq id no:32的重链可变区的核酸以及编码seq id no:39的轻链可变区的核酸;或者编码seq id no:33的重链可变区的核酸以及编码seq id no:40的轻链可变区的核酸。例如,编码seq id no:32的重链可变区的核酸可以由seq id no:43表示,并且编码seq id no:39的轻链可变区的核酸可以由seq id no:44表示。在一具体实施例中,提供编码seq id no:32或seq id no:33的重链可变区的核酸,以及编码seq id no:39或seq id no:40的轻链可变区的核酸。此外,seq id no:33的重链可变区可以由seq id no:45表示,并且seq id no:40的轻链可变区可以由seq id no:46表示。
15.此外,提供核酸,其编码包括与seq id no:96、98、100、102或104具有至少80%、至
少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的重链可变区;以及核酸,其编码包括与seq id no:97、99、101、103或105具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的轻链可变区。此外,提供编码seq id no:96、98、100、102或104的重链可变区的核酸以及编码seq id no:97、99、101、103或105的轻链可变区的核酸。
16.提供编码seq id no:96的重链可变区的核酸以及编码seq id no:97的轻链可变区的核酸、编码seq id no:98的重链可变区的核酸以及编码seq id no:99的轻链可变区的核酸、编码seq id no:100的重链可变区的核酸以及编码seq id no:101的轻链可变区的核酸、编码seq id no:102的重链可变区的核酸以及编码seq id no:103的轻链可变区的核酸、或者编码seq id no:104的重链可变区的核酸以及编码seq id no:105的轻链可变区的核酸。例如,编码seq id no:96的重链可变区的核酸可以由seq id no:106表示,并且编码seq id no:97的轻链可变区的核酸可以由seq id no:107表示。编码seq id no:98的重链可变区的核酸可以由seq id no:108表示,并且编码seq id no:99的轻链可变区的核酸可以由seq id no:109表示。编码seq id no:100的重链可变区的核酸可以由seq id no:110表示,并且编码seq id no:101的轻链可变区的核酸可以由seq id no:111表示。编码seq id no:102的重链可变区的核酸可以由seq id no:112表示,并且编码seq id no:103的轻链可变区的核酸可以由seq id no:113表示。编码seq id no:104的重链可变区的核酸可以由seq id no:114表示,并且编码seq id no:105的轻链可变区的核酸可以由seq id no:115表示。
17.另外,提供编码包括与seq id no:106、108、110、112或114具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的重链可变区的核酸;以及提供编码包括与seq id no:107、109、111、113或115具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的轻链可变区的核酸。
18.此外,本说明书公开用于预防或治疗癌症的组合物,所述组合物包括上述的抗体或其抗原结合片段。在一具体实施例中,所述组合物还可包括免疫检查点抑制剂或化学治疗剂。
19.另外,公开一种在有需要的受试者中治疗癌症的方法,包括向受试者施用在本技术中公开的所述单克隆抗体或其抗原结合片段的步骤。在一具体实施例中,所述癌症是过表达cd74的癌症。在一具体实施例中,所述癌症是乳腺癌、三阴性乳腺癌(triple-negative breast cancer,tbnc)、胰腺大肠癌、卵巢癌、胃癌、膀胱癌、白血病、前列腺癌、恶性黑色素瘤、癌症、食道癌、胃癌、头颈部癌、肺癌或肾癌。
20.另外,公开了在本技术中公开的所述单克隆抗体及其抗原结合片段在有需要的受试者中治疗癌症的用途。另外,公开了在本技术中公开的单克隆抗体及其抗原结合片段在有需要的受试者中治疗癌症的用途。并且,公开了在本技术中公开的单克隆抗体及其抗原结合片段在制备用于治疗有需要的受试者的癌症的药剂中的用途。附图简单说明
21.本公开的某些实施例的上述和其他方面、特征和优点将从以下结合附图的描述中
变得更加明显,其中:
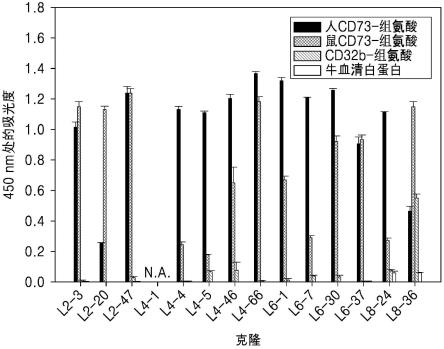
22.图1是显示通过生物淘选挑选的抗cd73抗体对于cd73的结合能力的图,其中,噬菌体抗体与cd73的结合通过测量450nm波长处的吸光度来确认,并且数据的标准偏差由误差线表示。
23.图2a显示通过将抗cd73噬菌体抗体的vh和v
l
基因序列克隆到含有ch和c
l
基因序列的pdcmv-dhfr载体中,从而显示制备的人igg1表达载体。
24.图2b显示igg1抗体的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page;sodium dodecyl sulfate-polyacrylamide gel electrophoresis)分析结果,从泳道1至12依次为l2-3、l2-47、l4-1、l4-4、l4-5、l4-46、l4-66、l6-1、l6-7、l6-30、l6-37和l8-24。
25.图3a显示用于确认经纯化的12种人igg1同种型(isotype)抗体是否与cd73结合而进行酶联免疫吸附剂测定(elisa;enzyme linked immunosorbent assay)的结果。
26.图3b显示用于比较经纯化的12种人igg1同种型抗体是否抑制cd73酶活性而在mda-mb-231细胞中进行体外测定(in vitro assay)的结果。通过使用孔雀石绿试剂(malachite green reagent)测量被cd73分解的磷酸盐来确认cd73酶活性。
27.图3c显示以elisa分析与人、猴、大鼠和小鼠cd73的交叉结合能力,且通过在450nm波长处测量吸光度来确认抗体与cd73的结合。
28.图4a至图4d是比较apba2-01和apba2-02抗体与水溶性cd73的结合力的图,且其中a至d分别显示人、猴、大鼠和小鼠cd73的elisa结果。
29.图5a是通过流式细胞术确认对在表达人cd73的mda-mb-231细胞中的apba2-01和apba2-02抗体与膜cd73的结合力进行比较的图。
30.图5b是通过流式细胞术确认对在表达小鼠cd73的4t1细胞中的apba2-01和apba2-02抗体与膜cd73的结合力进行比较的图。
31.图6a是显示通过生物膜干涉技术(bio-layer interferometry)分析apba2-01和apba2-02抗体是否竞争性结合于cpi-006的表位的结果的图。
32.图6b是显示通过生物膜干涉技术分析apba2-01和apba2-02抗体是否竞争性结合于medi-9447的表位的结果的图。
33.图7是显示通过孔雀石绿测定(malachite green assay)比较apba2-01和apba2-02抗体对水溶性cd73的酶活性的抑制的结果的图。
34.图8a是通过孔雀石绿测定比较在mda-mb-231细胞中apba2-01和apba2-02抗体对膜cd73的酶活性的抑制的结果的图。
35.图8b是显示通过celltiter-测定比较在4t1细胞中apba2-01和apba2-02抗体对膜cd73酶活性的抑制的结果的图。
36.图8c是通过孔雀石绿测定比较在mda-mb-231细胞中apba2-01和apba2-02抗体对膜cd73的酶活性的抑制的结果的图,其中,标准偏差由误差线表示,垂直轴由相对光单位(rlu;relative light units)表示。
37.图8d是显示通过celltiter-测定比较在4t1细胞中apba2-01和apba2-02抗体对膜cd73酶活性的抑制的结果的图。标准偏差由误差线表示,垂直轴由rlu表示。
38.图9是用扫描显微镜确认apba2-01和apba2-02抗体是否移入到膜cd73细胞中的结果。对应于fitc信号的cd73以白色表示,并用比例尺标记。
39.图10a是显示通过测量转移性乳腺癌小鼠模型中的平均肺重量来评估apba2-01和apba2-02抗体的抗癌效能的结果的图;*:p《0.05(单因素方差分析(one-way anova))。
40.图10b是显示通过测量转移性乳腺癌小鼠模型中的肺转移集落数来评估apba2-01和apba2-02抗体的抗癌效能的结果的图;*:p《0.05(单因素方差分析)。
41.图11a是显示通过测量乳腺癌小鼠模型中的肿瘤体积来评估apba2-01和apba2-02migg抗体的癌症生长抑制效能的结果的图;*:p《0.05。**:p《0.01,ns(不显着(not significant):p》0.05(两因素方差分析(two-way anova))。
42.图11b是显示通过在乳腺癌小鼠模型中比较抗体样品之间的肿瘤生长抑制力来评估apba2-01和apba2-02 migg抗体的癌症生长抑制效能的结果的图。
43.图11c是显示通过测量乳腺癌小鼠模型中的小鼠体重来评估apba2-01和apba2-02 migg抗体的癌症生长抑制效能的结果的图;*:p《0.05,**:p《0.01,ns(不显著):p》0.05(两因素方差分析)。
44.图12a是显示通过孔雀石绿测定法在mda-mb-231细胞中比较抗cd73抗体对膜cd73的酶活性抑制能力的结果的图。
45.图12b是显示通过celltiter-测定法比较mda-mb-231细胞中抗cd73抗体对cdc73的酶活性抑制的结果的图。
46.图13a是确认在4t1细胞中myxengo 3、4、6、7和15抗体对膜cd73蛋白的结合力的图。
47.图13b是确认在4t1.2细胞中myxengo 3、4、6、7和15抗体对膜cd73蛋白的结合力的图。
具体实施方式
48.本说明书公开与分化簇73(cd73;cluster of differentiation 73)结合的单克隆抗体或其抗原结合片段。
49.另外,公开编码所述单克隆抗体或其抗原结合片段的核酸、包括所述核酸的表达载体、以及用所述表达载体进行转化的细胞。
50.并且,公开包括所述单克隆抗体或其抗原结合片段的的组合物作为用于预防或治疗癌症的组合物。
51.附加方面将部分地在随后的描述中阐述,并且部分地将从描述中显而易见,或者可以通过实践本公开中阐述的实施例而得以学习。
52.公开一种抗体或其抗原结合片段,包括重链可变区,其包括:包括选自由seq id no:1、4、7、10、14或17的氨基酸序列组成的组中的重链互补决定域1(cdrh1)、包括选自由seq id no:2、5、8、11、15或18的氨基酸序列组成的组中的cdrh2、以及包括选自由seq id no:3、6、9、12、13、16或19的氨基酸序列组成的组中的cdrh3;以及轻链可变区,其包括:包括选自由seq id no:20、23、26或29的氨基酸序列组成的组中的轻链互补决定域1(cdrl1)、包括选自由seq id no:21、24、27或30的氨基酸序列组成的组中的cdrl2、以及包括选自由seq id no:22、25、28或31的氨基酸序列组成的组中的cdrl3。
53.在一具体实施例中,所述单克隆抗体或其抗原结合片段包括重链可变区,其包括:包括seq id no:1的氨基酸序列的cdrh1、包括seq id no:2的氨基酸序列的cdrh2、以及包
biol crystallogr 56(pt 10):1316-1323)的计算机软件进行改进。可以使用本领域技术人员已知的任何方法进行特变诱发作图研究。包括丙氨酸扫描特变技术的特变诱发技术的细节参照例如champe m等人,(1995)j biol chem 270:1388-1394and cunningham bc&wells ja(1989)science 244:1081-1085。在一实施例中,通过使用丙氨酸扫描特变诱发研究确定所述抗体的表位。
60.在本说明书中的术语“抗体”是指使抗原如病毒和细菌等并诱导细胞外刺激抵抗侵入身体的微生物的糖蛋白,特别是指疫球蛋白。在本说明书公开的所述抗体是单克隆抗体、多特异性抗体、人抗体、人源化抗体、嵌合抗体、单链fvs(scfv)、单链抗体、fab片段、f(ab')片段、二硫键连接的fvs(sdfv)和抗-独特型(抗-id)抗体,或所述抗体的表位结合片段等。具体地,所述抗体可以是单克隆抗体和完全人源抗体或人鼠嵌合抗体。所述单克隆抗体是指从实际上同质的抗体群体获得的抗体,即指的是相同的,除了可能存在于群体中的单个抗体中可能以痕量存在的自然发生的突变之外。单克隆抗体具有高度特异性,并针对单个抗原位点。由于本发明涉及抗cd73单克隆抗体,除非另有说明,否则未经修饰使用的术语“抗体”可指结合cd73表位的抗cd73抗体。本发明的范围不仅包括特异性结合cd73的完整抗体形式,还包括所述抗体分子的抗原结合片段。完整抗体具有具有两条全长轻链和两条全长重链的结构,每条轻链通过二硫键连接至重链。重链恒定区具有γ、μ、α、δ和ε型,并具有作为亚类的γ1、γ2、γ3、γ4、α1和α2。轻链的恒定区具有κ和λ型。
[0061]“结合亲和力(binding affinity)”常指分子(例如抗体)的单个结合位点与其结合配偶体(例如抗原)之间的总非共价相互作用的强度。除非另有说明,如在本说明书中使用的“结合亲和力”是指反映结合对成员(例如,抗体和抗原)间1:1相互作用的固有结合亲和力。分子x对其配偶体y的亲和力通常可以表示为平衡解离常数(equilibrium dissociation constant,kd)。可以以本领域已知的多种方式测量和/或表达亲和力,包括平衡解离常数(kd)和平衡缔合常数(equilibrium association constant,ka)。所述kd计算为k
off
/k
on
的商,而所述ka计算为k
on
/k
off
的商。k
on
是指例如抗体与抗原的结合速度常数,而k
off
是指例如抗体与抗原的解离。所述k
on
和k
off
可以通过本领域技术人员已知的技术来确定,例如或kinexa。
[0062]
在本说明书中的术语“免疫特异性结合(immunospecifically binds)”、“免疫特异性识别(immunospecifically recognizes)”、“特异性结合(specifically binds)”以及“特异性识别(specifically recognizes)”是抗体上下文中的类似术语,并如本领域技术人员所理解的,是指与抗原(例如,表位、免疫复合物或抗原结合位点的结合配偶体)结合的分子。例如,特异性结合抗原的分子可以结合其他肽或多肽,并且通常可以以由免疫测定(immunoassays)、kinexa 3000仪器(sapidyne instruments,boise,id)或其他分析法确定为低的亲和力来结合。在一实施例中,与抗原特异性结合的分子以比当分子结合另一抗原时的ka至少2log、2.5log、3log、4log或更高的ka来与抗原结合。
[0063]
在另一具体实施例中,免疫特异性结合抗原的分子在相似的结合条件下不与其他蛋白质发生交叉反应。在一实施例中,免疫特异性结合抗原的分子不会与其他蛋白质发生交叉反应。在一实施例中,本技术提供一种以比其他无关抗原更高的亲和力结合特定抗原如cd73的单克隆抗体及其抗原结合片段。在特定具体实施例中,本技术提供一种单克隆抗体及其抗原结合片段,相比于对通过放射免疫测定、表面等离子共振或动力学排除测定确
定的其他无关抗原的亲和力,所述单克隆抗体及其抗原结合片段以20%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更高亲和力与特定抗体如cd73结合。在一具体实施例中,本说明书中所述的单克隆抗体及其抗原结合片段与无关蛋白的结合范围为,例如,抗体对于通过放射免疫测定法测量的特定抗原的结合的10%、15%或20%或更小。
[0064]
在一具体实施例中,本技术提供以比其他物种的抗原更高的亲和力结合人cd73的单克隆抗体及其抗原结合片段。在特定具体实施例中,本技术提供一种单克隆抗体及其抗原结合片段,相比于对通过放射免疫测定法、表面等离子体共振或动力学排除测定法测量的另一物种的亲和力,所述单克隆抗体及其抗原结合片段以20%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更高的亲和力与人cd73结合。
[0065]
在一具体实施例中,所述抗体可以是fv(例如scfv)或完全抗体(igg)形式。此外,重链恒定区可以选自γ、μ、α、δ或ε中的任何一种同种型。此外,重链恒定区可以选自γ、μ、α、δ或ε中的任何一种同种型。轻链恒定区可以是κ或λ型。
[0066]
在本说明书中的术语“重链(heavy chain:hc或ch)”是指包括可变区域vh以及三个恒定区域ch1、ch2和ch3的全长重链及其片段,所述可变区域vh包括具有足以赋予抗原特异性的可变区(variable region:vr)的氨基酸序列。此外,“轻链(light chain:lc或cl)”指包括可变区域vl和恒定区域cl的全长轻链及其片段,所述可变区域vl包括具有足以赋予抗原特异性的可变区序列的氨基酸序列。
[0067]
所述“人源化”形式的非人(例如鼠)抗体是嵌合抗体,其包含源自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体是被来自具有对来自受体高变区的残基所需的特异性、亲和力和能力的非人类物种(供体抗体)如小鼠、大鼠、兔或非人类灵长类的高变区的残基取代的人类免疫球蛋白(受体抗体)。
[0068]
所述“人抗体”是来源于人免疫球蛋白的分子,其指构成包括互补决定区和结构区的抗体的全部氨基酸序列由人免疫球蛋白构成。在一具体实施例中,本发明涉及能够最小化非预期免疫反应的完全人抗体。
[0069]
所述“嵌合抗体”包括“嵌合”抗体(免疫球蛋白)以及表现出所需生物活性的所述抗体的片段,其中重链和/或轻链的部分与来自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而剩余的链与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源。
[0070]
所述“抗体可变域”是指包括互补决定区(complementary determining region:cdr、cdrh或cdrl,即cdrh1、cdrh2和cdrh3)以及框架区(fr)的氨基酸序列的抗体分子的轻链和重链部分。vh是指重链的可变域(variable region of heavy chain)。vl是指轻链的可变域(variable region of light chain)。
[0071]“互补决定区”(complementarity determining region:cdr、cdrh或cdrhl,即cdrl1、cdrl2和cdrl3)可以指为抗原结合所需而存在的抗体可变域的氨基酸残基。每个可变域通常具有确认为cdr1、cdr2和cdr3的三个cdr区。
[0072]
在本说明书中的术语“框架区(framework region:fr)”是指除cdr残基之外的可变域残基。每个可变域通常具有确认为fr1、fr2、fr3和fr4的四个fr。
[0073]
在本发明中,“抗原结合片段”是指具有抗原结合能力的抗体的片段,包括fab、f
(ab')、f(ab')2、fv等。“fv”片段是包含完整抗体识别和结合位点的抗体片段。该区由二聚体组成,其中一个重链可变域和一个轻链可变域例如与scfv紧密且实际上共价结合。“fab”片段包含轻链的可变域和恒定域以及重链的可变域和第一恒定域(ch1)。f(ab')2抗体片段通常包含一对fab片段,在其羧基末端附近通过其之间的铰链半胱氨酸共价连接。“单链fv”或“scfv”抗体片段包含抗体的vh和vl域,这些域存在于单个多肽链中。fv多肽可以进一步包括位于vh域和vl域之间的多肽接头,所述vh域和vl域使得scfv能够形成用于抗原结合的所需结构。
[0074]
fv是仅具有重链可变区和轻链可变区的最小抗体片段,且产生fv片段的重组技术公开于wo88/10649、wo88/106630、wo88/07085、wo88/07086和wo88/09344。在双链fv(two-chain fv)中,重链可变区和轻链可变区通过非共价键连接,且单链fv(single-chain fv,scfv)一般是重链可变区和轻链可变区通过肽接头共价键连接或直接连接在c端,因此,可以形成类似于双链fv的二聚体结构。这抗体片段可以使用蛋白水解酶获得(例如,用木瓜蛋白酶对整个抗体进行限制性切断而获得fab,用胃蛋白酶切断而获得f(ab')2片段),且可以通过基因重组技术制作。
[0075]
在本说明书中的术语“噬菌体展示”是指将变体多肽展示为与噬菌体如丝状噬菌体颗粒表面上的至少一部分包膜蛋白的融合蛋白的技术。噬菌体展示的有用性在于其可以通过靶向大量随机蛋白质变体来快速有效地分选以高亲和力结合靶抗原的序列。在噬菌体上展示肽和蛋白质文库已用于筛选数以百万计的多肽以寻找具有特异性结合特性的多肽。
[0076]
噬菌体展示技术为生成和筛选结合特定配体(例如抗原)的新型蛋白质提供了强大的工具。通过使用噬菌体展示技术,可以生成大量蛋白质变体文库,并且可以快速分选以高亲和力结合靶抗原的序列。编码变体多肽的核酸与编码病毒包膜蛋白如基因ⅲ蛋白或基因
ⅷ
蛋白的核酸序列融合。已经开发了一种单价噬菌体展示系统,其中编码蛋白质或多肽的核酸序列与编码基因ⅲ蛋白质的一部分的核酸序列融合。在单价噬菌体展示系统中,基因融合产物以低水平表达,野生型基因iii蛋白也表达以保持颗粒感染性。
[0077]
证明肽在丝状噬菌体表面的表达和功能性抗体片段在大肠杆菌周质中的表达是对于开发抗体噬菌体展示文库很重要。已经以多种方式制备抗体或抗原结合多肽文库,例如通过插入随机dna序列来改变单个基因的方法或克隆相关基因家族的方法。可以筛选文库以表达伴随所需特征的抗体或抗原结合蛋白。
[0078]
噬菌体展示技术与用于生产具有所需特性的抗体的常规杂交瘤和重组方法相比具有几个优势。该技术允许在不使用动物的情况下在短时间内生成具有各种序列的大型抗体文库。杂交瘤的制备或人源化抗体的制备可能需要几个月的制备期。此外,由于不需要免疫,噬菌体抗体文库可以产生针对有毒或低抗原性抗原的抗体。噬菌体抗体文库也可用于生成和确认新的治疗性抗体。
[0079]
可以使用其中使用噬菌体展示文库从免疫的、未免疫的人、生殖细胞系序列或者处女b细胞ig文库(repertory)生人抗体的技术。可通过使用各种淋巴组织来制备处女或非免疫抗原结合文库。
[0080]
能够从噬菌体展示文库中确认和分离高亲和力抗体的技术对于分离新型治疗性抗体非常重要。从文库中分离高亲和力抗体可能取决于文库的大小、细菌细胞的生产效率和文库的多样性。由抗体或抗原结合蛋白的不正确折叠和终止密码子的存在导致的生产效
率低下会减少文库的大小。当抗体或抗原结合域没有正确折叠,则可以抑制细菌细胞中的表达。可以通过交替突变可变/恒定界面表面上的残基或选定的cdr残基来改进表达。当在细菌细胞中产生抗体噬菌体文库时,框架区的序列是提供适当折叠的要素之一。
[0081]
在高亲和力抗体分离中,产生抗体或抗原结合蛋白的各种文库很重要。已发现cdr3区经常参与抗原结合。由于重链上的cdr3区在大小、序列和结构构象上很多样,其可用于制备各种文库。
[0082]
此外,可以通过在每个位置使用所有20个氨基酸随机化可变重链和轻链的cdr区来产生多样性。使用所有20个氨基酸可以产生高度多样化的变体抗体序列,并增加确认新抗体的机会。
[0083]
本发明的抗体或抗体片段在能够特异性识别cd73的范围内不仅可以包括本说明书中所述的抗cd73抗体的序列,还可以包括其生物学等价物。例如,可以对抗体的氨基酸序列进行额外的改变,以进一步提高抗体的结合亲和力和/或其他生物学特性。此类修饰包括例如抗体的氨基酸序列残基的缺失、插入和/或取代。这种氨基酸突变是基于氨基酸侧链取代基的相对相似性,例如疏水性、亲水性、电荷、大小等。根据对氨基酸侧链取代基的大小、形状和类型的分析,可以得知,精氨酸、赖氨酸和组氨酸都是带正电荷的残基;丙氨酸、甘氨酸和丝氨酸的大小相似;且苯丙氨酸、色氨酸和酪氨酸具有相似的形状。因此,基于这些考虑,精氨酸、赖氨酸和组氨酸;丙氨酸、甘氨酸和丝氨酸;而苯丙氨酸、色氨酸和酪氨酸可以说是生物学等价物。
[0084]
在导入所述突变时,可以考虑氨基酸的亲水指数(hydropathic index)。每个氨基酸根据其疏水性和电荷被赋予一个疏水性指数:异亮氨酸( 4.5);缬氨酸( 4.2);亮氨酸( 3.8);苯丙氨酸( 2.8);半胱氨酸/半胱氨酸( 2.5);蛋氨酸( 1.9);丙氨酸( 1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。疏水性氨基酸指数在赋予蛋白质相互作用的生物学功能(interactive biological function)方面非常重要。众所周知,必须取代为相似疏水性指数的氨基酸以保持相似的生物活性。当参考疏水性指数导入突变时,优选地,在疏水性指数差异在
±
2以内、更优选在
±
1以内、甚至更优选在
±
0.5以内的氨基酸之间进行取代。
[0085]
另一方面,也已知具有相似亲水性值(hydrophilicity value)的氨基酸之间的取代导致具有相同的生物学活性的蛋白。如美国专利第4,554,101号中所公开的,以下亲水性值被赋予给每个氨基酸残基:精氨酸( 3.0);赖氨酸( 3.0);天冬氨酸( 3.0
±
1);谷氨酸( 3.0
±
1);丝氨酸( 0.3);天冬酰胺( 0.2);谷氨酰胺( 0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5
±
1);丙氨酸(-0.5);组氨酸(-0.5);半胱氨酸(-1.0);蛋氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。不完全改变分子活性的蛋白质中的氨基酸交换是本领域已知的(h.neurath,r.l.hill,the proteins,academic press,new york,197)。最常见的交换是氨基酸残基ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、thr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu和asp/gly之间的交换。
[0086]
在一具体实施例中,沿本技术所述的抗体的vh(例如,cdr1、cdr2或cdr3)和/或vl(例如,cdr1、cdr2或cdr3)区的一个或多个cdr的位置只要维持与抗原的免疫特异性结合
(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),可以根据2、3、4、5或6个氨基酸的位置而变化。例如,只要维持免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),定义在本技术中所述的抗体的cdr位置通过相对于单克隆抗体或其抗原结合片段的cdr位置将cdr的n端和/或c端边界移动1、2、3、4、5或6个氨基酸来改变。在另一具体实施例中,沿本说明书所述的抗体的vh(例如,cdr1、cdr2或cdr3)和/或vl(例如,cdr1、cdr2或cdr3)区的一个或多个cdr的长度只要维持与抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),可以根据1、2、3、4、5或更多个氨基酸而变化。
[0087]
在一具体实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3可以是比本技术中所述的cdr中的一个或更多个短的1、2、3、4、5个或更多个的氨基酸。在另一具体实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3可以是比本技术中所述的cdr中的一个或更多个长的1、2、3、4、5个或更多个的氨基酸。在另一实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3的氨基末端与本技术中所述的cdr中的一个或多个相比,可以延长1、2、3、4、5或更多个氨基酸。在另一实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3的羧基末端与本技术中所述的cdr中的一个或多个相比,可以延长1、2、3、4、5或更多个氨基酸。在另一实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3的氨基末端与本技术中所述的cdr中的一个或多个相比,可以缩短1、2、3、4、5或更多个氨基酸。在另一实施例中,只要维持对于抗原的免疫特异性结合(例如,实际上维持如至少50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多),本技术中所述的cdrl1、cdrl2、cdrl3、cdrh1、cdrh2和/或cdrh3的羧基末端与本技术中所述的cdr中的一个或多个相比,可以缩短1、2、3、4、5或更多个氨基酸。本领域已知的任何方法可用于确定是否维持与抗原的免疫特异性结合,例如,记载了本说明书的“实施例”中描述的结合测定和条件。
[0088]
还可以使用数学算法来确定两个序列(例如,氨基酸序列或核酸序列)之间的百分比同一性。用于比较两个序列的数学算法的具体非限制性示例是修改为karlin s&altschul sf(1993)pnas 90:5873-5877的karlin s&altschul sf(1990)pnas 87:2264-2268的算法。所述算法被合并于altschul sf等人,(1990)j mol biol 215:403的nblast和xblast程序中。blast核苷酸搜索可以用nblast苷酸程序参数进行,例如分数=100,字长=12,以获得与本技术中所述的核酸分子同源的核苷酸序列。blast核苷酸搜索可以用xblast苷酸程序参数进行,例如分数=50,字长=3,以获得与本技术中所述的核酸分子同源的核
苷酸序列。为了获得用于比较目的的间隙对位,可以使用如ltschul sf等人,(1997)nuc acids res 25:3389 3402中所述的间隙blast(gapped blast)。或者,可通过使用psi blast进行测分子间的远距离关系的迭代搜索(id)。在使用blast、gapped blast和psi blast程序时,可以使用每个程序的默认参数(例如xblast和nblast)(例如,参照万维网上的美国国立生物技术信息中心(national center for biotechnology information,ncbi),ncbi.nlm.nih.gov)。用于比较数列的算法的另一个具体的、非限制性的例子是myers和miller的算法(the algorithm of myers and miller),1988,cabios 4:11 17。这些算法被合并于align程序(2.0版)中,其是gcg序列对位软件包的一部分。当使用align程序进行氨基酸序列比较时,可以使用pam120重量残基表、空位长度罚分12以及空位罚分4。
[0089]
两个序列之间的百分比同一性可以使用与上述技术类似的技术来确定有或没有空位。在计算百分比id时,通常只计算完全一致的项目。
[0090]
另一方面提供一种编码所述抗体或其抗原结合片段的核酸、包括所述核酸的表达载体、以及用所述表达载体转化的细胞。
[0091]
提供核酸,其编码包括与seq id no:32、33、34、35、36、37或38的氨基酸序列具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸的重链可变区;以及一种核酸,其编码包括与seq id no:39、40、41或42的氨基酸序列具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸的及轻链可变区。此外,提供核酸,其编码包括seq id no:32、33、34、35、36、37或38的氨基酸序列的重链可变区;以及核酸,其编码包括seq id no:39、40、41或42的氨基酸序列的轻链可变区。
[0092]
在一具体实施例中,提供编码seq id no:32的重链可变区和seq id no:39的轻链可变区的核酸;或者编码seq id no:33的重链可变区和seq id no:40的轻链可变区的核酸。例如,所述编码seq id no:32的重链可变区的核酸可以由seq id no:43表示,且所述编码seq id no:39的轻链可变区的核酸可以由seq id no:44表示。在一具体实施例中,提供编码seq id no:32或seq id no:33的重链可变区的核酸,以及编码seq id no:39或seq id no:40的轻链可变区的核酸。此外,所述编码seq id no:33的重链可变区的核酸可以由seq id no:45表示,且所述编码seq id no:40的轻链可变区的核酸可以由seq id no:46表示。
[0093]
此外,提供一种核酸,其编码包括与seq id no:96、98、100、102或104具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的重链可变区;以及一种核酸,其编码包括与seq id no:97、99、101、103或105具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的轻链可变区。此外,提供编码seq id no:96、98、100、102或104的重链可变区的核酸以及编码seq id no:97、99、101、103或105的轻链可变区的核酸。
[0094]
在一具体实施例中,提供编码seq id no:96的重链可变区以及seq id no:97的轻链可变区的核酸、编码seq id no:98的重链可变区以及seq id no:99的轻链可变区的核酸、编码seq id no:100的重链可变区以及seq id no:101的轻链可变区的核酸、编码seq id no:102的重链可变区以及seq id no:103的轻链可变区的核酸、或者编码seq id no:104的重链可变区以及seq id no:105的轻链可变区的核酸。例如,所述编码seq id no:96
的重链可变区的核酸可以由seq id no:106表示,并且所述编码seq id no:97的轻链可变区的核酸可以由seq id no:107表示。所述编码seq id no:98的重链可变区的核酸可以由seq id no:108表示,并且所述编码seq id no:99的轻链可变区的核酸可以由seq id no:109表示。所述编码seq id no:100的重链可变区的核酸可以由seq id no:110表示,并且所述编码seq id no:101的轻链可变区的核酸可以由seq id no:111表示。所述编码seq id no:102的重链可变区的核酸可以由seq id no:112表示,并且所述编码seq id no:103的轻链可变区的核酸可以由seq id no:113表示。所述编码seq id no:104的重链可变区的核酸可以由seq id no:114表示,并且所述编码seq id no:105的轻链可变区的核酸可以由seq id no:115表示。
[0095]
此外,提供核酸,其编码包括与seq id no:106、108、110、112或104具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的重链可变区;以及一种核酸,其编码包括与seq id no:107、109、111、113或115具有至少80%、至少85%、至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的氨基酸序列的轻链可变区。
[0096]
可通过分离编码本发明的抗体或其抗原结合片段的核酸来重组产生单克隆抗体或其抗原结合片段。分离核酸并将其插入可复制载体中,从而进一步克隆(dna扩增)或进一步表达。在一具体实施例中,本说明书中所述的核酸中的一种或多种可以插入一个载体中,或者说明书中所述的每种核酸可以插入单独的载体中。基于此,本发明在另一方面公开了包括所述核酸的载体。
[0097]
在本说明书中的术语“核酸”具有全面包括dna(gdna和cdna)和rna分子的含义,且在核酸中作为基本构成单位的核苷酸不仅包括天然核苷酸,还包括修饰糖或碱基部位的相似物(analogue)。可以修饰编码本发明的重链和轻链可变区的核酸序列。所述修饰包括核苷酸的添加、缺失或非保守取代或保守取代。
[0098]
使用常规方法(例如,通过使用能够特异性结合编码抗体重链和轻链的dna的寡核苷酸探针)容易地分离或合成编码所述抗体的dna。许多载体可用。载体成分通常包括但不限于以下一种或多种:信号序列、复制起点、一种或多种标记基因、增强子元件、启动子和转录终止序列。
[0099]
在本说明书中的术语“载体”是指用于在宿主细胞中表达靶基因的手段,并包括粘粒载体;病毒载体如噬菌体载体、腺病毒载体、逆转录病毒载体和腺相关病毒载体等。在所述载体中,编码抗体的核酸与启动子可操作地连接。
[0100]“可操作地连接”是指核酸表达调节序列(例如,启动子、信号序列或转录调节物结合位点阵列)与另一核酸序列之间的功能性结合,由此所述调节序列调节所述其他核酸序列的转录和/或翻译。
[0101]
在使用原核细胞作为宿主的情况下,通常包括能够进行转录的强启动子(例如,tac启动子、lac启动子、lacuv5启动子、lpp启动子、plλ启动子、prλ启动子、rac5启动子、amp启动子、reca启动子、sp6启动子、trp启动子和t7启动子等)、用于翻译起始的核糖体结合位点和转录/翻译终止序列。另外,例如,在使用真核细胞作为宿主的情况下,可以使用源自哺乳动物细胞基因组的启动子(如金属硫氨酸启动子、β-肌动蛋白启动子、人血红蛋白启动子和人肌肉肌酸启动子)或源自哺乳动物病毒的启动子(例如,腺病毒晚期启动子、牛痘病毒
7.5k启动子、sv40启动子、巨细胞病毒(cmv;cytomegalovirus)启动子、hsv的tk启动子、小鼠乳腺肿瘤病毒(mmtv;mouse mammary tumor virus)启动子、hiv的ltr启动子、莫洛尼病毒的启动子、爱泼斯坦巴尔病毒(ebv;epstein barr virus)的启动子和劳氏肉瘤病毒(rsv;rous sarcoma virus)的启动子),且通常具有多聚腺苷酸化序列作为转录终止序列。根据情况,载体可以与其他序列融合以促进从中表达的抗体的纯化。待融合的序列包括例如谷胱甘肽s-转移酶(pharmacia,美国)、麦芽糖结合蛋白(neb,美国)、flag(ibi,美国)以及6xhis(六组氨酸(hexahistidine);quiagen,美国)等。所述载体包括本领域常用的抗生素抗性基因作为选择标记,且具有例如氨苄青霉素、庆大霉素、羧苄青霉素、氯霉素、链霉素、卡那霉素、遗传霉素、新霉素和四环素的抗性基因。
[0102]
本发明在另一方面提供一种用上述载体转化的细胞。用于生成在本技术所述的抗体或其抗原结合片段的细胞可以是但不限于原核生物、酵母或高等真核细胞。可以使用原核宿主细胞,例如如大肠杆菌(escherichia coli)、诸如枯草芽孢杆菌和苏云金芽孢杆菌的等芽孢杆菌属菌株、链霉菌属(streptomyces)、假单胞菌属(pseudomonas)(例如,恶臭假单孢菌(pseudomonas putida))、奇异变形杆菌;(proteus mirabilis)和葡萄球菌(staphylococcus)(例如,肉葡萄球菌(staphylococcus carnosus)。然而,动物细胞是最受关注的,且有用的宿主细胞株的例子有cos-7、bhk、cho、chok1、dxb-11、dg-44、cho/-dhfr、cv1、cos-7、hek293、bhk、tm4、vero、hela、mdck、brl 3a、w138、hep g2、sk-hep、mmt、tri、mrc 5、fs4、3t3、rin、a549、pc12、k562、per.c6、sp2/0、ns-0、u20s或ht1080,但不限于此。
[0103]
本发明提供一种制备所述抗体或其抗原结合片段的方法,包括(a)培养包括所述表达载体所述的细胞;以及(b)从所述培养的细胞中回收抗体或其抗原结合片段。所述细胞可以在各种培养基中培养。在市售的培养基中,可以用作培养基而没有限制。本领域技术人员已知的所有其他必须补充物也可以以适当的浓度包括在内。培养条件,例如温度、ph等,已经与选择用于表达的宿主细胞一起使用,这对于本领域技术人员来说将是显而易见的。所述抗体或其抗原结合片段的回收可以通过例如离心或超滤除去杂质,并且可以使用例如亲和色谱法纯化所得产物。可以使用额外的其他纯化技术,例如阴离子或阳离子交换色谱、疏水相互作用色谱、羟基磷灰石色谱等。
[0104]
另一方面提供用于预防、改善或治疗癌症的组合物,其包括所述抗体或其抗原结合片段。所述组合物可以是药物组合物或保健功能食品。在一具体实施例中,所述组合物还可包括免疫检查点抑制剂或化学抗癌剂。例如,所述免疫检查点抑制剂可以是抗ctla-4抗体、抗pd-1抗体、抗pd-l1抗体等,且所述化学抗癌剂可以是例如化学疗法制剂(chemotherapy drug)、酪氨酸激酶抑制剂(tyrosine kinase inhibitor)等。在另一具体实施例中,所述组合物可以与放射线治疗剂组合施用。因此,根据一方面的组合物在表达cd73的各种癌症物种中增加抗癌活性,因此可以用作癌症治疗剂。
[0105]
例如,可以是用于预防或治疗癌症的药物组合物,包括(a)所述针对cd73的抗体或其抗原结合片段的药学有效量;以及(b)药学上可接受的载体。例如,本发明提供一种在有需要的受试者中预防或治疗癌症的方法,且所述方法包括向个体施用所需有效量的根据本发明的针对cd73的抗体或其抗原结合片段的步骤。
[0106]
由于所述组合物使用本技术中所述的单克隆抗体或其抗原结合片段作为有效成分,因此省略了对两者共同内容的描述。
[0107]
如在以下实施例中所证明,由于本发明的抗体或其抗原结合片段与cd73以高亲和力结合,从而可以抑制过表达cd73的癌细胞的移动,因此,可以用于癌症的预防和治疗。“预防”是指通过施用所述组合物来抑制或延缓癌症进展的任何行为,且“治疗”是指抑制癌症的发展、减轻癌症或消除癌症。
[0108]“过表达cd73的癌症”是指与相同组织类型的非癌细胞相比,在癌细胞表面具有显着更高水平的cd73的癌症。参照hay,c.m.等人,oncoimmunol.5:e1208875,10pages(2016),以及gao,z-w.等人,biomed res.intl.2014:460654,9页(2014)。作为应用于所述组合物的疾病的癌症是一种过度表达cd73的癌症,例如,可以是乳腺癌、结肠癌、成胶质细胞瘤、脑脊髓肿瘤、头颈部癌、肺癌、胸腺瘤、食道癌、肝癌、胰腺癌、胆道癌、肾癌、膀胱癌、前列腺癌、睾丸癌、生殖细胞瘤、卵巢癌、宫颈癌、子宫内膜癌、淋巴瘤、急性白血病、慢性白血病、多发性骨髓瘤、肉瘤、恶性黑色素瘤或皮肤癌等。在一具体实施例中,所述癌症是乳腺癌、三阴性乳腺癌(triple-negative breast cancer,tbnc)、胰腺大肠癌、卵巢癌、胃癌、膀胱癌、白血病、前列腺癌、恶性黑色素瘤、癌症、食道癌、胃癌、头颈部癌、肺癌或肾癌。
[0109]
另一方面可以是用于抑制癌细胞转移或侵袭的组合物,其包括所述针对cd73的抗体或其抗原结合片段。另外,本发明提供一种在有需要的个体中抑制癌细胞转移或侵袭的方法,且所述方法包括处理所述针对cd73的单克隆抗体或其抗原结合片段。
[0110]
本发明的组合物中可包括药学上可接受的载体,其包括但不限于乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、海藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、水、糖浆、甲基纤维素、甲基羟基苯甲酸、羟基苯甲酸丙酯、滑石、硬脂酸镁和矿物油等。本发明的组合物除了上述成分以外,还可以包括润滑剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、防腐剂等。
[0111]
本发明的药物组合物可以口服或胃肠外施用。在胃肠外施用的情况下,可以通过静脉内注射、皮下注射、肌肉注射、腹腔注射、内皮施用、内皮施用、局部施用、鼻内施用、肺内施用以及直肠施用等。在一具体实施例中,可以以静脉注射的形式施用。当口服施用时,由于蛋白质或肽被消化,应制剂化口服组合物以包覆活性药剂或防止其在胃中分解。此外,药物组合物可以通过能够将活性物质移动至靶细胞的任何装置来施用。
[0112]
根据本发明的组合物的合适施用量根据制剂化方法、施用方式、患者年龄、体重、性别、病理状况、饮食、施用时间、施用途径、排泄速度和反应敏感性等因素而异,且通常熟练的医师可以容易地确定和处方出对所需治疗或预防有效的施用量。例如,本发明的药物组合物的一日施用量可以为个体体重的0.0001mg/kg至100mg/kg、0.001mg/kg至50mg/kg、0.01mg/kg至25mg/kg、0.1mg/kg至10mg/kg、1mg/kg至5mg/kg或其范围。在本说明书中术语“药学有效量”是指足以预防或治疗癌症的量。
[0113]
本发明的药物组合物根据本发明所属领域的普通技术人员可以容易地实施的方法,通过使用药学上可接受的载体和/或赋形剂来制剂化,从而可以制备成单位用量或通过放入多用量容器来制备。此时,剂型可以是在油或水介质中的溶液、悬浮液或乳化液的形式,或者可以是提取物、散剂、栓剂、粉剂、颗粒剂、片剂或胶囊剂的形式,并可以另外包含分散剂或稳定剂。
[0114]
本发明的组合物可以作为单独的治疗剂施用或与其他治疗剂组合施用,并且可以与常规治疗剂顺序或同时施用。
[0115]
在根据本发明的用于预防或改善癌症的保健功能食品中,当所述抗体或其抗原结合片段用作保健功能食品的添加剂时,可以直接将其添加或与其他食品或食品成分一起使用,并且可以根据常规方法适当使用。有效成分的混合量可以根据预防、保健或治疗等各种使用目的来适当确定。
[0116]
保健功能食品的剂型可以是散剂、颗粒剂、丸剂、片剂、胶囊剂,也可以是一般食品或饮料的形式。
[0117]
所述食品的种类没有特别限定,作为可以添加所述物质的食品的例子,包括肉类、香肠、面包、巧克力、糖果类、零食类、饼干类、比萨饼、拉面、其他面类、口香糖类、冰淇淋类等乳制品、各种汤、饮料、茶、饮品、酒精饮料和维生素复合物等,并可包括通常意义上的所有食品。
[0118]
通常,在制备食品或饮料时,基于100重量份的原料,所述抗体或其抗原结合片段可以以15重量份或更小,优选10重量份或更小的量来添加。但是,在以健康卫生或健康调节为目的而长期摄入的情况下,所述量可以小于或等于上述范围。并且,在本发明中使用源自天然物的裂解物,在安全性方面没有问题,因此可以使用超出所述范围的量。
[0119]
在根据本发明的保健功能食品中,饮料可以含有各种香味剂或天然碳水化合物作为附加成分,如常规饮料。上述天然碳水化合物可以是单糖如葡萄糖和果糖,二糖如麦芽糖和蔗糖,多糖如糊精和环糊精,以及糖醇如木糖醇、山梨糖醇和赤藓糖醇等。作为甜味剂可以使用索马甜、甜菊糖苷提取物等天然甜味剂、糖精、阿斯巴甜等合成甜味剂等。天然碳水化合物的比例可为每100ml的根据本发明的饮料约0.01g至0.04g,优选约0.02g至0.03g。
[0120]
除上述以外,根据本发明的用于预防或改善癌症的保健功能食品包括各种营养素、维生素、电解质、调味剂、着色剂、果胶酸及其盐、海藻酸及其盐、有机酸、保护胶体增稠剂,ph调节剂,稳定剂、防腐剂、甘油、醇以及用于碳酸饮料的碳酸化剂。此外,本发明的用于改善睡眠的组合物可以含有用于制备天然果汁、果汁饮料和植物饮料的水果。这些成分可以单独使用或混合使用。这些添加剂的比例没有限制,一般相对于本发明的保健功能食品100重量份在0.01至0.1重量份的范围内选择。
[0121]
另一方面提供用于诊断癌症的组合物以及并可其的用于诊断癌症的试剂盒,所述组合物包括所述抗体或其抗原结合片段。本发明还涉及通过处理根据本发明的针对cd73的抗体或其抗原结合片段来诊断癌症的方法。
[0122]
通过根据本发明的针对cd73的抗体测量样品中cd73的表达水平可以诊断癌症。表达水平可以根据常规免疫测定方法测量,且可以通过使用所述针对cd73的抗体的放射免疫分析、放射免疫沉淀、免疫沉淀、免疫组织化学染色、elisa、捕获-elisa(enzyme-linked immunosorbent assay)、抑制或竞争测定、夹心测定、流式细胞术(flow cytometry)、免疫荧光染色和免疫亲和纯化来测量,但不限于此。通过所述免疫测定过程分析最终信号的强度,可以诊断癌症。换言之,当本发明的标志物的蛋白质在生物样品中高表达并且信号强于正常生物学样品(如,正常胃组织、血液、血浆或血清)时,则诊断为癌症。
[0123]
另一方面提供一种用于诊断癌症的试剂盒,其包括所述用于诊断癌症的组合物。所述试剂盒包括根据本发明的针对cd73的抗体,并且可以通过分析样品与抗体之间的反应所显示的信号来诊断癌症。此时,所述信号可包括但不限于与抗体结合的酶,例如碱性磷酸酶、β-半乳糖苷酶、辣根过氧化物酶、萤光素酶或细胞色素p450。此时,当碱性磷酸酶用作酶
时,作为底物,可以使用诸如溴氯吲哚磷酸盐(bcip;bromochloroindolyl phosphate)、氮蓝四唑(nbt;nitro blue tetrazolium)、萘酚-as-b1-磷酸盐(naphthol-as-b1-phosphate)以及增强化学荧光(ef;enhanced chemifluorescence)的显色底物。当使用辣根过氧化物酶时,可以使用诸如氯萘酚、氨基乙基咔唑、二氨基联苯胺、d-荧光素、光泽精(双-n-甲基吖啶硝酸盐)、苄氧基试卤灵、鲁米那、荧光红(amplex red)试剂(10-乙酰基-3,7-二羟基吩恶嗪)、hyr(对苯二胺-hcl和邻苯二酚)、tmb(四甲基联苯胺)、abts(2,2'-氮杂二[3-乙基苯并噻唑啉磺酸盐])、邻苯二胺(opd)和萘酚/派洛宁、葡糖氧化酶及t-nbt和m-吩嗪硫酸甲酯(pms;phenazine methosulfate)的底物,但不要限于此。
[0124]
另外,所述试剂盒可以包括产生可检测信号的标记,且所述标记可包括化学物质(例如生物素)、酶(碱性磷酸酶、β-半乳糖苷酶、辣根过氧化物酶和细胞色素p450)、放射性物质(例如c14、i125、p32和s35)、荧光物质(例如荧光素)、发光物质、化学发光材物质(chemiluminescent)和荧光共振能量转移(fret;fluorescence resonance energy transfer),但不限于此。用于癌症诊断的酶的活性测量或信号的测量可以根据本领域已知的各种方法进行。由此可以对cd73表达进行定性或定量分析。
[0125]
在下文中,将详细参照附图中所示的实施例,其中相同的附图标记始终表示相同的元件。在这方面,本实施例可以具有不同的形式,并且不应被解释为限于本说明书所记载的说明。因此,以下将通过参照附图描述本说明书的方面来简要描述实施例。在本说明书中使用的术语“和/或”包括一个或多个相关列表项的任何和所有组合。组件列表前面的诸如“至少一个”之类的表达会修改整个组件列表,但不会修改列表中的组件。实施例
[0126]
在下文中,提出优选的实施例以帮助理解本发明。然而,提供以下实施例只是为了更容易理解本发明,且本发明的内容不受以下实施例的限制。
[0127]
制备例1.通过生物淘筛(bio panning)的抗cd73抗体的挑选
[0128]
1-1.挑选特异性结合cd73的噬菌体抗体
[0129]
为了挑选与人和小鼠cd73蛋白特异性结合的抗体克隆,进行使用hudvfab-8l噬菌体抗体文库的生物淘筛。首先,将重组人cd73蛋白(sino biological,中国)和重组小鼠cd73蛋白(sino biological)分别与dynabeads
tm m-280tosylactivated微珠在4℃下反应48小时。将与每个cd73蛋白结合的微珠用含有udvfab-8l(hudvfab-l1~l6,l8,l12)重组抗体(展示于噬菌体包膜蛋白pⅲ的fab)文库的封闭缓冲液(blocking buffer:含有3%脱脂乳;(skim milk)和0.1%吐温20的磷酸盐缓冲生理盐水(pbs;phosphate-buffered saline))进行处理,且在4℃下反应16小时。此后,使用kingfisher ml设备去除非特异性结合cd73蛋白的重组噬菌体。通过用0.2m甘氨酸(ph 2.2)缓冲液进行处理来洗脱与cd73蛋白特异性结合的噬菌体,然后通过用1m的tris-hcl(ph 9.0)缓冲液进行处理来将其中和。用中和的噬菌体处理导入有抗体文库的轻链基因的每个tg1细胞(amersham pharmacia biotech,瑞典)并在37℃下感染1小时。将感染有噬菌体的tg1细胞铺在lb/act固体培养基(含有50μg/ml的氨苄青霉素(ampicillin)、10μg/ml的羧苄青霉素(carbenicillin)以及10μg/ml的四环素(tetracycline)的lb培养基)上并在27℃下培养16小时以去除未感染的tg1细胞。通过向含有培养的菌落的平板中添加10ml的液体培养基进行悬浮后,稀释至4.8
×
108个细胞/ml,且添加辅助噬菌体(ex-phage),从而在37℃下感染tg1细胞1小时。之后,使
用离心机将感染的tg1细胞沉淀,并去除上清液,然后将tg1细胞重悬于5ml的2
×
yt/actka培养基(含有50μg/ml氨苄青霉素、10μg/ml羧苄青霉素(carbenicillin)、10μg/ml四环素、50μg/ml那霉素、和0.001%阿拉伯糖(arabinose)的2
×
yt培养基),并在27℃下培养6小时。然后,使用离心机获得噬菌体的上清液,并与结合有cd73蛋白的dynabeads tm m-280 tosylactivated微珠在4℃下反应约20小时以结合。此后,所述生物淘选过程重复进行3此以挑选特异性结合cd73的噬菌体抗体。结果,从hudvfab-8l噬菌体抗体文库挑选包括结合于cd73的l2、l4、l6和l8轻链的多克隆抗体(polyclonal antibody)。
[0130]
1-2.挑选特异性结合cd73的单克隆噬菌体抗体
[0131]
在上述1-2中挑选的多克隆抗体中,通过进行噬菌体elisa(phage enzyme-linked immunosorbent assay)来挑选与cd73特异性结合的同时具有彼此不同重链cdr(hcdr)序列的单克隆抗体。将重组人cd73蛋白和重组小鼠cd73蛋白在包被缓冲液(coating buffer,0.1m nahco3,ph 9.6)中稀释至2μg/ml的浓度后,在96孔maxisorp elisa板(nunc,丹麦)中以每孔50μl分株,并在4℃下反应16小时,且将cd73蛋白涂布在板上。去除所有未涂布的蛋白和缓冲液,并以每孔200μl分株封闭缓冲液,且在37℃下反应1小时。1小时后,去除所有缓冲液,并以每孔200μl分株含有0.1%吐温20的pbs(pbs-t)到所有孔中,且重复此洗涤过程3次。将封闭缓冲液中含有噬菌体的上清液稀释至1/10,从而以50μl分株到每个孔中,并在37℃下反应1小时。然后,以与上述相同的方式洗涤,且用羊抗m13辣根过氧化物酶(horseradish peroxidase)(ge healthcare,芝加哥,伊利诺斯州)抗体进行处理,在37℃下反应1小时。以与上述相同的方式洗涤后,以50μl的tmb(3,3',5,5'-tetramethylbenzidine)(bd bioscience,franklin lakes,new jersey)底物分株板上的每个孔中。然后,通过使用680型酶标仪(model 680microplate reader)(bio-rad laboratories,赫拉克勒斯市,加利福尼亚州)在450nm波长处测量吸光度,从而挑选14种cd73特异性单克隆噬菌体抗体。
[0132]
图1是显示通过生物淘选挑选的抗cd73抗体对于cd73的结合能力的图。如图1所示,除l2-20外,所有噬菌体抗体均与人cd73结合。此外,l2-47、l4-66、l6-1、l6-30和l6-37噬菌体抗体以相当于对于人cd73的结合力的等于或大于50%的结合力与小鼠cd73结合。l8-34噬菌体抗体与cd32b而非cd73非特异性结合。在具有不同hcdr序列的14中单克隆噬菌体抗体中,除了与人cd73具有弱结合的l2-20和非特异性结合的l8-34之外,挑选12个抗cd73噬菌体抗体且用于后续试验。
[0133]
制备例2.人抗cd73 igg1抗体的生产和挑选
[0134]
2-1.抗cd73人igg1同种型表达载体的制备
[0135]
将从所述制备例1中挑选的12种抗cd73噬菌体抗体克隆且制备为人igg1抗体。具体地,将通过所述制备例1挑选的噬菌体抗体的v
l
(light chain variable region,轻链可变区)和vh(heavy chain variable region,重链可变区)基因序列克隆到包括人igg1(免疫球蛋白g1,immunoglobulin g1)同种型的c
l
(constant light chain,轻链恒定区)和ch1-ch2-ch3(constant heavy chain,轻链恒定区)基因序列的pdcmv-dhfr(由江原国立大学的hong hyo jeong教授提供)表达载体中,从而制备成完整igg1的形式(图2a)。使用pyrobest
tm dna聚合酶(takara,日本)进行聚合酶链式反应(polymerase chain reaction;pcr),并用t100热循环仪设备进行试验。为了克隆在所述制备例1中挑选的噬菌体抗体的轻
链序列,通过使用下表1的seq id no:47和seq id no:48在以下条件下进行pcr反应,从而增幅轻链前导序列(leader sequence):94℃30秒、58℃30秒以及72℃20秒。通过使用seq id no:49和seq id no:50进行pcr反应,从所述制备例1中挑选的噬菌体抗体的v
l
基因中增幅v
l
序列的基因。通过组合pcr(assembly pcr)将增幅的两个pcr产物在94℃30秒、58℃30秒和72℃60秒的条件下融合。此后,所述pcr产物和pdcmv-dhfr载体通过分别在37℃和55℃下用hindⅲ和bsiwi(takara)制酶处理而反应。使用t4 dna连接酶(ligase)对用两种限制酶处理的前导序列-v
l
基因片段和pdcmv-dhfr载体进行连接过程,并通过对以cacl2处理的感受态细胞(competent cell)施加热激来进行转化。接着,为了克隆在所述制备例1中挑选的噬菌体抗体的重链序列,使用seq id no:51和seq id no:52通过pcr反应增幅含有ecori序列的重链前导序列。使用seq id no:53和seq id no:54,通过pcr反应增幅含有apai序列的vh序列基因。增幅的两个pcr产物通过组合pcr反应融合(前导序列-vh),并用ecori和apai限制酶处理。以与上述相同的方式将经限制酶处理的前导序列-vh基因片段克隆到插入了轻链(v
l-c
l
)基因和ch1-ch2-ch3基因的pdcmv-dhfr载体中,从而制备人igg1表达载体。
[0136]
另一方面,作为阳性对照组的cpi-006(corvus pharmaceuticals,伯灵格姆,加利福尼亚州)和medi9447(medimmune,盖瑟斯堡,马里兰州)的重链和轻链基因(wo2018/013611,wo 2016/075099)由cosmo genetech合成,并通过使用作为轻链限制酶的hindⅲ(takara)和xbai(takara)以及作为重链限制酶的ecor
ꢀⅰ
(takara)和noti(takara),以与上述相同的方式克隆到pdcmv-dhfr载体中。表1表1
[0137]
2-2.抗cd73人igg1同种型抗体的生产和纯化
[0138]
为了生产挑选的12种抗cd73人igg1抗体,将在所述2-1中克隆的pdcmv-dhfr载体转染(transfection)到expicho-s
tm
(gibco)细胞中。具体地,expicho-s
tm
细胞在振荡培养箱(shaking incubator)中通过使用expicho-s
tm
表达培养基(gibco,thermofisher scientific)在37℃、140rpm、80%湿度和5%的co2条件下进行培养。通过使用expifectamine cho转染试剂盒(transfecton kit)和optipro
tm sfm(1
×
)(gibco)将插入了挑选的12个抗体基因的载体转染到至少3次传代培养的expicho-s
tm
细胞中。然后,在与上述相同的条件下在振荡培养箱中培养20小时。用expifectamine
tm cho补料(feed)和增强剂(enhancer)处理培养的细胞,并在与上述相同的条件下培养7天。回收培养基并在4,
000rpm、15分钟、4℃下进行离心以确保含有蛋白质样品的上清液,然后将上清液在0.2μm滤纸上过滤以去除杂质。然后,从cho细胞产生的抗体样品通过亲和层析法纯化。具体地,将captureselect igg-ch1亲和基质(affinity matrix)树脂在除去杂质的培养基上在4℃下反应16小时,从而使培养液的抗体样品与树脂结合。使用10柱体积(cvs;column volume)量的tbs缓冲液(ph 7.4)洗涤经反应的树脂,然后通过流入100mm的柠檬酸(citric acid,ph 3.0)缓冲液洗脱抗体样品,且加入1m tris-hcl(ph 9.0)缓冲液以将其中和至弱酸性(ph 6.0至6.5)。用0.2μm滤纸过滤中和的缓冲液来除去杂质,然后在uv 280nm波长下测定蛋白质,从而进行定量分析。
[0139]
2-3.抗cd73人igg1同种型抗体蛋白的大小分析
[0140]
通过sds-page分析在所述2-2中产生和纯化的抗体蛋白的大小。首先,将抗体蛋白在含有2-巯基乙醇(mercaptoethanol)的pierce
tm lds品缓冲液以及非还原性(4
×
;thermo fisher scientific)缓冲液中稀释,然后样品加热5分钟。之后,使用4%至15%的mini-tgx
tm
蛋白预制凝胶(precast protein gel)(bio-rad)作为梯度(gradient)将蛋白质样品以每孔1μg上样后,使用powerpac
tm
基本电源在140v下进行电泳49分钟。将电泳完成后的凝胶在亮蓝(brilliant blue)r 250蛋白染色溶液(elpisbio,韩国)中反应60分钟,然后用脱色缓冲液[30%甲醇(methanol),10%乙酸(acetic acid)]进行处理,并观察蛋白带。
[0141]
图2显示了人igg1抗体的sds-page分析结果。如图2b所示,12种经纯化的抗体的重链和轻链分别具有50kda和25kda的大小,且在与理论大小相似的位置观察到所有所述蛋白带。
[0142]
2-3.确认抗cd73人igg1同种型抗体对于cd73的结合力
[0143]
为了比较在所述2-2中生产和纯化的12种人抗cd73 igg1抗体对于cd73的结合力,进行elisa试验。在碳酸盐涂层缓冲液中将重组人cd73蛋白稀释至1μg/ml的浓度后,以每孔100μl分株到96孔maxisorp elisa板中,并在4℃下涂布16小时。去除所有未被涂布的蛋白质和缓冲液,并以每孔300μl分株含有3%bsa和0.1%吐温20的pbs缓冲液(ph7.4),然后在室温下反应2小时来进行封闭。2小时后,去除剩余的缓冲液,以每300μl分株pbs-t缓冲液到每个孔中,然后重复3次去除过程且洗涤。将所述pbs缓冲液依次稀释至100nm的浓度,并加入抗cd73 igg1抗体,且在37℃下反应1小时。洗涤后,加入驴抗人igg fc hrp(jackson immunoresearch,西葛罗夫,baltimore pike)抗体,并在37℃下反应1小时。在进行与上述方法相同的洗涤过程后,以每100μl分株tmb底物到所有孔中来反应7分钟,并用680型酶标仪在450nm波长处测量吸光度。还以与上述相同的方式测量阴性对照组(利妥昔单抗)和阳性对照组(cpi-006,medi9447)样品的吸光度。
[0144]
图3a为确认12种纯化的人抗cd igg1抗体对人cd73的结合力的图。如图3a所示,与bsa相比,12种纯化的抗体中的9中和2种阳性对照组与人cd73的结合显著地强,而其余三种抗体(l4-46、l6-7和l6-37)的结合相对较弱。此外,阴性对照组(利妥昔单抗igg1)抗体不与人cd73结合。
[0145]
2-4.确认针对膜cd73蛋白的酶活性
[0146]
为了比较在所述2-2中生产和纯化的12种人抗cd73 igg1抗体对膜cd73的酶活性的抑制能力,在细胞表面表达膜cd73的mda-mb-231细胞(韩国细胞株库)上进行孔雀石绿测
定(malachite green assay)。将mda-mb-231细胞分株到96孔平板中以达到2.0
×
104细胞/孔,并在37℃和5%co2条件下的培养箱中培养20小时。培养后,用测定缓冲液洗涤2次,并将12种人抗cd73 igg1抗体样品在测定缓冲液中稀释至500nm的浓度,然后加入每孔中,并在37℃下反应1小时。然后,向每个孔中加入250μm的amp并在37℃下反应20分钟,将不包括细胞的40μl的上清液分株到新的96孔板中。为了测量cd73的酶活性,使用孔雀石绿磷酸盐检测试剂盒(malachite green phosphate detection kit)检测上清液中的磷酸盐,并以epoch微孔板分光光度计(microplate spectrophotometer)设备在620nm波长处测量吸光度。还以与上述相同的方式测量阴性对照组(利妥昔单抗)和阳性对照组(cpi-006,medi9447)样品的吸光度。
[0147]
图3b是确认纯化的12种人抗cd73 igg1同种型抗体是否抑制cd73酶活性的结果。如图3b所示,与阴性对照组相比,12种抗cd73人igg1抗体中的5种抗体(l2-3、l4-4、l4-5、l4-66和l6-1)表现出等于或大于50%的酶活性抑制能力,其中,l6-1抗体显示90%的cd73酶活性抑制,从而显示出与cpi-006(91%)相似的高抑制能力。其余四种抗体(l2-3、l4-4、l4-5、l4-66)依次抑制cd73酶活性63%、61%、58%和50%,从而显示出与medi9447(34%)相似或更高的抑制能力。
[0148]
2-5.确认抗cd73人igg1同种型抗体与对于cd73的交叉结合力
[0149]
为了比较在所述2-3中表现出与阳性对照组相似或较高的cd73酶活性抑制能力的5种人抗cd73 igg1抗体(l2-3、l4-4、l4-5、l4-66、l6-1)对于人、猴、大鼠和小鼠cd73蛋白(sino biological)的交叉结合力,以与上述2-3相同的方式进行elisa试验。
[0150]
图3c显示了确认对于人、猴、大鼠和小鼠cd73的交叉结合力的结果。图3c显示出l4-66、l6-1和medi9447抗体对所有人、猴、大鼠和小鼠cd73有反应,但l2-3、l4-5和cpi-006抗体只对人和猴cd73有反应,而l4-4抗体只对人、猴和大鼠cd73有反应,从而显现出不同的结合模式。基于以上结果,挑选了与medi9447抗体类似地与人和小鼠cd73交叉结合的2种抗体(l4-66和l6-1),并分别命名为apba2-01和apba2-02。
[0151]
制备例3.apba2-01和apba2-02抗体的制备
[0152]
3-1.apba2-01和apba2-02单克隆抗体的制备
[0153]
生产了表达在所述制备例2-5中挑选的apba2-01和apba2-02单克隆igg抗体的稳定细胞池(cell pool)。首先,将apba2-01和apba2-02单克隆抗体的轻链和重链基因分别克隆到pd2539和pd2535nt(horizon discovery,英国)载体中。apba2-01和apba2-02抗体的v
l
和vh以及人igg同种型的c
l
和ch基因合成为优化于中国仓鼠卵巢(cho;chinese hamster ovary)细胞的密码子序列。用bbs1(thermo fisher scientific)和bsrg1(thermo fisher scientific)限制酶处理合成的apba2-01抗体的轻链基因,并将其连接到用相同限制酶处理的pd2539载体中。使用上述表1的seq id no:51和下表2的seq id no:55通过pcr反应增幅合成的apba2-01抗体的vh基因,并用下表2的seq id no:56和seq id no:57通过pcr反应增幅人igg的ch基因。经增幅的两种pcr产物通过组合pcr反应来融合。融合的重链基因和pd2535nt载体通过bbs1限制酶处理且反应。使用上述表1的seq id no:47和下表2的seq id no:58通过pcr反应增幅合成的apba2-02抗体的v
l
基因,并用下表2的seq id no:59和seq id no:60通过pcr反应增幅人igg的c
l
基因。使用上述表1的seq id no:51和下表2的seq id no:61通过pcr反应增幅apba2-02抗体的vh基因,并用下表2的seq id no:57和seq id no:
62通过pcr反应增幅人igg的ch基因。经增幅的两种pcr产物通过组合pcr反应来融合。此后,以与上述相同的方式对其进行克隆。表22
[0154]
3-2.apba2-01和apba2-02嵌合(chimeric)抗体的制备
[0155]
将apba2-01和apba2-02抗体制备成人-鼠igg1和igg2a嵌合抗体序列,其具有人v
l
和vh基因序列以及小鼠抗体序列的c
l
序列和小鼠ch序列。将合成的apba2-01和apba2-02的人v
l-小鼠c
l
嵌合抗体基因片段通过与上述3-1相同的方法插入并克隆到pd2539载体中。合成的小鼠igg1和igg2a的ch基因分别使用seq id no:63、seq id no:64、seq id no:64和seq id no:65通过pcr反应来增幅。然后,将其以与上述3-1相同的方法,通过进行组合pcr反应融合于apba2-01抗体的vh基因。将融合的apba2-01抗体基因和合成的apba2-02抗体的v
h-小鼠igg1和小鼠igg2a基因片段以与上述相同的方式克隆到pd2535nt载体中。
[0156]
3-3.制备稳定的apba2-01和apba2-02抗体蛋白池
[0157]
制备产生所述制备例3-1和3-2的抗体蛋白的稳定池。首先,将gs null cho k1(horizon discovery)细胞分株到其中在cdforticho(thermo fisher scientific)添加有4mm的l-谷氨酰胺(gibco)的培养基中,并在振荡培养箱中在37℃、125rpm、80%的湿度和5%的co2条件下培养。使用freestyle
tm max试剂(invitrogen)将分别插入有apba2-01和apba2-02的轻链和重链基因的载体以1:3的比例[pd2539(轻链):pd2535nt(重链)]共转染到培养细胞中,并通过使用总37.6μg的质粒载体,在与上述相同的条件下培养48小时。然后,将培养的细胞转移到50ml的锥形管(conical tube)(nunc),然后进行离心并重悬于不含l-谷氨酰胺的cdforticho培养基中,使用50μm的蛋氨酸亚砜亚胺(methionine sulfoximine;msx,sigma-aldrich,圣路易斯,密蘇里州)进行处理并初步挑选48小时。之
后,用10μg/ml的嘌呤霉素(puromycin)(gibco)进行处理并二次挑选48小时。然后,将沉淀的细胞重悬于未添加l-谷氨酰胺的培养基中以达到浓度为0.5
×
106细胞/ml,并用msx和嘌呤霉素一起进行处理,从而进行额外的挑选过程大约3周。此时,定期更换培养基以使细胞浓度维持在2.0
×
106细胞/ml并,通过培养直至细胞存活率达到90%或更高,从而制备稳定的池细胞库(cell stock)。使用countessⅱ自动细胞计数器测量细胞浓度和存活率。
[0158]
3-4.apba2-01和apba2-02嵌合抗体蛋白的生产和纯化
[0159]
从在所述3-3中制备的稳定池中生产apba2-01和apba2-02人-小鼠嵌合抗体蛋白。首先,将细胞重悬于cdforticho培养基中以达到细胞浓度为0.2
×
106细胞/ml,并在振荡培养箱中在37℃、125rpm、80%湿度和5%的co2条件下进行培养。培养后,当细胞浓度达到2.0
×
106细胞/ml时,将其转移到保持在37℃、125rpm、80%湿度和5%的co2条件下的振荡培养箱中,从而生产抗体样品7天。此后,通过离心获得含有抗体样品的上清液,并通过用0.2μm滤纸过滤来除去杂质。此后,从cho细胞产生的抗体样品通过三步层析(亲和层析、阳离子交换纯化、阴离子交换纯化)过程来进行纯化。首先,使用mabselect sure lx树脂进行亲和层析。用tris缓冲盐溶液(tbs;tris-buffered saline)缓冲液以10cvs的量洗涤树脂,然后将含有抗体样品的上清液以20ml/分钟的流速通过树脂。5cvs的tbs缓冲液和5cvs的含有3%的d-甘露醇的tbs缓冲液以25ml/分钟的流速流动,从而去除非特异性结合树脂的物质。通过以20ml/分钟的流速流动50mm的柠檬酸(ph 3.5)和3%的d-甘露醇缓冲液,并从树脂中洗脱特异性结合树脂的抗体样品。此后,对洗脱有蛋白质样品的缓冲液用1m tris-hcl、ph 8.0缓冲液进行处理且中和,并用0.2μm滤纸过滤来除去杂质。接下来,使用以50mm tris、200mm柠檬酸和ph 7.0的缓冲液平衡的capto高分辨率多峰层析(capto adhere impres multimodal chromatography)树脂进行阳离子交换纯化。从亲和层析获得的抗体样品在无菌蒸馏水中稀释1/4。然后,在以5ml/分钟的流速将抗体样品与树脂结合后,用5cvs的50mm tris、200mm柠檬酸、1m nacl、ph 7.0的缓冲液进行洗涤。此后,通过用5cvs的50mm tris、200mm柠檬酸、ph 7.0的缓冲液以25ml/分钟的流速洗涤来去除非特异性结合树脂的物质。然后,以20%-30%-40%-50%-70%-100%的逐步骤依次流动50mm tris、200mm柠檬酸和ph 3.0的缓冲液,并洗脱与树脂特异性结合的抗体样品。收集各步骤的洗脱液,并用0.2μm滤纸过滤后去除杂质。最后,使用poros
tm 50hq强阴离子交换树脂(strong anion exchange resin)进行阴离子交换纯化。首先,将2m nacl缓冲液以3ml/分钟的流速流入树脂进行洗涤,然后将5cvs的20mm的磷酸钠(sodium phosphate)、ph 6.5的缓冲液流入以达到平衡。为了将以阳离子交换纯化获得的抗体样品与树脂结合,用20mm的磷酸钠、ph 6.0的缓冲液对样品进行透析,从而调整ph和盐浓度。透析后的样品以5ml/分钟的流速流过树脂,并将含有收集到的蛋白质的缓冲液用0.2μm滤纸过滤来除去杂质,然后对蛋白质进行定量和分析。
[0160]
实施例1.对于cd73蛋白的结合力的比较
[0161]
1-1.对于水溶性cd73蛋白的结合力
[0162]
通过elisa试验确认在所述制备例3重生产和纯化的apba2-01和apba2-02抗体对于水溶性cd73蛋白的结合力。以与所述制备例2和3相同的方式进行,除了将抗体依次稀释且添加至1,500ng/ml至0.019ng/ml的浓度。对阳性对照组(medi9447、cpi-006)和阴性对照组(利妥昔单抗)进行相同的方法。
[0163]
图4a至图4d是确认apba2-01和apba2-02对于人、猴、大鼠和小鼠cd73的结合力的
图。如图4a至图4d所示,对于人cd73蛋白(图4a),结合力且顺序为medi9447》apba2-01》apba2-02》cpi-006。对于猴cd73蛋白(图4b),结合力顺序为medi9447=apba2-01》cpi-006》apba2-02。此外,对于大鼠cd73蛋白(图4c),结合力顺序为medi9447》apba2-02》apba2-01,且对于小鼠cd73蛋白(图4d),按medi9447》apba2-01》apba2-02的顺序显示出结合力。换言之,apba2-01继medi9447后显示出对cd73蛋白(人、猴和小鼠)的高结合力,且apba2-02与medi9447和apba2-01相比显示出对于cd73的相对较低的结合力,但显示出与cpi-006相似的结合力。
[0164]
1-2.对于膜cd73蛋白的结合力
[0165]
通过流式细胞术(flow cytometry)确认了在所述制备例3中生产和纯化的apba2-01和apba2-02抗体是否具有对于膜cd73蛋白的结合力。首先,将作为过表达人cd73的乳腺癌细胞株的mda-mb-231(韩国细胞株库)细胞和作为过表达小鼠cd73的乳腺癌细胞株的4t1(atcc)细胞分株到添加有10%胎牛血清(fbs;fetal bovine serum)(gibco)和1%的青霉素-链霉素(penicillin-streptomycin)(gibco)的rpmi-1640(thermo fisher scientific)培养基中,并在加湿培养箱(humidified incubator)中在37℃和5%的co2条件下培养。通过使用vi-cell自动细胞分析仪(automated cell analyzer)测量细胞数量和存活率。将mda-mb-231细胞和4t1细胞分别以2.0
×
105的细胞数量分株到灭菌的微管中,并用macs缓冲液(含有0.5%bsa、2mm edta的pbs)洗涤两次。之后,apba2-01和apba2-02抗体在macs缓冲液中稀释至40nm的浓度,并分别用mda-mb-231和4t1细胞处理,从而在4℃下进行反应1小时。1小时后,用macs缓冲液洗涤细胞3次,并添加山羊抗人igg fc fitc(invitrogen)来在4℃下进行反应30分钟。以与上述相同的方法洗涤mda-mb-231和4t1细胞,并用1%甲醛进行处理且固定所述细胞,然后使用bd facsverse设备进行流式细胞术。阳性对照组(cpi-006、medi9447)以及阴性对照组(利妥昔单抗)的分析方法如上所述。
[0166]
图5是比较在mda-mb-231细胞中apba2-01和apba2-02抗体对于膜cd73蛋白的结合力的图,且图5b是比较4t1细胞中的结合力的图。如图5a和图5b所示,对于mda-mb-231和4t1细胞,显示出顺序为medi9447》apba2-01》apba2-02》cpi-006的抗原结合力。另外,与阴性对照(利妥昔单抗)相比,medi9447、apba2-01和apba2-02抗体显示出更强的结合力。然而,与medi9447、apba2-01和apba2-02抗体相比,阳性对照组的cpi-006抗体显示出较弱的结合力。
[0167]
实施例2.表位比较分析
[0168]
通过生物膜干涉技术(bli;layer interferometry)比较且分析在所述制备例3中生产和纯化的apba2-01和apba2-02抗体与阳性对照组(cpi-006、medi9447)对于cd73的表位。首先,将抗人igg fc capture(ahc)芯片在无菌蒸馏水中反应15分钟以进行水合(hydration),并分别在添加有0.1%bsa的pbs、ph 7.4(0.1%pba)缓冲液和10mm甘氨酸(glycine)、以及ph 1.7的缓冲液中重复反应3次,每次20秒,从而进行前处理(conditioning)。之后,将作为阳性对照物质的cpi-006和medi9447抗体样品在0.1%pba缓冲液中稀释至200nm的浓度,并分别加载到芯片600秒后,与在0.1%pba缓冲液中稀释至200nm的浓度的重组人cd73蛋白样品反应900秒以结合。最后,将apba2-01和apba2-02样品在0.1%pba缓冲液中稀释至200nm的浓度,并与结合有重组人cd73蛋白的cpi-006反应900秒。所有实验过程均在30℃、1,000rpm摇动(shaking)条件下进行,且试验结果使用
fortebio data analysis 8软件进行分析。
[0169]
图6a显示分析apba2-01、apba2-02抗体是否竞争性结合cpi-006的表位的结果,且图6b显示分析是否竞争性结合medi9447的表位的结果。如图6a所示,未观察到与cpi-006共享表位的抗体。如图6b所示,可以确认,阳性对照组(medi9447和cpi-006)以及apba2-01抗体不与人cd73蛋白结合,但apba2-02进行结合。
[0170]
结果,由于apba2-01抗体不与结合有medi9447抗体的人cd73蛋白结合,因此,apba2-01抗体显示出与medi9447抗体类似的竞争性结合表位的可能性。与图6a的结果相反,cpi-006抗体不与结合有medi9447抗体的人cd73蛋白结合。换言之,由于cpi-006结合于在作为amp结合于cd73的位点的c末端的表位,并与amp竞争,从而抑制cd73酶活性。相反,medi9447通过与作为同型二聚体的cd73的n末端域结合并阻止转化为cd73的活性结构来抑制cd73酶活性。因此,预期到表现出与medi9447类似的活性抑制模式的apba2-01抗体抑制转化为cd73的活性结构,且预期到表现出与cpi-006类似的活性抑制模式的apba2-02抗体竞争性抑制amp与cd73的结合。
[0171]
实施例3.体外抑制cd73酶活性的能力的评估
[0172]
3-1.评估对水溶性cd73的活性抑制能力
[0173]
为了确认在所述制备例3中生产和纯化的apba2-01和apba2-02抗体是否抑制水溶性cd73蛋白的酶活性,进行了能够量化磷酸盐的孔雀石绿测定。首先,将重组人cd73蛋白在测定缓冲液(25mm tris、5mm mgcl2、ph 7.5)中稀释至2nm的浓度,且将apba2-01和apba2-02抗体样品在测定缓冲液中依次稀释至50nm至0.7813nm的浓度。稀释的cd73蛋白和每个抗体样品在37℃下反应1小时。然后,添加amp至400μm的最终浓度并在37℃下反应20分钟。之后,使用孔雀石绿磷酸盐检测试剂盒(malachite green phosphate detection kit)反应20分钟,然后用epoch微孔板分光光度计(microplate spectrophotometer)在620nm波长处测量吸光度。还以与上述相同的方式测量阳性对照组(cpi-006和medi9447)以及阴性对照组(人igg1同种型)(bio x cell,西黎巴嫩,新罕布什尔州)的吸光度。
[0174]
图7是通过孔雀石绿测定方法评估apba2-01和apba2-02抗体对水溶性cd73的酶活性抑制能力的结果。如图7所示,抗cd73抗体对水溶性cd73的酶活性抑制能力以cpi-006》apba2-01》apba2-02》medi9447的顺序显示。
[0175]
3-2.评估对膜cd73的活性抑制能力
[0176]
为了确认在所述制备例3中生产的apba2-01和apba2-02抗体是否抑制膜cd73蛋白的酶活性,分别进行磷酸盐定量(孔雀石绿测定)和荧光素氧化测量(celltiter-assay)。
[0177]
使用孔雀石绿测定分析cd73的酶活性。首先,以与所述制备例2至4相同的方式进行,除了为了测量cd73的酶活性,将mda-mb-231细胞和4t1细胞分别以2
×
104细胞/孔和1.0
×
104细胞/孔分株,并将apba2-01和apba2-02抗体样品稀释至400nm至0.0244nm的浓度来使用。还以如上所述的方式测量阴性对照组(利妥昔单抗)和阳性对照组(cpi-006,medi9447)样品的吸光度。
[0178]
接下来,使用celltiter-测定分析cd73的酶活性。首先,将mda-mb-231细胞和4t1细胞分别以2
×
104细胞/孔和1.0
×
104细胞/孔分株在96孔平板(spl)中,并在37℃和5%co2条件下的培养箱中培养20小时。培养后,去除上清液并用不含fbs的rpmi-1640培养基洗
涤。之后,将apba2-01和apba2-02抗体样品在培养基中依次稀释至500nm至0.0305nm的浓度,并在每个孔中进行处理,在37℃下反应30分钟。反应后,添加浓度为400μm的amp并在37℃下反应3小时。之后,将上清液在新的96孔白板中与浓度为200μm的atp进行反应,并用celltiter-进行处理,根据制造商提供的标准方法,使用synergy m1读取器设备测量发光度(luminescence)。还以与上述相同的方式测量阴性对照组(利妥昔单抗)和阳性对照组(cpi-006,medi9447)样品的发光度。
[0179]
图8a是通过孔雀石绿测定法评估在mda-mb-231细胞中抗cd73抗体对于膜cd73的酶活性抑制能力的结果,且图8c是通过celltiter-测定法评估的结果。如图8a所示,在mda-mb-231细胞中对于膜cd73的活性抑制能力测量为apba2-02》cpi-006》medi9447》apba2-01的顺序,且如图8c所示,测量为medi9447=apba2-01》cpi-006》apba2-02的顺序。
[0180]
图8b是通过孔雀石绿测定法评估在4t1细胞中抗cd73抗体对于膜cd73的酶活性抑制能力的结果,且图8d是通过celltiter-测定法评估的结果。如图8b所示,在4t1细胞中,测量为apba2-02》medi9447》apba2-01的顺序,且如图8d所示,测量为medi9447》apba2-01》apba2-02的顺序,根据测量方法,抑制能力存在差异。
[0181]
换言之,在孔雀石绿测定结果中,apba2-02抗体显示出最高水平的活性抑制(图8a和图8b),但在celltiter-测定结果中,显示最低水平的活性抑制(图8c和图8d)。此外,apba2-01抗体和medi9447在mda-mb-231细胞中仅抑制50%左右的cd73活性(图8a),但在4t1细胞中抑制等于或大于90%(图8b)。另一方面,cpi-006抗体不与小鼠cd73交叉结合,因此不在小鼠4t1细胞中进行反应(图8b和图8d)。
[0182]
实施例4.抗cd73抗体的移入膜cd73细胞中
[0183]
通过免疫荧光显微技术(immunofluorescence microscopy)确认在所述制备例3中生产和纯化的apba2-01和apba2-02抗体是否与细胞表面的膜cd73结合并移入(internalization)细胞中。首先,在12孔板(spl)中放入无菌盖玻片(paul marienfeld,德国),并将mda-mb-231细胞(1.0
×
105)分株到每个孔中,在37℃且5%co2培养箱中培养24小时。然后,除去培养基,apba2-01和apba2-02抗体在每个孔中以10mg/ml的浓度进行处理,并在37℃下分别反应20分钟、40分钟、60分钟和120分钟。阳性对照组(cpi-006和medi9447)也以相同方式反应。然后,去除反应完成后的各培养基,用pbs缓冲液洗涤附着的细胞3次后,以每1ml分株4%甲醛,并在37℃下固定细胞15分钟。以与上述相同的方式洗涤后,以每孔分株1ml的0.05%triton-x 100,在室温下反应15分钟以在细胞中诱导孔生成。然后,洗涤所述细胞,并添加2%pba缓冲液,在室温下进行封闭50分钟。洗涤后,添加fitc缀合的抗人fc抗体,并在室温下反应50分钟。以与上述相同的方式洗涤后,将固定有细胞的盖玻片(coverslips)与含有4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole;dapi)的vectashield hardset antifade封固培养基(mounting medium)溶液一起固定在载玻片上。然后,通过超灵敏、高分辨率共聚焦激光扫描显微镜分析固定细胞。
[0184]
图9是使用高分辨率共聚焦激光扫描显微镜(sr-clsm)确认apba2-01或apba2-02抗体是否移入膜cd73细胞中的图。如图9所示,在apba2-01、apba2-02抗体和medi9447的情况下,用mda-mb-231细胞处理20分钟后,在mda-mb-231细胞膜周围确认到cd73信号,且在40分钟后,观察到移入到cd73的细胞中。然而,在cpi-006的情况下,细胞内移入没有得到确认。
[0185]
实施例5.体内模型中的效能评估
[0186]
5-1.确认在转移性乳腺癌小鼠模型中的抗癌效果
[0187]
在转移性乳腺癌小鼠模型中确认在所述制备例3中生产和纯化的apba2-01和apba2-02抗体的抗癌效能。通过将乳腺癌细胞株4t1(5.0
×
105)施用于6周龄的雌性balb/c小鼠的尾静脉中来诱导肺癌。3天后,腹膜内施用20mg/kg的apba2-01和apba2-02抗体(相隔3天,4次)。阳性对照组(medi9447 higg1)和阴性对照组(同种型对照igg)也以如上所述的用量和方法施用。每次施用时测量小鼠体重,并在试验结束后,将小鼠的肺和脾脏切除并测量重量。通过用布安氏液(bouin’s solution)对切除的肺进行染色来确认菌落数。使用graphpad prism 5.0版程序进行统计分析。通过单因素方差分析(one-way anova)分析体重和肿瘤大小,当p《0.05时,确定为显着。
[0188]
图10a是在转移性乳腺癌小鼠模型中测量平均肺重量的图。如图10a所示,对于阳性对照组和apba2-01抗体,与阴性对照组相比,小鼠肺的重量没有变化,而在apba2-02的情况下,确认小鼠肺的重量减少了10.85%。
[0189]
图10b是测量转移性乳腺癌小鼠模型中肺转移集落数的图。如图10b所示,在阳性对照组、apba2-01和apba2-02的施用组的情况下,与阴性对照组相比,肺转移集落数分别减少0.04%、13%、16%,但无统计学意义。
[0190]
另一方面,对于小鼠体重和脾脏重量的,与阴性对照组相比,在apba2-01和apba2-01抗体以及阳性对照组中没有观察到显着变化。
[0191]
5-2.确认在乳腺癌小鼠模型中的癌症生长抑制
[0192]
在转移性乳腺癌小鼠模型中确认在所述制备例3中生产和纯化的apba2-01和apba2-02抗体的抗癌症生长抑制效能。通过将乳腺癌细胞株4t1(5.0
×
105)施用于乳腺脂肪垫(mammary fat pad)以诱导乳腺癌。3天后,apba2-01和apba2-02抗体分别与tbs和ph 7.4的缓冲液混合,来以20
㎎
/
㎏
总用量通过腹膜施用与小鼠中(相隔2天,6次)。阳性对照组(medi9447小鼠igg1、igg2a)和阴性对照组(同种型对照小鼠igg1、igg2a)(bio x cell)也如上所述的用量和方法施用。使用卡尺(calipers)每隔2天测量一次乳腺癌的大小。最后一次抗体施用结束后6天,将小鼠的肺切除,并观察有没有癌细胞转移。
[0193]
图11a是通过测量乳腺癌小鼠模型中的肿瘤体积确认apba2-01的migg1、migg2a和apba2-01的migg1、migg2抗体的癌症生长抑制效能的图,且图11b是通过比较肿瘤生长抑制能力确认癌症生长抑制效能的图。
[0194]
如图11a和图11b所示,与抗体的fc功能无关,与阴性对照组相比,apba2-01显示出约17%的乳腺癌生长抑制,且对于apba2-02抗体,具有fc功能的migg2a对乳腺癌的生长抑制效果具有33%,而没有fc功能的migg1具有18%。另一方面,在阳性对照组中,具有fc功能的migg2a显示出23%的生长抑制,而没有fc功能的migg1显示出35%的活性抑制。
[0195]
图11c是测量乳腺癌小鼠模型的重量的图。如图11c所示,在进行试验过程中没有观察到小鼠体重的变化。此外,也未发生癌细胞肺转移。
[0196]
实施例6.体外细胞模型的效能评估
[0197]
6-1.单克隆抗体的制备
[0198]
委托myxengo公司(美国)挑选与cd73蛋白特异性结合的抗体。myxengo公司使用了其具有的天然人scfv文库(naive human scfv library),并进行生物淘选以挑选候选抗体
克隆。挑选的克隆用igg4抗体表达,且该培养液从myxengo公司获得。通过使用captureselect igg-ch1亲和基质树脂的亲和层析分离和纯化每种接收的培养液,从而分离和纯化每种igg4抗体蛋白,并以与所述制备例2-2中相同的方式进行。
[0199]
6-2.确认针对膜cd73蛋白的酶活性
[0200]
以与所述实施例3-2相同的方式确认在所述实施例6-1中制备的七种人抗cd73igg1抗体对于cd73的酶活性抑制能力。此时,cpi-006和medi9947用作阳性对照组。
[0201]
图12a是通过孔雀石绿测定法评估在mda-mb-231细胞中抗cd73抗体对于膜cd73的酶活性抑制能力的结果,且图12是通过celltiter-测定法评估的结果。如图12a和12b所示,确认了7种抗体中的5种(第3、4、6、7、15)与阴性对照组相比具有显着更高的cd73酶活性抑制能力。
[0202]
实施例7.确认对于膜cd73蛋白的结合力
[0203]
为了确认在所述实施例6中挑选的抗cd73抗体(myxengo抗体3、4、6、7、15)的物种间交叉结合,使用小鼠细胞膜cd73表达细胞株(4t1(atcc,crl-2539)和4t1.2(atcc,crl-3406))进行抗体结合确认试验。首先,在添加了10%胎牛血清(fbs)(gibco,cat no.16000-044)的培养基中培养4t1细胞,而在其中在alphamem(minimum essential medium;corning fisher sci,10-022-cv)培养基中添加了10%胎牛血清(fbs)的培养基中培养4t1.2细胞。此后,用胰蛋白酶-edta(gibco,cat no.25200-056)分离附着在培养皿上的细胞后,以每2.0
×
105细胞分株到1.5ml管中。之后,通过离心使细胞下沉后,去除上清液并用在macs缓冲液[添加了0.5%牛血清白蛋白(sigma)、2mm edta(intron bio)的dpbs缓冲液(gibco)]中稀释至100nm浓度的100μl抗体样品重悬细胞,然后在4℃的条件下反应1小时。然后,加入800μl的macs缓冲液并离心来去除上清液。通过添加50μl的在macs缓冲液中以1:500的比例稀释的二抗山羊抗人igg fc fitc(novex,a18830)来重悬细胞。在4℃条件下反应1小时后,加入500μl的macs缓冲液,并进行离心来除去上清液。然后,在用200μl的0.4%多聚甲醛(t&i,在pbs中稀释)固定细胞后,使用流式细胞仪(bd,facsverse)分析制备的样品。
[0204]
图13a是确认在4t1细胞中myxengo 3、4、6、7和15抗体对膜cd73蛋白的结合力的图。图13b是确认在4t1.2细胞中myxengo 3、4、6、7和15抗体对膜cd73蛋白的结合力的图。
[0205]
如图13a和13b所示,与阴性对照组相比,5种抗体(第3、4、6、7、15)中的一种抗体(第15)与小鼠膜cd73强烈结合,且表现出与apba2-02抗体相似水平的抗原结合力。然而,4种抗体(第3、4、6、7)不与小鼠膜cd73结合。换言之,由于myxengo 15抗体表现出与apba2-02相似水平的抗原结合力,因此预期其具有与apba2-02相似的特性。因此,myxengo 15抗体可能在与cd73特异性结合的同时具有物种间交叉反应性。
[0206]
综上所述,单克隆抗体或其抗原结合片段可与cd73结合,降低cd73蛋白的酶活性抑制能力,且可抑制癌症转移或癌细胞生长,因此可用作癌症的治疗剂。另外,由于所述抗体或其抗原结合片段表现出物种间交叉反应性而可用于临床前动物试验,因此,可以节省测试免疫治疗剂的副作用、毒性和/或安全性所需的时间和成本。
[0207]
以上对本发明的描述是为了举例说明,本发明所属领域的普通技术人员可以理解,在不改变本发明的技术思想或本质特征的情况下,可以很容易地将其修改为其他具体形式。因此,应当理解,上述实施例在所有方面都是示例性的,而不是限制性的。
[0208]
本发明的广度(breadth)和范围不应受任何前述示例性实施例的限制,而应仅根
据权利要求书及其等同物来定义。
[0209]
在本说明书中所述的各种方面、实施例和选择都可以在任何修改中组合。
[0210]
本说明书中提及的所有出版物、专利和专利申请均以引用方式并入本文,其程度如同每个单独的出版物、专利或专利申请被具体且单独地指示以引用方式并入一样。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。