1.本发明属于类器官制备技术领域,具体涉及具有空腔结构的血管化心脏类器官及其制备方法。
背景技术:
2.心血管疾病是世界上威胁人类健康的头号杀手,在体外构建合适的模型用于探究其发病机理可以挽救数以百万计的生命。目前普遍使用2d培养的心肌或血管细胞作为模型,但其对于器官复杂结构的模拟非常有限。小鼠模型被广泛用于心血管疾病的研究,但是其基因组和人类差异巨大,无法研究一些人特有致病基因。因此构建合适的心脏模型用于探究人类生理病理过程十分重要。
3.近年来,利用人诱导多能干细胞(ipsc)构建的各种类器官既包含构成器官的主要细胞成分,又可以很好的模拟器官的3d结构,被广泛的用于探究生理、病理过程以及用于药物筛选。心脏是人类发育过程中形成的第一个具有功能的器官,但由于其复杂的结构,其也是最难进行体外建模的器官,直到2019年,jiyoung lee等研究者才首次报道了小鼠心脏类器官的体外构建。截至2022年,全世界范围内仅有5例比较完善的人心脏类器官研究被报道,发表在《cell》、《cell stem cell》、《nature biotechnology》、《nature communication》等世界高水平杂志上,这些为数不多的人心脏类器官研究工作都展示了心脏类器官在探究心脏发育、疾病模型构建和药物筛选等方面的巨大潜力。
4.心脏是具有多腔室结构且细胞成分最为复杂的器官之一,之前的研究者利用模具、支架材料,几何学等手段构建的心脏类组织在探究心肌收缩力,电生理以及药物筛选等方面都是强有力的工具,但是大多都不能模拟心脏的腔室结构,因此在探究与心脏形态相关的研究中都有一定的限制,因此构建具有腔室结构的心脏类器官更能模拟心脏的结构特点,对于探究心脏发育,药物筛选和疾病模拟(特别是心律不齐心脏病)有非常重要的意义。
5.血管化是各种类器官厄待解决的技术难题。目前构建的各种类器官中,缺少合适的血管网络,因此随着其尺寸的增长,内部的细胞因为缺少血管输送营养物质而出现坏死。使用内皮细胞(ecs)、血管平滑肌(vsmcs)以及间充质干细胞(mscs)构建微血管;提取脂肪组织中的微血管片段;模拟发育生物学激活血管细胞诱导通路等手段面临组织异质性,技术手段复杂,在类器官中形成无规则的内皮细胞集落,并不能有效的模拟真实血管结构等问题。并且血管化对于心脏类器官的形态发生更是鲜有研究。
6.大量的研究证明,血管对于心脏发育以及心肌细胞功能、结构和代谢成熟至关重要。因此构建更加完善的具有空腔结构的血管化心脏类器官在探究心脏发育、药物筛选、致病机理以及心脏再生有非常重要的意义,具有巨大的应用前景。
技术实现要素:
7.本发明的目的在于构建一种具有空腔结构的血管化心脏类器官,其特点为内部有空腔结构,具有功能化的血管网络,并以接近人体心脏搏动的频率进行自主搏动。
8.一种具有空腔结构的血管化心脏类器官的制备方法,包括如下步骤:步骤1、选取干细胞a及干细胞b进行体外培养和维持;其中,干细胞a为具有血管谱系细胞分化潜能的干细胞、干细胞b为具有心肌细胞分化潜能的干细胞;步骤2、分别诱导干细胞a与干细胞b分化为血管细胞球及心肌细胞球;步骤3、将步骤2制备的一个或多个血管细胞球和1个或多个心肌细胞球融合、并培养后制备得到血管化心脏类器官。
9.进一步的,所述干细胞a及干细胞b均选自人或动物的诱导多能干细胞、胚胎干细胞或成体干细胞。
10.进一步的,多能干细胞可以为人或动物的诱导多能干细胞或胚胎干细胞等具有全能性的细胞。
11.优选的,所述多能干细胞使用干细胞培养基维持传代前的培养密度为80%。
12.优选的,所述的干细胞培养基为essential 8或mtesr。
13.优选的,使用0.5 mm edta或accutase将hipsc消化成单细胞悬液,消化条件为室温或37℃,消化时间为6~8分钟;进一步的,步骤1制备血管细胞球的制备过程为将干细胞培养形成拟球体后分化为血管细胞球;或先在2d条件下将干细胞诱导分化为血管细胞后再聚集成球;进一步的,步骤2制备其他体细胞球的制备过程为将干细胞b培养形成拟球体后分化为心肌细胞球;或先在2d条件下将干细胞b诱导分化为心肌细胞后再聚集成球;优选的,当两种细胞团来自多能干细胞时,可先将干细胞培养成拟球体后分为两份,并分别诱导分化为血管细胞球和心肌细胞球。
14.进一步的,步骤3中所述的融合过程,采用血管细胞球和心肌细胞球在正常培养条件、悬浮培养条件或包埋入水凝胶等材料中融合。
15.优选的,所述融合步骤采用悬浮培养条件下融合。
16.进一步的,步骤3中,所述心肌细胞球的数量为1~4个。
17.进一步的,步骤3中,所述血管细胞球的数量为1~10个。
18.优选的,步骤3中,所述体细胞球的数量为1个;所述血管细胞球的数量为1个。
19.进一步的,步骤3中,所述培养的时间为3~5天。
20.优选的,成分明确的血管细胞球诱导培养基为cdm3-v(ripa1640为基础培养基,添加1 mg/ml bsa, 150 μg/ml laa)。分化的前两天添加6 μm chir99021,紧接更换培养基并添加50 ng/ml vegf和25 ng/ml fgf2诱导至第10天,每两天换液。
21.优选的,成分明确的心肌细胞球诱导培养基为cdm3-c(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa)。分化的前两天添加6 μm chir99021,紧接更换培养基并添加6 μm iwr诱导两天,随后更换培养基为cdm3-c培养至第8天,每两天换液。
22.优选的,构建成分明确的诱导体系将ebs分别诱导为血管细胞球和心肌细胞球。
23.优选的,区分诱导开始时间以获得不同尺寸的血管细胞球和心肌细胞球,心肌细胞的诱导晚于血管细胞的诱导,模拟器官发育的先后顺序。
24.优选的,两种细胞球的分化在同一天结束,便于后续细胞球融合构成类器官。
25.优选的,成分明确的血管化心脏类器官培养基为cdm3-c并添加50 ng/ml vegf和25ng/ml fgf2,并规定了20% fbs以促进细胞球间的融合和细胞的存活。
26.优选的,成分明确的血管化心脏类器官培养基fbs含量为2.5%,以确保后续应用中血清中不确定成分对研究的影响。
27.本发明还公开了一种具有空腔结构的血管化心脏类器官,采用上述方法制备而成。
28.本发明的有益效果在于:1、制备的到的心脏类器官具有明显的腔室结构,形成心肌壁。
29.2、制备得到的心脏类器官中形成明显的网络状血管结构,包覆于心肌壁中,血管为平滑肌细胞包裹内皮细胞形成的空腔结构。
30.3、血管可以明显的促进心肌细胞肌节的整齐排列,促进心肌细胞骨架的有序性,促进心肌细胞的跳动的一致性以及搏动频率。
31.4、血管可以促进心脏类器官的体积增长。
附图说明
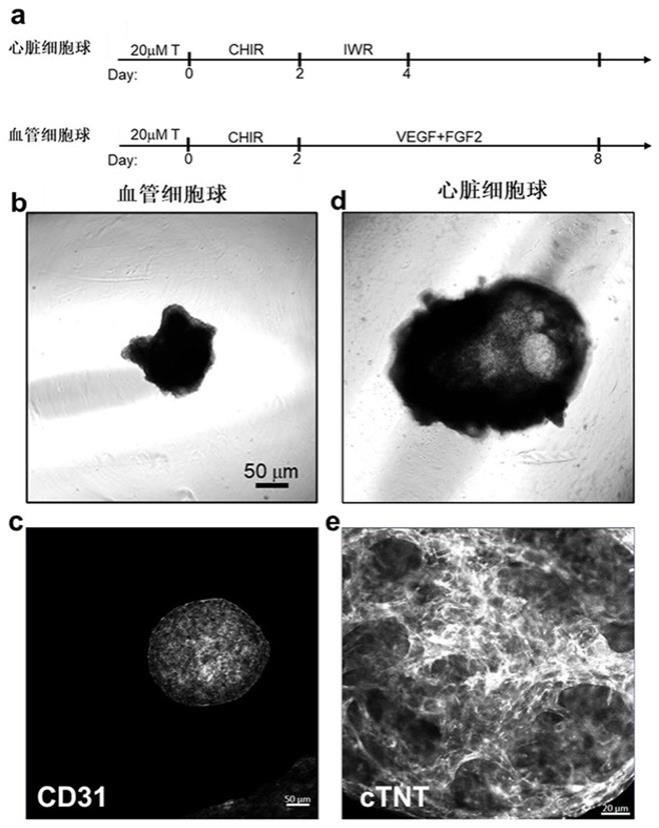
32.图1a为血管球和心肌球诱导流程图(其中上部分为实施例1的心肌细胞球诱导流程,下部分为所有实施例的血管细胞球诱导流程)、图1b为血管球明场照片、图1c为血管球cd31免疫荧光照片、图1d为实施例1心肌球明场照片、图1e为实施例1心肌球ctnt免疫荧光照片;图2为实施例1心脏类器官免疫荧光染色图(其中第一张为心肌细胞染色图、第二张为血管细胞染色图、第三张为心肌细胞和血管细胞同时染色图);图3为实施例1心脏类器官局部放大免疫荧光染色图(其中第一张为心肌细胞染色图、第二张为血管细胞染色图、第三张为心肌细胞和血管细胞同时染色图);图4为实施例1心脏类器官中具有血管的心肌细胞区域免疫荧光染色及统计图(其中“c”组为单纯心肌细胞球、“v”组为单纯血管细胞球、“c v”组为心肌细胞与血管细胞融合);图5为实施例1心肌细胞球和心脏类器官中ctnt免疫荧光图及统计图;图5a为心肌细胞ctnt免疫荧光照片、图5b分别为肌节有序指数、细胞核间距、肌节长度的统计图(其中第一张为肌节有序指数的统计图、第二张为细胞核间距的统计图、第三张为肌节长度的统计图);图6为实施例1心脏类器官体积随时间变化照片和统计图;图6a为血管化心脏类器官对比心肌细胞球rna-seq上调的通路富集气泡图;图6b为血管新生相关的差异基因富集热图、图6c为钙离子信号相关的差异基因富集热图(其中“c”组为单纯心肌细胞球、“v”组为单纯血管细胞球、“c v”组为心肌细胞与血管细胞融合);图7为实施例1中血管化心脏类器官随时间变化体积增长的明场照片和统计图(其中“c”组为单纯心肌细胞球、“v”组为单纯血管细胞球、“c v”组为心肌细胞与血管细胞融合);图8a为血管化心脏类器官对比心肌细胞球rna-seq上调的通路中血管新生相关的差异基因富集热图;图8b为肌节组装相关的差异基因富集热图、图8c为钙离子信号相关的差异基因富集热图;图9为实施例2中day30心脏类器官照片和跳动频率统计图;
图10为实施例2中2d条件下诱导心肌细胞及鉴定图;图10a为2d诱导及纯化心肌细胞流程图;图10b为2d条件诱导心肌细胞day7明场照片;图10c为2d条件诱导心肌细胞day7 ctnt免疫荧光照片;图10d为2d条件诱导心肌细胞day7效率流式图;图10e为2d条件诱导心肌细胞day10明场照片;图10f为2d条件诱导心肌细胞day10 ctnt免疫荧光照片;图10g为2d条件诱导心肌细胞day10效率流式图;图11a为实施例2中类器官随时间推移的明场照片;图11b为实施例3中类器官随时间推移的明场照片;图11c为实施例4中类器官随时间推移的明场照片;图12a为实施例2中类器官在day19的跳动频率统计图;、图12b为实施例3中类器官在day19的跳动频率统计图;图12c为实施例4中类器官在day19的跳动频率统计图。
具体实施方式
33.下面结合实施例对本发明的具体实施方式作进一步描述,以下实施例仅用于更加清楚地说明本发明的技术实施例,而不能以此来限制本发明的保护范围。
34.实施例1一种具有空腔结构的血管化心脏类器官的制备方法,血管球和心肌球都由ebs诱导得到,包括如下步骤:(1)将hipsc消化成单细胞悬液,按照1:3的比例传代至超低吸附孔板中,使用干细胞培养基培养1天,使胚胎干细胞或多能诱导干细胞形成拟胚体(ebs),随后将ebs分为两份;(2)其中一份ebs在4天后开始使用成分明确的心肌细胞球诱导体系开始为期8天的心肌细胞球的诱导。成分明确的心肌细胞球诱导培养基为cdm3-c(rpmi 1640为基础培养基,添加500μg/ml bsa,200μg/ml laa)。分化的前两天添加6μm chir99021,紧接更换培养基并添加6μm iwr诱导两天,随后更换培养基为cdm3-c培养至第8天,每两天换液(如图1a上部)。
35.(3)通过免疫荧光染色发现心肌细胞表达心肌特异标志物ctnt (如图1d,图1e) ;(4)另一份ebs在2天后开始使用成分明确的血管细胞球诱导体系开始为期10天的血管细胞球的诱导。成分明确的血管细胞球诱导培养基为cdm3-v(ripa1640为基础培养基,添加1 mg/ml bsa, 150μg/ml laa)。分化的前两天添加6μm chir99021,紧接更换培养基并添加50 ng/ml vegf和25 ng/ml fgf2诱导至第10天,每两天换液;(5)通过荧光染色染色发现血管细胞球表达内皮细胞特异性标志物cd31(如图1b,图1c);(6)在分化结束后将1个心肌细胞球和1个血管细胞球接种到超低吸附的96孔板的一个孔中;(7)在接种后的前3天添加成分明确的血管化心脏类器官的培养基并添加20 %的胎牛血清(fbs),促进细胞的存活和细胞球的融合,成分明确的血管化心脏类器官培养基为cdm3-o(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,50 ng/ul vegf, 25 ng/ml fgf2);(8)从第4天开始,减少血管化心脏类器官培养基中fbs的含量至2.5%;(9)在接种的第5天可以获得具有空腔结构的血管化心脏类器官,通过冰冻切片后
进行免疫荧光染色,结果显示该类器官中央有一个完整的空腔结构,外层为心肌细胞层(ctnt阳性)中穿插微血管网络(cd31阳性)(如图2、图3);通过横截面免疫荧光染色可以观察到血管具有典型的空腔结构(图3白色虚线);(10)为了观察类器官的血管化程度,本实施例对比了心肌细胞球、血管细胞球和血管化心脏类器官,通过对微血管网络进行染色(cd31阳性),发现血管化心脏类器官的血管化心肌细胞的程度可以达到28%左右,而只有心肌细胞球组只有8%左右,证明通过本实施例的血管化方法可以显著的促进心肌细胞球的血管化程度(如图4);(11)进一步分析血管对于心肌细胞的细胞结构和功能的影响,通过免疫荧光发现血管可以促进心肌结构的整齐排列(如图5a、图5b),利用rna测序技术(rna-seq)对获得类器官进行测序,分析发现血管的加入可以促进心肌细胞发育、血管新生、钙离子转移等相关通路的上调(如图6a),进一步对相关的差异基因进行聚类,发现相关的基因在血管化类器官中都呈上调趋势(如图6b和图6c);(12)将获得的心脏类器官持续培养,可以发现血管可以促进心脏类器官体积的持续增长(如图7),对不同时间点的类器官进行rna-seq,分析血管新生(图8a)、肌节组装(图8b)和钙离子转移(图8c)相关基因的表达,发现心脏类器官中的这些基因都是呈高表达模式,证明了本实施例构建的血管化心脏类器官可以模拟心脏的发育过程;(13)获得的第30天的心脏类器官的跳动频率和人心跳频率相当(如图9),表明随着培养时间的增加,类器官更加成熟,这也进一步验证了本实施例的rna-seq的结果。
36.实施例2一种具有空腔结构的血管化心脏类器官的制备方法,血管球由ebs诱导得到,心肌细胞球由2d条件下诱导的心肌细胞聚集成球获得,包括如下步骤:(1)将胚胎干细胞系h1消化成单细胞悬液,按照1:3的比例传代至超低吸附孔板中,使用干细胞培养基pe8培养1天,使胚胎干细胞或多能诱导干细胞形成拟胚体(ebs)随后开始血管细胞球的诱导(步骤如实施例1中所示);(2)ebs在4天后开始使用成分明确的血管细胞球诱导体系开始为期8天的血管细胞球的诱导。成分明确的血管细胞球诱导培养基为cdm3-v(ripa1640为基础培养基,添加1 mg/ml bsa, 150 μg/ml laa)。分化的前两天添加6 μm chir99021,紧接更换培养基并添加50 ng/ml vegf和25 ng/ml fgf2诱导至第10天,每两天换液。
37.(3)通过免疫荧光染色发现血管细胞球表达内皮细胞特异性标志物cd31(如图1b,图1c);(4)将步骤1中的h1消化成单细胞悬液,按照1:6的比例传代至matrigel包被的孔板中,使用干细胞培养基pe8培养3天,在细胞融合度达到80%左右时开始心肌细胞的的诱导。成分明确的心肌细胞诱导培养基为cdm3-c(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa);(5)心肌细胞分化的前两天添加6 μm chir99021,紧接更换培养基并添加6 μm iwr诱导两天,随后更换培养基为cdm3-c培养至第7天,心肌细胞开始跳动(如图10a、图10b);通过免疫荧光鉴定发现,大部分的细胞表达心肌细胞特异性标志物ctnt(如图10c),进一步利用流式细胞术鉴定发现ctnt阳性率为57%左右(如图10d);(6)为了获得纯度更高的心肌细胞,更换心肌细胞纯化培养基进行纯化。心肌纯化
培养基为rpmi 1640无葡萄糖为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,5 mm lactate;(7)纯化10天后获得高纯度的跳动的心肌细胞(如图10e),通过免疫荧光鉴定发现,纯化后的细胞几乎全部表达心肌细胞特异性标志物ctnt(如图10f),进一步利用流式细胞术鉴定发现ctnt阳性率为94%以上(如图10g);(8)在纯化完成的细胞中添加0.25%的胰酶,放入细胞培养箱中消化10-15分钟后,使用含有10% fbs的cdm-c培养基重悬成单细胞悬液,随后将0.5
×
104个心肌细胞放入低吸附的96孔板中过夜培养形成心肌细胞球;(9)第二天在含有心肌细胞球的孔板中接种1个已经诱导完成的血管细胞球;(10)在接种后的前3天添加成分明确的血管化心脏类器官的培养基并添加20%的胎牛血清(fbs),促进细胞的存活和细胞球的融合,成分明确的血管化心脏类器官培养基为cdm3-o(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,50 ng/ml vegf, 25 ng/ml fgf2);(11)从第4天开始,减少血管化心脏类器官培养基中fbs的含量至2.5%;(12)获得的第19天的心脏类器官的跳动频率可以到达每分钟30次左右(如图11a和图12a)。
38.实施例3一种具有空腔结构的血管化心脏类器官的制备方法,血管球由ebs诱导得到,心肌细胞球由2d条件下诱导的心肌细胞聚集成球获得,包括如下步骤:(1)将胚胎干细胞系h1消化成单细胞悬液,按照1:3的比例传代至超低吸附孔板中,使用干细胞培养基pe8培养1天,使胚胎干细胞或多能诱导干细胞形成拟胚体(ebs)随后开始血管细胞球的诱导(步骤如实施例1中所示);(2)ebs在4天后开始使用成分明确的血管细胞球诱导体系开始为期8天的血管细胞球的诱导。成分明确的血管细胞球诱导培养基为cdm3-v(ripa1640为基础培养基,添加1 mg/ml bsa, 150 μg/ml laa)。分化的前两天添加6 μm chir99021,紧接更换培养基并添加50 ng/ml vegf和25 ng/ml fgf2诱导至第10天,每两天换液(如图1a 下)。
39.(3)通过免疫荧光染色发现血管细胞球表达内皮细胞特异性标志物cd31(如图1b,图1c);(4)将步骤1中的h1消化成单细胞悬液,按照1:6的比例传代至matrigel包被的孔板中,使用干细胞培养基pe8培养3天,在细胞融合度达到80%左右时开始心肌细胞的的诱导(如图10中所示)。成分明确的心肌细胞诱导培养基为cdm3-c(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa);(5)心肌细胞分化的前两天添加6 μm chir99021,紧接更换培养基并添加6 μm iwr诱导两天,随后更换培养基为cdm3-c培养至第7天,心肌细胞开始跳动,通过免疫荧光鉴定发现,大部分的细胞表达心肌细胞特异性标志物ctnt(如图10c),进一步利用流式细胞术鉴定发现ctnt阳性率为57%左右(如图10d);(6)为了获得纯度更高的心肌细胞,更换心肌细胞纯化培养基进行纯化。心肌纯化培养基为rpmi 1640无葡萄糖为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,5 mm lactate;
(7)纯化10天后获得高纯度的跳动的心肌细胞,通过免疫荧光鉴定发现,纯化后的细胞几乎全部表达心肌细胞特异性标志物ctnt(如图10f),进一步利用流式细胞术鉴定发现ctnt阳性率为94%以上(如图10g);(8)在纯化完成的细胞中添加0.25%的胰酶,放入细胞培养箱中消化10-15分钟后,使用含有10% fbs的cdm-c培养基重悬成单细胞悬液,随后将1
×
104个心肌细胞放入低吸附的96孔板中过夜培养形成心肌细胞球;(9)第二天在含有心肌细胞球的孔板中接种1个已经诱导完成的血管细胞球;(10)在接种后的前3天添加成分明确的血管化心脏类器官的培养基并添加20%的胎牛血清(fbs),促进细胞的存活和细胞球的融合,成分明确的血管化心脏类器官培养基为cdm3-o(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,50 ng/ml vegf, 25 ng/ml fgf2);(11)从第4天开始,减少血管化心脏类器官培养基中fbs的含量至2.5%;(12)获得的第19天的心脏类器官的跳动频率可以到达每分钟45次左右(如图11b和图12b)。
40.实施例4一种具有空腔结构的血管化心脏类器官的制备方法,血管球由ebs诱导得到,心肌细胞球由2d条件下诱导的心肌细胞聚集成球获得,包括如下步骤:(1)将胚胎干细胞系h1消化成单细胞悬液,按照1:3的比例传代至超低吸附孔板中,使用干细胞培养基pe8培养1天,使胚胎干细胞或多能诱导干细胞形成拟胚体(ebs)随后开始血管细胞球的诱导(步骤如实施例1中所示);(2)ebs在4天后开始使用成分明确的血管细胞球诱导体系开始为期8天的血管细胞球的诱导。成分明确的血管细胞球诱导培养基为cdm3-v(ripa1640为基础培养基,添加1 mg/ml bsa, 150 μg/ml laa)。分化的前两天添加6 μm chir99021,紧接更换培养基并添加50 ng/ml vegf和25 ng/ml fgf2诱导至第10天,每两天换液(如图1a 下);(3)通过免疫荧光染色发现血管细胞球表达内皮细胞特异性标志物cd31(如图1b,图1c);(4)将步骤1中的h1消化成单细胞悬液,按照1:6的比例传代至matrigel包被的孔板中,使用干细胞培养基pe8培养3天,在细胞融合度达到80%左右时开始心肌细胞的的诱导(如图10中所示)。成分明确的心肌细胞诱导培养基为cdm3-c(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa);(5)心肌细胞分化的前两天添加6 μm chir99021,紧接更换培养基并添加6 μm iwr诱导两天,随后更换培养基为cdm3-c培养至第7天,心肌细胞开始跳动,通过免疫荧光鉴定发现,大部分的细胞表达心肌细胞特异性标志物ctnt(如图10c),进一步利用流式细胞术鉴定发现ctnt阳性率为57%左右(如图10d);(6)为了获得纯度更高的心肌细胞,更换心肌细胞纯化培养基进行纯化。心肌纯化培养基为rpmi 1640无葡萄糖为基础培养基,添加500μg/ml bsa,200 μg/ml laa,5 mm lactate;(7)纯化10天后获得高纯度的跳动的心肌细胞,通过免疫荧光鉴定发现,纯化后的细胞几乎全部表达心肌细胞特异性标志物ctnt(如图10f),进一步利用流式细胞术鉴定发
现ctnt阳性率为94%以上(如图10g);(8)在纯化完成的细胞中添加0.25%的胰酶,放入细胞培养箱中消化10-15分钟后,使用含有10% fbs的cdm-c培养基重悬成单细胞悬液,随后将1
×
105个心肌细胞放入低吸附的96孔板中过夜培养形成心肌细胞球;(9)第二天在含有心肌细胞球的孔板中接种1个已经诱导完成的血管细胞球;(10)在接种后的前3天添加成分明确的血管化心脏类器官的培养基并添加20%的胎牛血清(fbs),促进细胞的存活和细胞球的融合,成分明确的血管化心脏类器官培养基为cdm3-o(rpmi 1640为基础培养基,添加500 μg/ml bsa,200 μg/ml laa,50 ng/ml vegf, 25 ng/ml fgf2);(11)从第4天开始,减少血管化心脏类器官培养基中fbs的含量至2.5%;(12)获得的第19天的心脏类器官的跳动频率可以到达每分钟50次左右(如图11c和图12c)。
41.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。