1.本发明涉及一种基于诱导多能干细胞构建的全主动脉类器官芯片模型及其 应用,属于生物医药技术领域。
背景技术:
2.主动脉瘤(aortic aneurysm,aa)是指胸主动脉或腹主动脉的异常扩张,其 一旦进展为主动脉夹层(aortic dissection,ad)或破裂,则极为危险,24小时内 自然病死率接近50%。虽然aa可以通过手术或腔内手术治疗,但由于其发病机 制尚不明确,目前尚缺乏有效的药物治疗。研究表明,主动脉血管平滑肌细胞 (smooth muscle cell,smc)是主动脉壁的主要细胞成分,在主动脉病变过程中起 关键作用。
3.然而,基础及临床研究表明,aa的发病机制和对药物的反应存在节段异质 性。最近的临床研究发现,氟喹诺酮类药物的使用会增加人群中aa/ad的风 险,在氟喹诺酮类药物使用者中,大多数aa/ad病例与腹部aa相关,其次 是胸部aa。这可能是因为不同解剖主动脉节段(主动脉根部、升主动脉和主动 脉弓、降胸主动脉和腹主动脉)中的血管smc起源于不同的胚层,导致主动脉 节段异质性。以往的研究表明,升主动脉和主动脉弓部的血管smc主要来源于 神经嵴(neural crest,nc),降主动脉血管smc主要来源于轴旁中胚层(paraxialmesoderm,pm),主动脉根部血管smc主要来源于外侧中胚层(lateral mesoderm, lm)。此外,在loeys-dietz综合征和marfan综合征等各种血管疾病中,主 动脉的不同部分在药物敏感性和发病机制方面均表现出异质性。经典小鼠模型用 途广泛,但是对主动脉瘤小鼠模型进行表征仍然存在一定的难度。此外,小鼠模 型与人之间的物种差异性也是难以逾越的鸿沟。目前,传统的体外(twodimensional,2d)细胞培养模型广泛应用在生物学研究中,这些二维细胞培养进 行在培养皿或培养板中,难以体现人体组织器官复杂的生理功能。因此,迫切需 要一种合适的主动脉疾病模型,与动物模型互补,促进主动脉疾病的机制和药物 研究进展。
4.近年来,器官芯片技术在疾病建模和药物筛选领域受到越来越多的关注。通 过对芯片中的诱导多能干细胞或原代细胞加以仿生微生理或微机械刺激复原人 体微环境中的关键因素,达到更好地模拟人体生理学和病理生理学状态,彻底改 变了体外细胞培养模式。这也使研究人员对疾病机制有了更加深刻的见解,促进 了药物研发。现在已经有肺脏芯片、肾脏芯片、肝脏芯片、肠道芯片、心脏芯片、 血管芯片等被报道成功构建并用来构建疾病模型和药物筛选。
5.为了构建全主动脉器官芯片,在临床上,从同一个患者主动脉不同部位获取 全主动脉组织样本难度大且有违伦理;而从不同患者不同部位虽然可以得到主动 脉各个节段的血管smc,但又存在个体差异。近十几年来,通过重编程体细胞 获得的人类诱导多能干细胞(induced pluripotent stem cells,ipsc)技术的发展使 得获得不同胚层起源的人体组织细胞成为可能。ipsc是利用特定基因或特定基 因产物(蛋白质)诱导成体细胞重新编
程,在一定条件下转化为类似胚胎干细胞 的一类具有多向分化潜能的细胞。它在体外能分化为拟胚体,在动物体内能形成 畸胎瘤,在一定条件下甚至可以形成一个完整生命个体。自从2006年日本科学 家山中伸弥等利用小鼠成纤维细胞首次获得ipsc至今,人们已经在ipsc研究 领域取得了诸多突破性进展。不仅已经获得了多个物种的ipsc,而且在ipsc来 源方面也已包含皮肤成纤维细胞、骨髓来源细胞、脂肪干细胞、肠上皮细胞、尿 液肾上皮细胞、毛囊间充质干细胞等几乎所有体细胞。同时,由于诱导因子及其 导入方式的不断优化,编程效率也不断提高。此外,研究人员还利用ipsc技术 建立了多种疾病模型,比如遗传性血管疾病loeys-dietz综合征和marfan综合 征。2009年,中国科学家周琪和曾凡一等利用ipsc克隆出存活并具有繁殖能力 的小鼠,从而在世界上首次证实ipsc与胚胎干细胞同样具有全能性。现已证实 ipsc经诱导可分化成各种类型心血管细胞。2009年,timothy j.kamp首次证 实人ipsc可分化成有功能的心肌细胞(induced pluripotent stemcells-cardiomyocytes,ips-cms),并用免疫细胞化学和电生理学方法证实了 ips-cms与胚胎干细胞诱导分化的心肌细胞具有相同特性。
6.ipsc细胞模型的建立具有重要科学技术价值。首先,与传统细胞模型相比, 特异性ipsc可以更真实、全面地反映患者病理生理特征,为发病机制的研究提 供新的思路。其次,ipsc在合适条件下可无限扩增,从而为开展罕见疾病相关 研究提供足够标本。第三,在ipsc水平进行药物筛选,不仅可发现更为有效的 治疗药物,而且有助于在临床前期筛除毒性过大的药物,从而降低药物研发成本, 进一步提高临床药物试验的安全性,甚至有望克服个体差异,达到个体化治疗的 效果。此外,通过在ipscs水平对缺陷基因进行修饰从而改善细胞功能,将为 实现以ipscs技术治疗遗传性疾病提供新的实验依据。
技术实现要素:
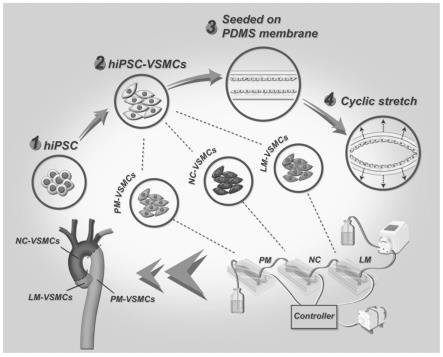
7.本发明的目的是:为了在体外模拟全主动脉平滑肌细胞体内环境中的病理生 理过程,揭示全主动脉节段异质性,本发明结合多能诱导干细胞(ipsc)技术, 诱导分化出三种胚胎起源特异性血管smc(nc-smcs、lm-smcs和 pm-smcs),分化的三胚层smc分别培养在串联的具有三层结构的芯片的细胞 培养腔中,模拟不同解剖主动脉节段,应用微流控技术及可控制的真空/气压提 供系统,构建出了可以控制平滑肌细胞的机械张力、节律和频率的芯片系统,成 功构建了全主动脉类器官芯片模型,并用于主动脉疾病分子机制研究及潜在药物 的筛选。
8.为了实现上述目的,本发明提供了一种基于ipsc构建的主动脉类器官芯片 模型,包括主动脉类器官芯片以及电磁阀控制器、真空气体泵、气体电磁阀、真 空过滤器和蠕动泵,所述主动脉类器官芯片是模拟主动脉器官的结构构建而成 的,包括模拟不同解剖主动脉节段的第一芯片、第二芯片和第三芯片,所述第一 芯片、第二芯片和第三芯片的基本结构相同,均包括由上至下依次设置的三层芯 片骨架,其中,所述芯片骨架的上、下两层分别开设有气体通道、中间层开设有 液体通道,相邻芯片骨架间设置有弹性膜,所述弹性膜与各层通道形成位于中间 的细胞培养腔和位于所述细胞培养腔上下两侧的真空腔,所述各芯片的液体通道 的两端端部设置有用于与外部连接的管道接口,所述各芯片的上、下层气体通道 相错开的端部设置有用于与外部连接的管道接口(上、下层气体通道仅其中一端 端部设置管道接口);
9.所述第一芯片、第二芯片和第三芯片的液体通道依次串联后与蠕动泵连接; 所述第一芯片、第二芯片和第三芯片的各真空腔分别依次连接真空过滤器、气体 电磁阀和真空气体泵,所述气体电磁阀与电磁阀控制器连接,所述第一芯片、第 二芯片和第三芯片的气体通道形成并联结构;
10.人源诱导多能干细胞定向分化的三胚层血管平滑肌细胞lm-smc、 nc-smc、pm-smc分别种植于第一芯片、第二芯片和第三芯片的细胞培养腔的 弹性膜上,用蠕动泵进行培养液的更换,模拟血液流动,电磁阀控制器控制气体 电磁阀的开闭,模拟细胞受到的生理性周期性张力和节律。
11.优选地,所述三胚层血管平滑肌细胞是由外周血细胞(peripheral bloodmononuclear cell,pbmc)重编程为人源诱导多能干细胞后,再经过分化培养得到。
12.优选地,所述芯片骨架由pdms材料制成,所述弹性膜为pdms膜。
13.优选地,所述管道接口包括软管和套设于所述软管内的不锈钢针管。
14.优选地,所述真空气体泵包括依次连接的泵体、水油分离器和真空调压阀, 所述真空调压阀与气体电磁阀连接。
15.上述人源诱导多能干细胞定向分化为三胚层血管平滑肌细胞的方法具体包 括如下步骤:
16.步骤1:用重编程试剂盒将收集的外周血细胞重新编程;
17.步骤2:之后将转染的细胞重新铺板在涂有玻连蛋白的培养皿上,并在e8 培养基中培养,每隔一天更换一次培养基;
18.步骤3:在第24天,重编程进行到克隆株细胞形态明显变大且没有克隆融 合的情况下,进行单克隆挑选培养,收集干细胞,铺在涂有matrigel的多孔板 上,并在mtesr1培养基中扩增培养,每天更换培养基;然后用accutase细胞 消化液消化细胞,并使用rocki培养液以1:5至1:7的比例每5-7天传代一 次,获得人源诱导多能干细胞;
19.步骤4:步骤3重编程培养得到的人源诱导多能干细胞定向分化为三胚层血 管平滑肌细胞lm-smc、nc-smc、pm-smc;
20.其中,对于lm-smc的分化采用的是cdm2培养基诱导分化,所述cdm2 培养基是由imdm和f12培养基按照质量比1:1的比例混合后与2mm glutamax、1%v/v化学定义脂质浓缩物、聚乙烯醇1mg/ml、胰岛素7μg/ml、 转铁蛋白15μg/ml和单硫代甘油450μm混合制成;
21.对于nc-smc的分化采用的是含有y27632的培养基中诱导分化;
22.对于pm-smc的分化采用的是含有dmem/f12、1xb27补充剂、1% pen/strep、1-thioglycerol 400μm、pdgf-bb 10ng/ml和tgf-β2ng/mlhipscs 的混合培养基诱导分化。
23.所有细胞培养均在37℃和5%co2的培养箱中培养。
24.优选地,所述人源诱导多能干细胞定向分化为lm-smc的过程包括:人源 诱导多能干细胞铺板过夜后,用dulbecco改良的eagle培养基dmem/f12清 洗hipsc,并在补充有激活素a30ng/ml、bmp4 40ng/ml、chir99021 6μm、 fgf2 20ng/ml和pik90 100nm的培养基中培养24小时,随后,获得的中间原 始细胞用dmem/f12 gibco洗涤,并在补充有a83-01 1μm、bmp4 30ng/ml 的cdm2培养基中向侧中胚层分化和c59 1μm中培养24小时或48小时,最 后,将lm细胞解离或直接在含有pdgf-bb 10ng/ml和tgf-β2ng/ml的 cdm2培养基中培养7天;
25.所述人源诱导多能干细胞定向分化为nc-smc的过程包括:将ipscs接种 在含有
y27632 10μm的tesre8培养基中,两天后,在含有y27632的培养 基中诱导细胞分化成神经嵴,然后在含有dmem/f12、1xn2补充剂、0.1%牛 血清白蛋白、1%青霉素/链霉素、sb431542 10μm和ldn193189 1μm的培养 基中培养6天,其中,在第2-6天将chir99021添加到分化培养基中,最后, 在含有dmem/f12、20%敲除血清替代物、pdgf-bb10 ng/ml和tgf-β2 ng/ml的培养基中持续培养6至8天;
26.所述人源诱导多能干细胞定向分化为pm-smc的过程包括:将ipsc接种 在含有y27632 10μm的tesre8培养基中,第二天,在含有dmem/f12、 1xb27补充剂、1%pen/strep、bmp4 25ng/ml、chir99021 8μm、抗坏血酸 50μg/ml和1-硫代甘油400μm的培养基中持续培养3天,然后,将pm细 胞解离并接种到含有dmem/f12(gibco)、1xb27补充剂、1%pen/strep、 1-thioglycerol 400μm、pdgf-bb 10ng/ml和tgf-β2ng/ml的pm-smc诱导 培养基中培养7天。
27.本发明还提供了上述的基于诱导多能干细胞构建的主动脉类器官芯片模型 在研究不同拉伸张力和节律对胚胎起源特异性smc形态、排列及细胞表型的影 响中的应用。
28.本发明还提供了上述的基于诱导多能干细胞构建的主动脉类器官芯片模型 在主动脉疾病节段异质性发病机制的研究中的应用。
29.本发明还提供了上述的基于诱导多能干细胞构建的主动脉类器官芯片模型 在主动脉疾病的分子机制研究及药物筛选中的应用。
30.本发明的发明原理及依据:研究发现,主动脉的各个节段(主动脉根部、升 主动脉及弓部、降主动脉)的血管细胞来源于胚胎发育过程中的不同部位,导致 即使最终分化为同一种细胞(如平滑肌细胞smc),其细胞的功能也有所差异, 从而导致疾病发生发展存在着节段异质性。主动脉smc是主动脉中层的功能细 胞,主要参与主动脉病变的发生发展,升主动脉及弓部区域smc主要来自于神 经嵴(nc),降主动脉区域主要来自于轴旁中胚层(pm),而主动脉根部主要来自 于侧板中胚层(lm),因此,主动脉各节段对主动脉病变可变易感性在不同的 疾病中产生机制均有所差异。同时,在心脏节律性收缩-舒张过程中,主动脉各 节段收缩幅度也不相同,为了更好研究主动脉疾病节段异质性发病机制和进行有 效药物筛选,需要构建一种全主动脉体外微生理系统—全主动脉器官芯片模型。
31.本发明的全主动脉类器官芯片模型包括分别用于种植三胚层血管平滑肌细 胞lm-smc、nc-smc、pm-smc的第一芯片、第二芯片和第三芯片,芯片由 三块刻有通道的pdms块和两张pdms薄膜组装而成。细胞培养在中间的pdms 膜上,芯片中间的通道为液道,灌装有培养液以供细胞生命活动所需。芯片上下 通道间歇抽气,通过薄膜上下的气压差使其发生期望的拉伸。芯片液道部分为串 联,由液体泵驱动,培养液维持不间断地循环,模拟血液流动;气道部分为并联, 可通过中控平台对三部分进行不同的张力和节律调节。该芯片模型的构建过程和 工作原理如图1所示。
32.与现有技术相比,本发明的有益效果在于:
33.(1)本发明的ipsc诱导分化的不同胚层起源的血管smc可以与人体细胞 有高度一致性,可以获得同一个体主动脉不同解剖节段的smc细胞,在合适的 条件下可体外无限扩增,克服了一定的临床伦理限制。此外,本发明的基于诱导 多能干细胞构建的主动脉类器官芯片模型能够完全模拟不同解剖主动脉节段的 异质性,可用于研究主动脉疾病节段异质性发病机制和进行有效药物筛选;
34.(2)本发明的全主动脉类器官芯片模型能精确控制细胞拉伸的幅度和频率, 从结构上更加符合血管的管状结构,双层pdms膜结构及芯片培养池尺寸的增 大使得芯片培养面积有了显著地增加,克服了微流控芯片细胞量不够用于复杂的 生物实验的缺陷,本芯片系统可以进行大通量实验,可重复性强,显著提高实验 效率,可减少实验成本。
附图说明
35.图1为本发明的全主动脉类器官芯片模型的构建过程和工作原理示意图;
36.图2为人源诱导多能干细胞(human induced pluripotent stem cells,hipsc)定向 分化为三胚层血管平滑肌细胞的过程及鉴定结果;
37.图3为全主动脉器官芯片的设计图和实物结构图;a:芯片设计图,b:芯 片系统实物图;c:串联的芯片结构图;
38.图4为芯片模具结构示意图;
39.图5为芯片制备简易示意图;
40.图6为周期性张力(0.5hz拉伸频率)对不同谱系来源ipsc-smc形态、排 列及细胞表型的影响;a:三种smc的免疫荧光染色图;b:三种smc的细胞 排列图;c:三种smc的细胞长宽比例统计结果;d:炎症标志物sm22在三 种smc中的表达水平;d:炎症标志物il-6在三种smc中的表达水平;f:细 胞外基质(ecm)降解蛋白mmp-9在三种smc中的表达水平;
41.图7为周期性张力(1hz拉伸频率)对不同谱系来源ipsc-smc形态、排列 及细胞表型的影响;a:三种smc的免疫荧光染色图;b:三种smc的细胞排 列图;c:三种smc的细胞长宽比例统计结果;d:炎症标志物sm22在三种smc 中的表达水平;d:炎症标志物il-6在三种smc中的表达水平;f:细胞外基质 (ecm)降解蛋白mmp-9在三种smc中的表达水平;
42.图8为周期性张力(2hz拉伸频率)对不同谱系来源ipsc-smc形态、排列 及细胞表型的影响;a:三种smc的免疫荧光染色图;b:三种smc的细胞排 列图;c:三种smc的细胞长宽比例统计结果;d:炎症标志物sm22在三种smc 中的表达水平;d:炎症标志物il-6在三种smc中的表达水平;f:细胞外基质 (ecm)降解蛋白mmp-9在三种smc中的表达水平;
43.图9为全主动脉芯片模型验证不同浓度的环丙沙星对不同谱系ipsc-smc的 影响:流式鉴定和蛋白免疫印迹;a:流式细胞术分析不同环丙沙星浓度对三种 smc的影响;b:流式细胞术的细胞死亡统计结果;c:蛋白质印迹检测不同环 丙沙星浓度处理后三种smc中caspase 3的表达;d:三种smc中caspase 3表 达量的统计结果;e:蛋白质印迹检测不同环丙沙星浓度处理后三种smc中bax 的表达;f:三种smc中bax表达量的统计结果;
44.图10为全主动脉芯片模型验证不同浓度的环丙沙星对不同谱系ipsc-smc 的影响:tunel染色鉴定和蛋白免疫印迹;a:tunel染色检测不同环丙沙星 浓度对三种smc的影响;b:tunel染色的细胞死亡统计结果;c:蛋白质印 迹检测不同环丙沙星浓度处理后三种smc中sm22的表达;d:三种smc中 sm22表达量的统计结果;e:蛋白质印迹检测不同环丙沙星浓度处理后三种smc 中nmp9的表达;d:三种smc中nmp9表达量的统计结果。
具体实施方式
45.为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下。
46.实施例1
47.1、诱导多能干细胞定向分化为不同谱系血管平滑肌细胞
48.(1)外周血细胞(peripheral blood mononuclear cell,pbmc)重编程为人源诱 导多能干细胞
49.使用sepmatetm pbmc分离管(加拿大干细胞技术公司)从健康供体的全 血样本中分离pbmc。将分离的pmbc在含有2mm glutamax、scf(100 ng/ml,peprotech,usa)、rhflt3(100ng/ml,peprotech,usa)、rhil-3(20ng/ml, peprotech)和rhil-6(20ng/ml,peprotech,美国)的sp34培养基(gibco)中 培养。培养7天后,通过离心(200
×
g,5分钟)收获pbmc,并根据试剂盒的 说明(thermo fisher scientific)用重编程试剂盒重新编程。在第2天,将转染的 细胞重新铺板在涂有玻连蛋白(thermo fisher scientific)的10cm培养皿上,并 在e8(thermo fisher scientific)中培养。每隔一天更换一次培养基。在第24天, 收集干细胞,铺在涂有matrigel的24孔板上,并在mtesr1(stemcelltechnologies,加拿大)中扩增,每天更换培养基。然后用accutase(stem celltechnologies,canada)消化细胞,并使用rocki(10μm,selleck,usa)以1: 5至1:7的比例每5-7天传代一次。所有细胞均在37℃和5%co2的培养箱 中培养。
50.(2)人源诱导多能干细胞(human induced pluripotent stem cells,hipsc)定向 分化为三胚层血管平滑肌细胞
51.(3)对于lm-smc分化,所有lm-smc分化均在化学成分确定的cdm2 基础培养基中进行。cdm2是imdm(gibco)和f12(gibco)培养基(1:1)与 2mm glutamax、1%v/v化学定义脂质浓缩物(life technologies)、聚乙烯醇 (pva,1mg/ml,sigma-aldrich)、胰岛素(7μg/ml,roche diagnostics)、转铁 蛋白(15μg/ml,roche diagnostics)和单硫代甘油(450μm,sigma-aldrich) 混合制成。ipscs铺板过夜后,用dulbecco改良的eagle培养基(dmem)/f12 (gibco)短暂清洗hipsc,并在补充有激活素a(30ng/ml,peprotech,usa)、 bmp4(40ng/ml,peprotech)、chir99021(6μm,selleck,usa)、fgf2(20ng/ml, peprotech,usa)和pik90(100nm,selleck,usa)的培养基中培养24小时。随 后,中间原始细胞用dmem/f12(gibco)短暂洗涤,并在补充有a83-01((1μm, selleck,usa)、bmp4(30ng/ml,peprotech,usa)的cdm2培养基中向侧中胚 层分化和c59(1μm,selleck,usa)中培养24小时或48小时。最后,将lm 细胞解离或直接在含有pdgf-bb(10ng/ml,peprotech,usa)和tgf-β(2ng/ml, peprotech,usa)的smc分化培养基(cdm2)中培养7天。
52.对于nc-smc分化,将hipscs以4
×
104个细胞/cm2的密度接种在含有 y27632(10μm,selleck,usa)的tesre8培养基中。两天后,在含有y27632的 培养基中诱导细胞分化成神经嵴。然后在含有dmem/f12(gibco)、1xn2补 充剂(life technologies)、0.1%牛血清白蛋白(bsa、sigma-aldrich)、1%青 霉素/链霉素、sb431542(10μm,selleck)和ldn193189(1μm,selleck,usa) 的培养基中培养6天。其中,在第2-6天将chir99021添加到分化培养基中。 最后,在含有dmem/f12(gibco)、20%敲除血清替代物(gibco)、pdgf-bb(10 ng/ml,peprotech,美国)和tgf-β(2ng/ml,peprotech,美国)的培养基中 持续培养6至8天;
53.(4)对于pm-smc分化,将ipscs以3
×
104个细胞/cm2的密度接种在 含有y27632(10μm,selleck,usa)的tesre8培养基中。第二天,在含有 dmem/f12(gibco)、1xb27补充剂(life technologies)、1%pen/strep、bmp4(25 ng/ml,peprotech,usa)、chir99021(8μm,selleck,美国)、抗坏血酸(50μg/ml, sigma)和1-硫代甘油(400μm,sigma)的培养基中持续
培养3天。然后,将 pm细胞解离并以3
×
104细胞/cm2的密度接种到pm-smc诱导培养基中培养 7天,该培养基含有dmem/f12(gibco)、1xb27补充剂(life technologies)、 1%pen/strep、1-thioglycerol(400μm,sigma)、pdgf-bb(10ng/ml,peprotech, usa)和tgf-β(2ng/ml,peprotech,usa);
54.上述人源诱导多能干细胞(human induced pluripotent stem cells,hipsc)定向 分化为三胚层血管平滑肌细胞的过程及鉴定结果如图2所示。
55.2、全主动脉体外微生理系统的构建
56.用具有弹性的聚二甲基硅氧烷(polydimethylsiloxane,pdms)材料制作三 层结构的芯片骨架,芯片设计如图3a所示。芯片有三层腔室结构组成,中间的 腔室结构的上下壁由弹性pdms膜组成,平滑肌细胞种植在这两层弹性pdms 膜上。顶层和底层的腔室通入真空负压气体,通过这两层腔室里的负压气体引起 弹性pdms膜的形变,从而引起平滑肌细胞的收缩-舒张的机械形变。用电极板 和气体电磁阀组成的控制系统搭建了可控制的真空/气压提供系统,构建出可以 控制平滑肌细胞的机械张力、节律和频率的控制系统。用蠕动泵进行培养液的更 换,模拟血液流动。为了避免外接的真空负压气体污染细胞,在气源出口部分安 装了气体过滤器并用真空调压阀控制真空负压的大小。由上述的pdms芯片、 控制器、流体控制端、气体控制端等四部分组成的器官芯片系统,芯片系统实物 图如图3b,3c所示。
57.(1)pdms胶的制备:pdms是一种高分子聚合材料,具有较好气体通透 性、光学性能以及较好的弹性。pdms是一种胶状物,由a液和b液组成。a 液是pdms原液,b液是pdms凝固引发剂。根据实验需要,按一定质量比例 将a和b液混合,如a:b=5:1、10:1、15:1、20:1(w/w),比例越大pdms软 度越大,硬度越小。因为在搅拌过程中,在pdms胶里面出现大量的小气泡, 因此将配好的pdms液放在真空抽气罐里放置0.5-1h。真空罐负压保持在在
ꢀ‑
0.1mpa到-0.8mpa之间。
58.(2)弹性pdms膜的准备:本发明中使用的弹性pdms膜购买于杭州包尔 得新材料科技有限公司,此商品化的pdms具有良好的弹性,厚度均一,裁剪 方便。此弹性pdms膜的参数如下列表1所示:
59.表1pdms膜的性能参数
60.指标数值硬度(邵氏a)50拉伸强度(mpa)5撕裂强度(kn/m)6断裂伸长率(%)400弹性模量2.1折光率(%)1.41适用温度范围(℃)-40—200细胞毒性无毒性厚度规格200
±
3μm
61.(3)芯片模具的制作:用cad画图软件设计出三片大小为100mm
×
40mm 外框结构及每片含有70mm
×
6mm
×
4mm大小通道的三层微流控芯片结构。用 cnc雕刻机床在聚甲基丙烯
酸甲酯(pmma)亚克力板上雕刻出三片大小为100 mm
×
40mm
×
6mm外框结构,并雕刻出三个70mm
×
6mm
×
4mm大小的液道 和气道部分。将在上述步骤雕刻出来的外框架以及通道块用pmma专用3m强 力双面胶贴在一个平的pmma板上,制作出芯片模具,如图4所示。
62.(4)芯片的制备及组装:将制备好的pdms胶倒在pmma芯片模具上, 用洗耳球把pdms表面上产生的小气泡吹破,尽量保证pdms胶里面没有气泡。 将倒在模具里的pdms胶平放在70℃的烘箱里,加热2h。从模具取出成形的 pdms块,在取出的过程中保持pdms块表面清洁。用1mm打孔器在相应位置 打孔,使得出入口与气道和液道相通。将商业化200μm厚度pdms薄膜剪成100 mm
×
40mm大小。将上述步骤制备好的3个pdms芯片块和2个pdms薄膜用 等离子清洗仪处理5min。从上到下,气道pdms块-pdms薄膜-液道pdms块
ꢀ‑
pdms薄膜-气道pdms块,按照上述顺序,将表面处理好的pdms块和pdms 薄膜贴在一起(图5)。在贴的过程中注意三个通道的边缘尽量重叠在一起。将 上述贴好的三层pdms芯片放在70℃的烘箱里,加热1h。准备内径1mm,3cm 长的乳胶软管数只。用外径1mm,长度1cm的顿性不锈钢针管插入到准备好的 软管一端,再用1.6mm大小的鲁尔接头插入到软另一端,制作接在芯片气道和 液道接口的管道。将准备好的管道插在芯片气道和液道出入口,从而完成完整的 pdms芯片。
63.(5)整个芯片系统的构建:整个系统的动力源为真空泵,泵的抽气口与水 油分离器相连,过滤气体防止泵受损。水油分离器与真空调压阀相连,调压阀用 来控制真空度的高低,从而控制pdms薄膜的拉伸度。之后与电磁阀入口相连, 电磁阀出口与芯片气道的接口相连。电磁阀是由电压控制开断的阀门。当电压大 于24v时,连通入口和出口,在气道造成低压环境,膜发生形变;小于24v时, 连通出口和大气,使气道压强恢复大气压,膜恢复形变。电磁阀的开断频率由单 片机控制,预先烧制好程序的单片机按指定频率控制其输出端口的电压高低。端 口输出高压为5v,低压为0v,通过电磁继电器调制将高压调制至24v后与电 磁阀相连从而使电磁阀按照预期频率开断。通过调节调压阀的开度可以实现拉伸 幅度可调,通过改变单片机的程序可以实现拉伸频率调节。用蠕动泵进行培养液 的更换或者药物的处理。
64.3、全主动脉类器官芯片模型的构建
65.将浓度为80μg/ml鼠尾胶原(sigma)灌入制备好的pdms芯片(包括第一 芯片、第二芯片和第三芯片)的液道里面,在室温下放置0.5-1h,再把胶原从液 道里面抽出来。将铺好胶原的pdms芯片放在60℃烘箱中直至胶原烘干。已用 胶原处理好的pdms芯片放在紫外线消毒柜里,灭菌1-2h。已灭菌处理好的芯 片放入超净工作台里,当平滑肌细胞长满至80%以上时,用0.25%的胰酶,放置 在37℃培养箱里,消化3min。消化结束后,3ml dmem/f12 10%胎牛血清(fbs) 的培养液加入到培养皿里中和胰酶,用1ml枪头反复吹打细胞,并把细胞悬液收 集在15ml离心管里。1200rpm转速离心5min,弃去上清。加入1mldmem/f12 10%胎牛血清(fbs)培养液,吹打细胞充分混匀,进行细胞计数。 根据细胞计数的数量,把细胞稀释至2
×
105浓度。缓慢向铺好胶原并消毒灭菌处 理好的pdms芯片液道里灌入pbs,并将pbs抽取弃掉。将稀释至2
×
105个/ml 浓度的平滑肌细胞悬液缓慢向液道里灌入(第一芯片、第二芯片和第三芯片的细 胞培养腔分别培养三胚层血管平滑肌细胞lm-smc、nc-smc、pm-smc)。之 后关好pdms芯片出入口的鲁尔接头。把芯片放置在37℃,5%co2培养箱里培 养24h。当细胞贴壁后,将pdms芯片的气道出口接在真空泵抽气孔。打开电磁 阀控制器开关。打开真空气压阀,调节气压大小,调控拉伸幅度。通过中控调整 拉伸频率。点击开始按
钮,将芯片放入37℃,5%co2培养箱里继续培养,拉伸 处理24h后关闭控制系统,完成整个主动脉类器官芯片模型的构建,可用于进行 后续的生物实验。
66.实施例2
67.应用上述实施例1构建的全主动脉类器官芯片模型,研究不同拉伸张力和节 律对胚胎起源特异性smc形态、排列及细胞表型的影响,实验中选择了三种拉 伸频率(0.5,1.0和2.0hz,相当于心率30次/分,60次/分和120次/分),分 为静态、低张力组和高张力组。首先,我们分析了0.5hz条件下不同节段smc 的拉伸差异。三种smc免疫荧光染色和细胞排列图像表明,0.5hz节律性应变 (拉伸24小时)对这些细胞几乎没有影响,与静态组相比,结果无统计学差异 (图6a-c)。sm22、il-6(一种炎症标志物)和细胞外基质(ecm)降解蛋 白mmp-9的表达水平在不同组之间相似(图6d-f)。这些结果表明,0.5hz可 能不足以有效地改变细胞收缩表型和ecm。接下来,以1hz的频率进行了拉 伸处理。三种smcs的免疫荧光染色和细胞排列图像(拉伸24h)分析表明, 在lm-smcs和nc-smc中,有节奏的高应变张力增加了细胞长度,并使细胞 倾向于垂直于施加的应变方向排列。有趣的是,在低应变拉伸下的pm-smc即 中发现了类似的变化(图7a-c)。rt-qpcr结果进一步表明sm22的表达水 平与形态变化一致(图7d)。此外,与lm-smc和nc-smc组相比,高应变 下pm-sm组il-6和mmp9的表达显着增加(图7e和7f)。最后,研究2hz 的频率拉伸下的影响。所有三种smc分析(拉伸24小时)的免疫荧光染色和 细胞排列图像显示,有节奏的低应变和高应变张力拉伸均可增加细胞长度,并使 细胞倾向于垂直于所施加应变的方向排列(图8a-c)。同样,rt-qpcr显示 sm22的表达水平在低应变或高应变下的所有三种细胞中均显着上调(图8d), 而il-6和mmp-9的表达在低应变和高应变下均显着增加。高应变张力(图8e 和8f),这可能对细胞活力和ecm有害。总的来说,我们的结果表明,1.0hz 的频率是最佳的拉伸频率,并且lm-smc和nc-smc在高张力拉伸下表现出 最佳状态,而pm-smc低拉伸应力比较敏感。三系细胞表现出不同的状态,反 映了主动脉的节段异质性。
68.实施例3
69.临床研究表明,喹诺酮类抗生素暴露会增加人群aa的风险,并且较多研究 发现以腹主动脉瘤最为多见,其次是胸主动脉瘤,表现出节段异质性。因为伦理 和模型的限制,目前只能进行回顾性研究。为了评估喹诺酮类代表环丙沙星对主 动脉不同节段的影响,检测了环丙沙星对全主动脉芯片中lm-smc、nc-smc 和pm-smc中细胞死亡和凋亡基因表达的直接影响。环丙沙星暴露24小时 后,流式细胞仪分析显示lm-smc和nc-smc在200μg/ml剂量下出现细 胞死亡,而pm-smc对环丙沙星浓度更敏感,在100μg/ml即出现凋亡增加(图 9a和9b)。tunel染色显示环丙沙星诱导的细胞死亡部分是由于细胞凋亡, 如tunel阳性细胞数量增加所示(图10a和10b)。与流式细胞术分析一致, 蛋白质印迹结果显示caspase 3和bax在200μg/ml剂量下在lm-smc和 nc-smc中显着上调,而在pm-smc中它们在100μg/ml时上调(图9c-f)。 此外,lm-smcs和nc-smcs在200μg/ml的剂量下降低了sm22的表达水 平并上调了mmp9的表达水平,而pm-smcs在100μg/ml的剂量下表现出 相似的曲线(图10c-f)。因此,与lm-smc和nc-smc相比,pm-smc对 环丙沙星暴露更敏感。
70.hipsc-smc在心血管研究和药物筛选的应用需要一个模拟生理反应的微体 外生理系统。本发明首先通过hipsc定向诱导分化为起源特异性lm-smc、 nc-smc和pm-smc,其代表不同主动脉节段中的smc,包括主动脉根部、 升主动脉和主动脉弓,以及降胸主动脉和腹
主动脉。微流控技术用于将三种不同 类型的smc连接成一个完整的主动脉芯片。构建的芯片模型适用于确定不同节 段smcs的适当微生理特性,发现smcs所有谱系的最佳频率为1hz,而它们 的张力敏感性不同。pm-smcs比lm-smcs和nc-smcs对拉伸应力更敏 感。此外,全主动脉芯片表现出良好的生理收缩性、完美的协调性一致性,适合 体外药物测试。药物测试实验也发现,与lm-smc和nc-smc相比,pm-smc 对环丙沙星暴露更敏感。
71.综上所述,本发明首次建立了全主动脉体外微生理系统,并证明了其在药物 测试和机制研究方面的可行性。该系统将为未来的各种应用奠定基础,包括研究 各种心血管疾病的病理机制和细胞-细胞相互作用信号,探索个性化治疗药物, 测试药物安全性。因此,hipsc衍生的全主动脉模型可以指导未来使用基于芯 片模型的临床试验,这些模型精确、相对低成本和高效,具有推广和临床转化潜 力。
72.上述实施例仅为本发明的优选实施例,并非对本发明任何形式上和实质上的 限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下, 还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。