1.本发明涉及一种抗肿瘤腺病毒以及包含其的抗癌组合物。
背景技术:
2.癌症是全球死亡人数最多的疾病之一,创新性癌症治疗剂的开发可在减少癌症治疗所产生的医药费用的同时,创造出高附加值。并且,根据2008年的统计,可攻克现有抗癌剂耐药性的分子治疗剂在主要7个国家(us、japan、france、germany、italy、spain、uk)占一百七十五亿美元($17.5billion)的市场规模(market size),2018年形成了约四百五十亿($45billion)的市场规模(market size),预计会比2008年增长9.5%的增长率。癌症的治疗分为手术、放射线治疗、化疗、生物学治疗,其中,化疗为通过化学物质抑制癌细胞的增殖或杀死癌细胞的治疗法,因抗癌剂呈现出的毒性很大部分还会在正常细胞中呈现,因而具有一定程度的毒性,由于抗癌剂在使用一定时期后会出现在原有的效果方面丧失效果的耐药性,因而迫切开发选择性地对癌细胞起效且不产生耐药性的抗癌剂(癌症攻克现状biowave 2004.6(19))。近来,通过确保对癌症的分子遗传信息来开发将癌的分子特性作为靶标的新型抗癌剂,有报告指出,针对只有癌细胞所具有的特定分子靶标(molecular target)的抗癌剂不会产生耐药性。
3.抑制基因表达的技术是用于治疗疾病的治疗剂开发及靶标检验中的重要工具。核糖核酸干扰(rnainterference,以下称作rnai)在其作用被发现后被证实在多种哺乳动物细胞(mammalian cell)中作用于序列特异性信使核糖核酸(mrna)(silence of the transcripts:rna interference in medicine.j mol med(2005)83:764773)。核糖核酸干扰(rnai)为通过使21~25个核苷酸大小的具有双螺旋结构的小干扰核糖核酸(small interfering rna,以下称作sirna)与具有互补序列的转录体(mrnatranscript)特异结合来分解该转录体并由此抑制特定蛋白质的表达的现象。在细胞内,核糖核酸(rna)双链由被称作核酸酶(dicer)的核酸内切酶(endonuclease)处理来转换成21个至23个的双链(base pair,bp)的小干扰核糖核酸,小干扰核糖核酸将通过与核糖核酸诱导沉默复合物(risc,rna-induced silencing complex)相结合来使得向导(反义)链识别靶信使核糖核酸并分解的过程,以序列特异性地阻碍靶基因的表达(nucleic-acid therapeutics:basic principles and recent applications.nature reviews drug discovery.2002.1、503-514)。根据伯特兰(bertrand)研究团队的报告,与反义寡核苷酸(antisense oligonucleotide,aso)相比,对于相同的靶基因的小干扰核糖核酸(sirna)在生物体内/外(in vitro及in vivo)对信使核糖核酸(mrna)表达的阻碍效果出色,该效果能够持续得到保障(comparison of antisense oligonucleotides and sirnas in cell culture and in vivo.biochem.biophys.res.commun.2002.296:1000-1004)。经分析,基于包含小干扰核糖核酸(sirna)的核糖核酸干扰(rnai)技术的治疗剂市场会于2020年在全球形成总计12兆韩元以上的市场规模,可应用该技术的对象将得到前所未有的扩大,被评为可对难以用现有的基于抗体、化合物的药品治疗的疾病进行治疗的新一代基因治疗技术。并且,小干扰
核糖核酸(sirna)的作用机制为通过与靶信使核糖核酸(mrna)互补结合来以序列特异性地调节靶基因的表达,因而使现有的基于抗体的药品或化学物质(small molecule drug)对特定蛋白质靶标实现最佳化为止花费很长的开发时间以及很大的开发费用,但与之相比,可应用的对象将得到前所未有的扩大,将缩短开发时间,具有可开发对将无法实现药品化的靶标物质包括在内的所有蛋白质靶标实现最佳化的向导化合物的优点(progress towards in vivo use of sirnas.molecular therapy.2006 13(4):664-670)。为此,近来进行着如下的研究,即,在能够对该核糖核酸介质干扰现象在现有的化学合成药品开发中引起的问题提供解决方案的同时,通过在转录体层面选择性地抑制特定蛋白质的表达来用于各种疾病治疗剂的开发,尤其用于肿瘤治疗剂的开发。并且,与现有抗癌剂不同,小干扰核糖核酸(sirna)治疗剂有因靶标明确而可预测副作用的优点,在这种靶标特异性方面,对于作为因多种基因问题而产生的疾病的肿瘤而言,这种靶标特异性反而会成为治疗效果不明显的原因。
技术实现要素:
4.技术问题
5.本发明的目的在于提供一种抗肿瘤腺病毒。
6.而且,本发明的目的在于提供一种治癌组合物。
7.技术方案
8.为了实现如上所述的目的,本发明提供包含将第一核酸作为靶序列的碱基序列及将第二核酸作为靶序列的碱基序列的抗肿瘤腺病毒。
9.而且,本发明提供包含上述抗肿瘤腺病毒的治癌组合物。
10.发明的效果
11.根据本发明,本发明的双链小干扰核糖核酸(sirna)通过同时抑制第一核酸及第二核酸的表达来促进癌细胞的杀灭,抗癌活性明显优于一同处理各个小干扰核糖核酸(sirna),具有能够在与抗癌剂的并用处理过程中协同提高癌细胞杀灭功效的效果,包含对用于表达抗肿瘤腺病毒的短发夹核糖核酸(shrna)进行编码的表达盒和人端粒酶逆转录酶(htert)启动子的腺病毒具有避开体内免疫反应来向癌细胞特异传递并达到全身治疗功效的效果,可实现局部传递,选择性优秀,通过最少侵袭性治疗也能够呈现出显著的抗癌效果,可有效用作各种癌症的抗癌组合物或抗癌辅助剂。
附图说明
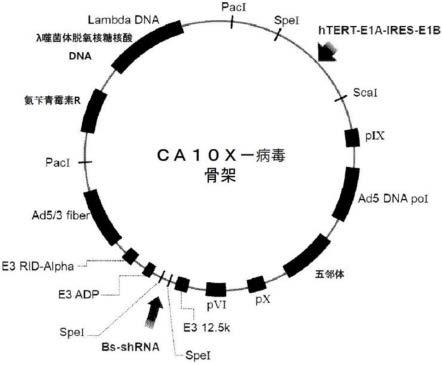
12.图1为示出用于在细胞内表达本发明的包含双靶标小干扰核糖核酸组的短发夹核糖核酸的载体图的图。
13.图2为确认基于本发明的组1至组9的双靶标双链小干扰核糖核酸的mtor或stat3基因表达抑制效果的图。
14.图3为确认基于本发明的双靶标小干扰核糖核酸组10(si-bb1)的bcl2基因(左)及bi-1基因(右)的表达抑制效果的图。
15.图4为确认基于本发明的双靶标小干扰核糖核酸组11至组15的bcl2基因及bi-1基因的表达抑制效果的图,其中,nc为对照组小干扰核糖核酸,si-bb2至si-bb6为本发明的小
干扰核糖核酸组11至组15。
16.图5为确认癌细胞株中的基于本发明的双靶标小干扰核糖核酸组16的ar基因及mtor基因的表达抑制效果的图,其中,a为h460细胞株,b为pc3细胞株,nc为对照组小干扰核糖核酸,siar为对于ar的小干扰核糖核酸,simtor为对于mtor的小干扰核糖核酸,si-at1为本发明的ar及mtor双靶标小干扰核糖核酸组16。
17.图6为确认基于本发明的双靶标小干扰核糖核酸组17~组28的a549细胞株中的ar基因及mtor基因的表达抑制效果的图,其中,nc为对照组小干扰核糖核酸,si-at2至si-at13为本发明的小干扰核糖核酸组17至组28。
18.图7为在多种癌细胞株中确认基于本发明的可同时抑制c-met及pd-l1的双靶标小干扰核糖核酸(double strand)的c-met及pd-l1基因的表达抑制效果的图。
19.图8为根据短发夹核糖核酸表达盒的脱氧核糖核酸(dna)量确认基于将对序列号66的ttggatccaa环状短发夹核糖核酸序列或序列号67的ttcaagagag环状短发夹核糖核酸序列进行编码的序列包含在内的载体的mtor及stat3的表达量的图。
20.图9为对串联连接两种单靶标小干扰核糖核酸后的基因表达抑制效果和本发明的双靶标短发夹核糖核酸的基因表达抑制效果进行比较的图。
21.图10为确认通过本发明的双靶标小干扰核糖核酸(组1至组9中的双靶标小干扰核糖核酸)同时抑制mtor及stat3时的人肺癌细胞株a549细胞的细胞存活率的图。
22.图11为确认在顺铂处理后通过本发明的双靶标小干扰核糖核酸同时抑制mtor及stat3时的人肺癌细胞株a549细胞的细胞存活率的图。
23.图12为确认在紫杉醇处理后通过本发明的双靶标小干扰核糖核酸同时抑制mtor及stat3时的人肺癌细胞株a549细胞的细胞存活率的图。
24.图13为确认在5-fu(5-fluorouracil)处理后通过本发明的双靶标小干扰核糖核酸同时抑制mtor及stat3时的人肺癌细胞株a549细胞的细胞存活率的图。
25.图14为确认通过本发明的双靶标小干扰核糖核酸组和抗癌剂的并用处理实现的癌细胞杀灭的图,其中,a为抗癌剂 bcl2小干扰核糖核酸 bi-1小干扰核糖核酸并用处理,b为本发明的双靶标小干扰核糖核酸组10(si-bb1) 抗癌剂并用处理。
26.图15为确认用作抗癌剂的bcl2抑制剂的abt-737和本发明的双靶标小干扰核糖核酸组10(si-bb1)的癌细胞杀灭效果和基于它们的并用处理的协同效果的图。
27.图16为对基于双靶标小干扰核糖核酸组10(si-bb1)和抗癌剂的并用处理的癌细胞杀灭效果和用对于bcl2基因的小干扰核糖核酸及对于bi-1基因的小干扰核糖核酸共同处理的组进行比较的图。
28.图17为确认癌细胞株中的基于双靶标小干扰核糖核酸组1的抗癌剂并用处理的癌细胞杀灭效果的图,其中,nc为对照组小干扰核糖核酸,no treat为未进行抗癌剂处理的对照组,si-at1为本发明的ar及mtor双靶标小干扰核糖核酸组16,a为du145细胞株,b为h460细胞株。
29.图18为以模式化的方式示出本发明的腺病毒的结构的图。
30.图19为示出本发明的腺病毒载体的载体图的图,其中,bs-短发夹核糖核酸为对本发明的双靶标短发夹核糖核酸进行编码的序列插入部位。
31.图20为在膀胱癌细胞株t24及253jbv中确认基于对人端粒酶逆转录酶(htert)启
动子及双靶标短发夹核糖核酸进行编码及表达的本发明的重组腺病毒ca102的mtor及stat3基因的表达抑制效果的图。
32.图21为在头颈部癌细胞株fadu及hsc-2中确认基于对人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸进行编码及表达的本发明的重组腺病毒ca102的mtor及stat3基因的表达抑制效果的图。
33.图22为在皮肤鳞状细胞癌细胞株a431及hsc-5中确认基于对人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸进行编码及表达的本发明的重组腺病毒ca102的mtor及stat3基因的表达抑制效果的图。
34.图23为从蛋白质层面确认膀胱癌细胞株t24及253j-bv中的基于本发明的重组腺病毒ca102的mtor及stat3基因的表达抑制效果的图。
35.图24为确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca101的bcl2及bi-1基因的表达抑制效果的图。
36.图25为在前列腺癌细胞株lncap中确认包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca103的ar及mtor基因的表达抑制效果的图。
37.图26为在前列腺癌细胞株c42b及22rv1中通过体外(in vitro)确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca103的ar及mtor基因的表达抑制效果的图。
38.图27为通过体内(in vivo)确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca103的ar及mtor基因的表达抑制效果的图。
39.图28为确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca104的c-met及pd-l1基因的表达抑制效果的图。
40.图29为确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca101的癌细胞株的杀灭效果的图。
41.图30为确认基于本发明的重组腺病毒ca102的膀胱癌细胞株rt4、t24及253j-bv的杀灭效果的图。
42.图31为确认基于本发明的重组腺病毒ca102的头颈部癌细胞株fadu及hsc-2的杀灭效果的图。
43.图32为确认基于本发明的重组腺病毒ca102的皮肤鳞状细胞癌细胞株a431及hsc-5的杀灭效果的图。
44.图33为确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca103的癌细胞株lncap的杀灭效果的图。
45.图34为确认基于包含人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸表达盒的本发明的重组腺病毒ca103的癌细胞株c42b及22rv1细胞株的杀灭效果的图。
46.图35为确认对于生物体内膀胱癌细胞(253j-bv)的本发明的重组腺病毒ca102的抗癌效果的图。
47.图36为确认对于生物体内头颈部癌细胞(fadu)的本发明的重组腺病毒ca102的抗癌效果的图。
l4,上述c3可不包含e3或包含e3,上述c4可包含l5,上述c5可不包含e4或包含e4,可包含序列号78的碱基序列。
64.在一实例中,腺病毒的e3区域可部分缺失,缺失的碱基序列可包含序列号82的碱基序列。
65.在一实例中,表达盒可位于腺病毒的内源基因的c3部位。
66.在一实例中,人端粒酶逆转录酶(htert)启动子能够以可操作的方式与腺病毒的内源基因的e1a及e1b相连接。
67.在一实例中,可在腺病毒的内源基因的e1a与e1b之间还包含内部核糖体进入位点(ires)序列(序列号76)。
68.在一实例中,上述表达盒可对短发夹核糖核酸(shrna)进行编码及表达。
69.在一实例中,上述短发夹核糖核酸(shrna)可同时抑制第一核酸及第二核酸的表达。
70.在一实例中,本发明的抗肿瘤腺病毒可通过核糖核酸(rna)干扰来分解核酸的信使核糖核酸(mrna)或抑制翻译,从而可抑制表达。
71.在一实例中,本发明的表达盒可通过使特异正义链与第一核酸或第二核酸部分互补结合以及特异反义链与第二核酸或第一核酸部分互补结合的双链小干扰核糖核酸(sirna)进行表达来同时抑制第一核酸及第二核酸。
72.在本发明中使用的术语“表达抑制”是指引起靶标基因的表达或翻译下降,优选地,意味着以此达到无法测到靶标基因表达或达到毫无意义的层面。
73.在本发明中使用的术语“小干扰核糖核酸(sirna)(sirna,small interfering rna)”是指通过特定信使核糖核酸(mrna)的裂解(cleavage)来引起核糖核酸干扰(rnai,rna interference)现象的短双链核糖核酸(rna)。通常,小干扰核糖核酸(sirna)由所具有的序列与靶基因的信使核糖核酸(mrna)相同的正义核糖核酸(rna)链和所具有的序列与之互补的反义核糖核酸(rna)链构成,但本发明的双链小干扰核糖核酸(sirna)为正义核糖核酸(rna)链对于第一核酸或第二核酸特异的小干扰核糖核酸(sirna)(对于第一核酸或第二核酸的反义链),且是反义核糖核酸(rna)链对于第二核酸或第一核酸特异的小干扰核糖核酸(sirna)(对于第二核酸或第一核酸的反义链),因而双链的小干扰核糖核酸(sirna)可分别同时抑制第一核酸或第二核酸或抑制其表达。
74.本发明中的术语“短发夹核糖核酸(shrna)(shrna,short hairpin rna)”是指如下的核糖核酸,即,通过在单链核糖核酸(rna)中部分包括回纹状的碱基序列来在3
′
区域形成双链结构并形成发夹似的结构,可在细胞内完成表达后由作为存在于细胞内的核糖核酸酶(rnase)的一种的dicer裂解来变换成小干扰核糖核酸(sirna),上述双链结构的长度不受特殊限制,优选为10核苷酸以上,更优选为20核苷酸以上。在本发明中,上述短发夹核糖核酸(shrna)可包含在表达盒,上述短发夹核糖核酸(shrna)可如下生成,即,在由对于各个基因的小干扰核糖核酸(sirna)反义链及正义链构成的组序列中,在将u变换成t之后,在正义链的3'连接ttggatccaa(ttggatccaa环)或ttcaagagag(ttcaagagag环)、反义链及tt来制备对短发夹核糖核酸(shrna)进行编码的表达盒,使其在细胞内表达。
75.在一实例中,第一核酸可包含与第二核酸的反向互补序列具有60%以上的互补性的碱基序列,第二核酸可包含与第一核酸的反向互补序列具有60%以上的互补性的碱基序
列。
76.在一实例中,第一核酸可包含与第二核酸的反向互补序列具有70%、80%、85%、90%、95%、96%、97%、98%或99%以上的互补性的碱基序列,第二核酸可包含与对于第一核酸的反向互补序列具有70%、80%、85%、90%、95%、96%、97%、98%或99%以上的互补性的碱基序列。
77.将包含在表达盒的第一核酸作为靶序列的碱基序列或将第二核酸作为靶序列的碱基序列的变异体包含在本发明的范围内。本发明的表达盒的概念如下,即,包括构成其的核酸分子的作用性等同物,例如,包括虽然核酸分子的部分碱基序列通过删除(deletion)、取代(substitution)或插入(insertion)变形但功能上能起到与碱基序列分子相同作用的变异体(variants)。对于核酸分子的“序列同源性%”可通过对两个最佳排列的序列和比较区域进行比较来确认,与对于两个序列的最佳排列的参考序列(不包括添加或删除)相比,比较区域中的核酸分子序列的一部分可包括添加或删除。
78.在一实例中,核酸可以是与癌相关的基因。
79.在一实例中,与癌相关的基因可以是在癌中表达增加的癌基因,癌基因可以是细胞凋亡(apoptosis)相关基因、转录因子(transcription factor)基因、转移(metastasis)相关基因、血管生成(angiogenesis)相关基因、癌细胞特异基因或酪氨酸激酶(tyrosine-kinase)基因。
80.在一实例中,上述细胞凋亡相关基因可以是abl1、akt1、akt2、bard1、bax、bcl11b、bcl2、bcl2a1、bcl2l1、bcl2l12、bcl3、bcl6、birc2、birc3、birc5、braf、card11、cav1、cbl、cdc25a、cdkn1a、cflar、cnr2、ctnnb1、cul4a、daxx、ddit3、e2f1、e2f3、e2f5、espl1、foxo1、hdac1、hspa5、igf1r、igf2、jun、junb、jund、malt1、map3k7、mcl1、mdm2、mdm4、myb、myc、nfkb2、npm1、ntrk1、pak1、pax3、pml、prkca、prkce、ptk2b、raf1、rhoa、tgfb1、tnfrsf1b、tp73、traf6、ywhag、ywhaq或ywhaz,上述转录因子基因可以是ar、arid3a、ascl1、atf1、atf3、bcl11a、bcl11b、bcl3、bcl6、cdc5l、cdx2、creb1、cux1、ddit3、dlx5、e2f1、e2f3、e2f5、elf4、elk1、elk3、en2、erg、ets1、ets2、etv1、etv3、etv4、etv6、fev、fezf1、fli1、fos、fosl1、foxa1、foxg1、foxm1、foxo1、foxp1、foxq1、gata1、gata6、gfi1、gfi1b、gli1、gli2、gli3、hes6、hhex、hlf、hmga1、hmga2、hoxa1、hoxa9、hoxd13、hoxd9、id1、id2、ikzf1、irf2、irf4、jun、junb、jund、kat6a、kdm2a、kdm5b、klf2、klf4、klf5、klf6、klf8、kmt2a、lef1、lhx1、lmx1b、maf、mafa、mafb、mbd1、mecom、mef2c、meis1、mitf、myb、myc、mycl、mycn、nanog、ncoa3、nfib、nfkb2、nkx2-1、otx2、patz1、pax2、pax3、pax4、pax8、pbx1、pbx2、pitx2、plag1、plagl2、pparg、ppp1r13l、prdm10、prdm13、prdm14、prdm15、prdm16、prdm6、prdm8、prdm9、rara、rel、rere、runx1、runx3、sall4、satb1、sfpq、six1、snai1、sox2、sox4、spi1、srebf1、stat3、taf1、tal1、tal2、tbx2、tbx3、tcf3、tfcp2、tfe3、thra、tlx1、tp63、tp73、twist1、wt1、ybx1、yy1、zbtb16、zbtb7a、zic2、znf217或znf268,上述转移相关基因可以是akt1、akt2、ar、cbl、cdh1、crk、csf1、ctnnb1、cttn、cxcr4、egfr、fgfr1、flt3、fyn、gli1、ilk、itga3、jak2、met、pdgfrb、plxnb1、prkci、ptch1、ptpn11、rac1、rhoa、rhoc、rock1、smo、snai1、src、tcf3或wt1,上述血管生成相关基因可以是braf、cav1、ctgf、egfr、erbb2、ets1、fgf4、fgf6、fgfr1、fgfr3、fgfr4、id1、nras、pdgfb、pdgfra、pdgfrb或sparc,上述酪氨酸激酶基因可以是abl1、abl2、alk、axl、blk、egfr、epha2、erbb2、erbb3、erbb4、fes、fgfr1、
fgfr2、fgfr3、fgfr4、fgr、flt3、fyn、itk、jak1、jak2、kit、lck、mertk、met、mst1r、ntrk1、ntrk3、pdgfra、pdgfrb、ptk2b、ptk7、ret、ros1、src、syk、tec或yes1。
81.在一实例中,上述癌基因可以是septin9、acod1、actn4、adam28、adam9、adgrf1、adrbk2、aff1、aff3、agap2、agfg1、agrn、ahcyl1、ahi1、aimp2、akap13、akap9、akirin2、aktip、aldh1a1、all1、anib1、anp32c、anp32d、aqp1、araf、arhgef1、arhgef2、arhgef5、aspscr1、aurka、baalc、baiap2l1、banp、bcar4、bckdhb、bcl9、bcl9l、bcr、bmi1、bmp7、boc、brd4、brf2、cabin1、camk1d、capg、cbfb、cblb、cbll1、cbx7、cbx8、ccdc28a、ccdc6、ccnb1、ccnb2、ccnd1、ccne1、ccnl1、cd24、cdc25c、cdc6、cdh17、cdk1、cdk14、cdk4、cdk5r2、cdk6、cdk8、cdkn1b、cdkn3、cdon、ceacam6、cenpw、chd1l、chic1、chl1、cks1b、cmc4、cntn2、cops3、cops5、crkl、crlf2、crot、crtc1、cryab、csf1r、csf3、csf3r、csnk2a1、csnk2a2、ct45a1、ctbp2、ctnnd2、ctsz、cul7、cxcl1、cxcl2、cxcl3、cygb、cyp24a1、dcd、dcun1d1ddb2、ddhd2、ddx6、dek、dis3、dnph1、dppa2、dppa4、dsg3、dusp12、dusp26、echs1、ect2、eef1a1、eef1a2、eef1d、eif3e、eif3i、eif4e、eif5a2、elavl1、ell、eml4、emsy、entpd5、epcam、eps8、eras、ergic1、ervw-1、evi2a、evi5、ewsr1、ezh2、fam189b、fam72a、fam83d、fasn、fdps、fgf10、fgf3、fgf5、fgf8、fr1op、fhl2、fip1l1、fndc3b、frat1、fubp1、fus、fzd2、gab2、gaec1、galnt10、galr2、glo1、gmnn、gna12、gna13、gnai2、gnaq、gnas、golph3、gopc、gpat4、gpm6a、gpm6b、gpr132、grem1、grm1、gsk3a、gsm1、h19、has1、hax1、hdgfrp2、hmgn5、hnrnpa1、hotair、hottip、hoxa-as2、hras、hspa1a、hspa4、hspb1、hulc、idh1、ifng、igf2bp1、ikbke、il7r、inppl1、ints1、ints2、ints3、ints4、ints5、ints7、ints8、irs2、ist1、jup、kdm4c、kiaa0101、kiaa1524、kif14、kras、ksr2、lamtor5、laptm4b、lcn2、ldhb、letmd1、lin28a、lin28b、lmo1、lmo2、lmo3、lmo4、lsm1、luadt1、macc1、macrod1、magea11、malat1、maml2、map3k8、mapre1、mas1、mcc、mcf2、mcf2l、mcts1、mefv、mfhas1、mfng、mien1、mina、mkl2、mlana、mllt1、mllt11、mllt3、mllt4、mmp12、mms22l、mn1、mnat1、mos、mpl、mpst、mras、mre11a、msi1、mtcp1、mtdh、mtor、muc1、muc4、mum1、myd88、naaa、nanogp8、nbpf12、ncoa4、neat1、nectin4、nedd4、nedd9、net1、ninl、nme1、notch1、notch4、nov、nsd1、nuak2、nup214、nup98、nutm1、olr1、pa2g4、padi2、pak7、park7、parm1、pbk、pcat1、pcat5、pdgfa、pdzk1ip1、pelp1、pfn1p3、pigu、pik3ca、pik3r1、pim1、pim2、pim3、pir、piwil1、plac8、plk1、ppm1d、ppp1r10、ppp1r14a、ppp2r1a、prame、prdm12、prmt5、psip1、psmd10、ptch2、ptma、ptp4a1、ptp4a2、ptp4a3、pttg1、pttg1ip、pttg2、pvt1、rab11a、rab18、rab22a、rab23、rab8a、ralgds、rap1a、rassf1、rbm14、rbm15、rbm3、rbmy1a1、rfc3、rgl4、rgr、rho、ring1、rint1、rit1、rnf43、rpl23、rras、rras2、rsf1、runx1t1、s100a4、s100a7、s100a8、sag、sart3、sbsn、sea、sec62、sertad1、sertad2、sertad3、set、setbp1、setdb1、sgk1、sirt1、sirt6、ski、skil、skp2、slc12a5、slc3a2、smr3b、smurf1、sncg、snora59a、snora80e、spag9、spata4、spry2、sqstm1、srsf1、srsf2、srsf3、srsf6、ss18、ssx1、ssx2、ssx2b、stil、stmn1、stra6、styk1、suz12、swap70、syt1、tac1、tacstd2、taf15、taldo1、taz、tbc1d1、tbc1d15、tbc1d3、tbc1d3c、tbc1d7、tcl1a、tcl1b、tcl6、tcp1、tfg、tgm3、tincr、tktl1、tle1、tmem140、tmpop2、tmprss2、tns4、tpd52、tpr、tre17、treh、trib1、trib2、trim28、trim32、trim8、trio、trip6、tspan1、tspy1、txn、tyms、tyrp1、ube2c、ube3c、uca1、uchl1、uhrf1、uri1、usp22、usp4、usp6、vav1、vav2、vav3、vim、wapl、whsc1、whsc1l1、wisp1、wnt1、wnt10a、
wnt10b、wnt2、wnt3、wnt5a、wwtr1、xcl1、xiap、yap1、yeats4、yy1ap1、zeb1-as1、zfand4、zfas1、zmym2、znf703或znhit6。
82.在一实例中,癌细胞特异基因可以是在肿瘤细胞表面表达的pd-l1(programmed death-ligand 1)。
83.在一实例中,本发明的表达盒的转录体作为靶标的第一核酸及第二核酸可以是分别选自由abl1、akt1、akt2、bard1、bax、bcl11b、bcl2、bcl2a1、bcl2l1、bcl2l12、bcl3、bcl6、birc2、birc3、birc5、braf、card11、cav1、cbl、cdc25a、cdkn1a、cflar、c-met、cnr2、ctnnb1、cul4a、daxx、ddit3、e2f1、e2f3、e2f5、espl1、foxo1、hdac1、hspa5、igf1r、igf2、jun、junb、jund、malt1、map3k7、mcl1、mdm2、mdm4、myb、myc、nfkb2、npm1、ntrk1、pak1、pax3、pml、prkca、prkce、ptk2b、raf1、rhoa、tgfb1、tnfrsf1b、tp73、traf6、ywhag、ywhaq、ywhaz、ar、arid3a、ascl1、atf1、atf3、bcl11a、bcl11b、bcl3、bcl6、cdc5l、cdx2、creb1、cux1、ddit3、dlx5、e2f1、e2f3、e2f5、elf4、elk1、elk3、en2、erg、ets1、ets2、etv1、etv3、etv4、etv6、fev、fezf1、fli1、fos、fosl1、foxa1、foxg1、foxm1、foxo1、foxp1、foxq1、gata1、gata6、gfi1、gfi1b、gli1、gli2、gli3、hes6、hhex、hlf、hmga1、hmga2、hoxa1、hoxa9、hoxd13、hoxd9、id1、id2、ikzf1、irf2、irf4、jun、junb、jund、kat6a、kdm2a、kdm5b、klf2、klf4、klf5、klf6、klf8、kmt2a、lef1、lhx1、lmx1b、maf、mafa、mafb、mbd1、mecom、mef2c、meis1、mitf、myb、myc、mycl、mycn、nanog、ncoa3、nfib、nfkb2、nkx2-1、otx2、patz1、pax2、pax3、pax4、pax8、pbx1、pbx2、pd-l1、pitx2、plag1、plagl2、pparg、ppp1r13l、prdm10、prdm13、prdm14、prdm15、prdm16、prdm6、prdm8、prdm9、rara、rel、rere、runx1、runx3、sall4、satb1、sfpq、six1、snai1、sox2、sox4、spi1、srebf1、stat3、taf1、tal1、tal2、tbx2、tbx3、tcf3、tfcp2、tfe3、thra、tlx1、tp63、tp73、twist1、wt1、ybx1、yy1、zbtb16、zbtb7a、zic2、znf217、znf268、akt1、akt2、ar、cbl、cdh1、crk、csf1、ctnnb1、cttn、cxcr4、egfr、fgfr1、flt3、fyn、gli1、ilk、itga3、jak2、met、pdgfrb、plxnb1、prkci、ptch1、ptpn11、rac1、rhoa、rhoc、rock1、smo、snai1、src、tcf3、wt1、braf、cav1、ctgf、egfr、erbb2、ets1、fgf4、fgf6、fgfr1、fgfr3、fgfr4、id1、nras、pdgfb、pdgfra、pdgfrb、sparc、abl1、abl2、alk、axl、blk、egfr、epha2、erbb2、erbb3、erbb4、fes、fgfr1、fgfr2、fgfr3、fgfr4、fgr、flt3、fyn、itk、jak1、jak2、kit、lck、mertk、met、mst1r、ntrk1、ntrk3、pdgfra、pdgfrb、ptk2b、ptk7、ret、ros1、src、syk、tec、yes1、septin9、acod1、actn4、adam28、adam9、adgrf1、adrbk2、aff1、aff3、agap2、agfg1、agrn、ahcyl1、ahi1、aimp2、akap13、akap9、akirin2、aktip、aldh1a1、all1、anib1、anp32c、anp32d、aqp1、araf、arhgef1、arhgef2、arhgef5、aspscr1、aurka、baalc、baiap2l1、banp、bcar4、bckdhb、bcl9、bcl9l、bcr、bmi1、bmp7、boc、brd4、brf2、cabin1、camk1d、capg、cbfb、cblb、cbll1、cbx7、cbx8、ccdc28a、ccdc6、ccnb1、ccnb2、ccnd1、ccne1、ccnl1、cd24、cdc25c、cdc6、cdh17、cdk1、cdk14、cdk4、cdk5r2、cdk6、cdk8、cdkn1b、cdkn3、cdon、ceacam6、cenpw、chd1l、chic1、chl1、cks1b、cmc4、cntn2、cops3、cops5、crkl、crlf2、crot、crtc1、cryab、csf1r、csf3、csf3r、csnk2a1、csnk2a2、ct45a1、ctbp2、ctnnd2、ctsz、cul7、cxcl1、cxcl2、cxcl3、cygb、cyp24a1、dcd、dcun1d1ddb2、ddhd2、ddx6、dek、dis3、dnph1、dppa2、dppa4、dsg3、dusp12、dusp26、echs1、ect2、eef1a1、eef1a2、eef1d、eif3e、eif3i、eif4e、eif5a2、elavl1、ell、eml4、emsy、entpd5、epcam、eps8、eras、ergic1、ervw-1、evi2a、evi5、ewsr1、ezh2、fam189b、fam72a、fam83d、fasn、fdps、fgf10、fgf3、fgf5、fgf8、fr1op、fhl2、fip1l1、fndc3b、frat1、
fubp1、fus、fzd2、gab2、gaec1、galnt10、galr2、glo1、gmnn、gna12、gna13、gnai2、gnaq、gnas、golph3、gopc、gpat4、gpm6a、gpm6b、gpr132、grem1、grm1、gsk3a、gsm1、h19、has1、hax1、hdgfrp2、hmgn5、hnrnpa1、hotair、hottip、hoxa-as2、hras、hspa1a、hspa4、hspb1、hulc、idh1、ifng、igf2bp1、ikbke、il7r、inppl1、ints1、ints2、ints3、ints4、ints5、ints7、ints8、irs2、ist1、jup、kdm4c、kiaa0101、kiaa1524、kif14、kras、ksr2、lamtor5、laptm4b、lcn2、ldhb、letmd1、lin28a、lin28b、lmo1、lmo2、lmo3、lmo4、lsm1、luadt1、macc1、macrod1、magea11、malat1、maml2、map3k8、mapre1、mas1、mcc、mcf2、mcf2l、mcts1、mefv、mfhas1、mfng、mien1、mina、mkl2、mlana、mllt1、mllt11、mllt3、mllt4、mmp12、mms22l、mn1、mnat1、mos、mpl、mpst、mras、mre11a、msi1、mtcp1、mtdh、mtor、muc1、muc4、mum1、myd88、naaa、nanogp8、nbpf12、ncoa4、neat1、nectin4、nedd4、nedd9、net1、ninl、nme1、notch1、notch4、nov、nsd1、nuak2、nup214、nup98、nutm1、olr1、pa2g4、padi2、pak7、park7、parm1、pbk、pcat1、pcat5、pd-l1、pdgfa、pdzk1ip1、pelp1、pfn1p3、pigu、pik3ca、pik3r1、pim1、pim2、pim3、pir、piwil1、plac8、plk1、ppm1d、ppp1r10、ppp1r14a、ppp2r1a、prame、prdm12、prmt5、psip1、psmd10、ptch2、ptma、ptp4a1、ptp4a2、ptp4a3、pttg1、pttg1ip、pttg2、pvt1、rab11a、rab18、rab22a、rab23、rab8a、ralgds、rap1a、rassf1、rbm14、rbm15、rbm3、rbmy1a1、rfc3、rgl4、rgr、rho、ring1、rint1、rit1、rnf43、rpl23、rras、rras2、rsf1、runx1t1、s100a4、s100a7、s100a8、sag、sart3、sbsn、sea、sec62、sertad1、sertad2、sertad3、set、setbp1、setdb1、sgk1、sirt1、sirt6、ski、skil、skp2、slc12a5、slc3a2、smr3b、smurf1、sncg、snora59a、snora80e、spag9、spata4、spry2、sqstm1、srsf1、srsf2、srsf3、srsf6、ss18、ssx1、ssx2、ssx2b、stil、stmn1、stra6、styk1、suz12、swap70、syt1、tac1、tacstd2、taf15、taldo1、taz、tbc1d1、tbc1d15、tbc1d3、tbc1d3c、tbc1d7、tcl1a、tcl1b、tcl6、tcp1、tfg、tgm3、tincr、tktl1、tle1、tmem140、tmpop2、tmprss2、tns4、tpd52、tpr、tre17、treh、trib1、trib2、trim28、trim32、trim8、trio、trip6、tspan1、tspy1、txn、tyms、tyrp1、ube2c、ube3c、uca1、uchl1、uhrf1、uri1、usp22、usp4、usp6、vav1、vav2、vav3、vim、wapl、whsc1、whsc1l1、wisp1、wnt1、wnt10a、wnt10b、wnt2、wnt3、wnt5a、wwtr1、xcl1、xiap、yap1、yeats4、yy1ap1、zeb1-as1、zfand4、zfas1、zmym2、znf703及znhit6组成的组中的不同的核酸。
84.在一实例中,第一核酸可以是stat3(signal transducer and activator of transcription3),第二核酸可以是mtor(mammalian target of rapamycin),在此情况下,表达盒可包含在序列号1及序列号2、序列号3及序列号4、序列号5及序列号6、序列号7及序列号8、序列号9及序列号10、序列号11及序列号12、序列号13及序列号14、序列号15及序列号16或序列号17及序列号18的碱基序列中使u变换成t的核酸。在上述内容中,序列号1及序列号2的小干扰核糖核酸(sirna)可使21mer中的17mer互补结合,序列号3及序列号4的小干扰核糖核酸(sirna)可使20mer中的16mer互补结合,序列号5及序列号6的小干扰核糖核酸(sirna)可使19mer中的15mer互补结合,序列号7及序列号8的小干扰核糖核酸(sirna)可使18mer中的14mer互补结合,序列号9及序列号10的小干扰核糖核酸(sirna)可使17mer中的16mer互补结合,序列号11及序列号12的小干扰核糖核酸(sirna)可使20mer中的17mer互补结合,序列号13及序列号14的小干扰核糖核酸(sirna)可使19mer中的16mer互补结合,序列号15及序列号16的小干扰核糖核酸(sirna)可使18mer中的15mer互补结合,序列号17及序列号18的小干扰核糖核酸(sirna)可使17mer中的14mer互补结合。并且,在第一核酸为
stat3及第二核酸为mtor的情况下,表达盒所包含的短发夹核糖核酸(shrna)表达脱氧核糖核酸(dna)(对stat3及mtor双重靶短发夹核糖核酸(shrna)进行编码的脱氧核糖核酸(dna)序列)可包含序列号66或序列号67的碱基序列。
85.在一实例中,第一核酸可以是bcl2(b-cell lymphoma 2),第二核酸可以是bi-1(bax inhibitor 1),在此情况下,表达盒可包含序列号19及序列号20、序列号21及序列号22、序列号23及序列号24、序列号25及序列号26、序列号27及序列号28或序列号29及序列号30的碱基序列。在上述内容中,由序列号19及序列号20构成的21mer的小干扰核糖核酸(sirna)组10使15mer互相互补,由序列号21及序列号22构成的20mer的小干扰核糖核酸(sirna)组11使14mer互相互补,由序列号23及序列号24构成的20mer的小干扰核糖核酸(sirna)组12使14mer互相互补,由序列号25及序列号26构成的19mer的小干扰核糖核酸(sirna)组13使13mer互相互补,由序列号27及序列号28构成的19mer的小干扰核糖核酸(sirna)组14使13mer互相互补,由序列号29及序列号30构成的18mer的小干扰核糖核酸(sirna)组15使12mer互相互补。以下表2中的序列号19、序列号21、序列号23、序列号25、序列号27或序列号29的小干扰核糖核酸(sirna)(antisense bcl-2)可与bcl-2的信使核糖核酸(mrna)互补结合,序列号20、序列号22、序列号24、序列号26、序列号28或序列号30的小干扰核糖核酸(sirna)(antisense bi-1)可与bi-1的信使核糖核酸(mrna)互补结合。并且,在第一核酸为bcl2及第二核酸为bi-1的情况下,包含在表达盒的短发夹核糖核酸(shrna)表达脱氧核糖核酸(dna)可包含序列号68或序列号69的碱基序列。
86.在一实例中,第一核酸可以是ar(androgen receptor),第二核酸可以是mtor(mammalian target of rapamycin),在此情况下,表达盒可包含序列号31及序列号32、序列号33及序列号34、序列号35及序列号36、序列号37及序列号38、序列号39及序列号40、序列号41及序列号42、序列号43及序列号44、序列号45及序列号46、序列号47及序列号48、序列号49及序列号50、序列号51及序列号52、序列号53及序列号54或序列号55及序列号56的碱基序列。在上述内容中,由序列号31及序列号32构成的20mer的小干扰核糖核酸(sirna)组16使18mer互相互补,由序列号33及序列号34构成的19mer的小干扰核糖核酸(sirna)组17使17mer互相互补,由序列号35及序列号36构成的18mer的小干扰核糖核酸(sirna)组18使16mer互相互补,由序列号37及序列号38构成的17mer的小干扰核糖核酸(sirna)组19使15mer互相互补,由序列号39及序列号40构成的19mer的小干扰核糖核酸(sirna)组20使15mer互相互补,由序列号41及序列号42构成的18mer的小干扰核糖核酸(sirna)组21使14mer互相互补,由序列号43及序列号44构成的17mer的小干扰核糖核酸(sirna)组22使13mer互相互补,由序列号45及序列号46构成的23mer的小干扰核糖核酸(sirna)组23使19mer互相互补,由序列号47及序列号48构成的22mer的小干扰核糖核酸(sirna)组24使18mer互相互补,由序列号49及序列号50构成的22mer的小干扰核糖核酸(sirna)组25使18mer互相互补,由序列号51及序列号52构成的21mer的小干扰核糖核酸(sirna)组26使17mer互相互补,由序列号53及序列号54构成的20mer的小干扰核糖核酸(sirna)组27使16mer互相互补,由序列号55及序列号56构成的21mer的小干扰核糖核酸(sirna)组28使17mer互相互补。序列号31、序列号33、序列号35、序列号37、序列号39、序列号41、序列号43、序列号45、序列号47、序列号49、序列号51、序列号53或序列号55的小干扰核糖核酸(sirna)(antisense ar)可与ar的信使核糖核酸(mrna)互补结合,序列号32、序列号34、序列号36、
序列号38、序列号40、序列号42、序列号44、序列号46、序列号48、序列号50、序列号52、序列号54或序列号56的小干扰核糖核酸(sirna)(antisense mtor)可与mtor的信使核糖核酸(mrna)互补结合。并且,在第一核酸为ar及第二核酸为mtor的情况下,包含在表达盒的短发夹核糖核酸(shrna)表达脱氧核糖核酸(dna)可包含序列号70或序列号71的碱基序列。
87.在一实例中,第一核酸可以是mgmt(o-6-methylguanine-dna methyltransferase),第二核酸可以是mtor,在此情况下,表达盒可包含序列号57及序列号58的碱基序列。
88.在一实例中,第一核酸可以是bcl2,第二核酸可以是mcl1(mcl1 apoptosis regulator),在此情况下,表达盒可包含序列号59及序列号60的碱基序列。
89.在一实例中,第一核酸可以是stat3,第二核酸可以是tfeb(transcription factor eb),在此情况下,表达盒可包含序列号61及序列号62的碱基序列。
90.在一实例中,第一核酸可以是c-met(homo sapiens met prot o-oncogene),第二核酸可以是pd-l1(programmed death-ligand 1),在此情况下,表达盒可包含在序列号63及序列号64的碱基序列中使u变换成t的核酸。在上述内容中,序列号63及序列号64的小干扰核糖核酸(sirna)可使19mer中的15me互补结合。并且,在第一核酸为c-met及第二核酸为pd-l1的情况下,包含于表达盒的短发夹核糖核酸(shrna)表达脱氧核糖核酸(dna)可包含序列号72或序列号73的碱基序列。
91.在一实例中,表达盒可包含可对将第一核酸作为靶序列的碱基序列、可形成发夹结构的环状序列、将第二核酸作为靶序列的碱基序列依次进行编码的碱基序列。
92.在一实例中,表达盒可被u6启动子调节表达。
93.在一实例中,腺病毒可以是组c的血清型为5型的腺病毒。
94.在一实例中,本发明的抗肿瘤腺病毒的溶瘤能力比野生型腺病毒高,溶瘤能力可比向野生型腺病毒导入人端粒酶逆转录酶(htert)启动子的腺病毒高。
95.在一实施方式中,本发明涉及包含本发明的抗肿瘤腺病毒的治癌组合物。
96.在一实例中,本发明的组合物还可包含抗癌剂,例如,阿西维辛(acivicin)、阿柔比星(aclarubicin)、阿考达唑(acodazole)、四环素(achromycin)、阿多来新(adozelesin)、阿拉诺新(alanosin)、阿地白介素(aldesleukin)、别嘌醇钠(allopurinol sodium)、六甲蜜胺(altretamine)、氨鲁米特(aminoglutethimide)、氨萘非特(amonafide)、安普利近(ampligen)、安吖啶(amsacrine)、雄激素(androgens)、蛇形菌素(anguidine)、阿非迪霉素甘氨酸酯(aphidicolin glycinate)、亮氨酸溶肉瘤素(asaley)、天冬酰胺酶(asparaginase)、5-氮杂胞苷(5-azacytidine)、咪唑硫嘌呤(azathioprine)、卡介苗杆菌(bacillus calmette-guerin,bcg)、贝氏抗叶酸药(baker's antifol)、6-巯基-2'-脱氧鸟苷(-2
′‑
deoxythioguanosine)、比生群(bisantrene hcl)、硫酸博来霉素(bleomycin sulfate)、白消安(busulfan)、丁硫氨酸-亚砜亚胺(buthionine sulfoximine)、bwa 773u82、bw 502u83/hcl、bw 7u85甲磺酸酯(mesylate)、ceracemide、卡贝替姆(carbetimer)、卡铂(carboplatin)、亚硝基脲氮芥(carmustine)、苯丁酸氮芥(chlorambucil)、氯喹喔啉磺酰胺(chloroquinoxaline-sulfonamide)、氯脲霉素(chlorozotocin)、色霉素a3(chromomycin a3)、顺铂(cisplatin)、克拉屈滨(cladribine)、皮质类固醇(corticosteroid)、短小棒状杆茵(corynebacterium parvum)、
cpt-11、克立那托(crisnatol)、环胞苷(cyclocytidine)、环磷酰胺(cyclophosphamide)、阿糖胞苷(cytarabine)、色他巴(cytembena)、马来酸dabis(dabis maleate)、达卡巴嗪(dacarbazine)、放线菌素d(dactinomycin)、柔红霉素hcl(danuorubicin hcl)、2-氮尿苷(diazauridine)、右雷佐生(dexrazoxane)、脱水半乳糖醇(dianhydrogalactitol)、地吖醌(diaziquone)、二溴卫矛醇(dibromodulcitol)、膜海鞘素(didemnin b)、乙硫氮(diethyldithiocarbamate)、肌苷二醛(diglycoaldehyde)、二氢-5-氮杂胞苷(dihydro-5-azacytidine)、阿霉素(doxorubicin)、棘霉素(echinomycin)、dedatrexate、依地福新(edelfosine)、依氟鸟氨酸(eflornithine)、elliott's solution、依沙芦星(elsamitrucin)、表柔比星(epirubicin)、依索比星(esorubicin)、磷酸雌二醇氮芥(estramustine phosphate)、雌激素(estrogens)、依他硝唑(etanidazol)、依硫磷酸(ethiofos)、依托泊苷(etoposide)、法曲唑(fadrazole)、法扎拉滨(fazarabine)、芬维a胺(fenretinide)、非格司亭(filgrastim)、非那雄胺(finasteride)、黄酮乙酸(flavone acetic acid)、氟尿苷(floxuridine)、磷酸氟达拉滨(fludarabine phosphate)、5'-氟尿嘧啶(5-fluorouracil)、fluosol
tm
、氟他胺(flutamide)、硝酸镓(gallium nitrate)、吉西他滨(gemcitabine)、醋酸戈舍瑞林(goserelin acetate)、hepsulfam、六亚甲基二乙酰胺(hexamethylene bisacetamide)、三尖杉酯碱(homoharringtonine)、硫酸肼(hydrazine sulfate)、4-羟雄固烯二酮(4-hydroxyandrostenedione)、羟基脲(hydrozyurea)、盐酸伊达比星(idarubicin hcl)、异环磷酰胺(ifosfamide)、4-甘薯黑疱霉醇(4-ipomeanol)、异丙铂(iproplatin)、异维a酸(isotretinoin)、甲酰四氢叶酸钙(leucovorin calcium)、醋酸亮丙瑞林(leuprolide acetate)、左旋咪唑(levamisole)、柔红霉素脂质体(liposome daunorubicin)、liposome-encapsulated doxorubicin、洛莫司汀(lomustine)、氯尼达明(lonidamine)、美登素(maytansine)、盐酸氮芥(mechlorethamine hydrochloride)、美法仑(melphalan)、美诺立尔(menogaril)、美巴龙(merbarone)、6-巯基嘌呤(6-mercaptopurine)、美司钠(mesna)、卡介苗的甲醇提取物(methanol extraction of bacillus calmette-guerin)、甲氨蝶呤(methotrexate)、n-甲基甲酰胺(n-methylformamide)、米非司酮(mifepristone)、米托胍腙(mitoguazone)、丝裂霉素c(mitomycin-c)、米托坦(mitotane)、盐酸米托蒽醌(mitoxantrone hydrochloride)、单核细胞/巨噬细胞集落刺激因子(monocyte/macrophage colony-stimulating factor)、大麻隆(nabilone)、萘福昔定(nafoxidine)、新制癌菌素(neocarzinostatin)、醋酸奥曲肽(octreotide acetate)、奥马铂(ormaplatin)、奥沙利铂(oxaliplatin)、紫杉醇(paclitaxel)、天冬氨酸(pala)、喷司他丁(pentostatin)、二酮哌嗪(piperazinedione)、哌泊溴烷(pipobroman)、吡柔比星(pirarubicin)、吡曲克辛(piritrexim)、罗蒽醌(piroxantrone hydrochloride)、pixy-321、普卡霉素(plicamycin)、卟吩姆钠(porfimer sodium)、泼尼莫司汀(prednimustine)、甲苄肼(procarbazine)、孕激素(progestins)、吡唑霉素(pirazofurin)、丙亚胺(razoxane)、沙格司亭(sargramostim)、司莫司丁(semustine)、锗螺胺(spirogermanium)、螺莫司汀(spiromustine)、链黑霉素(streptonigrin)、链脲佐菌素(streptozocin)、磺氯苯脲(sulofenur)、苏拉明钠(suramin sodium)、他莫昔芬(tamoxifen)、紫杉特尔(taxotere)、替加氟(tegafur)、替尼泊苷(teniposide)、1,4-二偕胺肟苯(terephthalamidine)、特洛西酮(teroxirone)、硫鸟嘌呤
(thioguanine)、塞替派(thiotepa)、胸苷注射液(thymidine injection)、噻唑呋林(tiazofurine)、托泊替康(topotecan)、托瑞米芬(toremifene)、维a酸(tretinoin)、盐酸三氟拉嗪(trifluoperazine hydrochloride)、三氟尿苷(trifluredine)、曲美沙特(trimetrexate)、肿瘤坏死因子(tnf,tumor necrosis factor)、尿嘧啶氮芥(uracil mustard)、硫酸长春碱(vinblastine sulfate)、硫酸长春新碱(vincristine sulfate)、长春地辛(vindesine)、长春瑞滨(vinorelbine)、长春利定(vinzolidine)、yoshi 864、佐柔比星(zorubicin)、阿糖胞苷(cytosine arabinoside)、依托泊甙(etoposide)、美法仑(melphalan)、紫杉醇(taxol)及它们的混合物。优选为顺铂(cisplatin)、紫杉醇(paclitaxel)、5-氟尿嘧啶(5-fu,5-fluorouracil)、甲氨蝶呤(methotrexate)、阿霉素(doxorubicin)、柔红霉素(daunorubicin)、阿糖胞苷(cytosine arabinoside)、依托泊甙(etoposide)、美法仑(melphalan)、苯丁酸氮芥(chlorambucil)、环磷酰胺(cyclophosphamide)、长春地辛(vindesine)、丝裂霉素(mitomycin)、博来霉素(bleomycin)、他莫昔芬(tamoxifen)及紫杉醇(taxol),更优选为顺铂(cisplatin)、紫杉醇(paclitaxel)或5-氟尿嘧啶(5-fu,5-fluorouracil),只要能够实现通过与本发明的组合物并用处理来对抗癌效果起到协同效果这一目标,则不限定于此。
97.上述癌可以是选自由大肠癌、乳腺癌、子宫癌、子宫颈癌、卵巢癌、前列腺癌、脑瘤、头颈部肿瘤、黑色素瘤、骨髓瘤、白血病、淋巴瘤、胃癌、肺癌、胰腺癌、非小细胞肺癌、肝癌、食道癌、小肠癌、肛周癌、输卵管肿瘤、子宫内膜肿瘤、阴道肿瘤、外阴肿瘤、霍奇金病、膀胱癌、肾癌、输尿管癌、肾细胞肿瘤、肾骨盆肿瘤、骨癌、皮肤癌、头癌、颈部癌、皮肤黑色素瘤、眼球内黑色素瘤、内分泌腺癌、甲状腺癌、副甲状腺癌、副肾癌、软组织肉瘤、尿道癌、阴茎癌、中枢神经系统(central nervous system;cns)肿瘤、1次cns淋巴瘤、脊髓瘤、多态性胶质母细胞瘤及垂体腺瘤组成的组中的一种。
98.在本发明中,术语“启动子”是指包含对于核糖核酸(rna)聚合酶的结合部位具备转为启动子下游(downstream)基因的信使核糖核酸(mrna)的转录引发活性的加密区域的上游(upstream)的非解读核酸序列。在本发明的表达盒中,上述启动子可使用可引发短发夹核糖核酸(shrna)的表达的任意启动子。具体地,本发明的启动子可使用在所有时间段都能始终引起目标基因的表达的启动子(constitutive promoter)或在特定位置、时间引起目标基因的表达的启动子(inducible promoter),例如有u6启动子、h1启动子、cmv(cytomegalovirus)启动子、sv40启动子、cag启动子(hitoshi niwa et al.,gene,108:193-199,1991)、camv35s启动子(odell et al.,nature 313:810-812,1985)、rsyn7启动子(美国专利申请第08/991,601号)、水稻肌动蛋白(rice actin)启动子(mcelroy et al.,plant cell 2:163-171,1990)、泛素启动子(christensen et al.,plant mol.biol.12:619-632,1989)、als启动子(美国专利申请第08/409,297)等。除此之外,可使用在美国专利第5,608,149、第5,608,144号、第5,604,121号、第5,569,597号、第5,466,785号、第5,399,680号、第5,268,463号及第5,608,142号等公开的启动子等本领域技术人员周知的所有公知启动子,但并不限定于此。优选地,本发明的启动子可以是u6启动子、hi启动子、cmv启动子,根据本发明的优选一实例,可使用u6启动子。
99.本发明的组合物还可包含辅助剂(adjuvant)。在上述辅助剂方面,只要是本技术领域中周知的辅助剂,就能够以不受限制的方式使用,例如,可通过还包含弗氏佐剂
(freund)的完整辅助剂或不完整辅助剂来增加其效果。
100.本发明的组合物可制备成向药学上可接受的载体混入有效成分的形态。其中,药学上可接受的载体包括制药领域中常规使用的载体、赋形剂以及稀释剂。可用于本发明的组合物的药学上允许的载体并不限定于此,但可举例有乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁以及矿物油等。
101.本发明的组合物可分别通过常规的方法来以散剂、颗粒剂、片剂、胶囊剂、悬浮液、乳液、糖浆剂、喷剂等口服剂型、外用剂型、栓剂或灭菌注射溶液形态剂型化来使用。
102.在进行配置的情况下,可通过使用通常使用的填充剂、增量剂、结合剂、湿润剂、崩解剂、表面活性剂等稀释剂或赋形剂来制备。用于口服给药的固体制剂包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,这样的固体制剂在上述有效成分混合一种以上的赋形剂,例如淀粉、碳酸钙、蔗糖、乳糖、明胶等来制备。并且,除单纯的赋形剂外,还可使用硬脂酸镁、滑石粉之类的润滑剂。用于口服的液体制剂有悬浮剂、内溶液剂、乳剂、糖浆剂等,除广为使用的稀释剂的水、液体石蜡以外,还可以包含多种赋形剂,例如湿润剂、甜味剂、芳香剂、保存剂等。用于胃肠外给药的制剂包括灭菌的水溶液、非水性溶剂、悬浮剂、油剂、冷冻干燥制剂、栓剂等。非水性溶剂、悬浮剂可以使用丙二醇、聚乙二醇、橄榄油之类的植物油、油酸乙酯之类的可注射的酯类等。栓剂的基剂可以使用合成脂肪酸酯(witepsol)、聚乙二醇、吐温(tween)61、可可脂、月桂酯、甘油明胶等。
103.本发明的组合物可通过多种途径向个体给药。给药的所有方式可预计,例如,可通过口服、静脉、肌肉、皮下、腹腔内注射等来给药。
104.本发明的药学组合物的给药量可通过考虑个体的年龄、体重、性别、身体状态等来选择。上述药学组合物中所包含的单一域抗体的浓度可根据对象进行多种选择,这是不言而喻的,优选地,以0.01~5000μg/ml的浓度包含在药学组合物。在其浓度小于0.01μg/ml的情况下,有可能不会有药学活性,在其浓度大于5000μg/ml的情况下,有可能在人体内产生毒性。
105.本发明的组合物可用于癌及其综合征的预防或治疗,还可用作抗癌辅助剂。
106.并且,本发明提供将向个体给予药剂学有效量的本发明的组合物的步骤包括在内的癌的预防及治疗方法。
107.将以治疗有效量或药学有效量给予本发明的组合物。术语“药学有效量”意味着足以按可用于医学治疗的合理受益/危险比例治疗疾病的量,有效用量方面根据将个体的种类及病情、年龄、性别、药物活性、对于药物的敏感度、给药时间、给药途径以及排出比例、治疗时间、同时使用的药物包括在内的要素及其他医学领域公知的要素来确定。
108.在一实施方式中,本发明涉及本发明的抗肿瘤腺病毒的肿瘤预防或治疗用途。
109.在一实施方式中,本发明涉及利用本发明的抗肿瘤腺病毒的肿瘤治疗方法。
具体实施方式
110.以下,将通过如下的实施例更详细地说明本发明。但是,以下实施例仅用于具体记述本发明的内容,本发明并不限定于以下实施例。
111.实施例1.制备双靶标小干扰核糖核酸(sirna)
112.1-1.mtor及stat3双靶标小干扰核糖核酸(sirna)
113.按下列表1中的序列制备了可同时抑制stat3(signal transducer and activator of transcription 3)及mtor(mammalian target of rapamycin)的双靶标小干扰核糖核酸(sirna)(double strand)(bioneer,daejeon,korea)。具体地,组1的序列号1及序列号2的小干扰核糖核酸(sirna)使21mer中的17mer互补结合,组2的序列号3及序列号4的小干扰核糖核酸(sirna)使20mer中的16mer互补结合,组3的序列号5及序列号6的小干扰核糖核酸(sirna)使19mer中的15mer互补结合,组4的序列号7及序列号8的小干扰核糖核酸(sirna)使18mer中的14mer互补结合,组5的序列号9及序列号10的小干扰核糖核酸(sirna)使17mer中的16mer互补结合。并且,组6的序列号11及序列号12的小干扰核糖核酸(sirna)使20mer中的17mer互补结合,组7的序列号13及序列号14的小干扰核糖核酸(sirna)使19mer中的16mer互补结合,组8的序列号15及序列号16的小干扰核糖核酸(sirna)使18mer中的15mer互补结合,组9的序列号17及序列号18的小干扰核糖核酸(sirna)使17mer中的14mer互补结合。在以下的表1的各个组的两个序列以双股(double strand)形态进入到细胞内之后,各个组的反义mtor(antisense_mtor)的小干扰核糖核酸(sirna)mtor信使核糖核酸(mrna)(gi|206725550|ref|nm_004958.3|homo sapiens mechanistic target of rapamycin(serine/threonine kinase)(mtor),mrna)的靶标部位互补结合,各组的反义stat3(antisense_stat3)的小干扰核糖核酸(sirna)与stat3信使核糖核酸(mrna)(gi|47080104|ref|nm_139276.2|homo sapiens signal transducer and activator of transcription3(acute-phase response factor)(stat3)、transcript variant 1,mrna)的靶标部位互补结合,因而将减少mtor及stat3的基因表达。
114.表1
[0115][0116]
1-2.bcl2及bi-1双靶标小干扰核糖核酸
[0117]
按下列表2中的序列制备了可同时抑制bcl2(b-cell lymphoma 2)及bi-1(bax inhibitor 1)的21mer的双靶标小干扰核糖核酸(sirna)(double strand)(bioneer,daejeon,korea)。具体地,由以下的表2中的序列号19及序列号20构成的21mer的小干扰核糖核酸(sirna)组10使15mer互相互补,由序列号21及序列号22构成的20mer的小干扰核糖核酸(sirna)组11使14mer互相互补,由序列号23及序列号24构成的20mer的小干扰核糖核酸(sirna)组12使14mer互相互补,由序列号25及序列号26构成的19mer的小干扰核糖核酸
(sirna)组13使13mer互相互补,由序列号27及序列号28构成的19mer的小干扰核糖核酸(sirna)组14使13mer互相互补,由序列号29及序列号30构成的18mer的小干扰核糖核酸(sirna)组15使12mer互相互补。以下表2中的序列号19、序列号21、序列号23、序列号25、序列号27或序列号29的小干扰核糖核酸(sirna)(antisense bcl-2)可与bcl-2的信使核糖核酸(mrna)互补结合,序列号20、序列号22、序列号24、序列号26、序列号28或序列号30的小干扰核糖核酸(sirna)(antisense bi-1)与bi-1的信使核糖核酸(mrna)互补结合,因而本发明的小干扰核糖核酸(sirna)组10至小干扰核糖核酸(sirna)组15同时减少bcl-2及bi-1基因的表达。
[0118]
表2
[0119][0120][0121]
1-3.ar及mtor双靶标小干扰核糖核酸(sirna)
[0122]
按下列表3中的序列制备了可同时抑制ar(androgen receptor)及mtor(mammalian target of rapamycin)的双靶标小干扰核糖核酸(sirna)(double strand)组(bioneer,daejeon,korea)。具体地,由序列号31及序列号32构成的20mer的小干扰核糖核酸(sirna)组16使18mer互相互补,由序列号33及序列号34构成的19mer的小干扰核糖核酸(sirna)组17使17mer互相互补,由序列号35及序列号36构成的18mer的小干扰核糖核酸(sirna)组18使16mer互相互补,由序列号37及序列号38构成的17mer的小干扰核糖核酸(sirna)组19使15mer互相互补,由序列号39及序列号40构成的19mer的小干扰核糖核酸(sirna)组20使15mer互相互补,由序列号41及序列号42构成的18mer的小干扰核糖核酸(sirna)组21使14mer互相互补,由序列号43及序列号44构成的17mer的小干扰核糖核酸(sirna)组22使13mer互相互补,由序列号45及序列号46构成的23mer的小干扰核糖核酸(sirna)组23使19mer互相互补,由序列号47及序列号48构成的22mer的小干扰核糖核酸
(sirna)组24使18mer互相互补,由序列号49及序列号50构成的22mer的小干扰核糖核酸(sirna)组25使18mer互相互补,由序列号51及序列号52构成的21mer的小干扰核糖核酸(sirna)组26使17mer互相互补,由序列号53及序列号54构成的20mer的小干扰核糖核酸(sirna)组27使16mer互相互补,由序列号55及序列号56构成的21mer的小干扰核糖核酸(sirna)组28使17mer互相互补。以下表3中的序列号31、序列号33、序列号35、序列号37、序列号39、序列号41、序列号43、序列号45、序列号47、序列号49、序列号51、序列号53或序列号55的小干扰核糖核酸(sirna)(antisense ar)与ar的信使核糖核酸(mrna)互补结合,序列号32、序列号34、序列号36、序列号38、序列号40、序列号42、序列号44、序列号46、序列号48、序列号50、序列号52、序列号54或序列号56的小干扰核糖核酸(sirna)(antisense mtor)与mtor的信使核糖核酸(mrna)互补结合。因而本发明的小干扰核糖核酸(sirna)组16至小干扰核糖核酸(sirna)28同时减少ar及mtor基因的表达。
[0123]
表3
[0124][0125]
1-4.mgmt及mtor双靶标小干扰核糖核酸
[0126]
按下列表4中的序列制备了可同时减少(抑制)mgmt(o-6-methylguanine-dna methyltransferase,nm_002412.5)及mtor(nm_004958.3)基因的表达的双靶标小干扰核糖核酸(sirna)(double strand)组(bioneer,daejeon,korea)。
[0127]
表4
[0128][0129]
1-5.bcl2及mcl1双靶标小干扰核糖核酸(sirna)
[0130]
按下列表5中的序列制备了可同时减少(抑制)bcl2(nm_000633.2)及mcl1(mcl1apoptosis regulator,nm_021960.5)基因的表达的双靶标小干扰核糖核酸(sirna)(double strand)组(bioneer,daejeon,korea)。
[0131]
表5
[0132][0133]
1-6.stat3及tfeb双靶标小干扰核糖核酸(sirna)
[0134]
按下列表6中的序列制备了可同时减少(抑制)stat3(nm_139276.2)及tfeb(transcription factor eb,nm_007162.2)基因的表达的双靶标小干扰核糖核酸(sirna)(double strand)组(bioneer,daejeon,korea)。
[0135]
表6
[0136][0137]
1-7.c-met及pd-l1双靶标小干扰核糖核酸(sirna)
[0138]
按下列表7中的序列制备了可同时抑制c-met(homo sapiens met proto-oncogene)及pd-l1(programmed death-ligand 1)的双靶标小干扰核糖核酸(sirna)(double strand)组(bioneer,daejeon,korea)。具体地,由序列号63及序列号64构成的19mer的小干扰核糖核酸(sirna)组32使15mer互相互补,以下表7的序列号63的小干扰核糖核酸(sirna)(antisense c-met)与c-met的信使核糖核酸(mrna)互补结合,序列号64的小干扰核糖核酸(sirna)(antisense pd-l1)与pd-l1的信使核糖核酸(mrna)互补结合。因而本发明的小干扰核糖核酸(sirna)组同时减少c-met及pd-l1基因的表达。
[0139]
表7
[0140][0141][0142]
实施例2.制备双靶标短发夹核糖核酸(shrna)
[0143]
2-1.mtor及stat3靶标短发夹核糖核酸(shrna)
[0144]
为了可在细胞内表达在上述实施例中制备的小干扰核糖核酸(sirna),制备了表达短发夹核糖核酸(shrna)的表达盒。具体地,代表性地制备了包含多个小干扰核糖核酸(sirna)中的组1的双靶标小干扰核糖核酸(sirna)(序列号1及序列号2)小干扰核糖核酸(sirna)双链的序列和环状序列的多个短发夹核糖核酸(shrna)(ttggatccaa环状短发夹核糖核酸(shrna)及ttcaagagag环状短发夹核糖核酸(shrna))(表8)。将所制备的各个短发夹核糖核酸(shrna)表达盒分别配置成在pe3.1载体(图1)的限制酶pstⅰ及ecor
ⅴ
切割位置中位于u6启动子(序列号65)之后,由此制备了在细胞内表达包含将mtor及stat3作为靶标的双靶标小干扰核糖核酸(sirna)的两种短发夹核糖核酸(shrna)的重组表达载体。
[0145]
表8
[0146][0147]
2-2.bcl2及bi-1靶标短发夹核糖核酸(shrna)
[0148]
为了可在细胞内表达在上述实施例中制备的小干扰核糖核酸(sirna),制备了表达短发夹核糖核酸(shrna)的表达盒。具体地,代表性地制备了包含多个小干扰核糖核酸(sirna)中的组10的双靶标小干扰核糖核酸(sirna)(序列号19及序列号20)小干扰核糖核酸(sirna)双链的序列和环状序列的多个短发夹核糖核酸(shrna)(ttggatccaa环状短发夹核糖核酸(shrna)及ttcaagagag环状短发夹核糖核酸(shrna))(表9)。将所制备的表达各个短发夹核糖核酸(shrna)的多个表达盒分别配置成在pe3.1载体(图1)的限制酶pstⅰ及ecor
ⅴ
切割位置中位于u6启动子(序列号65)之后,由此制备了在细胞内表达包含将bcl2及bi-1作为靶标的双靶标小干扰核糖核酸(sirna)的两种短发夹核糖核酸(shrna)的重组表达载体。
[0149]
表9
[0150][0151]
2-3.ar及mtor靶标短发夹核糖核酸(shrna)
[0152]
为了可在细胞内表达在上述实施例中制备的小干扰核糖核酸(sirna),制备了表达短发夹核糖核酸(shrna)的表达盒。具体地,代表性地制备了多个小干扰核糖核酸
(sirna)中的组16的双靶标小干扰核糖核酸(sirna)(序列号31及序列号32)小干扰核糖核酸(sirna)双链的序列和环状序列的多个短发夹核糖核酸(shrna)(ttggatccaa环状短发夹核糖核酸(shrna)及ttcaagagag环状短发夹核糖核酸(shrna))(表10)。将所制备的表达各个短发夹核糖核酸(shrna)的多个表达盒分别配置成在pe3.1载体(图1)的限制酶pstⅰ及ecor
ⅴ
切割位置中位于u6启动子(序列号65)之后,由此制备了在细胞内表达包含将ar及mtor作为靶标的双靶标小干扰核糖核酸(sirna)的两种短发夹核糖核酸(shrna)的重组表达载体。
[0153]
表10
[0154][0155]
2-4.c-met及pd-l1靶标短发夹核糖核酸(shrna)
[0156]
为了可在细胞内表达在上述实施例中制备的小干扰核糖核酸(sirna),制备了包含双靶标小干扰核糖核酸(sirna)小干扰核糖核酸(sirna)双链的序列和环状序列的多个短发夹核糖核酸(shrna)表达盒(ttggatccaa环状短发夹核糖核酸(shrna)及ttcaagagag环状短发夹核糖核酸(shrna))。具体地,从5'向3'方向来在上述表7中的小干扰核糖核酸(sirna)组(序列号63及序列号64)的正义链的3'连接ttggatccaa(ttggatccaa环)或ttcaagagag(ttcaagagag环)、反义链及tt,来制备了对短发夹核糖核酸(shrna)进行编码的脱氧核糖核酸(dna)序列并在表11中示出(小干扰核糖核酸(sirna)由大写字母表示,追加序列由小写字母表示)。将所制备的多个短发夹核糖核酸(shrna)表达盒分别配置成在pe3.1载体(图1)的限制酶pstⅰ及ecor
ⅴ
切割位置中位于u6启动子(序列号65)之后,由此制备了在细胞内表达包含将c-met及pd-l1作为靶标的双靶标小干扰核糖核酸(sirna)的两种短发夹核糖核酸(shrna)的重组表达载体。
[0157]
表11
[0158][0159]
实施例3.确认双靶标小干扰核糖核酸(sirna)的基因表达抑制效果
[0160]
3-1.抑制mtor及stat3表达
[0161]
在向12-孔板分别注入hela细胞后,在添加有10%胎牛血清(fbs,hyclone公司)的无血清细胞冻存培养基(rpmi,hyclone公司)中以37℃的温度、5%的co2的条件进行了培养,直到细胞密度达到50%。之后,用转染试剂(lipofectamine3000,invitrogen,carlsbad,ca,usa)向上述细胞分别转染在上述实施例1中制备的组1至组9的双靶标小干扰核糖核酸(sirna),以使mtor及stat3同时敲落。在转染48小时之后,通过破碎细胞来用genejet rna purification kit(英杰,invitrogen)提取了总核糖核酸(rna)。将所提取的总核糖核酸(rna)用作模板来用revoscripttm rt premix(intron biotechnology)执行了逆转录反应。利用包含25ng至200ng的逆转录的互补脱氧核糖核酸(cdna)的试料20μl和ampone taq dna polymerase(geneall)及taqman gene expression assays(applied biosystems)并利用abi prism 7700sequence detection system及qs3 real-time pcr(biosystems)来对mtor(hs00234522_m1)、stat3(hs01047580_m1)及gapdh(hs02758991_g1)执行反应。实时聚合酶链反应(real-time pcr)条件按在50℃的温度下执行2分钟及在95℃的温度下执行10分钟的阶段以及在95℃的温度下执行15秒钟及在60℃的温度下执行60秒钟的阶段等两个循环共执行了40个循环。所有反应反复执行3次并取了平均值。由此获得的多个结果用于对作为管家基因的gapdh的信使核糖核酸(mrna)值的正规化。
[0162]
结果显示,因组1至组9中的双靶标小干扰核糖核酸(sirna),与对照组相比,确认到mtor及stat3的剩余表达为约20%至40%,可知双靶标小干扰核糖核酸(sirna)可同时抑制两种基因的表达(图2)。
[0163]
3-2.bcl2及bi-1表达抑制
[0164]
在向12孔板分别注入hela细胞后,在添加有10%胎牛血清(fbs,hyclone公司)的无血清细胞冻存培养基(rpmi,hyclone公司)中以37℃的温度、5%的co2的条件进行了培养,直到细胞密度达到50%。之后,用3μl的转染试剂(lipofectamine3000,invitrogen,carlsbad,ca,usa)来按每孔80pmole向培养上述hela细胞的孔转染在上述实施例1(表2)中制备的双靶标小干扰核糖核酸(sirna)组10以及(si-bb1)及双靶标小干扰核糖核酸(sirna)组11至组15,以使bcl2及bi-1同时敲落。在转染48小时之后,通过破碎细胞来用genejet rnapurification kit(英杰,invitrogen)提取了总核糖核酸(rna)。在将所提取的总核糖核酸(rna)用作模板来通过实时聚合酶链反应(rt-pcr)逆转录成互补脱氧核糖核酸(cdna)之后,通过定量聚合酶链反应(q-pcr)来确认了基于双靶标小干扰核糖核酸(sirna)的bcl2及bi-1的信使核糖核酸(mrna)表达量。作为参考,所使用的探针为bcl2
(thermo,hs00608023_m1)、bi-1(thermo,dm01835892_g1)、gapdh(thermo,hs02786624_g1),使用了qs3装备来执行。所有反应反复执行3次并取了平均值。由此获得的多个结果用于对作为管家基因的gapdh的信使核糖核酸(mrna)值的正规化。
[0165]
结果显示,通过双靶标小干扰核糖核酸(sirna)组均减少了bcl2及bi-1的表达,可知本发明的双靶标小干扰核糖核酸(sirna)可同时抑制两种基因的表达(图3及图4)。
[0166]
因此,本发明的双靶标小干扰核糖核酸(sirna)可同时抑制两种基因的表达,因而确认到通过促进癌细胞的杀灭来呈现出显著的抗癌活性,呈现出可有效用作多种肿瘤的抗癌组合物或抗癌辅助剂。
[0167]
3-3.ar及mtor表达抑制
[0168]
在向12孔板分别注入pc3细胞株、h460细胞株及a549细胞株后,在添加有10%胎牛血清(fbs,hyclone公司)的无血清细胞冻存培养基(rpmi,hyclone公司)中以37℃的温度、5%的co2的条件进行了培养,直到细胞密度达到50%。之后,用3μl的转染试剂(lipofectamine)3000(invitrogen,carlsbad,ca,usa)来按每孔80pmole向培养上述细胞的孔转染在上述实施例1中制备的双靶标小干扰核糖核酸(sirna)组16至组28(表3),以使ar及mtor同时敲落。其中,组16转染到h460细胞,组17转染到pc3细胞,从而执行了敲落,作为其阳性对照组,分别转染了表12中所记载的对于ar的小干扰核糖核酸(sirna)和对于mtor的小干扰核糖核酸(sirna)。在转染48小时之后,通过破碎细胞来用genejet rna purification kit(英杰,invitrogen)提取了总核糖核酸(rna)。在将所提取的总核糖核酸(rna)用作模板来通过实时聚合酶链反应(rt-pcr)逆转录成互补脱氧核糖核酸(cdna)之后,通过定量聚合酶链反应(q-pcr)来确认了分别基于小干扰核糖核酸(sirna)和本发明的双靶标小干扰核糖核酸(sirna)组16至组28(si-at1至siat13)的ar及mtor的信使核糖核酸(mrna)的表达量。为了确认信使核糖核酸(mrna)表达量,利用了对于ar或mtor的引物组和反应混合物[10x reaction buffer 2μl、hq buffer 2μl、dntp 1.6μl、primer(f、r、10pmole/ul)各1μl、template(500ng)2μl、taq 0.2μl、dw 10.2μl、total vol.20μl]。将在聚合酶链反应(pcr)条件下[将在95℃的温度下执行2分钟,将在95℃的温度下执行20秒钟的阶段执行30循环,在60℃的温度下执行10秒钟,在72℃的温度下执行30秒钟~60秒钟,在72℃的温度下执行5分钟]敲落的细胞破碎物中的ar及mtor的信使核糖核酸(mrna)变换成互补脱氧核糖核酸(cdna)。并且,将逆转录的互补脱氧核糖核酸(cdna)用作模板,来准备了反应混合物[template(rt-pcr product)6μl、taqman probe 3μl、10x reaction buffer 6μl、hq buffer 6μl、dntp 4.8μl、taq 0.6μl、dw 10.2μl、total vol.60μl]并执行了定量聚合酶链反应(q-pcr)[在95℃的温度下执行10分钟,在95℃的温度下执行15秒钟及在60℃的温度下每分钟执行40个循环]。作为参考,所使用的探针为ar(thermo,hs00171172_m1)、mtor(thermo,hs00234508_m1)、gapdh(thermo,hs02786624_g1),使用了qs3装备来执行。所有反应反复执行3次并取了平均值。由此获得的多个结果用于对作为管家基因的gapdh的信使核糖核酸(mrna)值的正规化。
[0169]
表12
[0170][0171]
结果显示,在pc3细胞及h460细胞株中,ar及mtor的表达均基于本发明的双靶标小干扰核糖核酸(sirna)组16及组17减少(图5),减少程度与基于各个小干扰核糖核酸(sirna)的效果相似或更优秀。并且,基于本发明的双靶标小干扰核糖核酸(sirna)组17及组28来使得ar及mtor的表达均减少(图6)。由此,可知本发明的双靶标小干扰核糖核酸(sirna)可同时有效抑制两种基因的表达。
[0172]
3-4.抑制c-met及pd-l1表达
[0173]
在向12孔板分别注入胶质母细胞瘤细胞株u-87、前列腺癌细胞株cwr22rv-1(22rv-1)、黑色素瘤细胞株a431及非小细胞肺癌细胞株hcc827后,在添加有10%胎牛血清(fbs,hyclone公司)的无血清细胞冻存培养基(rpmi,hyclone公司)中以37℃的温度、5%co2的条件进行了培养,直到细胞密度达到50%。之后,用3μl的转染试剂(lipofectamine)3000(invitrogen,carlsbad,ca,usa)来按每孔80pmole向培养上述细胞的孔转染在上述实施例中制备的双靶标小干扰核糖核酸(sirna)组(表7),以使c-met及pd-l1同时敲落。在转染48小时之后,通过破碎细胞来用genejet rna purification kit(英杰,invitrogen)提取了总核糖核酸(rna)。在将所提取的总核糖核酸(rna)用作模板来通过实时聚合酶链反应(rt-pcr)逆转录成互补脱氧核糖核酸(cdna)之后,通过定量聚合酶链反应(q-pcr)来确认了分别基于小干扰核糖核酸(sirna)和本发明的双靶标小干扰核糖核酸(sirna)组的c-met及pd-l1的信使核糖核酸(mrna)表达量。为了确认信使核糖核酸(mrna)表达量,利用了对于pd-l1或c-met的引物组和反应混合物[10
×
reaction buffer 2μl、hq buffer 2μl、dntp 1.6μl、primer(f、r、10pmole/ul)各1μl、template(500ng)2μl、taq 0.2μl、dw 10.2μl、total vol.20μl]。将在聚合酶链反应(pcr)条件下[将在95℃的温度下执行2分钟,将在95℃的温度下执行20秒钟的阶段执行30循环,在60℃的温度下执行10秒钟,在72℃的温度下执行30秒钟~60秒钟,在72℃的温度下执行5分钟]敲落的细胞破碎物中的c-met及pd-l1的信使核糖核酸(mrna)变换成互补脱氧核糖核酸(cdna)。并且,将逆转录的互补脱氧核糖核酸(cdna)用作模板,来准备了反应混合物[template(rt-pcr product)6μl、taqman probe3μl、10
×
reaction buffer 6μl、hq buffer 6μl、dntp 4.8μl、taq 0.6μl、dw 10.2μl、total vol.60μl]并使用qs3装备来执行了定量聚合酶链反应(q-pcr)[在95℃的温度下执行10分钟,在95℃的温度下执行15秒钟,在60℃的温度下每分钟执行40个循环]。所有反应反复执行3次并取了平均值。由此获得的多个结果用于对作为管家基因的gapdh的信使核糖核酸(mrna)值的正规化。
[0174]
结果显示,在u-87细胞株、22rv-1细胞株、a431细胞株及hcc827细胞株中,c-met及pd-l1的表达均基于本发明的双靶标小干扰核糖核酸(sirna)组减少(图7a至7d)。由此,可知本发明的双靶标小干扰核糖核酸(sirna)可同时有效抑制两种基因的表达。
[0175]
实施例4.确认双靶标小干扰核糖核酸(sirna)及短发夹核糖核酸(shrna)的基因表达抑制效果
[0176]
4-1.双靶标短发夹核糖核酸(shrna)的基因表达抑制效果
[0177]
按0、1及2μg来利用转染试剂(lipofectamine3000)分别向a549细胞及胶质母细胞瘤细胞u-87(u87mg)转染了包含对在上述实施例2中制备的mtor及stat3靶标短发夹核糖核酸(shrna)进行编码的序列号66的ttggatccaa环状短发夹核糖核酸(shrna)序列或序列号67的ttcaagagag环状短发夹核糖核酸(shrna)序列(表8)的载体。在转染48小时之后,利用记载于上述实施例的实时聚合酶链反应(real time pcr)分析方法确认了mtor和stat3的基因表达减少程度。
[0178]
结果显示,mtor及stat3的表达在包含本发明的双靶标小干扰核糖核酸(sirna)的两种短发夹核糖核酸(shrna)中均减少,以与短发夹核糖核酸(shrna)的脱氧核糖核酸(dna)的量成比例的方式呈现出减少20%的倾向(图8)。
[0179]
4-2.单靶标小干扰核糖核酸(sirna)及双靶标短发夹核糖核酸(shrna)的基因表达抑制效果比较
[0180]
对利用2个启动子串联连接两种单靶标小干扰核糖核酸(sirna)的和本发明的双靶标短发夹核糖核酸(shrna)的基因表达抑制效果进行了比较。具体地,在以mtor-stat3或stat3-mtor的顺序串联连接对于mtor的小干扰核糖核酸(sirna)及对于stat3的小干扰核糖核酸(sirna)之后,比较了对mtor及stat3的基因表达抑制效果和本发明的mtor/stat3双靶标短发夹核糖核酸(shrna)。
[0181]
结果显示,在293t细胞株中,与利用启动子串联连接两个对于基因的小干扰核糖核酸(sirna)的情况(direct shmtor-stat3或direct shstat3-mtor)相比,利用本发明的双靶标短发夹核糖核酸(shrna)的情况呈现出了更显著的基因表达抑制效果(图9)。
[0182]
实施例5.确认基于双靶标小干扰核糖核酸(sirna)的癌细胞杀灭效果
[0183]
为了确认基于本发明的组1至组9的双靶标小干扰核糖核酸(sirna)的癌细胞杀灭效果,在按5
×
103cell/孔向96-孔板分别注入人肺癌细胞株a549细胞之后,用lipofectamine3000向细胞分别转染了组1至组9的双靶标小干扰核糖核酸(sirna)。在转染48小时后,追加性地在24小时后向细胞处理5mg/ml的mtt(promega,ltd.)并培养了4小时。之后,去除了培养基并进行了150μl的增容溶液(solubilization solution)及终止液(stop solution)处理,在37℃的温度下培养了4小时。在570nm下测定了反应溶液的吸光度,利用以下数学式计算了细胞存活率。
[0184]
数学式1
[0185]
细胞存活率=实验组吸光度(570nm)/对照组吸光度(570nm)
×
100(%)
[0186]
结果显示,当利用本发明的组1至组9中的双靶标小干扰核糖核酸(sirna)同时抑制mtor及stat3时,与对照组相比,细胞存活率比对照组明显减少。因此,确认到本发明的组1至组9的双靶标小干扰核糖核酸(sirna)有效地杀灭了癌细胞(图10)。
[0187]
实施例6.确认基于双靶标小干扰核糖核酸(sirna)和抗癌剂的并用处理的癌细胞杀灭效果
[0188]
6-1.mtor及stat3双靶标小干扰核糖核酸(sirna)和抗癌剂的并用处理
[0189]
6-1-1.和顺铂(cisplatin)的并用处理
[0190]
在按5
×
103cell/孔向96-孔板分别注入人肺癌细胞株a549细胞之后,用lipofectamine3000向细胞分别转染了本发明的组1至组9的双靶标小干扰核糖核酸
(sirna)(mtor及stat3同时敲落)。在转染48小时后,处理了5μm的顺铂并培养了10小时。之后,如上述实施例,执行了mtt反应,在570nm下测定了吸光度,来计算了细胞存活率。
[0191]
结果显示,当和顺铂并用处理并用本发明的组1至组9的双靶标小干扰核糖核酸(sirna)同时抑制mtor及stat3时,细胞存活率减少了约50%~70%,与对照组相比,确认到显著的差异。因此,在和抗癌剂的并用处理中,当同时抑制两种基因时,确认到明显提高了细胞杀灭效果(图11)。
[0192]
6-1-2.和紫杉醇(paclitaxel)的并用处理
[0193]
在按5
×
103cell/孔向96-孔板分别注入人肺癌细胞株a549细胞之后,用lipofectamine3000向细胞分别转染了本发明的组1至组9的双靶标小干扰核糖核酸(sirna)(mtor及stat3同时敲落)。在转染48小时后,处理了5μm的紫杉醇并培养了10小时。之后,如上述实施例4,执行了mtt反应,在570nm下测定了吸光度,来计算了细胞存活率。
[0194]
结果显示,当和紫杉醇并用处理并用本发明的组1至组9的双靶标小干扰核糖核酸(sirna)同时抑制mtor及stat3时,细胞存活率减少了约30~50%,与对照组相比,确认到显著的差异。因此,在和抗癌剂的并用处理中,当同时抑制两种基因时,确认到明显提高了细胞杀灭效果(图12)。
[0195]
6-1-3.和5-氟尿嘧啶(5-fu、5-fluorouracil)的并用处理
[0196]
在按5
×
103cell/孔向96-孔板分别注入人肺癌细胞株a549细胞之后,用lipofectamine3000向细胞分别转染了本发明的组1至组9的双靶标小干扰核糖核酸(sirna)(mtor及stat3同时敲落)。在转染48小时后,处理了5μm的紫杉醇并培养了10小时。之后,如上述实施例4,执行了mtt反应,在570nm下测定了吸光度,来计算了细胞存活率。
[0197]
结果显示,当和5-氟尿嘧啶并用处理并用本发明的组1至组9的双靶标小干扰核糖核酸(sirna)同时抑制mtor及stat3时,细胞存活率减少了约30%为止,与对照组相比,确认到显著的差异。因此,在和抗癌剂的并用处理中,当同时抑制两种基因时,确认到明显提高了细胞杀灭效果(图13)。
[0198]
6-2.bcl2及bi-1双靶标小干扰核糖核酸(sirna)的和抗癌剂的并用处理
[0199]
6-2-1.bcl2及bi-1双靶标小干扰核糖核酸(sirna)的协同抗癌效果
[0200]
在向作为人子宫颈癌细胞株的hela细胞分别转染本发明的双靶标小干扰核糖核酸(sirna)组1(si-bb1)或作为对照组的个别bcl2小干扰核糖核酸(sirna)及bi-1小干扰核糖核酸(sirna)之后,按种类分别处理6个小时的抗癌剂,之后通过mtt分析确认了癌细胞株的杀灭程度。具体地,用7.5μl的转染试剂来按每孔200pmole向分别注入于6孔板的hela细胞转染小干扰核糖核酸(sirna)并培养了48小时,重新向96-孔板重新分别注入细胞株并以使细胞密度(2.5
×
104)达到50%的方式进行培养,对于对照组,在抗癌剂的浓度方面用0.5μm的红豆杉醇、20μm的顺铂及10μm的依托泊苷分别进行处理,向处理本发明的双靶标小干扰核糖核酸(sirna)组的细胞则用一半浓度的0.25μm的红豆杉醇、10μm的顺铂及5μm的依托泊苷分别进行处理,在6小时之后,与上述实施例相同,通过执行mtt分析来确认了癌细胞的杀灭程度。
[0201]
结果显示,对于一同转染对bcl2或bi-1各自的小干扰核糖核酸(sirna)的对照组而言,几乎不产生癌细胞的杀灭,仅在和抗癌剂并用处理时部分产生基于抗癌剂的癌细胞杀灭效果(图14的a部分)。相反,对于本发明的双靶标小干扰核糖核酸(sirna)组1(si-bb1)
而言,产生了明显的癌细胞的杀灭,与一同处理bcl2小干扰核糖核酸(sirna)及bi-1小干扰核糖核酸(sirna)的对照组相比,即使和浓度明显低的抗癌剂并用处理,也确认到癌细胞杀灭效果协同增加(图14的b部分)。由此,可推导出本发明的双靶标小干扰核糖核酸(sirna)本身呈现出抗癌活性,基于和抗癌剂并用处理的协同效果也对双靶标小干扰核糖核酸(sirna)呈现出特异性。
[0202]
6-2-2.比较与bcl2及bi-1双靶标小干扰核糖核酸(sirna)的bcl2抑制剂之间的效果
[0203]
对本发明的对于bcl2及bi-1的双靶标小干扰核糖核酸(sirna)(组1si-bb1)的癌细胞杀灭抑制效果和用作基于对bcl2的抑制的癌细胞治疗剂的abt-737药物进行了比较。具体地,如同上述实施例,在分别注入作为前列腺癌细胞的lncap细胞株之后,转染了本发明的对于bcl2及bi-1的小干扰核糖核酸(sirna)组1(si-bb1),处理了3μm的abt-737并培养了12小时,之后通过mtt分析确认了癌细胞株的杀灭程度。
[0204]
结果显示,通过abt-737或本发明的对于bcl2及bi-1的小干扰核糖核酸(sirna)组1(si-bb1)的处理,lncap细胞株的死亡增加,尤其,在abt-737和本发明的双靶标小干扰核糖核酸(sirna)并用处理的情况下,可知癌细胞的协同杀灭效果明显增加(图15)。
[0205]
6-2-3.比较bcl2及bi-1双靶标小干扰核糖核酸(sirna)和各个小干扰核糖核酸(sirna)的抗癌效果
[0206]
在6孔板分别培养作为人前列腺癌细胞株的pc3细胞株之后,分别转染本发明的双靶标小干扰核糖核酸(sirna)组10(si-bb1)和作为对照组的表13中的对于bcl2或bi-1的各个小干扰核糖核酸(sirna),在48小时后,以10~20um处理了顺铂。在处理顺铂12小时之后,向细胞处理5mg/ml的mtt(promega,ltd.)并培养了4小时。之后,去除了培养基并进行了150μl的增容溶液(solubilization solution)及终止液(stop solution)处理,在37℃的温度下培养了4小时。在570nm下测定了反应溶液的吸光度,利用上述数学式1计算了细胞存活率。
[0207]
表13
[0208][0209]
结果显示,与未处理顺铂且处理对照组小干扰核糖核酸(sirna)的对照组相比,将本发明的双靶标小干扰核糖核酸(sirna)组10和顺铂并用处理的组呈现出癌细胞杀灭明显增加,与对于bcl2及bi-1分别处理小干扰核糖核酸(sirna)的组相比,确认到其程度明显增加(图16)。
[0210]
6-3.ar及mtor双靶标小干扰核糖核酸(sirna)和抗癌剂的并用处理
[0211]
在6孔板分别培养du145细胞株及h460细胞株之后,分别转染本发明的双靶标小干扰核糖核酸(sirna)组16(si-at1),在48小时后,处理了50um的顺铂、20um的依托泊苷或1um的红豆杉醇并培养了16小时。之后,向细胞处理5mg/ml的mtt(promega,ltd.)并培养了4小时,之后去除了培养基并进行了150μl的增容溶液(solubilization solution)及终止液
(stop solution)处理,在37℃的温度下培养了4小时。在570nm下测定了反应溶液的吸光度,计算了细胞存活率。
[0212]
结果显示,对于作为前列腺癌细胞株的du145细胞株,本发明的双靶标小干扰核糖核酸(sirna)独自也引起细胞杀灭(无抗癌剂处理组(no treat)),在未呈现出细胞杀灭效果的顺铂处理组中,本发明的双靶标小干扰核糖核酸(sirna)也引起细胞杀灭。并且,可确认到,对于略微呈现出抗癌活性的依托泊苷和紫杉醇,通过并用处理本发明的双靶标小干扰核糖核酸(sirna)组16(si-at1)来明显提高du145细胞杀灭(图17的a部分)。并且,对于作为肺癌细胞株的h460,也与du145细胞株类似地,本发明的双靶标小干扰核糖核酸(sirna)本身呈现出细胞杀灭效果,当依托泊苷和紫杉醇并用处理时,可知呈现出明显的抗癌活性(图17的b部分)。
[0213]
实施例7.制备双靶标短发夹核糖核酸(shrna)编码腺病毒
[0214]
在将人端粒酶逆转录酶(htert)启动子(序列号74)-e1a(序列号75)-内部核糖体进入位点(序列号76)-e1b序列(序列号77)(总序列:序列号78)插入于腺病毒载体的speⅰ与scaⅰ之间之后,通过向e3区域(region)的speⅰ之间分别插入u6启动子和在上述实施例中制备的bcl2及bi-1双靶标短发夹核糖核酸(shrna)(u6启动子 bcl2及bi-1双靶标短发夹核糖核酸(shrna)编码序列:序列号79)、mtor及stat3双靶标短发夹核糖核酸(shrna)(u6启动子 mtor及stat3双靶标短发夹核糖核酸(shrna)编码序列:序列号80)以及ar及mtor双靶标短发夹核糖核酸(shrna)序列(u6启动子 ar及mtor双靶标短发夹核糖核酸(shrna)编码序列:序列号81),来对人端粒酶逆转录酶(htert)启动子及双靶标短发夹核糖核酸(shrna)执行编码及表达,制备了有感染性的重组腺病毒(bcl2及bi-1双靶标短发夹核糖核酸(shrna)编码及表达腺病毒:ca101;mtor及stat3双靶标短发夹核糖核酸(shrna)编码及表达腺病毒:ca102;ar及mtor双靶标短发夹核糖核酸(shrna)编码及表达腺病毒:ca103;c-met及pd-l1双靶标短发夹核糖核酸(shrna)编码(表达)腺病毒:ca104)(参照图19)。而且,作为对照组,还制备了仅插入人端粒酶逆转录酶(htert)的重组腺病毒(ca10g)。之后,通过分析所制备的腺病毒载体的序列,在无异常的情况下利用pacⅰ限制酶来使病毒基因组线性化,利用cacl2法向293a细胞进行转导来生产了各个病毒。
[0215]
实施例8.确认双靶标短发夹核糖核酸(shrna)编码腺病毒的基因表达抑制
[0216]
8-1.确认ca102的mtor及stat3表达抑制
[0217]
8-1-1.确认信使核糖核酸(mrna)水平
[0218]
8-1-1-1.膀胱癌
[0219]
在膀胱癌细胞株中确认了在上述实施例7中制备的重组腺病毒ca102对靶标基因mtor及stat3的表达抑制效果。具体地,在向12孔板分别注入作为人膀胱癌细胞株的t24细胞(0.5
×
105/well)及253jbv细胞(1
×
105/well)之后,1小时后以达到10moi的方式向各个孔处理ca10g及ca102,72小时后利用核糖核酸制备试剂盒(rna prep kit,宝生物工程(takara),9767a)执行了核糖核酸制备(rna prep)。之后,利用分光光度计(nanodirp)执行核糖核酸(rna)定量,利用实时预混仪(rt premix,intron,25081)来每管放入400ng/20ul并与预混(premix)内容物均匀混合,之后利用聚合酶链式反应(pcr)仪器来在45℃的温度下反应1小时(hr)以及在95℃的温度下反应5分钟,从而合成了互补脱氧核糖核酸(cdna)。将所合成的互补脱氧核糖核酸(cdna)2ul用作模板,制备了作为实验组的聚合酶链式反应
(pcr)混合物(总体积为20ul)(模板2ul、正向引物0.5ul(10pmole/ul)、反向引物0.5ul(10pmole/ul)、10ul 2x master mix(bioline、bio-94005)及7ul dw)。通过使所制备的聚合酶链式反应(pcr)混合物产生涡旋来混合好并离心分离后,在定量聚合酶链反应(qpcr)仪器(applied biosystems,qs3)中按在95℃的温度下进行5分钟、在95℃的温度下进行10秒钟以及在60℃的温度下进行30秒钟等步骤执行了40个循环的反应。其结果利用定量聚合酶链反应(qpcr)设备中的程序得到分析。
[0220]
结果显示,在t24细胞及253jbv细胞两者中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和mtor及stat3双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca102明显抑制mtor及stat3基因的表达(图20)。
[0221]
8-1-1-2.头颈部癌
[0222]
通过上述实施例中的方法来在作为头颈部癌细胞株的hsc-2及fadu中确认了在上述实施例7中制备的重组腺病毒ca102对靶标基因mtor及stat3的表达抑制效果,结果显示,在两种细胞株中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和mtor及stat3双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca102均明显抑制mtor及stat3基因的表达(图21)。
[0223]
8-1-1-3.皮肤鳞状细胞癌(skin squamouscarcinoma)
[0224]
通过上述实施例中的方法来在作为皮肤鳞状细胞癌细胞株的a431及hsc-5中确认了在上述实施例7中制备的重组腺病毒ca102对靶标基因mtor及stat3的表达抑制效果,结果显示,在两种细胞株中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和mtor及stat3双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca102均明显抑制mtor及stat3基因的表达(图22)。
[0225]
8-1-2.确认蛋白质表达抑制
[0226]
在向膀胱癌细胞株t24细胞及253jbv细胞处理在上述实施例7中制备的重组腺病毒ca102后,通过蛋白质印迹分析在蛋白质层面确认了对于靶标基因mtor及stat3的表达抑制效果。结果显示,在两种细胞株中,本发明的重组腺病毒ca102均抑制了mtor及stat3的蛋白质表达(图23)。
[0227]
8-2.确认ca101的bcl2及bi-1表达抑制
[0228]
确认了在上述实施例7中制备的重组腺病毒ca101对靶标基因bcl2及bi-1的表达抑制效果。具体地,在向12孔板分别注入u-87细胞(1
×
105/well)后,1小时后以达到10moi的方式向各个孔处理ca10g及ca101,72小时后利用核糖核酸制备试剂盒(rna prep kit,宝生物工程(takara),9767a)执行了核糖核酸制备(rna prep)。之后,利用分光光度计(nanodirp)执行核糖核酸(rna)定量,利用实时预混仪(rt premix,intron,25081)来每管放入400ng/20ul并与预混(premix)内容物均匀混合,之后利用聚合酶链式反应(pcr)仪器来在45℃的温度下反应1小时(hr)以及在95℃的温度下反应5分钟,从而合成了互补脱氧核糖核酸(cdna)。将所合成的互补脱氧核糖核酸(cdna)2ul用作模板,制备了作为实验组的聚合酶链式反应(pcr)混合物(总体积为20ul)(模板2ul、正向引物0.5ul(10pmole/ul)、反向引物0.5ul(10pmole/ul)、10ul 2
×
master mix(bioline、bio-94005)及7ul dw)。通过使所制备的聚合酶链式反应(pcr)混合物产生涡旋来混合好并离心分离后,在定量聚合酶链反
应(qpcr)仪器(applied biosystems,qs3)中按在95℃的温度下进行5分钟、在95℃的温度下进行10秒钟以及在60℃的温度下进行30秒钟等步骤执行了40个循环的反应。其结果利用定量聚合酶链反应(qpcr)设备中的程序得到分析。
[0229]
结果显示,在u-87细胞中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和bcl2及bi-1双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca101明显抑制bcl2及bi-1基因的表达(图24)。
[0230]
8-3.确认ca103的ar及mtor表达抑制
[0231]
8-3-1.在生物体外(in vitro)
[0232]
确认了在上述实施例7中制备的重组腺病毒ca103对靶标基因ar及mtor的表达抑制效果。具体地,在按1
×
105/well向12孔板分别注入作为人前列腺癌细胞株的lncap、c42b及22rv1后,1小时后以达到2moi或5moi的方式向各个孔处理ca10g及ca103,72小时后利用核糖核酸制备试剂盒(rna prep kit,宝生物工程(takara),9767a)执行了核糖核酸制备(rna prep)。之后,利用分光光度计(nanodirp)执行核糖核酸(rna)定量,利用实时预混仪(rt premix,intron,25081)来每管放入400ng/20ul并与预混(premix)内容物均匀混合,之后利用聚合酶链式反应(pcr)仪器来在45℃的温度下反应1小时(hr)以及在95℃的温度下反应5分钟,从而合成了互补脱氧核糖核酸(cdna)。将所合成的互补脱氧核糖核酸(cdna)2ul用作模板,制备了作为实验组的聚合酶链式反应(pcr)混合物(总体积为20ul)(模板2ul、正向引物0.5ul(10pmole/ul)、反向引物0.5ul(10pmole/ul)、10ul 2
×
master mix(bioline、bio-94005)及7ul dw)。通过使所制备的聚合酶链式反应(pcr)混合物产生涡旋来混合好并离心分离后,在定量聚合酶链反应(qpcr)仪器(applied biosystems,qs3)中按在95℃的温度下进行5分钟、在95℃的温度下进行10秒钟以及在60℃的温度下进行30秒钟等步骤执行了40个循环的反应。其结果利用定量聚合酶链反应(qpcr)设备中的程序得到分析。
[0233]
结果显示,在lncap细胞株中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和ar及mtor双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca103明显抑制ar及mtor基因的表达(图25)。并且,在c42b及22rv1中,与ca10g相比,本发明的重组腺病毒ca103也明显抑制ar及mtor基因的表达(图26)。
[0234]
8-3-2.生物体内(in vivo)
[0235]
向balb c nu/nu小鼠皮下移植前列腺癌细胞株(22rv-1)来构建前列腺癌小鼠模板,会后分别向肿瘤内直接给药1次上述实施例7中制备的重组腺病毒ca10g及ca103(2
×
108pfu/spot,3times),21天后摘除肿瘤并通过蛋白印迹分析及ihc分析确认了肿瘤内ar及mtor基因的表达程度。蛋白印迹分析结果显示,在将ca103给药的组中,与对照组及ca10g给药组相比,mtor及ar的表达减少,在ihc分析结果中也显示将ca103给药的组中的mtor及ar的荧光表达比对照组及ca10g给药组减少70%~790%以上,确认到ca103有效抑制作为肿瘤内的靶标基因的mtor及ar的表达9(图27)。
[0236]
8-4.确认ca104的c-met及pd-l1表达抑制
[0237]
确认了上述实施例7中制备的重组腺病毒ca104对靶标基因c-met及pd-l1的表达抑制效果。具体地,在向12孔板分别注入a431细胞株(1
×
105/well)之后,1小时后以达到
2moi或5moi的方式向各个孔处理ca10g及ca104,72小时后利用核糖核酸制备试剂盒(rna prep kit,宝生物工程(takara),9767a)执行了核糖核酸制备(rna prep)。之后,利用分光光度计(nanodirp)执行核糖核酸(rna)定量,利用实时预混仪(rt premix,intron,25081)来每管放入400ng/20ul并与预混(premix)内容物均匀混合,之后利用聚合酶链式反应(pcr)仪器来在45℃的温度下反应1小时(hr)以及在95℃的温度下反应5分钟,从而合成了互补脱氧核糖核酸(cdna)。将所合成的互补脱氧核糖核酸(cdna)2ul用作模板,制备了作为实验组的聚合酶链式反应(pcr)混合物(总体积为20ul)(模板2ul、正向引物0.5ul(10pmole/ul)、反向引物0.5ul(10pmole/ul)、10ul 2x master mix(bioline、bio-94005)及7ul dw)。通过使所制备的聚合酶链式反应(pcr)混合物产生涡旋来混合好并离心分离后,在定量聚合酶链反应(qpcr)仪器(applied biosystems,qs3)中按在95℃的温度下进行5分钟、在95℃的温度下进行10秒钟以及在60℃的温度下进行30秒钟等步骤执行了40个循环的反应。其结果利用定量聚合酶链反应(qpcr)设备中的程序得到分析。
[0238]
结果显示,在a431细胞中,与仅包含人端粒酶逆转录酶(htert)启动子的重组腺病毒ca10g相比,编码及表达人端粒酶逆转录酶(htert)启动子和c-met及pd-l1双靶标短发夹核糖核酸(shrna)的本发明的重组腺病毒ca104明显抑制c-met及pd-l1基因的表达(图28)。
[0239]
实施例9.确认双靶标短发夹核糖核酸(shrna)编码腺病毒的抗癌效果
[0240]
9-1.确认ca101的抗癌效果
[0241]
对在上述实施例7中制备的重组腺病毒ca10g及ca101的癌细胞杀灭效果进行了比较。具体地,在向96孔板分别基础注入u87mg细胞(5
×
103/well)之后,1小时后以分别达到1moi、2moi、5moi、10moi、30moi或50moi的方式向各个孔处理ca10g及ca101,72小时后放入mtt试剂并在37℃的温度下进行了3小时的培养。3小时后,分别从各个孔去除培养基并分别以100ul放入dmso,之后直接使用酶标仪来在540nm的波长下测定了吸光度并执行了mtt分析。
[0242]
结果显示,与ca10g相比,可确认到本发明的ca101明显杀灭癌细胞(图29)。
[0243]
9-2.确认ca102的抗癌效果
[0244]
9-2-1.膀胱癌
[0245]
对在上述实施例7中制备的重组腺病毒ca10g及ca102的癌细胞杀灭效果进行了比较。具体地,在向96孔板分别基础注入t24细胞(2.5
×
103/well)、253j-bv细胞(5
×
103/well)以及人膀胱上皮细胞株rt4细胞(5
×
103/well)之后,1小时后以分别达到1moi、2moi、5moi、10moi、20moi或50moi的方式向各个孔处理ca10g及ca102,72小时后放入mtt试剂并在37℃的温度下进行了3小时的培养。3小时后,分别从各个孔去除培养基并分别以100ul放入dmso,之后直接使用酶标仪来在540nm的波长下测定了吸光度并执行了mtt分析。
[0246]
结果显示,与ca10g相比,可确认到本发明的ca102明显死亡癌细胞(图30)。
[0247]
9-2-2.头颈部癌
[0248]
为了确认本发明的重组腺病毒ca102的头颈部癌细胞杀灭效果,向作为头颈部癌细胞株的hsc-2及fadu处理在上述实施例4中制备的重组腺病毒ca10g及ca102并通过mtt分析比较了细胞杀灭效果。结果显示,以处理10moi为基准,经过ca10g处理时,约40%的细胞被杀灭,相反编码及表达mtor及stat3双靶标短发夹核糖核酸(shrna)的ca102引发了70%以上的细胞杀灭(图31)。
[0249]
9-2-3.皮肤鳞状细胞癌
[0250]
为了确认本发明的重组腺病毒ca102的皮肤鳞状细胞癌细胞杀灭效果,向作为皮肤鳞状细胞癌细胞株的a431及hsc-5处理在上述实施例4中制备的重组腺病毒ca10g及ca102并通过mtt分析比较了细胞杀灭效果。结果显示,以处理10moi为基准,ca102的细胞杀灭效果明显高于ca10g(图32)。
[0251]
9-3.确认ca103的抗癌效果
[0252]
对在上述实施例7中制备的重组腺病毒ca10g及ca103的癌细胞杀灭效果进行了比较。具体地,在按5
×
103/well向96孔板分别注入lncap、c42b及22rv1细胞株之后,1小时后以分别达到1moi、2moi、5moi、10moi、20moi、40moi或50moi的方式向各个孔处理ca10g及ca103,72小时后放入mtt试剂并在37℃的温度下进行了3小时的培养。3小时后,分别从各个孔去除培养基并分别以100ul放入dmso,之后直接使用酶标仪来在540nm的波长下测定了吸光度并执行了mtt分析。
[0253]
结果显示,在lncap细胞株中,与ca10g相比,本发明的ca103明显杀灭癌细胞(图33),在c42b及22rv1细胞株中,本发明的ca103也明显杀灭癌细胞(图34)。
[0254]
实施例10.确认双靶标短发夹核糖核酸(shrna)编码腺病毒的生物体内(in vivo)抗癌效果
[0255]
10-1.确认ca102的抗癌效果
[0256]
10-1-1.对于生物体内癌细胞的抗癌效果
[0257]
为了确认本发明的重组腺病毒ca102对体内癌细胞的抗癌效果,在100mm3板分别培养1.0
×
107个膀胱癌细胞株253j-bv及头颈部癌细胞株fadu之后,以2moi及5moi分别处理本发明的重组腺病毒ca10g及ca102达1小时(对照组经pbs处理),在换成新的培养基后培养了2个小时。之后,回收细胞并以1:1(v/v)的比例与基质胶(matrigel)混合,在向6周龄的雄性balb/c nu-nu小鼠移植(xenograft)后,观察了32天。结果显示,在253j-bv中,癌细胞的大小在以2moi处理ca10g的组中明显减小,而在以2moi处理ca102的组中出现了癌细胞被消灭(图35)。并且,在fadu中,癌细胞的大小在以5moi处理ca10g的组中未呈现出比对照组明显的差异,而在以5moi处理ca102的组中出现了癌细胞被消灭(图36)。
[0258]
10-1-2.对于形成在生物体内的肿瘤的抗癌效果
[0259]
在向6周龄的雄性balb/c nu-nu小鼠移植5.0
×
106个膀胱癌细胞株253j-bv之后,按每周两次的频率进行了观察,当肿瘤的大小平均达到150~200mm3时,以使肿瘤大小的平均值分别达到恒定的方式分为多个组,以每日1次的频率3天共3次向肿瘤分别注入(intratumoral injection)了2.0
×
108pfu的ca10g和ca102病毒。之后,按一周两次的频率观察肿瘤大小43天。结果显示,在将ca10g给药的情况下,肿瘤大小比对照组减小,但随着时间的推移,癌细胞的生长率重新增加,相反,在将ca102给药的情况下,肿瘤大小比对照组及ca10g明显减小,即使经历时间的推移,癌细胞的生长也明显被抑制(图37)。
[0260]
10-1-3.基于给药次数的对于形成在生物体内的肿瘤的抗癌效果
[0261]
在向6周龄的雄性balb/c nu-nu小鼠移植5.0
×
106个膀胱癌细胞株253j-bv之后,按每周两次的频率进行了观察,当肿瘤的大小平均达到200mm3时,以使肿瘤大小的平均值分别达到恒定的方式分为多个组,以每日1次的频率3天共5次向肿瘤分别注入(intratumoral injection)了1.0
×
108pfu的ca10g和ca102病毒。之后,按一周两次的频率
观察肿瘤大小42天。结果显示,肿瘤的大小基于ca102的给药次数减少,确认到癌细胞的生长基于给药次数得到抑制(图38)。
[0262]
10-1-4.基于给药量的对于形成在生物体内的肿瘤的抗癌效果
[0263]
在向6周龄的雄性balb/c nu-nu小鼠移植胶质母细胞瘤细胞株(u-87)之后,观察肿瘤的大小,当肿瘤的大小平均达到200mm3时,以使肿瘤大小的平均值分别达到恒定的方式分为多个组,对每个组分别采用不同的ca102给药量来直接向肿瘤内给药,从而观察了肿瘤的体积及重量。结果显示,与ca10g处理组相比,ca102处理组中的肿瘤的体积及重量大有减少,随着给药量的增加,抗癌效果进一步增加(图39)。
[0264]
10-2.确认ca103的抗癌效果
[0265]
在向balb c nu/nu小鼠皮下移植前列腺癌细胞株(22rv-1)来构建前列腺癌小鼠模型之后,分别向肿瘤内将在上述实施例7中制备的重组腺病毒ca10g及ca103直接给药(2
×
108pfu/spot,3次),从而观察了其生长,结果显示,与未处理对照组(buffer处理组)及载体对照组(ca10g处理组)相比,确认到ca103处理组中的肿瘤的体积及重量大为减少(图40)。
[0266]
实施例11.确认与双靶标短发夹核糖核酸(shrna)编码腺病毒的抗癌剂之间的并用处理效果
[0267]
在向balb c nu/nu小鼠皮下移植膀胱癌细胞株(253j-bv)来分别构建膀胱癌小鼠模型之后,分别向肿瘤内将在上述实施例7中制备的重组腺病毒ca10g及ca102直接给药,从而观察了肿瘤的生长,结果显示,与未处理对照组(buffer处理组)及载体对照组(ca10g处理组)相比,确认到ca102处理组中的肿瘤的体积及重量大为减少,在作为抗癌剂的顺铂并用给药的情况下,确认到抗癌效果协同增加(图41)。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。