predictive vlue of the sflt-1:plgf ratio in women with suspected preeclampsia[j]. n engl j med, 2016, 374(1):13-22)。然而通过sflt-1/plgf比值预测子痫前期的方法孕周较晚,远迟于《指南》推荐的阿司匹林服用时间(孕16周),不利于pe早期预防。此外,sflt-1/plgf比值多用于排除1周内pe的发生风险,全孕期需要多次检测,孕妇支出成本较高。
[0009]
现有的几种子痫前期预测方式虽有一定的临床价值,但均非有效且特异性高的子痫前期预测方法。而妊娠20周后才可预测子痫前期,则会错过服用阿司匹林预防的最佳时间。
[0010]
目前尚无有效的检测方法,可以在妊娠早期评估pe 风险。缺少可靠的在妊娠早期预测子痫风险的生物标志物是其中的原因之一。因此需要一种有效的检测方法能够在16 周之前较为准确地评估pe 的风险并给与相应的治疗,并由此开发针对早产型子痫前期的预测产品,以满足巨大的临床需求。
技术实现要素:
[0011]
本发明的目的是寻找在妊娠早期预测子痫风险的生物标志物,并由此建立妊娠早期评估pe 风险的产品与方法。
[0012]
一方面,本发明提供生物标志物群组,包括endoglin,svegfr2和rbp4。
[0013]
在一些实施方案中,所述生物标志物群组用于患病风险预测或评估或疾病诊断,优选用于先兆子痫相关状况评估,更优选用于先兆子痫风险预测或评估或先兆子痫诊断。
[0014]
另一方面,本发明提供试剂盒或设备,包括用于检测受试者样品中生物标志物群组中的生物标志物表达量的检测试剂,所述生物标志物群组包括endoglin,svegfr2和rbp4。
[0015]
在一些实施方案中,所述生物标志物群组用于患病风险预测或评估或疾病诊断,优选用于先兆子痫相关状况评估,更优选用于先兆子痫风险预测或评估或先兆子痫诊断。
[0016]
另一方面,本发明提供筛选用于先兆子痫风险预测或评估或先兆子痫诊断的生物标志物群组的方法,包括以下步骤:1)检索获得与先兆子痫相关的潜在候选生物标志物;2)在受试者的样品中进一步确认表达量发生变化的所述候选生物标志物;3)与所述受试者的临床信息比对,通过构建公式,计算先兆子痫风险分数;4)选取先兆子痫风险模型表现最好的分界值作为阈值;5)当先兆子痫风险分数高于阈值时,经验证临床性能好的候选生物标志物的组合确定为生物标志物群组。
[0017]
另一方面,本发明提供预测受试者是否有患先兆子痫的风险的方法,包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即预测受试者有患先兆子痫的风险。
[0018]
另一方面,本发明提供评估受试者患先兆子痫的风险高低的方法,包括:
1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,则分数越高,受试者患先兆子痫的风险也越高。
[0019]
另一方面,本发明提供诊断受试者是否患有先兆子痫的方法,包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即诊断受试者患有先兆子痫。
[0020]
另一方面,本发明提供包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志物群组中的生物标志物特异性结合的检测试剂在制备用于预测受试者是否有患先兆子痫的风险的试剂盒或设备中的用途,所述预测包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即预测受试者有患先兆子痫的风险。
[0021]
另一方面,本发明提供包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志物群组中的生物标志物特异性结合的检测试剂在制备用于评估受试者患先兆子痫的风险高低的试剂盒或设备中的用途,所述评估包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,则分数越高,受试者患先兆子痫的风险也越高。
[0022]
另一方面,本发明提供包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志物群组中的生物标志物特异性结合的检测试剂在制备用于诊断受试者是否患有先兆子痫的试剂盒或设备中的用途,所述诊断包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即诊断受试者患有先兆子痫。
[0023]
在一些实施方案中,所述样品是体液样品,优选血液、血清或血浆样品。
[0024]
在一些实施方案中,所述生物标志物的表达量是蛋白水平或核酸水平的表达量。
[0025]
在一些实施方案中,所述受试者是怀孕受试者,孕周在6周到40周,例如6周到13周,例如11周到13周,例如20周到40周,例如23周到33周,例如34周到40周。
[0026]
在一些实施方案中,所述怀孕受试者的孕周在6周到13周,例如11周到13周。
[0027]
在一些实施方案中,所述先兆子痫是早产型子痫前期。
[0028]
在一些实施方案中,所述公式为,或其结果的任意的简单调整,其中α介于-5.487与-1.261之间,β1介于0.041与0.304之间,β2介于0.001与0.086之间,β3介于0.025与0.172之间。
[0029]
在一些实施方案中,所述阈值介于0.350与0.394之间,或因公式的简单调整使其产生的任意的简单调整。
[0030]
在一些实施方案中,所述公式为,或其结果的任意的简单调整。
[0031]
在一些实施方案中,所述阈值为0.379,或因公式的简单调整使其产生的任意的简单调整。
[0032]
在一些实施方案中,所述怀孕受试者的孕周在20周到40周。
[0033]
在一些实施方案中,所述公式为,或其结果的任意的简单调整,其中α介于-1.537与-1.399之间,β1介于0.129与0.403之间,β2介于-0.163与-0.004之间,β3介于-0.029与0.000之间。
[0034]
在一些实施方案中,所述怀孕受试者的孕周在23周到33周。
[0035]
在一些实施方案中,所述先兆子痫是早发型子痫。
[0036]
在一些实施方案中,所述阈值介于0.550与0.781之间,或因公式的简单调整使其产生的任意的简单调整。
[0037]
在一些实施方案中,所述公式为,或其结果的任意的简单调整。
[0038]
在一些实施方案中,所述阈值为0.761,或因公式的简单调整使其产生的任意的简单调整。
[0039]
在一些实施方案中,所述怀孕受试者的孕周在34周到40周。
[0040]
在一些实施方案中,所述先兆子痫是晚发型子痫前期。
[0041]
在一些实施方案中,所述阈值介于0.556与0.773之间,或因公式的简单调整使其产生的任意的简单调整。
[0042]
在一些实施方案中,所述公式为
,或其结果的任意的简单调整。
[0043]
在一些实施方案中,所述阈值为0.723,或因公式的简单调整使其产生其任意的简单调整。
[0044]
本发明成功地筛选到了与子痫前期相关的生物标志物,可以在妊娠5-25周,特别是11-13
6
周更准确预测子痫前期风险,填补了子痫前期风险预测试剂国内外空白。该预测不需要联合包括母体危险因素、平均动脉压(map)、妊娠相关蛋白a(pappa)及子宫动脉搏动指数(utpi)等其他指标,孕早期具有较高pe预测准确性。
[0045]
sflt-1/plgf仅对于妊娠20周后可做子痫前期短期预测与辅助预测,且需多次检测。相比之下,本发明的方法可在妊娠全孕期预测子痫前期风险,适合于所有产检孕妇。
[0046]
在描述本发明的产品和方法之前,应理解本发明不限于所述的特定产品或方法,因而当然可改变。还应理解,本文所用的术语仅用于描述特定实施方案的目的,而不欲具限制性,因为本发明的范围将仅由所附权利要求书限制。
[0047]
在提供数值范围时,应理解,除非上下文另有明确说明,否则还特定公开介于所述范围的上限和下限之间的每一中间值。介于所述范围中的任何所述值或中间值与所述范围中的任何其它所述值或中间值之间的每一较小范围涵盖在本发明内。这些较小范围的上限和下限可独立地包括在范围中或排除在范围外,并且其中任一界限、无一界限或两个界限包括在较小范围内的每一范围也涵盖在本发明内,受制于所述范围中任何明确排除的界限。在所述范围包括一个或两个界限时,排除那些所包括界限的任一个或两个的范围也包括在本发明中。
[0048]
除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解相同的含义。虽然与本文所述类似或等效的任何方法和材料可以用于实施或测试本发明,但现在描述一些潜在和优选的方法和材料。本文所提及的所有公开案通过引用的方式并入本文中以结合所引用的公开案来公开和描述方法和/或材料。应理解,在存在冲突的程度上,本公开取代所并入的公开案的任何公开内容。
[0049]
本领域技术人员在阅读本公开内容后将显而易见,本文所描述和说明的每一单独的实施方案具有分立成分和特征,在不偏离本发明的范围或精神的情况下,其可容易地与任何其它若干个实施方案的特征分离或组合。可以所述事件的顺序或以逻辑上可能的任何其它顺序进行任何所述方法。
[0050]“先兆子痫”又称为“子痫前期”,是子痫发生的前兆。“先兆子痫风险”指与没有患先兆子痫风险的怀孕受试者相比,有患先兆子痫风险怀孕受试者具有统计学意义上显著提高的在未来的预后时窗内会患先兆子痫的可能性。优选地,所述的可能性是至少80%,至少85%,至少90%,至少95%,至少97%,至少98%,至少99%或高达100%。
[0051]
本发明用于先兆子痫风险预测、评估或诊断的生物标志物群组包括endoglin,svegfr2和rbp4。
[0052]
endoglin 是转化生长因子β(tgf-β)亚型的可溶性受体,子痫前期患者通过胎盘endoglin蛋白过度表达,引起循环中endoglin蛋白水平升高,阻断tgf-β的促血管生成作用
及血管舒张作用,引起血管生成障碍和内皮损伤。通过检测孕妇体内endoglin蛋白表达量的高低,可以预测孕妇患有子痫前期的风险,对整个孕期起干预指导作用。
[0053]
血管内皮生长因子受体(svegfr2)在促进血管生成及调控方面起关键作用,在子痫前期患者中svegfr2 表达水平降低,通过检测孕妇体内svegfr2 表达量的高低,可以预测孕妇患有子痫前期的风险,对整个孕期起干预指导作用。
[0054]
视黄醇结合蛋白(rbp4)作为一种新的脂肪因子,与糖脂代谢的调节及胰岛素抵抗有重要关系,子痫前期可能与胰岛素抵抗和高胰岛素血症有关。血清rbp4 水平升高有可能导致内皮功能受损,削弱氧化亚氮依赖的血管扩张,加重血管病变,从而导致子痫前期的发生。
[0055]
本发明发现,endoglin/svegfr2/rbp4浓度的改变明显早于先兆子痫发病,且endoglin/svegfr2/rbp4的计算数值可以更好地反映血管的生长情况。在评估蛋白尿和血压的基础上,联合检测endoglin/svegfr2/rbp4的表达量并得出的计算数值对先兆子痫具有良好的风险预测、评估或诊断价值和指导意义。
[0056]
除了上述生物标志物,本发明还可包括其他用于先兆子痫风险预测、评估或诊断的生物标志物,前提是这些生物标志物与endoglin/svegfr2/rbp4的计算数值可以对先兆子痫具有良好的风险预测、评估或诊断价值和指导意义。
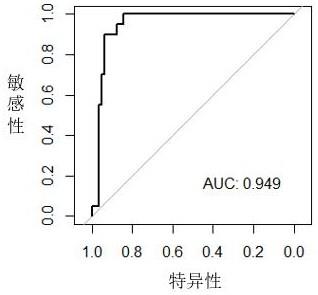
[0057]
本发明相应开发了试剂盒或设备,用于疾病诊断或患病风险预测或评估,优选用于先兆子痫相关状况评估,更优选用于先兆子痫诊断或风险预测或评估。所述试剂盒或设备包括用于检测受试者样品中生物标志物群组中的生物标志物表达量的检测试剂,所述生物标志物群组包括endoglin,svegfr2和rbp4。
[0058]
术语“受试者”涉及动物,优选哺乳动物,更优选人。本发明中的受试者需为怀孕受试者。优选地,本发明的受试者应不表现先兆子痫症状。这种先兆子痫症状优选地是本发明其它部分中具体描述的临床症状。更优选地,所述症状包含选自下述的至少一种症状:上腹部疼痛,头痛,视觉障碍,水肿。但是,本发明的受试者也可以表现上述的至少一种症状,因而已经疑似患上先兆子痫。
[0059]
术语“样品”指体液样品,分离的细胞样品,或来自组织或器官的样品。可由公知的技术获得体液样品,且优选地包括血液,血浆,血清或尿液样品,更优选血液,血浆或血清样品。可由任意的组织或器官通过,例如活组织检查,获取组织或器官样品。可通过分离技术,例如离心或者细胞分选,由体液、组织或器官获取分离的细胞。优选地,细胞的、组织的、或器官的样品由表达或产生本发明所述的肽的那些细胞、组织或器官获取。
[0060]
术语“表达量”指生物标志物的蛋白或核酸表达水平,所述核酸包括例如dna或rna。所述“表达量”优选指生物标志物的蛋白表达水平。
[0061]
根据本发明,确定本发明生物标志物的表达量可通过所有已知的手段实现。以蛋白表达量为例,可直接或间接地进行测量。直接测量涉及基于由蛋白获得的信号、以及与样品中所述蛋白的分子数量直接相关的信号强度,测量蛋白的数量或浓度。间接测量包括测量例如配体,标签或酶反应产物获得的信号。
[0062]
根据本发明,确定所述蛋白的量可通过所有已知的用于确定样品中蛋白的量的手段实现。所述手段包括应用标记分子的,以各种不同的夹层法、竞争法,或其它测定法形式进行的免疫测量设备和方法。所述的测定法将产生表明是否存在所述蛋白的信号。而且,所
述信号的强度,优选地与样品中蛋白的量直接或间接相关(例如,成反比)。其它适合的方法包括测量特异于所述蛋白的物理或化学特性,例如其精确的分子量或nmr谱。所述方法包括,优选生物传感器,与免疫分析偶联的光学设备,生物芯片,分析设备,例如质谱仪,nmr-分析仪,或色谱设备等。
[0063]
具体的,本发明的蛋白检测基于磁微粒的吖啶酯化学发光免疫学。吖啶酯标记物在化学结构上有产生发光的特殊基团,在发光免疫分析过程中添加激发液后即可直接参与发光反应,无需底物液,通常此类物质无本底发光,是一类发光效率很高的发光剂。吖啶酯或吖啶磺酰胺均可与抗体(或抗原)结合,生产具有化学发光活性强,免疫反应特异性高的标记物,吖啶酯通常标记在抗体或抗原的氨基上,标记抗体时最好定向偶联在抗体的固定区上,以便使得抗体既能比较高效率标记又不会损伤抗体活性。磁微粒是由高分子单体聚合而成的微球或颗粒,直径多为微米级或毫米级,其表面带有能与抗体或抗原结合的功能团,如氨基,羧基,羟基等,故可以通过特定的偶联方法形成化学偶联,有结合力强,容量大的优点。在免疫反应时,磁微粒可以均匀地分散到反应溶液中,比表面积较大,有利于反应加速进行,提高了反应速率。
[0064]
本发明采用将抗体直接包被在磁微粒上,吖啶酯直接标记抗体的偶联方法,不需要引入生物素-链霉亲和素系统,操作简单,重复性较好,并且偶联效率高,发光信号强,便于大规模应用。以该方法可以得到灵敏度更高、线性范围广。磁微粒-吖啶酯系统平台下的联检项目试剂盒,可以同时检测endoglin/svegfr2/rbp4三个项目,通过公式计算结果进行判定,能够辅助临床更早期、快速的进行先兆子痫预测、预测不良妊娠结局,帮助医生对高危人群进行识别与治疗,从而保障妊娠期母婴安全。
[0065]
合适的“检测试剂”,可以是与有待通过本发明的方法研究的受试者样品中的至少一种标志物特异性结合的配体,例如与endoglin,svegfr2或rbp4特异性结合的抗体。另一方面,在测量所述检测试剂和所述的至少一种标志物之间形成的复合物的量之前,使所述的样品与所述复合物分离。因此,一方面所述检测试剂可以固定化于固体支持物上。另一方面可通过施用清洗溶液使所述的样品与在固体支持物上形成的复合物分离。所形成的复合物与存在于样品中的至少一种标志物的量是成比例的。可以理解待应用的检测试剂的特异性和/或灵敏度决定了样品中包含的可被特异性结合的至少一种标志物的比例程度。
[0066]
确定蛋白的量可优选地包括下述步骤:(a)使所述的蛋白与特定的配体接触,(b)优选地去除未结合的配体,(c)测量结合配体的量。所述的结合配体将产生强度信号。本发明中的结合包括共价和非共价结合。本发明中的配体可以是与本发明中的蛋白结合的任意化合物,例如肽,多肽,核酸或小分子。优选的配体包括抗体,核酸,肽或多肽,例如所述蛋白、及其包含所述蛋白的结合结构域的片段的受体或结合配偶体,以及适体,例如核酸或肽适体。制备此类配体的方法是本领域共知的。例如适合的抗体和适体的鉴定和生产可由供应商提供。本领域的普通技术人员通晓研发具有更高亲和力及特异性的上述配体的衍生物的方法。例如可以向所述核酸、肽或多肽中引入随机突变。然后通过本领域已知的筛选程序,例如噬菌体展示,测试所得衍生物的结合力。本发明中所指的抗体包括多克隆抗体和单克隆抗体以及它们的片段,例如能结合抗原或半抗原的fv,fab和f(ab)2片段。本发明还包括单链抗体,以及人源化杂合抗体,其中显示所需抗原特异性的非人供体抗体的氨基酸序列与人受体抗体的氨基酸序列结合。所述的供体序列通常至少包括所述供体的抗原结合氨
基酸残基,但也可包含所述供体抗体的其它结构和/或功能相关氨基酸残基。所述的杂合体可通过本领域已知的若干种方法制备。优选地,所述配体或试剂与所述蛋白特异性地结合。根据本发明的特异性结合指,所述配体或试剂基本上不与存在于待分析样品中的其它蛋白或物质结合,即:发生交叉反应。优选地,所述特异性结合蛋白具有比任何其他相关的蛋白强达至少3倍,更优选至少10倍,和甚至更优选至少50倍的结合亲和力。如果例如根据其在western blot上的大小,或通过其在样品中相对更高的丰度,仍然可以明确地区分和测量,那么所述非特异性结合有可能是可容忍的。所述配体的结合可通过本领域任何已知的方法进行测量。优选地,所述方法是半定量或定量的。
[0067]
本发明的设备的实例包括用于检测化学或生物反应结果或者监控化学或生物反应进程的临床化学分析仪,凝聚化学分析仪(coagulation chemistry analyzers),免疫化学分析仪,尿分析仪,核酸分析仪,试剂盒,等等。
[0068]
所述设备的实施方案可包括一个或以上的用于实践本发明的主题的分析仪单元。本发明中所公开的设备的分析仪单元可通过已知的任何连接方式与本发明所公开的计算单元可操作地通讯。此外,根据本发明,分析仪单元可以包括较大设备中用于预测目的的样品检测,例如定性和/或定量评估之一或两者的独立的装置或元件。例如,分析仪单元可以执行或辅助样品和/或试剂的移液,计量,混合。分析仪单元可包括用来夹持试剂以进行测定的试剂夹持单元。试剂的安排可以是,例如在盛有单独的试剂或一组试剂的容器或匣子里,置于储藏室或输送器中合适的托座或位置之中。检测试剂还可以固定在与样品相接触的固体支持物上。分析仪单元还可以包括对于特定的分析最优化的处理和/或检测组件。
[0069]
根据一些实施方案,分析仪单元可配置为对样品中的分析物,例如标志物,进行光学检测。用于光学检测的分析仪单元的示例包括配置为将电磁能转化成电信号的设备,其包括单一的和多元件或阵列光学探测器。根据本公开,光学探测器能监控光电磁信号并提供代表置于光路中的样品内分析物的存在和/或浓度的电输出信号,或与相对于基线信号的应答信号。所述设备还可以包括,例如光电二极管,包括雪崩光电二极管,光电晶体管,光电导检测器,线性传感器阵列,ccd检测器,cmos检测器,包括cmos阵列检测器,光电倍增管,以及光电倍增管阵列。根据某些实施方案,光学检测器,例如光电二极管或光电倍增管可包括附加的信号调节或处理电器元件。例如光学检测器可包括至少一个预放大器,电子过滤器,或集成电路。合适的预放大器包括,例如集成、跨阻抗,和电流增益(电流反射镜)预放大器。
[0070]
此外,本发明的一个或以上的分析仪单元可包含用于发射光的光源。例如,分析仪单元的光源可以由至少一个光发射元件(例如,发光二极管,电力发射源如白炽灯,电致发光灯,气体放电灯,高强度放电灯,激光)组成,用于测量待测样品中分析物的浓度,或使得能够能量转换(例如,通过荧光共振能量转移或催化酶)。
[0071]
此外,所述设备的分析仪单元可包括一个或以上的温育单元(例如用于将样品或试剂保持在特定的温度或温度范围)。在一些实施方案中,分析仪单元可包括用于使样品处于重复的温度循环中并监测样品中扩增产物量的变化的热循环仪,包括实时热循环仪。
[0072]
本文中公开的设备的分析仪单元还可包括或可操作地连接于反应容器或小杯输送单元。输送单元的示例包括液体加工单元,例如移液单元,用来将样品和/或试剂递送到反应容器。所述移液单元可包含可重复使用的耐洗针,例如钢针,或者一次性的移液头。所
述的分析仪单元还可包括一个或以上的混合单元,例如用于振荡含液体的小杯的振荡器,或用来混合小杯或试剂容器中的液体的搅拌桨。
[0073]
本发明还涉及适于通过实施上述的方法预测怀孕受试者是否有患先兆子痫的风险的设备,其包括:a)分析仪单元,其包含特异性地结合endoglin、svegfr2和rbp4的检测试剂,所述单元适合于确定怀孕受试者样品中endoglin、svegfr2和rbp4的表达量;和b)含数据处理器的评估单元,所述数据处理器具有用于实施下述步骤的执行算法:i)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;ii)比较所述先兆子痫风险分数,如果高于阈值,即预测受试者有患先兆子痫的风险。
[0074]
本发明中使用的术语“设备”涉及包含彼此可操作地连接的上述单元的系统,其使得可根据本发明的方法进行预测。可用于所述分析单元的优选检测试剂在本发明的其它部分公开。分析单元(或分析仪单元)优选地包括处于固体支持物上的固定形式的检测试剂,其将与包含待确定其数量的生物标志物的样品相接触。此外,所述分析单元还可以包含检测器,其用于确定与所述生物标志物特异性结合的检测试剂的量。可将经确定的量转移到所述评估单元。所述评估单元包括带有执行算法的数据处理元件,例如计算机,所述数据处理元件通过执行基于计算机的算法实施本发明的方法的步骤,由此实施比例计算,比较计算出的比例,和评估比较结果,其中所述本发明的方法的步骤已在本发明的其他部分详细阐述。所述结果可作为参数化的预测原始数据输出而给出。可以理解这些数据通常需要经过医生的解读。但是也可以预计专家系统设备,其中上述的输出包含无需专业医生进行解读的、经处理的预测原始数据。
[0075]
本发明中使用的术语“试剂盒”指各种检测试剂和部件的集合,优选地,其单独地或在单一的容器内提供。所述的容器内还包括实施本发明的方法的操作指南。这些操作指南可以是使用手册的形式,也可以通过计算机程序代码提供,当在计算机或数据处理设备上运行所述计算机程序代码时,其能够执行本发明的方法中的计算和比较,并相应地建立预测。所述的计算机程序代码可以是在数据存储介质或设备上,例如光学存储介质(例如光盘),或者直接在计算机或数据处理设备上提供。而且,所述的试剂盒可优选地包含用于校准目的的标准量的生物标志物,所述生物标志物在本发明的其他部分阐述。
[0076]
术语“预测”涉及判断受试者是否有患先兆子痫的风险,用于在症状出现前确定受试者发病的可能性(即评估未来发病的风险)。
[0077]
术语“评估”是指确定受试者患先兆子痫的风险的高低。优选的,应该确定较之对象人群的平均风险,受试者风险是否处于升高的风险或降低的风险。对于有足够风险的受试者(根据检测结果确定),可采取预防性干预措施。
[0078]
术语“诊断”在本文中用于指对分子或病理学状态、疾病或疾患(例如先兆子痫)的鉴定或分类。例如,“诊断”可以指特定先兆子痫类型的鉴定。本发明的“诊断”可以与《指南》中提供的其他诊断标准结合,用于提供附加信息,以帮助确定或验证受试者的临床状态。
[0079]
如本领域技术人员将理解的,这种预测、评估、诊断虽然是优选的,但可能不会对100%的被研究的受试者都是正确的。然而,该术语要求能够正确地评估具有统计学意义的
部分的受试者,从而将其识别为是否有患先兆子痫的风险,患先兆子痫的风险高低以及是否患有先兆子痫。
[0080]
本发明中临床性能分为灵敏度,特异性,阳性预测值(ppv),阴性预测值(npv)。
[0081]“灵敏度”可用来衡量某种试验检测出有病者的能力,灵敏度是将实际有病的人正确地判定为真阳性的比例。灵敏度=真阳性人数/(真阳性人数 假阴性人数)*100%。
[0082]“特异性”是衡量试验正确地判定无病者的能力,特异度是将实际无病的人正确地判定为真阴性的比例。特异性=真阴性人数/(真阴性人数 假阳性人数)*100%。
[0083]
阳性预测值(ppv)=真阳性人数/(真阳性人数 假阳性人数)*100%。
[0084]
阴性预测值(npv)=真阴性人数/(真阴性人数 假阴性人数)*100%。
[0085]
本发明基于所述生物标志物的表达量,利用公式计算出先兆子痫风险分数。计算公式可以基于不同的算法,例如弹性网络回归算法。具体地,本发明将样本的类别即先兆子痫患病或正常作为因变量,样本特征值矩阵作为自变量,定义目标函数,并进行建模,形成先兆子痫风险分数公式,例如。
[0086]
其中e为自然常数,α,β1,β2和β3为特征系数,endoglin、svegfr2和rbp4为对应生物标志物的表达量。该先兆子痫风险分数公式仅为示例,不应理解为对本发明技术方案的限制。基于本发明确定的生物标志物,本领域技术人员可以根据对象人群、样本情况、临床使用场景、临床性能需求等的不同构建合适的先兆子痫风险分数公式。
[0087]
本发明以auc (roc曲线下方面积)作为模型的评判指标,对所建模型进行验证。auc的高低和临床使用场景等因素都可能影响上述先兆子痫风险分数公式,例如特征系数α,β1,β2和β3的数值。例如以auc大于0.85的指标,α,β1,β2和β3可在一定范围内调整。以auc大于0.9的指标,α,β1,β2和β3的范围又可能会相应变化。本发明中的α,β1,β2和β3的数值范围仅为示例,不应理解为对本发明技术方案的限制。
[0088]
基于特定的临床使用场景,可以根据不同的临床性能需求来确定阈值。例如可以以敏感度达到90%以上,特异性达到90%以上和npv达到90%以上的要求,选取能使ppv达到最高的分界值为本临床使用场景的阈值。当临床使用场景和临床性能需求发生变化时,阈值也会相应发生变化。由于特征系数α,β1,β2和β3的数值均处于一个范围内,根据各特征系数两端值的固定,可将阈值固定在一个范围内。
[0089]
为了便于临床使用,本发明的先兆子痫风险分数公式可以基于其结果做任意的简单调整。仍以上述先兆子痫风险分数公式为例,由于其计算结果在0-1的范围内,可以对其进行任意的简单调整,例如但不限于,乘以一个倍数例如10、100,加上一个常数例如1、2等,以增加其可读性和易操作性。
[0090]
相应的,本发明的阈值也可随着上述公式的简单调整而进行任意的简单调整,例如但不限于,乘以一个倍数例如10、100,加上一个常数例如1、2等等,以增加其可读性和易操作性。
附图说明
[0091]
图1显示生物标志物发现与验证流程。
[0092]
图2显示生物标志物endoglin、svegfr2和rbp4各自的roc曲线图。
[0093]
图3显示11
0
到13
6
周临床使用场景下最佳先兆子痫风险模型roc曲线图。
[0094]
图4显示20
0
到33
6
周临床使用场景下最佳先兆子痫风险模型roc曲线图。
[0095]
图5显示34
0
到分娩临床使用场景下最佳先兆子痫风险模型roc曲线图。
具体实施方式
[0096]
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例仅用于更加清楚地说明本发明的技术方案,从而使本领域技术人员能很好地理解和利用本发明,而不是限制本发明的保护范围。
[0097]
本发明实施例中涉及到的实验方法、生产工艺、仪器以及设备,其名称和简称均属于本领域内常规的名称,在相关用途领域内均非常清楚明确,本领域内技术人员能够根据该名称理解常规工艺步骤并应用相应的设备,按照常规条件或制造商建议的条件进行实施。
[0098]
实施例1:生物标志物的发现与验证流程虽然先兆子痫早期临床症状出现较晚,但胎儿和母体组织之间已经出现异常的相互作用,因此这项研究中,我们需要通过大数据分析,识别潜在的与先兆子痫相关的生物标志物,再通过组学分析,从中筛选并得到多组候选的生物标志物,流程见图1,其大致包括以下步骤。
[0099]
1、搜集全球生物相关数据库;2、获得与pe相关的候选生物标志物,包括但不限于leptin,sflt1,pigf,adam12,afm,apln,apoa,apod,apoe,c8b,casp8,clcn6,cp,crh,ebi3,fgb,fn1,fstl3,gpx3,hp,hexb,hsd17b1,htra1,igkv3d-20,iglc3,il1rap,inha,inhba,itih3,krt1,mfap5,mtr,pltp,procr,pvrl4,rbp4,saa1,sdc1,sell,serpina3,serping1,sh#bgrl3,siglec6,slc2a1vtn,wwf等;3、通过质谱蛋白组学数据非依赖型扫描模式(dia)分析,从所述候选生物标志物中进一步进行筛选,得到在怀孕受试者的样品中表达量发生变化的候选生物标志物,其中上调的包括pappa2,serping1,sdc1,eng,c1qtnf3,inhbe,vsig4,dennd10,lhx5,casp8,ptx3,cgb3,bnc2,angptl6等;下调的包括hba1,ighg3,sh3bgrl3,iglc3,clcn6,flna,igkv2d-40,igkv3d-20,mrt等;4、通过免疫学技术(例如luminex ivd)分析验证样本;5、数据模型计算;6、与临床信息比对,获得一组用于后续检测的生物标志物,进行后续研究。
[0100]
实施例2:6到14周孕周预测模型的构建本发明的主要目的之一在于根据三个生物标志物所构建的预测模型在怀孕早期来评估先兆子痫患病风险的应用。具体的,三个生物标志物为endoglin ,svegfr2和rbp4。
[0101]
为了实现上述目的,实施了如下筛选生物标志物以及构建预测模型的步骤:第一步:确定模型训练样本252人,其中先兆子痫患者样本84例,正常妊娠样本168
例,所有样本的孕周均在6到14周。
[0102]
第二步:对各生物标志物进行单变量分析,按照p值《0.05,差异倍数》1.2或者《1/1.2,auc》0.60筛选出跟先兆子痫有显著差异的标志物。其中差异倍数,是描述测量a和测量b间数量变化的量度,它被定义为两个量之间的比率;auc为roc曲线下的面积, roc曲线全称为受试者工作特征曲线,它是根据一系列不同的分界值,以真阳性率(敏感性)为纵坐标,假阳性率(1-特异性)为横坐标绘制的曲线, auc作为衡量学习器优劣的一种性能指标,其取值范围在0.5和1间,auc值越大该分类器效果越好。在本发明实施例的单变量分析中,差异倍数所计算的测量a和测量b分别是先兆子痫样本的各生物标志物平均表达量和正常样本的各生物标志物平均表达量;分类器进行区分的两类分别是先兆子痫样本和正常妊娠样本。本发明涉及的三个生物标志物详细分析结果见表1, roc曲线图见图2。
[0103]
第三步:用筛选出的有显著差异的三个生物标志物作为特征,通过r语言包glmnet中的弹性网络回归算法进行监督学习,根据三倍交叉验证进行参数优化,构建预测先兆子痫风险评估模型。在平均交叉验证时,当样本均方预测误差最小时,可得到性能最佳的模型;当平均交叉验证误差在一个方差范围内,可得到具备优良性能得模型。
[0104]
具体而言,glmnet 是一个通过惩罚最大似然拟合广义线性和相似模型的包。弹性网络回归算法属于常规算法,是套索回归和岭回归的混合技术,套索回归会进行特征的挑选,岭回归会保留所有的特征,而弹性网络综合了套索回归和岭回归,它将l1惩罚与l2惩罚同时引入到目标函数的最小化过程中,在获得稀疏系数的同时,维持了岭回归的正则属性。弹性网络回归算法的代价函数通过两个参数 λ 和 ρ 来控制惩罚项的大小:。
[0105]
glmnet 算法使用循环坐标下降法,该方法在每个参数固定不变的情况下连续优化目标函数,并反复循环直到收敛。代价函数最小时 w 的大小:。
[0106]
在r语言包glmnet中的函数cv.glmnet会保存两个λ值。lambda.min和lambda.1se,其中lambda.min是给出最小平均交叉验证误差的λ值。另一个λ值 lambda.1se,它给出的模型使得误差在最小值的一个标准误差以内。然后根据所储存的两个λ值通过r语言包glmnet中的函数coef可提取出对应的特征系数,此时得到的两组特征系数则为本案例模型参数的范围边界值。
[0107]
具体地,本发明将样本的类别即先兆子痫患病或正常作为因变量,样本特征值矩阵作为自变量,定义目标函数,目标函数包括正则化。其中,正则化的主要作用是防止过拟合,并对模型添加正则化项可以限制模型的复杂度,使得模型在复杂度和性能达到平衡。然后使用 cv.glmnet函数,选择弹性网络算法进行建模。在参数设置时,由于本案例使用了弹性网络算法,所以给与参数ρ的范围在0到1之间,ρ为惩罚系数。然后在范围内生成多个不同ρ的模型,再以auc (roc曲线下方面积)作为模型的评判指标,并使用三折交叉验证,对所建模型进行验证。
[0108]
上述根据弹性网络模型构建的风险公式如下:。
[0109]
其中α为截距,β1,β2和β3分别为endoglin,svegfr2和rbp4的系数。根据auc大于0.85的指标,α,β1,β2和β3处于一定的范围内,具体范围见表2。
[0110] 第四步:根据临床使用场景确定模型分数阈值。具体的,先将样本的孕周固定在11
0
到13
6
周(对应为11-13孕周),先兆子痫患者样本定义为生产孕周早于37周的先兆子痫患者,正常对照样本定义为生产孕周大于等于37周的正常对照人员,确定临床使用场景之后的先兆子痫患者样本有10例,正常对照样本有68例。然后将先兆子痫患者样本通过有放回的随机抽样自助生成20例的患病样本,再根据先兆子痫早产的发病率为0.9%,将正常对照样本的68例进行有放回的随机抽样自助生成2203例的正常样本。最后根据上述新生成的由20例先兆子痫患病样本和2203例正常样本的数据集,通过先兆子痫风险模型进行计算风险分数的计算,并根据敏感度达到90%以上,特异性达到90%以上和npv达到90%以上的要求,选取能使ppv达到最高的分界值为本临床使用场景的阈值。由于第三步中各系数均处于一个范围内,根据各特征系数两端值的固定,可将阈值范围固定在0.350到0.394,在该范围阈值下风险分数的最优具体表现见表3,最优roc曲线图见图3。
[0111]
实施例3:20到40周孕周预测模型的构建本发明的主要目的之一在于根据三个生物标志物所构建的预测模型在怀孕早期来评估先兆子痫患病风险的应用。具体的,三个生物标志物为endoglin ,svegfr2和rbp4。
[0112]
为了实现上述目的,实施了如下构建预测模型的步骤:第一步:确定模型训练样本63人,其中先兆子痫患者样本32例,正常妊娠样本31例,其中所有样本的孕周均在20到40周。
[0113]
第二步:用已锁定的三个生物标志物作为特征,通过r语言包glmnet中的弹性网络算法进行监督学习,根据三倍交叉验证进行参数优化,构建预测先兆子痫风险评估模型。在平均交叉验证时,当样本均方预测误差最小时,可得到性能最佳的模型;当平均交叉验证误差在一个方差范围内,可得到具备优良性能得模型。上述根据弹性网络模型构建的风险公式如下:。
[0114]
其中α为截距,β1,β2和β3分别为endoglin,svegfr2和rbp4的系数。根据auc大于0.85的指标,α,β1,β2和β3可在一定范围内调整,具体范围见表4。
[0115]
第三步:根据两种不同的临床使用场景确定模型分数阈值。
[0116]
具体的,临床使用场景一将样本的孕周固定在20
0
到33
6
周(对应为20-33孕周),先兆子痫患者样本定义为样本收集时间在34周以内的早发性先兆子痫患者样本,正常对照样本定义为样本收集时间在34周以内的正常对照人员样本,确定临床使用场景之后的先兆子痫患者样本有15例,正常对照样本有15例。通过先兆子痫风险模型进行计算风险分数的
计算,并根据敏感度达到90%以上,特异性达到90%以上和ppv达到90%以上的要求,选取能使npv达到最高的分界值为本临床使用场景的阈值。由于第二步中各系数均处于一个范围内,根据各特征系数两端值的固定,可将阈值范围固定在0.550到0.781,在该范围阈值下先兆子痫风险模型的表现见表5。其中当α=-1.463,β1=0.286,β2=-0.128,β3=-0.008且阈值为0.761时,先兆子痫风险模型在该场景下能得到最佳表现,此时最优roc曲线图见图4。
[0117]
临床使用场景二将孕周固定在34
0
(对应为34孕周)到分娩,先兆子痫患者样本定义为样本收集时间在34周以后的晚发性先兆子痫患者样本,正常对照样本定义为样本收集时间在34周以后的正常对照人员样本,确定临床使用场景之后的先兆子痫患者样本有17例,正常对照样本有16例。然后通过兆子痫风险模型进行计算风险分数的计算,并根据特异性达到90%以上和ppv达到90%以上的要求,选取能使npv和敏感度达到最高的分界值为本临床使用场景的阈值。同样由于第二步中各系数均处于一个范围内,根据各特征系数两端值的固定,可将阈值范围固定在0.556到0.773,在该范围阈值下先兆子痫风险模型的表现见表5,此时最优roc曲线图见图5。
[0118]
实施例4:试剂盒的制备方法1、吖啶酯标记的第一endoglin 抗体制备方法:1)量取标记缓冲溶液于离心管中;2)加入第一endoglin 抗体,充分混匀;3)加入吖啶酯溶液,充分混匀,室温避光震荡反应;吖啶酯与第一endoglin 抗体摩尔比为1:13;第一endoglin 抗体与吖啶酯室温避光震荡反应的时间为30-150min;4)将以上混合物装入超滤管中,2000-4000rpm,离心20-40min;5)加入适量的标记缓冲液定量,-20℃密封保存。
[0119]
2、吖啶酯标记的第一svegfr2 抗体制备方法:1)量取标记缓冲溶液于离心管中;2)加入第一svegfr2 抗体,充分混匀;3)加入吖啶酯溶液,充分混匀,室温避光震荡反应;吖啶酯与第一svegfr2 抗体摩尔比为1:10;第一svegfr2 抗体与吖啶酯室温避光震荡反应的时间为30-150min;4)将以上混合物装入超滤管中,2000-4000rpm,离心20-40min;5)加入适量的标记缓冲液定量,-20℃密封保存。
[0120]
3、吖啶酯标记的第一rbp4 抗体的制备方法:
1)量取标记缓冲溶液于离心管中;2)加入第一rbp4 抗体,充分混匀;3)加入吖啶酯溶液,充分混匀,室温避光震荡反应;吖啶酯与第一rbp4 抗体摩尔比为1:10;第一rbp4 抗体与吖啶酯室温避光震荡反应的时间为30-150min;4)将以上混合物装入超滤管,2000-4000rpm,离心20-40min;5)加入适量的标记缓冲液定量,-20℃密封保存。
[0121]
4、包被有第二endoglin 抗体的磁微粒的制备方法:1)取200mg 磁微粒,磁分离去上清,用0.05mol/l,ph4.5-5.5mes缓冲液400ul 重悬;2)加入0.5-1ml 新鲜配制的浓度为10mg/ml 的edc 水溶液,室温混悬30-60min;3)磁分离,去上清,用0.05mol/l,ph4.5-5.5mes 缓冲液400ul重悬;4)加入50ug 的第二endoglin 抗体,室温混悬10-30min;5)磁分离,去上清,用磁微粒缓冲液稀释重悬到0.5mg/ml,完成磁分离试剂的制备。
[0122]
5、包被有第二svegfr2 抗体的磁微粒的制备方法:1)取200mg 磁微粒,磁分离去上清,用0.05mol/l,ph4.5-5.5mes缓冲液400ul 重悬;2)加入0.5-1ml 新鲜配制的浓度为10mg/ml 的edc 水溶液,室温混悬30-60min;3)磁分离,去上清,用0.05mol/l,ph4.5-5.5mes 缓冲液400ul重悬;4)加入50ug 的第二svegfr2 抗体,室温混悬10-30min;5)磁分离,去上清,用磁微粒缓冲液稀释重悬到0.5mg/ml,完成磁分离试剂的制备。
[0123]
6、包被有第二rbp4 抗体的磁微粒的制备方法:1)取200mg 磁微粒,磁分离去上清,用0.05mol/l,ph4.5-5.5mes缓冲液400ul 重悬;2)加入0.5-1ml 新鲜配制的浓度为10mg/ml 的edc 水溶液,室温混悬30-60min;3)磁分离,去上清,用0.05mo1/l,ph4.5-5.5mes 缓冲液400ul重悬;4)加入50ug 的第二rbp4 抗体,室温混悬10-30min;5)磁分离,去上清,用磁微粒缓冲液稀释重悬到0.5mg/ml,完成磁分离试剂的制备。
[0124]
本实施例的预激发液的制备方法为:将0.8l 纯化水、4.862ml浓硝酸和5.46ml30%双氧水依次加入1l 避光广口玻璃容器中,加纯化水定容至1l,搅拌混匀后,过滤得预激发液;其ph 为1.10,其中各组分的浓度为:硝酸:0.07m;过氧化氢:0.6%;本实施例制备激发缓冲液的方法为:将0.8l 纯化水、4.82g 十六烷基三甲基溴化铵依次加入到1l 广口玻璃容器中,搅拌至固体完全溶解,加入28.056g 氢氧化钾,搅拌至完全溶解后,加纯化水定容至1l,过滤得激发缓冲液;以上方法制备缓冲液b 的ph 为13.5,其中各组分的浓度如下:氢氧化钾:0.5m;十六烷基三甲基溴化铵:0.478wt%。
[0125]
实施例5:试剂盒的使用方法检测流程如下:
1、可溶性endoglin 蛋白(endoglin 抗体)定量检测试剂盒的使用方法如下:1)加25ul 校准品、质控品或待测标本至检测管中;2)加50ul 第二endoglin 抗体-磁微粒至检测管中;3)加50ul 第一endoglin 抗体吖啶酯至检测管中;4)混匀后,37
±
0.5℃温育30 分钟;5)加450ul 清洗液至检测管中,混匀;6)磁分离去上清;7)重复步骤5、6,四遍;8)加100ul 预激发液a 及100ul 激发液b 至检测管中;9)9、2s 后检测发光强度。
[0126]
2、svegfr2定量检测试剂盒的使用方法如下:1)加25ul 校准品、质控品或待测标本至检测管中;2)加50ul 第二svegfr2 抗体-磁微粒至检测管中;3)加50ul 第一svegfr2 抗体-吖啶酯至检测管中;4)混匀后,37
±
0.5℃温育30 分钟;5)加450l 清洗液至检测管中,混匀;6)磁分离去上清;7)重复步骤5、6,四遍;8)加100ul 预激发液a 及100ul 激发液b 至检测管中;9)2s 后检测发光强度。
[0127]
3、rbp4定量检测试剂盒的使用方法如下:10) 加25ul 校准品、质控品或待测标本至检测管中;11) 加50ul 第二rbp4 抗体-磁微粒至检测管中;12) 加50ul 第一rbp4 抗体-吖啶酯至检测管中;13) 混匀后,37
±
0.5℃温育30 分钟;14) 加450l 清洗液至检测管中,混匀;15) 磁分离去上清;16) 重复步骤5、6,四遍;17) 加100ul 预激发液a 及100ul 激发液b 至检测管中;18) 9、2s 后检测发光强度。
[0128]
采用本专利的endoglin、svegfr2、rbp4 三种试剂盒分别检测先兆子痫组以及正常妊娠组血清中endoglin、svegfr2、rbp4 三种血清标志物的含量,并进行数据分析和比对,从而得出比值,以验证其对于预测先兆子痫发病率的特异性和敏感性。
[0129]
本发明包括,但不限于以下技术方案:项目1. 生物标志物群组,包括endoglin,svegfr2和rbp4。
[0130]
项目2. 项目1的生物标志物群组,用于患病风险预测或评估或疾病诊断,优选用于先兆子痫相关状况评估,更优选用于先兆子痫风险预测或评估或先兆子痫诊断。
[0131]
项目3. 试剂盒或设备,包括用于检测受试者样品中生物标志物群组中的生物标志物表达量的检测试剂,所述生物标志物群组包括endoglin,svegfr2和rbp4。
[0132]
项目4. 项目3的试剂盒或设备,其中所述生物标志物群组用于患病风险预测或评估或疾病诊断,优选用于先兆子痫相关状况评估,更优选用于先兆子痫风险预测或评估或先兆子痫诊断。
[0133]
项目5. 筛选用于先兆子痫风险预测或评估或先兆子痫诊断的生物标志物群组的方法,包括以下步骤:1)检索获得与先兆子痫相关的候选生物标志物;2)在受试者的样品中进一步确认表达量发生变化的所述候选生物标志物;3)与所述受试者的临床信息比对,通过构建公式,计算先兆子痫风险分数;4)选取先兆子痫风险模型表现最好的分界值作为阈值;5)当先兆子痫风险分数高于阈值时,经验证临床性能好的候选生物标志物的组合确定为生物标志物群组。
[0134]
项目6. 项目5的方法,其中所述生物标志物群组包括endoglin,svegfr2和rbp4。
[0135]
项目7. 预测受试者是否有患先兆子痫的风险的方法,包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即预测受试者有患先兆子痫的风险。
[0136]
项目8. 评估受试者患先兆子痫的风险高低的方法,包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,则分数越高,受试者患先兆子痫的风险也越高。
[0137]
项目9. 诊断受试者是否患有先兆子痫的方法,包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即诊断受试者患有先兆子痫。
[0138]
项目10. 包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志物群组中的生物标志物特异性结合的检测试剂在制备用于预测受试者是否有患先兆子痫的风险的试剂盒或设备中的用途,所述预测包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即预测受试者有患先兆子痫的风险。
[0139]
项目11. 包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志
物群组中的生物标志物特异性结合的检测试剂在制备用于评估受试者患先兆子痫的风险高低的试剂盒或设备中的用途,所述评估包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,则分数越高,受试者患先兆子痫的风险也越高。
[0140]
项目12. 包括endoglin,svegfr2和rbp4的生物标志物群组,或者与所述生物标志物群组中的生物标志物特异性结合的检测试剂在制备用于诊断受试者是否患有先兆子痫的试剂盒或设备中的用途,所述诊断包括:1)在所述受试者的样品中,确定包括endoglin,svegfr2和rbp4的生物标志物的表达量;2)基于所述生物标志物的表达量,利用公式计算先兆子痫风险分数;3)将所述先兆子痫风险分数与阈值比较,如果高于阈值,即诊断受试者患有先兆子痫。
[0141]
项目13. 项目3-12任一项的试剂盒或设备、方法或用途,其中所述样品是体液样品,优选血液、血清或血浆样品。
[0142]
项目14. 项目3-13任一项的试剂盒或设备、方法或用途,其中所述生物标志物的表达量是蛋白水平或核酸水平的表达量。
[0143]
项目15. 项目3-14任一项的试剂盒或设备、方法或用途,其中所述受试者是怀孕受试者,孕周在6周到40周,例如6周到13周,例如11周到13周,例如20周到40周,例如23周到33周,例如34周到40周。
[0144]
项目16. 项目15的方法或用途,其中所述怀孕受试者的孕周在6周到13周,例如11周到13周。
[0145]
项目17. 项目15的方法或用途,其中所述先兆子痫是早产型子痫前期。
[0146]
项目18. 项目16或17的方法或用途,其中所述公式为,或其结果的任意的简单调整,其中α介于-5.487与-1.261之间,β1介于0.041与0.304之间,β2介于0.001与0.086之间,β3介于0.025与0.172之间。
[0147]
项目19. 项目18的方法或用途,其中所述阈值介于0.350与0.394之间,或因公式的简单调整使其产生的任意的简单调整。
[0148]
项目20. 项目16或17的方法或用途,其中所述公式为,或其结果的任意的简单调整。
[0149]
项目21. 项目20的方法或用途,其中所述阈值为0.379,或因公式的简单调整使其产生的任意的简单调整。
[0150]
项目22. 项目15的方法或用途,其中所述怀孕受试者的孕周在20周到40周。
[0151]
项目23. 项目22的方法或用途,其中所述公式为,或其结果的任意的简单调整,其中α介于-1.537与-1.399之间,β1介于0.129与0.403之间,β2介于-0.163与-0.004之间,β3介于-0.029与0.000之间。
[0152]
项目24. 项目22或23的方法或用途,其中所述怀孕受试者的孕周在23周到33周。
[0153]
项目25. 项目22或23的方法或用途,其中所述先兆子痫是早发型子痫。
[0154]
项目26. 项目24或25的方法或用途,其中所述阈值介于0.550与0.781之间,或因公式的简单调整使其产生的任意的简单调整。
[0155]
项目27. 项目24或25的方法或用途,其中所述公式为,或其结果的任意的简单调整。
[0156]
项目28. 项目27的方法或用途,其中所述阈值为0.761,或因公式的简单调整使其产生的任意的简单调整。
[0157]
项目29. 项目22或23的方法或用途,其中所述怀孕受试者的孕周在34周到40周。
[0158]
项目30. 项目22或23的方法或用途,其中所述先兆子痫是晚发型子痫前期。
[0159]
项目31. 项目29或30的方法或用途,其中所述阈值介于0.556与0.773之间,或因公式的简单调整使其产生的任意的简单调整。
[0160]
项目32. 项目29或30的方法或用途,其中所述公式为,或其结果的任意的简单调整。
[0161]
项目33. 项目32的方法或用途,其中所述阈值为0.723,或因公式的简单调整使其产生其任意的简单调整。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。