一种超声结合酶交联协同制备高持水性大豆蛋白冷凝胶工艺
1.本发明涉及食品加工技术领域,具体提供一种超声结合酶交联协同制备高持水性大豆分离蛋白凝胶的制备方法。
背景技术:
2.大豆分离蛋白(spi)是从大豆低温脱脂豆粕中提取的一种蛋白质含量不低于90%的混合蛋白,其主要由7s(β-伴大豆球蛋白)和11s(大豆球蛋白)两种球形蛋白组成,因其基本氨基酸组成均衡,具有良好的营养特性和应用价值,被广泛应用于食品行业。凝胶性是spi的重要性质,由于其凝胶具有高营养、高生物相容性等优点,在食品领域具有营养补充,包埋递送风味物质、活性物质等多种应用。但纯大豆分离蛋白凝胶具有力学性能不足、溶解性差等多种问题,制约了大豆蛋白凝胶在食品领域的应用。spi的凝胶性可以通过改性得到改善,这对大豆分离蛋白在食品行业和非食品行业领域的应用具有一定的意义。
3.目前有多种技术用于提升spi的凝胶性。按照改性机理不同可分为物理改性,化学改性和酶改性三种方式。超声波作为物理改性方式的一种,具有很多优点。如绿色安全、食品成分破坏减少、副产品少和操作简单。超声波可以在极短的时间内,产生高温、高压和高频波段,使蛋白分子展开,使紧密的分子结构变得疏松,包埋在内部的基团移动到蛋白表面,导致功能性质发生变化。尽管超声处理对大豆蛋白的凝胶特性有一定提高作用,但单一的改性方式对蛋白功能特性的提升效果有限。酶改性作为主要生物改性手段,通过对蛋白质肽链的水解作用,改变其分子结构,从而达到改善蛋白质功能特性的方法。酶改性法可以最大程度地保留蛋白质的原有营养,反应控制较简单、条件温和,且改性效果明显。
4.目前,单一改性方式对大豆分离蛋白结构和tg酶交联大豆分离蛋白凝胶特性影响的研究很多,但单一的改性方式对蛋白功能特性的提升效果有限,而超声联合酶改性对tg酶交联大豆分离蛋白凝胶特性影响在现阶段研究较少,商业化程度也较低。
技术实现要素:
5.针对现有技术不足,本发明提供一种超声结合酶交联协同制备高持水性大豆蛋白冷凝胶制备方法,利用超声与tg酶联合处理改善大豆分离蛋白凝胶特性,克服现有技术的不足,为大豆分离蛋白凝胶的制备提供新技术。该凝胶具有凝胶网络结构均匀致密,工艺简单,成本低的特点。
6.为实现以上目的,本发明的技术方案通过以下技术方案予以实现:
7.(1)将大豆分离蛋白分散于蒸馏水中,室温下搅拌制备大豆分离蛋白分散液;
8.(2)将分散液在一定超声功率下处理进行改性处理,冻干并保存;
9.(3)将上述样品分散于蒸馏水中,搅拌使其充分溶解,加入tg酶,搅拌均匀;
10.(4)将上述处理后的溶液进行加热、冷却、储藏、静置,获得本发明超声结合酶交联协同制备高持水性大豆蛋白冷凝胶产品。
11.优选的,步骤(1)中将大豆分离蛋白分散于蒸馏水中,液料比为10ml/g,室温下搅拌2h制备大豆分离蛋白分散液。
12.优选的,步骤(2)中将分散液在功率300-500w下超声处理20min,然后在ph为7.0、温度50℃条件下进行改性处理。
13.优选的,步骤(3)中样品和蒸馏水的比例为1:10,tg酶用量为15-25u/g。
14.优选的,步骤(4)中将上述处理后的溶液置于50℃下加热45min,采用冰水浴冷却到室温。
15.优选的,步骤(4)中将样品放置在4℃条件下静置12h,制成凝胶。
16.本发明提供一种超声结合酶交联协同制备高持水性大豆蛋白冷凝胶制备方法,与现有技术相比优点在于:
17.(1)tg酶是凝胶中常用的食品添加剂,本发明采用tg酶催化大豆分离蛋白交联,将酶肽链上谷氨酰残基的γ-酰基,与赖氨酸上的ε-氨基、伯氨基和水交联,从而改善其蛋白凝胶的结构稳定性,提高凝胶的致密度和持水性。(2)本发明运用超声联合tg酶交联协同制备大豆分离蛋白冷凝胶,可以有效改变大豆分离蛋白的凝胶性。获得的凝胶强度和持水性得到显著提高,超声处理使蛋白结构展开,有利于tg酶的交联作用,形成均匀致密的凝胶结构。(3)本发明的方法能够更好地对大豆分离蛋白凝胶复合物更深地认识,对进一步了解超声联合酶改性对tg酶交联大豆分离蛋白凝胶特性有着重要的理论指导意义,为食品工业应用大豆分离蛋白以及改善大豆分离蛋白凝集性质提供了新的思路。
具体实施方式
18.为使本发明实施例的目的、技术方案和优点更加清楚,下面结合本发明实施例对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
19.实施例1:
20.(1)将大豆分离蛋白分散于蒸馏水中(液料比为10ml/g),室温下搅拌2h制备大豆分离蛋白分散液;
21.(2)将分散液在功率300w下超声处理20min,然后在ph为7.0、50℃条件下进行改性处理,冻干并保存;
22.(3)将上述样品分散于蒸馏水中(液料比10ml/g),搅拌使其充分溶解,加入tg酶(20u/g),搅拌均匀。
23.(4)将上述处理后的溶液置于50℃下加热45min,取出冷却至室温,将样品放置在4℃条件下静置12h,制成凝胶。
24.实施例2:
25.(1)将大豆分离蛋白分散于蒸馏水中(液料比为10ml/g),室温下搅拌2h制备大豆分离蛋白分散液;
26.(2)将分散液在功率400w下超声处理20min,然后在ph为7.0、50℃条件下进行改性处理,冻干并保存;
27.(3)将上述样品分散于蒸馏水中(液料比10ml/g),搅拌使其充分溶解,加入tg酶(20u/g),搅拌均匀。
28.(4)将上述处理后的溶液置于50℃下加热45min,取出冷却至室温,将样品放置在4
℃条件下静置12h,制成凝胶。
29.实施例3:
30.(1)将大豆分离蛋白分散于蒸馏水中(液料比为10ml/g),室温下搅拌2h制备大豆分离蛋白分散液;
31.(2)将分散液在功率300w下超声处理20min,然后在ph为7.0、50℃条件下进行改性处理,冻干并保存;
32.(3)将上述样品分散于蒸馏水中(液料比10ml/g),搅拌使其充分溶解,加入tg酶(25u/g),搅拌均匀。
33.(4)将上述处理后的溶液置于50℃下加热45min,取出冷却至室温,将样品放置在4℃条件下静置12h,制成凝胶。
34.实施例4:
35.一种超声结合酶交联协同制备高持水性大豆蛋白冷凝胶制备方法,包括以下步骤:测定实施例1~3大豆分离蛋白凝胶性能,具体步骤如下:
36.(1)凝胶强度测定:将凝胶切成圆柱形(直径20mm、高度10mm),利用ta-xt型质构仪测定样品的凝胶强度。使用p/36r型探头,触发力0.0294n,下降高度10mm,测前速度为5.0mm/s,测试速度1.0mm/s,测后速度5.0mm/s。
37.(2)凝胶持水性测定:,将10g的蛋白凝胶置于50ml离心管中,并在4℃下以8000
×
g离心15min,记录离心管的重量m0,离心管和离心前凝胶样品重量m1与离心管和离心后凝胶样品重量m2。whc表示为凝胶重量的百分比离心后相对于初始凝胶的重量。持水率计算公式为:
[0038][0039]
对照组:未经处理的大豆分离蛋白凝胶
[0040]
结果如下表所示:
[0041]
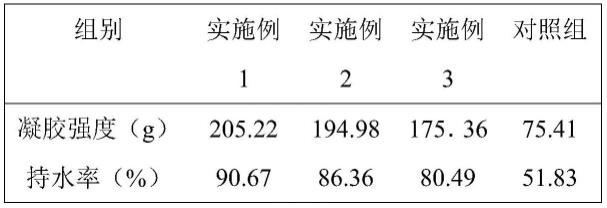
表1各实施例的理化指标比较
[0042][0043]
综合表1可以看出,spi通过tg酶交联形成蛋白酶促凝胶,超声功率及tg酶添加量不同,spi形成酶促凝胶的凝胶强度也不相同。当超声功率从300w提高到400w时,凝胶强度和持水率分别下降了5.25%和4.99%,当tg酶添加量从20u/g增加至25u/g时,凝胶强度和持水率分别下降了17.03%和12.65%,这说明与超声相比,tg酶添加量对凝胶强度和持水率的影响较高。相较于未经处理的spi凝胶,tg酶诱导的经超声处理的spi凝胶强度和持水率分别提升了172.11%、158.45%、132.54%、和74.94%、66.62%、55.30%,这是由于超声处理产生的空化效应使spi结构展开,粒径减小,活性基团暴露在分子表面,从而使spi在tg酶的交联作用下形成的凝胶结构孔洞变小,从而使凝胶强度和持水性升高,形成表面光滑、
均匀致密的凝胶结构。
[0044]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
