灰树花多糖f2在制备肠道益生元中的应用
技术领域
1.本发明涉及生物医药领域,具体涉及灰树花多糖f2在制备肠道益生元中的应用。
背景技术:
2.肠道微生物发酵转化生成为短链脂肪酸(short-chain fatty acids,scfa),如丁酸、丙酸和乙酸。scfas能够给肠道上皮细胞提供能量,维持水电解质的平衡,还具有调节肠道菌群平衡,改善肠道功能,以及抗病原微生物、抗炎、抗肿瘤、预防肥胖、预防非酒精性脂肪肝(nafld)和预防二型糖尿病(t2dm)方面具有重要作用。其中,丁酸能够为肠道上皮细胞提供近60%至70%的能量,具有促进肠道内葡萄糖的生成,参与肠道内糖代谢,维持能量稳态的作用;丙酸能够参与并调节胆固醇的合成,减少促炎因子的产生,减轻结肠细胞的dna损伤,还可以同肝脏中的脂肪酸受体相互作用从而调节葡萄糖的产生;乙酸是肠道主要代谢物之一,可直接刺激神经系统降低食欲,预防肥胖相关的高胰岛素血症和高甘油三酯血症。大量的证据表明,增加scfas的产生有利于宿主发挥抗肥胖和抗糖尿病作用。
3.由于道德伦理、人体或动物自身体系、实验条件、耗时费用等因素的限制,建立体外消化模拟体系十分必要。已有大量的胃肠道模拟系统用于研究经口服后食物成分的结构变化、消化率和释放情况。体外发酵是研究不同底物对肠道菌群生长影响的有效工具。肠道微生物的体外模拟发酵系统的最大的特点就是能够模拟肠道微生物在宿主体内的发酵。作为体外发酵系统,自然就避免人体吸收微生物代谢产物的影响,从而能够直接获得反映肠道微生物的代谢状况的数据。体外培养模型的主要用途是在可控的ph、温度和底物浓度等条件下对分离出来的肠道菌群进行培养,用于底物调控肠道菌群代谢等相关研究。分批静态培养通常为添加一定量的培养基培养单一细菌或者混合菌群,培养过程中发酵罐封闭厌氧,并无新的底物添加,发酵周期通常较短。分批培养模型通常被用于研究发酵底物对肠道微生物的生理状态和生物多样性的影响,以及肠道微生物对于底物的消化吸收情况。这个模型适用于考察使用不同剂量或者类型的生物活性物质时,个体之间表现的差异性。另外,分批培养模型可以通过考察微生物生长过程中的代谢物类型,来帮助阐明代谢通路的形成方式,但由于培养过程中底物的消耗及次级代谢产物的积累改变了微生物初始培养条件,长时间体外分批培养将影响与体内肠道菌群生长特性的相关性。
技术实现要素:
4.本发明的目的是提供灰树花多糖f2在制备肠道益生元中的应用。
5.本发明另外还提供了一种肠道益生元,其含有灰树花多糖f2。
6.优选,灰树花多糖f2在制备促进肠道内短链脂肪酸生成的制剂中的应用。
7.优选,所述的短链脂肪酸是乙酸、丙酸和/或丁酸。
8.本发明通过实验发现,肠道菌群利用灰树花多糖f2产生了大量的短链脂肪酸,例如乙酸、丙酸和/或丁酸,丁酸能够为肠道上皮细胞提供近60%至70%的能量,具有促进肠道内葡萄糖的生成,参与肠道内糖代谢,维持能量稳态的作用;丙酸能够参与并调节胆固醇
的合成,减少促炎因子的产生,减轻结肠细胞的dna损伤,还可以同肝脏中的脂肪酸受体相互作用从而调节葡萄糖的产生,因此可以用于制备肠道益生元。
附图说明:
9.图1是发酵不同时间的hpgpc图谱,从上至下分别是0、6、12、24、48h;
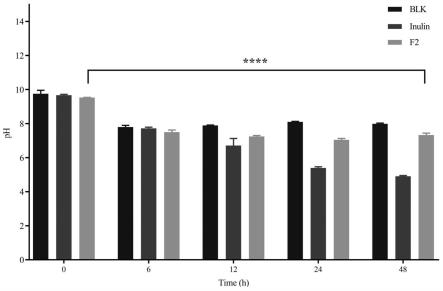
10.图2是灰树花多糖组分f2酵解产物中ph值变化,每组柱子从左至右分别是blk、inulin(菊糖,下同)、f2,注:0h和48h,ph值差异有统计学意义,
*
p《0.05、
**
p《0.01、
***
p《0.001、
****
p《0.0001。
11.图3是总糖含量变化,每组柱子从左至右分别是blk、inulin、f2,注:0h和48h,ph值差异有统计学意义,
*
p《0.05、
**
p《0.01、
***
p《0.001、
****
p《0.0001;
12.图4是还原糖含量变化,每组柱子从左至右分别是blk、inulin、f2,注:0h和48h,ph值差异有统计学意义,
*
p《0.05、
**
p《0.01、
***
p《0.001、
****
p《0.0001;
13.图5是灰树花多糖发酵产物单糖组成变化,从下至上分别是0、6、12、24、48h和standard monosaccharides;
14.图6是在不同时间点各组酵解产物中scfa含量的变化,注:0h和48h,多糖f2组与blk组比较,乙酸、丙酸和丁酸含量,差异有统计学意义,
*
p《0.05、
**
p《0.01,其中(a)、(b)和(c)的每组柱子从左至右分别是blk、inulin、f2;(d)中三组柱子从左至右分别是blk、inulin、f2。
具体实施方式:
15.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
16.实施例1:
17.1、实验方法
18.1.1粪便样品的收集及处理
19.从3名健康志愿者身上收集新鲜的人类粪便(2女1男),志愿者在过去3个月内未服用任何抗生素。刮取3名健康志愿者的新鲜粪便,取中间未被污染的部分,装入15ml无菌离心管中,立即加入无菌磷酸盐缓冲溶液(0.1mol/l,ph=7.2)中,得到粪便固液混合物(10%,w/v),均质1min,离心(4℃,500
×
g,5min),取上清液,得到粪菌菌液。粪便浆的制备过程在低温环境中进行,要求不超过15min。该实验已经得到伦理许可。
20.1.2灰树花多糖f2的体外粪菌发酵实验
21.体外发酵灰树花多糖f2方法参考相关文献(liu et al.,2020;zhou et al.,2018或cn201310733480.8)。
22.(1)培养基的配制。制备基本营养生长培养基:2.0g/l酵母提取物,2.0g/l蛋白胨,0.1g/l nacl,0.01g/l mgso4
·
7h2o,0.04g/l kh2po4,0.04g/l k2hpo4,0.01g/l cacl,2g/l nahco3,0.02g/l氯化血红素,0.01g/l刃天青,0.5g/l l-盐酸半胱氨酸,0.5g/l胆汁盐,2.0ml/l吐温80,10μl/l维生素k,其配制方法是将各成分加入到溶剂水中,混合均匀,将配制好的培养基灭菌(121℃,20min),放于超净工作台备用。
23.(2)实验操作步骤。设置共三个组,空白组(blk组):0.5ml粪菌菌液 4.5ml培养基 空白,阳性对照组(inulin组):0.5ml粪菌菌液 4.5ml培养基 菊糖(10mg/ml),实验组(f2
组)0.5ml粪菌菌液 4.5ml培养基 灰树花多糖f2(10mg/ml),总发酵体积为5ml装入锥形瓶,封口,每组3个重复,在37℃恒温厌氧箱进行发酵。在发酵0、6、12、24和48h时间点收集发酵物用于进一步检测指标检测。
24.1.3酵解产物的分子量变化的测定
25.将不同时间点取出的各组酵解产物离心(12000rpm/min,5min),将上清液转移至干净的加盖的离心管中。采用高效凝胶渗透色谱法(hpgpc)测定酵解产物中分子量的分布。
26.1.4酵解产物的ph值变化的测定
27.取1.3中的上清液,ph值由数字酸度计ph计直接进行测定,平行测定三次。
28.1.5酵解产物的多糖和还原糖含量的测定
29.取1.3中的上清液,根据《中华人民共和国农业行业标准ny/t 1676-2008食用菌中粗多糖含量的测定》,采用苯酚-硫酸法测定酵解产物中中多糖含量。采用dns法测定酵解产物中还原糖含量。
30.1.6酵解产物中单糖组成的测定
31.取1.3中的上清液,采用pmp-hplc柱前衍生法测定酵解产物单糖组成的。
32.1.7酵解产物中短链脂肪酸含量的测定
33.酵解产物中短链脂肪酸含量的测定采用气相色谱法(gc),参照张俊楠的方法并有微小的改动(张俊楠,2018)。
34.(1)样品预处理。取1.3中的上清液,吸取上清液1ml,加入100ul磷酸溶液,涡旋振荡,加入1ml乙醚萃取,涡旋3min,4℃离心10min(8000r/min,1min),取上层有机相,加入800ul乙醚提取,再次涡旋、离心,重复5次,挥干萃取液乙醚,复溶于100μl乙醚,过0.22μm滤膜,用于gc-2010plus检测。
35.(2)标准曲线的配制。准确吸取挥发性游离酸混合物标准品,配制成0、0.625、1.25、2.50、5.00、10.00mmol/l的标准溶液,使用0.22μm滤膜过滤后用于gc-2010plus测定,建立以标准酸浓度为横坐标和以峰面积为纵坐标的标准曲线。
36.(3)气相色谱条件。柱子:agilent毛细管色谱柱hp-innowax(30m
×
0.25mm
×
0.5μm);载气:1ml/min,氮气;进样量:2μl,不分流;升温程序:起始温度为65℃,保持3min,然后45℃/min升温至200℃,保持2min,继续15℃/min升温至230℃,保持2min,;fid检测器:进样口温度220℃。
37.2、实验结果
38.2.1灰树花多糖f2的体外模拟消化及粪菌发酵结果分析
39.2.1.1体外模拟消化的结果和酵解产物中分子量变化分析
40.溶液的配制:
41.唾液电解质:0.7644g nacl、1.491g kcl、0.1332g cacl2溶于1l的蒸馏水中,用1mol/l的hcl和1mol/l的nahco3将ph调至6.9
±
0.05。模拟唾液:0.3450gα-淀粉酶溶解于400ml唾液电解质中,磁力搅拌20min后过滤,滤液中再加入400ml的唾液电解质溶液,混匀。
42.胃电解质:3.19g nacl、1.10g kcl、0.15g cacl 2
h2o、0.60g nahco3、1l去离子水,用0.1mol/l hcl溶液调节胃电解质溶液的ph至3.0
±
0.1。模拟胃液:150ml胃电解质、2ml ch3coona(1mol/l、ph=5)、37.5mg胃蛋白酶,用0.1mol/l hcl溶液调节模拟胃液的ph至3.0
±
0.1。
43.肠电解质:5.40g nacl、0.65g kcl、0.33g cacl 2
h2o、1l去离子水,用1.0mol/l naoh溶液调节ph至7.0
±
0.1。7g/100ml胰酶溶液:胰酶溶于超纯水中,离心(3000
×
g,10min),取上清液。4%胆盐溶液:4g胆盐溶于96ml的超纯水,离心(3500
×
g,10min),取上清液。模拟肠液:50ml肠电解质、100ml的4%胆盐溶液、50ml胰酶溶液、6.5mg胰蛋白酶,混合均匀,用1.0mol/l的naoh溶液调节ph至7.0
±
0.1。
44.配制模拟唾液、胃液和肠液,并且加入灰树花多糖f2溶液(3mg/ml),充分混合后,放至37℃,200rpm摇床反应,以模仿食物在口腔中的温度、时间。于0、5min之后,取其中1.5ml迅速沸水浴灭活10min,准备用于后续指标测定。在结束唾液消化后取5ml用透析袋(500da)进行透析1天,透析袋外溶液收集,用于后续检测是否有单糖生成。剩余的模拟唾液消化液,继续实验。
45.吸取模拟唾液消化后中液体12ml,加入模拟胃液12ml,将上述混合液充分混合后,放至37℃摇床200rpm反应4h,模仿食物在胃中的温度、时间。分别在0、0.5、1、2、4h时取出1.5ml样品迅速沸水浴灭活10min,用于后续指标测定。4h后取出4.5ml溶液用透析袋(500da)进行透析1天,透析袋外溶液收集,用于后续检测是否有单糖生成。剩余的模拟唾液-胃液消化液12ml,继续实验。
46.吸取模拟胃液消化后液体12ml,加入模拟肠液3.6ml,上述混合液充分混合后,放至37℃水浴锅中反应6h,以模仿食物在小肠中的温度、时间。分别在0、0.5、1、2、4、6h时取出1.5ml样品迅速沸水浴灭活10min,用于后续指标测定。6h后取出5ml样品透析(500da)1天,收集透析袋外溶液,用于后续检测是否有单糖生成,剩余的模拟唾液-胃液-肠液进行后续指标测定。
47.通过高效凝胶渗透色谱法(hpgpc法)测定唾液消化产物的分子量分布,发现分子量保留时间,分子量无显著变化,表明唾液可能不消化灰树花多糖f2。
48.仅从多糖的分子量变化来判断其是否被消化是不完全正确的,因为当多糖降解程度不高或只降解一小部分时,hpgpc法不能准确检测到微小的分子量变化。但有研究发现,当多糖降解时,糖苷键会断裂产生还原型末端。因此还需要从消化前后产物还原糖含量的变化来侧面验证多糖是否有降解和糖苷键断裂。因此,通过测定0、5min消化产物还原糖含量,发现还原糖含量几乎无变化,说明无还原糖产生,侧面证明唾液不能消化灰树花多糖f2。多糖水解后生成单糖,对不同时间点唾液消化后的产物按照进行单糖组成的分析,唾液消化后无单糖产生。
49.胃液消化后,分子量分布发生了微小变化,保留时间随时间延长而增加,分子量逐渐减小。还原糖含量较唾液消化时期有增加,侧面证明,多糖连接改变,糖苷键有断裂。分子量和还原糖含量变化说明胃液能够降解少量的灰树花多糖f2。对不同时间点胃液消化产物进行游离单糖检测发现,灰树花多糖f2经胃液消化0、0.5、1、2、4h后胃液消化产物中只含有glc,不含其他单糖。并且glc色谱峰面积随着消化时间的延长,几乎无明显的变化,这表明胃液可能降解灰树花多糖f2,但没有产生游离单糖。游离单糖结果、分子量和还原糖结果说明,灰树花多糖f2经过胃液消化,分子量减小,还原糖含量增加,表明胃液能够降解少部分的灰树花多糖f2。
50.对肠液消化不同时间点的消化产物进行检测,发现在肠液中消化时分子量不再发生变化。还原糖含量先只有较小的变化,无显著性差异,说明灰树花多糖f2在肠液中只微小
的降解并达到消化终点。肠液消化产物游离单糖检测发现肠液消化产物0h本身含有一定量的glu,灰树花多糖f2经胃液消化4h后胃液消化产物中也含有glc,不含其他单糖且几乎无明显的变化,这表明肠液可能使得灰树花多糖f2有微小的降解,但无游离单糖产生。
51.上述模拟消化实验已经证实灰树花多糖f2在人体唾液、模拟胃液和小肠液消中稳定性较好,灰树花多糖f2可到达结肠,但被肠道微生物利用的程度并不清楚。因此,有必要进一步研究灰树花多糖f2的体外酵解特征。
52.首先探究灰树花多糖f2体外酵解过程中其分子量是否发生变化。如图1所示,灰树花多糖f2在hpgpc图谱上的保留时间(11.444min和19.193min)在不同发酵时间内发生明显改变,其对应的信号强度(峰面积)随着发酵时间的延长明显减弱至基本无峰状态。另外,灰树花多糖f2经发酵6、12、24和48h后,在hpgpc图谱上保留时间分别在25.921、26.488min处出现小峰,说明灰树花多糖f2在体外酵解过程中被肠道微生物逐渐酵解为一些低分子量片段。
53.2.1.2酵解产物中ph值变化分析
54.ph值会随着多糖体外发酵过程而变化,侧面印证了发酵过程的发生。ph值变化如图2所示,酵解0~12h,多糖f2酵解后培养物的ph值显著下降(p《0.01),24h之后的酵解过程中ph值有上升。空白组结果与多糖组类似,推测可能是24h后由于营养物质已经耗尽,肠道微生物利用了一部分有机酸后ph值有回升。而阳性对照组由于菊糖含量充足,肠道微生物持续利用菊糖,产生大量的scfa,ph值持续下降并保持在一个酸性环境。
55.2.1.3酵解产物中总糖和还原糖含量测定分析
56.如图3所示,经过48h的体外发酵,多糖中总糖的消耗量达91.61%,多糖f2组多糖含量显著减少,表明在发酵过程中多糖被肠道微生物充分利用。在发酵开始的0~12h,多糖开始被消耗,肠道微生物生长并利用部分多糖;12~24h,发酵液中的总糖含量迅速降低,肠道微生物生长达到较大值,充分、大量地利用多糖;24~48h,多糖的消耗速率变慢肠道微生物生长变缓慢,对多糖的利用也逐渐减少。多糖消耗结果与ph值测定结果一致。
57.如图4所示,经过48h的体外发酵,还原糖含量从0.21
±
0mg/ml下降至0.02
±
0mg/ml,还原糖含量显著下降。0~6h,还原糖含量降低;6~12h,还原糖含量有增加,可能是多糖被酵解,糖苷键断裂会暴露出一些还原端。随后12~24h,还原糖含量继续减少,24~48h,还原糖含量达到稳定状态。
58.多糖含量、还原糖含量的变化表明,在体外发酵过程中,可以推断灰树花多糖f2在体外酵解过程中会被肠道微生物作为酵解反应的底物所利用。
59.2.1.4酵解产物中单糖含量的分析
60.如图5所示,发酵6h后,在发酵产物中检测到glc,随着发酵进行,12h后,glc的含量下降至无法检测。0~48h未能检测到其他单糖产生。在发酵过程中,多糖链接会断裂,有单糖生成。单糖结果分析表明灰树花多糖f2的体外发酵过程中,肠道菌群会将其部分降解成单糖,并且继续利用。
61.2.1.5酵解产物中短链脂肪酸(scfa)含量的变化分析
62.肠道微生物产生的短链脂肪酸能够调节机体,对人体的代谢产生影响,对肠道疾病、维持机体肠道环境稳态意义重大。取样的人体新鲜粪便含有丰富的肠道菌群,并且体外发酵实验是在厌氧环境下,模拟肠道菌群在人体肠道环境。研究表明,细菌在厌氧环境下可
以利用多糖产生短链脂肪酸,并且发酵产酸能力与作为底物的多糖的种类相关(yang et al.,2013)。
63.如图6所示,随着体外发酵进行,能够明显观察到灰树花多糖组分f2组的短链脂肪酸含量明显提高,具体数值见表1。灰树花多糖组分f2组中,丙酸浓度最高,其次是乙酸和丁酸。在12~48h内,丙酸含量显著性增加。体外发酵实验结束后,灰树花多糖组分f2组的丙酸浓度从0.05
±
0.05mmol/l增加到12.30
±
6.64mmol/l,乙酸浓度从0.84
±
0.31mmol/l增加到7.00
±
4.35mmol/l,丁酸浓度从0.20
±
0.04mmol/l增加到0.30
±
0.13mmol/l,具有显著性。这与ph值的变化也是基本一致的。
64.表1灰树花多糖实验组、空白对照和阳性对照组发酵产物中scfa的含量
[0065][0066][0067]
注:0h和48h,多糖f2组与blk组比较,乙酸、丙酸和丁酸含量,差异有统计学意义,
*
p《0.05、
**
p《0.01。
[0068]
综上所述,灰树花多糖f2组在体外发酵过程中,肠道菌群利用了多糖,并且产生了大量的短链脂肪酸。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。