一种筛选并富集神经节苷脂抗原特异性b细胞方法和装置
技术领域
1.本发明涉及生物医药领域,特别涉及一种筛选并富集神经节苷脂抗原特异 性b细胞的方法和装置。
背景技术:
2.吉兰巴雷综合征(guillain-barre syndrome,gbs)系一类免疫介导的急性 炎性周围神经病,是引起急性对称性迟缓性麻痹最常见的原因。该病具有自限 性,但部分患者会遗留较严重的后遗症影响生活质量,重症患者可累及呼吸肌 诱发呼吸衰竭而死亡。已明确神经节苷脂抗体在gbs发病中有重要作用,神经 节苷脂抗体与周围神经细胞膜上的神经节苷脂发生交叉性免疫反应可以引起周 围神经损伤。神经节苷脂一种具有唾液酸的糖脂,在人和哺乳动物的神经组织 中含量丰富,尤其在周围神经的轴索上。gm1是神经节苷脂重要的亚型之一,常 常用于神经节苷脂的研究,gm1被b细胞抗原受体(b-cell receptor,bcr)而非t 细胞抗原受体识别,因此本发明所述的gm1抗原特异性细胞为gm1抗原特异性b 细胞。在健康人群中,由于机体对自身抗原存在免疫耐受,gm1抗原特异性b 细胞表达抑制性受体或存在抑制性信号传导通路,bcr结合自身抗原gm1后细 胞不能被正常激活、分化、增殖,成为分泌gm1抗体的致病性浆细胞。如果这 种免疫耐受机制被打破,gm1抗原特异性b细胞数量或者功能异常,机体就会 产生高亲和力的gm1抗体损伤周围神经,引起gbs。因此,研究gm1抗原特 异性b细胞,对于探索gbs的发病机制以及筛选阻断gm1抗体产生的作用靶 点从而治疗gbs有着重要意义。另外,由于gm1抗体在gbs发病机制探索领 域的应用,使其制备生产具有重要价值,gm1抗原特异性b细胞具有分化成为 分泌gm1抗体的浆细胞的潜能,优化gm1抗原特异性b细胞筛选富集方法有 助于提高gm1单克隆抗体制备效率。
3.目前尚没有文献报道简单可行的标记神经节苷脂抗原特异性b细胞以及高 效筛选并富集神经节苷脂抗原特异性b细胞的方法。建立一种高效筛选并富集 神经节苷脂抗原特异性b细胞的方法,有助于后续研究者在获得目的细胞的基 础上,深入展开争对gbs发病机制的多种研究,例如对比分析健康人群及gbs 患者的gm1抗原特异性b细胞数量、功能、亚群(初始b细胞、记忆b细胞、 浆母细胞等)、转录组学、蛋白组学、单细胞测序等等。传统的gm1单克隆抗 体制备中常常通过无限稀释法或者显微镜下逐一手动挑选单个细胞的方式来获 得gm1抗原特异性b细胞,该过程耗时长,效率低,过程繁琐。建立一种高效 并富集神经节苷脂抗原特异性b细胞的方法,可以快速获得的高纯度的gm1抗 原特异性b细胞,简化传统gm1单克隆抗体制备的流程,缩短抗体制备的周期 并提高生产效率,通过单b细胞技术,从gm1抗原特异性b细胞中扩增igg 重链和轻链可变区基因,然后在哺乳动物细胞内表达获得具有生物活性的单克 隆抗体,保留了重链和轻链可变区的天然配对,具有基因多样性好、效率高、 全天然源性的特点。
4.gm1抗原特异性b细胞在外周血b细胞库中比例小于1%,因而直接研究 它们在免疫反应发展过程中的状态变化存在困难。从血液或者脾脏筛选富集这 群罕见细胞存在一定技术难度,以前,研究人员使用抗原包被板或抗原吸附柱, 或者抗原包被红细胞重置等
30min,溶液体积为每107个pbmc加入1ml biotin-gm1与sp-af647混合液。
18.将所述细胞洗涤后,取1
×
106个细胞用于流式细胞仪验证gm1抗原特异性 b细胞的比例,剩余细胞用于后续实验;
19.对于对照组,还包括:
20.省略biotin-gm1与streptavidin-alexa fluor 647孵育步骤,直接将 streptavidin-alexa fluor 647与pbmc共同孵育,条件相同,明确偶联荧光的非 gm1抗原特异性细胞的比例,即非特异性荧光染色比例;
21.对于竞争组,还包括:
22.将浓度大于biotin-gm1 50-100倍的gm1提前与pbmc细胞共同孵育,洗 涤后再将细胞与biotin-gm1与streptavidin-alexa fluor 647混合液孵育,操作同 步骤3,探索gm1是否可以与biotin-gm1竞争结合gm1抗原特异性b细胞的 bcr,进一步明确gm1抗原特异性b细胞的抗原特异性。
23.可选的,所述将步骤一中所述的细胞进行洗涤、离心以及过滤包括:
24.将实验组处理后的细胞离心后用80ul缓冲液(automacs running buffer)重 悬,添加20ul偶联alexa fluor 647抗体的磁珠,混悬后4℃避光孵育30min;
25.洗涤、离心细胞,重悬于500ul缓冲液中;
26.细胞悬液用30um的尼龙网过滤。
27.可选的,所述筛选得到gm1抗原特异性细胞包括:
28.将细胞悬浮液全部添加于置于macs分选器的ms分选柱或者ls分选柱 (下面以ms柱子为例,用前加500ul缓冲液润洗柱子),macs分选器置于磁 场,用500ul缓冲液洗涤3次,洗涤液中为未标记的非gm1抗原特异性细胞, 收集洗涤液用于后续流式检测对照;
29.将ms分选柱移除的macs分选器置于15ml离心管,加入1ml缓冲液于分 选柱中,快速将柱塞推入分选柱,立即冲洗出磁性标记的细胞
30.可选的,所述方法还包括:
31.重复执行所述筛选得到gm1抗原特异性b细胞的步骤。
32.另一方面,提供了一种筛选并富集神经节苷脂抗原特异性b细胞装置,所 述装置包括处理器与存储器,所述存储器用于存储一组程序代码,所述处理器 调用所述存储器所存储的程序代码用于实现权利要求1至5任一所述的方法。
33.本发明实施例提供的技术方案带来的有益效果是:
34.通过生物素与链霉亲和素具有高亲和力的原理,实现了对gm1抗原特异性 b细胞的荧光标记。通过macs分选器的磁场效应,alexa fluor 647抗体偶联 的磁珠与alexa fluor 647荧光标记的细胞悬浮液加入置于磁场的分选柱,用缓 冲液冲洗分选柱,所有未标记的细胞(非gm1抗原特异性细胞)被冲洗掉,标 记的gm1抗原特异性细胞留在分选柱上,将分选柱移出磁场再用缓冲液快速冲 出细胞,即可获得gm1抗原特异性b细胞。macs操作在10分钟左右即可完 成,操作简单快速,得到的gm1抗原特异性b细胞纯度高、回收率高,富集细 胞较未富集细胞纯度可提高50-100倍,获得的目的细胞无损伤、有活力。
附图说明
35.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所 需要
使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明 的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下, 还可以根据这些附图获得其他的附图。
36.图1是本发明实施例提供的原理示意图;
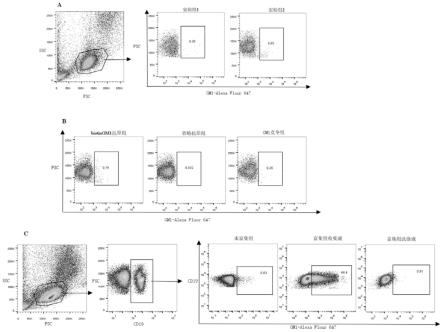
37.图2是本发明实施例提供的流式鉴定gm1抗原特异性细胞比例图,其中, 图2a:2种荧光标记方案gm1结合细胞占淋巴细胞的比例;图2b:3组实验 (添加biotin-gm1、省略biotin-gm1、gm1竞争biotingm1)gm1结合细胞占 淋巴细胞的比例;图2c:macs富集前后及macs洗涤液中gm1抗原特异性 b细胞占b细胞的比例。
具体实施方式
38.为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明实施例 中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描 述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中 的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其 他实施例,都属于本发明保护的范围。
39.提供了一种筛选并富集神经节苷脂抗原特异性b细胞方法,方法包括:
40.步骤一、标记并得到gm1抗原特异性b细胞;
41.步骤二、磁珠分选富集gm1抗原特异性b细胞;
42.其中,步骤一中,设置三组实验,分别为实验组:biotingm1抗原组、对照 组:省略biotingm1抗原组、竞争组:gm1竞争biotingm1与bcr结合组,实 验组用于标记gm1抗原特异性b细胞,对照组用于检测非特异性荧光染色比例, 竞争组用于明确gm1抗原特异性b细胞的抗原特异性;
43.步骤二包括:
44.将步骤一中的细胞进行洗涤、离心以及过滤;
45.筛选得到gm1抗原特异性b细胞;
46.可选的,标记并得到gm1抗原特异性b细胞包括:
47.取粉末状biotin-gm1,用dmso溶解成浓度为1ug/ul原液避光保存。
48.用40℃pbs溶液将biotin-gm1配成0.1ug/ml工作液,稀释过程中将液体 涡旋10-15分钟有利于溶解和混匀。
49.将0.1ug/ml biotin-gm1与5ug/ml streptavidin-alexa fluor 6474℃避光孵育 大于3h,让其充分结合。抗原及荧光的最佳浓度通过流式摸索得出,biotin-gm1 抗原浓度过高会使未予streptavidin-alexa fluor 647结合的抗原竞争结合gm1 抗原特异性b细胞,使gm1抗原特异性b细胞的标记率偏低,biotin-gm1抗 原浓度过低会使部分gm1抗原特异性b细胞富余,使gm1抗原特异性b细胞 的标记率偏低;荧光浓度过高,会增强荧光与pbmc的非特异性结合,使gm1 抗原特异性b细胞的标记率偏高,荧光浓度过低,使部分biotin-gm1未予荧光 结合而富余,使gm1抗原特异性b细胞的标记率偏低。
50.将biotin-gm1与streptavidin-alexa fluor 647混合液与pbmc 4℃避光孵育 30min,溶液体积为每107个pbmc加入1ml biotin-gm1与sp-af647混合液。
51.将细胞洗涤后,取1
×
106个细胞用于流式细胞仪验证gm1抗原特异性b 细胞的比例,剩余细胞用于后续实验;
52.对于对照组,还包括:
53.省略biotin-gm1与streptavidin-alexa fluor 647孵育步骤,直接将 streptavidin-alexa fluor 647与pbmc共同孵育,条件相同,明确偶联荧光的非 gm1抗原特异性细胞的比例,即非特异性荧光染色比例;
54.对于竞争组,还包括:
55.将浓度大于biotin-gm1 50-100倍的gm1提前与pbmc细胞共同孵育,洗 涤后再将细胞与biotin-gm1与streptavidin-alexa fluor 647混合液孵育,操作同 步骤3,探索gm1是否可以与biotin-gm1竞争结合gm1抗原特异性b细胞的 bcr,进一步明确gm1抗原特异性b细胞的抗原特异性。
56.可选的,将步骤一中的细胞进行洗涤、离心以及过滤包括:
57.将实验组处理后的细胞离心后用80ul缓冲液(automacs running buffer)重 悬,添加20ul偶联alexa fluor 647抗体的磁珠,混悬后4℃避光孵育30min;
58.洗涤、离心细胞,重悬于500ul缓冲液中;
59.细胞悬液用30um的尼龙网过滤。
60.可选的,筛选得到gm1抗原特异性b细胞包括:
61.将细胞悬浮液全部添加于置于macs分选器的ms分选柱或者ls分选柱 (下面以ms柱子为例,用前加500ul缓冲液润洗柱子),macs分选器置于磁 场,用500ul缓冲液洗涤3次,洗涤液中为未标记的非gm1抗原特异性细胞, 收集洗涤液用于后续流式检测对照;
62.将ms分选柱移除的macs分选器置于15ml离心管,加入1ml缓冲液于分 选柱中,快速将柱塞推入分选柱,立即冲洗出磁性标记的细胞
63.可选的,方法还包括:
64.重复执行筛选得到gm1抗原特异性b细胞的步骤。
65.为了使得本领域技术人员进一步了解本发明所提供的技术方案,下面将结 合附图,对本发明所提供的筛选并富集神经节苷脂抗原特异性b细胞方法进行 进一步的说明:
66.(一)探索gm1抗原特异性b细胞标记方案,该过程可以为:
67.1、样本准备:密度梯度离心法联合红细胞裂解法从人全血标本中提取pbmc。
68.2、设置2组实验,摸索2种荧光标记抗原特异性细胞方案的条件及优劣: 实验组1为biotin-gm1先与pbmc孵育,后与streptavidin-alexa fluor 647孵育; 实验组2为biotin-gm1先与streptavidin-alexa fluor 647孵育,后与pbmc孵育。 biotin-gm1的浓度梯度设置为:100ug/ml、10ug/ml、1ug/ml、0.1ug/ml,0.01ug/ml。 streptavidin-alexa fluor 647的浓度梯度设置为:0.1ug/ml,0.5ug/ml,2ug/ml, 5ug/ml,10ug/ml。biotin-gm1溶解温度设置为室温、40℃、50℃、60℃。 抗原及荧光的最佳孵育条件通过流式摸索获得,biotin-gm1最佳浓度为0.1ug.ml, streptavidin-alexa fluor 647最佳浓度为5ug/ml,biotin-gm1溶解温度为40℃。 实验组1抗原浓度及荧光浓度过高会导致pbmc非抗原特异性荧光标记增强, 使抗原特异性细胞出现假阳性,而抗原及荧光浓度过低会降低抗原特异性细胞 阳性率。实验组2抗原浓度过高会使未予荧光结合的抗原竞争结合抗原特异性 bcr,使抗原特异性细胞的阳性率偏低,抗原浓度过低会使部分抗原特异性细 胞富余,使抗原特异性细胞的阳性率偏低;荧光浓度过高,会增强荧光与pbmc 的非特异性结合,使抗原特异性细胞的阳性率偏高,荧光浓度过低,使部分抗 原未予荧光结合而富余,使抗原特异性细
胞的阳性率偏低。本发明认为实验组2 较实验组1获得的gm1抗原特异性细胞阳性率更高,原因可能是实验组1 biotin-gm1在pbmc悬液里形成脂质体,溶解度较低,减少了gm1与bcr的 结合,biotin-gm1与streptavidin-alexa fluor 647预先孵育后再与pbmc孵育, 形成的biotin-gm1-streptavidin-alexa fluor 647耦合物提高了biotin-gm1的溶解 度,减少了脂质体的形成。实验染色全过程应在4℃或者冰上进行,避免抗原 结合bcr后激活细胞,影响后续的相关实验。
69.3、实验组1:
70.①
取粉末状biotin-gm1,用dmso溶解成浓度为1ug/ul原液避光保存。
71.②
用40℃pbs溶液将biotin-gm1配成0.1ug/ml工作液,稀释过程中将液 体涡旋10-15分钟有利于溶解和混匀。
72.③
将0.1ug/ml biotin-gm1 100ul加入(0.5-1)
×
106个pbmc混匀,4℃ 孵育30min。
73.④
缓冲液洗涤,1500rpm,5min离心pbmc后,加入5ug/ml streptavidin-alexafluor 647 100ul混匀,4℃避光孵育30min。
74.⑤
洗涤、离心,条件同
④
,加入300ul缓冲液重悬pbmc,流式上机检测 (结果见图2a)。
75.4、实验组2:
76.①
biotin-gm1配置方法同实验组1,将0.1ug/ml biotin-gm1与5ug/mlstreptavidin-alexa fluor 6474℃避光孵育大于3h,让其充分结合。
77.②
取100ul biotin-gm1与streptavidin-alexa fluor 647混合液加入(0.5-1)
ꢀ×
106个pbmc混匀,4℃避光孵育30min。
78.③
洗涤、离心,条件同前,加入300ul缓冲液重悬pbmc,流式上机检测(结 果见图2a)。
79.(二)明确gm1抗原特异性b细胞抗原特异性,该过程可以为:
80.1、采用上述实验组2的荧光染色方案标记gm1抗原特异性b细胞进行后 续实验。设置3组实验,分别为实验组:biotingm1抗原组、对照组:省略biotingm1 抗原组、竞争组:gm1竞争biotingm1与bcr结合组,实验组用于标记gm1 抗原特异性细胞,对照组用于检测非特异性荧光染色比例,竞争组用于进一步 明确gm1抗原特异性细胞的抗原特异性。
81.2、实验组:
82.①
biotin-gm1配置方法同前。
83.②
将0.1ug/ml biotin-gm1与5ug/ml sp-af647 4℃避光孵育大于3h,让其 充分结合。
84.③
将biotin-gm1与streptavidin-alexa fluor 647混合液与pbmc 4℃避光 孵育30min,溶液体积为每107个pbmc加入1ml biotin-gm1与streptavidin-alexafluor 647混合液。
85.④
洗涤、离心,条件同前,取1
×
106个细胞用于流式细胞术验证gm1抗原 特异性细胞在淋巴细胞中的比例(见图2b),剩余细胞用于后续实验。
86.3、对照组:省略biotin-gm1与streptavidin-alexa fluor 647孵育步骤,直 接将streptavidin-alexa fluor 647与pbmc共同孵育,条件同实验组,明确偶联 荧光的非抗原
特异性细胞的比例(见图2b)。
87.5、竞争组:将浓度大于biotin-gm1 50-100倍的gm1提前与pbmc细胞共 同孵育,洗涤后再将细胞与biotin-gm1与streptavidin-alexa fluor 647混合液孵 育,条件同实验组,明确gm1与biotin-gm1竞争结合gm1抗原特异性b细胞 的bcr比例(见图2b),证明gm1抗原特异性b细胞的抗原特异性。
88.(三)磁珠分选富集gm1抗原特异性b细胞,该过程可以为:
89.1、将上述实验组处理后的细胞离心后用80ul缓冲液重悬,添加20ul偶联alexa fluor 647抗体的磁珠,混匀后4℃避光孵育30min。
90.2、洗涤、离心细胞,重悬于500ul缓冲液中。
91.3、细胞悬液用30um的尼龙网过滤。
92.4、将细胞悬浮液全部添加于置于macs分选器的ms分选柱或者ls分选 柱(下面以ms柱子为例,用前加500ul缓冲液润洗柱子),macs分选器置于 磁场,用500ul缓冲液洗涤3次,洗涤液中为未标记的非gm1抗原特异性细胞, 收集洗涤液作为对照流式上机检测(见图2c)。
93.5、将ms分选柱移除的macs分选器置于15ml离心管,加入1ml缓冲液 于分选柱中,快速将柱塞推入分选柱,立即冲洗出磁性标记的细胞。
94.6、为了提高gm1抗原特异性b细胞纯度,洗脱的部分可以通过第二个ms 或ls柱子进行富集。使用新的柱子重复上述步骤4-5磁分离过程,其中,该步 骤为可选步骤。
95.7、将上述获得的磁性标记目的细胞用percp-cd19抗体染色后并流式上机 检测(见图2c),获得的目的细胞可用于后续多种实验。
96.针对现有技术缺点,本发明提供了一种结合荧光标记及macs技术高效筛 选并富集gm1抗原特异性b细胞的方法。该方法通过生物素与链霉亲和素具有 高亲和力的原理,首先将用生物素化的gm1(biotin-gm1)与偶联链霉亲和素 的荧光alexa fluor 647(streptavidin-alexa fluor 647)结合,形成biotin-gm1
‑ꢀ
streptavidin-alexa fluor 647耦合物。由于alexa fluor 647分子量小,抗原性弱, 极少与bcr结合,使其成为抗原特异性细胞分选的优选荧光标记物。将 biotin-gm1-streptavidin-alexa fluor 647耦合物与pbmc孵育,带有荧光的gm1 抗原可以与gm1抗原特异性bcr结合,从而实现荧光标记gm1抗原特异性b 细胞(目的细胞)。由于目的细胞在pbmc中含量很低,不利于直接进行后续的 实验研究,例如流式分析目的细胞亚群及功能,目的细胞培养、转录组测序、 单抗制备等,因此采用macs技术来富集纯化目的细胞。macs技术主要组成 成分为macs磁珠、macs分选柱和macs分选器。macs磁珠是与高度特异 性单克隆抗体相偶联的超顺磁化微粒。macs分选柱置于一个永久性磁场— macs分选器中,可以将磁力增强1000倍,足以滞留仅标记极少量磁珠的目的 细胞。将alexa fluor 647抗体偶联的磁珠与alexa fluor 647荧光标记的细胞悬 浮液加入置于磁场的分选柱,用缓冲液冲洗分选柱,所有未标记的细胞(非gm1 抗原特异性细胞)被冲洗掉,标记的gm1抗原特异性b细胞留在分选柱上。将 分选柱从磁场移除,再用缓冲液快速冲洗分选柱,即可获得被标记的gm1抗原 特异性b细胞组分。macs操作在10分钟左右即可完成,操作简单快速,得到 的gm1抗原特异性b细胞纯度高、回收率高,富集细胞较未富集细胞纯度可提 高50-100倍,获得的目的细胞无损伤、有活力,可用于后续从实验室到临床的 多种研究。
97.上述所有可选技术方案,可以采用任意结合形成本发明的可选实施例,在 此不再一一赘述。
98.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的 精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的 保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
