用于治疗和预防前激肽释放酶相关疾患的组合物和方法
1.序列表
2.本技术连同序列表一起以电子格式提交。序列表提供为在2021年3月10日创建的名称为biol0377woseq_st25.txt的文件,所述文件的大小为56kb。电子格式的序列表中的信息以引用的方式整体并入本文中。
技术领域
3.本文提供了施用isis 721744以在有需要的人受试者中改善水肿、减少前激肽释放酶(pkk)rna、减少pkk蛋白和/或降低pkk活性的方法。在某些情况下,方法适用于改善遗传性血管性水肿的至少一种症状。遗传性血管性水肿的此类症状包括但不限于肿胀、恶心、呕吐、瘙痒、头痛、疲劳、腹痛、呼吸短促、鼻炎、过敏反应和支气管收缩。在某些情况下,方法适用于改善黄斑水肿的至少一种症状。黄斑水肿的此类症状包括但不限于视力模糊、水波样视觉、视物变形和视力丧失。
背景技术:
4.前激肽释放酶(pkk)是一种糖蛋白,其由klkb1基因编码,且在激活因子xii后,从其酶原形式裂解成酶形式,称为血浆激肽释放酶(pk)。pk是激肽-激肽释放酶途径的成员,在炎症、血压控制、凝血和疼痛中发挥作用。pk从纤溶酶原生成纤溶酶并从激肽原中释放激肽(例如缓激肽)。此外,pk可以反过来活化fxii,且从而增强缓激肽释放。
5.水肿是一个或多个身体部分,包括四肢、躯干和气道(例如鼻窦、嘴巴、喉咙、肺)肿胀的医学术语。当损伤、炎症或其它疾患(例如低白蛋白、过敏、充血性心力衰竭、糖尿病、基因突变)导致小血管将体液泄漏到附近组织中时,就会出现水肿。存在许多类型的水肿,包括但不限于遗传性血管性水肿(hae)、肺水肿、脑水肿和黄斑水肿。
6.hae是一种罕见的常染色体显性遗传疾病,其特征是复发性和不可预测的肿胀发作,尤其是皮肤、胃系统、口咽组织和喉粘膜,可能危及生命。hae的典型肿胀由回应于接触系统组分控制不足所致的过度缓激肽形成的血管通透性和体液流出局部增加引起。在大多数情况下,hae是由基因serping1的基因突变引起,所述基因编码调节激肽-激肽释放酶途径的c1酯酶抑制剂(c1-inh)。这些基因突变导致c1-inh缺乏(i型hae)或功能障碍(ii型hae)。serping1基因编码c1-酯酶抑制剂(c1-inh)。
7.在罕见的第三种hae,iii型hae(也称为正常水平(nl)-c1-inh-hae)中,患者具有正常水平的功能性c1-inh,并且通常具有明显的临床表现,包括更高频率的面部、咽部和舌头肿胀。iii型hae至少有四种亚型:与fxii基因(f12)中的基因突变(例如thr328lys、thr328arg、thr309lys和thr309arg)相关的亚型,也称为“hae-fxii”;与纤溶酶原基因(plg)中的基因突变(例如lys330glu)相关的亚型,也称为“hae-plg”;与血管生成素-1基因(angpt1)中的基因突变(例如ala119ser)相关的亚型,也称为“hae-angpt1”;以及与f12、plg或angpt1突变无关的亚型,也称为“hae-ui”。
8.黄斑水肿是一种体液聚集在视网膜(包括黄斑)中,导致视力模糊、视物变形或水
波样视觉的疾患。在某些情况下,黄斑水肿会导致部分或完全视力丧失。黄斑水肿可能由眼科手术、黄斑变性、视网膜血管阻塞、眼部感染和眼部炎症引起或与其相关。黄斑水肿通常由糖尿病性神经病变引起,糖尿病性神经病变是糖尿病的一种并发症,特征是视网膜内和/或附近的血管受损和渗漏。与糖尿病性神经病变相关的黄斑水肿被称为糖尿病性黄斑水肿(dme)。dme是糖尿病性视网膜病变患者视力丧失或视力受损的最常见原因。
附图说明
9.图1a显示在向健康志愿者每月给予isis 721744期间的多个时间点,血浆中pkk蛋白的平均浓度相对于基线的百分比变化。
10.图1b显示在向健康志愿者每月给予isis 721744期间的多个时间点,平均血浆酶原活化(血浆生成缓激肽的能力的量度)相对于基线的百分比变化。
技术实现要素:
11.本文提供了用于改善水肿的方法,以及在有需要的人受试者中降低pkk rna、pkk蛋白和/或pkk活性的方法。在某些实施方案中,水肿包括遗传性血管性水肿。在某些实施方案中,水肿包括黄斑水肿。在某些实施方案中,方法包括施用治疗有效量的寡聚化合物。在某些实施方案中,寡聚化合物是isis 721744。在某些实施方案中,治疗有效量在约40mg至约120mg范围内。在某些实施方案中,治疗有效量是约80mg。在某些实施方案中,治疗有效量是约100mg。在某些实施方案中,治疗有效量约每2周施用一次。在某些实施方案中,治疗有效量约每4周施用一次。在某些实施方案中,治疗有效量约每8周施用一次。在某些实施方案中,方法包括约每4周一次施用约80mg isis 721744的负荷剂量,以及随后约每4周一次施用100mg isis 721744的维持剂量。在某些实施方案中,方法包括约每4周一次施用约80mg isis 721744的负荷剂量,以及随后约每8周一次施用80mg isis 721744的维持剂量。在某些实施方案中,方法包括约每2周一次施用约80mg isis 721744的负荷剂量,以及随后约每4周一次施用80mg isis 721744的维持剂量。
具体实施方式
12.应理解,上述一般描述和以下详细描述均仅为示例性和解释性的并且不是限制性的。在本文中,除非另外确切说明,否则单数的使用包括复数。如本文所用,除非另外说明,否则“或”的使用意指“和/或”。此外,术语“包括(including)”以及其它形式,如“包括(includes)”和“包括(included)”的使用不是限制性的。另外,除非另外确切说明,否则如“元件”或“组分”的术语既涵盖包含一个单元的元件和组分,又涵盖包含多于一个子单元的元件和组分。
13.本文所使用的小节标题仅出于组织性目的并且不解释为限制所描述的主题。本技术中引用的所有文献、文献的部分,包括但不限于专利、专利申请、文章、书籍和论文集,特此明确地针对本文所讨论文献的部分以及其整体以引用的方式并入。
14.定义
15.除非提供具体定义,否则本文所述的与分析化学、合成有机化学以及医药化学结合使用的命名法以及其程序和技术是本领域公知和常用的那些。在允许的情况下,在本公
开全文中引用的所有专利、申请、公布的申请和其它出版物和其它数据均以引用的方式整体并入本文中。
16.除非另外指出,否则以下术语具有以下含义:
17.如本文所用,“2
’‑
脱氧核糖核苷”是指包含2
’‑
h(h)脱氧核糖基糖部分的核苷。在某些实施方案中,2
’‑
脱氧核糖核苷是2
’‑
β-d脱氧核糖核苷并且包含2
’‑
β-d-脱氧核糖基糖部分,所述部分具有在天然存在的脱氧核糖核酸(dna)中发现的β-d构型。在某些实施方案中,2
’‑
脱氧核糖核苷可包含经修饰核碱基或可包含rna核碱基(例如尿嘧啶)。
18.如本文所用,“2
’‑
moe”意指2
’‑
och2ch2och3基团代替核糖基糖部分的2
’‑
oh基团。“2
’‑
moe糖部分”是2
’‑
och2ch2och3基团代替核糖基糖部分的2
’‑
oh基团的糖部分。除非另有说明,否则2
’‑
moe糖部分呈β-d构型。“moe”意指o-甲氧基乙基。
19.如本文所用,“2
’‑
moe核苷”意指包含2
’‑
moe糖部分的核苷。
20.如本文所用,“5-甲基胞嘧啶”意指用连接至5位置的甲基修饰的胞嘧啶。5-甲基胞嘧啶是经修饰核碱基。
21.如本文所用,“约”意指所提供值的正负7%。
22.如本文所用,“施用”意指向人受试者提供药剂。
23.如本文所用,关于治疗的“改善”意指至少一种症状相对于不存在治疗时的相同症状的改善。在某些实施方案中,改善是症状的严重性或频率的降低,或症状的严重性或频率的延迟发作或进展减缓。
24.如本文所用,“血管性水肿发作”意指患有hae的受试者的身体部分的肿胀。在某些实施方案中,受试者在肿胀发作时无损伤或感染。如本文所用,“突破性发作”意指当受试者正在接受hae的预防性治疗时发生的血管性水肿发作。
25.如本文所用,“抗水肿剂”意指减轻、改善或预防有需要的受试者的身体部分水肿的药剂。
26.如本文所用,“抗炎剂”意指改善或预防有需要的受试者的炎症状况的药剂。
27.如本文所用,“抗血栓形成剂”意指改善或预防有需要的受试者的血栓形成病症的药剂。
28.如本文所用,“共轭基团”意指直接连接至寡核苷酸的一组原子。共轭基团包括共轭部分和将共轭部分连接至寡核苷酸的共轭接头。
29.如本文所用,“共轭接头”意指单键或原子组,其包含将共轭部分连接至寡核苷酸的至少一个键。在某些实施方案中,共轭接头包含可裂解部分。
30.如本文所用,“共轭部分”意指通过共轭接头连接至寡核苷酸的一组原子。在某些实施方案中,共轭基团包含细胞靶向部分。
31.如本文所用,“剂量”意指所施用的药剂的量。
32.如本文所用,“水肿”意指一个或多个身体部分的肿胀。在某些实施例中,身体部分是四肢,例如手、脚、臂、腿、脸。在某些实施例中,身体部分不是四肢,例如腹部、舌头、眼睛。在某些实施例中,身体部分促进呼吸,例如肺、气管、鼻窦。
33.如本文所用,“pkk rna”是人基因klkb1的rna表达产物。
34.如本文所用,“pkk蛋白”是pkk rna的蛋白表达产物。
35.如本文所用,“pkk活性”是pkk蛋白在活化部分促凝血酶原激酶时间(aptt)测试中
的活性,所述测试表征受试者血液的凝固。来自受试者的测试血浆样品中的pkk活性在aptt测试中如下地分析:通过将测试血浆样品添加到pkk免疫耗竭的对照血浆样品中,并将所得组合样品的凝血(时间)与具有参考量的pkk的一种或多种参考血浆样品进行比较来确定相对pkk活性。
36.如本文所用,“炎症疾患”意指受试者的身体部分变红、肿胀、疼痛、功能障碍或它们的组合的疾患。在某些实施方案中,炎症状况包括身体部位的任何变红(发红)、温度升高(灼热)、肿胀(肿瘤)、疼痛(痛感)或功能丧失。在某些实施方案中,受试者发烧(体温高于37℃)。在某些实施方案中,炎症状况是糖尿病、关节炎、哮喘、肝炎、溃疡性结肠炎和克罗恩病(crohn's disease)、损伤或感染。
37.如本文所用,术语“核苷间键”意指寡核苷酸中邻接核苷之间的共价键。如本文所用,“修饰的核苷间键”意指除了天然存在的核苷间键之外的任何核苷间键。“硫代磷酸酯核苷间键”是修饰的核苷间键,其中磷酸二酯核苷间键的非桥连氧原子之一被硫原子取代。
38.如本文所用,“klkb1基因”是指编码pkk rna的基因组序列。一般来说,一个人有两个klkb1基因,所述基因可具有相同或不同的核碱基序列。
39.如本文所用,“负荷剂量”意指在达到药剂的稳态浓度的初始给药阶段期间施用的药剂的治疗有效量。“初始负荷剂量”意指施用的第一负荷剂量。“最后负荷剂量”意指在施用第一维持剂量之前最近施用的负荷剂量。
40.如本文所用,“维持剂量”意指在已达到药剂的稳态浓度之后的给药阶段期间施用的药剂的治疗有效量。
41.如本文所用,“修饰的寡核苷酸”意指其中至少一个核苷或核苷间键被修饰的寡核苷酸。
42.如本文所用,“核碱基”意指未修饰的核碱基或修饰的核碱基。“未修饰的核碱基”是腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)或鸟嘌呤(g)。“修饰的核碱基”是除未修饰的a、t、c、u或g之外的能够与至少一个未修饰的核碱基配对的原子组。“5-甲基胞嘧啶”是修饰的核碱基。如本文所用,“核碱基序列”意指不依赖于任何糖或核苷间键修饰的靶核酸或寡核苷酸中的邻接核碱基的顺序。
43.如本文所用,“核苷”意指包含核碱基和糖部分的化合物。核碱基和糖部分各自独立地未经修饰或经修饰。如本文所用,“修饰的核苷”意指包含修饰的核碱基和/或修饰的糖部分的核苷。“连接的核苷”是以邻接序列连接的核苷(即,在连接的核苷之间不存在额外核苷)。如本文所用,“寡核苷酸”意指通过核苷间键连接的连接核苷链,其中每个核苷和核苷间键可经修饰或未经修饰。除非另有说明,否则寡核苷酸由8-50个连接核苷组成。
44.如本文所用,“寡聚化合物”意指包含寡核苷酸和共轭基团的化合物。
45.如本文所用,“药学上可接受的载体或稀释剂”意指适用于向人受试者施用的任何物质。某些此类载体使药物组合物能够被配制为例如片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆料、悬浮液和锭剂以便由人受试者口服摄入。在某些实施方案中,药学上可接受的载体或稀释剂为无菌水、无菌盐水或无菌缓冲溶液。
46.如本文所用,“药学上可接受的盐”意指化合物的生理学和药学上可接受的盐。药学上可接受的盐保留母体化合物的所需生物活性且不会赋予非所需毒理学效应。
47.如本文所用,“钾盐”意指寡聚化合物的盐,其中所述盐的阳离子是钾。
48.如本文所用,“难治”意指对用于治疗疾患的疗法或药剂具有抗性。在某些实施方案中,难以用疗法或药剂治疗的受试者在接受疗法或药剂后具有疾患的一种或多种症状。在某些实施方案中,疾患的一种或多种症状的严重性不因疗法或药剂而降低。在某些实施方案中,疾患的一种或多种症状的发生率不因疗法或药剂而降低。
49.除非另有说明,否则如本文所用,“rna”意指rna转录物且包括前mrna和成熟mrna。
50.如本文所用,“钠盐”意指寡聚化合物的盐,其中所述盐的阳离子是钠。
51.如本文所用,“受试者”意指人或非人动物。在某些实施方案中,受试者是人受试者。“有需要的受试者”是将从本文公开的寡聚化合物的施用中受益的受试者。在某些实施方案中,有需要的受试者患有水肿。
52.如本文所用,“糖部分”意指未修饰的糖部分或修饰的糖部分。“未修饰的糖部分”意指如在rna中发现的2
’‑
oh(h)β-d核糖基部分(“未修饰的rna糖部分”),或如在dna中发现的2
’‑
h(h)β-d脱氧核糖基部分(“未修饰的dna糖部分”)。未修饰的糖部分在1’、3’和4’位置各有一个氢,在3’位置有一个氧,且在5’位置有两个氢。“修饰的糖部分”或“修饰的糖”意指修饰的呋喃糖基糖部分或糖替代物。
53.如本文所用,“症状”意指表明疾病或病症的存在或程度的任何身体特征或测试结果。在某些实施方案中,症状对于受试者或检查或测试受试者的医学专业人员是明显的。
54.如本文所用,“治疗有效量”意指对人受试者提供治疗益处的药剂的量。例如,治疗有效量改善疾病的症状。
55.如本文所用,“血栓栓塞疾患”意指涉及由血栓引起的栓塞的任何疾病或疾患。此类疾病和疾患的实例包括血栓形成、栓塞和血栓栓塞的类别。血栓栓塞疾患也可以称为血栓栓塞事件或血栓形成事件。有血栓栓塞风险的受试者包括但不限于具有以下各者的受试者:高血压、高胆固醇血症、心房颤动、心脏瓣膜病症、心脏瓣膜疾病、机械心脏瓣膜、手术、癌症、怀孕、老龄、使用口服避孕药、不动性、败血症、心房颤动、动脉粥样硬化、冠状动脉疾病(cad)、抗磷脂综合征、血栓前凝血障碍(例如因子v leiden血栓形成倾向)或它们的组合。
56.如本文所用,“周”意指7天。
57.某些实施方案
58.本公开提供以下非限制性编号的实施方案:
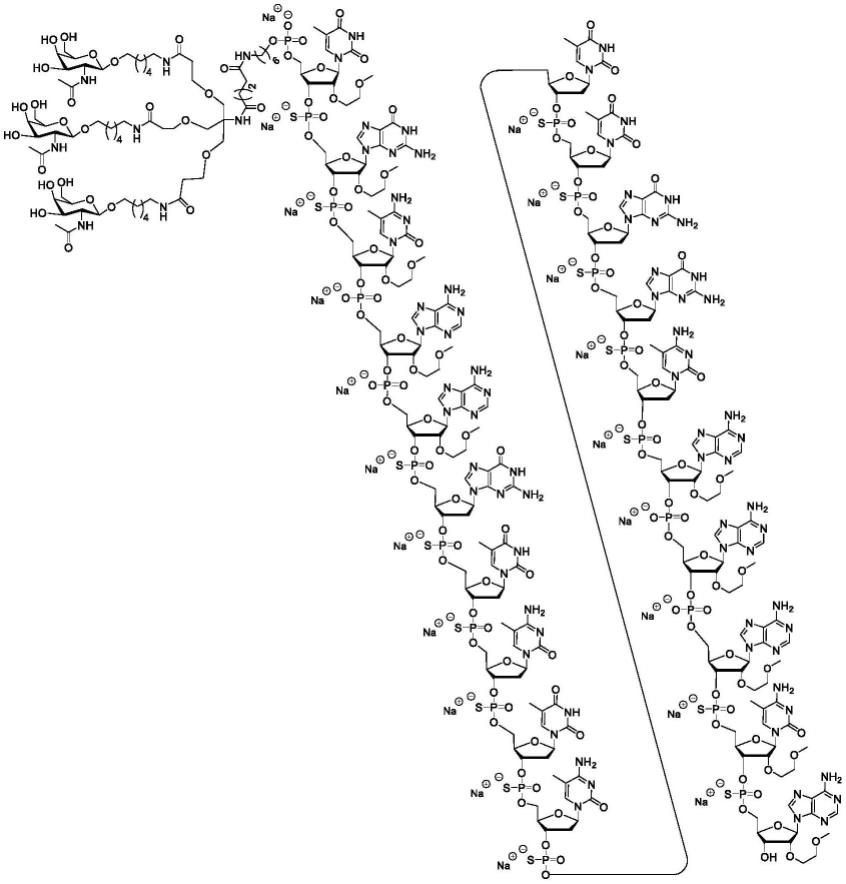
59.实施方案1.一种改善有需要的人受试者的水肿的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0060][0061]
(seq id no:4),或其盐。
[0062]
实施方案2.根据实施方案1所述的方法,其中所述盐是钠盐或钾盐。
[0063]
实施方案3.一种改善有需要的人受试者的水肿的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0064][0065]
(seq id no:4)。
[0066]
实施方案4.一种改善有需要的人受试者的水肿的方法,所述方法包括向所述人受试者施用治疗有效量的寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0067][0068]
且其中,
[0069]
a=腺嘌呤核碱基,
[0070]
mc=5-甲基胞嘧啶核碱基,
[0071]
g=鸟嘌呤核碱基,
[0072]
t=胸腺嘧啶核碱基,
[0073]
e=2
’‑
moe糖部分,
[0074]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0075]
s=硫代磷酸酯核苷间键,且
[0076]
o=磷酸二酯核苷间键。
[0077]
实施方案5.根据实施方案1至4中任一项所述的方法,其中水肿是遗传性血管性水肿,并且遗传性血管性水肿的至少一种症状得到改善。
[0078]
实施方案6.根据实施方案5所述的方法,其中至少一种症状选自恶心、呕吐、瘙痒、头痛、疲劳、腹痛、呼吸短促、鼻炎、过敏反应、支气管收缩和肿胀,以及它们的组合。
[0079]
实施方案7.根据实施方案1至4中任一项所述的方法,其中水肿是黄斑水肿,并且黄斑水肿的至少一种症状得到改善。
[0080]
实施方案8.根据实施方案7所述的方法,其中至少一种症状选自视力模糊、水波样视觉、视物变形和视力丧失,以及它们的组合。
[0081]
实施方案9.一种降低有需要的人受试者中的前激肽释放酶(pkk)rna的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0082][0083]
(seq id no:4),或其盐。
[0084]
实施方案10.根据实施方案9所述的方法,其中所述盐是钠盐或钾盐。
[0085]
实施方案11.一种降低有需要的人受试者中的pkk rna的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0086][0087]
(seq id no:4)。
[0088]
实施方案12.一种降低有需要的人受试者中的pkk rna的方法,所述方法包括向所述人受试者施用治疗有效量的寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0089][0090]
且其中,
[0091]
a=腺嘌呤核碱基,
[0092]
mc=5-甲基胞嘧啶核碱基,
[0093]
g=鸟嘌呤核碱基,
[0094]
t=胸腺嘧啶核碱基,
[0095]
e=2
’‑
moe糖部分,
[0096]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0097]
s=硫代磷酸酯核苷间键,且
[0098]
o=磷酸二酯核苷间键。
[0099]
实施方案13.一种降低有需要的人受试者中的pkk蛋白的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0100][0101]
(seq id no:4),或其盐。
[0102]
实施方案14.根据实施方案13所述的方法,其中所述盐是钠盐或钾盐。
[0103]
实施方案15.一种降低有需要的人受试者中的pkk蛋白的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0104][0105]
(seq id no:4)。
[0106]
实施方案16.一种降低有需要的人受试者中的pkk蛋白的方法,所述方法包括向所述人受试者施用治疗有效量的寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0107][0108]
且其中,
[0109]
a=腺嘌呤核碱基,
[0110]
mc=5-甲基胞嘧啶核碱基,
[0111]
g=鸟嘌呤核碱基,
[0112]
t=胸腺嘧啶核碱基,
[0113]
e=2
’‑
moe糖部分,
[0114]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0115]
s=硫代磷酸酯核苷间键,且
[0116]
o=磷酸二酯核苷间键。
[0117]
实施方案17.一种降低有需要的人受试者中的pkk活性的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0118][0119]
(seq id no:4),或其盐。
[0120]
实施方案18.根据实施方案17所述的方法,其中所述盐是钠盐或钾盐。
[0121]
实施方案19.一种降低有需要的人受试者中的pkk活性的方法,所述方法包括向所述人受试者施用治疗有效量的根据以下化学结构的寡聚化合物:
[0122][0123]
(seq id no:4)。
[0124]
实施方案20.一种降低有需要的人受试者中的pkk活性的方法,所述方法包括向所述人受试者施用治疗有效量的寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0125][0126]
且其中,
[0127]
a=腺嘌呤核碱基,
[0128]
mc=5-甲基胞嘧啶核碱基,
[0129]
g=鸟嘌呤核碱基,
[0130]
t=胸腺嘧啶核碱基,
[0131]
e=2
’‑
moe糖部分,
[0132]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0133]
s=硫代磷酸酯核苷间键,且
[0134]
o=磷酸二酯核苷间键。
[0135]
实施方案21.根据实施方案1至20中任一项所述的方法,其中治疗有效量是20mg。
[0136]
实施方案22.根据实施方案1至20中任一项所述的方法,其中治疗有效量是40mg。
[0137]
实施方案23.根据实施方案1至20中任一项所述的方法,其中治疗有效量是60mg。
[0138]
实施方案24.根据实施方案1至20中任一项所述的方法,其中治疗有效量是80mg。
[0139]
实施方案25.根据实施方案1至20中任一项所述的方法,其中治疗有效量是100mg。
[0140]
实施方案26.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、145mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg和300mg。
[0141]
实施方案27.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195mg、约200mg、约205mg、约210mg、约215mg、约220mg、约225mg、约230mg、约235mg、约240mg、约245mg、约250mg、约255mg、约260mg、约265mg、约270mg、约275mg、约280mg、约285mg、约290mg、约295mg和约300mg。
[0142]
实施方案28.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:75.0mg、75.1mg、75.2mg、75.3mg、75.4mg、75.5mg、75.6mg、75.7mg、75.8mg、75.9mg、76.0mg、76.1mg、76.2mg、76.3mg.76.4mg、76.5mg、76.6mg、76.7mg、76.8mg、76.9mg、77.0mg、77.1mg、77.2mg、77.3mg、77.4mg、77.5mg、77.6mg、77.7mg、77.8mg、77.9mg、78.0mg、78.1mg、78.2mg、78.3mg.78.4mg、78.5mg、78.6mg、78.7mg、78.8mg、78.9mg、79.0mg、79.1mg、79.2mg、79.3mg、79.4mg、79.5mg、79.6mg、79.7mg、79.8mg、79.9mg、80.0mg、80.1mg、80.2mg、80.3mg.80.4mg、80.5mg、80.6mg、80.7mg、80.8mg、80.9mg、81.0mg、81.1mg、81.2mg、81.3mg、81.4mg、81.5mg、81.6mg、81.7mg、81.8mg、81.9mg、82.0mg、82.1mg、82.2mg、82.3mg.82.4mg、82.5mg、82.6mg、82.7mg、82.8mg、82.9mg、83.0mg、83.1mg、83.2mg、83.3mg、83.4mg、83.5mg、83.6mg、83.7mg、83.8mg、83.9mg、84.0mg、84.1mg、84.2mg、84.3mg.84.4mg、84.5mg、84.6mg、84.7mg、84.8mg、84.9mg和85.0mg。
[0143]
实施方案29.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:约75.0mg、约75.1mg、约75.2mg、约75.3mg、约75.4mg、约75.5mg、约75.6mg、约75.7mg、约75.8mg、约75.9mg、约76.0mg、约76.1mg、约76.2mg、约76.3mg、约76.4mg、约76.5mg、约76.6mg、约76.6、约76.7mg、约76.8mg、约76.9mg、约77.0mg、约77.1mg、约77.2mg、约77.3mg、约77.4mg、约77.5mg、约77.6mg、约77.7mg、约77.8mg、约77.9mg、约78.0mg、约78.1mg、约78.2mg、约78.3mg、约78.4mg、约78.5mg、约78.6mg、约78.7mg、约78.8mg、约78.9mg、约79.0mg、约79.1mg、约79.2mg、约79.3mg、约79.4mg、约79.5mg、约79.6mg、约79.7mg、约79.8mg、约79.9mg、约80.0mg、约80.1mg、约80.2mg、约80.3mg、约80.4mg、约80.5mg、约80.6mg、约80.7mg、约80.8mg、约80.9mg、约81.0mg、约81.1mg、约81.2mg、约81.3mg、约81.4mg、约81.5mg、约81.6mg、约81.7mg、约81.8mg、约81.9mg、约82.0mg、约82.1mg、约82.2mg、约82.3mg、约82.4mg、约82.5mg、约82.6mg、约82.7mg、约82.8mg、约82.9mg、约83.0mg、约83.1mg、约83.2mg、约83.3mg、约83.4mg、约83.5mg、约83.6mg、约83.7mg、约83.8mg、约83.9mg、约84.0mg、约84.1mg、约84.2mg、约84.3mg、约84.4mg、约84.5mg、约84.6mg、约84.7mg、约84.8mg、约84.9mg和约85.0mg。
[0144]
实施方案30.根据实施方案1至20中任一项的方法,其中所述治疗有效量是以下中的任一个:10mg至140mg、10mg至130mg、10mg至120mg、10mg至110mg、10mg至100mg、10mg至90mg、10mg至80mg、10mg至70mg、10mg至60mg、10mg至50mg、10mg至40mg、10mg至30mg、10mg至20mg、20mg至140mg、20mg至130mg、20mg至120mg、20mg至110mg、20mg至100mg、20mg至90mg、20mg至80mg、20mg至70mg、20mg至60mg、20mg至50mg、20mg至40mg、20mg至30mg、30mg至140mg、30mg至130mg、30mg至120mg、30mg至110mg、30mg至100mg、30mg至90mg、30mg至80mg、30mg至70mg、30mg至60mg、30mg至50mg、30mg至40mg、40mg至140mg、40mg至130mg、40mg至120mg、40mg至110mg、40mg至100mg、40mg至90mg、40mg至80mg、40mg至70mg、40mg至60mg、40mg至50mg、50mg至140mg、50mg至130mg、50mg至120mg、50mg至110mg、50mg至100mg、50mg至90mg、50mg至80mg、50mg至70mg、50mg至60mg、60mg至140mg、60mg至130mg、60mg至120mg、60mg至110mg、60mg至100mg、60mg至90mg、60mg至80mg、60mg至70mg、70mg至140mg、70mg至130mg、70mg至120mg、70mg至110mg、70mg至100mg、70mg至90mg、70mg至80mg、80mg至140mg、80mg至130mg、80mg至120mg、80mg至110mg、80mg至100mg、80mg至90mg、90mg至140mg、90mg至130mg、90mg至120mg、90mg至110mg、90mg至100mg、100mg至140mg、100mg至130mg、100mg至
120mg、100mg至110mg、110mg至140mg、110mg至130mg、110mg至120mg、120mg至140mg、120mg至130mg、130mg至140mg、65mg至95mg、65mg至90mg、65mg至85mg 65mg至80mg、65mg至75mg、65mg至70mg、70mg至95mg、70mg至85mg、70mg至75mg、75mg至100mg、75mg至95mg、75mg至90mg、75mg至85mg、75mg至80mg、80mg至95mg、80mg至85mg、85mg至100mg、85mg至90mg、90mg至95mg、95mg至100mg、80mg至89mg、80mg至88mg、80mg至87mg、80mg至86mg、80mg至84mg、80mg至83mg、80mg至82mg、80mg至81mg、81mg至90mg、82mg至89mg、82mg至88mg、82mg至87mg、82mg至86mg、82mg至85mg、82mg至84mg、82mg至83mg、83mg至90mg、83mg至89mg、83mg至88mg、83mg至87mg、83mg至86mg、83mg至85mg、83mg至84mg、84mg至90mg、84mg至89mg、84mg至88mg、84mg至87mg、84mg至86mg、84mg至85mg、85mg至89mg、85mg至88mg、85mg至87mg、85mg至86mg、86mg至90mg、86mg至89mg、86mg至88mg、86mg至87mg、87mg至90mg、87mg至89mg、87mg至88mg、88mg至90mg、88mg至89mg和89mg至90mg。
[0145]
实施方案31.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:小于300mg、小于295mg、小于290mg、小于285mg、小于280mg、小于275mg、小于270mg、小于265mg、小于260mg、小于255mg、小于250mg、小于245mg、小于240mg、小于235mg、小于230mg、小于225mg、小于220mg、小于215mg、小于210mg、小于205mg、小于200mg、小于195mg、小于190mg、小于185mg、小于180mg、小于175mg、小于170mg、小于165mg、小于160mg、小于150mg、小于145mg、小于140mg、小于135mg、小于130mg、小于125mg、小于120mg、小于115mg、小于110mg、小于105mg、小于100mg、小于95mg、小于90mg、小于85mg、小于80mg、小于75mg、小于70mg、小于65mg、小于60mg、小于55mg、小于50mg、小于45mg、小于40mg、小于35mg、小于30mg、小于25mg和小于20mg。
[0146]
实施方案32.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:小于约300mg、小于约295mg、小于约290mg、小于约285mg、小于约280mg、小于约275mg、小于约270mg、小于约265mg、小于约260mg、小于约255mg、小于约250mg、小于约245mg、小于约240mg、小于约235mg、小于约230mg、小于约225mg、小于约220mg、小于约215mg、小于约210mg、小于约205mg、小于约200mg、小于约195mg、小于约190mg、小于约185mg、小于约180mg、小于约175mg、小于约170mg、小于约165mg、小于约160mg、小于约150mg、小于约145mg、小于约140mg、小于约135mg、小于约130mg、小于约125mg、小于约120mg、小于约115mg、小于约110mg、小于约105mg、小于约100mg、小于约95mg、小于约90mg、小于约85mg、小于约80mg、小于约75mg、小于约70mg、小于约65mg、小于约60mg、小于约55mg、小于约50mg、小于约45mg、小于约40mg、小于约35mg、小于约30mg、小于约25mg和小于约20mg。
[0147]
实施方案33.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:至少10mg、至少15mg、至少20mg、至少25mg、至少30mg、至少35mg、至少40mg、至少45mg、至少50mg、至少55mg、至少60mg、至少65mg、至少70mg、至少75mg、至少80mg、至少85mg、至少90mg、至少95mg、至少约100mg、至少105mg、至少115mg、至少120mg、至少125mg、至少130mg、至少135mg、至少140mg、至少145mg和至少150mg。
[0148]
实施方案34.根据实施方案1至20中任一项所述的方法,其中所述治疗有效量是以下中的任一个:至少约10mg、至少约15mg、至少约20mg、至少约25mg、至少约30mg、至少约35mg、至少约40mg、至少约45mg、至少约50mg、至少约55mg、至少约60mg、至少约65mg、至少约
70mg、至少约75mg、至少约80mg、至少约85mg、至少约90mg、至少约95mg、至少约100mg、至少约105mg、至少约115mg、至少约120mg、至少约125mg、至少约130mg、至少约135mg、至少约140mg、至少约145mg和至少约150mg。
[0149]
实施方案35.根据实施方案1至34中任一项所述的方法,所述方法包括每4周一次施用所述寡聚化合物。
[0150]
实施方案36.根据实施方案1至34中任一项所述的方法,所述方法包括每8周一次施用所述寡聚化合物。
[0151]
实施方案37.根据实施方案1至34中任一项所述的方法,所述方法包括约每4周一次施用所述寡聚化合物。
[0152]
实施方案38.根据实施方案1至34中任一项所述的方法,所述方法包括约每8周一次施用所述寡聚化合物。
[0153]
实施方案39.根据实施方案1至34中任一项所述的方法,所述方法包括每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次、每15周一次、每16周一次、每17周一次、每18周一次、每19周一次或每20周一次施用所述寡聚化合物。
[0154]
实施方案40.根据实施方案1至34中任一项所述的方法,所述方法包括约每4周一次、约每5周一次、约每6周一次、约每7周一次、约每8周一次、约每9周一次、约每10周一次、约每11周一次、约每12周一次、约每13周一次、约每14周一次、约每15周一次、约每16周一次、约每17周一次、约每18周一次、约每19周一次或约每20周一次施用所述寡聚化合物。
[0155]
实施方案41.根据实施方案1至34中任一项所述的方法,所述方法包括施用至少两个负荷剂量的寡聚化合物和至少两个维持剂量的寡聚化合物。
[0156]
实施方案42.根据实施方案41所述的方法,其中所述负荷剂量是80mg或约80mg的量。
[0157]
实施方案43.根据实施方案41或42所述的方法,其中所述维持剂量是小于80mg的量。
[0158]
实施方案44.根据实施方案43所述的方法,其中所述维持剂量是20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg或75mg。
[0159]
实施方案45.根据实施方案43所述的方法,其中所述维持剂量是约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg或约75mg。
[0160]
实施方案46.根据实施方案41至45中任一项所述的方法,所述方法包括每4周一次施用负荷剂量,以及每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次、每15周一次、每16周一次、每17周一次、每18周一次、每19周一次或每20周一次施用至少两个维持剂量。
[0161]
实施方案47.根据实施方案41至45中任一项所述的方法,所述方法包括约每4周一次施用负荷剂量,以及约每5周一次、约每6周一次、约每7周一次、约每8周一次、约每9周一次、约每10周一次、约每11周一次、约每12周一次、约每13周一次、约每14周一次、约每15周一次、约每16周一次、约每17周一次、约每18周一次、约每19周一次或约每20周一次施用至少两个维持剂量。
[0162]
实施方案48.根据实施方案41至45中任一项所述的方法,所述方法包括每2周一次
施用负荷剂量,以及每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次、每15周一次、每16周一次、每17周一次、每18周一次、每19周一次或每20周一次施用至少两个维持剂量。
[0163]
实施方案49.根据实施方案41至45中任一项所述的方法,所述方法包括约每2周一次施用负荷剂量,以及约每5周一次、约每6周一次、约每7周一次、约每8周一次、约每9周一次、约每10周一次、约每11周一次、约每12周一次、约每13周一次、约每14周一次、约每15周一次、约每16周一次、约每17周一次、约每18周一次、约每19周一次或约每20周一次施用至少两个维持剂量。
[0164]
实施方案50.根据实施方案1至49中任一项所述的方法,其中所述人受试者具有遗传性血管性水肿或它们的风险。
[0165]
实施方案51.根据实施方案50所述的方法,其中所述遗传性血管性水肿是i型hae。
[0166]
实施方案52.根据实施方案50所述的方法,其中所述遗传性血管性水肿是ii型hae。
[0167]
实施方案53.根据实施方案51或52所述的方法,其中所述人受试者在serping1基因中具有基因突变。
[0168]
实施方案54.根据实施方案50所述的方法,其中所述遗传性血管性水肿是iii型hae。
[0169]
实施方案55.根据实施方案54所述的方法,其中所述人受试者在选自f12、plg和angpt1的基因中具有基因突变。
[0170]
实施方案56.根据实施方案54所述的方法,其中所述受试者在选自f12、plg和angpt1的基因中不具有基因突变。
[0171]
实施方案57.根据实施例50至56中任一项所述的方法,其中所述人受试者难以用至少一种抗水肿剂治疗。
[0172]
实施方案58.根据实施方案57所述的方法,其中所述至少一种抗水肿剂包括组胺抑制剂、c1酯酶抑制剂、减弱的雄激素、抗纤维蛋白溶解剂、血管紧张素转换酶抑制剂、血管紧张素ii 1型受体阻断剂、激肽释放酶抑制剂、缓激肽b2受体拮抗剂或它们的组合。
[0173]
实施方案59.根据实施例50至58中任一项所述的方法,其中所述人受试者难以用组胺抑制剂、抗纤维蛋白溶解剂、减弱的雄激素、c1酯酶抑制剂和缓激肽b2受体拮抗剂治疗。
[0174]
实施方案60.根据实施方案58或59所述的方法,其中所述抗纤维蛋白溶解剂是氨甲环酸。
[0175]
实施方案61.根据实施方案58至60中任一项所述的方法,其中所述减弱的雄激素是达那唑。
[0176]
实施方案62.根据实施方案58至61中任一项所述的方法,其中所述缓激肽b2受体拮抗剂是艾替班特(icatibant)。
[0177]
实施方案63.根据实施方案57至62中任一项所述的方法,其中相对于受试者在初始施用至少一种抗水肿剂之前经历的血管性水肿发作的发生率,所述至少一种抗水肿剂使受试者经历的血管性水肿发作的发生率降低小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%,如在初始施用至少一种抗水肿剂后至少1、至少2、至少3、
至少4或至少6个月内所测量。
[0178]
实施方案64.根据实施方案57至63中任一项所述的方法,其中在初始施用至少一种抗水肿剂后约1小时、约2小时、约4小时、约8小时、约12小时、约24小时或约48小时,所述至少一种抗水肿剂使肿胀减轻小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%。
[0179]
实施方案65.根据实施方案50至64中任一项所述的方法,其中所述人受试者在施用前每月平均具有至少1次、至少2次、至少3次、至少4次、至少5次或至少6次血管性水肿发作,如在至少1、2、3、4、5、6、8或12个月内所测量。
[0180]
实施方案66.根据实施方案1至49中任一项所述的方法,其中所述人受试者具有黄斑水肿或它们的风险。
[0181]
实施方案67.根据实施方案66所述的方法,其中所述人受试者患有糖尿病、糖尿病性黄斑水肿、糖尿病性视网膜病或它们的组合。
[0182]
实施方案68.一种改善有需要的人受试者的遗传性血管性水肿的方法,所述方法包括向所述人受试者施用约80mg根据以下化学结构的寡聚化合物:
[0183][0184]
(seq id no:4),或其盐。
[0185]
实施方案69.根据实施方案68所述的方法,其中所述盐是钠盐或钾盐。
[0186]
实施方案70.一种改善有需要的人受试者的遗传性血管性水肿的方法,所述方法包括向所述人受试者施用约80mg根据以下化学结构的寡聚化合物:
[0187][0188]
(seq id no:4)。
[0189]
实施方案71.一种改善有需要的人受试者的遗传性血管性水肿的方法,所述方法包括向所述人受试者施用约80mg寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0190][0191]
且其中,
[0192]
a=腺嘌呤核碱基,
[0193]
mc=5-甲基胞嘧啶核碱基,
[0194]
g=鸟嘌呤核碱基,
[0195]
t=胸腺嘧啶核碱基,
[0196]
e=2
’‑
moe糖部分,
[0197]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0198]
s=硫代磷酸酯核苷间键,且
[0199]
o=磷酸二酯核苷间键。
[0200]
实施方案72.根据实施方案68至71中任一项所述的方法,所述方法包括向人受试者施用80mg寡聚化合物。
[0201]
实施方案73.根据实施方案68至71中任一项所述的方法,其中所述方法包括约每4周一次向人受试者施用至少两个约80mg剂量的寡聚化合物,以及随后约每4周一次施用至少两个约100mg剂量的寡聚化合物。
[0202]
实施方案74.根据实施方案68至71中任一项所述的方法,其中所述方法包括每4周一次向人受试者施用至少两个80mg剂量的寡聚化合物,且随后每4周一次施用至少两个100mg剂量的寡聚化合物。
[0203]
实施方案75.根据实施方案73或74所述的方法,其中在每4周一次或约每4周一次施用80mg或约80mg寡聚化合物期间,所述人受试者具有至少一次血管性水肿发作。
[0204]
实施方案76.根据实施方案68至71中任一项所述的方法,其中所述方法包括约每4周向人受试者施用至少两个约80mg负荷剂量的寡聚化合物,以及约每8周施用至少两个约80mg维持剂量的寡聚化合物。
[0205]
实施方案77.根据实施方案68至71中任一项所述的方法,其中所述方法包括每4周一次向人受试者施用至少两个80mg负荷剂量的寡聚化合物,以及每8周一次施用至少两个80mg维持剂量的寡聚化合物。
[0206]
实施方案78.根据实施方案75至77中任一项所述的方法,其中在每4周一次或约每4周一次施用80mg或约80mg寡聚化合物期间,所述受试者不具有血管性水肿发作。
[0207]
实施方案79.根据实施方案68至78中任一项所述的方法,其中所述遗传性血管性
水肿是i型hae、ii型hae或iii型hae。
[0208]
实施方案80.根据实施方案79所述的方法,其中所述遗传性血管性水肿是iii型hae,并且所述人受试者在选自f12、plg和angpt1的基因中具有基因突变。
[0209]
实施方案81.根据实施方案79所述的方法,其中所述遗传性血管性水肿是iii型hae,并且所述人受试者在选自f12、plg和angpt1的基因中不具有基因突变。
[0210]
实施方案82.根据实施方案68至81中任一项所述的方法,其中所述人受试者难以用至少一种抗水肿剂治疗。
[0211]
实施方案83.根据实施方案82所述的方法,其中所述至少一种抗水肿剂包括组胺抑制剂、c1酯酶抑制剂、减弱的雄激素、抗纤维蛋白溶解剂、血管紧张素转换酶抑制剂、血管紧张素ii 1型受体阻断剂、激肽释放酶抑制剂、缓激肽b2受体拮抗剂或它们的组合。
[0212]
实施方案84.根据实施方案68至83中任一项所述的方法,其中所述人受试者难以用组胺抑制剂、抗纤维蛋白溶解剂、减弱的雄激素、c1酯酶抑制剂和缓激肽b2受体拮抗剂治疗。
[0213]
实施方案85.根据实施方案83或84所述的方法,其中所述抗纤维蛋白溶解剂是氨甲环酸。
[0214]
实施方案86.根据实施方案83至85中任一项所述的方法,其中所述减弱的雄激素是达那唑。
[0215]
实施方案87.根据实施方案83至86中任一项所述的方法,其中所述缓激肽b2受体拮抗剂是艾替班特。
[0216]
实施方案88.根据实施方案82至87中任一项所述的方法,其中相对于受试者在初始施用至少一种抗水肿剂之前经历的血管性水肿发作的发生率,所述至少一种抗水肿剂使受试者经历的血管性水肿发作的发生率降低小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%,如在初始施用至少一种抗水肿剂后至少1、至少2、至少3、至少4或至少6个月内所测量。
[0217]
实施方案89.根据实施方案82至87中任一项所述的方法,其中在初始施用至少一种抗水肿剂后约1小时、约2小时、约4小时、约8小时、约12小时、约24小时或约48小时,所述至少一种抗水肿剂使肿胀减轻小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%。
[0218]
实施方案90.根据实施方案82至87中任一项所述的方法,其中所述人受试者在施用前每月平均具有至少1次、至少2次、至少3次、至少4次、至少5次或至少6次血管性水肿发作,如在至少1、2、3、4、5、6、8或12个月内所测量。
[0219]
实施方案91.一种改善有需要的人受试者的黄斑水肿的方法,所述方法包括向所述人受试者施用约80mg根据以下化学结构的寡聚化合物:
[0220][0221]
(seq id no:4),或其盐。
[0222]
实施方案92.根据实施方案91所述的方法,其中所述盐是钠盐或钾盐。
[0223]
实施方案93.一种改善有需要的人受试者的黄斑水肿的方法,所述方法包括向所述人受试者施用约80mg根据以下化学结构的寡聚化合物:
[0224][0225]
(seq id no:4)。
[0226]
实施方案94.一种改善有需要的人受试者的黄斑水肿的方法,所述方法包括向所述人受试者施用约80mg寡聚化合物,其中所述寡聚化合物具有以下化学符号(5’至3’):(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0227][0228]
且其中,
[0229]
a=腺嘌呤核碱基,
[0230]
mc=5-甲基胞嘧啶核碱基,
[0231]
g=鸟嘌呤核碱基,
[0232]
t=胸腺嘧啶核碱基,
[0233]
e=2
’‑
moe糖部分,
[0234]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0235]
s=硫代磷酸酯核苷间键,且
[0236]
o=磷酸二酯核苷间键。
[0237]
实施方案95.根据实施方案91至94中任一项所述的方法,所述方法包括向人受试者施用80mg寡聚化合物。
[0238]
实施方案96.根据实施方案91至95中任一项所述的方法,所述方法包括约每2周一次向人受试者施用至少两个约80mg负荷剂量的寡聚化合物,以及约每4周一次施用至少两个约80mg维持剂量的寡聚化合物。
[0239]
实施方案97.根据实施方案91至95中任一项所述的方法,所述方法包括每2周一次向人受试者施用至少两个80mg负荷剂量的寡聚化合物,以及每4周一次施用至少两个80mg维持剂量的寡聚化合物。
[0240]
实施方案98.根据实施方案91至97中任一项所述的方法,其中所述人受试者患有糖尿病性黄斑水肿。
[0241]
实施方案99.根据实施方案1至98中任一项所述的方法,其中所述人受试者具有炎症疾患、血栓栓塞疾患、水肿或它们的风险。
[0242]
实施方案100.根据实施方案1至99中任一项所述的方法,其中所述寡聚化合物通过皮下注射施用。
[0243]
实施方案101.根据实施方案1至100中任一项所述的方法,其中所述寡聚化合物是自施用的。
[0244]
实施方案102.根据实施方案1至101中任一项所述的方法,其中受试者中的pkk rna降低。
[0245]
实施方案103.根据实施方案1至102中任一项所述的方法,其中受试者中的pkk蛋
白降低。
[0246]
实施方案104.根据实施方案1至103中任一项所述的方法,其中受试者中的pkk活性降低。
[0247]
i.pkk
[0248]
在某些实施方案中,本文描述减少受试者的细胞或生物体液中的pkk rna和/或pkk蛋白的方法。pkk rna由位于人4号染色体上的人klkb1基因编码。pkk蛋白是pkk rna的蛋白表达产物。相对于其它细胞类型,pkk蛋白在肝脏中高度表达。人klkb1基因的代表性核碱基序列以如下genbank登录号提供:从核苷酸111693001至111730000截短的nt_016354.19,作为seq id no:1并入本文。人pkk mrna的代表性核碱基序列以genbank登录号nm_000892.3提供,作为seq id no:2并入本文。人pkk蛋白的蛋白序列以genbank登录号np_000883.2提供,作为seq id no:3并入本文。
[0249]
ii.isis 721744
[0250]
在某些实施方案中,本文描述了向有需要的受试者施用寡聚化合物isis 721744的方法。在某些实施方案中,isis 721744的特征在于5-10-5moe间隙聚体,具有(从5’到3’)tgcaagtctcttggca aaca的序列(作为seq id no:4并入本文),其中核苷1-5和16-20中的每一个(从5’到3’)包含2
’‑
moe修饰并且核苷6-15中的每一个是2
’‑
脱氧核糖核苷,其中核苷3至4、4至5、16至17和17至18之间的核苷间键是磷酸二酯核苷间键,并且核苷1至2、2至3、5至6、6至7、7至8、8至9、9至10、10至11、11至12、12至13、13至14、14至15、15至16、18至19和19至20之间的核苷间键是硫代磷酸酯核苷间键,并且其中每个胞嘧啶是5
’‑
甲基胞嘧啶。
[0251]
在某些实施方案中,isis 721744由以下化学符号(5’至3’)表示:(tha-galnac3)o tes ges mceo aeo aes gds tds mcds tds mcds tds tds gds gds mcds aeo aeo aes mces ae(seq id no:4);其中(tha-galnac3)o由以下结构表示:
[0252][0253]
且其中,
[0254]
a=腺嘌呤核碱基,
[0255]
mc=5-甲基胞嘧啶核碱基,
[0256]
g=鸟嘌呤核碱基,
[0257]
t=胸腺嘧啶核碱基,
[0258]
e=2
’‑
moe糖部分,
[0259]
d=2
’‑2’‑
β-d-脱氧核糖基糖部分,
[0260]
s=硫代磷酸酯核苷间键,且
[0261]
o=磷酸二酯核苷间键。
[0262]
在某些实施方案中,isis 721744由以下化学结构表示:
[0263][0264]
(seq id no:4)。
[0265]
结构1.isis 721744
[0266]
在某些实施方案中,isis 721744的钠盐由以下化学结构表示:
[0267][0268]
(seq id no:4)。
[0269]
结构2.isis 721744的钠盐
[0270]
iii.某些药物组合物
[0271]
在某些实施方案中,本文描述向受试者施用包含寡聚化合物isis721744的药物组合物的方法。在某些实施方案中,药物组合物包含药学上可接受的稀释剂或载体。在某些实施方案中,药物组合物包含无菌盐水溶液和isis 721744或基本上由其组成。在某些实施方案中,无菌盐水为医药级盐水。在某些实施方案中,药物组合物包含无菌水和isis 721744或基本上由其组成。在某些实施方案中,无菌水为医药级水。在某些实施方案中,药物组合物包含磷酸盐缓冲盐水和isis721744或基本上由其组成。
[0272]
在某些实施方案中,药物组合物包含一种或多种赋形剂和isis721744。在某些实施方案中,赋形剂选自水、盐溶液、醇、聚乙二醇、明胶、乳糖、淀粉酶、硬脂酸镁、滑石、硅酸、粘性石蜡、羟甲基纤维素以及聚乙烯吡咯烷酮。
[0273]
在某些实施方案中,包含寡聚化合物isis 721744的药物组合物包括寡聚化合物isis 721744的任何药学上可接受的盐、isis 721744的酯或此类酯的盐。在某些实施方案中,包含isis 721744的药物组合物在施用于人受试者时能够(直接或间接)提供生物活性
代谢物或其残留物。因此,例如,本公开还涉及寡聚化合物isis 721744的药学上可接受的盐、isis 721744的前药、所述前药的药学上可接受的盐以及其它生物等效物。合适的药学上可接受的盐包括但不限于钠盐和钾盐。
[0274]
在某些实施方案中,药物组合物包含一种或多种脂质部分和寡聚化合物isis 721744。在某些实施方案中,脂质部分用于增加isis721744至具体细胞或组织的分布。在某些所述方法中,将isis 721744引入到由阳离子脂质和中性脂质的混合物制成的预先形成的脂质体或脂质复合物中。在某些方法中,在不存在中性脂质的情况下形成具有单阳离子脂质或聚阳离子脂质的dna复合物。
[0275]
在某些实施方案中,本文公开的药物组合物包含递送系统。递送系统的实例包括但不限于脂质体和乳液。某些递送系统适用于制备药物组合物,所述药物组合物包括包含疏水化合物的那些。在某些实施方案中,使用了某些有机溶剂,如二甲亚砜。
[0276]
在某些实施方案中,药物组合物包含一种或多种组织特异性递送分子,其设计用于将寡聚化合物isis 721744递送至特定组织或细胞类型。例如,在某些实施方案中,药物组合物包括涂有组织特异性抗体的脂质体。
[0277]
在某些实施方案中,药物组合物包含共溶剂系统。某些所述共溶剂系统包含例如苯甲醇、非极性表面活性剂、水可混溶的有机聚合物以及水相。在某些实施方案中,所述共溶剂系统用于疏水化合物。所述共溶剂系统的非限制性实例为vpd共溶剂系统,其为包含3%w/v苯甲醇、8%w/v非极性表面活性剂polysorbate 80
tm
和65%w/v聚乙二醇300的无水乙醇溶液。所述共溶剂系统的比例可在不显著改变其溶解度和毒性特征的情况下明显改变。此外,共溶剂组分的身份可改变:例如,可使用其它表面活性剂替代polysorbate 80
tm
;可改变聚乙二醇的分数大小;其它生物相容的聚合物可替代聚乙二醇,例如聚乙烯吡咯烷酮;并且其它糖或多糖可取代右旋糖。
[0278]
在某些实施方案中,药物组合物被制备用于经口施用。在某些实施方案中,药物组合物被制备用于经颊施用。在某些实施方案中,药物组合物被制备用于通过注射(例如,静脉内、皮下、肌肉内、鞘内(it)、脑室内(icv))施用。在某些所述实施方案中,药物组合物包含载体并且配制于水溶液中,如水或生理上相容的缓冲液如汉克斯溶液、林格氏溶液或生理盐水缓冲液。在某些实施方案中,包括其它成分(例如,帮助溶解或充当防腐剂的成分)。在某些实施方案中,使用适当的液体载体、悬浮剂等来制备可注射悬浮液。某些注射用药物组合物以单位剂型呈现,例如在安瓿中或在多剂量容器中。某些注射用药物组合物为油性或水性媒剂中的悬浮液、溶液或乳液,并且可含有配制剂,如悬浮剂、稳定剂和/或分散剂。某些适用于注射用药物组合物的溶剂包括但不限于亲脂溶剂和脂肪油(如芝麻油)、合成脂肪酸酯(如油酸乙酯或甘油三酯)以及脂质体。
[0279]
在某些条件下,寡聚化合物isis 721744充当酸。虽然isis 721744可以质子化(游离酸)形式绘制或描述,或离子化并与阳离子(盐)形式结合,但isis 721744的水溶液在这些形式之间平衡存在。例如,isis721744在水溶液中的磷酸键在游离酸、阴离子和盐形式之间平衡存在。除非另有说明,否则术语“isis 721744”旨在包括所有此类形式。此外,isis 721744有几个所述键,每一个都处于平衡状态。因此,isis721744以多种形式存在于溶液中,在多个位置均处于平衡状态。术语“isis 721744”旨在包括所有所述形式。绘制的结构必须描绘单一形式。然而,除非另有说明,否则所述绘图同样旨在包括对应形式。在本文中,
描绘isis 721744的游离酸的结构后跟术语“或其盐”明确包括可完全或部分质子化/去质子化/与阳离子结合的所有所述形式。在某些情况下,鉴定了一种或多种特定阳离子。
[0280]
在某些实施方案中,isis 721744在含钠的水溶液中。在某些实施方案中,isis 721744在含钾的水溶液中。在某些实施方案中,isis721744在pbs中。在某些实施方案中,isis 721744在水中。在某些所述实施方案中,溶液的ph用naoh和/或hcl调节以达到所需的ph。
[0281]
在本文中描述了某些特定剂量。为清楚起见,以毫克为单位的isis 721744剂量表示isis 721744游离酸形式的质量。如上所述,在水溶液中,游离酸与阴离子和盐形式处于平衡状态。然而,为了计算剂量,假设isis 721744以无溶剂、无乙酸钠、无水、游离酸形式存在。例如,当isis 721744在包含钠(例如盐水)的溶液中时,isis 721744可部分或完全去质子化并与na 离子结合。然而,质子的质量仍然计入剂量的重量,且na 离子的质量不计入剂量的重量。因此,例如,80mg isis 721744的剂量等于重80mg的完全质子化分子的数量。这将等效于84mg无溶剂、无乙酸钠、无水钠化isis 721744。类似地,100mg isis 721744的剂量将等效于105mg无溶剂、无乙酸钠、无水钠化isis 721744。
[0282]
iv.某些剂量
[0283]
在某些实施方案中,本文描述向受试者施用治疗有效量的寡聚化合物isis 721744的方法。在某些实施方案中,治疗有效量是约20mg。在某些实施方案中,治疗有效量是约40mg。在某些实施方案中,治疗有效量是约60mg。在某些实施方案中,治疗有效量是约80mg。
[0284]
在某些实施方案中,治疗有效量是约100mg。在某些实施方案中,治疗有效量是20mg。在某些实施方案中,治疗有效量是40mg。在某些实施方案中,治疗有效量是60mg。在某些实施方案中,治疗有效量是80mg。在某些实施方案中,治疗有效量是100mg。
[0285]
在某些实施方案中,治疗有效量是以下中的任一个:5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg、140mg、145mg、150mg、155mg、160mg、165mg、170mg、175mg、180mg、185mg、190mg、195mg、200mg、205mg、210mg、215mg、220mg、225mg、230mg、235mg、240mg、245mg、250mg、255mg、260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg和300mg。
[0286]
在某些实施方案中,治疗有效量是以下中的任一个:约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195mg、约200mg、约205mg、约210mg、约215mg、约220mg、约225mg、约230mg、约235mg、约240mg、约245mg、约250mg、约255mg、约260mg、约265mg、约270mg、约275mg、约280mg、约285mg、约290mg、约295mg和约300mg。
[0287]
在某些实施方案中,治疗有效量是以下中的任一个:75.0mg、75.1mg、75.2mg、75.3mg、75.4mg、75.5mg、75.6mg、75.7mg、75.8mg、75.9mg、76.0mg、76.1mg、76.2mg、76.3mg.76.4mg、76.5mg、76.6mg、76.7mg、76.8mg、76.9mg、77.0mg、77.1mg、77.2mg、77.3mg、77.4mg、77.5mg、77.6mg、77.7mg、77.8mg、77.9mg、78.0mg、78.1mg、78.2mg、78.3mg.78.4mg、
78.5mg、78.6mg、78.7mg、78.8mg、78.9mg、79.0mg、79.1mg、79.2mg、79.3mg、79.4mg、79.5mg、79.6mg、79.7mg、79.8mg、79.9mg、80.0mg、80.1mg、80.2mg、80.3mg.80.4mg、80.5mg、80.6mg、80.7mg、80.8mg、80.9mg、81.0mg、81.1mg、81.2mg、81.3mg、81.4mg、81.5mg、81.6mg、81.7mg、81.8mg、81.9mg、82.0mg、82.1mg、82.2mg、82.3mg.82.4mg、82.5mg、82.6mg、82.7mg、82.8mg、82.9mg、83.0mg、83.1mg、83.2mg、83.3mg、83.4mg、83.5mg、83.6mg、83.7mg、83.8mg、83.9mg、84.0mg、84.1mg、84.2mg、84.3mg.84.4mg、84.5mg、84.6mg、84.7mg、84.8mg、84.9mg和85.0mg。
[0288]
在某些实施方案中,治疗有效量是以下中的任一个:约75.0mg、约75.1mg、约75.2mg、约75.3mg、约75.4mg、约75.5mg、约75.6mg、约75.7mg、约75.8mg、约75.9mg、约76.0mg、约76.1mg、约76.2mg、约76.3mg、约76.4mg、约76.5mg、约76.6mg、约76.6、约76.7mg、约76.8mg、约76.9mg、约77.0mg、约77.1mg、约77.2mg、约77.3mg、约77.4mg、约77.5mg、约77.6mg、约77.7mg、约77.8mg、约77.9mg、约78.0mg、约78.1mg、约78.2mg、约78.3mg、约78.4mg、约78.5mg、约78.6mg、约78.7mg、约78.8mg、约78.9mg、约79.0mg、约79.1mg、约79.2mg、约79.3mg、约79.4mg、约79.5mg、约79.6mg、约79.7mg、约79.8mg、约79.9mg、约80.0mg、约80.1mg、约80.2mg、约80.3mg、约80.4mg、约80.5mg、约80.6mg、约80.7mg、约80.8mg、约80.9mg、约81.0mg、约81.1mg、约81.2mg、约81.3mg、约81.4mg、约81.5mg、约81.6mg、约81.7mg、约81.8mg、约81.9mg、约82.0mg、约82.1mg、约82.2mg、约82.3mg、约82.4mg、约82.5mg、约82.6mg、约82.7mg、约82.8mg、约82.9mg、约83.0mg、约83.1mg、约83.2mg、约83.3mg、约83.4mg、约83.5mg、约83.6mg、约83.7mg、约83.8mg、约83.9mg、约84.0mg、约84.1mg、约84.2mg、约84.3mg、约84.4mg、约84.5mg、约84.6mg、约84.7mg、约84.8mg、约84.9mg和约85.0mg。
[0289]
在某些实施方案中,治疗有效量是以下中的任一个:10mg至140mg、10mg至130mg、10mg至120mg、10mg至110mg、10mg至100mg、10mg至90mg、10mg至80mg、10mg至70mg、10mg至60mg、10mg至50mg、10mg至40mg、10mg至30mg、10mg至20mg、20mg至140mg、20mg至130mg、20mg至120mg、20mg至110mg、20mg至100mg、20mg至90mg、20mg至80mg、20mg至70mg、20mg至60mg、20mg至50mg、20mg至40mg、20mg至30mg、30mg至140mg、30mg至130mg、30mg至120mg、30mg至110mg、30mg至100mg、30mg至90mg、30mg至80mg、30mg至70mg、30mg至60mg、30mg至50mg、30mg至40mg、40mg至140mg、40mg至130mg、40mg至120mg、40mg至110mg、40mg至100mg、40mg至90mg、40mg至80mg、40mg至70mg、40mg至60mg、40mg至50mg、50mg至140mg、50mg至130mg、50mg至120mg、50mg至110mg、50mg至100mg、50mg至90mg、50mg至80mg、50mg至70mg、50mg至60mg、60mg至140mg、60mg至130mg、60mg至120mg、60mg至110mg、60mg至100mg、60mg至90mg、60mg至80mg、60mg至70mg、70mg至140mg、70mg至130mg、70mg至120mg、70mg至110mg、70mg至100mg、70mg至90mg、70mg至80mg、80mg至140mg、80mg至130mg、80mg至120mg、80mg至110mg、80mg至100mg、80mg至90mg、90mg至140mg、90mg至130mg、90mg至120mg、90mg至110mg、90mg至100mg、100mg至140mg、100mg至130mg、100mg至120mg、100mg至110mg、110mg至140mg、110mg至130mg、110mg至120mg、120mg至140mg、120mg至130mg、130mg至140mg、65mg至95mg、65mg至90mg、65mg至85mg 65mg至80mg、65mg至75mg、65mg至70mg、70mg至95mg、70mg至85mg、70mg至75mg、75mg至100mg、75mg至95mg、75mg至90mg、75mg至85mg、75mg至80mg、80mg至95mg、80mg至85mg、85mg至100mg、85mg至90mg、90mg至95mg、95mg至100mg、80mg至89mg、80mg至88mg、
80mg至87mg、80mg至86mg、80mg至84mg、80mg至83mg、80mg至82mg、80mg至81mg、81mg至90mg、82mg至89mg、82mg至88mg、82mg至87mg、82mg至86mg、82mg至85mg、82mg至84mg、82mg至83mg、83mg至90mg、83mg至89mg、83mg至88mg、83mg至87mg、83mg至86mg、83mg至85mg、83mg至84mg、84mg至90mg、84mg至89mg、84mg至88mg、84mg至87mg、84mg至86mg、84mg至85mg、85mg至89mg、85mg至88mg、85mg至87mg、85mg至86mg、86mg至90mg、86mg至89mg、86mg至88mg、86mg至87mg、87mg至90mg、87mg至89mg、87mg至88mg、88mg至90mg、88mg至89mg和89mg至90mg。
[0290]
在某些实施方案中,治疗有效量是以下中的任一个:小于300mg、小于295mg、小于290mg、小于285mg、小于280mg、小于275mg、小于270mg、小于265mg、小于260mg、小于255mg、小于250mg、小于245mg、小于240mg、小于235mg、小于230mg、小于225mg、小于220mg、小于215mg、小于210mg、小于205mg、小于200mg、小于195mg、小于190mg、小于185mg、小于180mg、小于175mg、小于170mg、小于165mg、小于160mg、小于150mg、小于145mg、小于140mg、小于135mg、小于130mg、小于125mg、小于120mg、小于115mg、小于110mg、小于105mg、小于100mg、小于95mg、小于90mg、小于85mg、小于80mg、小于75mg、小于70mg、小于65mg、小于60mg、小于55mg、小于50mg、小于45mg、小于40mg、小于35mg、小于30mg、小于25mg和小于20mg。
[0291]
在某些实施方案中,治疗有效量是以下中的任一个:小于约300mg、小于约295mg、小于约290mg、小于约285mg、小于约280mg、小于约275mg、小于约270mg、小于约265mg、小于约260mg、小于约255mg、小于约250mg、小于约245mg、小于约240mg、小于约235mg、小于约230mg、小于约225mg、小于约220mg、小于约215mg、小于约210mg、小于约205mg、小于约200mg、小于约195mg、小于约190mg、小于约185mg、小于约180mg、小于约175mg、小于约170mg、小于约165mg、小于约160mg、小于约150mg、小于约145mg、小于约140mg、小于约135mg、小于约130mg、小于约125mg、小于约120mg、小于约115mg、小于约110mg、小于约105mg、小于约100mg、小于约95mg、小于约90mg、小于约85mg、小于约80mg、小于约75mg、小于约70mg、小于约65mg、小于约60mg、小于约55mg、小于约50mg、小于约45mg、小于约40mg、小于约35mg、小于约30mg、小于约25mg和小于约20mg。
[0292]
在某些实施方案中,治疗有效量是以下中的任一个:至少10mg、至少15mg、至少20mg、至少25mg、至少30mg、至少35mg、至少40mg、至少45mg、至少50mg、至少55mg、至少60mg、至少65mg、至少70mg、至少75mg、至少80mg、至少85mg、至少90mg、至少95mg、至少约100mg、至少105mg、至少115mg、至少120mg、至少125mg、至少130mg、至少135mg、至少140mg、至少145mg和至少150mg。在某些实施方案中,治疗有效量不超过约200mg、约250mg、约300mg、约350mg或约400mg。
[0293]
在某些实施方案中,治疗有效量是以下中的任一个:至少约10mg、至少约15mg、至少约20mg、至少约25mg、至少约30mg、至少约35mg、至少约40mg、至少约45mg、至少约50mg、至少约55mg、至少约60mg、至少约65mg、至少约70mg、至少约75mg、至少约80mg、至少约85mg、至少约90mg、至少约95mg、至少约100mg、至少约105mg、至少约115mg、至少约120mg、至少约125mg、至少约130mg、至少约135mg、至少约140mg、至少约145mg和至少约150mg。在某些实施方案中,治疗有效量不超过约200mg、约250mg、约300mg、约350mg或约400mg。
[0294]
v.某些给药方案
[0295]
在某些实施方案中,本文描述一次或多次向受试者施用治疗有效量的寡聚化合物isis 721744的方法。在某些实施方案中,方法包括施用治疗有效量至少1、2、3、4、5、6、7、8、
9或10次。在某些实施方案中,方法包括约每2周一次施用治疗有效量。在某些实施方案中,方法包括约每3周一次施用治疗有效量。在某些实施方案中,方法包括约每4周一次施用治疗有效量。在某些实施方案中,方法包括约每8周一次施用治疗有效量。在某些实施方案中,方法包括每2周一次施用治疗有效量。在某些实施方案中,方法包括每3周一次施用治疗有效量。在某些实施方案中,方法包括每4周一次施用治疗有效量。在某些实施方案中,方法包括每8周一次施用治疗有效量。
[0296]
在某些实施方案中,方法包括约每1天、约每2天、约每3天、约每4天、约每5天、约每6天、约每7天、约每8天、约每9天、约每10天施用治疗有效量。
[0297]
在某些实施方案中,方法包括约每1周、约每2周、约每3周、约每4周、约每5周、约每6周、约每7周、约每8周、约每9周、约每10周、约每11周、约每12周、约每13周、约每14周、约每15周、约每16周、约每17周、约每18周、约每19周或约每20周施用治疗有效量。
[0298]
在某些实施方案中,方法包括施用治疗有效量至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月或至少约12个月。
[0299]
负荷和维持剂量
[0300]
在某些实施方案中,治疗有效量作为负荷剂量和/或维持剂量施用。在某些实施方案中,方法包括施用一个或多个负荷剂量且随后施用一个或多个维持剂量。在某些实施方案中,方法包括约每3周一次施用负荷剂量,以及随后约每4周一次施用维持剂量。在某些实施方案中,方法包括约每4周一次施用负荷剂量,以及随后约每8周一次施用维持剂量。
[0301]
在某些实施方案中,方法包括施用至少2个负荷剂量、至少3个负荷剂量、至少4个负荷剂量、至少5个负荷剂量或至少6个负荷剂量。在某些实施方案中,方法包括施用2、3、4、5、6、7、8、9、10、11、12、13、14、15或16个负荷剂量。在某些实施方案中,方法包括约每1周一次、约每2周一次、约每3周一次、约每4周一次、约每5周一次、约每6周一次、每7周一次,约每8周一次,约每9周一次、约每10周一次、约每11周一次或约每12周一次施用一个或多个负荷剂量。在某些实施方案中,方法包括施用初始负荷剂量和在施用初始负荷剂量后约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周或约12周施用第二负荷剂量。
[0302]
在某些实施方案中,方法包括施用至少2个维持剂量、至少3个维持剂量、至少4个维持剂量、至少5个维持剂量或至少6个维持剂量。在某些实施方案中,方法包括施用2、3、4、5、6、7、8、9、10、11、12、13、14、15或16个维持剂量。在某些实施方案中,方法包括约每4周一次、约每5周一次、约每6周一次、约每7周一次、约每8周一次、约每9周一次、约每10周一次、约每11周一次、约每12周一次、约每13周一次、约每14周一次、约每15周一次、约每16周一次、约每17周一次、约每18周一次、约每19周一次或约每20周一次施用一个或多个维持剂量。在某些实施方案中,方法包括施用第一维持剂量和在施用第一维持剂量后约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周、约15周、约16周、约17周、约18周、约19周或约20周施用第二维持剂量。
[0303]
在某些实施方案中,方法包括在施用最后一个负荷剂量后约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周、约15周、约16周、约17周、约18周、约19周或约20周施用一个或多个第一维持剂量。
[0304]
vi.效力和功效
[0305]
在某些实施方案中,本文描述了降低人受试者的细胞或生物流体中的pkk rna、pkk蛋白和/或pkk活性的方法,其中所述方法包括向受试者施用治疗有效量的isis 721744。在某些实施方案中,方法降低人受试者血液中的pkk rna、pkk蛋白和/或pkk活性。在某些实施方案中,方法降低人受试者肝脏中的pkk rna、pkk蛋白和/或pkk活性。可以确定方法是否减少pkk rna、pkk蛋白和/或pkk活性,例如通过检测/量化施用前获得的第一生物样品中的pkk rna、pkk蛋白和/或pkk活性的第一量和检测/量化施用后获得的第二生物样品中的pkk rna、pkk蛋白和/或pkk活性的第二量,并且通过比较第一量与第二量来检测或量化pkk rna、pkk蛋白和/或pkk活性的减少。
[0306]
在某些实施方案中,方法包括将pkk rna、pkk蛋白、pkk活性或它们的组合降低1-100%,或由这些值中的任何两个定义的范围。在某些实施方案中,方法包括将pkk rna和/或pkk蛋白降低1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。
[0307]
在某些实施方案中,方法包括将细胞或受试者中的pkk rna、pkk蛋白、pkk活性或它们的组合降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。
[0308]
在某些实施方案中,方法包括将细胞或受试者中的pkk rna、pkk蛋白、pkk活性或它们的组合降低约5%至约10%、约10%至约15%、约15%至约20%、约20%至约25%、约25%至约30%、约30%至约35%、约35%至约40%、约40%至约45%、约45%至约50%、约50%至约55%、约55%至约60%、约60%至约65%、约65%至约70%、约70%至约75%、约75%至约80%、约80%至约85%、约85%至约90%、约90%至约95%或约95%至100%。
[0309]
在某些实施方案中,方法包括向受试者施用isis 721744且检测或量化受试者的细胞或生物流体中的pkk rna、pkk蛋白、pkk活性或它们的组合。在某些实施方案中,方法包括检测/量化施用前获得的第一生物样品中的pkk rna、pkk蛋白、pkk活性或它们的组合;检测/量化施用后获得的第二生物样品中的pkk rna、pkk蛋白、pkk活性或它们的组合;以及通过比较第一量与第二量来检测或量化pkk rna、pkk蛋白、pkk活性或它们的组合的减少。在某些实施方案中,第二生物样品在施用后小于约24小时获得。在某些实施方案中,第二生物样品在施用后小于约1周获得。在某些实施方案中,第二生物样品在施用后约1周、约2周、约3周、约4周、约5周、约6周、约7周、约8周、约9周、约10周、约11周、约12周、约13周、约14周、约15周、约16周、约17周或约18周获得。在某些实施方案中,方法包括在比较第一量与第二量之后增加或减少剂量。在某些实施方案中,方法包括在比较第一量与第二量之后更频繁或更不频繁地施用。
[0310]
评估isis 721744的功效
[0311]
a.遗传性血管性水肿
[0312]
在某些实施方案中,本文所述的方法足以有效地改善或预防人受试者的遗传性血管性水肿的至少一种症状。在某些实施方案中,遗传性血管性水肿的至少一种症状选自肿胀、恶心、呕吐、瘙痒、头痛、疲劳、腹痛、呼吸短促、鼻炎、过敏反应和支气管收缩,以及它们的组合。
[0313]
在某些实施方案中,本文所述的方法足以有效地降低患有hae的受试者的血管性水肿发作的发生率。在某些实施方案中,本文所述的方法将血管性水肿发作的发生率降低至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%或至少约90%,如在至少约1个月、至少约2个月、至少约3个月、至少约4个月、约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月内所测量。在某些实施方案中,血管性水肿发作包括突破性发作。
[0314]
在某些实施方案中,本文所述的方法足以有效地减轻患有hae的受试者的血管性水肿发作的严重度。在某些实施方案中,本文所述的方法足以有效地将患有血管性水肿发作的受试者的身体部分的肿胀减少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或99%,或由这些值中的任何两个定义的范围。在施用寡聚化合物isis 721744之前和之后,可以测量肿胀的减少,例如在身体部位(例如腹部、手臂、手腕、脚踝、颈部)周围用卷尺测量。在某些实施方案中,血管性水肿发作是突破性发作。
[0315]
在某些实施方案中,本文所述的方法足以有效降低难以用抗水肿剂治疗的hae受试者的血管性水肿发作的严重度或发生率。在某些实施方案中,相对于用至少一种抗水肿剂治疗前,难以用抗水肿剂治疗的受试者经历血管性水肿发作频率的小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%降低,如在用至少一种抗水肿剂治疗后的至少1、至少2、至少3、至少4或至少6个月内所测量。在某些实施方案中,相对于用至少一种抗水肿剂治疗前,难以用至少一种抗水肿剂治疗的受试者不经历血管性水肿发作频率的降低,如在用至少一种抗水肿剂治疗后的至少1、至少2、至少3、至少4或至少6个月内所测量。在某些实施方案中,相对于用至少一种抗水肿剂治疗前,难以用抗水肿剂治疗的受试者经历肿胀的小于约5%、小于约10%、小于约20%、小于约30%、小于约40%或小于约50%减轻,如在用至少一种抗水肿剂治疗后约1小时、约2小时、约4小时、约8小时、约12小时、约24小时或约48小时所测量。在某些实施方案中,难以用抗水肿剂治疗的受试者继续具有血管性水肿发作的至少一种症状,如在用至少一种抗水肿剂治疗后约1小时、约2小时、约4小时、约8小时、约12小时、约24小时或约48小时所观察。在某些实施方案中,当用一种或多种抗水肿剂进行预防性治疗时,难治性受试者继续具有一种或多种遗传性血管性水肿症状。在某些实施方案中,当用一种或多种抗水肿剂进行预防性治疗时,难治性受试者继续具有血管性水肿发作。在某些实施方案中,血管性水肿发作包括突破性发作。
[0316]
b.黄斑水肿
[0317]
在某些实施方案中,本文所述的方法足以有效地改善人受试者的黄斑水肿的至少一种症状。在某些实施方案中,黄斑水肿的至少一种症状选自视力模糊、水波样视觉、视物变形、视力丧失和它们的组合。
[0318]
在某些实施方案中,本文所述的方法足以有效改善患有黄斑水肿的受试者的视力,如通过中央亚区厚度(cst),也称为(中央)中心凹厚度所评估。cst是直径为1mm的黄斑
最中央区域中的黄斑平均厚度,并且可以用zeiss cirrus仪器或heidelberg spectralis仪器测量。在某些实施方案中,黄斑水肿受试者在投与前具有至少约300μm、至少约310μm、至少约320μm、至少约330μm、至少约340μm或至少约350μm的cst。在某些实施方案中,方法将受试者的cst降低至少约10μm、至少约20μm、至少约30μm、至少约40μm、至少约50μm或至少约60μm。
[0319]
在某些实施方案中,本文所述的方法足以有效改善患有黄斑水肿的受试者的视力或最佳矫正视力(bcva),如通过斯内伦视力表(snellen chart)、斯隆视力表(sloan chart)或早期治疗糖尿病性视网膜病变研究(etdrs)表所评估。这些图表提供了字母行,所述字母随着后续的每一行而逐渐变小。图表与受试者保持一定距离,并要求受试者阅读字母。受试者根据他们阅读字母行的能力而获得分数。在某些实施方案中,患有黄斑水肿的受试者具有小于20/25、小于20/32、小于20/40、小于20/50或小于20/63的视力分数,如由斯内伦视力表或斯隆视力表或etdrs表上的同等分数所评估。在某些实施方案中,方法将这些图表中的任一个上的视力提高至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10个字母。
[0320]
在某些实施方案中,本文所述的方法足以有效改善患有黄斑水肿的受试者的视力,提高受试者在通过彩色眼底照相评估的糖尿病性视网膜病变严重程度量表(drss)上的评级。staurenghi等,br j ophthalmol.2018;102:954-958更详细地描述了drss。在某些实施方案中,方法提供受试者的drss分数的至少2步改进。
[0321]
vii.某些组合疗法
[0322]
在某些实施方案中,方法包括将isis 721744与至少一种其它药剂共同施用。在某些实施方案中,至少一种其它药剂改善水肿。在某些实施方案中,水肿为遗传性血管性水肿。在某些实施方案中,水肿为黄斑水肿。在某些实施方案中,isis 721744与至少一种其它药剂共同施用以产生组合效应。在某些实施方案中,isis 721744与至少一种其它药剂共同施用以产生协同效应。
[0323]
在某些实施方案中,isis 721744和至少一种其它药剂在相同时间施用。在某些实施方案中,isis 721744和至少一种其它药剂在不同时间施用。在某些实施方案中,isis 721744和至少一种其它药剂在单一配制物中一起制备。在某些实施方案中,施用的isis 721744和至少一种其它药剂分开制备。
[0324]
在某些实施方案中,isis 721744与抗水肿剂共同施用于患有hae的受试者。抗水肿剂的非限制性实例包括c1-inh蛋白、血管紧张素转换酶抑制剂、血管紧张素ii 1型受体阻断剂(arb)、抗组胺剂、皮质类固醇、抗纤维蛋白溶解剂(例如氨甲环酸)、缓激肽抑制剂、缓激肽2型受体阻断剂(例如艾替班特)、激肽释放酶抑制剂(例如拉那鲁单抗(lanadelumab)、艾卡拉肽(ecallantide)、bcx7353)和减弱的雄激素(例如达那唑、康力龙、氧雄龙)。在某些实施方案中,抗水肿剂是源自血浆的c1-inh浓缩物或重组c1-inh浓缩物。在某些实施方案中,受试者是女性并且抗水肿剂包含能够在受试者中消耗雌激素或抑制雌激素活性的促性腺激素释放激素或其类似物。
[0325]
在某些实施方案中,isis 721744与皮质类固醇、非甾体抗炎药(nsaid)和血管内皮生长因子(vegf)抑制剂(例如抗vegf抗体)中的至少一种共同施用至患有黄斑水肿的受试者。
[0326]
在某些实施方案中,isis 721744与抗血栓形成剂共同施用至有需要的受试者。抗血栓形成剂的非限制性实例包括非甾体抗nsaid、环氧合酶抑制剂(例如阿司匹林)、二磷酸腺苷(adp)受体抑制剂(例如氯吡格雷和噻氯匹定)、磷酸二酯酶抑制剂(例如西洛他唑)、糖蛋白iib/iiia抑制剂(例如阿昔单抗、依替巴肽、替罗非班和去纤维肽)、腺苷再摄取抑制剂(例如双嘧达莫)、香豆素(例如华法林)、肝素和其衍生物(例如依诺肝素)、直接凝血酶抑制剂(例如来匹卢定、比伐卢定)、阿哌沙班和直接干扰特定凝血因子酶促作用的小分子化合物(例如利伐沙班,其干扰因子xa)。
[0327]
在某些实施方案中,isis 721744与抗炎剂共同施用至有需要的受试者。抗炎剂的非限制性实例包括甲氨蝶呤、阿巴西普、英利昔单抗、环磷酰胺、硫唑嘌呤、皮质类固醇、环孢菌素a、氨基水杨酸盐、柳氮磺胺吡啶、羟氯喹、来氟米特、依那西普、依法珠单抗、6-巯基嘌呤(6-mp)和肿瘤坏死因子-α(tnfα)和其它细胞因子阻断剂或拮抗剂。在某些实施方案中,抗炎剂包括非甾体抗炎药(nsaid)。nsaids包括但不限于乙酰水杨酸、胆碱水杨酸镁、二氟尼柳、水杨酸镁、双水杨酸酯、水杨酸钠、双氯芬酸、依托度酸、非诺洛芬、氟比洛芬、吲哚美辛、酮洛芬、酮咯酸、甲氯芬那酯、萘普生、萘丁美酮、保泰松、吡罗昔康、舒林酸、托美汀、对乙酰氨基酚、布洛芬、cox-2抑制剂、美洛昔康和曲马多。
[0328]
在某些实施方案中,方法包括向有需要的受试者施用isis 721744且在施用之前、期间和/或之后对受试者进行血浆置换。
[0329]
实施例
[0330]
以下实施例说明了本公开的某些实施方案并且不是限制性的。此外,在提供具体实施方案时,发明人已考虑了那些具体实施方案的一般应用。例如,具有具体基序的寡核苷酸的公开为具有相同或类似基序的另外的寡核苷酸提供了合理支持。并且,例如,除非另外指出,否则在特别高亲和力的修饰出现在具体位置处时,相同位置处的其它高亲和力修饰也被认为是合适的。
[0331]
实施例1:使用isis 721744进行的1期人体临床试验
[0332]
isis 721744在无菌盐水溶液中以100mg/ml的浓度提供。在一项随机、双盲、安慰剂对照研究中测试了不同剂量的isis 721744,以评估isis 721744在健康志愿者中的安全性、耐受性、药物动力学和药效学。受试者每月接受四次皮下注射的安慰剂或isis 721744,每次注射剂量为20、40、60或80mg。
[0333]
isis 721744产生血浆pkk蛋白(图1a)浓度和酶原活化(图1b)的剂量依赖性平均降低。如ferrone等人,“ionis-pkk
rx a novel antisense inhibitor of prekallikrein and bradykinin production,”2019,nucleic acid ther.,(29):82-91所述地测量酶原活化。各剂量组的血浆pkk水平的平均降低幅度在比基线低52.9%至93.6%范围内。在80mg组中,血浆pkk蛋白水平在最后一个剂量之后两周显示相比于基线93.6%(
±
2.3)的平均(
±
sd)下降。在此剂量组中的最后一个剂量后,药理学持续三个月,pkk水平相比于基线平均下降74.7%(
±
12.7)。类似地,在80mg剂量组中的最后一个剂量后,血浆酶原活化在两周时显示相比于基线98.6%(
±
2.0)的平均(
±
sd)降低,且在三个月时显示76.6%(
±
13.4)的降低。
[0334]
未发生严重不良事件,且无受试者因治疗出现的不良事件(teae)而中断给药。凝血、aptt和凝血酶原的实验室测试中无剂量或时间依赖性变化。
isis 721744或安慰剂的皮下治疗,每四周一次,持续至少十二周。在这十二周内并非未发作的患者被转换为100mg的剂量。在这十二周内未发作的患者的施用频率被降低到每八周一次。
[0347]
在多个时间点评估药效学和功效,包括测量裂解高分子量激肽原(chk)水平和/或血浆中pkk活性的百分比变化。pkk活性如实例2中所述地确定。主要终点是每月血管性水肿发作的时间标准化次数。在研究期间密切监测患者安全。安全性和耐受性评估包括例如体格检查、生命体征、不良事件、伴随用药和血浆实验室测试。
[0348]
实施例5:isis 721744用于黄斑水肿的2期人体临床试验
[0349]
isis 721744在糖尿病性黄斑水肿患者中的安全性和有效性在一项随机、双盲、安慰剂对照的2期研究中进行了评估。一些患者可能先前已接受过另一黄斑水肿治疗,例如抗vegf抗体或其它vegf抑制剂治疗。在第1、3、5、9和13周,患者被随机分配接受80mg isis 721744或安慰剂的皮下治疗。
[0350]
在多个时间点评估药效学和功效。主要终点是在第一次给药后17周和25周时中央视网膜亚区厚度(cst)减少》60μm的患者比例。次要终点是在第一次给药后17周和25周时最佳矫正视力(bcva)平均增加≥5的患者比例。其它探索性终点包括cst和bcva评分的平均变化;糖尿病性视网膜病变严重程度量表(drss)的≥2步改善;定义为cst的黄斑水肿分辨率,在cirrus上小于300μm或在heidelberg spectralis仪器上小于320μm;视力字母评分提高10个字母(2行增益)或15个字母(3行增益);以及血浆pkk rna浓度和/或血浆pkk蛋白浓度随时间的绝对和相对降低。在研究期间密切监测患者安全。安全性和耐受性评估包括例如体格检查、生命体征、不良事件、伴随用药和血浆实验室测试。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。