1.本发明提供了一种用于在测试样品中检测具有复制能力的病毒(复制型病毒,复制感受态病毒,replication competent virus)的新方法。所述方法包括培养和稀释多个单独的细胞培养物等分试样(aliquots),该等分试样包含病毒允许细胞(容许病毒感染细胞,virus-permissive cells)和一部分测试样品,随后测试具有复制能力的病毒的存在。所述方法可以与阳性对照平行使用,其也在本文中提供。
背景技术:
2.基因疗法广泛涉及使用遗传物质来治疗疾病。可以使用载体将治疗性遗传物质合并到宿主的靶细胞中,以实现核酸的转移。此类载体一般可分为病毒和非病毒类别。使用病毒载体递送治疗性基因是众所周知的,基因疗法产品现在是我们全球医疗保健市场的重要组成部分。
3.作为复制周期的一部分,病毒自然地将其遗传物质引入宿主的靶细胞。工程化病毒载体利用这种能力将目的核苷酸(nucleotide of interest,noi)递送至靶细胞。迄今为止,许多病毒已被工程化为基因疗法的载体。这些包括逆转录病毒、腺病毒(adv)、腺相关病毒(aav)、单纯疱疹病毒(hsv)和牛痘病毒(vacv)。
4.逆转录病毒载体已被开发用于各种遗传病症的疗法,并在临床试验和批准的治疗性产品(例如strimvelis
tm
和kymriah
tm
等))中继续显示出越来越好的前景。目前,journal of gene medicine数据库中注册了超过459项涉及逆转录病毒基因疗法的人体临床试验;158项基因疗法临床试验正在使用慢病毒载体(http://www.abedia.com/wiley/vectors.php,2017年4月更新)。
5.用于基因疗法的病毒载体通常被工程化为具有复制缺陷。因此,重组载体可以直接感染靶细胞,但不能产生感染性病毒体的更多代。其它类型的病毒载体可以仅在癌细胞内具有条件复制能力,并且可以附加地编码毒性转基因或酶原。
6.用于人类基因疗法和疫苗接种的病毒载体的制备有据可查。众所周知的病毒载体制备方法包括用载体dna成分转染原代细胞或哺乳动物/昆虫细胞系,然后进行有限的温育期,然后从培养基中收获粗载体(在本文中称为“收获上清液”)和/或细胞。通常,载体生产所需的每种成分都由单独的质粒编码,部分是出于安全原因,因为其然后需要发生许多重组事件以便通过该生产过程形成具有复制能力的病毒颗粒。
7.尽管病毒载体被工程化为具有复制缺陷,但在许多情况下,可能可取的是或甚至必需验证在样品或组合物(例如配制用于给药的治疗性或药物组合物)中不存在具有复制能力的病毒(例如作为具有复制能力的逆转录病毒(rcr)或具有复制能力的慢病毒(rcl))。存在用于验证不存在具有复制能力的病毒的许多方法,包括[1]检测在逆转录病毒(和推定的rcr/rcl)中表达但不在病毒载体颗粒中表达的基因转录的pcr测定(参见例如wo2019/152747),[2]测量推定rcr/rcl的必要功能特性的测定(sastry et al.,2005),和[3]表型分析,例如噬斑形成测定(forestell et al.,1996)。在大多数测定形式中,需要基于细胞
的阶段来扩增测试物品中存在的任何潜在rcr/rcl以增加置信度/灵敏度,然后进行终点测定。在测试物品(例如载体产品)与推定的rcr/rcl具有相同的特性(例如逆转录酶活性)的情况下,扩增阶段还提供了稀释该活性的必要时间,以便终点测定可以明确检测到可能存在的实际rcr/rcl的潜在信号。这是通过将合适的阳性对照病毒增添到(spiked into)用测试物品接种的扩增细胞培养物中来建模的。对于rcr/rcl测试,测试物品是载体材料且也是生产后细胞,因此需要对任何给定批次的载体产品进行两次测试。然而,许多因素使得具有复制能力的病毒(rcv)测试变得复杂,特别是关于培养阶段的规模。过去曾报道过由正在开发用于临床用途的病毒载体系统产生的rcv,但来自第三代慢病毒系统的rcl尚未见报道。因此,rcv检测系统必须预测当前理论上的病毒。因此,通常需要十五个或更多个各自具有至少40ml培养物的烧瓶来启动每次测定,该测定要经过多个传代。因此,通常需要在3到4周的测定时间过程中处理超过100个烧瓶。因此,这些方法可能既费时又费力,尤其是因为这些测试方法通常需要在3级遏制(containment)下进行,具体取决于所采用的阳性对照病毒。在许多培养瓶中长时间手动传代大量样品也增加了人为错误和/或引入微生物污染的可能性,这两者都会导致代价高昂的测定失败或终止。
[0008]
需要一种用于在测试样品中检测具有复制能力的病毒的改善方法。
技术实现要素:
[0009]
本发明基于以下令人惊讶的发现,即当使用较低的单独等分体积(例如小于12ml)时,仍可以准确检测具有复制能力的病毒。这一发现使此类测定更容易自动化,例如通过使用包含可以被机器人处理的多个孔的组织培养板。此类测定的自动化显著减少了操作员的工作量并提高了测定通量(产量,throughput)。此外,发明人发现在传代低体积等分试样期间可以使用至少2的稀释因子,而不会不利地影响灵敏度。有利地,本文所述的方法可用于减少用于具有复制能力的病毒检测的总体积和/或等分试样数量,同时保持灵敏度。
[0010]
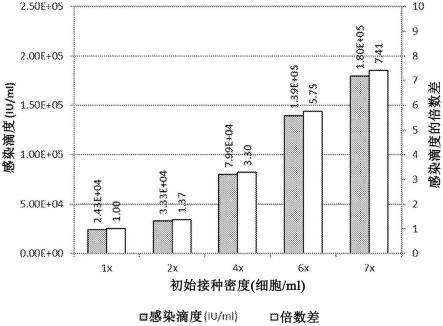
发明人还研究了哪些初始细胞接种密度可用于本文所述的单位体积。有利的是,他们发现可以使用至少总计1x105个细胞/ml的接种密度。令人惊讶的是,他们还发现增加初始接种密度会增加测定的灵敏度,而不会对相应阳性对照的感染速率产生抑制作用。有利的是,因此可以使用在约总计1x105个细胞/ml至总计1x107个细胞/ml范围内的初始接种密度(例如,在约总计5x105个细胞/ml至约总计1x107个细胞/ml的范围内,诸如总计1x106个细胞/ml至约总计1x107个细胞/ml)。因此,本文所述的接种密度可用于增加感染速率和/或减少所需测试样品的总初始体积,同时仍遵守fda指南。
[0011]
当制备的用于基因疗法的病毒产品需要在临床发布之前进行测试时,本文描述的方法很有用。在此背景下,本文所述的方法可以与任何适当的阳性对照(例如减毒性具有复制能力的慢病毒,其具有在其核苷酸序列内的至少一个附属基因(accessory gene,附加基因)发生功能性突变,其中所述至少一个附属基因选自:vif、vpr、vpx、vpu和nef,如本文其它地方所述)同时进行。在此背景下,发明人还已经生成了一种新的vif 、δvpr、δvpu和δnef hiv-1具有复制能力的病毒(本文中称为“hivδa3vif ”),在与本文所述的方法结合使用时其特别有用,因为其在整个测定时间过程中保持感染性。因此,这种阳性对照可以有利地用于本文所述的测定背景中。
[0012]
发明人已经使用包含用于制备慢病毒载体的生产终末细胞(eopc)的测试样品证
明了本发明。然而,本文所述的方法同样适于用于在包含所制备的慢病毒载体本身(例如收获上清液)的测试样品中检测具有复制能力的病毒的方法,因为用于测试慢病毒载体或eopc的细胞培养方法依赖于相同的因素,即病毒允许细胞存在至少十五天(即在测定的时间过程中)的传染性、敏感性和培养。
[0013]
下面提供的数据表明,本文所述的新方法可用于检测具有复制能力的慢病毒。然而,本发明不限于慢病毒系统并且可以用于检测任何具有复制能力的病毒,诸如逆转录病毒、腺病毒、腺相关病毒、单纯疱疹病毒或牛痘病毒,前提条件是使用相容的病毒允许细胞和相应的阳性对照。如将在下面更详细地描述的,本领域技术人员可以很容易地识别与其选择的病毒一起使用的相容病毒允许细胞和相应阳性对照。
[0014]
一种用于在测试样品中检测具有复制能力的病毒的方法,包括:
[0015]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积小于12ml,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0016]
b)培养所述等分试样至少9天;
[0017]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0018]
d)测试具有复制能力的病毒的存在。
[0019]
适当地,所述病毒可以选自由以下组成的组:逆转录病毒、腺病毒、腺相关病毒、单纯疱疹病毒和牛痘病毒。
[0020]
适当地,所述逆转录病毒可以是慢病毒。
[0021]
适当地,步骤a)中每个单独的细胞培养物等分试样的最大水体积可以选自:11ml、10ml、5ml或3ml。
[0022]
适当地,在步骤c)中,所有等分试样的总体积可减少至少50%。适当地,所述测试样品可以包含病毒颗粒或生产终末细胞。
[0023]
适当地,所述病毒允许细胞可以是是非贴壁的。
[0024]
适当地,所述病毒允许细胞可以选自:
[0025]
a)永生化t细胞系,任选其中所述细胞选自jurkat、cem-ss、pm1、molt4、molt4.8、supt1、mt4或c8166细胞;或
[0026]
b)非t细胞系,任选其中所述细胞选自hek293或92br细胞。
[0027]
适当地,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0028]
适当地,步骤a)中所述多个单独细胞培养物等分试样的初始接种密度可以在约总计1
×
105个细胞/ml至约总计1
×
107个细胞/ml的范围内。
[0029]
适当地,步骤a)中所述多个单独的细胞培养物等分试样的初始接种密度可以在约总计1
×
106个细胞/ml至总计1
×
107个细胞/ml的范围内。
[0030]
适当地,步骤c)可以包括将所述等分试样再培养至少8天或9天。
[0031]
适当地,每个单独的细胞培养等分试样可以在细胞培养容器内。
[0032]
适当地,所述细胞培养容器可以选自细胞培养管、细胞培养皿或包括多个孔的细胞培养板。
[0033]
适当地,所述包括多个孔的细胞培养板可以选自由以下组成的组:4孔、6孔、8孔、
12孔、24孔、48孔、96孔和384孔细胞培养板。
[0034]
适当地,所述包括多个孔的细胞培养板可以是12孔板或24孔板。
[0035]
适当地,所述方法可以是自动化的。
[0036]
适当地,可以使用pcr或elisa测试具有复制能力的病毒的存在。
[0037]
适当地,可以使用逆转录酶测定测试具有复制能力的病毒的存在。
[0038]
适当地,所述方法可用于检测测试样品中具有复制能力的慢病毒,并且所述方法可以与包含减毒性具有复制能力慢病毒的阳性对照样品平行进行,该慢病毒具有在其核苷酸序列内功能突变的至少一个附属基因,其中所述至少一个附属基因选自:vif、vpr、vpx、vpu和nef。
[0039]
适当地,所述方法可以用于检测测试样品中具有复制能力的hiv、siv、shiv或其变体。
[0040]
适当地,所述减毒性具有复制能力的慢病毒可以具有vif、vpr、vpx、vpu和nef中的至少三个发生功能突变。
[0041]
适当地,所述减毒性具有复制能力的病毒可以包含根据seq id no:1的核酸序列。
[0042]
适当地,所述方法可以用于测试用于基因疗法的产品。
[0043]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0044]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为10ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0045]
b)培养所述等分试样至少9天;
[0046]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0047]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独细的胞培养物等分试样的总体积可以是至少约115ml。
[0048]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0049]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为5ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0050]
b)培养所述等分试样至少9天;
[0051]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0052]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0053]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0054]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为3ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0055]
b)培养所述等分试样至少9天;
[0056]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0057]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0058]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0059]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为2ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0060]
b)培养所述等分试样至少9天;
[0061]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0062]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0063]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0064]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为1ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0065]
b)培养所述等分试样至少9天;
[0066]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0067]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0068]
适当地,所述用于在测试样品中检测具有复制能力的病毒的方法可以包括:
[0069]
a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为0.6ml或更少,其中每个等分试样包含所述样品的一部分和病毒允许细胞;
[0070]
b)培养所述等分试样至少9天;
[0071]
c)将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样;和
[0072]
d)测试具有复制能力的病毒的存在。在这个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。
[0073]
还提供了包含根据seq id no:1的核酸序列的具有复制能力的病毒。
[0074]
贯穿本说明书的描述和权利要求,词语“包括”和“包含”及其变体表示“包括但不限于”,它们不旨在(且不)排除其它部分、添加剂、组分、整数或步骤。
[0075]
贯穿本说明书的描述和权利要求,单数包括复数,除非上下文另有要求。特别地,在使用不定冠词的情况下,除非上下文另有要求,否则说明书应理解为考虑复数和单数。
[0076]
结合本发明的特定方面、实施方式或实施例描述的特征、整数、特性、化合物、化学部分或基团应理解为适用于本文所述的任何其它方面、实施方式或实施例,除非与之不相容。
[0077]
下面更详细地描述本发明的各个方面。
附图说明
[0078]
下面参考附图对本发明实施方式作进一步描述,其中:
[0079]
图1显示了增加初始接种密度对计算的感染滴度的影响(操作员1)。
[0080]
图2显示了增加初始接种密度对计算的感染滴度的影响(操作员2)。
[0081]
图3示出了显示特定实施例的示意图,其中在测定的过程中将8x24孔板依次汇集
到1x12孔板中。
[0082]
图4显示了用于生成rcl测定阳性对照病毒的附属基因敲除的示意图。显示了野生型(wt)hiv-1前病毒基因组结构;u3启动子驱动转录,转录由tat激活。未剪接和单剪接的mrna分别编码gagpol和env蛋白,并且未剪接的vrna被包装到病毒体中。未剪接的mrna需要反式rev以从细胞核中输出。载体系统中不存在附属基因vif、vpr、vpu和nef,并且通常仅在原代细胞中复制需要。理想情况下,适用于rcl测定的阳性对照病毒应是载体系统所基于的亲本病毒的最减毒版本(在本例中为hiv-1)。减毒变体hivδa3vif 和hivδa4编码/表达tat和rev,它们是复制所绝对必需的。附属基因在两种变体中都发生了功能突变,除了在使用c8166-45细胞时hivδa3vif 中需要vif外,因为这些细胞表达低水平的限制因子apobec3g,而vif可以抵消限制因子apobec3g。
[0083]
图5显示了所进行的实验的概述和数据,该实验表明完全减毒的hiv-1(hivδa4)在c8166细胞中的传代过程中失去传染性。首先通过瞬时转染在hek293t细胞中产生在vif、vpr、vpu和nef中具有功能性突变的hivδa4前病毒dna。通过f-pert(rt-qpcr)滴定所得到的hivδa4病毒储液以量化rt单位的数量。然后在c8166细胞上滴定病毒储液,用10倍连续稀释的病毒一式三份感染(每孔1000比1rt单位),然后在接种后的数天后通过f-pert测量从头产生的hivδa4。在f-pert测定中,将感染的阳性-阴性阈值设置为ct 25;低于ct 25表明在第1代之前(第0代)明确地从头产生了hivδa4。并行地,用100rt单位的hivδa4病毒储液接种c8166细胞的主要培养物并传代六次,然后生成用于rcl测定的病毒pc库。然而,如第0代进行的那样重复对这一最终hivδa4病毒储液的f-pert分析后,表明尽管用rt单位匹配量的hivδa4病毒接种新鲜c8166细胞,但与起始病毒储液相比,从头hivδa4的产生显著减少。这表明在c8166细胞中传代的病毒随着时间的推移而减毒。推测这是由于文献报道的c8166细胞中apobec3g的低水平表达导致的。
[0084]
图6显示了对编码hivδa4或hivδa3vif 的质粒dna的限制酶消化的溴化乙锭染色琼脂糖凝胶分析,证明通过克隆成功“重新插入”vif orf。
[0085]
图7显示了所进行的实验的概述和数据,该实验表明通过长期感染c8166细胞保持病毒活性需要vif功能。首先通过瞬时转染在hek293t细胞中产生野生型hiv-1(nl4-3)、hivδa4和hivδa3vif 病毒储液。在t25烧瓶中,使用100rt单位的各病毒储液感染1.5x106个c8166细胞,并且培养3-4天以允许从头病毒生产。在每个传代点,对无细胞培养上清液进行取样并分析rt活性(f-pert测定),然后用0.1ml无细胞上清液接种新鲜c8166细胞培养物(即,仅上清液传代病毒)。绘制了每个传代点上清液中的rt活性,表明hivδa4逐渐失去感染新细胞的能力,而hivδa3vif 病毒能够有效感染细胞,从而在传代前的每个点产生最大感染的培养物。在第6代对三种病毒基因组中pol内的一个区域进行测序,显示hivδa4中的g》a超突变事件与野生型或hivδa3vif(数据未显示)相比增加了约10倍,这与hivδa4丧失传染性是由于apobec3g的半限制性水平所致的假设一致。
[0086]
本文提及的专利、科学和技术文献确立了本领域技术人员在提交申请时可获得的知识。已授权的专利、已公布的和未决的专利申请以及本文引用的其它出版物的全部公开内容在此通过引用并入本文,其程度如同每一个被具体且单独地指示通过引用并入一样。如有任何不一致之处,以本公开为准。
[0087]
下面更详细地描述了本发明的各个方面。
具体实施方式
[0088]
用于检测具有复制能力的病毒的方法
[0089]
本文提供了一种在测试样品中检测具有复制能力的病毒的新方法。所述方法包括培养和稀释包含所述测试样品的一部分和病毒允许细胞的多个单独的细胞培养物等分试样,随后测试具有复制能力的病毒的存在。本文所述的方法对于测试基因疗法用产品特别有用。
[0090]
如本文所用,“测试样品”是指可以包含具有复制能力的病毒的任何目的样品。典型地,测试样品是否包含具有复制能力的病毒在所述方法开始时是未知的。
[0091]
在特定实例中,测试样品包含病毒颗粒或生产终末细胞。
[0092]
因此,在一个实例中,测试样品可以包含病毒颗粒。病毒颗粒在本文中也称为病毒载体颗粒、病毒体或病毒。病毒颗粒可以存在于细胞培养上清液中,该细胞培养上清液是在制备用于基因疗法的病毒载体期间收集的。此类细胞培养上清液在本文中也称为收获上清液。因此,测试样品可以是收获上清液。典型地,此类测定也称为“具有复制能力的病毒”测定(rcv测定,例如rcr测定(对于逆转录病毒)或rcl测定(对于慢病毒))。
[0093]
在另一个实例中,测试样品可以是生产终末细胞样品。典型地,此类测定称为“具有复制能力的病毒共培养物”测定(rcvcc测定,例如rcrcc测定(对于逆转录病毒)或rclcc测定(对于慢病毒)),因为它们需要生产终末细胞与病毒允许细胞的共培养。术语“生产终末细胞样品”是指包含生产终末细胞的任何样品。“生产终末细胞”是已用于制备病毒载体的细胞。换句话说,它们是在制备周期结束时剩余的生产细胞。生产细胞也称为病毒载体生产细胞或载体生产细胞。
[0094]“病毒载体生产细胞”、“载体生产细胞”或“生产细胞”应理解为能够生产病毒载体或病毒载体颗粒的细胞。载体生产细胞可以是“生产者细胞”或“包装细胞”。病毒载体系统的一种或多种dna构建体可以稳定整合或游离地保持在病毒载体生产细胞内。或者,可以将病毒载体系统的所有dna成分瞬时转染到病毒载体生产细胞中。在又一个替代方案中,可以用载体生产所需的剩余成分瞬时转染稳定表达一些成分的生产细胞。
[0095]
如本文所用,术语“包装细胞”是指含有产生病毒载体颗粒所必需的元件但缺乏载体基因组的细胞。任选地,此类包装细胞含有一种或多种能够表达病毒结构蛋白(例如gag、gag/pol和env)的表达盒。
[0096]
生产者细胞/包装细胞可以是任何适合的细胞类型。它们可以是体外培养的细胞,例如组织培养细胞系。它们通常是哺乳动物细胞,但可以是例如昆虫细胞。合适的哺乳动物细胞包括鼠成纤维细胞衍生的细胞系或人细胞系。优选地,载体生产细胞来源于人细胞系。合适的真核细胞例如哺乳动物或人类细胞的非限制性实例包括hek293t、hek293、cap、cap-t、cho细胞per.c6细胞。合适的昆虫细胞的非限制性实例可以是sf9细胞。
[0097]
用于将核酸引入生产细胞的方法在本领域中是众所周知的并且之前已经描述过。
[0098]
本文所述的方法用于在测试样品中检测具有复制能力的病毒的存在。如本文所用,“具有复制能力的病毒”是指能够复制的病毒,即它不是或不再是复制缺陷的。因此,该病毒可以直接感染靶细胞并能够产生更多代的感染性病毒体。
[0099]
可以使用本文所述的方法检测任何合适的病毒。例如,该病毒可以能够感染哺乳动物(优选人)细胞。合适的病毒可以选自由以下组成的组:逆转录病毒、腺病毒、腺相关病
毒、单纯疱疹病毒和牛痘病毒。例如,该病毒可以是慢病毒。在一个实例中,该病毒是sin(自灭活)病毒。在一些实例中,目的病毒可以是选择的mmlv、hiv-1、eiav或其变体。以下“一般定义”部分提供了每种病毒的详细信息。
[0100]
提供多个单独的细胞培养物等分试样
[0101]
本文所述的方法包括步骤:a)提供多个单独的细胞培养物等分试样,每个等分试样的最大水体积为少于12ml(例如,视情况而定最大水体积为11ml、10ml、5ml或3ml),其中每个等分试样包含所述测试样品中的一部分和病毒允许细胞。通过使用多个具有相对较小体积的等分试样,本文提供的方法可以更容易地自动化。令人惊讶的是,在rcr和rcrcc测定(以及它们的等效物,包括rcl和rclcc测定)的背景下,使用具有小培养体积的多个等分试样在测定中保持灵敏度。在此背景下,灵敏度至关重要,因为此类检测系统必须预测当前理论上的病毒。
[0102]
当与多个单独的细胞培养物等分试样(每个等分试样具有较小的最大水体积(例如3ml或更少))组合使用时,本文所述的方法特别有利,因为这种体积与自动化特别相关。
[0103]
如本文所用,“单独的细胞培养物等分试样”(本文也缩写为“等分试样”)是指存在于单个细胞培养反应室内的离散细胞培养体积。换言之,它是指存在于单个细胞培养反应室内的细胞培养组合物的总量。细胞培养反应室可以是细胞培养孔(例如细胞培养板内的孔)、细胞培养管、细胞培养皿或细胞培养瓶。
[0104]
细胞培养管、细胞培养瓶、细胞培养皿和细胞培养板在本文中被称为细胞培养容器,因为它们是可用于本文所述方法中的离散细胞培养产品(或消耗品)的实例。细胞培养管、细胞培养瓶、细胞培养皿通常是具有单个细胞培养反应室的细胞培养容器,而细胞培养板通常是具有多个细胞培养反应室(即多个孔)的细胞培养容器。其它合适的细胞培养容器在本领域中是众所周知的。
[0105]
因此,作为具体实例,细胞培养容器可以是包括多个孔的细胞培养板。在此背景下,细胞培养容器(板)具有多个细胞培养反应室(孔),每个反应室能够容纳一个单独的细胞培养等分试样(离散体积的细胞培养物)。
[0106]
任选地,所述细胞培养容器选自细胞培养管、细胞培养皿或包括多个孔的细胞培养板。优选地,细胞培养容器是包括多个孔的细胞培养板,因为这种形式最适合自动化。例如,细胞培养板可以选自4孔、6孔、8孔、12孔、24孔、48孔、96孔或384孔细胞培养板。在特定实例中,可以使用12孔板和/或24孔板。如本领域技术人员将清楚的,在包括多个孔的细胞培养板的情况下,每个孔被认为是可以含有单独的细胞培养物等分试样的独立细胞培养反应室。因此,4孔板是可包含至多四个单独的细胞培养物等分试样(在其独立细胞培养反应室/孔中的每个中都有一个等分试样)的细胞培养容器;6孔板是可以包含至多六个单独的细胞培养物等分试样(其独立细胞培养反应室/孔中的每个中都有一个等分试样)的细胞培养容器等。
[0107]
在一个实例中,单独的细胞培养物等分试样存在于作为细胞培养板的细胞培养容器中,因为细胞培养板特别适合自动化并且可用于高通量测定。如本领域技术人员清楚的那样,在某些情况下,使用细胞培养管也可能是有用的,因为此类细胞培养容器也可以用于自动化方法中(例如可以使用多个eppendorf管)。细胞培养皿也可用于自动化方法。因此,在一些实例中,单独的细胞培养物等分试样可以存在于细胞培养容器中,该容器是细胞培
养板、细胞培养皿或细胞培养管。在一些实例中,细胞培养容器不是细胞培养瓶。
[0108]
在优选的实例中,所述多个单独的细胞培养物等分试样在一个(或多个)细胞培养板中。所述多个单独的细胞培养物等分试样(例如每个具有较小的最大水体积,例如小于12ml,例如3ml或更少)由此可以存在于一个或多个细胞培养板中,其中所述板的孔含有所述等分试样(每孔一个等分试样)。在这一背景下,例如,可以在两个或多个24孔细胞培养板中提供48个或更多个单独的细胞培养物等分试样(即每个等分试样被提供在板内的独立孔内)。本领域技术人员可以容易地识别如何提供所述多个等分试样的其它实例(例如以一个或多个4孔、6孔、8孔、12孔、24孔、48孔、96孔或384孔细胞培养板或其组合的形式)。
[0109]
如本文所用,“多个单独的细胞培养物等分试样”是指两个或更多个单独的细胞培养物等分试样。本文所述的方法在步骤a)中可以提供8或更多、16或更多、24或更多、32或更多、40或更多、48或更多、56或更多、64或更多、72或更多、80或更多、88或更多、96或更多、104或更多、112或更多、120或更多、128或更多、136或更多、144或更多、152或更多、160或更多、168或更多、176或更多、184或更多、192或更多、384或更多个等单独的细胞培养物等分试样。
[0110]
本文提供的方法包括其中平行(即同时)培养所述多个单独的细胞培养物等分试样的情况以及其中顺序培养(即不完全相同的时间)所述多个单独的细胞培养物等分试样的情况。例如,所述方法包括其中所述单独的细胞培养物等分试样以例如8、12、24、48、96等批次培养的情况,其中顺次培养每个批次直至已培养例如192个单独的细胞培养物等分试样的总批次,以及直至准备好用于测试具有复制能力的病毒的存在。然而,一般来说,同时培养是优选的。
[0111]
在特定的实例中,在步骤a)中提供48或更多个单独的细胞培养物等分试样。在另一个实例中,在步骤a)中提供96或更多个单独的细胞培养物等分试样。在另一个实例中,在步骤a)中提供120或更多个单独的细胞培养物等分试样。在进一步的实例中,在步骤a)中提供192或更多个单独的细胞培养物等分试样。在另一个实例中,在步骤a)中提供384或更多个单独的细胞培养物等分试样。
[0112]
如本文所述,步骤a)的每个单独的细胞培养物等分试样具有小于12ml的最大水体积。
[0113]
步骤a)的所述多个单独的细胞培养物等分试样可以全部具有相同的体积,或者可以具有不同的体积,条件是每个单独的细胞培养物等分试样的最大水体积小于12ml。如本文所用,“最大水体积”是指可用于单独的细胞培养物等分试样的总水体积。换言之,所述单独的细胞培养物等分试样的水体积可小于12ml(例如11ml、10ml、5ml或3ml、或更少)。
[0114]
如本领域技术人员清楚的那样,“单独的细胞培养物等分试样”必须具有一定体积,否则它将不是等分试样。因此,等分试样的最小水体积不能为零。最小水体积的合理下限将取决于所使用的反应室。例如,可以将下限设置为0.1ml。换句话说,单独的细胞培养物等分试样的水样体积可以小于12ml(例如11ml、10ml、5ml或3ml或更少等),最小水体积为0.1ml。因此,本文所述的单独的细胞培养物等分试样可被认为具有在约0.1ml至所需最大水体积(小于12ml、11ml、10ml、5ml、3ml等)范围内的水体积。
[0115]
如上所述,本文所述的方法当与最大水体积为3ml的等分试样组合使用时特别有利,因为自动化方法中通常使用此类体积。因此,所述单独的细胞培养物等分试样的水体积
优选为3ml、或少于3ml(例如2.9ml或更少、2.8ml或更少、2.7ml或更少、2.6ml或更少、2.5ml或更少、2.4ml或更少、2.3ml或更少、2.2ml或更少、2.1ml或更少2.0ml或更少、1.9ml或更少、1.8ml或更少、1.7ml或更少、1.6ml或更少、1.5ml或更少、1.4ml或更少、1.3ml或更少、1.2ml或更少、1.1ml或更少、1.0ml或更少、0.9ml或更少、0.8ml或更少、0.7ml或更少、0.6ml或更少、0.5ml或更少、0.4ml或更少、0.3ml或更少、0.2ml或更少等)。典型地,如上所述,每个等分试样的最小水体积可以为0.1ml。
[0116]
在特定的实例中,步骤a)中所述单独的细胞培养物等分试样的水体积可以为2ml或更少。在另一个实例中,步骤a)中所述单独的细胞培养物等分试样的水体积可以为1ml或更少。在进一步的实例中,步骤a)中所述单独的细胞培养物等分试样的水体积可以为0.6ml或更少。
[0117]
如本领域技术人员将清楚的,所需的单独的细胞培养物等分试样的数量将取决于等分试样的大小和方法内待测试的测试样品的总体积。本领域技术人员将能够确定最大水体积小于12ml的单独细胞培养物等分试样的适当数量以用于其所需目的。
[0118]
例如,当使用24孔板时,可以使用每孔最大水体积0.6ml。
[0119]
例如,fda的rclcc测试指南规定,应测试1%或最多1x108个生产终末细胞(eopc)。在标准测试条件下,本领域技术人员可以通过将eopc与病毒允许细胞系(例如c8166细胞)共培养、细胞传代和收获上清液分析(例如通过f-pert)来进行此操作。使用常规基于烧瓶的测定,10个t225烧瓶可以单独接种1.00e 07个c8166细胞和1.00e 07个eopc,总体积为40ml。因此,rclcc测定的初始接种密度将为5.00e 05个细胞/ml。
[0120]
使用本文所述的方法时为了遵守fda指南,本领域技术人员将意识到,基于上述基于烧瓶的测定中使用的接种密度,28x24孔板可用于进行24孔板规模的rclcc测定,每孔最大水体积为0.6ml。因此,本领域技术人员将能够选择适当数量的具有适当培养体积(并且以适当的接种密度)的等分试样,以使用本文列出的参数进行其所需的方法。
[0121]
为免生疑问,可使用类似的方法来确定其它测定(如rcl检测或任何其具有复制能力的病毒测定)所需的等分试样数量和相应体积。
[0122]
在一个实例中,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以是至少约115ml。所述总体积可以在一个细胞培养容器内(例如,当仅使用一个细胞培养板时,其中所述总体积是板中所有等分试样的总和)或可以分布在多个细胞培养容器中(例如,当使用多于一个细胞培养板时,所述总体积是所有板中存在的所有等分试样的总和)。
[0123]
例如,在测试包含生产终末细胞的样品的背景下,步骤a)的所述多个单独细胞培养物等分试样的总体积可以至少为100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等)。
[0124]
因此,例如,在测试包含生产终末细胞的样品中的背景下,步骤a)的所述多个单独细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独细胞培养物等分试样的水体积各自可以为10ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为10ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0125]
替代地,在测试包含生产终末细胞的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为5ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为5ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0126]
例如,在测试包含生产终末细胞的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0127]
在一个实例中,在测试包含生产终末细胞的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0128]
在进一步的实例中,在测试包含生产终末细胞的样品中的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0129]
在一个实例中,在测试包含生产终末细胞的样品中的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0130]
例如,在测试包含病毒颗粒的样品的背景下(例如收获上清液),步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等)。例如,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等)。
[0131]
因此,例如,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞
培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为10ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为10ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0132]
替代地,在测试包含病毒颗粒的样品中的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为5ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为5ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0133]
例如,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0134]
在一个实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0135]
在进一步的实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0136]
在一个实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少30ml(例如至少40ml、至少50ml、至少60ml、至少70ml、至少80ml、至少90ml等),其中所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少,并且所有等分试样的总体积可以为至少约50ml。
[0137]
替代地,例如,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为10ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为10ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0138]
例如,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试
样的水体积各自可以为5ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为5ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0139]
替代地,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为3ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0140]
在一个实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为2ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0141]
在进一步的实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为1ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0142]
在一个实例中,在测试包含病毒颗粒的样品的背景下,步骤a)的所述多个单独的细胞培养物等分试样的总体积可以为至少100ml(例如100ml或更多、110ml或更多、115ml或更多、120ml或更多、130ml或更多、140ml或更多、150ml或更多、200ml或更多、250ml或更多、300ml或更多、350ml或更多、400ml或更多、450ml或更多等),其中所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少。在这个实例中,所述单独的细胞培养物等分试样的水体积各自可以为0.6ml或更少,并且所有等分试样的总体积可以为至少约115ml。
[0143]
本领域技术人员将清楚的,步骤a)所需的所述多个单独的细胞培养物等分试样的总体积将取决于步骤a)中所需的细胞总数和步骤a)的所述多个单独的细胞培养物等分试样中使用的初始接种密度。本领域技术人员将能够根据他们的期望目的适当地调整这些参数。
[0144]
本发明人已经确定,当使用各自最大水体积小于12ml(例如,视情况而定的最大水体积为11ml、10ml、5ml或3ml或更少)的多个单独的细胞培养物等分试样时,可以使用至少总计1x105个细胞/ml的初始接种密度。如本文所用,“接种密度”是指添加到细胞培养容器中以用细胞接种容器的每单位体积的细胞总数。在本发明的背景下,“初始接种密度”是指步骤a)中提供的每单位体积的细胞数。本文别处提供了根据本发明的方法的合适的接种密度。
[0145]
典型地,在本文所述方法中的培养开始时,所述等分试样中存在的细胞密度(初始接种密度)可以在约总计1x105个细胞/ml至约总计1x107个细胞/ml的范围内。在本上下文中,“总计细胞/ml”用来指代等分试样中的所有细胞(不论它们是来自测试样品中的细胞
(例如生产终末细胞)还是病毒允许细胞)。这种接种密度大致相当于常规基于烧瓶的培养方法中使用的密度。
[0146]
因此,在一个实例中,步骤a)中所述多个单独的细胞培养物等分试样的初始接种密度为至少总计1x105个细胞/ml、至少总计2x105个细胞/ml、至少总计3x105个细胞/ml、至少总计4x105个细胞/ml、至少总计5x105个细胞/ml、至少总计6x105个细胞/ml、至少总计7x105个细胞/ml、至少总计8x105个细胞/ml、至少总计9x105个细胞/ml、至少总计1x106个细胞/ml、至少总计2x106个细胞/ml、至少总计3x106个细胞/ml、至少总计4x106个细胞/ml、至少总计5x106个细胞/ml、至少总计6x106个细胞/ml、至少总计7x106个细胞/ml、至少总计8x106个细胞/ml、至少总计9x106个细胞/ml或至少总计1x107个细胞/ml。
[0147]
因此,在另一个实例中,步骤a)中所述多个单独的细胞培养物等分试样的初始接种密度在约总计1x105个细胞/ml至约总计1x107个细胞/ml的范围内。
[0148]
例如,步骤a)中所述多个单独的细胞培养物等分试样的初始接种密度在约总计5x105个细胞/ml至约总计1x107个细胞/ml的范围内。
[0149]
在另一个实例中,步骤a)中所述多个单独的细胞培养物等分试样的初始接种密度在约总计1x106个细胞/ml至约总计1x107个细胞/ml的范围内。
[0150]
所述多个单独的细胞培养物等分试样各自包含所述测试样品的一部分(即,被测试的总样品的一定百分比)和病毒允许细胞。病毒允许细胞是可以支持病毒生长并且允许病毒复制的细胞。允许细胞或宿主是允许病毒避开其防御而复制的细胞或宿主。用于本文所述方法的病毒允许细胞的类型典型地可以基于目的病毒来选择(即,将目的病毒与病毒允许细胞选定为相容)。合适的病毒允许细胞的非限制性实例包括:永生化t细胞系如c8166细胞(例如允许hiv),和非t细胞系如hek293细胞(例如允许mlv和eiav)。本领域技术人员可以容易地识别针对目的病毒的合适的病毒允许细胞。
[0151]
在一个实例中,所述病毒允许细胞是永生化t细胞系。适合的t细胞系包括jurkat、cem-ss、pm1、molt4、molt4.8、supt1、mt4或c8166细胞。
[0152]
在替代的实例中,所述病毒允许细胞是非t细胞系。适合的非t细胞系包括hek293或92br细胞。
[0153]
在一个实例中,所述病毒允许细胞是非贴壁的。如本文所用,“非贴壁细胞”是不附着于表面的细胞。为免生疑问,非贴壁细胞可在细胞培养物等分试样中形成细胞聚集体。许多细胞类型在溶液中生长并且不附着在表面上。非贴壁细胞可以通过简单地取少体积的亲本培养物并在新鲜生长培养基中稀释来进行继代培养。这些培养物中的细胞密度通常以
‘
细胞/ml’为单位测量。细胞通常将具有最佳生长的优选密度范围,并且继代培养(在本文中称为“传代”)通常会尝试将细胞保持在该范围内。在本文所述的方法中使用非贴壁细胞是特别有利的,例如当方法是自动化时。
[0154]
非贴壁病毒允许永生化t细胞系的非限制性实例是c8166细胞。在检测到病毒(例如hiv或等效物)被c8166所允许的情况下,本文所述的方法中通常使用c8166细胞。
[0155]
在替代实例中,所述病毒允许细胞是贴壁的。贴壁细胞附着在细胞培养容器底部等表面上生长。这些细胞类型必须先从表面脱离,然后才能进行继代培养。对于继代培养,细胞可以通过多种方法之一分离,包括胰蛋白酶处理以分解导致表面粘附的蛋白质、用edta螯合钙离子以破坏一些蛋白质粘附机制、或如重复洗涤或使用细胞刮刀等的机械方
法。然后将脱离的细胞重新悬浮在新鲜的生长培养基中,并使其沉降回到它们的生长表面上。
[0156]
贴壁病毒允许细胞的非限制性实例是hek293细胞(其为非t细胞系)。在检测到病毒(例如eiav或等效物)被hek293允许的情况下,本文所述的方法中通常使用hek293细胞。在一些实例中,hek293细胞也可以被认为是非贴壁的,因为它们可以适应悬浮状态。
[0157]
提供多个单独的细胞培养物等分试样的步骤可以包括从源样品产生所述多个单独的细胞培养物等分试样。换言之,所述方法可以包括将源测试样品与病毒允许细胞混合并将其分成等分试样的步骤,以产生所述单独的细胞培养物等分试样。因此,最初可以提供测试样品与病毒允许细胞的单一混合物,然后等分以提供多个单独的细胞培养物等分试样。替代地,所述方法可以包括将一部分源测试样品与一部分病毒允许细胞混合的步骤,以分别产生每个单独的细胞培养物等分试样。
[0158]
培养等分试样
[0159]
本文所述的方法包括培养所述细胞培养物等分试样。如本文所用,术语“培养”是指将细胞保持在人工(例如体外或离体)环境中。通常,细胞在有利于其增殖、分化和/或持续活力的条件下培养。通常在细胞培养基中培养细胞。
[0160]
术语“细胞培养基”和“培养基”(每种情况下的复数“培养基”)是指用于培养活细胞的营养溶液。本领域技术人员已知各种细胞培养基,他们还将理解待培养的细胞类型可决定待使用的培养基的类型。
[0161]
例如,培养基可以选自由以下组成的组:杜氏改良eagle培养基(dmem)、ham's f-12(f-12)、最小必需培养基(mem)、基础培养基eagle(bme)、rpmi-1640、ham's f-10、α最小必需培养基(αmem)、glasgow氏最小必需培养基(g-mem)和iscove氏改良dulbecco培养基(imdm)或它们的任何组合。在本公开的背景下可以等效地使用市售的(例如由thermo fisher scientific、waltham、ma市售)或以其它方式在本领域中公知的其它培养基。再次,仅作为实例,培养基可以选自由以下组成的组:293sfm、cd-cho培养基、vp sfm、bgjb培养基、brinster's bmoc-3培养基、细胞培养冷冻培养基、cmrl培养基、ehaa培养基、erdf培养基、fischer氏培养基、gamborg氏b-5培养基、glutamax
tm
补充培养基、grace氏昆虫细胞培养基、hepes缓冲培养基、richter氏改良mem、ipl-41昆虫细胞培养基、leibovitz's l-15培养基、mccoy's 5a培养基、mcdb 131培养基、培养基199、改良的eagle氏培养基(mem)、培养基nctc-109、schneider氏果蝇培养基、tc-100昆虫培养基、waymouth氏mb 752/1培养基、william氏培养基e、无蛋白杂交瘤培养基ii(pfhm ii)、aim v培养基、角化细胞sfm、定义的角化细胞sfm、sfm、完全甲基纤维素培养基、hepatozyme-sfm、neurobasal
tm
培养基、neurobasal-a培养基、hibernate
tm
a培养基、hibernate e培养基、内皮sfm、人内内皮sfm、杂交瘤sfm、pfhm ii、sf 900培养基、sf 900ii sfm、express培养基、cho-s-sfm、aminomax-ii完全培养基、aminomax-c100完全培养基、aminomax-c140基础培养基、pub-max
tm
核型分析培养基、骨髓核型分析培养基和knockout
tm
d-mem,或它们的任何组合。
[0162]
所述方法包含将等分试样培养适当的持续时间。通常,当细胞培养至少两天时,将细胞传代到新鲜培养基中是有益的。如本文所用,“传代”是指从一个“亲本”细胞培养物等
分试样(本文也称为“亲本等分试样”)收获生长细胞并将它们重新接种以产生新的“子代”细胞培养物等分试样(本文中也称为“子代等分试样”)的步骤。换句话说,它是指细胞培养物的继代培养。在这种背景下,子代等分试样是细胞处于继代培养的新等分试样,而亲本等分试样是处于传代或继代培养的先前等分试样。因此,传代是指将一定比例的细胞悬浮液和/或上清液从一个等分试样转移到另一个等分试样。
[0163]
当贴壁细胞传代时,通常在仍然贴壁时在pbs中洗涤细胞,从等分试样中脱离,然后重新悬浮在培养基中。将一部分重悬的细胞转移到新的等分试样中。当非贴壁细胞传代时,细胞处于悬浮液中,因此可以将一部分等分试样直接转移到新的等分试样中。
[0164]
细胞培养的传代次数是指它被收获和重新接种的次数。在传代期间,收获一定体积的亲本细胞培养物等分试样并重新接种到新的子代等分试样中(通常进入新鲜细胞培养基)。重新接种到子代等分试样中的亲本等分试样的体积可以通过当从亲本等分试样中收获细胞并重新接种细胞以产生子代等分试样时使用的稀释因子来表征。替代地,它可以表征为来自亲本细胞培养物等分试样的细胞百分比,或为子代等分试样的初始细胞接种密度。
[0165]
步骤b)中培养等分试样
[0166]
在本文所述方法的步骤b)中,将所述等分试样培养至少9天。例如,所述方法步骤b)中,所述等分试样可以培养至少9天、至少10天、至少11天或至少12天等。
[0167]
在本文所述方法的背景下,所述方法的步骤b)可以包括至少一个传代,其中收获来自亲本等分试样的细胞并且重新接种到新的子代等分试样中。用于传代细胞的标准方法是本领域众所周知的。
[0168]
通常,在步骤b)中传代等分试样时使用“直接传代”。如本文所用,“直接传代”是指其中一个子代等分试样中的细胞源自一个亲本等分试样的传代。术语“直接传代”和“连续传代”在本文中可互换使用。在直接传代中,因此每一代(亲本到子代)之间的等分试样总数保持不变,但是亲本和子代等分试样中的细胞数会不同(由于在传代过程中发生的稀释因子,其中只有一部分所述亲本细胞培养物等分试样中的细胞被转移到子代等分试样中)。
[0169]
换句话说,“直接传代”是指在不合并等分试样的情况下进行传代,即将体积x从等分试样1转移到等分试样2。下表展示了在直接传代背景下可以如何使用分流比和稀释因子的一些实例。
[0170][0171]
表1:等分试样直接传代的实例。如本文所用,“分流比”是细胞悬浮液和/或上清液
从一个等分试样转移到另一个等分试样的比例。相比之下,“稀释因子”考虑了最终等分体积。如果最终等分体积大于起始等分试样,也应考虑到这一点。
[0172]
因此,本文所述方法的步骤b)可以包括将所述等分试样培养至少9天。其中在所述至少9天期间直接传代所述等分试样。在一个实例中,本文所述方法的步骤b)可以包括将所述等分试样培养至少9天,其中在所述至少9天期间将所述等分试样直接传代至少两次。
[0173]
通常(但不总是),在等分试样的直接传代过程中,子代等分试样的总体积等于(或相同于)它所源自的亲本等分试样的总体积。换言之,如果亲本等分试样的总体积为3ml,则子代等分试样的总体积通常也为3ml。在这种情况下,所有亲本等分试样的总体积与所有子代等分试样的总体积相同。
[0174]
通常,在等分试样的直接传代期间,并非来自亲本等分试样的所有细胞都转移到子代等分试样中。例如,可以使用至少2至20的分流比,例如可以使用至少4、至少5、至少6、至少8、至少10、至少12、至少14、至少16、至少18、至多20的分流比。“分流比”是指从亲本等分试样转移到子代等分试样的细胞悬浮液和/或上清液的比例。因此,分流比2可被视为相当于将亲本细胞培养物等分试样中细胞悬液和/或上清液的50%重新接种到新的“子代”等分试样中。类似地,分流比4因此可被视为相当于将亲本细胞培养物等分试样中细胞悬浮液和/或上清液的25%重新接种到新的“子代”等分试样中。另外,分流比20因此可以被视为相当于将亲本细胞培养物等分试样中细胞悬浮液和/或上清液的5%重新接种到新的“子代”等分试样中。在以下提供的实例中,在所述方法的步骤b)中使用分流比4。然而,可以理解的是,不同的分流比可以适合于不同的细胞类型或不同的培养条件。
[0175]
因此,本文所述方法的步骤b)可以包括将所述等分试样培养至少9天,其中在所述至少9天期间直接传代所述等分试样,并且对于每次传代使用至少2(例如至少4)的分流比,任选地其中所有亲本等分试样的总体积与每次传代的所有子代等分试样的总体积相同。例如,分流比可以在约2至约20的范围内。
[0176]
本文其它地方(例如在步骤a)的上下文中)讨论了合适初始接种密度并且同样适用于此处。这些初始接种密度也可用作步骤b)的传代过程中重新接种每个子代等分试样所需的细胞数量的指导(并因此可以使用的合适的分流比)。例如,每次传代的子代等分试样的初始接种密度可以在总计1x105个细胞/ml至约总计1x107个细胞/ml的范围内。例如,每次传代的子代等分试样的初始接种密度可以在约总计5x105个细胞/ml至约总计1x107个细胞/ml的范围内等。
[0177]
步骤c)中使用稀释因子进行培养和传代
[0178]
本文所述的方法包含步骤c),其中在步骤b)后将所述等分试样再培养至少6天。在步骤c)中,在每次传代中使用至少2的稀释因子传代所述等分试样。换言之,通过将亲本等分试样稀释至少2倍以产生子代等分试样来进行步骤c)中每个等分试样的传代。如本文所用,术语“稀释因子”是指初始溶液的体积(从亲本等分试样转移的体积)与最终溶液(子代等分试样)的体积之比,即v1与v2之比或v1∶v2。可以计算稀释因子df∶df=v2÷v1
。例如,当将500μl亲本等分试样用来生成总体积为1ml的子代等分试样时,这表示稀释因子(df)为2。作为进一步的实例,当将250μl亲本等分试样用来生成总体积为1ml的子代等分试样时,这表示稀释因子(df)为4等。本领域技术人员可以确定其它合适的稀释因子。
[0179]
稀释因子2在本领域中也被称为1∶2的稀释因子或1比2的稀释因子。这是指将来自
亲本等分试样的一个单位体积与一个新的单位体积(例如新培养基)组合以产生总共有2个单位体积的新子代等分试样。类似地,4的稀释因子在本领域中也被称为1∶4的稀释因子或1比4的稀释因子。这是指将来自亲本等分试样的一个单位体积与三个新单位体积(例如新培养基)组合以产生总共有4个单位体积的新子代等分试样。类似地,稀释因子8在本领域中也称为1∶8的稀释因子或1比8的稀释因子。这是指将来自亲本等分试样的一个单位体积与七个新单位体积(例如新培养基)组合以产生总共有8个单位体积的新子代等分试样。
[0180]
在一些实例中,在每次传代中使用至少2的稀释因子将所述等分试样传代。在一些实例中,在每次传代中使用至少4的稀释因子将所述等分试样传代。在一些实例中,在每次传代中使用至少6的稀释因子将所述等分试样传代。
[0181]
在一些实例中,在步骤c)中发生的每次传代中,使用至少8的稀释因子对等分试样进行传代。
[0182]
在一些实例中,在步骤c)中发生的每次传代中,使用约2至约20的稀释因子对等分试样进行传代。
[0183]
取决于步骤c)的整个持续时间,在步骤c)期间可以进行的传代数将会有所有不同。本领域技术人员使用其常识可以容易地确定合适的传代数。例如,步骤c)可以包括两代、三代或更多(例如,如果步骤c)的持续时间超过6天)。
[0184]
本文提供的方法是有利的,因为它们使用至少2的稀释因子(例如在约2至约20的范围内),以及低的单独等份试样体积(少于12ml)。本文描述的方法可以在步骤c)中附加地包括一个或多个下列特征:
[0185]
(i)等分试样总体积的减少(当将步骤c)开始时的总体积与步骤c)结束时的总体积相比)
[0186]
(ii)汇集等分试样以减少总体等分试样数(当将步骤c)开始时的总等分试样数与步骤c)结束时的总等分试样数相比)
[0187]
(iii)在步骤c)中传代过程中使用至少4的分流比
[0188]
(iv)使用(i)和(ii)的组合
[0189]
(v)使用(i)和(iii)的组合
[0190]
(vi)使用(ii)和(iii)的组合
[0191]
(vii)使用(i)、(ii)和(iii)三者的组合。
[0192]
下面分别讨论这些方面中的每一个。以下单独讨论的所有特征也适用于本文所述的组合。当与小等分体积(诸如3ml或更小的体积)一起使用时,这些方面特别有用,因为它们有助于自动化。
[0193]
(i)步骤c)中的等分试样体积
[0194]
在步骤c)中的传代期间,子代等分试样的总体积可以等于(或相同于)它所源自的亲本等分试样的总体积。例如,如果亲本等分试样的总体积为3ml,则子代等分试样也可以具有3ml的总体积。
[0195]
替代地,在步骤c)中的传代期间,子代等分试样的总体积可以不同于(例如,高于,但优选低于)其源自的亲本等分试样的总体积。换言之,如果亲本等分试样的总体积为3ml,则子代等分试样的总体积可不同于(例如高于,但优选低于)3ml。
[0196]
在一些实例中,步骤c)结束时所有等分试样的总体积等于或小于步骤c)开始时所
有等分试样的总体积。这可以通过在传代期间减少子代等分试样的体积(与亲本等分试样相比)或通过在传代期间汇集亲本等分试样以使用两个亲本产生子代等分试样来实现。等分试样总体积的减少在具有复制能力的病毒的检测方法中特别有利,常规情况下该检测方法通常使用大的总培养体积(因此进行起来可能很费力)。例如,在步骤c)中可以将所有等分试样的总体积减少至少50%。其可以减少至少75%、至少83%、至少87.5%、至少90%等。在特定的实例中,在步骤c)中,所有等分试样的总体积可减少至少87.5%。
[0197]
换言之,步骤c)可以包括将所述等分试样再培养至少6天,其中在每次传代时使用至少2(例如在约2至约20的范围内)的稀释因子传代所述等分试样,并且其中在步骤c)中所有等分试样的总体积减少至少50%或至少87.5%(例如在至少两个传代中,或至少三个传代中)。
[0198]
如上所述,通过在传代期间减少子代等分试样的体积(与亲本等分试样相比)或通过在传代期间汇集亲本等分试样的体积,与步骤c)开始时相比,步骤c)结束时所有等分试样的总体积可以减少。
[0199]
(ii)步骤c)中汇集传代
[0200]
汇集传代在本文所述方法的步骤c)中可以特别有利,因为它们可以用来减少步骤c)中使用的传代的总等分试样数目(并且在步骤c)结束时可以附加地用来减少等分试样的体积),这可以使得液体处理更加容易。如本文所用,“汇集传代”是指收获亲本等分试样并汇集亲本等分试样,使得一个子代等分试样重新接种来自多于一个亲本等分试样的细胞或上清液。汇集可包括用来自两个亲本、三个亲本或四个亲本等的细胞重新接种一个子代等分试样。例如,可以收获并合并(“汇集”)来自两个亲本等分试样的细胞,并且将一部分合并的细胞用来重新接种一个子代等分试样。在另一个实例中,可以收获来自两个亲本等分试样的细胞但不合并,并且将每种亲本细胞的一部分添加到一个子代等分试样中以实现来自这些亲本的细胞的汇集。因此,汇集减少每次传代后的等分试样总数。
[0201][0202]
表2:等分试样的汇集传代的实例,即同时将来自等分试样a的体积x和来自等分试样b的体积y转移到等分试样c。
[0203]
因此,在一些实例中,步骤c)中可以使用汇集传代,通过至少2的汇集因子来减少总的等分试样数量。如本文所用,术语“汇集因子”是指步骤c)开始时的等分试样总数(称为“a1”)与步骤c)结束时的等分试样总数(称为“a2”)之比,即a1与a2之比或a1∶a2。可以计算汇集因子pf∶pf=a1÷
a2。例如,当步骤c)开始时的等分试样总数为96且步骤c)结束时的等分试样总数为24时,则汇集因子为96
÷
24=4。
[0204]
汇集因子2在本文中也称为2∶1的汇集因子或2比1的汇集因子。这是指将两个亲本等分试样汇集成一个子代等分试样。类似地,汇集因子4在本文中也称为4∶1的汇集因子或4比1的汇集因子。这是指将4个亲本等分试样汇集成一个子代等分试样。类似地,汇集因子8在本文中也被称为8∶1的汇集因子或8比1的汇集因子。这是指将8个亲本等分试样汇集成一个子代等分试样。
[0205]
可以使用成对方法进行汇集(其中两个亲本分试样在每次传代结束时汇集成一个子代等分试样)。以下实施例部分展示了汇集的成对方法。也可以使用其它合适的汇集方法,包括例如一次汇集多于两个亲本等分试样。其非限制性实例可以是将四个亲本等分试样汇集成一个子代等分试样(例如,将来自24孔板的四个等分试样汇集成6孔板上的一个等分试样)。这种方法允许操作员在测定期间连续减少等分试样(或测定板)的总数,而不会影响检测灵敏度,即可以用8个板开始测定,并且在3-4周内依次减少至单一板。
[0206]
在步骤c)期间可以通过约2至约8的汇集因子来汇集等分试样。
[0207]
在一些实例中,在步骤c)中通过至少2的汇集因子来汇集等分试样(即,例如在经历至少两次传代,或在经历至少三次传代,当比较步骤c)开始时的等分试样数量与步骤c)结束时的等分试样数量时,总数减少至少2的汇集因子)。在一些实例中,在步骤c)期间通过至少4的汇集因子来汇集等分试样(即,例如在经历至少两次传代,或在经历至少三次传代,当比较步骤c)开始时的等分试样数量与步骤c)结束时的等分试样数量时,总数减少至少4的汇集因子)。在一些实例中,在步骤c)期间通过至少6的汇集因子来汇集等分试样(即,例如在经历至少两次传代,或在经历至少三次传代,当比较步骤c)开始时的等分试样数量与步骤c)结束时的等分试样数量时,总数减少至少6的汇集因子)。
[0208]
在一些实例中,在步骤c)期间通过至少8的汇集因子来汇集等分试样(即,例如在经历至少两次传代,或在经历至少三次传代,当比较步骤c)开始时的等分试样数量与步骤c)结束时的等分试样数量时,总数减少至少8的汇集因子)。
[0209]
在步骤c)中的每次传代期间,可以通过约2至约8范围内的汇集因子来汇集等分试样。
[0210]
在一些实例中,在步骤c)中的每次传代期间使用至少2的汇集因子来汇集等分试样。在一些实例中,在步骤c)中的每次传代期间使用至少4的汇集因子来汇集等分试样。在一些实例中,在步骤c)中的每次传代期间使用至少6的汇集因子来汇集等分试样。在一些实例中,在步骤c)中的每次传代期间使用至少8的汇集因子来汇集等分试样。这可以发生在至少两次或至少三次传代中。
[0211]
因此,在一些实例中,步骤c)可以包括将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样,并且其中在步骤c)期间通过至少4或至少8的汇集因子来汇集所述等分试样以减少在步骤c)结束时的总等分试样数目。
[0212]
在步骤c)期间减少总等分试样数量和等分试样的总体积可能是特别有利的。因此,在一个实例中,步骤c)可以包括将所述等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子传代所述等分试样,并且其中在步骤c)期间通过将至少4或至少8的汇集因子汇集所述等分试样以减少总的等分试样数量,其中在步骤c)期间所有等分试样的总体积也减少至少50%或至少87.5%。
[0213]
如上文在步骤b)的上下文中所述,在等分试样的传代过程中,并非来自亲本等分
试样的所有细胞都被转移到子代等分试样中。这也适用于步骤c)中的传代。因此,在步骤c)中,可以使用至少2至20的分流比。本文其它地方详细讨论了直接传代背景下的分流比。在汇集传代的背景下,为每个亲本单独计算“分流比”(作为从该亲本等分试样转移到子代等分试样的细胞悬浮液和/或上清液的比例)。
[0214]
令人惊讶的是,发明人已经发现,步骤c)中使用的分流比可以高于步骤b)中使用的分流比(尤其是在汇集传代的背景下),而不会不利地影响方法的灵敏度。因此,在步骤c)中优选至少4的分流比(特别是在汇集传代的背景下)。
[0215]
步骤c)中传代分流比
[0216]
在本文所述方法的步骤c)期间,在每次传代时使用2的稀释因子来传代等分试样。在传代期间,可以使用任何合适的分流比。如本文其它地方所讨论的,适当的分流比包括4至20。
[0217]
令人惊讶的是,发明人已经发现,步骤c)中使用的分流比可以高于步骤b)中使用的分流比,而不会不利地影响方法的灵敏度,即使在使用小于12ml(例如3ml或更少)的小等分体积时。换言之,可以在每次传代时丢弃相当大比例的亲本等分试样,而不会对测定的整体灵敏度产生不利影响。因此,在一个实例中,步骤c)可以包括将等分试样再培养至少6天,其中在每次传代时使用至少2的稀释因子和至少4的分流比对等分试样进行传代。任选地,在步骤c)期间,所有等分试样的总体积可同时减少至少50%或至少87.5%。
[0218]
当使用此分流比时,子代等分试样的总体积可以等于(或相同于)其所源自的亲本等分试样的总体积。换言之,如果亲本等分试样的总体积为3ml,则子代等分试样的总体积也可以为3ml。替代地,在步骤c)的传代过程中,子代等分试样的总体积可以不同于(例如高于,但优选低于)其所源自的亲本等分试样的总体积。换言之,如果亲本等分试样的总体积为3ml,则子代等分试样的总体积可以不同于(例如高于,但优选低于)3ml。
[0219]
在一些实例中,当使用至少4的分流比时,步骤c)结束时所有等分试样的总体积相同于或小于步骤c)开始时所有等分试样的总体积。这可以通过在传代期间减少子代等分试样(与亲本等分试样相比)的体积或通过在传代期间汇集亲本等分试样来实现。减少等分试样的总体积在用于具有复制能力的病毒的检测方法中是特别有利的,常规情况下所述检测方法使用较大的总培养体积(并因此进行起来可能很费力)。例如,在步骤c)期间所有等分试样的总体积可减少至少50%。其可以减少至少75%、至少83%、至少87.5%、至少90%等。在特定的实例中,在步骤c)期间,所有等分试样的总体积可减少至少87.5%。
[0220]
在传代期间,还应考虑重新接种的细胞数。本文其它地方讨论了合适的初始接种密度(例如在步骤a)的上下文中)并且在此处同样适用。这些初始接种密度也可用作步骤b)的传代过程中重新接种每个子代等分试样所需的细胞数量的指导。例如,每次传代的子代等分试样的初始接种密度可以在约总计1x105个细胞/ml至约总计1x107个细胞/ml的范围内。例如,每次传代的子代等分试样的初始接种密度可以在约总计5x105个细胞/ml至约总计1x107个细胞/ml的范围内等。
[0221]
步骤c)中的培养时间
[0222]
本文所述方法的步骤c)包括将等分试样再培养至少6天。为避免疑义,在测试具有复制能力的病毒之前,可以将等分试样培养更长的持续时间,例如至少另外的7、8、9、10、11天或更多天。因此,本文所述的方法可以需要至少3周(例如3至4周或4至5周)来完成。
[0223]
在测试样品包含细胞(例如生产终末细胞)的实例中,在测试具有复制能力的病毒之前(即在本文所述方法的步骤d)之前)的某些点引入附加过滤步骤(例如使用0.45μm过滤器)可以是有益的。
[0224]
有利地,本文描述的方法可以是自动化的。如本文所用,“自动化”是指通过高度自动化手段,包括通过电子设备,来操作或控制该方法的技术、方法或系统。该方法的自动化可以减少操作者的工作量或增加该方法的通量。可以在自动化方法中使用的自动化手段的非限制性实例是液体处理器。合适的液体处理器在本领域中是已知的。有利地,自动化方法可以增加本文所述方法的可靠性。
[0225]
为避免疑义,可以只有步骤b)和c)是自动化的。任选地,步骤a)和/或步骤d)也可以是自动化的。步骤b)和c)可以与步骤d)独立地自动化。例如,从步骤c)到步骤d)可以需要一些操作员交互和/或输入。
[0226]
也可以手动地进行本文提供的任何(或所有)步骤。例如,步骤a)可以手动进行,而步骤b)和c)(以及可选的d))是自动化的。
[0227]
该方法可以与多个对照并行进行。对照可以包括阴性对照和/或阳性对照。
[0228]
阴性对照的实例可以使用包含病毒允许细胞(和所有合适的试剂等)但不包含测试样品的等分试样来进行所述方法。在这种背景下,所述方法可以称为“阴性对照法”。适当地,可以使用相同的试剂、培养条件、病毒允许细胞、汇集策略、检测手段等,与用于检测测试样品中具有复制能力的病毒的方法并行进行阴性对照法。
[0229]
阳性对照的实例可以使用包含病毒允许细胞和具有复制能力的病毒(作为测试样品的替代)的等分试样来进行所述方法。在这种背景下,具有复制能力的病毒(“阳性对照”)可以被称为包含在“阳性对照样品”中,并且所述方法可以被称为“阳性对照法”。适当地,可以使用相同的试剂、培养条件、病毒允许细胞、汇集策略、检测手段等,与用于检测测试样品中具有复制能力的病毒的方法并行进行阳性对照方法。
[0230]
通常(但不总是),阳性对照病毒将来自与载体系统(在rcr/rcl测定中测试)所基于的病毒相同的病毒。例如但非限制,siv载体的阳性对照病毒将来自siv,hiv病毒的阳性对照病毒将来自hiv等(但是最近来自mlv的阳性对照越来越多地被用作更通用的阳性对照)。理想地,阳性对照病毒的基因组将在rcr/rcl测定时所使用的选定扩增/指示细胞系内对复制能力多余的所有基因中进行功能减毒。对于源自慢病毒的阳性对照病毒,减毒基因通常是已知的宿主/免疫调节/逃逸的附属基因。这是因为这些基因/功能通常不存在于所使用的逆转录病毒/慢病毒载体系统中,因此理论上从载体生产过程中产生的推定rcr/rcl极不可能获得这些功能。辅助慢病毒基因(例如tat或rev)通常保留在阳性对照病毒基因组中,因为这些基因通常对复制至关重要。替代地,mlv用作阳性对照病毒,它是一种简单的逆转录病毒,缺乏慢病毒基因组中存在的许多专门的附属基因,并且最接近地模拟了可能来自高度工程化的相应逆转录病毒/慢病毒载体系统的推定rcr/rcl。因此,理想地,将选择缺乏所有附属基因的阳性对照病毒,但这可以在经验上取决于扩增/指示细胞系内的复制效率。因此,为了开发稳健的rcr/rcl测定,有时阳性对照病毒仍会在扩增/指示细胞系内表达一种或多种功能性附属基因。
[0231]
在一个实例中,阳性对照样品可以包含减毒性具有复制能力的慢病毒,该慢病毒在其核苷酸序列内具有至少一个附属基因发生功能缺失,其中所述至少一个附属基因选
自:vif、vpr、vpx、vpu和nef。例如,减毒性具有复制能力的慢病毒可以具有vif、vpr、vpx、vpu和nef中的至少三个发生功能缺失。
[0232]
在特定的实例中,阳性对照减毒性具有复制能力的病毒可以包含根据seq id no:1的核酸序列或其变体,或者由seq id no:1的核酸序列或其变体组成。这种阳性对照特别有用于作为用于检测测试样品中具有复制能力的慢病毒(尤其是在检测具有复制能力的hiv、siv、shiv或其变体时)的方法的阳性对照,因为它在多次传代后保持传染性方面特别有效(由于其vif 状态)。
[0233]
所述变体可以是seq id no:1的密码子优化的变体。如本文所用,“密码子优化的”(或“c.o.”)是指编码目的基因的多核苷酸序列相对于天然多核苷酸序列被修饰,同时不改变编码氨基酸序列。该术语在本领域中是众的周知的。多核苷酸序列的密码子优化可以导致多种效应,这些效应增加细胞中编码蛋白质的整体翻译效率/表达水平。
[0234]
所述变体也可以是seq id no:1的功能变体。功能变体通常仅含有一个或多个氨基酸的保守取代,或在由seq id no:1编码的蛋白质的非关键区域中的非关键氨基酸的取代、缺失或插入。用于识别功能性和非功能性变体(例如功能性和非功能性等位基因变体)的方法为本领域普通技术人员所熟知。
[0235]
功能变体可以包含与seq id no:1的核酸序列具有至少约60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的核酸序列。适当地,百分比同一性可以计算为相对于参比序列(例如seq id no:1)的整个长度或其部分或片段的同一性百分比。
[0236]“非必需的”(或“非关键的”)氨基酸残基是可以从由seq id no:1编码的氨基酸序列改变而不消除或更优选地基本上不改变生物活性的残基,而“必需的”(或“关键的”)氨基酸残基会导致生物活性变化。例如,预计保守的氨基酸残基特别不易于改变,除了结构域疏水核心内的氨基酸残基通常可以被具有近似等效疏水性的其它残基替换而不显著改变活性。
[0237]“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的氨基酸残基替换的取代。具有相似侧链的氨基酸残基家族已在本领域中定义。这些家族包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸),具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸),具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸),具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸),具有β-支链侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)和具有芳族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,蛋白质中的非必需(或非关键)氨基酸残基优选被来自相同侧链家族的另一个氨基酸残基替换。替代地,在另一个实施方式中,可以随机引入突变,并且可以筛选所得突变体的生物活性以识别保留活性的突变体。
[0238]
与由seq id no:1编码的相应氨基酸序列相比,seq id no:1的保守氨基酸取代变体可以具有至少一个(例如两个或更少、三个或更少、四个或更少、五个或更少、六个或更少、七个或更少、八个或更少、九个或更少、十个或更少等)保守氨基酸取代。
[0239]
除了本文所述的方法之外,上面讨论的阳性对照可有用于多种不同的背景。例如,其可以在当前被用来检测具有复制能力的病毒的常规基于烧瓶的细胞培养方法中用作阳
性对照。因此,上面讨论的阳性对照可用于任何rcl或rclcc方法。在此背景下,其特别有用于作为用于检测测试样品中具有复制能力的慢病毒的方法的阳性对照,例如在检测具有复制能力的hiv、siv、shiv或其变体时。
[0240]
本文所述的阳性对照可以是试剂盒的一部分。适当地,试剂盒可以进一步包含一种或多种附加试剂,诸如缓冲剂等。缓冲剂可以是稳定缓冲剂、稀释缓冲剂等。
[0241]
除了上述组分之外,试剂盒可以进一步包括用于指导使用试剂盒的部分从而实践本文所述方法的说明。用于实践所述方法的说明通常记录在合适的记载介质上。例如,说明可以印刷在基材上,例如纸或塑料等。说明可以作为包装插页存在于试剂盒中、试剂盒容器或其部分的标签中(即,与包装或分包装相关)等。说明可以作为电子存储数据文件存在于合适的计算机可读存储介质上,例如cd-rom、软盘、闪存驱动器等。在某些情况下,试剂盒中不存在实际说明,但可以提供从远程来源(例如通过互联网)获取说明的方法。该实施方式的一个实例是一种试剂盒,其包括可以查看说明和/或可以从中下载说明的网址。与说明一样,这种获得说明的方法可以记录在合适的基材上。
[0242]
本文所述的方法包括测试具有复制能力的病毒的存在的步骤(所述方法的步骤d))。可以使用检测具有复制能力的病毒存在的任何合适方法。通常,一旦传代步骤已完成(例如,在培养至少3周、至少4周或至少5周后),进行测试具有复制能力的病毒存在的步骤,但也可以从每次传代时从残留样品中收集测试样品。然而,其还可以在所有传代步骤完成之前附加地(或替代地)进行(例如在方法的中间步骤)。例如,其可在15天后、18天后、21天后、24天后、27天后、30天后、33天后或更长时间后进行。因此,其可以进行多于一次(例如在所述方法中至少两次、至少三次、至少四次、至少五次、至少六次等)。在此背景下,可以在所需时间点收获上清液并储存直到方法完成,以便可以同时(或并行地)测试所有上清液(代表所述方法中的不同时间点)的具有复制能力的病毒。用于获得和/或储存上清液的适当方法是本领域公知的。
[0243]
例如,可以使用pcr来测试具有复制能力的病毒的存在。在一个实例中,使用pcr(例如qpcr)作为检测具有复制能力的病毒的方法来测量靶基因例如psi-gag的rna或dna水平。qpcr测定已经开发用于检测vsv-g作为检测具有复制能力的病毒的手段。在另一个实例中,测量逆转录酶活性水平(例如使用f-pert)作为检测具有复制能力的病毒的手段(即,使用逆转录酶测定诸如f-pert来测试具有复制能力的病毒的存在)。作为非限制性实例,在以下实施例部分详细地描述了使用f-pert的具有复制能力病毒的检测。
[0244]
也可以使用替代测定(诸如基于蛋白质的测定)来检测具有复制能力的病毒。例如,先前已经开发并且可以使用用于检测p24的elisa测定。
[0245]
基于pcr的方法在本领域中是众所周知的。本领域技术人员可以容易地确定合适的试剂和方法。类似地,蛋白质检测方法(例如elisa)在本领域中也是众所周知的。本领域技术人员可以容易地确定合适的试剂和方法。
[0246]
上述方法检测样品中存在的具有复制能力的病毒。如本文所用,“检测”是指指示样品中存在具有复制能力的病毒。当所述方法以给定值指示样品中存在例如病毒基因、病毒蛋白质和/或病毒活性例如逆转录酶活性时,则检出具有复制能力的病毒。通常将给定值与参考值和/或从阳性对照产生的相应值和/或从阴性对照产生的相应值进行比较。通过,等于或高于参考值(阈值,高于该阈值则存在具有复制能力的病毒)的给定值视为指示在测
试样品中存在具有复制能力的病毒。相反,低于参考值的给定值视为指示样品不存在具有复制能力的病毒。合适的参考值和对照(阳性和阴性)在本领域中是众所周知的。
[0247]
一般定义
[0248]
下面提供了多个一般定义。
[0249]
生产细胞的培养
[0250]
培养生产细胞(包装细胞系或生产者细胞系,或用病毒载体编码成分瞬时转染的细胞)以增加细胞和病毒数量和/或病毒滴度。进行细胞培养以使其能够代谢和/或生长和/或分裂和/或产生目的病毒载体。这可以通过本领域技术人员熟知的方法来完成,包括但不限于为细胞提供营养,例如在适当的培养基中。该方法可以包括附着于表面的生长、悬浮生长或其组合。培养可以例如在组织培养多孔板、培养皿、滚瓶、波浪袋中或在生物反应器中使用分批、分批补料、连续系统等进行。为了通过细胞培养实现病毒载体的大规模生产,本领域优选具有能够在悬浮液中生长的细胞。
[0251]
核酸
[0252]
如本文所用的术语“核酸”通常是指基本上由核苷酸组成的任何长度的低聚物或聚合物(优选线性聚合物)。核苷酸单元通常包括杂环碱基、糖基和至少一个(例如一个、两个或三个)磷酸基团,包括修饰或取代的磷酸基团。杂环碱基尤其可以包括嘌呤和嘧啶碱基,诸如广泛存在于天然存在的核酸中的腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u),其它天然存在的碱基(例如黄嘌呤、肌苷、次黄嘌呤)以及化学或生物化学修饰(例如甲基化的)、非天然或衍生碱基。糖基尤其可以包括戊糖(呋喃戊糖)基团,例如优选地在天然存在的核酸中常见的核糖和/或2-脱氧核糖,或阿拉伯糖,2-脱氧阿拉伯糖,苏糖或己糖糖基,以及修饰或取代的糖基。如本文所指的核酸可以包括天然存在的核苷酸、修饰的核苷酸或其混合物。修饰的核苷酸可以包括修饰的杂环碱基、修饰的糖部分、修饰的磷酸基团或其组合。可以引入磷酸基团或糖的修饰以提高稳定性、抗酶降解性或一些其它有用的特性。术语“核酸”进一步优选地包括dna、rna和dna rna杂合分子,具体地包括hnrna、pre-mrna、mrna、cdna、基因组dna、扩增产物、寡核苷酸和合成(例如化学合成的)dna、rna或dna rna杂合物。核酸可以是天然存在的,例如存在于自然界中或从自然界中分离;或者可以是非天然存在的,例如重组的(即通过重组dna技术产生的)和/或部分或全部化学或生化合成的。“核酸”可以是双链的、部分双链的或单链的。在单链的情况下,核酸可以是有义链或反义链。此外,核酸可以是环状或线性的。
[0253]
载体
[0254]
载体是允许或促进实体从一个环境转移到另一个环境的工具。例如,在重组核酸技术中使用的一些载体允许将实体例如核酸片段(例如异源dna片段,例如异源cdna片段)转移到靶细胞中并由其表达。载体可以促使目的核酸/目的核苷酸(noi)整合,以在靶细胞内保持noi及其表达。替代地,该载体可以通过在瞬时系统中表达noi来促进该载体的复制。载体可用于将异源核酸(dna或rna)保持在细胞内,或促进包含dna或rna区段的载体的复制或由核酸区段编码的蛋白质的表达。载体可以促使目的核酸/目的核苷酸(noi)整合,以在靶细胞内保持noi及其表达。替代地,载体可以通过在瞬时系统中表达noi来促使载体复制。
[0255]
在本文所述的方法的背景下,目的载体是病毒载体,特别是逆转录病毒载体。病毒载体也可以称为载体、载体病毒体或载体颗粒。载体可以含有一种或多种可选择标志基因
(例如新霉素抗性基因)和/或可追踪标志基因(例如编码绿色荧光蛋白(gfp)的基因)。例如,可以使用载体来感染和/或转导靶细胞。
[0256]
载体可以是表达载体。如本文所述的表达载体包含含有能够被转录的序列的核酸区域。因此,编码mrna、trna和rrna的序列包括在该定义中。优选地,表达载体包含与控制序列可操作地连接的本发明的多核苷酸,所述控制序列能够通过靶细胞提供编码序列的表达。
[0257]
逆转录病毒载体
[0258]
逆转录病毒载体可以源自或可以可源自任何合适的逆转录病毒。已经识别出大量不同的逆转录病毒。实例包括:鼠白血病病毒(mlv)、人t细胞白血病病毒(htlv)、小鼠乳腺肿瘤病毒(mmtv)、劳斯肉瘤病毒(rsv)、藤波肉瘤病毒(fusv)、莫洛尼鼠白血病病毒(mo mlv)、fbr鼠骨肉瘤病毒(fbr msv)、莫洛尼鼠肉瘤病毒(mo-msv)、阿贝尔森鼠白血病病毒(a-mlv)、禽骨髓细胞瘤病毒29(mc29)和禽红细胞增多症病毒(aev)。在coffin et al.(1997)“retroviruses”,cold spring harbour laboratory press eds:jm coffin,sm hughes,he varmus pp 758-763中可以找到逆转录病毒的详细列表。
[0259]
逆转录病毒可大致分为两类,即“简单”和“复杂”。逆转录病毒甚至可以进一步分为七组。其中五组代表具有致癌潜力的逆转录病毒。其余两组是慢病毒和泡沫病毒。如上的coffin et al(1997)中存在这些逆转录病毒的综述。
[0260]
逆转录病毒和慢病毒基因组的基本结构具有许多共同的特征,例如5’ltr和3’ltr,它们之间或内部存在使基因组能够被包装的包装信号、引物结合位点、能够整合到靶细胞基因组中的整合位点以及编码包装成分的gag/pol和env基因,所述包装成分是病毒颗粒组装所需的多肽。慢病毒具有额外的特征,例如hiv中的rev基因和rre序列,这使得整合的前病毒的rna转录物能够有效地从细胞核输出到受感染靶细胞的细胞质。
[0261]
在前病毒中,这些基因的两端都有称为长末端重复序列(ltr)的区域。ltr负责前病毒整合和转录。ltr也作为增强子-启动子序列,并且可以控制病毒基因的表达。
[0262]
ltr本身是相同的序列,可以分为三个元件,分别称为u3、r和u5。u3来源于rna 3’末端独有的序列。r来源于rna两端重复的序列,并且u5来源于rna 5’末端独有的序列。这三个元件的大小在不同的逆转录病毒中可能有很大差异。
[0263]
在典型的逆转录病毒载体中,可以从病毒中去除复制所必需的一个或多个蛋白质编码区的至少一部分;例如,gag/pol和env可以不存在或不起作用。这使得病毒载体具有复制缺陷。
[0264]
慢病毒是一大组逆转录病毒的一部分。在coffin et al(1997)“retroviruses”cold spring harbour laboratory press eds:jm coffin,sm hughes,he varmus pp 758-763中可以找到慢病毒的详细列表。如本文所用,慢病毒载体是包含可源自慢病毒的至少一个组成部分的载体。优选地,该组成部分涉及载体感染或转导靶细胞并表达noi的生物学机制。
[0265]
简而言之,慢病毒可以分为灵长类和非灵长类组。灵长类慢病毒的实例包括但不限于:人类免疫缺陷病毒(hiv例如hiv-1或hiv-2),人类自身免疫缺陷综合征的病原体(aids),和猴免疫缺陷病毒(siv)。非灵长类慢病毒组包括原型“慢病毒”visna/maedi病毒(vmv),以及相关的山羊关节炎脑炎病毒(caev),马传染性贫血病毒(eiav),猫免疫缺陷病
毒(fiv),梅迪维斯纳病毒(mvv)和牛免疫缺陷病毒(biv)。其它实例包括visna慢病毒。
[0266]
慢病毒家族与逆转录病毒的不同之处在于慢病毒具有感染分裂细胞和非分裂细胞的能力(lewis et al(1992)embo j 11(8):3053-3058以及lewis and emerman(1994)j virol 68(1):510-516)。相比之下,诸如mlv等其它逆转录病毒无法感染非分裂或缓慢分裂的细胞,诸如构成例如肌肉、脑、肺和肝组织的那些细胞。
[0267]
腺病毒和腺相关病毒载体
[0268]
也可以使用本文所述的方法检测腺病毒。腺病毒是一种双链、线性dna病毒,其不通过rna中间体进行复制。有超过50种不同的人类腺病毒血清型,根据其基因序列分为6个亚组。
[0269]
腺病毒是双链dna无包膜病毒,其能够在体内、离体和体外转导人类和非人类来源的多种细胞类型。这些细胞包括呼吸道上皮细胞、肝细胞、肌肉细胞、心肌细胞、滑膜细胞、原代乳腺上皮细胞和有丝分裂后终末分化细胞,如神经元。
[0270]
腺病毒载体也能够转导非分裂细胞。这对于诸如囊性纤维化等疾病非常重要,其中肺上皮中受感染的细胞更新速度较慢。事实上,利用腺病毒介导的囊性纤维化转运蛋白(cftr)向受困扰的成年囊性纤维化患者肺部的转移的多个试验正在进行中。
[0271]
腺病毒已被用作基因疗法的载体和用于异源基因表达的载体。大(36kb)基因组可容纳多达8kb的外来插入dna,并且能够在互补细胞系中有效复制,以产生高达1012个转导单位/ml的极高滴度。因此,腺病毒是研究原代非复制细胞中基因表达的最佳系统之一。
[0272]
来自腺病毒基因组的病毒或外源基因的表达不需要复制细胞。腺病毒载体通过受体介导的内吞作用进入细胞。一旦进入细胞,腺病毒载体很少整合到宿主染色体中。相反,它们在宿主细胞核中作为线性基因组以附加体形式(独立于宿主基因组)发挥作用。
[0273]
重组腺相关病毒(aav)和基于腺病毒的病毒载体用于基因疗法的应用非常普遍,并且其制备已有据可查。通常,基于aav的载体在哺乳动物细胞系(例如基于hek293的)中或通过使用杆状病毒/sf9昆虫细胞系统产生。aav载体可以通过瞬时转染载体成分编码dna来生产,通常与来自腺病毒或单纯疱疹病毒(hsv)的辅助功能一起,或通过使用稳定表达aav载体成分的细胞系来生成。腺病毒载体通常在稳定表达腺病毒e1功能的哺乳动物细胞系中生产(例如基于hek293的)。
[0274]
腺病毒载体通常也通过使用生产细胞系的连续轮“感染”经由辅助功能依赖性复制来“扩增”。腺病毒载体及其生产系统包括包含全部或部分腺病毒基因组的多核苷酸。众所周知,腺病毒是但不限于源自ad2、ad5、ad12和ad40的腺病毒。腺病毒载体通常为封装在腺病毒外壳中的dna的形式或以另一种病毒或病毒样形式(例如单纯疱疹病毒和aav)封装的腺病毒dna的形式。
[0275]
aav载体通常理解为来源于腺相关病毒血清型的载体,包括但不限于aav-1、aav-2、aav-3、aav-4、aav-5、aav-6、aav-7和aav-8。aav载体可以全部或部分缺失所述aav野生型基因中的一种或多种,优选rep和/或cap基因,但保留功能性侧翼itr序列。功能性itr序列对于aav病毒体的拯救、复制和包装是必需的。因此,aav载体在本文中定义为至少包括病毒复制和包装(例如功能性itr)顺式所需的那些序列。itr不必是野生型核苷酸序列,并且可以改变,例如通过核苷酸的插入、缺失或替换,只要这些序列提供功能性拯救、复制和包装。
‘
aav载体’也指其蛋白质外壳或衣壳,它为将载体核酸递送至靶细胞核提供了有效的载体。
aav生产系统需要辅助功能,其通常是指aav衍生的编码序列,这些编码序列可以被表达以提供aav基因产物,这些基因产物反过来又可以反式发挥作用以用于生产性aav复制。因此,aav辅助功能包括主要的aav开放阅读框(orf)、rep和cap。rep表达产物已被证明具有许多功能,其中包括:dna复制的aav起点的识别、结合和切口;dna解旋酶活性;和调节aav(或其它导师源)启动子的转录。cap表达产物提供必要的包装功能。aav辅助功能在本文中用于补充aav载体中缺失的反式aav功能。应当理解的是,aav辅助构建体通常是指包括提供从aav载体中缺失的aav功能的核苷酸序列的核酸分子,该aav载体要用于生产递送目的核苷酸序列的转导载体。aav辅助构建体通常用于提供aav rep和/或cap基因的瞬时表达,以补充aav复制所必需的缺失aav功能;然而,辅助构建体缺乏aav itr,并且既不能复制也不能包装自己。aav辅助构建体可以是质粒、噬菌体、转座子、粘粒、病毒或病毒体的形式。已经描述了许多aav辅助构建体,例如编码rep和cap表达产物的常用质粒paav/ad和plm29 45。参见例如samulski et al.(1989)j.virol.63:3822-3828;和mccarty et al.(1991)j.virol.65:2936-2945。已经描述了编码rep和/或cap表达产物的许多其它载体。参见例如美国专利no.5,139,941和6,376,237。此外,众所周知,术语“辅助功能”是指非aav源性病毒和/或aav复制所依赖的细胞功能。因此,该术语涵盖aav复制所需的蛋白质和rna,包括参与aav基因转录激活、阶段特异性aav mrna剪接、aav dna复制、cap表达产物合成和aav衣壳组装的那些部分。基于病毒的辅助功能可以源自任何已知的辅助病毒,例如腺病毒、疱疹病毒(1型单纯疱疹病毒除外)和牛痘病毒。
[0276]
单纯疱疹病毒载体
[0277]
单纯疱疹病毒(hsv)是一种有包膜的双链dna病毒,可自然地感染神经元。其可以容纳外源dna的大区段,这使得它作为一种载体系统具有吸引力,并已被用作向神经元递送基因的载体(manservigiet et al open virol j.(2010)4:123-156)。
[0278]
在治疗程序中使用hsv需要对菌株进行减毒,以使它们无法建立裂解循环。特别地,如果hsv载体用于人类基因疗法,多核苷酸应优选插入到必需基因中。这是因为如果病毒载体遇到野生型病毒,可能会通过重组将异源基因转移到野生型病毒中。然而,只要将多核苷酸插入到必需基因中,这种重组转移也会缺失受体病毒中的必需基因,并防止异源基因“逃逸”到具有复制能力的野生型病毒群中。
[0279]
牛痘病毒载体
[0280]
本文所述的方法也可用于检测具有复制能力的痘苗病毒的存在。牛痘病毒载体包括mva或nyvac。牛痘载体的替代包括禽痘载体,例如称为alvac的鸡痘或金丝雀痘,以及由此衍生的可以感染并在人体细胞中表达重组蛋白但不能复制的毒株。
[0281]
除非本文另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。例如,singleton and sainsbury,dictionary of microbiology and molecular biology,2d ed.,john wiley and sons,ny(1994);以及hale and marham,the harper collins dictionary of biology,harper perennial,ny(1991)为本领域技术人员提供了本发明中使用的许多术语的通用词典。尽管与本文所述的那些相似或等效的任何方法和材料可用于本发明的实践,但本文描述了优选的方法和材料。因此,以下紧接定义的术语通过参考整个说明书进行更全面的描述。此外,如本文所用,单数术语“一(a)”、“一种(an)”和“该/所述(the)”包括复数指代,除非上下文另有明确说
明。除非另有说明,核酸从左到右以5'到3'方向书写;氨基酸序列分别以氨基到羧基的方向从左到右书写。应当理解的是,本发明不限于所描述的特定方法、方案和试剂,因为这些可以根据本领域技术人员使用它们的背景而变化。
[0282]
sin载体
[0283]
用于本发明方法的载体优选以其中病毒增强子和启动子序列已缺失的自失活(sin)构型使用。可以生成sin载体并且在体内、离体或体外转导非分裂靶细胞,其功效与野生型载体相似。sin前病毒中长末端重复(ltr)的转录失活应阻止具有复制能力的病毒的动员。这也应该能够通过消除ltr的任何顺式作用效应来调节来自内部启动子的基因表达。
[0284]
例如,通过缺失转录增强子或3’ltr的u3区域中的增强子和启动子构建了自失活逆转录病毒载体系统。经过一轮载体逆转录和整合后,这些变化被复制到5’和3’ltr中,产生转录失活的前病毒。然而,此类载体中ltr内部的任何启动子仍将具有转录活性。这种策略已被用于消除病毒ltr中的增强子和启动子对来自内部基因转录的影响。此类影响包括转录增加或转录抑制。这种策略还可用于消除从3’ltr到基因组dna的下游转录。这在人类基因疗法中尤为重要,其中重要的是防止任何内源性癌基因的意外激活。yu et al.,(1986)pnas 83:3194-98;marty et al.,(1990)biochimie 72:885-7;naviaux et al.,(1996)j.virol.70:5701-5;iwakuma et al.,(1999)virol.261:120-32;deglon et al.,(2000)human gene therapy 11:179-90。us 6,924,123和us 7,056,699中描述了sin慢病毒载体。
[0285]
可以使用vsv-g(水疱性口炎病毒-g)来拟型本文所述的载体。这允许将病毒浓缩到高滴度。
[0286]
序列同一性
[0287]
术语“同一性”和“同一”等是指两个聚合分子之间,例如两个核酸分子之间,例如两个dna分子之间的序列相似性。例如,可以使用altschul et al.1990(j mol biol 215:403-10)最初描述的基本局部对齐搜索工具(blast),诸如tatusova and madden 1999(fems microbiol lett 174:247-250)描述的“blast 2序列”算法,进行序列比对和序列同一性的确定。
[0288]
用于比对序列以进行比较的方法是本领域众所周知的。例如,以下文献中描述了各种程序和比对算法:smith and waterman(1981)adv.appl.math.2:482;needleman and wunsch(1970)j.mol.biol.48:443;pearson and lipman(1988)proc.natl.acad.sci.u.s.a.85:2444;higgins and sharp(1988)gene 73:237-44;higgins and sharp(1989)cabios 5:151-3;corpet et al.(1988)nucleic acids res.16:10881-90;huang et al.(1992)comp.appl.biosci.8:155-65;pearson et al.(1994)methods mol.biol.24:307-31;tatiana et al.(1999)fems microbiol.lett.174:247-50。在例如altschul et al.(1990)j.mol.biol.215:403-10中可以找到序列比对方法和同源性计算的详细考虑。
[0289]
国家生物技术信息中心(national center for biotechnology information,ncbi)基本局部比对搜索工具(blast
tm
;altschul et al.(1990))可从多个来源获得,包括国家生物技术信息中心(bethesda,md)和在互联网上,其与多个序列分析程序结合使用。关于如何使用该程序确定序列同一性的说明可在互联网上的blast
tm
的“帮助”部分下获得。对
于核酸序列的比较,可以使用默认参数使用blast
tm
(blastn)程序的“blast 2序列”功能。当通过这种方法评估时,与参考序列具有更大相似性的核酸序列将显示出更高的同一性百分比。通常,百分比序列同一性是在整个序列长度上计算的。
[0290]
例如,通过needleman-wunsch算法使用以下评分参数适当地找到全局最优比对:匹配分值: 2;不匹配分值:-3;空位罚分:空位打开5,空位延伸2。通过比对的碱基数与比对的总长度的比率乘以100适当地计算得到的最佳全局比对的百分比同一性,其中比对长度包括匹配和不匹配。
[0291]
由以下非限制性实施例论证本发明的方面。
[0292]
实施例
[0293]
实施例1:rclcc测定
–
t225烧瓶规模和24w板规模测定的比较
[0294]
t225烧瓶规模测定
[0295]
先前已以t225烧瓶规模进行了rclcc测定。使用1.00e 07个c8166细胞和1.00e 07个生产终末细胞(eopc)接种10x t225烧瓶,最终体积为50ml/烧瓶。因此,rclcc测定中的初始接种密度为4.00e 05个细胞/ml。为了满足fda rclcc测试指南,设置10x测试物品烧瓶,以测试总计1.00e 08个eopc。烧瓶直接传代最多9代,并且从第6代开始收获上清液。
[0296][0297]
表3:rclcc-t225烧瓶规模计算
[0298]
在烧瓶规模rclcc测定的持续时间内,处理的测试物品的总体积在测定期间保持恒定。
[0299]
[0300][0301]
表4:t225烧瓶规模测定的不同传代中使用的体积
[0302]
板规模rclcc检测
[0303]
使用2.60e 05个c8166细胞和2.60e 05个生产终末细胞(eopc)接种16x24孔板,每孔的最终体积为1ml,从而测试总计1.00e 08个eopc。板直接传代最多9代,从并且第7代开始收获上清液。从第3代开始,在随后的传代中将24孔板汇集到单个24孔板(图3)。
[0304][0305][0306]
表5:rclcc-24孔板规模计算
[0307]
在板规模rclcc测定的持续时间内,所处理的测试物品的总体积在测定的持续时间内顺序减小。
[0308][0309]
表6:板规模测定的不同传代中使用的体积
[0310]
进行了一项比较研究以显示汇集不会损害测定灵敏度。数据显示在下表7a-c中。
[0311]
本项研究使用了三种不同的hivδa3vif 阳性对照病毒接种剂量(剂量a、b和c)来增添(接种,引入,突增到,spike)含有细胞培养基和病毒允许细胞的细胞培养孔。将增添的孔培养至少15天(传代),然后测试是否存在病毒。平行测试了两种不同的传代方案:直接传代(表7左侧)和汇集传代(表7右侧)。在整个比较研究中使用了等效的等分体积(小于3ml)。无论使用直接传代还是汇集传代,都显示相同的结果。这表明汇集不会对测定的灵敏度产生不利影响,即使使用小于3ml的小等分体积也是如此。
[0312][0313][0314]
[0315][0316]
表7a-c:显示了在两种传代方案下以三个接种剂量评估的hivδa3vif 阳性对照病毒的感染率(对照批次-仅直接传代;汇集批次-从第9天开始汇集传代)。在所有三个接种剂量下,所有观察到的感染率在对照批次和汇集批次中均符合预期。同样,对照批次中所有受感染的孔也在汇集批次中受到感染,这表明汇集不会损害测定灵敏度。
[0317]
实施例2:产生新的hiv-1阳性对照
[0318]
用于基因疗法的慢病毒载体通常由多个载体系统组件开发而成。基于hiv的最小第3代载体系统没有附属基因vif、vpr、vpu和nef以及附属基因tat。标准载体基因组包括包装信号(ψ)、rev响应元件(rre)、中央多嘌呤序列(cppt)、内部目的核苷酸(noi)表达盒、典型的转录后调控元件(pre)、3’多嘌呤序列(ppt)和自失活(sin)ltr。生产系统采用编码在不同dna上的四个核心组件:载体基因组、gagpol、rev和包膜。第三代载体可以使用野生型或密码子优化的gagpol orf,但后者的使用大大降低了可能导致rcl产生的载体成分之间同源重组的概率。然而,最终载体药物产品临床发布的要求是测试rcl的存在。
[0319]
rcl测定设计的一个方面是利用适当的阳性对照病毒。因此产生了两种阳性对照:hivδa4和hivδa3vif (参见图4)。
[0320]
产生hivδa4
[0321]
对野生型hiv-1进行工程改变,使附属基因vif、vpr、vpu和nef功能缺失以产生hivδa4,从而对可能源自最小载体系统的假定rcl进行建模。
[0322]
c8166-45细胞系是通过htlv-1tax1表达通过t细胞永生化得到的,并且高度允许hiv-1感染。因此,这些细胞通常用作使用hiv-1基阳性对照的rcl测定扩增细胞系。然而,已评估的对野生型或减毒hiv-1的感染具有敏感性的其它(较少)允许细胞包括cem-ss、mt4、molt4、molt4.8、pm1、h9、jurkat和supt1细胞。最初,通过用前病毒dna转染hek293t细胞产生一个大型的hivδa4主病毒库,通过c8166-45细胞扩增病毒,然后通过荧光产物增强型逆转录酶(f-pert)测定量化该库的物理滴度。使用该数据,通过在48孔规模下c8166-45细胞的连续稀释感染来确定库的感染滴度。然而,与hek293t-制备的起始病毒相比,主病毒库的传染性为约1000倍低(图5)。
[0323]
f-pert测定是一种被充分描述的方案并且是本领域技术人员已知的。例如,样品可以使用裂解缓冲液/溶液进行破坏/裂解,并通过f-pert qpcr进行分析。f-pert主混合物可以含有ms2 rna和引物以及对ms2具有特异性的探针。相对于具有已知活性水平的rt标准来测量逆转录酶活性水平。
[0324]
产生hivδa3vif
[0325]
通过geneart和插入到pmk4-3δa4(miniprep h10)中的sbfi-ecori片段制得了合成质粒(pvif repair)。消化来自新minipreps的克隆dna以筛选pmk4-3δa3vif 。pmk4-3δa3vif 中存在附加的ndei位点并且缺失了asei位点(图6)。
[0326]
汇集来自克隆3和4的dna并且用来生成hivδa3vif 的病毒储液。
[0327]
生产hivδa3vif 主病毒储液
[0328]
细胞接种
[0329]
hek293t细胞取自常规glp传代储液。t150烧瓶接种9.2x106个细胞/26.3ml,并且10cm2板接种3.5x106个细胞/10ml,并且在37℃下温育过夜。
[0330]
用前病毒dna转染细胞
[0331]
培养物看起来健康,并用如下前病毒dna转染。
[0332][0333][0334]
表8:转染方案
[0335]
方案
[0336]
在5ml bijou管中,将dna(a)加入到optimem(b)中
–
混合
[0337]
在bijou管中,将lipofectamine加入到optimem(d),缓慢地混合
–
温育5min
[0338]
逐滴地将l2k/optim(c)加入到a b混合物中
–
充分漩涡混合
[0339]
在室温下温育转染混合物25min
[0340]
将txn混合物逐滴添加到适当标记的培养物中-涡旋混合
[0341]
将培养物在37℃下温育过夜。
[0342]
诱导
[0343]
将丁酸钠添加到培养物中至最终培养物为10mm,持续6小时,然后分别将53ml和10ml新鲜培养基添加到10cm2板(txn1)和t150烧瓶(txn2)中。将培养物在37℃下温育约20小时。
[0344]
病毒收获
[0345]
收获来自两种培养物的上清液并通过0.2μm过滤器过滤。在冷冻管中制备15份0.6ml的hivδa4等分试样和92x0.5ml的hivδa3vif 等分试样,并储存在-80℃。
[0346]
hivδa3vif 的生产是成功的。这个主病毒库现在称为hivδa3vif 。
[0347]
c8166培养物中wt hiv、hivδa3vif 和hivδa4的传染性测试
[0348]
c8166-45细胞以前曾被报道对vif缺陷型hiv-1是半允许的。通过在c8166-45培养物中进行仅病毒直接传代历时4周,比较了wt hiv、hivδa3vif 和hivδa4的传染性。在moi
约0.1开始感染,在f-pert分析前温育3-4天,并用0.1ml含病毒上清液接种新培养物(图7)。
[0349]
野生型hiv和hivδa3vif 都能够连续感染c8166细胞,但hivδa4(一种vif缺陷型减毒性hiv病毒)通过直接传代变得无感染性。这表明c8166细胞对vif缺陷型hiv-1是半允许的。
[0350]
读者应注意到与本技术相关的本说明书同时提交或在此之前提交并且与本说明书一起公开供公众查阅的所有论文和文献上,并且所有此类论文和文献的内容均通过引用并入本文。
[0351]
本说明书(包括任何所附权利要求、摘要和附图)中公开的所有特征和/或如此公开的任何方法或过程的所有步骤可以以任何组合进行组合,但除了其中至少一些此类特征和/或步骤是相互排斥的组合。
[0352]
除非另有明确说明,否则本说明书(包括任何所附权利要求、摘要和附图)中公开的每个特征都可以被用于相同、等效或类似目的的替代特征代替。因此,除非另有明确说明,否则所公开的每个特征仅是一系列等效或相似特征的一个实例。
[0353]
本发明不限于任何前述实施方式的细节。本发明延伸至本说明书(包括任何所附权利要求、摘要和附图)中公开的特征的任何新的一个或任何新的组合,或延伸至如此公开的任何方法或过程的步骤的任何新的一个或任何新的组合。
[0354]
序列
[0355]
seq id no:1-hivδa3vif
[0356]
[0357]
[0358]
[0359][0360]
seq id no:2 hivδa4
[0361]
[0362]
[0363]
clinical grade vector products”.mol ther.2011mar;19(3):557-566.
[0367]
corre et al.2016
‑“″
rcl-pooling assay
″
:a simplified method for the detection of replication competent lentiviruses in vector batches using sequential pooling”.hum gene ther.feb;27(2):202-10.doi:101089/hum.2015.166.
[0368]
forestell,s.,dando,j.,bhnlein,e.and rigg,r.(1996).improved detection of replication-competent retrovirus.joumal of virological methods,60(2),pp.171-178
[0369]
miskin,j.,chipchase,d,rohll,j.,beard,g,wardell,t.,angell,d.,roehl,h.,jolly,d.,kingsman,s.and mitrophanous,k(2005).a replication competent lentivirus(rcl)assay for equine infectious anaemia virus(eiav)-based lentiviral vectors.gene therapy,13(3),pp.196-205.
[0370]
sastry,l.,xu,y.,duffy,l.,koop,s.,jasti,a.,roehl,h.,jolly,d.and cornetta,k.(2005).product-enhanced reverse transcriptase assay for replication-competent retrovirus and lentivirus detection.human gene therapy,16(10),pp.1227-1236
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。