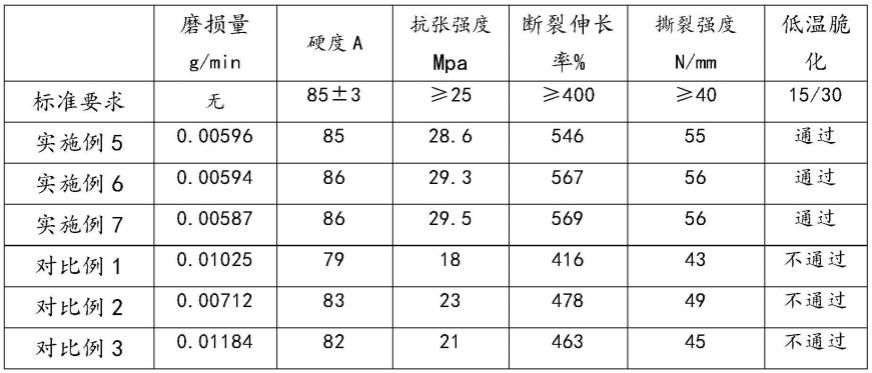
1.本发明涉及肝癌模型技术领域,具体是一种小鼠肝癌模型细胞的体外培养方法及其应用。
背景技术:
2.肝癌是最常见的癌症之一,对人类生命和健康造成严重危害,其发病率和死亡率长期居高不下。肝癌发病机制的探究、诊断和新靶点发现及其药物研发是亟需解决的问题。
3.肿瘤组织包含多种细胞,如免疫细胞、成纤维细胞等,以及不同细胞分泌细胞因子和生长因子、胞外基质等。肿瘤免疫微环境中有多种免疫细胞的浸润,包括cd4
t、cd8
t细胞、自然杀伤细胞、巨噬细胞、单核细胞、树突状细胞、调节性t淋巴细胞(regulatory tcell,treg)等(balkwill,capasso et al.2012)。肿瘤组织中不同类型的细胞、细胞表达的不同配体与相应的受体相互作用和胞外基质相互作用形成复杂的调控体系,构成了肿瘤微环境。因此,简单的体外肿瘤细胞培养体系难以全面揭示肿瘤微环境中不同细胞间复杂的相互调控网络。因此,小鼠肝癌模型的建立成为解决该难题的重要方案,亦是探究肿瘤发展机制和药物研发的基础。
4.随着对肿瘤发展过程中肿瘤细胞和机体免疫系统间的相互过程理解逐步深入,肿瘤免疫编辑理论逐渐形成。肿瘤的发生发展在免疫系统监视下主要经历免疫清除、免疫平衡和免疫逃逸三个免疫编辑阶段(gavin p.dunn,allen t.bruce et al.2002)。当所有变异的细胞被免疫细胞识别和杀伤,肿瘤细胞均被清除时,免疫编辑过程完成。但部分变异的细胞会对自身免疫原性编辑或通过影响肿瘤微环境来逃避免疫系统的监视,肿瘤细胞与免疫细胞处于一个短暂的平衡阶段,此时的肿瘤细胞在免疫系统的压力下,处于一个类似于休眠的状态,表现为临床不可检测的肿瘤,通常被认为是一种带瘤生存阶段。随着突变的不断积累(如dna突变和基因表达变化),肿瘤细胞会进一步产生一系列恶性表型(如:不产生特异性抗原,抵抗细胞凋亡等)来躲避免疫系统的监视,在此阶段不能清除肿瘤细胞,将导致肿瘤细胞抵抗,进而进入逃逸阶段,形成临床可检测的肿瘤。肿瘤免疫编辑揭示了免疫系统与肿瘤发生发展的关系。因此,认清免疫系统清除肿瘤细胞以及肿瘤细胞免疫逃逸的分子机制,是开发肿瘤免疫治疗的关键(gavin p dunn,lloyd j old et al.2004)。肿瘤微环境中不同类型的细胞在肝癌发生、发展及其治疗中发挥不同作用,比如肿瘤细胞可以表达免疫抑制因子,将具有抗肿瘤作用的巨噬细胞转变为促肿瘤的巨噬细胞。由于机体免疫系统区分“自我”和“非我”的特征,肿瘤微环境中肿瘤细胞和免疫细胞之间相互作用的研究只能使用同基因型肿瘤模型。因此,同基因型小鼠肝癌模型是研究肝癌细胞和肿瘤微环境中免疫细胞之间相互作用的基础。
5.常见的用于肝癌免疫学研究的小鼠模型有移植瘤模型,化学致癌剂诱导的肝癌模型以及基因工程肝癌模型。化学致癌剂诱导的肝癌模型试验周期长,模型建立需要有足够的技术经验,发病时间难以控制。基因工程肝癌模型需要特定的基因工程小鼠,相比较于化学致癌剂诱导肝癌其实验周期长,成本最高。肝癌皮下移植瘤模型具有操作简单方便,可以
直观观察肿瘤的生长,方便检测动物体重、肿瘤生长曲线、肿瘤重量等重要数据的优点。因此,皮下瘤模型是目前肿瘤研究,肿瘤免疫研究和药物研发等最常用的肿瘤模型。
6.小鼠肝癌细胞hepa1-6等均衍生于c57l铅色小鼠,能够在免疫缺陷小鼠和c57l铅色小鼠中迅速形成皮下瘤。然而目前c57bl/6小鼠是肿瘤学研究和肿瘤免疫研究中最为广泛使用的小鼠品系。c57bl/6小鼠品系基因背景与c57l铅色小鼠不同,使得hepa1-6在免疫系统完整的野生型c57bl/6小鼠中建立的皮下瘤生长缓慢,甚至被c57bl/6小鼠机体免疫系统所排斥。
7.c57bl/6小鼠同基因型肝癌模型的缺少严重限制限制了肝癌相关的研究,尤其是肝癌免疫调节和治疗的相关研究。
8.因此,需要建立一种能够在普遍使用的免疫完整(immune competent)野生型c57bl/6小鼠中能够快速建立皮下瘤和尾静脉注射形成原位肝癌的细胞系(命名为hepa1-6bl)。
技术实现要素:
9.本发明为了解决小鼠肝癌模型建立方法存在的问题,提供一种小鼠肝癌模型细胞的体外培养方法及其应用。
10.为了实现上述目的,本发明提供了一种小鼠肝癌模型细胞的体外培养方法,其主要特点是:包括以下步骤:
11.(1)制备注射小鼠用hepa1-6细胞;
12.(2)将所述的注射小鼠用hepa1-6细胞注射小鼠,监测小鼠肿瘤体积生长,筛选达到预设肿瘤大小的小鼠,获取肿瘤组织;
13.(3)处理所述的肿瘤组织,获得小鼠肝癌模型细胞,命名为hepa1-6bl细胞。
14.较佳地,所述的步骤(1)具体为:
15.(1-1)取出冻存于液氮中的hepa1-6细胞;于37℃快速解冻复苏;
16.(1-2)打开细胞冻存管,将细胞沉淀加入含5ml培养液的10ml离心管,在4℃条件下,离心,弃掉上清;
17.(1-3)4ml dmem完全高糖培养基重悬细胞沉淀,均匀添加至6cm细胞培养皿中,放置37℃、5%co2的培养箱中培养;
18.(1-4)待细胞密度达到80%~90%,胰酶消化进行细胞传代;
19.(1-5)1ml完全培养基重悬细胞,在6cm的培养皿中铺入细胞,培养细胞至良好,获得所述的注射小鼠用hepa1-6细胞。
20.较佳地,所述的步骤(1-5)中,培养细胞至良好,高倍镜下可见:细胞边缘光滑,轮廓清晰可见,细胞内部透光性好,折射性强,颗粒少,无空泡。
21.较佳地,所述的步骤(2)具体为:
22.(2-1)制备单细胞悬液;
23.(2-2)皮下注射每只小鼠,饲养;
24.(2-3)将细胞注射小鼠记为第0天,从第7天开始,监测小鼠肿瘤体积生长,记录肿瘤体积;
25.(2-4)筛选达到预设肿瘤大小的小鼠,获取肿瘤组织。
26.较佳地,所述的步骤(3)具体为:
27.(3-1)将肿瘤组织放至含有消化液的6孔板中,进行消化;
28.(3-2)将6孔板所有组织及消化液加入含有细胞筛的50ml离心管中过滤,并进行离心;
29.(3-3)弃掉上清,加dmem完全高糖培养基重悬细胞沉淀,并铺入6孔板,放置37℃、5%co2的培养箱中培养,获得hepa1-6bl细胞。
30.本发明还提供了所述的体外培养方法得到的小鼠肝癌模型细胞在建立小鼠肝癌模型中的应用。
31.本发明的hepa1-6bl细胞及皮下瘤模型的有益效果在于:
32.(1)hepa1-6bl细胞在体外培养具有以下特点:hepa1-6bl细胞培养条件与培养方法简单,生长速度快,增殖率高。hepa1-6bl细胞中多种免疫调节相关基因表达发生改变,可通过分子生物学方法对其进行改造,在分子水平和细胞水平探究这些基因在肝癌发展中的作用和机制,同时能够在体外实验中研究肝癌细胞和免疫细胞之间的相互作用。细胞水平的研究结果可以直接在小鼠模型中验证。
33.(2)hepa1-6bl肝癌细胞皮下瘤模型的特点:
34.hepa1-6bl细胞中与免疫相关基因的表达发生改变,免疫逃逸能力增强。相较于其他肝癌细胞系,在免疫系统完整的c57bl/6小鼠中细胞成瘤率高,皮下成瘤速度快,肿瘤发生均一的特点。此外,hepa1-6bl肝癌细胞皮下瘤模型具有易于建立、实验周期短,实验成本低等特点。hepa1-6bl皮下瘤中免疫细胞浸润较为丰富,其中巨噬细胞是主要的肿瘤浸润免疫细胞亚群,t细胞和nk细胞的肿瘤浸润较少。这一特征与肝癌病人肿瘤组织中免疫细胞浸润特征相似,因此该模型中免疫细胞浸润和功能可以反映肝癌病人肿瘤微环境。该模型可用于肝癌免疫逃逸,免疫耐药和免疫治疗药物筛选和研发。
35.(3)hepa1-6bl细胞在c57bl/6小鼠体内形成肝原位癌的特点:
36.hepa1-6bl细胞可用于在最为广泛使用的野生型c57bl/6小鼠体内构建肝原位癌模型,与化学致癌剂诱导的肝癌模型以及基因工程肝癌模型相比,hepa1-6bl细胞在c57bl/6小鼠体内形成肝原位癌有如下3个特点:
37.1)hepa1-6bl肝癌原位癌模型的建立无需致癌试剂诱导和其他试剂辅助,在整个实验过程中具有很高的安全性。
38.2)原位癌的建立只需要c57bl/6背景小鼠即可,无需构建和繁育特定的转基因小鼠,只需要进行一次高压尾静脉注射即可完成模型构建,因此该模型建立操作简单,整个实验周期短,有效地缩短研究周期和降低研究成本。
39.3)注射c57bl/6小鼠后3-4周时间范围内形成肝脏原位瘤,小鼠发病时间稳定,小鼠个体之间的差异小,重复性好,非常适用于抗肝癌药物的药效评价与机制研究。
附图说明
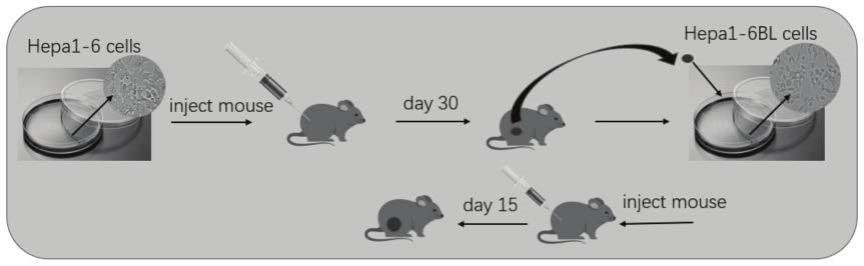
40.图1为本发明提供的小鼠肝癌模型流程图。
41.图2a和2b为实施例1中细胞注射小鼠后肿瘤生长曲线图。
42.图3为实施例2中单细胞悬液培养流程图。
43.图4为实施例2中hepa1-6bl短链重复序列(str)图谱。
44.图5a和5b为实施例3中细胞注射小鼠后肿瘤生长曲线图。
45.图6a~6c为实施例3中肝脏组织hepa1-6bl细胞转移结果图。
46.图7为实施例4中得到的火山图。
47.图8为实施例4中得到的go功能富集分析结果图。
48.图9为实施例4中得到的kegg功能富集分析结果图。
49.图10a及10b为hepa1-6和hepa1-6bl肿瘤细胞的差异基因示意图。
50.图11为实施例5中流式细胞术结果分析示意图。
51.图12为hepa1-6bl肿瘤组织中不同免疫细胞亚群的分类图。
52.图13为不同细胞亚群中排名前十标志高变基因的表达量热图。
53.图14为hepa1-6bl肿瘤组织中不同免疫细胞亚群的比例示意图。
具体实施方式
54.为了能够更清楚地描述本发明的技术内容,下面结合具体实施例来做进一步的描述。
55.如图1所示,为本发明提供的小鼠肝癌模型流程图。其中,小鼠肝癌模型细胞的步骤主要为:制备注射小鼠用hepa1-6细胞;将所述的注射小鼠用hepa1-6细胞注射小鼠,监测小鼠肿瘤体积生长,筛选肿瘤体积达到预设体积的小鼠,获取肿瘤组织;处理所述的肿瘤组织,获得小鼠肝癌模型细胞,命名为hepa1-6bl细胞。经过该体外培养方法得到的小鼠肝癌模型细胞可以用来建立小鼠肝癌模型。
56.实施例1
57.建立hepa1-6小鼠皮下瘤模型
58.(1)细胞培养及制备注射小鼠细胞
59.所需材料:超净台预先打开紫外30min备用;预先打开水浴锅,温度调至37℃备用;含0.25%edta胰酶消化液,dmem完全培养基(含1%的青霉素、1%链霉素和10%fbs),无菌pbs缓冲液放置室温备用。
60.细胞培养具体步骤如下:
61.从液氮中取出细胞,迅速放入37℃水浴锅,1-2min后,从水浴锅取出细胞;
62.在细胞培养室的超净台内打开细胞冻存管,将细胞悬液加入含有5ml培养液的10ml离心管,在4℃条件下,350g转速,离心4min,弃掉上清;
63.4ml dmem完全高糖培养基重悬细胞沉淀,均匀添加至6cm细胞培养皿中,放置37℃、5%co2的培养箱中培养;
64.待细胞密度达到80%-90%,在超净台中进行细胞传代,步骤如下:弃掉细胞培养上清,加入3ml无菌pbs缓冲液清洗细胞,弃掉pbs,加入0.5ml 0.25%edta胰酶消化液,完全覆盖细胞培养皿底部,将其放入37℃,5%co2的培养箱中,消化1min,倒置显微镜下观察细胞形态,有部分细胞掉落或细胞形态发生改变时,在培养皿中加入2ml完全培养基,吹打培养皿底部的细胞,使其完全掉落,将细胞移入离心管,4℃条件下,350g转速,离心4min,弃掉上清;
65.1ml完全培养基重悬细胞,在6cm的培养皿中铺入5x 105个细胞,4ml培养体系;
66.细胞培养至状态良好,高倍镜下可见:细胞边缘光滑,轮廓清晰可见,细胞内部透
光性好,折射性强,颗粒少,无空泡等。
67.制备注射小鼠细胞具体如下:
68.如上制备单细胞悬液,加入1ml无双抗无胎牛血清的1640培养基重悬细胞,进行细胞计数及台盼蓝染色,调整细胞数目为1.0x 108/ml,并确保细胞存活率大于90%。
69.(2)构建小鼠模型
70.所需材料:c57bl/6j雌性野生型(wt)小鼠,周龄约8周。
71.构建小鼠模型具体步骤如下:
72.将准备预先制备的hepa1-6细胞(1.0x 108/ml),每只小鼠皮下注射100ul,饲养在spf级屏障系统内,给与正常食物和饮水供应,每隔2天,观察小鼠状态是否良好;
73.将细胞注射小鼠记为第0天,从第7天开始,每隔2天使用游标卡尺监测小鼠肿瘤体积生长,采用长乘以宽的测量方式记录肿瘤大小;
74.在15天左右大部分肿瘤被排斥,仅有1只小鼠肿瘤生长较快,在注射肿瘤细胞1个月后,肿瘤大小达到17mm x 10mm,其中肿瘤生长曲线如图2a及2b所示。
75.实施例2
76.hepa1-6肿瘤组织处理及hepa1-6bl细胞制备
77.(1)肿瘤组织的获取
78.1)将肿瘤体积达到170mm2的小鼠进行安乐处死;
79.2)在超净台中收取肿瘤组织,并进行称取50mg肿瘤组织放至含300ul消化液(胶原酶1mg/ml,dnase1 20ug/ml)的6孔板中,使用剪刀剪碎肿瘤组织,补消化液至1.5ml;
80.4)将6孔板放至37℃摇床,150rpm转速,消化45min;
81.5)于超净工作台中将无菌细胞筛放置50ml离心管上,加3ml pbs湿润细胞筛滤布备用。将6孔板所有组织及消化液加入含有细胞筛的50ml离心管中,同时使用1ml注射器的活塞柄研磨肿瘤组织,加pbs冲洗细胞,使之完全过滤至50ml离心管中;
82.6)4℃离心机350g转速,离心4min;
83.7)弃掉上清,加4ml dmem完全高糖培养基重悬细胞沉淀,并铺入6孔板,4ml体系,放置37℃、5%co2的培养箱中培养;
84.(2)单细胞悬液培养,可参考图3。
85.(3)hepa1-6bl细胞传代
86.1)第1天:观察细胞形态,镜下可见:细胞碎片、悬浮细胞及贴壁细胞,培养基颜色未见变黄,弃掉上清,使用无菌pbs清洗细胞3次,以去除悬浮细胞及细胞碎片,加入2ml dmem完全高糖培养基放入37℃、5%co2的培养箱中培养;
87.2)第2天:观察细胞形态,镜下可见:少量悬浮细胞及大多数贴壁细胞,培养基颜色未见变黄,细胞密度达到90%。细胞传代:弃掉上清,使用无菌pbs清洗细胞3次,以去除悬浮细胞;加入0.5ml 0.25%edta胰酶消化液,完全覆盖细胞培养皿底部,消化30s;在培养皿中加入2ml完全培养基,吹打培养皿底部的细胞,使其完全掉落,将细胞移入离心管,4℃条件下,350g转速,离心4min,弃掉上清;加入2ml完全培养基重悬,取250ul细胞悬液,铺入6孔板中,2ml培养体系;
88.3)第3天:观察细胞形态,镜下可见:少量悬浮细胞及大多数贴壁细胞,培养基颜色未见变黄,细胞密度达到50%;
89.(4)hepa1-6bl短链重复序列(str)图谱
90.hepa1-6bl短链重复序列(str)图谱如图4所示。
91.(5)hepa1-6bl的冻存
92.1)弃掉上清,沿细胞培养皿的壁部缓慢加入3ml无菌pbs缓冲液清洗细胞;
93.2)弃掉pbs,加入0.5ml 0.25%edta胰酶消化液,完全覆盖细胞培养皿底部,消化30s,在培养皿中加入2ml完全培养基,吹打培养皿底部的细胞,使其完全掉落,将细胞移入离心管,4℃条件下,350g转速,离心4min;
94.3)弃掉上清,加入1ml无菌无血清细胞冻存液并混匀,移至细胞冻存管中,使用冻存盒于-80℃冻存。24h后将冻存的细胞转入液氮保存。
95.(6)hepa1-6bl的复苏
96.1)从液氮中取出细胞,迅速放入37℃水浴锅,1-2min后,从水浴锅取出细胞;
97.2)在细胞培养室的超净台内打开细胞冻存管,将细胞悬液加入含5ml培养液的10ml离心管,在4℃条件下,350g转速,离心4min,在超净台内打开盖子,弃掉上清;
98.3)加入4ml dmem完全高糖培养基重悬细胞沉淀,接种于6cm细胞培养皿中,放置37℃、5%co2的培养箱中培养。
99.(7)hepa1-6bl细胞的生长速度
100.hepa1-6bl细胞状态良好时,生长速度较快,第1天密度达到90%,以1:3的传代方式,第二天细胞密度可达80-90%。
101.实施例3
102.建立hepa1-6bl皮下瘤模型及肝转移原位模型
103.(1)构建小鼠皮下肿瘤模型
104.1)选择c57bl/6j雌性wt小鼠,周龄约8周,动物饲养条件同hepa1-6模型小鼠饲养条件。
105.2)制备hepa1-6bl细胞悬液,调整细胞悬液浓度为5.0x 106/ml,每只小鼠皮下注射100ul,监测肿瘤体积方式同前。
106.3)肿瘤生长曲线如图5a和5b所示。
107.(2)构建小鼠肝转移原位癌模型
108.1)实验小鼠选择c57bl/6j雄性wt小鼠,周龄约11周,动物饲养条件同上。
109.2)制备hepa1-6bl细胞,调整细胞悬液浓度为5.0x 105/ml,在8秒内每只小鼠尾静脉注射2ml,在第22天安乐处死,收取肝脏组织并评估肿瘤转移。
110.3)肝脏组织中hepa1-6bl细胞转移结果图6a~6c所示。
111.实施例4
112.分析hepa1-6与hepa1-6bl细胞转录组差异和免疫调节基因差异
113.(1)trizol提取hepa1-6与hepa1-6bl细胞总rna,进行转录组测序。
114.通过r软件的deseq2软件包,比较两个不同细胞系的显著差异基因。
115.如图7所示,表明有6031个基因在hepa1-6和hepa1-6bl细胞中的转录水平存在显著差异基因(显著差异基因的筛选标准为adjusted p value《0.05,|log2fc|≥1),其中hepa1-6bl与hepa1-6相比,转录水平上调的基因有2652个,下调的基因有3479个。
116.(2)显著差异基因进行功能富集分析。
117.如图8所示,运用r软件的clusterprofiler软件包进行go(gene ontology)功能富集分析,表明差异基因主要显著富集在细胞迁移(cell migration),细胞趋化(cell chemotaxis)等生物学功能。
118.(3)运用r软件的clusterprofiler软件包进行kegg功能富集分析,如图9所示,表明差异基因主要显著富集在细胞因子与细胞因子受体互作关系(cytokine-cytokine receptor interaction)、细胞黏附分子(cell adhesion molecules)、il17信号通路(il17 signaling pathway)等相关通路。这些通路的改变表明相比较于hepa1-6细胞,hepa1-6bl细胞小鼠中发展过程中与免疫系统相互作用发生改变。
119.(4)从gene lists(immport.org)网站获取免疫基因集列表,并与hepa1-6和hepa1-6bl肿瘤细胞的差异基因取交集,获得显著差异的免疫基因347个(如图10a所示)。
120.运用r pheatmap function绘制具有显著差异的免疫基因表达量热图。如图10b所示,表明具有更多的免疫相关基因在hepa1-6bl细胞系中下调;免疫抑制基因s100a4、slc16a3等在hepa1-6bl中上调。表明hepa1-6bl肿瘤细胞的免疫逃逸能力增强是hepa1-6bl细胞迅速形成肿瘤的主要原因之一。hepa1-6和hepa1-6bl的转录组测序结果进行比较有助于深刻的揭示hepa1-6bl肝癌细胞的基因在小鼠体内经过免疫编辑,与肿瘤发生、发展和免疫逃逸相关的基因。
121.实施例5
122.hepa1-6bl皮下瘤免疫细胞浸润分析
123.(1)单细胞悬液制备
124.1)安乐处死荷瘤小鼠,取出肿瘤组织,并进行称重;
125.3)将200mg肿瘤组织放至300ul组织消化液的12孔板中,使用剪刀剪碎肿瘤组织,组织消化液至1.5ml;
126.4)将12孔板放至37℃摇床,150rpm转速,消化45min;
127.5)将细胞筛放置50ml离心管上,加3ml pbs湿润细胞筛滤布备用;将12孔板所有组织及消化液加入含有细胞筛的50ml离心管中,同时使用1ml注射器的活塞柄研磨肿瘤组织,同时加pbs冲洗细胞,使之完全进入50ml离心管中;
128.6)4℃离心机350g转速,离心4min;
129.7)弃掉上请,每200mg肿瘤组织加1ml 2%facs buffer(1ml胎牛血清 50ml pbs)重悬细胞沉淀。
130.(2)流式抗体染色及染色
131.1)在96孔u底板中加入150ul样本,4℃预冷离心机,使用350g转速,离心4min,弃掉上清;
132.2)在棕色离心管中使用2%facs buffer作为稀释溶液稀释apccy7-cd45.2(500倍)、fc blockade(200倍),7aad(200倍);
133.3)将40ul混合抗体稀释液加入第1)步中,使用移液枪吹打混匀细胞2-3次,4℃避光染色20min,加入150ul pbs稀释染色;
134.4)4℃预冷离心机,使用350g转速,离心4min,弃掉上清。
135.5)加入200ul 2%facs buffer重悬细胞,待上机检测;
136.6)使用ariaiii流式细胞仪上机检测。
137.7)使用flowjo_v10软件分析流式数据,如图11所示,cd45.2
细胞比例大约10%。
138.8)根据7)中流式细胞术分析方法,使用aria iii分选hepa1-6bl肿瘤组织中cd45.2
活细胞。通过10x genomics 3’转录组使用短读长测序和微流控技术实现对9200个细胞的单细胞转录组表达谱分析。将含有barcode信息的凝胶珠与细胞和酶的混合物结合,在微流体系统中头通过油表面活性剂液滴包裹,形成gems(gel beads-in-emulsions)。gems流到储液器中并被收集,凝胶珠溶解释放barcode序列,逆转录cdna片段,并对样本进行标记。
139.9)将凝胶珠破碎并打碎油滴,以cdna为模板进行pcr扩增。使用cnda酶将cdna打断成200-300bp的片段之后在添加测序接头p3和测序引物r1等进行pcr扩增获得dna文库。
140.10)利用illumina测序平台的双端测序模式对建好的文库进行高通量测序。在read 1端,包含了16bp的barcode信息和10bp的umi信息用于确定细胞和表达量定量;在read2端,包含了cdna片段,用于参考基因组比对确定mrna所对应的基因。采用10xgenomics官方分析软件cell ranger对原始数据进行数据质量统计,并比对参考基因组。
141.11)进行细胞、基因表达量和表达比例,以及线粒体表达等质控后,运用r软件sseurat软件包将9200个免疫细胞聚类为14个细胞亚群,结果如图12所示。
142.12)图13为不同细胞亚群中排名前十的标志高变基因的表达量热图。运用r软件seurat软件包find markers功能,筛选出每个细胞亚群的标志基因(高变基因)。图13为每个细胞亚群中排名前十的高变基因的表达量热图。通过查阅文献建立每个免疫细胞亚群的标志基因库,以及根据肿瘤免疫理论,根据每个细胞亚群排名前十的高变基因表达量热图,注释鉴定每个细胞亚群的种类。细胞亚群的鉴定结果已注释在图13中。
143.13)图14为hepa1-6bl肿瘤组织中不同免疫细胞亚群的比例。将9200个免疫细胞进行细胞亚群的分类、鉴定注释后,计算每个细胞亚群在整个hepa1-6bl肝癌组织免疫细胞中的细胞比例。
144.研究结果发现hepa1-6bl肝癌组织免疫细胞中tam特征的巨噬细胞占比将近50%,单核细胞为26%,嗜碱性粒细胞,cd8
t细胞和cd4
t细胞的比例分别接近5%,dc和nk细胞占比将近3%,中性粒细胞占比1%。通过单细胞转录组测序结果首次完整、清晰的展现了hepa1-6bl肝癌组织浸润的细胞亚群的种类及其细胞数目占比。该模型中免疫细胞的浸润和肝癌病人肿瘤组织中免疫细胞的浸润具有很高的相似性。表明该模型可以很好的反应肝癌病人肿瘤微环境,用于肝癌及其免疫学研究。
145.在此说明书中,本发明已参照其特定的实施例作了描述。但是,很显然,仍可以做出各种修改和变换而不背离本发明的精神和范围。因此,说明书和附图应被认为是说明性的而非限制性的。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。