1.本发明属于有机光敏剂技术领域,具体涉及一种以基于喹喔啉的四环或多环骨架为核心骨架,在骨架上引入取代基,衍生得到一类新型和高效的可见光有机光敏剂及其制备方法和应用。
背景技术:
2.在可见光照射下,有机小分子光敏剂催化的有机化学反应和聚合反应由于其高效和绿色等特点,近年来已经成为热点研究领域;传统的光催化剂以过渡金属型居多,但过渡金属一般比较昂贵且对环境造成污染,同时已经开发的在可见光照射下高效的有机小分子光敏剂类型较少;因此,设计合成新型和高效的可见光有机光催化剂并应用于有机化学反应和聚合反应非常重要。
3.近年来一类由苯胺和咔唑、吩噻嗪和吩噁嗪等三环骨架组成的有机光催化剂引起了人们的重视;该类光敏剂能够高效地催化丙烯酸酯的自由基聚合(j.am.chem.soc.2014,136,16096-16101;macromolecules 2018,51,7421-7434;j.am.chem.soc.2016,138,11399-11407;acs macro lett.2018,7,1016-1021);但该类光敏剂在可见光区域的吸收非常弱。
4.由基于喹喔啉的四环共轭骨架衍生的有机小分子在近紫外和可见光区有很强的吸收,但该类化合物报道的却很少(j.heterocyclic chem.1981,18,405-407;liebigs ann.chem.1987,921-925),作为可见光区光敏剂在有机化学反应(org.lett.2018,20,5700-5704)和在聚合反应中的应用非常少(polymer 2004,45,2559-2566;j.photochem.photobio.a:chem.2008,198,60-68;j.photochem.photobio.a:chem.2009,202,115-121;j.photochem.photobio.a:chem.2009,202,147-153;inter.j.photoenergy 2012,487620);文献中所报道的由基于喹喔啉的四环共轭骨架衍生的有机小分子结构类型和数量很少,其应用也没有被充分发掘,因此开发在可见光照射下稳定并且对有机反应和聚合反应催化效率高的该类光敏剂就显得非常重要。
技术实现要素:
5.本发明的目的在于提供一类由基于喹喔啉的四环共轭骨架衍生出新的有机小分子光敏剂,开发了该类光敏剂的制备方法,发现了该类光敏剂在近紫外和可见光照射下可高效催化有机反应和聚合反应。
6.本发明提供的由基于喹喔啉的四环共轭骨架衍生的有机小分子光敏剂结构见通式和子通式i~ix:
[0007][0008]
式中:
[0009]
z1或z2选自取代的碳、氮、氧、硫、膦或硼,从而分为i~ix共九个子通式。
[0010]
x或y选自h、卤素、硝基、氰基、三氟甲基、c
1-c6烷基或烯基或炔基、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂原子(o、n、s、p、卤素)、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个芳基取代、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂芳基取代、芳基、杂芳基、羟基、c
1-c6烷基氧基、芳基氧基、杂芳基氧基、c
1-c6烷基氧基羰基、芳基氧基羰基、杂芳基氧基羰基、c
1-c6酰氧基、芳基酰氧基、杂芳基酰氧基、巯基、c
1-c6烷基硫基、芳基硫基、杂芳基硫基、c
1-c6烷基硫基羰基、芳基硫基羰基、杂芳基硫基羰基、c
1-c6酰硫基、芳基酰硫基、杂芳基酰硫基、氨基、n-c
1-c6烷基氨基、n,n-二c
1-c6烷基氨基、n-芳基氨基、n-c
1-c6烷基-n-芳基氨基、n,n-二芳基氨基、n,n-芳基杂芳基氨基、n,n-二杂芳基氨基、n-c
1-c6烷基氨基羰基、n,n-二c
1-c6烷基氨基羰基、n-芳基氨基羰基、n-c
1-c6烷基-n-芳基氨基羰基、n,n-二芳基氨基羰基、n,n-芳基杂芳基氨基羰基、n,n-二杂芳基氨基羰基、c
1-c6烷基酰胺基、n-芳基c
1-c6烷基酰胺基、n-杂芳基c
1-c6烷基酰胺基、n-芳基芳基酰胺基、n-芳基杂芳基酰胺基、n-杂芳基芳基酰胺基、n-杂芳基杂芳基酰胺基、c
1-c6烷基酰亚胺基、芳基酰亚胺基、c
1-c6烷基磺酰胺基、n-c
1-c6烷基c
1-c6烷基磺酰胺基、n-芳基c
1-c6烷基磺酰胺基、n-杂芳基c
1-c6烷基磺酰胺基、n-c
1-c6烷基芳基磺酰胺基、n-芳基芳基磺酰胺基、n-杂芳基芳基磺酰胺基、n-c
1-c6烷基杂芳基磺酰胺基、n-芳基杂芳基磺酰胺基、n-杂芳基杂芳基磺酰胺基、n-c
1-c6烷基氨基磺酰基、n,n-二c
1-c6烷基氨基磺酰基、n-芳基氨基磺酰基、n-c
1-c6烷基-n-芳基氨基磺酰基、n,n-二芳基氨基磺酰基、n,n-芳基杂芳基氨基磺酰基、n,n-二杂芳基氨基磺酰基、c
1-c6烷基砜基、c
1-c6烷基亚砜基、芳基砜基、
芳基亚砜基、杂芳基砜基、杂芳基亚砜基、二c
1-c6烷基磷酰基、二芳基磷酰基、二杂芳基磷酰基、c
1-c6烷基芳基磷酰基、二c
1-c6烷基氧基磷酰基、二芳基氧基磷酰基、二杂芳基氧基磷酰基、c
1-c6烷基氧基芳基氧基磷酰基、c
1-c6烷基芳基氧基磷酰基、c
1-c6烷基氧基芳基磷酰基、n,n-二c
1-c6烷基氨基磷酰基、n,n-二芳基氨基磷酰基、n,n-二杂芳基氨基磷酰基、n,n-c
1-c6烷基芳基氨基磷酰基、二c
1-c6烷基磷酰氧基、二芳基磷酰氧基、二杂芳基磷酰氧基、c
1-c6烷基芳基磷酰氧基、二c
1-c6烷基氧基磷酰氧基、二芳基氧基磷酰氧基、二杂芳基氧基磷酰氧基、c
1-c6烷基氧基芳基氧基磷酰氧基、c
1-c6烷基芳基氧基磷酰氧基、c
1-c6烷基氧基芳基磷酰氧基、二c
1-c6烷基磷酰氧基、二芳基磷酰氧基、二杂芳基磷酰氧基、c
1-c6烷基芳基磷酰氧基、二c
1-c6烷基氧基磷酰氧基、二芳基氧基磷酰氧基、二杂芳基氧基磷酰氧基、c
1-c6烷基氧基芳基氧基磷酰氧基、c
1-c6烷基芳基氧基磷酰氧基、c
1-c6烷基氧基芳基磷酰氧基、二c
1-c6烷基磷酰氨基、二芳基磷酰氨基、二杂芳基磷酰氨基、c
1-c6烷基芳基磷酰氨基、二c
1-c6烷基氧基磷酰氨基、二芳基氧基磷酰氨基、二杂芳基氧基磷酰氨基、c
1-c6烷基氧基芳基氧基磷酰氨基、c
1-c6烷基芳基氧基磷酰氨基、c
1-c6烷基氧基芳基磷酰氨基或含n,o,s的非芳香杂环基。
[0011]
r1或r2选自h、c
1-c6烷基或烯基或炔基、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂原子(o、n、s、p、卤素)、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个芳基取代、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂芳基取代、c
1-c6烷基酰基、c
1-c6烷氧基羰基、c
1-c6烷氨基羰基、c
1-c6烷基磺酰基、c
1-c6烷氧基磷酰基、c
1-c6烷氧基、c
1-c6烷胺基、芳基、芳基氧基羰基、芳基酰基、芳基氨基羰基、芳氧基、芳胺基、芳基磺酰基、芳基磷酰基、芳基氧磷酰基、杂芳基、杂芳基氧基羰基、杂芳基酰基、杂芳基氨基羰基、杂芳基磺酰基、杂芳基磷酰基、杂芳基氧基磷酰基、杂芳基磷酰氧基、杂芳基氧基磷酰基或含n,o,s的非芳香杂环基。
[0012]
r3或r4选自h、c
1-c6烷基或烯基或炔基、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂原子(o、n、s、p、卤素)、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个芳基取代、c
1-c6烷基或烯基或炔基的一个或几个碳原子上有一个或多个杂芳基取代、r3与r4组成的环状c
1-c6烷基(其中c
1-c6烷基为上述所涉及的各种取代的c
1-c6烷基)、羰基或硫羰基。
[0013]
在上述衍生物的定义中,所用术语不论单独使用还是用在复合词中,代表如下取代基:
[0014]
n为0,1或2;
[0015]
m为0或1;
[0016]
卤素为氟、氯、溴或碘;
[0017]
烷基为直链或支链烷基;
[0018]
烯基为有2-6个碳原子的直链或支链并可在任何位置上存在有双键;
[0019]
炔基为有2-6个碳原子的直链或支链并可在任何位置上存在有三键。
[0020]
本发明光敏剂子通式i~vii按scheme-1所示合成方法:
[0021]
[0022]
scheme-1光敏剂子通式i~vii的合成路线
[0023]
制备步骤如下:
[0024]
将两种反应原料、催化剂和碱溶于溶剂中,在加入或不加入氧化剂下,加热得到通式化合物;反应式中各基团如权利要求1的定义。
[0025]
本发明光敏剂子通式i~iii按scheme-2所示合成方法:
[0026][0027]
scheme-2光敏剂子通式i~iii的合成路线
[0028]
制备步骤如下:
[0029]
将邻苯二胺或苯酚或苯硫酚和2,3-二氯喹喔啉、碱和溶剂混合加热得到r1=h的子通式i~iii化合物;上述所得产物、催化剂和碱溶于溶剂中,在加入或不加入氧化剂下,加热得到子通式i~iii化合物;反应式中各基团如权利要求1中的定义。
[0030]
本发明光敏剂子通式iii(其中r1=r2)按scheme-3所示合成方法:
[0031][0032]
scheme-3光敏剂子通式iii的合成路线
[0033]
制备步骤如下:
[0034]
将两种反应原料、催化剂和碱溶于溶剂中,在加入或不加入氧化剂下,加热得到子通式iii化合物;反应式中各基团如权利要求1中的定义。
[0035]
本发明光敏剂子通式iii按scheme-4所示合成方法:
[0036][0037]
scheme-4光敏剂子通式iii的合成路线
[0038]
制备步骤如下:
[0039]
将两种反应原料和碱溶于溶剂中,加热得到子通式iii化合物;反应式中各基团如权利要求1中的定义。
[0040]
本发明光敏剂子通式iii按scheme-5所示合成方法:
[0041][0042]
scheme-5光敏剂子通式iii的合成路线
[0043]
制备步骤如下:
[0044]
将n-r1取代的邻苯二胺和2,3-二氯喹喔啉、碱和溶剂混合加热得到r2=h的子通式iii化合物;上述所得产物、催化剂和碱溶于溶剂中,在加入或不加入氧化剂下,加热得到子通式iii化合物;反应式中各基团如权利要求1中的定义。
[0045]
本发明光敏剂子通式v按scheme-6所示合成方法:
[0046][0047]
scheme-6光敏剂子通式v的合成路线
[0048]
制备步骤如下:
[0049]
将邻苯二胺和靛红、碱和溶剂混合加热得到r1=h的子通式v化合物;上述所得产物、催化剂和碱溶于溶剂中,在加入或不加入氧化剂下,加热得到子通式v化合物。反应式中各基团如权利要求1中的定义。
[0050]
本发明所述有机光敏剂在有机化学反应中的应用按scheme-7所示反应:
[0051][0052]
scheme-7所述有机光敏剂在有机化学反应中的应用
[0053]
反应步骤如下:
[0054]
将苯基环丙胺、取代的烯烃、光敏剂和溶剂加入反应管中,氩气保护下用一定波长的led灯照射反应,得到胺基环戊烷产物;反应式中各基团如权利要求1和6中的定义。
[0055]
本发明所述有机光敏剂在聚合反应中的应用按scheme-8所示反应:
[0056][0057]
scheme-8所述有机光敏剂在聚合反应中的应用
[0058]
反应步骤如下:
[0059]
将烯烃、自由基引发剂r
5-q2、光敏剂和溶剂加入反应管中,氩气保护下用一定波长的led灯照射反应,得到聚合物;反应式中各基团如权利要求1和7中的定义。
[0060]
本发明所述有机光敏剂在聚合反应中的应用按scheme-9所示反应:
[0061][0062]
scheme-9所述有机光敏剂在聚合反应中的应用
[0063]
反应步骤如下:将烯烃、胺和光敏剂加入反应管中,在有或无溶剂下,氩气保护下
用一定波长的led灯照射反应,得到聚合物;反应式中各基团如权利要求1和8中的定义。
[0064]
所述的有机溶剂选自丙酮、二氯甲烷、氯仿、四氯化碳、苯、甲苯、甲醇、乙醇、乙酸乙酯、乙酸、四氢呋喃、乙腈、1,4-二氧六环、n,n-二甲基苯胺、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮或二甲基亚砜。
[0065]
所述的催化剂选自cu2o,cui,cuo,cucl2,cu(oac)2,cui,cucl,cuso4,cupf6,cubf4,cu(oso2cf3)2,pdcl2,pd(oac)2,pd2(dba)3,nicl2,nibr2,ni(oac)2,cufe2o4,fecl3,fecl2,fe2o3,feso4,co(oac)2,co(acac)2,co(tpp),cobr2,cocl2等。
[0066]
所述的的碱选自et3n,(ipr)2net,吡啶,naoh,koh,nbu4noh,
t
buona,
t
buok,k2co3,na2co3,cs2co3,k3po4等。
[0067]
所述的的氧化剂选自o2,空气,(
t
buo)2,tempo,n-氧化吡啶等。
[0068]
所述由基于喹喔啉的四环共轭骨架衍生的有机小分子均可用作光敏剂用于催化有机化学反应和聚合反应。本发明的技术效果是:在近紫外和可见光照射下,所述有机光敏剂高效催化有机化学反应和聚合反应。
附图说明
[0069]
下面结合附图对本发明进一步说明。
[0070]
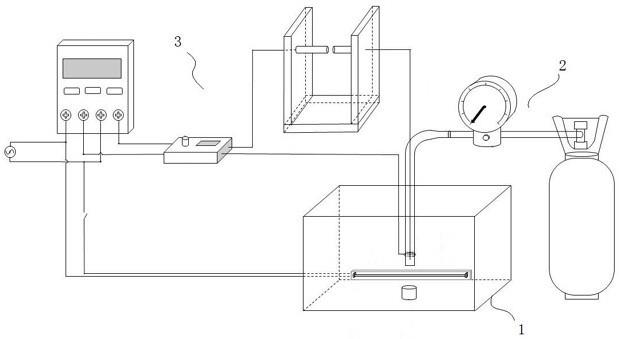
附图:紫外-可见吸收光谱数据由日本jasco v-570紫外-可见光谱仪或analytikjenaplus高智能紫外可见分光光度计测定,光谱扫描范围从250nm到600nm;荧光光谱测量使用edinburgh instruments的fs5稳态瞬态荧光光谱仪spectrofluorometer;伏安特性曲线由上海辰华t-660m电化学工作站或chi660e电化学工作站测定;x射线强度数据是在rigaku 007hf xtalab p200单晶衍射仪(mo)上测量的;聚合物的分子量和分子量分布使用waters 1525凝胶渗透色谱仪(gpc)测定。
[0071]
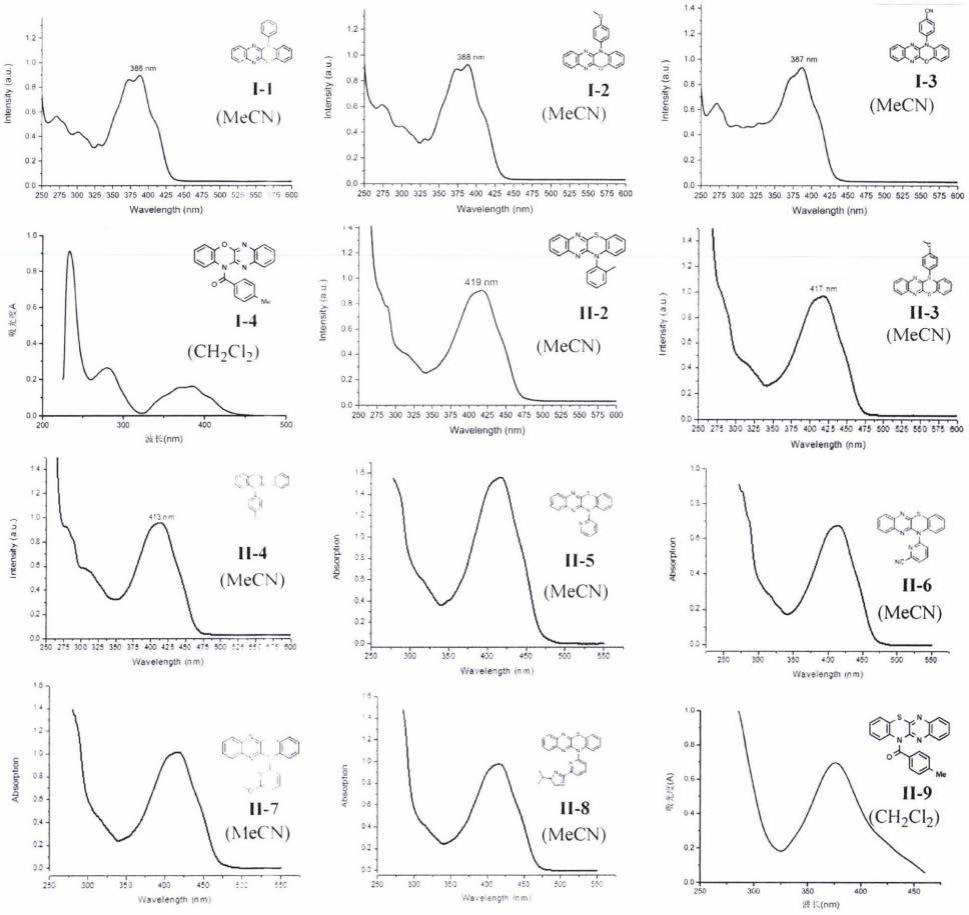
图1为光敏剂i-1~i-4和ii-2~ii-9的紫外-可见光吸收光谱;
[0072]
图2为光敏剂i-8,ii-12~ii-14,v-3,v-5和v-6的紫外-可见光吸收光谱;
[0073]
图3为光敏剂iii-2~iii-17的紫外-可见光吸收光谱和荧光发射光谱;
[0074]
图4为光敏剂i-1~i-3,ii-3~ii-4和iii-2~iii-17的伏安特性曲线;
[0075]
图5为实例22所得聚合物的溶胶凝胶色谱图;
[0076]
图6为光敏剂化合物iii-8的x-ray;
[0077]
图7为光催化聚合反应通式。
具体实施方式
[0078]
以下结合实施例来进一步说明本发明,其目的是能更好的理解本发明的内容及体现本发明的实质性特点,因此所举之例不应视为对本发明保护范围的限制。
[0079]
实施例1
[0080]
光敏剂i-1的合成
[0081]
[0082]
50ml单口烧瓶中,将2-氨基苯酚(0.34g,3.125mmol)加入到koh(0.4g,7.13mmol)和水(2ml)的混合溶液中,待固体溶解后,反应体系中加入溶于dmf(6ml)的2,3-二氯喹喔啉(0.5g,2.5mmol),而后体系升温至120℃回流5h,tlc检测反应。反应完成后,反应体系中加入冰水淬灭,抽滤出固体,并用水(50ml)洗涤三次,真空干燥,得到产物灰绿色固体i-1(0.33g,产率55%)。
[0083]
实施例2
[0084]
光敏剂i-3的合成
[0085][0086]
将i-1(99.8mg,0.44mmol,1.0eq)和对甲氧基苯硼酸(111.2mg,0.67mmol,1.5eq)加入100ml双口烧瓶中,随后将无水n,n-二甲基甲酰胺和无水乙腈(v/v,15ml/15ml)按比例混合后加入双口烧瓶中,待固体完全溶解后,再加入无水乙酸铜(124mg,0.67mmol,1.5eq),碳酸铯(146mg,0.44mmol,1.0eq)和吡啶(106μl,1.32mmol,3.0eq),在氧气球的保护下,将反应体系加热至110℃,tlc检测反应,反应18小时。反应完成后,将反应体系冷却至室温,向体系中滴加饱和nh4cl溶液淬灭反应,加入适量水析出固体,用乙酸乙酯萃取三次,合并有机相,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压浓缩,硅胶柱层析分离,乙酸乙酯∶石油醚=1∶40过柱,柱层析纯化后得到88.4mg黄色固体产物i-3,产率59%。
[0087]
实施例3
[0088]
光敏剂i-5的合成
[0089][0090]
将i-1(0.1g,0.421mmol)分散在装有2ml吡啶的具支试管中,加热至35℃搅拌,将对甲基苯甲酰氯(0.13ml,0.148g,0.955mmol)在3min内逐滴滴加到体系中,滴加完成后升温至90℃回流反应3h后tlc检测反应进度,待i-1无明显剩余后,停止加热,降至室温后于通风橱内滴加新配10%盐酸水溶液,直至ph试纸检测体系ph<3,用新配10%碳酸氢钠水溶液中和过量盐酸至不再有气泡生成,抽滤后用碳酸氢钠水溶液洗涤固体滤渣,收集固体滤渣后使用dmf-甲醇混合溶液重结晶得到析出固体,最后用石油醚-乙酸乙酯混合溶液做展开剂(石油醚∶乙酸乙酯=20∶1)进行柱层析得到0.059g目标产物i-5,产率为43%。
[0091]
实施例4
[0092]
光敏剂ii-1的合成
[0093][0094]
50ml单口烧瓶中,将2-氨基苯硫酚(0.39g,3.125mmol)加入到koh(0.4g,7.13mmol)和水(2ml)的混合溶液中,待固体溶解后,反应体系中加入溶于dmf(7ml)的2,3-二氯喹喔啉(0.5g,2.5mmol),而后体系升温至120℃回流4h,tlc检测反应。反应完成后,反应体系中加入冰水淬灭,抽滤出固体,并用水(50ml)洗涤三次,真空干燥,得到亮黄色固体产物ii-1(0.63g,产率94%)。
[0095]
实施例5
[0096]
光敏剂ii-2的合成
[0097][0098]
将ii-1(1g,4mmol),na2co3(848mg,8mmol),铜粉(51mg,20mol%)和碘苯(20ml)加热回流直到ii-1反应完全。混合物冷却到室温,过量碘苯减压蒸馏出。加入乙醇,加热溶解,过滤。滤液冷却析出的固体再重结晶得到1.18g黄色固体产物ii-2,产率90%。
[0099]
实施例6
[0100]
光敏剂ii-5的合成
[0101][0102]
将ii-1(0.1004g,0.40mmol,1.0eq)和对氰基苯硼酸(0.0926g,0.60mmol,1.5eq)加入100ml双口烧瓶中,随后将无水n,n-二甲基甲酰胺和无水乙腈(v/v,15ml/15ml)按比例混合后加入双口烧瓶中,待固体完全溶解后,再加入无水乙酸铜(0.111g,0.60mmol,1.5eq),碳酸铯(0.1327g,0.40mmol,1.0eq)和吡啶(96μl,1.2mmol,3.0eq),在氧气球的保护下,将反应体系加热至100℃,tlc检测反应,反应24小时。反应完成后,将反应体系冷却至室温,向体系中滴加饱和nh4cl溶液淬灭反应,加入适量水析出固体,用乙酸乙酯萃取三次,合并有机相,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压浓缩,硅胶柱层析分离,乙酸乙酯∶石油醚=1∶40过柱,柱层析纯化后得到88.8mg黄色固体产物ii-5,产率63%。
[0103]
实施例7
[0104]
光敏剂ii-6的合成
[0105][0106]
在小试管中加入ii-1(251mg,1.0mmol)、2-溴代吡啶(193mg,1.2mmol)、cu(13mg,0.2mmol)和na2co3(106mg,1.0mmol),再加入1ml dmf,氩气抽换气后,加热回流反应12h。反应结束冷却至室温,加入二氯甲烷稀释溶解后用饱和食盐水洗涤2次,有机相用无水硫酸钠干燥,旋干过柱得到279mg目标产物ii-6,收率85%。
[0107]
实施例8
[0108]
光敏剂ii-9的合成
[0109][0110]
在小试管中加入ii-1(251mg,1.0mmol)、2-溴代吡啶-2-噁唑啉(325mg,1.2mmol)、cu(13mg,0.2mmol)和na2co3(106mg,1.0mmol),再加入1ml dmf,氩气抽换气后,加热回流反应28h。反应结束冷却至室温,加入dcm溶解稀释后,用饱和食盐水洗涤2次,有机相用无水硫酸钠干燥后旋干过柱,得到341.6mg目标产物ii-9,收率为78%。溴代吡啶噁唑啉中异丙基所连接的噁唑啉上碳的立体构型为r、s或消旋。
[0111]
实施例9
[0112]
光敏剂ii-10的合成
[0113][0114]
将ii-1(0.1g,0.398mmol)分散在装有2ml吡啶的具支试管中,加热至35℃搅拌,将对甲基苯甲酰氯(0.13ml,0.148g,0.955mmol)在3min内逐滴滴加到体系中,滴加完成后升温至90℃回流反应6h,降至室温后于通风橱内滴加新配10%盐酸水溶液,直至ph试纸检测体系ph<3,用新配10%碳酸氢钠水溶液中和过量盐酸至不再有气泡生成,抽滤后用碳酸氢钠水溶液洗涤固体滤渣,收集固体滤渣后使用dmf-甲醇混合溶液重结晶得到析出固体,最后用石油醚-乙酸乙酯混合溶液做展开剂(石油醚∶乙酸乙酯=20∶1)进行柱层析得到75mg目标产物ii-10,产率为49%。
[0115]
实施例10
[0116]
光敏剂ii-11和ii-12的合成
[0117][0118]
将联萘酚硼酸酯(2.51g,4.0mmol,1.0eq)与ii-1(2.11g,8.4mmol,2.1eq)加入250ml双口烧瓶中,随后再将甲苯(80ml,0.05m)加入双口烧瓶中,待固体完全溶解后,加入无水乙酸铜(1.82g,10.0mmol,2.5eq),碳酸铯(1.30g,4.0mmol,1.0eq)和吡啶(960μl,12.0mmol,3.0eq),接上氧气球,将反应体系加热至120℃,tlc检测反应,反应24小时。反应完成后,将反应体系冷却至室温,向体系中滴加饱和nh4cl溶液淬灭反应,加入适量水析出固体,用乙酸乙酯萃取三次,合并有机相,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压浓缩,硅胶柱层析分离,乙酸乙酯∶石油醚=1∶30过柱,柱层析纯化后得到1.33g黄色固体产物ii-11,产率55%。所用联萘酚硼酸酯的立体构型为r、s或消旋。
[0119]
将式ii-11(1.25g,2.0mmol,1.0eq)加入100ml单口烧瓶中,随后再将1,4-二氧六环(40ml,0.05m)加入单口烧瓶中,待固体完全溶解后,再加入6m hcl(1.33ml,8.0mmol,4.0eq),将反应体系加热至60℃反应14小时(tlc检测)。反应完成后,将反应体系冷却至室温,向体系中滴加饱和nahco3溶液淬灭反应,加入适量水析出固体,用乙酸乙酯萃取三次,合并有机相,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压浓缩,硅胶柱层析分离,乙酸乙酯∶石油醚=1∶20过柱,柱层析纯化后得到0.86g橙黄色固体产物ii-12,产率80%。
[0120]
实施例11
[0121]
光敏剂ii-13的合成
[0122][0123]
将ii-2(0.54g,1.0mmol,1.0eq)和吡啶(20ml,0.05m)加入100ml双口烧瓶中,待固体完全溶解后,在氩气球的保护下,将反应体系加热至120℃,反应3小时,再缓慢加入三氯氧磷(373μl,4.0mmol,4.0eq),120℃反应12小时,再将反应体系降温至103℃,向体系中滴加蒸馏水(1.8ml,100.0mmol,100.0eq),反应3小时,随后将反应体系降温至室温,加入3m hcl调节至溶液的ph=1,用二氯甲烷萃取三次,合并有机相,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压浓缩,硅胶柱层析分离,甲醇∶乙酸乙酯=1∶30过柱,柱层析纯化后得到0.37g黄色固体产物ii-13,产率62%。
[0124]
实施例12
[0125]
光敏剂iii-1的合成
[0126][0127]
50ml单口烧瓶中,将2,3-二氯喹喔啉(0.3g,1.5mmol)和邻苯二胺(0.324g,3mmol)溶于乙二醇(30ml),反应体系在150℃下加热5h,tlc监测反应。反应完成后,向体系中加水(20ml)淬灭反应,抽滤出固体,并用水(50ml)洗涤三次,真空干燥,得到黄色固体产物iii-1(0.26g,产率74%)。
[0128]
实施例13
[0129]
光敏剂iii-9的合成
[0130][0131]
25ml单口烧瓶中加入iii-1(0.05g,0.21mmol),α-萘硼酸(0.081g,0.47mmol),无水乙酸铜(0.1g,0.5mmol),三乙胺(0.065ml,0.47mmol)和乙腈(8ml),将反应体系加热至90℃搅拌,回流过夜,tlc检测反应。反应完成后,降至室温,向体系中滴加饱和nahco3溶液(10ml)淬灭反应,用乙酸乙酯(20ml)萃取三次,有机相合并,无水na2so4干燥,减压浓缩,硅胶柱层析分离,淋洗剂石油醚∶乙酸乙酯=25∶1,得到黄色固体产物iii-9(29mg,产率15%)。
[0132]
实施例14
[0133]
光敏剂iii-10的合成
[0134][0135]
在50ml圆底烧瓶中加入原料iii-1(0.47g,2.13mmol,1.0eq),2-碘萘(2.17g,8.54mmol,4.0eq),铜粉(0.28g,4.27mmol,2.0eq),k2co3(0.60g,4.27mmol,2.0eq),dmf(20ml),抽换氩气三次,在150℃下搅拌,tlc检测。反应结束后,冷却至室温,抽滤,用乙酸乙酯洗涤,合并有机相,加入水(50ml)。用乙酸乙酯(20ml x 3)萃取。合并的有机相用饱和
nacl水溶液(20ml x 2)洗涤,无水硫酸钠干燥,旋干后柱色谱(石油醚∶乙酸乙酯=20∶1)分离。得黄色固体产物iii-10(0.28g;产率20%)。
[0136]
实施例15
[0137]
光敏剂iii-2的合成
[0138][0139]
50ml单口烧瓶中加入2,3-二氯喹喔啉(0.2g,1mmol),n-苯基邻苯二胺(0.368g,2mmol)和乙二醇(20ml),反应体系加热到150℃搅拌,回流5h,tlc监测反应。反应完成后,向反应体系中加入水(20ml)淬灭反应,抽滤出固体,并用水(50ml)洗涤三次,真空干燥,得到绿色固体产物iii-2(0.24g,产率78%)。
[0140]
实施例16
[0141]
光敏剂iii-4的合成
[0142][0143]
在100ml圆底烧瓶中加入n-对三氟甲基苯基邻苯二胺(2.58g,10.05mmol,1.0eq),2,3-二氯喹喔啉(1.02g,5.02mmol,0.5eq),叔丁醇钠(1.47g,15.06mmol,1.5eq),dmf(30ml),抽换氮气三次,在150℃下回流搅拌,tlc检测。反应结束后,加入水(100ml),用浓盐酸调ph=2,加热至100℃搅拌1h,冷却后抽滤,用无水乙醇洗涤,真空干燥,柱色谱(石油醚∶乙酸乙酯=20∶1)分离。得黄色固体产物iii-4(1.15g,产率60%)。
[0144]
实施例17
[0145]
光敏剂iii-11的合成
[0146][0147]
在50ml圆底烧瓶中加入iii-2(0.99g,3.22mmol,1.0eq.),对甲氧基碘苯(1.54g,3.03mmol,4.0eq.),铜粉(0.71g,6.44mmol,2.0eq.),k2co3(0.93g,6.44mmol,2.0eq.),dmf(40ml),抽换氩气三次,在150℃下搅拌,tlc检测。反应结束后,冷却至室温,抽滤,用乙酸乙酯洗涤,合并有机相,加入水(100ml)。用乙酸乙酯(50ml x 3)萃取。合并的有机相用饱和
nacl水溶液(20ml x 2)洗涤,无水硫酸钠干燥,旋干后柱色谱(石油醚∶乙酸乙酯=20∶1)分离。得黄色固体0.67g,产率51%。
[0148]
实施例18
[0149]
光敏剂iii-24的合成
[0150][0151]
在50ml圆底烧瓶中加入2,3-二氯-8-甲氧基碳基喹喔啉(0.31g,1.2mmol,1.2eq.),1,2-二苯胺基苯(0.27g,1.0mmol,1.0eq.),cs2co3(0.77g,2.5mmol,2.5eq.),dmf(40ml),抽换氩气三次,在120℃下搅拌,tlc检测。反应结束后,冷却至室温,抽滤,用乙酸乙酯洗涤,合并有机相,加入水(100ml)。用乙酸乙酯(50ml x 3)萃取。合并的有机相用饱和nacl水溶液(20ml x 2)洗涤,无水硫酸钠干燥,旋干后柱色谱(石油醚∶乙酸乙酯=20∶1)分离。得固体0.29g,产率65%。
[0152]
实施例19
[0153]
光敏剂v-1的合成
[0154][0155]
50ml单口烧瓶中加入吲哚满二酮(0.5g,3.4mmol),邻苯二胺(0.41g,3.8mmol)和17ml无水乙醇,体系避光,69℃加热回流过夜,tlc检测反应。反应结束后,冷却至室温,抽滤,用石油醚(20ml)洗涤三次,得到浅黄色固体产物v-1(0.54g,产率73%)。反应用乙酸代替乙醇做溶剂,120℃下回流反应4小时,也可得到0.62g产物,收率83%。
[0156]
实施例20
[0157]
光敏剂v-5的合成
[0158][0159]
100ml双口瓶中加入v-1(4mmol,1.0eq),对氰基苯硼酸(6mmol,1.5eq),dmf(22.5ml)和乙腈(22.5ml)。然后加入无水cu(oac)2(6mmol,1.5equiv),cs2co3(4mmol,1.0eq)和吡啶(12mmol,3.0eq)。混合物在110℃和氧气氛围中搅拌反应24h。反应混合物冷却至室温并加入饱和nh4cl溶液。加入适量水后,用乙酸乙酯萃取三次。合并的有机层用饱和食盐水洗,无水na2so4干燥,过滤,减压浓缩,柱层析分离(石油醚∶乙酸乙酯=20∶1)得0.92g产物,收率72%。
[0160]
实施例21
[0161]
光敏剂v-2的合成
[0162][0163]
25ml单口烧瓶中,加入化合物v-1(0.1g,0.46mmol),苯甲酰氯(0.089ml,0.77mmol),三乙胺(0.1ml)和超干燥的n,n-二甲基甲酰胺(4ml),反应体系加热到120℃搅拌5h,tlc监测反应。反应完成后,加水淬灭,用乙酸乙酯(20ml)萃取三次,有机相合并,无水na2so4干燥,减压浓缩,硅胶柱层析分离,洗脱剂石油醚∶乙酸乙酯=9∶1,得到浅绿色固体产物v-2(0.049g,产率33%)。
[0164]
实施例22
[0165]
光敏剂催化苯基环丙胺与苯基乙烯基砜的[3 2]环加成反应
[0166][0167]
将苯基环丙胺(0.1801g,1.35mmol,1.5eq)和苯基乙烯基砜(0.1529g,0.90mmol,1.0eq)加入50ml光反应管中,随后再向光反应管中加入无水甲苯6ml,待固体完全溶解后,再加入光敏剂ii-5(3.0mg,0.0009mmol,o.1%eq),将18w波长为420nm的蓝光灯作为可见光光源,置于离光反应管5cm处,室温反应,tlc检测反应,反应1小时。反应完成后,将溶剂减压浓缩,硅胶柱层析分离,乙酸乙酯∶石油醚=1∶10过柱,柱层析纯化后得到棕色油状液体,产率92%,dr值>19∶1。核磁:1h nmr(400mhz,cdcl3)δ7.87(s,1h),7.67-7.56(m,1h),7.49(t,j=7.7hz,2h),7.12-7.04(m,2h),6.68(dd,j=8.0,6.7hz,1h),6.49-6.43(m,2h),4.23(dt.j=7.4,4.0hz,1h),3.50-3.40(m,1h),2.24(dq,j=12.9,7.8hz,1h),2.11(dtd,j=13.8,7.9,5.9hz,1h),2.03-1.93(m,1h),1.87(ddd,j=15.0,7.4,4.2hz,1h),1.79(dt,j=12.8,7.9hz,1h),1.70-1.59(m,1h);
13
c nmr(101mhz,cdcl3)δ146.38,138.40,133.84,129.34,129.30,128.59,118.01,113.45,69.55,55.90,33.61,25.74,23.44;hrms-esi(m/z):calcd for c
17h20
no2s[m h]
302.1212,found 302.1215。
[0168]
实施例23
[0169]
光敏剂催化甲基丙烯酸甲酯的自由基聚合反应
[0170][0171]
在50ml光反应仪试管中,ar气保护条件下,将α-溴代苯乙酸乙酯(0.0228g,
0.094mmol,1%eq),α-甲基丙烯酸甲酯(0.943g,9.4mmol,1.0eq)和化合物光敏剂i-4(0.0033g,0.0094mmol,0.1%eq)溶于n,n-二甲基苯胺(1ml)中,放置于光反应仪中,在5w波长为395nm光的照射下,搅拌8h。而后向体系中加入50ml甲醇室温下搅拌1h,抽滤出固体,甲醇(50ml)洗涤三次,真空干燥,得到产物a(0.75g,单体转化率79.7%)。然后用凝胶色谱仪测得产物的分子量(mw)为28094和分子量分布为1.77,聚合物a的溶胶凝胶色谱如图5所示。
[0172]
实施例24
[0173]
光敏剂iii-3催化甲基丙烯酸甲酯的自由基聚合反应
[0174][0175]
在25ml试管中加入α-甲基丙烯酸甲酯(1.0ml,9.4mmol,1.0eq),光敏剂iii-3(0.0094mmol,0.001eq),dmso(1.0ml),ipr2net(12.1mg,0.094mmol,0.01eq),抽换氩气三次,在405nm leds灯照射下搅拌反应。8h后加入50ml甲醇,抽滤,真空干燥,得白色固体产物,称重得产物801mg,转化率100%。凝胶色谱测得数均分子量mn为28.90kda,分子量分布系数mw/mn为1.64。
[0176]
实施例25
[0177]
光敏剂iii-3催化甲基丙烯酸甲酯的自由基聚合反应
[0178][0179]
在25ml试管中加入α-甲基丙烯酸甲酯(1.0ml,9.4mmol,1.0eq),光敏剂iii-3(0.0094mmol,0.001eq),三乙醇胺(12.1mg,0.094mmol,0.01eq),抽换氩气三次,用405nm leds灯照射下搅拌反应。8h后加入50ml甲醇,抽滤,真空干燥,得白色固体产物,称重得产物952mg,转化率84%。凝胶色谱测得数均分子量mn为404.86kda,分子量分布系数mw/mn为1.38。以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
[0180]
现将根据实施例1~21的制备方法而采用不同的原料制备的该类衍生物i-1~ix-1列入表1,化合物结构确定所用的核磁共振数据由bruker avance 400mhz超导核磁共振仪或bruker avance 600mhz超导核磁共振仪测定,tms作为内标;质谱数据由傅立叶变换高分辨质谱仪(varian 7.0t ftms)测定,熔点是在yanaco-241仪器上测得。
[0181]
表1目标化合物子通式i-x的结构、核磁氢谱、碳谱、氟谱、高分辨质谱数据、性质和熔点。
[0182]
[0183]
综上所述由喹喔啉衍生的四环或多环骨架为核心骨架,在这些骨架上引入取代基,制备了一类在近紫外和可见光区域稳定和有强吸收的有机光敏剂,并且发现该类光敏剂能够高效地催化有机化学反应和聚合反应;这些结果将对进一步探索新型有机化学反应和聚合反应具有重要的意义,将对开发聚合反应的应用具有重要的价值。
[0184]
虽然以上描述了本发明的具体实施方式,本发明的保护范围是由所附权利要求书限定的。本领域的技术人员在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改,但这些变更和修改均落入本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。