1.本发明属于有机电致发光领域,具体涉及一种组合物、制剂、有机电致发光器件及显示或照明装置,其中客体为一种基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物磷光材料。
背景技术:
2.有机发光二极管(organic light-emitting diode,oled)是新一代的全彩显示和照明技术。相比于液晶显示响应速度慢、可视角小、需要背光源、能耗高等缺点,oled作为一种自主发光器件无需背光源,节能;且其驱动电压低、响应速度快、分辨率和对比度高、视角广、低温性能出众;oled的器件可以做的更薄,并且可以做成柔性结构。此外,还具有生产成本低、生产工艺简单、可进行大面积生产等优点。因此,oled在高端电子产品、航空航天方面有着广泛而巨大的应用前景;随着投资的逐步加大、研发的进一步深入、及生产设备的升级改造,oleds在未来有着非常广泛的应用场景和发展前景。
3.oled发展的核心是发光材料的设计和开发。早期oled器件中其发光材料主要为有机小分子荧光材料。然而自旋统计量子学表明,在电致发光的情况下,产生的单线态激子和三线态激子(exciton)分别为25%和75%,由于传统荧光材料只能利用处于单线态的激子,因此其最大理论内部量子效率仅为25%,其余75%的三重态激子通过非辐射跃迁损失。美国普林斯顿大学的forrest教授和南加州大学的thompson教授于1998年发现了室温下重金属有机配合物分子的磷光电致发光现象。由于重金属原子的强自旋轨道耦合作用,可以使激子更容易由单线态向三线态发生系间蹿越(isc),从而使得oled器件可以充分利用电激发所产生所有单线态和三线态激子,使发光材料的理论内部量子效率可达到100%(nature,1998,395,151)。
4.目前应用的oled器件中发光层几乎全部使用主客体发光体系机制,即在主题材料中掺杂客体发光材料,主题材料的能系一般大于客体发光材料,将能量由主体材料传递给客体材料,使客体材料被激发而发光。常用的有机磷光客体材料一般为重金属原子如铱(iii)、铂(ii),pd(ii)等。目前应用的重金属磷光有机配合物分子环金属铱(iii)配合物分子,且数量有限。地壳中金属铂元素的含量和世界范围内的年产均为金属铱元素的约十倍,用于制备铱(iii)配合物磷光材料的ircl
3.
h2o(1100人民币/克)价格也要远高于制备铂(ii)配合物磷光材料的ptcl2(210人民币/克);此外,制备铱(iii)配合物磷光材料时涉及含铱(iii)二聚体、铱(iii)中间体配体交换、mer-铱(iii)配合物的合成和mer-到fac-铱(iii)配合物异构体转换四步反应,使总收率大为降低,大大降低了原料ircl
3.
h2o的利用率,提高了铱(iii)配合物磷光材料的制备成本。相比之下,铂(ii)配合物磷光材料的制备只有最后一步配体的金属化设计铂盐的反应,铂元素利用率高,可进一步降低铂(ii)配合物磷光材料的制备成本。综上所述,铂(ii)配合物磷光材料的制备成本要远低于铱(iii)配合物磷光材料。然而目前铂、钯配合物材料和器件的开发仍存在一些技术难点,如何提高器件效率及寿命是比较重要的研究问题。因此亟需开发新型磷光金属铂(ii)配合物。
5.目前有机oled组件中的发光层几乎全部使用主客体发光体系机构,即在主体材料中掺杂客体发光材料,一般来说,有机主体材料的能系要比客体材料大,即能量由主体传递给客体,使客体材料被激发而发光。常用的磷光有机材料cbp(4,4
′‑
bis(9-carbazolyl)-biphenyl)具有高效和高三线态能级,当其作为有机材料时,三线态能量能够有效地从发光有机材料转移到客体磷光发光材料。但是由于cbp的空穴易传输而电子难流动的特性,使得发光层的电荷不平衡,结果降低了器件的效率。
6.本发明发现特定主体材料和客体磷光材料的组合可提高有机电致发光器件的外量子效率、降低元器件的操作电压。
技术实现要素:
7.本发明的目的是提供一种或多种应用于有机电致发光器件发光层的客体磷光材料和主体材料及其组合以及包含该组合的有机电致发光器件。
8.本发明提供了一种金属铂(ii)或钯(ii)配合物磷光材料,其结构如式(i)所示:
[0009][0010]
在式(i)中,m为pt或pd;y1、y2、y3、y4、y5、y6、y7、y8、y9、y
10
、y
11
、y
12
、y
13
、y
14
、y
15
、y
16
、y
17
和y
18
各自独立地为n或ch;r1、r2、r3、r4、r5和r6的取代方式各自独立地表示为单取代、双取代、三取代或者无取代;r1、r2、r3、r4、r5和r6各自独立地表示为氢、氘、烷基、卤代烷基、环烷基、烷氧基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的芳氧基、卤素、环烯基、取代或未取代的杂环基、烯基、炔基、羟基、巯基、硝基、氰基、取代或未取代的氨基、单或二烷基氨基、单或二芳基氨基、酯基、腈基、异腈基、烷氧基羰基、酰氨基、烷氧基羰基氨基、芳氧基羰基氨基、磺酰基氨基、氨磺酰基、氨基甲酰基、烷硫基、亚磺酰基、脲基、磷酰胺基、亚胺基、磺基、羧基、肼基、取代或未取代的芳基胺基、取代或未取代的杂芳基胺基、烷基硅基、取代或未取代的芳基硅基、取代或未取代的杂芳基硅基、取代或未取代的芳基氧硅基、取代或未取代的杂芳基氧硅基、取代或未取代的芳基酰基、取代或未取代的杂芳基酰基、取代或未取代的氧膦基的任意一种,且两个或者多个邻近的r1、r2、r3、r4、r5和r6可以选择性链接形成稠环。
[0011]
本发明提供了一种或多种由结构式(i)表示的基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物客体磷光材料和由结构式(ii)或式(iii)表示的一种或多种主体材料的组合,结构式(i)和结构式(ii)或式(iii)如下所示:
[0012][0013][0014]
其中:
[0015]
在式(i)中,m为pt或pd;y1、y2、y3、y4、y5、y6、y7、y8、y9、y
10
、y
11
、y
12
、y
13
、y
14
、y
15
、y
16
、y
17
和y
18
各自独立地为n或ch;r1、r2、r3、r4、r5和r6的取代方式各自独立地表示为单取代、双取代、三取代或者无取代;r1、r2、r3、r4、r5和r6各自独立地表示为氢、氘、烷基、卤代烷基、环烷基、烷氧基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的芳氧基、卤素、环烯基、取代或未取代的杂环基、烯基、炔基、羟基、巯基、硝基、氰基、取代或未取代的氨基、单或二烷基氨基、单或二芳基氨基、酯基、腈基、异腈基、烷氧基羰基、酰氨基、烷氧基羰基氨基、芳氧基羰基氨基、磺酰基氨基、氨磺酰基、氨基甲酰基、烷硫基、亚磺酰基、脲基、磷酰胺基、亚胺基、磺基、羧基、肼基、取代或未取代的芳基胺基、取代或未取代的杂芳基胺基、烷基硅基、取代或未取代的芳基硅基、取代或未取代的杂芳基硅基、取代或未取代的芳基氧硅基、取代或未取代的杂芳基氧硅基、取代或未取代的芳基酰基、取代或未取代的杂芳基酰基、取代或未取代的氧膦基的任意一种,且两个或者多个邻近的r1、r2、r3、r4、r5和r6可以选择性链接形成稠环;
[0016]
在式(ii)和(iii)中,x1、x2、x3、x4、x5、x6、x7、x8、x9、x
10
、x
11
、x
12
、x
13
、x
14
、x
15
、x
16
、x
17
、x
18
、x
19
和x
20
各自独立地为n或ch;z1、z2、z3、z4、z5、z6、z7、z8、z9、z
10
、z
11
、z
12
和z
13
各自独立地为n或ch,且至少有2个为n;l1、l2和l3不存在或选自单键、o、s、cr
15r16
、sir
17r18
、nr
19
;a、b、c和d各自独立地选自c6-c30芳基、c2-c30杂芳基;r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
各自独立地表示为单取代、双取代、三取代、四取代或者无取代;且r7、r8、r9、r
10
、r
11
、r
12
、r13
、r
14
、r
15
、r
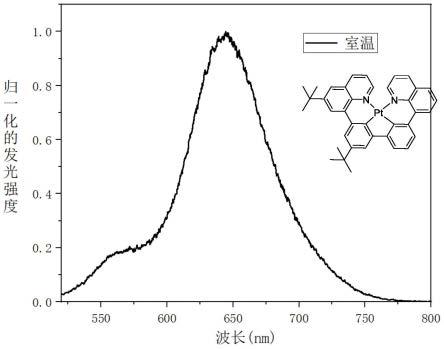
16
、r
17
、r
18
和r
19
各自独立地表示为氢、氘、烷基、卤代烷基、环烷基、烷氧基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的芳氧基、卤素、环烯基、取代或未取代的杂环基、烯基、炔基、羟基、巯基、硝基、氰基、取代或未取代的氨基、单或二烷基氨基、单或二芳基氨基、酯基、腈基、异腈基、烷氧基羰基、酰氨基、烷氧基羰基氨基、芳氧基羰基氨基、磺酰基氨基、氨磺酰基、氨基甲酰基、烷硫基、亚磺酰基、脲基、磷酰胺基、亚胺基、磺基、羧基、肼基、取代或未取代的芳基胺基、取代或未取代的杂芳基胺基、烷基硅基、取代或未取代的芳基硅基、取代或未取代的杂芳基硅基、取代或未取代的芳基氧硅基、取代或未取代的杂芳基氧硅基、取代或未取代的芳基酰基、取代或未取代的杂芳基酰基、取代或未取代的氧膦基的任意一种,且两个或者多个邻近的r1、r2、r3、r4、r5和r6可以选择性链接形成稠环。
[0017]
进一步的,所述的基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物客体磷光材料,所述铂(ii)或钯(ii)配合物具有如下之一的结构:
[0018]
[0019]
[0020]
[0021]
[0022]
[0023]
[0024]
[0025]
[0026]
[0027]
[0028]
[0029][0030]
进一步的,所述的有机主体材料,式(ii)选自(ii)-1至(ii)-24所述的化合物:
[0031]
[0032][0033]
其中,x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
,l1、l2和l3,a和b,r7、r8、r9和r
10
与上述定义相同。
[0034]
进一步的,式中a、b、c和d选自以下结构所述的基团:
[0035][0036]
其中,r
15
、r
16
、r
17
、r
18
和r
19
与上述定义相同。
[0037]
进一步的,本发明所述的主体材料选自下列结构或由以下结构组成的群组:
[0038]
[0039]
[0040]
[0041]
[0042]
[0043]
[0044]
[0045]
[0046]
[0047]
[0048]
[0049]
[0050]
[0051]
[0052]
[0053]
[0054]
[0055]
[0056]
[0057]
[0058]
[0059]
[0060]
[0061]
[0062]
[0063]
[0064]
[0065]
[0066]
[0067]
[0068]
[0069]
[0070]
[0071]
[0072]
[0073]
[0074]
[0075]
[0076]
[0077]
[0078]
[0079]
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095]
[0096]
[0097][0098]
优选的,本发明所述的主体材料选自下列结构或由以下结构组成的群组:
[0099]
[0100]
[0101]
[0102][0103]
本发明还涉及一种有机电致发光器件,包括阴极层、阳极层和有机层,该有机层包括空穴注入层、空穴传输层、发光层、空穴阻挡层、电子注入层、电子传输层中至少一层,其中该器件的发光层中含有所述的一种或多种由结构式i表示的客体化合物和由结构式(ii)或结构式(iii)表示的一种或多种主体化合物。
[0104]
本发明所述的有机电致发光器件发光层组合物中客体材料的质量百分数在0.1%-50%。
[0105]
本发明所述的结构式(ii)或结构式(iii)中选取两个化合物的组合作为主体材料使用时,它们的体积比例为1:99至99:1。
[0106]
本发明涉及一种组合物包含结构式(i)和结构式(ii)或结构式(iii)的一种或多种与溶剂形成的制剂,所用的溶剂没有特别限制,可以使用本领域技术人员熟知的例如甲苯、二甲苯、均三甲苯、四氢化萘、十氢萘、双环己烷、正丁基苯、仲丁基苯、叔丁基苯等不饱和烃溶剂、四氯化碳、氯仿、二氯甲烷、二氯乙烷、氯丁烷、溴丁烷、氯戊烷、溴戊烷、氯己烷、溴己烷、氯环己烷、溴环己烷等卤化饱和烃溶剂,氯苯、二氯苯、三氯苯等卤化不饱和烃溶剂,四氢呋喃、四氢吡喃等醚溶剂,苯甲酸烷基酯等酯类溶剂。
[0107]
本发明还提供了一种有机电致发光器件,其包括阴极层、阳极层和有机层,所述有机层包括组合物,所述组合物包含一种基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物磷光材料和有机主体材料,其中金属铂(ii)或钯(ii)配合物磷光材料的结构式如式(i)所示;有机主体材料的结构式(ii)或式(iii)所示:
[0108][0109]
其中:
[0110]
在式(i)中,m为pt或pd;y1、y2、y3、y4、y5、y6、y7、y8、y9、y
10
、y
11
、y
12
、y
13
、y
14
、y
15
、y
16
、y
17
和y
18
各自独立地为n或ch;r1、r2、r3、r4、r5和r6的取代方式各自独立地表示为单取代、双取代、三取代或者无取代;r1、r2、r3、r4、r5和r6各自独立地表示为氢、氘、烷基、卤代烷基、环烷基、烷氧基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的芳氧基、卤素、环烯基、取代或未取代的杂环基、烯基、炔基、羟基、巯基、硝基、氰基、取代或未取代的氨基、单或二烷基氨基、单或二芳基氨基、酯基、腈基、异腈基、烷氧基羰基、酰氨基、烷氧基羰基氨基、芳氧基羰基氨基、磺酰基氨基、氨磺酰基、氨基甲酰基、烷硫基、亚磺酰基、脲基、磷酰胺基、亚胺基、磺基、羧基、肼基、取代或未取代的芳基胺基、取代或未取代的杂芳基胺基、烷基硅基、取代或未取代的芳基硅基、取代或未取代的杂芳基硅基、取代或未取代的芳基氧硅基、取代或未取代的杂芳基氧硅基、取代或未取代的芳基酰基、取代或未取代的杂芳基酰基、取代或未取代的氧膦基的任意一种,且两个或者多个邻近的r1、r2、r3、r4、r5和r6可以选择性链接形成稠环;
[0111]
在式(ii)和(iii)中,x1、x2、x3、x4、x35、x6、x7、x8、x9、x
10
、x
11
、x
12
、x
13
、x
14
、x
15
、x
16
、x
17
、x
18
、x
19
和x
20
各自独立地为n或ch;z1、z2、z3、z4、z5、z6、z7、z8、z9、z
10
、z
11
、z
12
和z
13
各自独立地为n或ch,且至少有2个为n;l1、l2和l3不存在或选自单键、o、s、cr
15r16
、sir
17r18
、nr
19
;a、b、c和d各自独立地选自c6-c30芳基、c2-c30杂芳基;r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
各自独立地表示为单取代、双取代、三取代、四取代或者无取代;且r7、r8、r9、r
10
、r
11
、r12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
和r
19
各自独立地表示为氢、氘、烷基、卤代烷基、环烷基、烷氧基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的芳氧基、卤素、环烯基、取代或未取代的杂环基、烯基、炔基、羟基、巯基、硝基、氰基、取代或未取代的氨基、单或二烷基氨基、单或二芳基氨基、酯基、腈基、异腈基、烷氧基羰基、酰氨基、烷氧基羰基氨基、芳氧基羰基氨基、磺酰基氨基、氨磺酰基、氨基甲酰基、烷硫基、亚磺酰基、脲基、磷酰胺基、亚胺基、磺基、羧基、肼基、取代或未取代的芳基胺基、取代或未取代的杂芳基胺基、烷基硅基、取代或未取代的芳基硅基、取代或未取代的杂芳基硅基、取代或未取代的芳基氧硅基、取代或未取代的杂芳基氧硅基、取代或未取代的芳基酰基、取代或未取代的杂芳基酰基、取代或未取代的氧膦基的任意一种,且两个或者多个邻近的r1、r2、r3、r4、r5和r6可以选择性链接形成稠环。
[0112]
优选的,上述铂(ii)或钯(ii)配合物为上述化合物pt1至化合物pt352以及化合物pd1至化合物pd32中任一者。
[0113]
优选的,上述式(ii)选自(ii)-1至(ii)-24所述的化合物:
[0114]
[0115][0116]
其中,x1、x2、x3、x4、x5、x6、x7、x8、x9和x
10
,l1、l2和l3,a和b,r7、r8、r9和r
10
与权利要求1相同。
[0117]
优选的,上述式中a、b、c和d选自以下结构所述的基团:
[0118][0119]
其中,r15、r16、r17、r18和r19与权利要求1相同。
[0120]
优选的,上述式(ii)或式(iii)所述的有机主体材料选自上述化合物0-1至化合物33-80。
[0121]
本发明还提供了一种显示或照明装置,所述的显示或照明装置含有上述有机电致发光器件。
[0122]
本发明还提供了基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物磷光材料在制作有机发光器件中的应用。
[0123]
本发明对所述有机电致器件的制备方法没有特殊的限制,除了使用一种或多种由结构式i表示的客体化合物和由结构式(ii)或结构式(iii)表示的一种或多种主体化合物之外,采用本领域技术人员熟知的发光器件的制备方法和材料制备得到即可。
[0124]
本发明所述的有机电致器件是有机光伏器件、有机发光器件(oled)、有机太阳电池(osc)、电子纸(e-paper)、有机感光体(opc)、有机薄膜晶体管(otft)及有机内存器件(organic memory element)、照明和显示装置中任意一种。
[0125]
在本发明中,有机光电器件是可以利用喷溅涂覆法、电子束蒸发、真空蒸镀等方法在基板上蒸镀金属或具有导电性的氧化物以及它们的合金形成阳极;在制备得到的阳极表面按顺序蒸镀空穴注入层、空穴传输层、发光层、空气阻挡层和电子传输层,以后再蒸镀阴极的方法制备。以上方法以外基板上按阴极、有机物层、阳极顺序蒸镀制作有机电致器件。所述有机物层是也可以包括空穴注入层、空穴传输层、发光层、空穴阻挡层及电子传输层等多层结构。在本发明中有机物层是采用高分子材料按溶剂工程(旋转涂膜(spin-coating)、薄带成型(tape-casting)、刮片法(doctor-blading)、丝网印刷(screen-printing)、喷墨印刷或热成像(thermal-imaging)等)替代蒸镀方法制备,可以减少器件层数。
[0126]
根据本发明的有机电致器件所使用的材料可以分为顶发射、低发射或双面发射。根据本发明实施方案的有机电致器件的化合物可以有机发光器件类似的原理适用于有机太阳能电池、照明的oled、柔性oled、有机感光体,有机薄膜晶体管等电致器件方面。
[0127]
本发明的有益效果:基于两个二齿配体的客体铂(ii)或钯(ii)磷光材料分子容易振动、扭曲从而导致非辐射衰减,使得磷光效率较低。相较于二齿铂(ii)或钯(ii)配合物,基于联苯基喹啉配位的四齿环金属铂(ii)或钯(ii)配合物客体磷光材料的刚性结构可以有效抑制因分子振动引起的非辐射衰减,不但可以实现高效率发光,并且具有良好的热稳定性;此外,本发明的涉及的客体材料和主体材料均具有很好的热稳定性,主体材料组合物能够平衡空穴和电子的输运,使主体和客体间的能量传输更加高效,其具体表现为用本发明的组合物作为发光层制作的有机电致发光器件其外量子效率的提升,同时起亮电压降低。
附图说明
[0128]
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图,其中:
[0129]
图1为具体实施方式中的铂配合物pt1在二氯甲烷溶液中的室温发射光谱;
[0130]
图2为具体实施方式中的铂配合物pt2在二氯甲烷溶液中的室温发射光谱;
[0131]
图3为具体实施方式中的铂配合物pt3在二氯甲烷溶液中的室温发射光谱;
[0132]
图4为具体实施方式中的铂配合物pt4在二氯甲烷溶液中的室温发射光谱;
[0133]
图5为具体实施方式中的铂配合物pt5在二氯甲烷溶液中的室温发射光谱;
[0134]
图6为具体实施方式中的铂配合物pt6在二氯甲烷溶液中的室温发射光谱;
[0135]
图7为具体实施方式中的铂配合物pt7在二氯甲烷溶液中的室温发射光谱;
[0136]
图8为通过密度泛函理论(dft)计算得到的pt9、pt10、pd1和pt12的homo及lumo轨道分布及其能级比较;
[0137]
图9为通过密度泛函理论(dft)计算得到的pt13、pd2、pt15和pt16的homo及lumo轨道分布及其能级比较;
[0138]
图10为通过密度泛函理论(dft)计算得到的pt17、pt18、pt19和pt20的homo及lumo轨道分布及其能级比较;
[0139]
图11为通过密度泛函理论(dft)计算得到的pt21、pt22、pt23和pt24的homo及lumo轨道分布及其能级比较;
[0140]
图12为通过密度泛函理论(dft)计算得到的pt25、pt26、pt27和pt28的homo及lumo轨道分布及其能级比较;
[0141]
图13为本发明有机电致发光二极管器件结构层图,其中,110代表基板,120表示阳极,130表示空穴注入层,140表示空穴传输层,150表示发光层,160表示空穴阻挡层,170表示电子传输层,180表示电子注入层,190表示阴极。
具体实施方式
[0142]
需要指出的是,上面的一般说明和下面的详细说明都只是示范性和解释性的,不具有限定性。
[0143]
可通过参考以下具体实施方式和其中包含的实施例而更容易地理解本公开。
[0144]
在披露和描述本发明的化合物、器件和/或方法之前,应该理解他们不限于具体的合成方法(否则会另外指出),或者具体的试剂(否则会另外指出),因为这当然是能够变化的。也应该理解本发明中使用的术语仅是用于描述具体方面的目的,而不意图是限制。虽然与本发明描述的那些类似或者等价的任何方法和材料都可用于该实践或者试验,下面描述示例性的方法和材料。
[0145]
在本发明的一种优选实施方式中,本发明的oled器件中含有空穴传输层,空穴传输材料可以优选自已知或未知的材料,特别优选地选自以下结构,但并不代表本发明限于以下结构:
[0146][0147]
在本发明的一种优选实施方式中,本发明的oled器件中含有的空穴传输层,其包含一种或多种p型掺杂剂。本发明优选的p型掺杂剂为以下结构,但并不代表本发明限于以下结构:
[0148][0149]
本发明的一种优选实施方式中,所述的电子传输层可以选自化合物et-1至et-13的至少一种,但并不代表本发明限于以下结构:
[0150][0151]
本发明所使用的术语“可选的”或“可选地”意味着随后描述的事件或情况可以或不发生,并且该描述包括所述事件或情况发生的情况及它不发生的情况。
[0152]
披露了可用于制备本发明所述的组合物的组分,以及要用于本发明中披露的方法中的组合物本身。这些和其它物质披露于本发明中,并且应该理解当披露了这些物质的组合、子集、相互作用、组、等,而不能具体地披露这些化合物的每个各种单独和总的组合和置换的具体参参考时,每个都具体地在本发明中预期和描述了。例如,如果披露和讨论了具体的化合物,和讨论了能够对许多包含该化合物的分子进行的许多改性,那么具体地预期该化合物的各种和每种组合和置换,并且可能进行所述改性,否则会另外具体地相反地指出。因此,如果披露了一类分子a、b和c以及一类分子d、e和f,和组合分子a-d的实例,那么即使每个没有单独地记载,也考虑披露了每个单独地和总地预期的含义组合,a-e、a-f、b-d、b-e、b-f、c-d、c-e和c-f。同样地,也披露了任何子集或者这些的组合。因此,例如,应该考虑披露了小组a-e、b-f和c-e。这些观念适用于本发明的所有方面,包括但不限于制备和使用该组合物的方法的步骤中。因此,如果存在各种另外的步骤能够进行,应该理解,这些另外的步骤各自能够以该方法的具体实施方式或者实施方式的组合进行。
[0153]
本发明使用的连接原子能够连接两个基团,例如,n和c基团。该连接原子能够任选地(如果价键允许)具有其他附接的化学部分。例如,在一方面,氧不会具有任何其它的化学基团附接,因为一旦键合至两个原子(例如,n或c)价键已经被满足。相反,当碳是连接原子时,两个另外的化学部分能够附接至该碳原子。合适的化学部分包括但不限于氢、羟基、烷基、烷氧基、=o、卤素、硝基、胺、酰胺、巯基、芳基、杂芳基、环烷基和杂环基。
[0154]
本发明使用的术语“环状结构”或类似术语是指任何环状化学结构,其包括但不限于芳基、杂芳基、环烷基、环烯基、杂环基、卡宾和n-杂环卡宾。
[0155]
本发明使用的术语“取代的”预期包含有机化合物的所有允许的取代基。在宽的方面,允许的取代基包括有机化合物的非环和环状、支化的和非支化的、碳环的和杂环的,和芳族和非芳族取代基。说明性的取代基包括,例如,以下描述的那些。对于合适的有机化合
物来说,允许的取代基可为一个或多个,相同或者不同。对于本发明的目的而言,杂原子(例如氮)能够具有氢取代基和/或本发明所述的有机化合物的任何允许的取代基,其满足该杂原子的价键。本公开不意图以任何方式用有机化合物允许的取代基来进行任何限制。同样,术语“取代”或“取代有”包含隐含条件是这种取代符合取代的原子和该取代基的允许的价键,和该取代导致稳定的化合物(例如,不会自发地进行转化(例如通过重排、环化、消去等)的化合物)。也预期,在某些方面,除非明确地相反地指出,否则,单独的取代基能够进一步任选地是取代的(即,进一步是取代或未取代的)。
[0156]
在定义各种术语时,“r
1”、“r
2”、“r
3”和“r
4”在本发明中用作总的符号来表示各种具体的取代基。这些符号能够是任何取代基,不限于本发明披露的那些,和当将他们在一种情况下限定为某些取代基时,他们在其它情况下可限定为一些其它的取代基。
[0157]
本发明使用的术语“烷基”是支化的或未支化的1至24个碳原子的饱和的烃基,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、仲戊基、新戊基、己基、庚基、半基、壬基、癸基、十二烷基、十四烷基、十六烷基、二十烷基、二十四烷基等。该烷基可为环状或非环的。该烷基可为支化或者非支化的。该烷基也可为取代或未取代的。例如,该烷基可取代有一个或多个基团,包括但不限于本发明所述的任选取代的烷基、环烷基、烷氧基、氨基、卤素、羟基、硝基、甲硅烷基、硫-氧代(sulfo-oxo)或巯基。“低级烷基”基团是含有1至6个(例如1至4个)碳原子的烷基。
[0158]
在整个说明书中,“烷基”通常用于同时指代未取代烷基和取代烷基;但是,取代烷基也在本发明中通过确定烷基上的具体的取代基来具体地提及。例如,术语“卤化的烷基”或者“卤代烷基”具体地是指取代有一个或多个卤素(例如,氟、氯、溴或碘的)烷基。术语“烷氧基烷基”具体地是指取代有一个或多个烷氧基的烷基,如下所述。术语“烷基氨基”具体地是指取代有一个或多个氨基的烷基,如下所述,等。当在一种情况中使用“烷基”而在另一情况中使用具体的术语如“烷基醇”时,不意味着暗示该术语“烷基”不同时指代具体的术语如“烷基醇”等。
[0159]
本实践也用于本发明所述的其它组。也即,当术语如“环烷基”同时指代未取代的和取代的环烷基部分时,该取代的部分可另外具体地在本发明中确定;例如,具体取代的环烷基可称为例如“烷基环烷基”。类似的,取代的烷氧基可具体地称为例如“卤化的烷氧基”,具体的取代烯基可为例如“烯醇”等。同样地,使用总的术语如“环烷基”和具体的术语如“烷基环烷基”的实践不意图暗示该总术语不同时包含该具体术语。
[0160]
本发明使用的术语“环烷基”是由至少三个碳原子构成的非芳族基于碳的环。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、环壬基等。术语“杂环烷基”是一类如上定义的环烷基,并且包含在术语“环烷基”的含义中,其中至少一个环碳原子被杂原子例如但不限于氮、氧、硫或磷取代。该环烷基和杂环烷基可为取代或未取代的。该环烷基和杂环烷基可取代有一个或多个基团,包括但不限于如本发明所述的烷基、环烷基、烷氧基、氨基、卤素、羟基、硝基、甲硅烷基、硫-氧代(sulfo-oxo)或巯基。
[0161]
术语“聚烯烃基团”其用在本发明中用来指代含有两个或更多的ch2基团且连接着其他相同部分。“聚烯烃基团”可以表示为-(ch2)
a-,其中“a”是整数2至500。
[0162]
术语“烷氧基”和“烷氧基基团”,其用在本发明中用来指代通过醚连接基键合的烷基或环烷基;也即,“烷氧基”可定义为-or1,其中r1是如上定义的烷基或环烷基。“烷氧基”也
包含刚刚描述的烷氧基的聚合物;也即,烷氧基可为聚醚如-or
1-or2或者-or
1-(or2)
a-or3,其中“a”是整数1至200,而r1、r2和r3各自独立地为烷基、环烷基或其组合。
[0163]
本发明使用的术语“烯基”是2至30个碳原子的烃基,其结构式含有至少一个碳-碳双键。不对称结构例如(r1r2)c=c(r3r4)意图包含e和z异构体。这可推定在本发明的结构式中,其中存在不对称烯烃,或者它可通过键符号c=c明确表示。该烯基可取代有一个或多个基团,包括但不限于本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基、杂芳基、醛基、氨基、羧基、酯基、卤素、羟基、羰基、叠氮基、硝基、甲硅烷基、硫基-氧代(sulfo-oxo)或巯基。
[0164]
本发明使用的术语“环烯基”是非芳族的基于碳的环,其由至少3个碳原子构成,并且含有至少一个碳碳双键,即,c=c。环烯基的实例包括但不限于环丙烯基,环丁烯基,环戊烯基,环戊二烯基,环己烯基,环己二烯基,降冰片烯基(norbornenyl),等。术语“杂环烯基”是一类如上定义的环烯基,并且包含在术语“环烯基”的含义中,其中该环的至少一个碳原子用杂原子例如但不限于氮、氧、硫、或磷取代。环烯基和杂环烯基可为取代或未取代的。该环烯基和杂环烯基可取代有一个或多个基团,包括但不限于本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基、杂芳基、醛基、氨基、羧基、酯基、卤素、羟基、羰基、叠氮基、硝基、甲硅烷基、硫基-氧代(sulfo-oxo)或巯基。
[0165]
本发明使用的术语“炔基”是具有2至30个碳原子的烃基,其具有含有至少一个碳-碳三键的结构式。炔基可为未取代的或者取代有一个或者多个基团,所述基团包括但不限于本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基、杂芳基、醛基、氨基、羧基、酯基、卤素、羟基、羰基、叠氮基、硝基、甲硅烷基、硫基-氧代(sulfo-oxo)或巯基。
[0166]
本发明使用的术语“环炔基”是非芳族的基于碳的环,其包含至少七个碳原子并含有至少一个碳-碳三键。环炔基的实例包括但不限于环庚炔基、环辛炔基、环壬炔基等。术语“杂环炔基”是一种类型的如上所定义的环烯基,并且包含在术语“环炔基”的含义内,其中所述环的碳原子中的至少一个被杂原子替代,所述杂原子例如但不限于氮、氧、硫或者磷。环炔基和杂环炔基可为取代或未取代的。环炔基和杂环炔基可取代有一个或者多个基团,所述基团包括但不限于本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基、杂芳基、醛基、氨基、羧基、酯基、卤素、羟基、羰基、叠氮基、硝基、甲硅烷基、硫基-氧代(sulfo-oxo)或巯基。
[0167]
本发明使用的术语“芳基”是含有任何基于碳的芳族基团的基团,所述基于碳的芳族基团包括但不限于苯基、萘基、苯基基、联苯基、苯氧基苯基、蒽基、菲基等。术语“芳基”也包括“杂芳基”,其被定义为含有芳族基团的基团,所述芳族基团具有至少一个引入芳族基团的环内的杂原子。杂原子的实例包括但不限于氮、氧、硫,和磷。同样,术语“非杂芳基”(其也包括在术语“芳基”中)定义了含有芳族基团的基团,所述芳族基团不含杂原子。芳基可为取代或未取代的。芳基可取代有一个或者多个基团,所述基团包括但不限于本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基、杂芳基、醛基、氨基、羧基、酯基、卤素、羟基、羰基、叠氮基、硝基、甲硅烷基、硫基-氧代(sulfo-oxo)或巯基。术语“联芳基(biaryl)”是特定类型的芳基并且包含在“芳基”的定义中。联芳基是指经稠合的环结构结合在一起的两个芳基,如在萘中一样,或者经一个或者多个碳-碳键连接的两个芳基,如在联苯中一样。
[0168]
本发明使用的术语“醛”通过式-c(o)h表示。在整个说明书中,“c(o)”是羰基(即,c=o)的简写形式。
[0169]
本发明使用的术语“胺”或“氨基”通过式-nr1r2表示,其中r1和r2可以独立的从氢、烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或杂芳基中选择。
[0170]
本发明使用的术语“烷基氨基”通过式-nh(-烷基)表示,其中烷基如本发明所述。代表性实例包括但不限于甲基氨基、乙基氨基、丙基氨基、异丙基氨基、丁基氨基、异丁基氨基、(仲丁基)氨基、(叔丁基)氨基、戊基氨基、异戊基氨基、(叔戊基)氨基、己基氨基等。
[0171]
本发明使用的术语“二烷基氨基”通过式-n(烷基)2表示,其中烷基如本发明所述。代表性实例包括但不限于二甲基氨基、二乙基氨基、二丙基氨基、二异丙基氨基、二丁基氨基、二异丁基氨基、二(仲丁基)氨基、二(叔丁基)氨基、二戊基氨基、二异戊基氨基、二(叔戊基)氨基、二己基氨基、n-乙基-n-甲基氨基、n-甲基-n-丙基氨基、n-乙基-n-丙基氨基等。
[0172]
本发明使用的术语“羧酸”通过式-c(o)oh表示。
[0173]
本发明使用的术语“酯”通过式-oc(o)r1或者-c(o)or1表示,其中r1可为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。本发明使用的术语“聚酯”通过式-(r1o(o)c-r
2-c(o)o)
a-或者-(r1o(o)c-r
2-oc(o))
a-表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基,或者杂芳基并且“a”为1至500的整数。术语“聚酯”用于描述通过具有至少两个羧基的化合物与具有至少两个羟基的化合物之间的反应产生的基团。
[0174]
本发明使用的术语“醚”通过式r1or2表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。本发明使用的术语“聚醚”通过式-(r1o-r2o)
a-表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基,或者杂芳基并且“a”为1至500的整数。聚醚基团的实例包括聚氧化乙烯、聚氧化丙烯和聚氧化丁烯。
[0175]
本发明使用的术语“卤素”是指卤素氟、氯、溴和碘。
[0176]
本发明使用的术语“杂环基”是指3至30个碳原子单环的和多环的非芳族环系,并且本发明使用的“杂芳基”是指单环和多环的不多于60个碳原子的芳香族环系:其中环成员中的至少一个不为碳。该术语包括氮杂环丁烷基、二噁烷基、呋喃基、咪唑基、异噻唑基、异噁唑基、吗啉基、噁唑基、包括1,2,3-噁二唑基、1,2,5-噁二唑基和1,3,4-噁二唑基的噁唑基、哌嗪基、哌啶基、吡嗪基、吡唑基、哒嗪基、吡啶基、嘧啶基、吡咯基、吡咯烷基、四氢呋喃基、四氢吡喃基、包括1,2,4,5-四嗪基的四嗪基、包括1,2,3,4-四唑基和1,2,4,5-四唑基的四唑基、包括1,2,3-噻二唑基、1,2,5-噻二唑基和1,3,4-噻二唑基的噻二唑基、噻唑基、噻吩基、包括1,3,5-三嗪基和1,2,4-三嗪基的三嗪基、包括1,2,3-三唑基和1,3,4-三唑基的三唑基等。
[0177]
本发明使用的术语“羟基”通过式-oh表示。
[0178]
本发明使用的术语“酮”通过式r1c(o)r2表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基,或者杂芳基。
[0179]
本发明使用的术语“叠氮基”通过式-n3表示。
[0180]
本发明使用的术语“硝基”通过式-no2表示。
[0181]
本发明使用的术语“腈”通过式-cn表示。
[0182]
本发明使用的术语“甲硅烷基”通过式—sir1r2r3表示,其中r1、r2和r3可独立地为氢或者本发明所述的烷基、环烷基、烷氧基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。
[0183]
本发明使用的术语“硫-氧代基团”通过式-s(o)r1、-s(o)2r1、-os(o)2r1或者-os(o)2or1表示,其中r1可为氢或者本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基,或者杂芳基。在整个说明书中,“s(o)”为s=o的简写形式。本发明使用的术语“磺酰基”是指通过式-s(o)2r1表示的硫-氧代基团,其中r1可为烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。本发明使用的术语“砜”通过式r1s(o)2r2表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。本发明使用的术语“亚砜”通过式r1s(o)r2表示,其中r1和r2可独立地为本发明所述的烷基、环烷基、烯基、环烯基、炔基、环炔基、芳基或者杂芳基。
[0184]
本发明使用的术语“巯基”通过式-sh表示
[0185]
本发明使用的“r
1”、“r
2”、“r
3”、“r
n”(其中n为整数)可独立地具有上面列举的基团中的一个或者多个。例如,如果r1为直链烷基,那么烷基的一个氢原子可任选取代有羟基、烷氧基、烷基、卤素等。取决于选择的基团,第一基团可结合在第二基团内,或者可选择地,第一基团可悬挂即连接至第二基团。例如,对于短语“包含氨基的烷基”,氨基可结合在烷基的主链内。可选择地,氨基可连接至烷基的主链。所选基团的性质将决定是否第一基团嵌入或者连接至第二基团。
[0186]
本发明所述化合物可含有“任选取代的”部分。通常,术语“取代的”(无论在前面是否存在术语“任选”)意味着指出的部分的一个或者多个氢被适合的取代基替代。除非另作说明,否则“任选取代的”基团可在基团的每个可取代位置具有适合的取代基,以及当在任何给出的结构中超过一个位置可取代有超过一个选自指定基团的取代基时,在每个位置的取代基可相同或者不同。本发明设想的取代基组合优选为形成稳定的或者化学上可行的化合物的那些。在某些方面,除非清楚地相反指示,否则还涵盖的是,各个取代基可进一步任选被取代(即,进一步取代或未取代)。
[0187]
本发明使用的术语“稠环”是指相邻的两个取代基可以稠合成六元芳环、杂芳环,例如苯环、吡啶环、吡嗪环、哒嗪环、间二氮杂环等,以及饱和的六元或七元碳环或碳杂环等。
[0188]
化合物的结构可通过下式表示:
[0189][0190]
其被理解为等同于下式:
[0191][0192]
其中n通常为整数。即,rn被理解为表示五个单独的取代基r
a(1)
、r
a(2)
、r
a(3)
、r
a(4)
、r
a(5)
。“单独的取代基”是指每个r取代基可独立地限定。例如,如果在一个情况中r
a(m)
为卤素,那么在这种情况下r
a(n)
不一定是卤素。
[0193]
在本发明公开的和描述的化学结构和部分中数次提及r1、r2、r3、r4、r5、r6等。在说明书中r1、r2、r3、r4、r5、r6等的任何描述分别适用于引用r1、r2、r3、r4、r5、r6等的任何结构或者部分,除非另作说明。
[0194]
本发明使用的术语“稠环”是指相邻的两个取代基可以稠合成六元芳环、杂芳环,例如苯环、吡啶环、吡嗪环、哒嗪环、间二氮杂环等,以及饱和的六元或七元碳环或碳杂环等。
[0195]
由于多种原因,使用有机材料的光电子器件变得越来越迫切。用于制造这种装置的许多材料相对便宜,因此有机光电装置具有无机装置成本优势的潜力。此外,有机材料的固有特性,例如它们的柔性,可以使它们非常适合于诸如在柔性基底上的制造等特殊应用。有机光电子器件的实例包括有机发光器件(oled)、有机光电晶体管、有机光伏电池和有机光电探测器。对于oled,有机材料可能具有优于常规材料的性能优点。例如,有机发光层发光的波长通常可以用适当的掺杂剂调谐。
[0196]
激子从单重激发态衰减到基态以产生即时发光,其是荧光。如果激子从三重激发态衰减到基态以产生发光,这是磷光。由于重金属原子在单线态和三线态激发态之间的强自旋轨道耦合,有效地增强了系间穿越(isc),所以磷光金属配合物(如铂配合物)已经表现出其同时利用单线态和三线态激子的潜力,实现100%内部量子效率。因此,磷光金属配合物是有机发光器件(oled)的发射层中的掺杂剂的良好选择,并且在学术和工业领域中已经获得了极大的关注。在过去十年中,已经取得了许多成果,从而导致了该技术的有利可图的应用,例如,oled已被用于智能手机,电视和数码相机的高级显示器。
[0197]
然而,迄今为止,蓝色电致发光器件仍然是该技术中最具挑战性的领域,蓝色器件的稳定性是其一大问题。已经证明,主体材料的选择对蓝色器件的稳定性非常重要。但是,蓝色发光材料的三重激发态(t1)最低能量非常高,这意味着蓝色器件的主体材料的三重激发态(t1)最低能量应该更高。这导致蓝色设备的主体材料的开发困难加大。
[0198]
本发明的金属配合物可以被定制或调谐到期望具有特定发射或吸收特性的特定应用。可以通过改变围绕金属中心的配体的结构或改变配体上的荧光发光体的结构来调节本发明公开的金属配合物的光学性质。例如,在发射和吸收光谱中,具有给电子取代基的配体的金属配合物或吸电子取代基通常可以表现出不同的光学性质。可以通过修饰荧光发光体和配体上的共轭基团来调节金属配合物的颜色。
[0199]
本发明的配合物的发射可以例如通过改变配体或荧光发光体结构来调节,例如从紫外线到近红外。荧光发光体是有机分子中的一组原子,其可以吸收能量以产生单重态激发态,单重激子迅速衰变以产生即时发光。一方面,本发明的配合物可提供大部分可见光谱的发射。在具体实例中,本发明的配合物可以在可见光或近红外光的波段范围内发光。另一方面,本发明的配合物相对于传统的发射配合物具有改进的稳定性和效率。另外,本发明的配合物可用作例如生物应用,抗癌剂,有机发光二极管(oled)中的发射体或其组合的发光标记。在另一方面,本发明的配合物可用于发光器件,例如紧凑型荧光灯(cfl)、发光二极管(led)、白炽灯及其组合。
[0200]
本文公开了包含铂的化合物或复合配合物。术语化合物或配合物在本发明可互换使用。另外,本文公开的化合物具有中性电荷。
[0201]
本文公开的化合物可以表现出期望的性质并且具有可以通过选择合适的配体调
节的发射和/或吸收光谱。在另一方面,本发明可以排除本文具体叙述的任何一种或多种化合物,结构或其部分。
[0202]
本文公开的化合物适用于各种各样的光学和电光装置,包括但不限于光吸收装置,例如太阳能和感光装置,有机发光二极管(oleds),光发射器件或能够兼容光吸收和发射的器件以及用作生物应用的标记物。
[0203]
如上所述,所公开的化合物是铂配合物。同时,本文公开的化合物可用作oled应用的主体材料,例如全色显示器。
[0204]
本文公开的化合物可用于各种应用。作为发光材料,该化合物可用于有机发光二极管(oled),发光装置和显示器以及其他发光器件。
[0205]
另外,相对于传统材料,本发明中的化合物用于发光器件(如oleds)中,可以提高发光效率和器件的操作时间。
[0206]
本发明的化合物可以使用多种方法制备,包括但不限于本文提供的实施例中所述的那些。
[0207]
本文公开的化合物可以是延迟的荧光和/或磷光发射体。一方面,本文公开的化合物可以是延迟的荧光发射体。一方面,本文公开的化合物可以是磷光发射体。另一方面,本文公开的化合物可以是延迟荧光发射体和磷光发射体。
[0208]
本发明的实施方式所公开的化合物适用于各种各样的光学和电光装置,包括但不限于太阳能和光敏感器件这样的光吸收器件、有机发光二极管(oleds),光发射器件或既有光吸收又有光发射能力的器件以及用作生物应用的标记物。
[0209]
本发明的实施方式所提供的化合物可用在一种诸如oled之类的发光器件中,器件包括至少一个阴极、至少一个阳极和至少一层发光层,所述发光层中的至少一层包括上述的基于苯基咔唑的四齿环金属铂配合物。具体来说,发光器件可以包括依次沉积形成的阳极、空穴传输层、发光层、电子传输层和阴极。其中空穴传输层、发光层、电子传输层均为有机层,阳极和阴极与电连接。
[0210]
合成实施例
[0211]
以下关于化合物合成、成分、器件或者方法的例子只是为向该行业领域提供一个一般的方法,并不是用于限制该专利的保护范围.对于专利中提到的数据(数量,温度等)尽可能的保证精确,但也可能会存在一些误差。除非特别指出,否则称重都是分开称重,温度是℃,或者是常温,压力是接近常压。
[0212]
下面例子中提供了新化合物的制备方法,但是该类化合物的制备不受限于此方法。在该专业技术领域中,由于本专利中的所保护的化合物易于修饰制备,因此,其制备可以采用下列所列举的方法或者采用其他的方法。下面的例子仅作为实施例,并不用于限制该专利的保护范围。温度、催化剂、浓度、反应物以及反应过程均可以改变,用于对不同的反应物,选择不同条件制备所述化合物。
[0213]1h nmr(500mhz)、1h nmr(400mhz)、
13
c nmr(126mhz)谱在ananceⅲ(500m)型核磁共振波谱仪上测定;如无特别说明,核磁均用dmso-d6或者含0.1%tms的cdcl3做溶剂,其中1h nmr谱若以cdcl3作溶剂时,以tms(δ=0.00ppm)作为内标;以dmso-d6作溶剂时,以tms(δ=0.00ppm)或残留dmso峰(δ=2.50ppm)或残留水峰(δ=3.33ppm)做内标。
13
c nmr谱中,以cdcl3(δ=77.00ppm)或者dmso-d6(δ=39.52ppm)作为内标。hplc-ms agilent 6210tof lc/
ms型质谱仪上测定;hrms谱在agilent 6210tof lc/ms型液相色谱-飞行时间质谱仪上测定。1h nmr谱图数据中:s=singlet,d=doublet,t=triplet,q=quartet,p=quintet,m=multiplet,br=broad。
[0214]
合成路线
[0215]
实施例1:铂配合物pt1可按如下路线合成:
[0216][0217]
l1的合成:向带有磁力转子的schlenk管中,加入cl-1(440mg,1.49mmol,1.00当量),pin-1(576mg,1.49mmol,1.00当量),pd2(dba)3(40.8mg,0.05mmol,0.03当量),三环己基磷(25mg,0.09mmol,0.06当量),磷酸钾(631mg,2.97mmol,2.00当量),抽换氮气三次后注射加入1,4-二氧六环8ml和水2ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=10:1,减压蒸馏除去溶剂,得白色固体670mg,收率87%。1h nmr(500mhz,cdcl3):δ1.46(s,9h),7.38(dd,j=8.5,4.5hz,1h),7.58(t,j=7.5hz,1h),7.71
–
7.75(m,3h),7.87(d,j=2.0hz,1h),7.97(t,j=1.5hz,1h),8.17(dd,j=8.0,1.5hz,1h),8.89(dd,j=4.0,2.0hz,1h)。
[0218]
pt1的合成:向带有磁力转子的50ml三口瓶中依次加入l1(200mg,0.38mmol,1.00当量),二氯化铂(113mg,0.42mmol,1.10当量),抽换氮气三次,注射加入苯甲腈15ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯=20:1),减压蒸馏除去溶剂,得黄色固体110mg,收率41%。1h nmr(400mhz,dmso-d6):δ1.54(s,9h),7.17(t,j=8.0hz,1h),7.47(d,j=7.2hz,1h),7.61(dd,j=8.0,5.2hz,1h),7.81(d,j=8.0hz,1h),8.08(d,j=2.0hz,1h),8.31(d,j=4.8,1.2hz,1h),8.65(d,j=1.6hz,1h),8.83(dd,j=8.4,1.2hz,1h)。
[0219]
实施例2:铂配合物pt2可按如下路线合成:
[0220][0221]
l2的合成:向带有磁力转子的schlenk管中,加入cl-2(166mg,0.47mmol,1.05当量),pin-2(200mg,0.45mmol,1.00当量),pd2(dba)3(12.4mg,0.01mmol,0.03当量),三环己基磷(7.6mg,0.03mmol,0.06当量),磷酸钾(200mg,0.95mmol,2.10当量),抽换氮气三次后注射加入1,4-二氧六环6ml和水1.5ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=10:1,减压蒸馏除去溶剂,得白色固体240mg,收率84%。1h nmr(400mhz,cdcl3):δ1.44(s,9h),1.47(s,9h),7.38(dd,j=8.4,4.4hz,1h),7.69(t,j=
1.6hz,1h),7.74
–
7.77(m,3h),7.89(d,j=2.4hz,1h),8.17(dd,j=8.0,1.6hz,1h),8.89(dd,j=4.0,1.6hz,1h)。
[0222]
pt2的合成:向带有磁力转子的50ml三口瓶中依次加入l2(120mg,0.19mmol,1.00当量),二氯化铂(55mg,0.20mmol,1.10当量),抽换氮气三次,注射加入苯甲腈12ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯=20:1),减压蒸馏除去溶剂,得红色固体70mg,收率45%。1h nmr(400mhz,dmso-d6):δ1.46(s,9h),1.54(s,9h),7.58
–
7.62(m,2h),7.71(d,j=0.8hz,1h),8.07(d,j=2.0hz,1h),8.33(dd,j=5.2,2.0hz,1h),8.61(d,j=1.6hz,1h),8.81(dd,j=8.4,2.0hz,1h)。
[0223]
实施例3:铂配合物pt3可按如下路线合成:
[0224][0225]
l3的合成:向带有磁力转子的schlenk管中,加入cl-2(159mg,0.45mmol,1.05当量),pin-3(200mg,0.43mmol,1.00当量),pd2(dba)3(11.8mg,0.01mmol,0.03当量),三环己基磷(7.2mg,0.03mmol,0.06当量),磷酸钾(191mg,0.90mmol,2.1当量),抽换氮气三次后注射加入1,4-二氧六环6ml和水1.5ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=10:1,减压蒸馏除去溶剂,得白色固体237mg,收率84%。1h nmr(400mhz,cdcl3):δ1.43(s,9h),1.44(s,9h),1.47(s,9h),7.37
–
7.45(m,3h),7.49
–
7.53(m,2h),7.70
–
7.79(m,8h),7.84
–
7.85(m,1h),7.89(d,j=2.0hz,1h),8.02(d,j=2.0hz,1h),8.09(d,j=2.0hz,1h),8.17(dd,j=8.4,1.6hz,1h),8.26(dd,j=8.4,1.6hz,1h),8.89(dd,j=4.4,1.6hz,1h),8.95(dd,j=4.4,1.6hz,1h)。
[0226]
pt3的合成:向带有磁力转子的50ml三口瓶中依次加入l3(180mg,0.28mmol,1.00当量),二氯化铂(81mg,0.30mmol,1.1当量),抽换氮气三次,注射加入苯甲腈15ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯/二氯甲烷=5:1:1),减压蒸馏除去溶剂,得红色固体49mg,收率21%。1h nmr(400mhz,dmso-d6):δ1.45(s,9h),1.46(s,9h),1.54(s,9h),7.52(t,j=7.6hz,1h),7.60
–
7.68(m,6h),7.72(s,1h),7.82
–
7.85(m,1h),8.00(d,j=7.6hz,2h),8.08(d,j=2.0hz,1h),8.35(dd,j=4.8,1.2hz,1h),8.40
–
8.43(m,2h),8.62(d,j=1.6hz,1h),8.78(d,j=1.6hz,1h),8.83(dd,j=8.0,1.2hz,1h),8.90(dd,j=8.4,1.2hz,1h)。
[0227]
实施例4:铂配合物pt4可按如下路线合成:
[0228]
[0229]
l4的合成:向带有磁力转子的schlenk管中,加入cl-3(143mg,0.45mmol,1.05当量),pin-3(200mg,0.43mmol,1.00当量),pd2(dba)3(11.8mg,0.01mmol,0.03当量),三环己基磷(7.2mg,0.03mmol,0.06当量),磷酸钾(191mg,0.90mmol,2.1当量),抽换氮气三次后注射加入1,4-二氧六环6ml和水1.5ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=10:1,减压蒸馏除去溶剂,得白色固体210mg,收率82%。1h nmr(400mhz,cdcl3):δ1.44(s,9h),7.38
–
7.46(m,4h),7.48
–
7.52(m,4h),7.60(t,j=7.6hz,1h),7.73
–
7.78(m,8h),7.87(t,j=1.6hz,1h),8.00
–
8.03(m,3h),8.08(t,j=2.8hz,2h),8.26(ddd,j=8.4,3.2,1.6hz,2h),8.94(ddd,j=6.0,4.4,2.0hz,2h)。
[0230]
pt4的合成:向带有磁力转子的50ml三口瓶中依次加入l3(100mg,0.15mmol,1.00当量),二氯化铂(44.8mg,0.16mmol,1.1当量),抽换氮气三次,注射加入苯甲腈12ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯/二氯甲烷=6:1:1),减压蒸馏除去溶剂,得红色固体85mg,收率65%。1h nmr(400mhz,dmso-d6):δ1.45(s,9h),7.19(t,j=7.6hz,1h),7.50
–
7.72(m,10h),7.85(s,1h),7.96(d,j=8.4hz,1h),8.00
–
8.05(m,4h),8.41
–
8.46(m,4h),8.80(d,j=1.2hz,1h),8.86(d,j=1.6hz,1h),8.91
–
8.93(m,2h)。
[0231]
实施例5:配合物pt5按如下路线合成:
[0232][0233]
l5合成:向带有磁力转子的schlenk管中,加入br-1(113mg,0.39mmol,1.00当量),pin-1(150mg,0.39mmol,1.00当量),pd(pph3)4(13.4mg,0.01mmol,0.03当量),碳酸钾(106mg,0.77mmol,2.0当量),抽换氮气三次后注射加入1,4-二氧六环5ml和水1ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=20:1,减压蒸馏除去溶剂,得白色固体140mg,收率78%。1h nmr(500mhz,cdcl3):δ1.46(s,9h),7.38(dd,j=8.0,4.0hz,1h),7.42(dd,j=8.5,4.5hz,1h),7.57
–
7.63(m,3h),7.70
–
7.73(m,4h),7.75(d,j=2.0hz,1h),7.80(dd,j=6.0,1.5hz,1h),7.84(dd,j=8.0,1.5hz,1h),7.87(d,j=2.5hz,1h),7.96
–
7.98(m,2h),8.17(dd,j=8.5,2.0hz,1h),8.21(dd,j=8.0,1.5hz,1h),8.89(dd,j=4.0,1.5hz,1h),8.95(dd,j=4.0,1.5hz,1h)。
[0234]
pt5合成:向带有磁力转子的50ml三口瓶中依次加入l5(130mg,0.28mmol,1.00当量),二氯化铂(81.9mg,0.31mmol,1.1当量),抽换氮气三次,注射加入苯甲腈15ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯/二氯甲烷=10:2:1),减压蒸馏除去溶剂,得红色固体68mg,收率37%。1h nmr(500mhz,dmso-d6):δ1.53(s,9h),7.13
–
7.18(m,2h),7.47(d,j=2.5hz,2h),7.61
–
7.65(m,2h),7.81(t,j=8.0hz,2h),7.88(t,j=8.0hz,1h),8.08(d,j=2.0hz,1h),8.13
–
8.15(m,1h),8.31(dd,j=5.0,1.5hz,1h),8.38
(dd,j=5.0,1.5hz,1h),8.65(d,j=2.0hz,1h),8.67(d,j=7.0hz,1h),8.83(dd,j=8.5,1.5hz,1h),8.85(dd,j=8.5,1.5hz,1h)。
[0235]
实施例6:配合物pt6按如下路线合成:
[0236][0237]
l6合成:向带有磁力转子的schlenk管中,加入br-1(113mg,0.39mmol,1.00当量),pin-3(171mg,0.39mmol,1.00当量),pd(pph3)4(13.4mg,0.01mmol,0.03当量),碳酸钾(106mg,0.77mmol,2.0当量),抽换氮气三次后注射加入1,4-二氧六环5ml和水1ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯)=40:1,减压蒸馏除去溶剂,得白色固体160mg,收率80%。1h nmr(500mhz,cdcl3):δ1.44(s,9h),1.46(s,9h),7.38(dd,j=8.0,4.0hz,1h),7.42(dd,j=8.5,4.5hz,1h),7.56
–
7.59(m,1h),7.61
–
7.64(m,1h),7.70(d,j=1.5hz,1h),7.71
–
7.74(m,3h),7.74(d,j=2.5hz,1h),7.78
–
7.81(m,2h),7.84(dd,j=8.0,1.0hz,1h),7.87(d,j=2.0hz,1h),7.95(t,j=1.5hz,1h),8.17(dd,j=8.5,2.0hz,1h),8.21(dd,j=8.0,1.5hz,1h),8.88(dd,j=4.5,2.0hz,1h),8.96(dd,j=4.0,2.0hz,1h)。
[0238]
pt6合成:向带有磁力转子的50ml三口瓶中依次加入l6(130mg,0.25mmol,1.00当量),二氯化铂(73mg,0.28mmol,1.1当量),抽换氮气三次,注射加入苯甲腈15ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯/二氯甲烷=10:2:1),减压蒸馏除去溶剂,得红色固体85mg,收率48%。1h nmr(500mhz,dmso-d6):δ1.44(s,9h),1.54(s,9h),7.15(t,j=7.5hz,1h),7.52(d,j=6.0hz,1h),7.55(d,j=1.5hz,1h),7.62(dd,j=5.0,1.0hz,1h),7.64(dd,j=5.0,1.0hz,1h),7.71
–
7.71(m,1h),7.81(d,j=8.0hz,1h),7.87(t,j=7.5hz,1h),8.08(d,j=2.0hz,1h),8.13
–
8.14(m,1h),8.32(dd,j=5.5,1.5hz,1h),8.40(dd,j=5.5,1.5hz,1h),8.61(d,j=2.0hz,1h),8.67(d,j=2.5hz,1h),8.83(dd,j=8.5,3.5hz,1h),8.83(dd,j=8.0,1.0hz,1h)。
[0239]
实施例7:铂配合物pt7可按如下路线合成:
[0240][0241]
l7的合成:向带有磁力转子的schlenk管中,加入cl-3(150mg,0.47mmol,1.00当量),pin-1(184mg,0.47mmol,1.00当量),pd2(dba)3(13.04mg,0.01mmol,0.03当量),三环己基磷(7.99mg,0.03mmol,0.06当量),磷酸钾(211mg,0.99mmol,2.1当量),抽换氮气三次后注射加入1,4-二氧六环6ml和水1.5ml,升温85℃。反应24h。反应混合物加水淬灭,用乙酸乙酯萃取三次后合并有机相,加无水硫酸钠干燥,将所得粗品通过硅胶柱色谱进行分离纯化,
淋洗剂(石油醚/乙酸乙酯)=10:1,减压蒸馏除去溶剂,得白色固体240mg,收率93%。1h nmr(500mhz,cdcl3):δ1.47(s,9h),7.38
–
7.44(m,2h),7.46(dd,j=8.0,4.0hz,1h),7.50
–
7.53(m,2h),7.59
–
7.63(m,2h),7.72
–
7.80(m,7h),7.89(d,j=2.0hz,1h),8.00(t,j=2.0hz,1h),8.04
–
8.05(m,2h),8.09(d,j=2.0hz,1h),8.19(dd,j=8.0,1.5hz,1h),8.28(dd,j=8.0,1.5hz,1h),8.90(dd,j=4.5,2.0hz,1h),8.96(dd,j=4.0,2.0hz,1h)。
[0242]
pt7的合成:向带有磁力转子的50ml三口瓶中依次加入l7(150mg,0.27mmol,1.00当量),二氯化铂(77.5mg,0.29mmol,1.05当量),抽换氮气三次,注射加入苯甲腈15ml。用氮气鼓泡30分钟后升温180℃,反应48小时。反应混合物减压蒸馏除去苯甲腈,后将反应混合物通过硅胶柱色谱进行分离纯化,淋洗剂(石油醚/乙酸乙酯/二氯甲烷=10:3:1),减压蒸馏除去溶剂,得红色固体40mg,收率20%。1h nmr(500mhz,dmso-d6):δ1.54(s,9h),7.16
–
7.19(m,2h),7.48
–
7.53(m,3h),7.60
–
7.68(m,4h),7.82(d,j=8.0hz,1h),7.95(d,j=8.0hz,1h),8.03
–
8.05(m,2h),8.09(d,j=2.0hz,1h),8.34(dd,j=5.0,1.5hz,1h),8.38(dd,j=5.5,1.5hz,1h),8.45(d,j=2.0hz,1h),8.66(d,j=2.0hz,1h),8.83
–
8.86(m,2h),8.91(dd,j=8.5,1.5hz,1h)。
[0243]
光物理测试和理论计算说明
[0244]
使用horiba jobin yvon fluorolog-3光谱仪上进行稳态发射实验和寿命测量。pt(ii)配合物使用titan软件包进行理论计算。利用密度泛函理论(dft)优化了基态(s0)分子的几何结构。使用b3lyp泛函进行dft计算,其中c、h、o和n原子使用6-31g(d)基组,pt原子使用lanl2dz基组。
[0245][0246]
由图1-图7可知,上述铂(ii)配合物在二氯甲烷溶液中可强烈发光,其溶液量子效率均大于50%。如下表1所示,部分铂(ii)配合物的热重分析(tga)数据表明其具有很高的热稳定性,5%质量损失温度均在430℃以上。
[0247]
表1
[0248]
铂(ii)配合物分解温度(5%质量损失温度)pt1434℃pt5435℃pt6438℃
[0249]
表2:部分金属配合物的前线轨道能级
[0250]
金属配合物homo/evlumo/evgap/evpt9-4.61-1.982.63pt10-4.65-2.062.59
pt124.62-2.022.60pt13-4.56-2.032.53pt15-4.49-1.962.53pt16-4.51-1.882.63pt17-4.31-1.872.44pt18-4.53-1.912.62pt19-4.44-2.022.42pt20-4.60-1.942.66pt21-4.57-1.902.67pt22-4.52-1.912.61pt23-4.56-2.002.56pt24-4.72-2.172.55pt25-4.88-2.072.81pt26-4.29-1.812.48pt27-4.57-2.062.51pt28-4.62-2.162.68pd1-4.75-1.952.80pd2-4.72-1.962.76
[0251]
[0252][0253]
部分铂(ii)配合物的理论计算数据列于表2。从表中可知,铂(ii)配合物的前线轨道能级可以通过调控配体结构进行调节。
[0254]
由图8可知,基于母核的对称结构,其前线轨道电子云分布也具有一定的对称性,其homo主要分布在中心金属原子和联苯基团上,而lumo主要分布在两个喹啉基团上。在pt9中,在喹啉6号位引入的叔丁基几乎不参与前线轨道的分布,但可增大其空间位阻并提高分子的热稳定性。pt10中在苯基基团上引入一个苯基,由于引入苯基与分子母核结构较大的二面角,导致了其homo分布并没有明显地向引入地苯环上离域,引入苯基可以很好的提高铂配合物的电子传输性能。pd1将中心金属原子由铂替换为钯,可以观察到其能级差显著变大,因而预计其发射光谱将会产生蓝移。pt12则可以在不明显改变分子电子云分布的情况下改善配合物的溶解性和电子传输能力。
[0255]
由图9可知,pt13中喹啉环上引入的叔丁基对前线轨道几乎没有贡献,而引入的苯基可以使其lumo分布明显向右侧离域。通过引入多个叔丁基可以很好的提高分子的热稳定性并抑制分子间π-π堆积,有利于配合物的升华。pt15和pt16在联苯基团引入了多个取代基,发现其homo改变很小,因而推测可以在联苯基团引入功能性取代基改善分子结构。
[0256]
由图10可知,pt18中联苯基团引入叔丁基和异丙基,其homo能级提高,并且可以很好的提高铂配合物的热稳定性、抑制分子间π-π堆积。pt19中,在左侧苯基上并苯基,共轭结构增大,其homo向引入的苯基离域,其homo能级明显提高,因而可以通过产生共轭的方式调控其homo能级。pt20中,由于右侧形成稠环,产生了共轭,导致其右侧lumo分布减少。
[0257]
由图11可知,在两侧分别引入叔丁基和环烷基,其电子云分布变化都较小,环烷基同样可以很好的提高分子的热稳定性和抑制分子间π-π堆积。pt23引入苯并呋喃,将homo分布离域,微弱提高了其homo能级,引入共轭体系可以增强分子刚性,且对电子云分布影响很小,可以提高激子利用率。图12中pt28在右上角引入三氟甲基,可以明显观察到其lumo能级明显向三氟甲基侧离域,lumo能级显著降低。因而可以通过在一侧引入吸电子基调控其lumo能级。
[0258]
本发明中涉及的主体材料通过已知的合成方法获得。
[0259]
oled器件的制备:在发光面积为2mm
×
2mm大小的ito玻璃的表面或阳极上蒸镀p掺杂材料p-1~p-5或者将此p掺杂材料以1%~50%浓度与表中所述的化合物共蒸形成5-100nm的空穴注入层(hil),5-200nm的空穴传输层(htl),随后在空穴传输层上形成10-100nm的发光层(eml)(可含有所述的化合物),最后依次用所述的化合物形成电子传输层(etl)20-200nm和阴极50-200nm,如有必要在htl和eml层中间加入电子阻挡层(ebl),在etl和阴极间加入电子注入层(eil)从而制造了有机发光元件。通过标准方法测试所述的oled,列于表3。
[0260][0261]
表3
[0262][0263]
由表3可以看出,与使用传统的主体材料cbp对比器件1相比,使用本发明提供化合物组合作为主体的器件例1至器件例7可以明显提升oled器件的电流效率,同时降低驱动电压。
[0264]
综上所述,在联苯基团引入功能性取代基可以改善分子结构并且对分子的前线轨道分布营销较小。尤其是在联苯基团上引入叔丁基可以很好的抑制分子间π-π堆积。同样在联苯基团引入共轭集团如并苯或苯并呋喃可以将homo离域,调控homo能级。将中心金属原子由铂更换为钯,可以显著改变能级差,预计使分子发射光谱蓝移,可对其光物理性质进行调节。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。