1.本发明涉及单细菌测序领域,具体涉及一种基于数字微流控技术的单细菌基因组测序方法。
背景技术:
2.微生物是多样性和丰度最高、分布最广、生存与代谢方式最丰富的生命体,在生物地球化学循环中发挥着关键的驱动作用,对人体的生命健康也有重要的影响。然而,我们对细菌的认识基本上来源于对少数可培养细菌的研究上。但由于目前的培养技术存在局限性,大部分细菌仍难以进行纯培养,从而阻碍了人们对这些不可培养细菌的研究,这大大限制了我们对种类多样、数量庞大的细菌的认知。开发不需要依赖培养的研究方法可使我们摆脱这种限制,从而对细菌界有更全面系统的认识。基因组被称为生命的蓝图,通过基因组即可以获取细菌大量的信息,例如解析细菌的分类和功能,构建代谢通路等等。目前,宏基因组和单细菌基因组都是免培养的基因组测序方法,但由于宏基因组的测序数据来源复杂,组装的基因组容易存在错配的情况,而单细菌基因组只来源于单个细菌,因此可有效避免这个问题,其组装的基因组还可作为参考基因组用于宏组学数据集的注释。另外,单细菌基因组测序可以测到细菌内的所有dna信息,所以还可以研究微生物间的相互作用,如感染、共生、捕食等科学问题。此外,由于单细菌基因组测序技术具有单细胞的分辨率,因此该方法还可用于研究细菌个体间的异质性,解析细菌异质性耐药等用传统方法难以研究的科学问题。然而,与真核细胞的单细胞基因组测序较快的发展相比,单细菌基因组测序的发展较为滞后,主要原因可归纳为以下几点,1、细菌的直径一般在0.2~7μm之间,仅为真核细胞的十分之一,细胞尺寸太小且通体透明,所以很难观察与分离;2、细菌种类繁多,细胞壁的组成和厚度较为多样,大部分细菌的细胞壁难以裂解,因此核酸不易释放。3、细菌的dna含量非常少,绝大部分细菌只有几飞克,仅为真核细胞的千分之一。4、要满足目前测序要求的上样量,核酸含量至少需要达到纳克级别,这就需要对dna进行百万倍以上的扩增,极易造成扩增偏差,同时,这也让污染防护变得极为重要,因为极微量的污染都会被放大。
3.目前大部分单细胞基因组测序方法针对哺乳动物细胞等无细胞壁细胞进行开发,这些方法并不适用于细菌等具有细胞壁细胞的裂解和扩增。为此,科研人员建立了几种针对细菌的单细菌基因组测序方法,这些方法主要基于流式细胞荧光分选技术(facs)和微流控技术,例如基于facs发展了wga-x,基于微孔微流控发展了midas,基于凝胶液滴微流控发展了sic-seq、sag-gel platform等。拉曼分选技术是近年来新兴的一种单细胞分选技术,基于该技术发展了rage-seq等单细菌基因组测序方法。
4.然而,目前发展的这些单细菌基因组测序方法仍存在不足。例如基于facs发展的wga-x,通过facs将单个细菌分到孔板或离心管内进行裂解和扩增,借助突变的equiphi29聚合酶降低了扩增偏差并提高了基因组覆盖率。但facs分选环境不完全密闭,极易引入污染,而且在孔板或离心管中进行反应的体积太大,不仅需要消耗大量试剂,还会造成更大的扩增偏差。基于微孔微流控发展的midas,通过大量纳升级的微孔阵列提高获得单个细菌的
成功率,具有较高的通量,此外纳升级的反应体系可有效减少扩增偏差,大大提高了基因组的恢复率,获得更高的基因组完整度。但微孔芯片对单细菌的捕获是随机的,服从泊松分布,因此微孔的利用率很低,试剂也因此被浪费,而且midas需要手动从微孔里挑取成功扩增的dna产物,操作较为繁琐,难度大。基于凝胶液滴微流控发展的sic-seq,通过液滴微流控芯片可产生大量包裹有单细菌的微液滴,结合液滴编码技术(barcode),一次可对50000个以上的细菌进行测序,实现高通量测序,然而该方法基因组覆盖率很低,仅为0.1%~1%,而且该方法在扩增前就将dna打断,使后期序列拼接时难以进行基因组从头组装(de novo assembly),这限制了该方法在不可培养细菌基因组中的应用。由于液滴微流控具有高通量的优点,因此还发展了sag-gel platform等方法,然而,液滴微流控与微孔微流控一样都服从泊松分布,液滴存在大量空载,利用率低,而且,这些平台可控性较差,无法实现选择性的细胞捕获,难以移除不健康、死细胞或多细胞的液滴,一定程度上造成了试剂的浪费和样品的交叉污染。基于拉曼分选技术发展的rage-seq是一种新兴的单细胞分选测序技术,通过联用光镊及液滴微流控技术,将特定拉曼表型的单个细菌从群体中精准分离,加入试剂后通过振荡生成大量小液滴,从而减小反应体积,大大减小了扩增偏差,提高了基因组覆盖度,而且该方法能将细菌的基因型和表型联系在一起,可获取更多的细菌信息。但该方法仍存在一些不足,例如拉曼信号的采集需要较长的时间、将液滴转移到试管将增加污染的可能性等等。
5.基于以上样本污染率高,试剂耗费严重,信号采集时间长等问题,目前开发利用全自动数字微流控平台(dmf)进行单细胞基因组测序技术成为热点。dmf平台具有微型化、集成化、可视化、自动化的优势,是一种动态可控的新兴微流控技术。厦门大学杨朝勇等人,开发了基于全自动数字微流控的单细胞测序平台,该平台可对细胞完成选择性捕获,全自动过程的样本污染率低,组装能力强、基因覆盖度高,但其与目前大部分针对哺乳动物细胞等无细胞壁单细胞基因组测序存在相同的问题,适用于哺乳细胞的全自动单细胞测序技术并不适用于细菌等具有细胞壁的细胞进行单细胞基因组测序,存在细胞难裂解、扩增污染难防护等问题,进一步影响了基因的组装和覆盖度。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供一种基于数字微流控技术的单细菌基因组测序方法。
7.本发明提供了数字微流控芯片,其包括细菌捕获及裂解单元、液滴生成通道、储液池单元和电极接口;所述储液池单元的数量不低于5个,分别存储有裂解试剂a、裂解试剂b、中和液、扩增试剂和菌液;其中,
8.裂解试剂a包括:800~2400u/μl溶菌酶、400~1200mm二硫苏糖醇(dtt)和2~6mm乙二胺四乙酸(edta);
9.裂解试剂b包括:300~500mm koh、80~120mm dtt和5~15mm edta;
10.中和液包括:0.8~1.2m tris-hcl溶液;
11.扩增试剂包括:随机引物、dna聚合酶、dntp、扩增缓冲液和dtt。
12.进一步的,在一些具体实施例中,所述的裂解试剂a、裂解试剂b、中和液和扩增试剂独立的如下i)~iv)所示时的裂解效果好、基因完整度高:
13.i)、裂解试剂a包括:1600u/μl溶菌酶、800mm dtt和4mm edta;
14.ii)、裂解试剂b包括:400mm koh、100mm dtt和10mm edta;
15.iii)、中和液包括1m tris-hcl溶液;
16.iv)、扩增试剂包括随机引物、dna聚合酶、dntp、扩增缓冲液和dtt。
17.在本发明中,所述扩增试剂中的dna聚合酶包括但不限于:vent dna聚合酶、t7 dna聚合酶、t4 dna聚合酶、dna聚合酶i、sulfolobus dna聚合酶iv、phi29 dna聚合酶、bst dna聚合酶、equiphi29 dna聚合酶中的任意一种或两种以上的组合,本发明对此不做限定。
18.进一步的,本发明以equiphi29 dna聚合酶为受试对象,对细菌单基因组进行扩增。equiphi29 dna聚合酶的高保真结合全自动数字微流控平台的优势可进一步降低扩增偏差,提高基因组覆盖度。
19.在本发明中,所述的扩增缓冲液包括适用于以上dna聚合酶扩增的市售或自配扩增缓冲液,本发明对此不做限定。
20.本发明中,所述的数字微流控芯片还包括荧光染料、填充油和纯化试剂;
21.所述荧光染料选自pi、dapi,syto-9,fm 1-43fx,fm 4-64,fm 4-64fx,bacligh bacterial stains,alexa fluor 647nhs ester,celltracker
tm
红色cmtpx或fm 1-43;
22.所述填充油选自矿物油、氟油、硅烷油、二甲基硅油;
23.所述纯化试剂选自柱纯化试剂或磁珠纯化试剂。
24.更进一步的,本发明以fm 1-43荧光染料对细菌进行荧光染色,便于单细胞捕获状况的观察及细胞形态信息的获取;本发明以二甲基硅油为受试对象用于芯片的密封;本发明利用磁珠纯化试剂进行纯化。
25.本发明中,所述的裂解试剂a、裂解试剂b、中和液的体积比为1:(1~1.5):(1~1.5);所述扩增试剂与裂解试剂a、裂解试剂b和中和液的混合液的体积比为1:6.5。
26.更进一步的,所述的裂解试剂a、裂解试剂b、中和液的体积比为1:1.5:1.5时的单细菌裂解效果好,基因完整度高。
27.基于哺乳动物等的微型单细胞裂解体系并不适用于细菌等具有细胞壁的单细菌的裂解。本发明开发了适用于细菌的单细胞微型裂解体系,本发明提供的裂解体系包括裂解液a、裂解液b和中和液,裂解液a为酶裂解试剂,裂解液b为碱裂解试剂,先酶裂解、再碱裂解,最后中和,获得了良好的裂解效果。相对于其他裂解方案或裂解试剂的选择而言,获得的裂解效果好,基因完整度高,更有利于后续文库的构建和测序反应的进行。
28.在本发明中,所述的数字微流控芯片包括细菌捕获及裂解单元、液滴生成通道、储液池单元和电极接口。所述细菌捕获及裂解单元包括:上极板基底,设置在所述上极板基底下表面的ito涂层,设置于所述ito涂层下表面的上疏水层,上极板及上疏水层为透光的,利于捕获单菌的观察;下极板基底,设置于所述下极板基底上表面的介质层,嵌设于所述介质层内的电极,设置在所述介质层上表面的下疏水层,支撑于所述下疏水层和所述上疏水层之间的支撑体,所述上疏水层、所述下疏水层和所述支撑体之间形成液滴生成通道,所述下疏水层嵌设有亲水凹槽,所述亲水凹槽的上槽口与所述液滴生成通道相通;所述液滴生成通道的通口与所储液池单元连通;所述储液池单元的数量不低于5个,分别存储有裂解试剂a、裂解试剂b、中和液、扩增试剂和菌液;所述电极接口与所述电极相连接。
29.进一步的,所述的电极层要求使用能导电的材料,包括但不限于金属、合金、石墨
烯、氧化铟锡。疏水层要求使用能疏水的材料,包括但不限于聚四氟乙烯或聚乙烯醇。上极板基底和上疏水层使用透明材料。所述上极板基底和下极板基底独立的选自玻璃、石英、塑料材料。
30.所述亲水凹槽为中空的圆柱形结构,直径为150~300μm,与储液池有2个电极以上的距离;所述的储液池尺寸为1mm
×
1mm,储液池与通道的尺寸比值为(5~8):1。
31.本发明提供了一种数字微流控装置,其包括本发明所述的数字微流控芯片、集成电路和成像系统,所述的集成电路与数字微流控芯片的电极接口相连。
32.所述数字微流控装置中,所述的集成电路为数字微流控芯片的电路控制系统,通过集成电路芯片上相邻电极通断电,使电极上的液滴移动。所述成像系统位于数字微流控芯片正上方,或者可移动至数字微流控芯片正上方用于观测芯片上的亲水凹槽内细菌分离情况。
33.本发明提供了一种单细菌基因组测序的方法,包括利用本发明所述的数字微流控芯片和/或本发明所述的数字微流控装置进行单细菌的分离捕获、核酸扩增、文库构建和全基因组测序。
34.更进一步的,本发明所述的单细菌基因组测序的步骤如下所示:
35.a.将细菌样品用荧光染料进行染色;
36.b.将上述a步骤进行染色处理的细菌悬液置于数字微流控芯片中,加入填充油封闭芯片,使菌液通过液滴生成通道移动至亲水凹槽,通过荧光显微镜观察分离捕获单个细菌;
37.c.控制电极通断电,依次使裂解试剂a、裂解试剂b、中和液通过液滴生成通道进入亲水凹槽对上述b步骤捕获的单细菌在数字微流控芯片上进行裂解,获得细菌基因组dna;
38.d.控制电极通断电,扩增试剂通过液滴生成通道进入亲水凹槽,对基因组dna进行扩增;
39.e.上述d步骤获得的扩增产物转移到离心管中进行核酸纯化、测序文库构建,最终上机测序。
40.本发明中,步骤c所述的裂解,裂解方法包括但不限于酶裂解法、极端ph裂解法、化学试剂裂解法、物理裂解法中的一种或两种以上的组合,本发明对此不做限定。进一步的,在本发明中,利用酶裂解结合碱裂解的方式进行细胞裂解;第一步为酶裂解,加入的试剂裂解试剂a,包括溶菌酶、dtt、edta混合液,第二步为碱裂解b,加入的试剂为koh和edta混合液,最后加入中和液tris-hcl溶液进行中和。
41.本发明中,步骤e所述的核酸纯化,纯化方法包括但不限于磁珠纯化法、离心柱纯化法,本发明对此不做限定。进一步的,本发明使用磁珠纯化试剂盒dna clean beads(vazyme biotech co.,ltd.)进行核酸纯化。
42.本发明中,步骤e所述的文库构建,构建方法包括但不限于ngs fast dna library prep set for illumina、collibri
tm es dna library prep kits for illumina systems、trueprep
tm dna library prep kit v2 for等,本发明对此不做限定。进一步的,本发明使用trueprep
tm dna library prep kit v2 for对扩增产物进行文库构建。
43.本发明提供了所述的数字微流控芯片,和/或所述的数字微流控装置在细菌文库构建中的应用。
44.进一步的,所述的细菌文库包括但不限于克隆文库、表达文库、质粒文库或噬菌体文库,本发明对此不做限定。
45.本发明提供了所述的数字微流控芯片,和/或所述的数字微流控装置在细菌基因组测序平台中的应用。
46.进一步的本发明所述测序平台包括但不限于illumina hiseq-2000、illumina hiseq-2500、illumina novaseq 6000、pacbio sequelii、promehion。在本发明中,优选地,使用illumina novaseq 6000测序平台进行2
×
150bp双端测序。
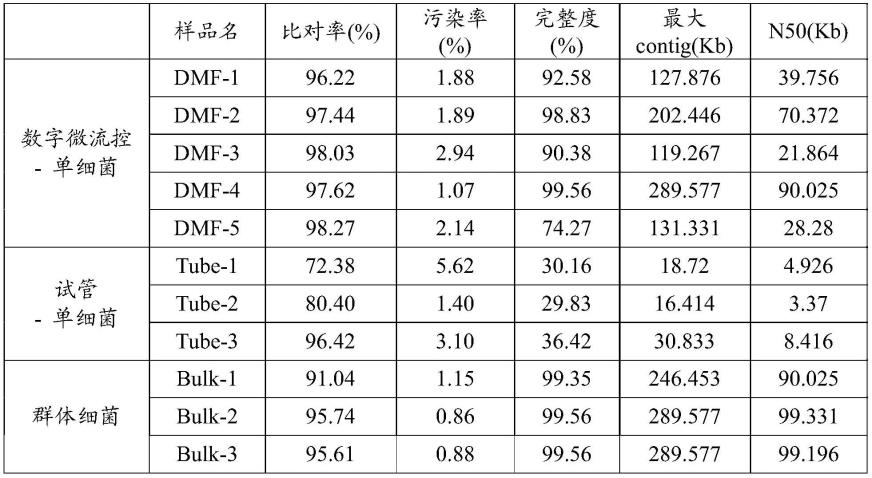
47.更进一步的,本发明所述的细菌包括格兰仕阳性细菌和格兰仕阴性细菌,本发明以革兰氏阴性细菌大肠杆菌为受试对象,进行基于数字微流控平台的单细菌基因组测序。实验结果表明,与试管(tube)及群体细菌(bulk)基因组测序的结果进行比较,基于数字微流控平台的单细菌基因组测序比对率最高且污染率小,基因组完整度及覆盖度高,显示出该方法在单细胞基因组测序上的显著优势。
48.本发明开发了基于全自动数字微流控平台(dmf)的适用于单细菌的微型裂解体系、数字微流控芯片及单细菌基因组测序技术,实验结果表明,裂解体系单细菌细胞裂解迅速、基因完整度好、组装效率及基因覆盖度高;同时该裂解体系及基于该裂解体系的微流控芯片与dmf的联用,减少了试剂的损耗,降低了样品污染风险、提高了反应效率、减小了扩增偏差,使之更适用于单细菌基因组测序。
附图说明
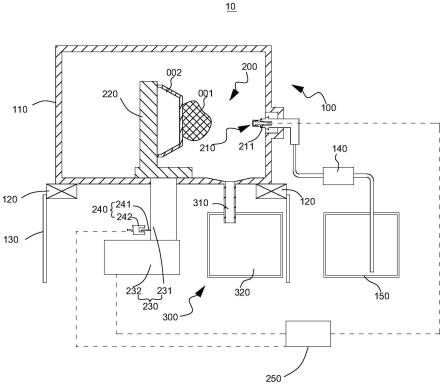
49.图1示数字微流控芯片结构侧视图,其中,1:上极板基底;2:ito涂层;3a:上疏水层;3b:下疏水层;4:支撑体;5:亲水凹槽;6:介质层;7:电极层;8:下极板基底;
50.图2示微流控芯片俯视图,其中,1:下极板电路连接点;2为电极层阵列;
51.图3示基于数字微流控装置的单细菌基因组测序示意图。
具体实施方式
52.本发明提供了一种基于数字微流控技术的单细菌基因组测序方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
53.在本发明的描述中,术语“上”、“下”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明而不是要求本发明必须以特定的方位构造和操作,因此不能理解为对本发明的限制。
54.本发明中,所述的单细菌基因组测序的步骤如下所示:
55.a.利用5μg/ml的荧光染料fm 1-43,冰上孵育30min将细菌样品荧光染色;
56.b.将上述a步骤进行染色处理的细菌悬液置于数字微流控芯片中,加入填充油封闭芯片,控制电极通断电,生成30nl菌液液滴通过滴通道移动至亲水凹槽,通过荧光显微镜
观察分离捕获单个细菌;
57.c.将上述b步骤捕获的单细菌在数字微流控芯片上进行裂解,控制电极通断电,裂解试剂a液滴30nl,裂解液b液滴45nl,中和液45nl通过液滴生成通道进入亲水凹槽,裂解获得细菌基因组dna;
58.d.控制电极通断电,扩增试剂通过液滴生成通道进入亲水凹槽,扩增试剂液滴为3
×
250nl,45℃下孵育6h对基因组dna进行扩增;
59.e.上述d步骤获得的扩增产物转移到离心管中进行核酸纯化、测序文库构建,最终上机测序。
60.本发明采用的试材皆为普通市售品,皆可于市场购得。
61.下面结合实施例,进一步阐述本发明:
62.实施例1基于数字微流控技术的单细菌基因组测序方法
63.一、数字微流控装置结构
64.数字微流控装置包括数字微流控芯片、集成电路和成像系统。成像系统位于数字微流控芯片正上方,具有多通道成像功能,用于获取芯片、液滴及细菌的图像信息,在明场下,用于获取液滴的位置和体积信息;在荧光场下,用于观察所述亲水位点处捕获到细菌的个数。集成电路为数字微流控芯片的电路控制系统,通过集成电路芯片上相邻电极通断电,使电极上的液滴移动。
65.数字微流控芯片包括细菌捕获及裂解单元、液滴生成通道、储液池单元和电极接口。细菌捕获及裂解单元如图1所示,其包括:上极板基底(图1中的1),设置在上极板基底下表面的ito涂层(图1中的2),设置于ito涂层下表面的上疏水层(图1中的3a),上极板基底、ito涂层及上疏水层为透光的;下极板基底(图1中的8),设置于下极板基底上表面的介质层(图1中的6),介质层具有亲水特性,可粘附微小液滴;嵌设于介质层内的电极层(图1中的7),电极层要求使用能导电的材料,电极层包括电极接口(图2中的1)、储液池电极单元、及电极层阵列(图2中的2);设置在介质层上表面的下疏水层(图1中的3b);支撑于下疏水层和上疏水层之间的支撑体(图1中的4);上疏水层、下疏水层和支撑体之间形成液滴生成通道;下疏水层嵌设有亲水凹槽(图1中的5),亲水凹槽为中空的圆柱形结构,直径为150~300μm,亲水凹槽与储液池有2个电极以上的距离,以便在到达亲水位点时生成小液滴。亲水凹槽的上槽口与所述液滴生成通道相通,通过控制集成电路在液滴生成通道内根据需要生成10nl~250nl的液滴。液滴生成通道的通口与所储液池单元连通,储液池单元的数量不低于5个,分别存储有裂解试剂a、裂解试剂b、中和液、扩增试剂和菌液(如图3所示),储液池尺寸通常为1mm
×
1mm,且应大于通道尺寸,储液池与通道尺寸大小比通常为5:1至8:1。电极接口与电极相连接。
66.二、单细菌基因组测序
67.如图3所示,基于数字微流控技术的单细菌基因组测序方法的步骤包括细菌染色、单菌分离、细胞裂解、全基因组扩增、文库构建及上机测序。本发明以大肠杆菌为受试对象,进行细菌单基因组测序,具体步骤如下:
68.1、将大肠杆菌样品制成细菌悬液,向细菌悬液中加入终浓度为5μg/ml的荧光染料fm 1-43,冰上孵育30min。
69.2、裂解试剂a为溶菌酶ready-lyse lysozyme溶菌酶1600u/μl,800mm二硫苏糖醇
(dtt)、4mm乙二胺四乙酸(edta);裂解试剂b为400mm koh,100mm dtt,10mm edta;中和液为1m tris-hcl。将300nl染色后的细菌菌液、300nl裂解试剂a(溶菌酶、dtt、edta混合液)、450nl裂解试剂b(koh和dtt混合液)、450nl中和液(hcl溶液)、3000nl mda扩增试剂(随机引物、equiphi29 polymerase、dntp、reaction buffer、dtt混合液,按照表1配制)分别加到dmf芯片上不同的储液槽上。
70.表1扩增混合液配制
[0071] 试剂终浓度体积1equiphi29 dna聚合酶(10u/μl)1u/μl1.2μl210
×
equiphi29扩增缓冲液1
×
1.2μl3dntp(10mm)0.4mm0.48μl4随机引物(500μm)40μm1μl5dithiothreitol(dtt,100mm)10mm1.2μl6h2o 4.92μl
[0072]
3、通过控制仪及电路控制模块控制电极驱动电路,按预设次序进行电极的通断电控制,从而从细菌储液区电极单元产生一个细菌悬液液滴(30nl),并通过控制将此液滴移动至亲水位点区域,使细胞悬液液滴从亲水位点上通过,在表面张力的作用下使亲水位点留下小液滴,小液滴可能含有不同数目的细菌,反复通过亲水位点直至小液滴中仅含单个细菌,便捕获到了单细菌。通过控制电极驱动电路,将原始细胞悬液液滴移至废液区中移除。
[0073]
4、依照步骤3的方法,从裂解试剂1储液区电极单元产生一个裂解试剂a液滴(30nl),将此液滴移动到亲水位点所在电极与单细菌混合,在电极上来回移动液滴使试剂充分混合,常温下孵育20min。
[0074]
5、依照步骤3的方法,从裂解试剂2储液区电极单元产生一个裂解试剂b液滴(45nl),将此液滴移动到亲水位点所在电极与上述液滴混合,在电极上来回移动液滴使试剂充分混合,常温下孵育20min。
[0075]
6、依照步骤3的方法,从中和液储液区电极单元产生一个中和液液滴(45nl),将此液滴移动到亲水位点所在电极与上述液滴混合,在电极上来回移动液滴使试剂充分混合,终止裂解。
[0076]
7、依照步骤3的方法,从mda扩增液储液区电极单元产生3个mda扩增液滴(3
×
250nl),将液滴移动到亲水位点所在电极与上述液滴混合,在电极上来回移动液滴使试剂充分混合,45℃下孵育6h对dna进行扩增。
[0077]
8、75℃,15min终止扩增反应,整个过程完全密闭,不易引入污染。
[0078]
9、将扩增后的液滴回收到试管中,使用纯化试剂盒dna clean beads(vazyme biotech co.,ltd.)对扩增产物进行纯化。
[0079]
10、纯化后的产物用equalbit dsdna hs assay kit进行定量。
[0080]
11、使用建库试剂盒trueprep
tm dna library prep kit v2 for对扩增产物进行建库。
[0081]
12、最后用illumina novaseq 6000测序平台进行2
×
150bp双端测序。三、结果:
[0082]
我们将dmf上的单菌基因组测序与试管(tube)里单菌基因组测序以及群体细菌(bulk)基因组测序的结果进行比较。结果如表1所示,三者的read比对率和污染率基本一致,而dmf的比对率是最高的,且污染率低于5%,说明dmf在防止污染方面表现优异。在最关键的指标基因组完整度方面,dmf远高于tube而与bulk接近,基因组的平均完整度在90%左右,个别单菌基因组接近100%,这说明dmf小体积的反应体系确实能减小扩增偏差,进而提高基因组完整度。在基因组组装的关键指标最大contig和n50方面,dmf远高于tube,个别与bulk相当。整体来看,本发明建立的基于数字微流控技术dmf的单细菌基因组测序的结果显著优于试管的单细菌基因组测序结果,显示出该方法在单细胞基因组测序上的显著优势。
[0083]
表2单细菌基因组测序结果与评价
[0084][0085]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。