1.本发明属于生物医学诊断领域,涉及10基因作为靶标物在开发用于对肾透明细胞癌患者进行预后的产品中的应用。
背景技术:
2.肾癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,学术名词全称为肾细胞癌,又称肾腺癌,简称为肾癌。肾癌约占成人恶性肿瘤的2%~3%,占成人肾脏恶性肿瘤的80%~90%。世界范围内各国或各地区的发病率各不相同,总体上发达国家发病率高于发展中国家,城市地区高于农村地区,男性多于女性,男女患者比例约为2∶1,发病年龄可见于各年龄段,高发年龄50~70岁。据全国肿瘤防治研究办公室和卫生部卫生统计信息中心统计我国试点市、县肿瘤发病及死亡资料显示我国肾癌发病率呈逐年上升趋势,至2008年已经成为我国男性恶性肿瘤发病率第10位。
3.在病理上,西医通常将肾癌分为4型:透明细胞型肾癌、颗粒细胞型肾癌、混合细胞型肾癌、未分化细胞型肾癌。其中,绝大多数为肾透明细胞癌(clear cell renal carcinoma,ccrcc),占肾癌的70%-85%,其癌细胞常排列成片状、条索状、腺泡状或管状,很像肾小管。免疫检查点抑制剂治疗可提高肾透明细胞癌患者的生存率。然而,由于免疫功能障碍和免疫逃逸,并非所有ccrcc患者均能从免疫治疗中获益。
技术实现要素:
4.本发明的目的是提供10基因作为靶标物在开发用于对肾透明细胞癌患者进行预后的产品中的应用。
5.本发明提供了产品甲在制备对肾透明细胞癌患者进行预后的系统中的应用;
6.所述产品甲为用于检测受试者癌组织中10个基因的产品;
7.所述受试者为肾透明细胞癌患者。
8.本发明还保护产品乙在制备对肾透明细胞癌患者进行预后的系统中的应用;
9.所述产品乙为用于检测受试者癌组织中10个基因表达水平的产品;
10.所述受试者为肾透明细胞癌患者。
11.本发明还保护产品乙和记载有方法乙-1的载体在制备对肾透明细胞癌患者进行预后的系统中的应用;
12.所述方法乙-1包括如下步骤:
13.(1)检测受试者癌组织中所述10个基因的表达水平;
14.(2)获得风险评分;
15.(3)风险评分小于或等于阈值的受试者为低风险,风险评分大于阈值的受试者为高风险,低风险的预后优于高风险;
16.所述受试者为肾透明细胞癌患者。
17.本发明还保护产品乙和记载有方法乙-2的载体在制备对肾透明细胞癌患者进行预后的系统中的应用;
18.所述方法乙-2包括如下步骤:
19.(1)检测受试者癌组织中所述10个基因的表达水平;
20.(2)获得风险评分;
21.(3)风险评分小于或等于阈值的受试者为低风险,风险评分大于阈值的受试者为高风险,高风险的预后差,低风险的预后优;
22.所述受试者为肾透明细胞癌患者。
23.本发明还保护产品丙在制备对肾透明细胞癌患者进行预后的系统中的应用;
24.所述产品丙为用于获得风险评分的产品;
25.所述基因表达水平为受试者癌组织中基因的表达水平;
26.所述受试者为肾透明细胞癌患者。
27.本发明还保护产品丙和记载有判断标准-1的载体在制备对肾透明细胞癌患者进行预后的系统中的应用;所述判断标准-1为:风险评分小于或等于阈值的受试者为低风险,风险评分大于阈值的受试者为高风险,低风险的预后优于高风险。
28.本发明还保护产品丙和记载有判断标准-2的载体在制备对肾透明细胞癌患者进行预后的系统中的应用;所述判断标准-2为:风险评分小于或等于阈值的受试者为低风险,风险评分大于阈值的受试者为高风险,高风险的预后差,低风险的预后优。
29.本发明还保护一种系统,其用途为对肾透明细胞癌患者进行预后;
30.所述系统为系统甲或系统乙或系统丙;
31.所述系统甲包括所述产品甲;
32.所述系统乙包括所述产品乙;
33.所述系统乙还包括记载有所述方法乙-1或所述方法乙-2的载体。
34.所述系统丙包括所述产品丙。
35.所述系统丙还包括记载有所述判断标准-1或所述判断标准-2的载体。
36.本发明还保护10个基因作为检测标志物在开发对肾透明细胞癌患者进行预后的产品中的应用。
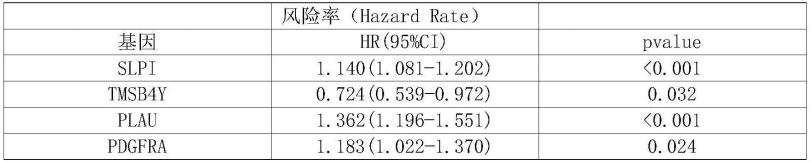
37.以上任一所述受试者为肾透明细胞癌患者。
38.以上任一所述10个基因如下:tmsb4y基因、ndrg1基因、sema3g基因、sema6d基因、bmp1基因、tslp基因、mchr1基因、shc1基因、prkx基因和trim55基因。
39.以上任一所述风险评分=(-0.371
×
tmsb4y基因表达水平) (-0.208
×
ndrg1基因表达水平) (-0.313
×
sema3g基因表达水平) (-0.375
×
sema6d基因表达水平) (0.397
×
bmp1基因表达水平) (0.690
×
tslp基因表达水平) (0.079
×
mchr1基因表达水平) (0.405
×
shc1基因表达水平) (-0.330
×
prkx基因表达水平) (-0.131
×
trim55基因表达水平)。
40.所述基因表达水平为受试者肾脏癌组织中基因的表达水平。
41.以上任一所述系统为试剂盒或检测平台。
42.以上任一所述产品为试剂、试剂套装、试剂盒或试剂装置套装。
43.以上任一所述基因表达水平是通过illumina hiseq 2000 rna测序平台获得的。
44.以上任一所述阈值(cut off值)为1.421925。
45.所述低风险的预后优于高风险体现为低风险的患者的生存率高于高风险的患者。
46.所述预后优体现为生存率高。
47.所述预后差体现为生存率低。
48.所述生存率为1年生存率或2年生存率或3年生存率。
49.本发明对于肾透明细胞癌患者的预后具有重大应用推广价值。
附图说明
50.图1为单因素和多因素cox回归分析森林图;a,单因素cox回归分析森林图;b,多因素cox回归分析森林图。
51.图2为实施例2中两个风险亚组的km生存曲线。
52.图3为实施例2中irps风险评分对530例ccrcc患者的1年、3年、5年预后预测的roc曲线。
53.图4为对比irps风险评分、18基因模型以及tide打分对于530例ccrcc患者3年预后预测的roc曲线。
54.图5为实施例3中的irps评分对免疫治疗疗效的预测价值结果图。
具体实施方式
55.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
56.实施例1、标志物的筛选
57.一、差异免疫相关基因的构建与通路富集分析
58.获取539例ccrcc样本和72例正常组织样本的rna-seq表达数据。以fdr《0.05和|log2(fc)|》1为筛选标准,共识别出ccrcc中9459个差异免疫基因,其中7191个上调基因,2268个下调基因。另外,从import和innatedb数据库中下载了2660个与免疫功能相关的基因。将差异基因与免疫相关基因取交集后,共得到946个差异免疫基因(irdegs)。利用go和kegg数据库进行功能富集分析,探索irdegs潜在的生物学功能。在go分析弦图中,与irdegs相关的前8个通路分别是白细胞介导免疫、基于免疫球蛋白超家族结构域构建的免疫受体体细胞重组的适应性免疫反应、淋巴细胞介导免疫、细胞激活的正向调节、白细胞激活的正向调节、免疫反应分子中介物的产生,淋巴细胞激活的正向调节,以及b细胞介导的免疫。在kegg通路分析中,“细胞因子细胞因子受体相互作用”被认为是最显著的免疫相关富集通路。
59.二、使用wgcna筛选目标基因
60.对上述946个irdegs进行wgcna分析,筛选目标基因。首先,剔除一些在层次聚类树中高度大于20000的杂散样本。相关系数大于0.9,选取最优软阈值“3”来构建网络拓扑分析。表达模式相似的基因聚集在同一个模块中,以颜色区分各个基因模块。采用动态剪枝方
法识别出6个模块,包括棕色、绿色、红色、黑色、蓝色和黄色模块,灰色模块包含与其他基因缺乏表达关系的基因。其中与肿瘤性状相关性最显著的是棕色模块,该模块包含137个免疫相关的目标基因。因此,最终选择了棕色的模块来进一步建立预测标志物。
61.三、构建预测标志物
62.获取ccrcc样本的相应患者的临床数据。选取棕色模块中的137个基因,通过单因素cox比例风险回归分析获得了57个作为独立预后因素的基因(表1)。其中19个基因为预后的危险因素,其余38个基因为保护因素。接下来,使用lasso回归分析排除过拟合基因,最终筛选出21个具有预后价值的最佳基因,用以构建多基因预后标志物。进一步将这21个基因纳入多因素cox比例风险回归分析。利用aic来选择并构建最佳的预后模型,因此,最终共选择10个免疫相关基因作为预测标志物(irps)。
63.最终选择的10个基因为:tmsb4y、ndrg1、sema3g、sema6d、bmp1、tslp、mchr1、shc1、prkx和trim55。10个基因回归系数见表2。
64.表1 57个基因的单因素cox回归分析结果
65.[0066][0067][0068]
表2 多因素cox回归分析构建预测标志物
[0069]
基因回归系数coeftmsb4y-0.370799426734673ndrg1-0.208342957618115sema3g-0.313103289028077sema6d-0.374848454871035bmp10.396543838929799tslp0.690025515099794mchr10.0789209176183345shc10.404852831304043prkx-0.3297361444858trim55-0.130722246225554
[0070]
四、构建风险评分公式
[0071]
irps评分,又称为风险评分。
[0072]
基因表达丰度,又称为基因表达水平。基因表达丰度数据是通过illumina hiseq 2000 rna测序平台获得的。
[0073]
风险评分=(-0.371
×
tmsb4y基因表达水平) (-0.208
×
ndrg1基因表达水平) (-0.313
×
sema3g基因表达水平) (-0.375
×
sema6d基因表达水平) (0.397
×
bmp1基因表达水平) (0.690
×
tslp基因表达水平) (0.079
×
mchr1基因表达水平) (0.405
×
shc1基因表达水平) (-0.330
×
prkx基因表达水平) (-0.131
×
trim55基因表达水平)。
[0074]
实施例2、应用irps评分进行预后
[0075]
530例ccrcc样本,均为肾透明细胞癌患者手术时的肾脏癌组织样本。
[0076]
一、获取相关数据
[0077]
获取各个ccrcc样本相关患者的临床数据。
[0078]
获取各个ccrcc样本的10个基因(10个基因为:tmsb4y、ndrg1、sema3g、sema6d、bmp1、tslp、mchr1、shc1、prkx和trim55)表达丰度数据(基因表达丰度数据是通过illumina hiseq 2000 rna测序平台获得的)。按照实施例1的步骤四计算irps评分。根据irps风险评分的最佳分界点(cut off值为1.421925),将患者分两个风险亚组,irps风险评分大于cut off值的患者归属为高风险亚组,irps风险评分小于或等于cut off值的患者归属为低风险亚组。
[0079]
获取各个ccrcc样本相关患者的后续生存数据(即从手术日期开始计的生存时间)。
[0080]
二、对患者的临床病理特征和irps亚组情况进行分析
[0081]
相关患者的临床病理特征和irps亚组(根据irps风险评分归属的高风险亚组或者低风险亚组)见表3。临床病理特征:年龄、性别、肿瘤侧性、肿瘤分级、肿瘤分期、t分期、n分期和m分期。
[0082]
表3 临床病理特征和irps亚群
[0083][0084]
irps风险评分与除性别外的所有特征有关。ccrcc以男性居多(344,64.9%),平均年龄60.6岁。大约一半的患者在没有远处转移和ii-iii级疾病的早期诊断。高风险亚组共169例患者,低风险亚组共361例患者。高风险亚组的平均年龄(62.4
±
12.3岁)高于低风险亚组(59.7
±
11.9岁)(p=0.015)。高风险亚组患者可能为左侧性,iii-iv分级,iii-iv分期。高风险亚组患者发生远处转移的概率高于低风险亚组。高风险亚组倾向于表现为晚期(iii-iv期,62.7%)和病理分级差(iii-iv级,77.5%),这与较差的生存结果相关。
[0085]
单因素和多因素cox回归分析的结果见表4。irps风险评分是一个独立的预后预测生物标志物。单因素cox比例风险回归分析显示年龄、分级、分期、t、n、m和irps风险评分似乎与生存显著相关(见图1的a),多因素cox比例风险回归分析显示年龄和irps风险评分为独立因素,与生存显著相关(见图1的b),证实即使忽略其他干扰因素,irps风险评分仍是预后的独立标志。
[0086]
表4 单因素和多因素cox回归分析
[0087][0088]
三、应用irps评分进行预后
[0089]
530例ccrcc样本的10个基因表达丰度数据、irps评分数据、相关患者的风险亚组归属情况、生存时间以及生存状态见表5。生存状态中,1代表统计数据时已死亡,0代表统计数据时尚存活。生存时间指的是患者从手术当天开始计至统计数据时生存经历的时间,生存时间为0是由于患者手术刚结束。
[0090]
表5
[0091]
[0092]
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102][0103]
两个风险亚组的km生存曲线见图2。km生存曲线显示,低危亚组的生存结果优于高危亚组(p《0.001)。
[0104]
将高危亚组的患者预测为死亡,将低危亚组的患者预测为生存。根据患者的真实生存状况制作roc曲线,结果见图3。1年生存期的roc曲线auc为0.814,2年生存期的roc曲线auc为0.756,3年生存期的roc曲线auc为0.773,提示irps评分对生存结局的预测具有较高的准确性。
[0105]
对比例、
[0106]
实施例2中的530例ccrcc样本,获取18个基因表达丰度数据(基因表达丰度数据是通过illumina hiseq 2000 rna测序平台获得的)。建立18个基因模型并进行生存预测,根据患者的真实生存状况绘制3年生存期的roc曲线。18个基因记载于如下文献:li,g.,et al.,identification of an independent immune-genes prognostic index for renal cell carcinoma.bmc cancer,2021.21(1):p.746.。
[0107]
实施例2中的530例ccrcc样本,通过tide打分进行生存预测。根据患者的真实生存状况绘制3年生存期的roc曲线。
[0108]
对比irps风险评分、18基因模型以及tide打分对于530例ccrcc样本的相关患者3年预后预测的roc曲线见图4。
[0109]
irps风险评分,auc=0.773。
[0110]
18基因模型评分,auc=0.556。
[0111]
tide打分评分,auc=0.539。
[0112]
实施例3、
[0113]
采用肿瘤免疫功能障碍与免疫排斥(tide)评分(http://tide.dfci.harvard.edu/)来确定irps评分对免疫治疗疗效的预测价值。
[0114]
见图5。irps评分归属为高危亚组的患者与较高的tide评分相关(p《0.001)。因此,irps评分归属于高危亚组的患者可能有更多的肿瘤免疫功能障碍和排斥的可能性,可能无法从免疫治疗中获益。
[0115]
上述10个基因,物种均为homo sapiens(human),具体信息见表6。
[0116]
表6
[0117][0118]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。