1.本发明涉及层状双氢氧化物电子化合物及其制造方法。
2.本技术基于2020年2月17日在日本提出申请的特愿2020-024751号主张优先权,将其内容援引于此。
背景技术:
3.电子化合物(electride,也称为电子化物)是指电子作为阴离子发挥作用的物质(例如,非专利文献1)。
4.电子化合物中所包含的电子不属于特定的轨道而局部存在,因此其具有与1价阴离子同样的电荷并且由于其质量小而表现出量子力学的行为,因此,其物性受到了关注。具体而言,基于来源于其低功函数的高给电子能力等的特征,对其应用的关注逐渐提高。
5.作为于常温稳定的电子化合物,例如,可举出使用被称为“钙铝石型化合物”的无机化合物而得到的电子化合物(专利文献1、非专利文献2)。
[0006]“钙铝石型化合物”是以ca、al、o为构成成分的铝硅酸钙,并且是所谓具有与钙铝石同型的晶体结构的化合物。就上述钙铝石型化合物而言,其代表组成由12cao
·
7al2o3(c12a7)表示,并具有在通过其晶体骨架形成的笼内的空间中包含有2个氧原子作为“自由氧”的结构。利用电子对上述钙铝石型化合物中的自由氧进行取代而得的钙铝石型化合物为电子化合物(以下称为c12a7电子化合物)(专利文献1、非专利文献2)。将c12a7单晶、粉末或薄膜在钛金属中进行高温热处理,由此能够制造c12a7电子化合物(专利文献2)。
[0007]
此外,报道了由铝化合物及锶化合物(12sro
·
7al2o3)形成的s12a7电子化合物,就s12a7电子化合物而言,报道了具有在还原性气氛下于1150℃~1530℃的范围的温度进行还原热处理的工序的制造方法(专利文献3)。s12a7电子化合物具有由12sro
·
7al2o3表示的代表组成,并具有利用三维连接而成的骨架所形成的空隙(笼)。该笼中内含阴离子及电子,由此呈现出导电性。
[0008]
此外,除了c12a7电子化合物、s12a7电子化合物以外,还公开了作为层状化合物的ca2n(专利文献4、非专利文献4)、y2c(非专利文献5)这样的于常温稳定的电子化合物。报道了这些物质中电子被封闭在其晶体结构中的笼内、或者被封闭在晶体的层间。来自ca2n或y2c的电子化合物需要例如1000℃以上的高温处理。
[0009]
发现上述电子化合物例如能够通过担载ru等过渡金属而作为催化剂使用,特别是成为具有良好的氨合成能力的催化剂(非专利文献3、专利文献5、6)。此外,报道了使用电子化合物的电子发射元件(专利文献2)、使用非晶电子化合物c12a7:e-的硅系薄膜半导体装置(专利文献7)、具有由c12a7电子化合物构成的层的太阳能电池及薄膜晶体管这样的半导体元件(专利文献8)。
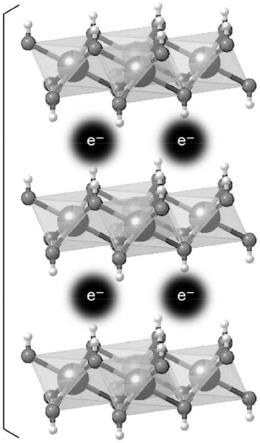
[0010]
另一方面,与粘土矿物不同,层状双氢氧化物(layered double hydroxide,以下有时简称为ldh。)的层具有正电荷,在层间具有阴离子,并具有阴离子交换性(非专利文献6)。就层状双氢氧化物而言,可以在结构的层间插入(intercalate)阴离子。
[0011]
层状双氢氧化物可以是天然物、或者合成物。天然的层状双氢氧化物中最常见的阴离子是碳酸根离子。但是,关于合成ldh,在理论上可掺入广泛种类的层间阴离子(从卤化物离子、硝酸根离子或者硫酸根离子这样的小无机阴离子,直至有机阴离子及复杂的2分子)。
[0012]
市售的层状双氢氧化物为通式[mg6al2(oh)
16
]co3·
4h2o的mg-al碳酸型水滑石。图8示出由式:mg4al2(oh)
16
co3(h2o)
4 x
表示的、具有水滑石的层状结构的层状双氢氧化物的结构。
[0013]
现有技术文献
[0014]
专利文献
[0015]
专利文献1:国际公开第2005/000741号
[0016]
专利文献2:国际公开第2007/060890号
[0017]
专利文献3:日本特开2018-154505号公报
[0018]
专利文献4:日本特开2014-24712号公报
[0019]
专利文献5:国际公开第2012/077658号
[0020]
专利文献6:国际公开第2014/034473号
[0021]
专利文献7:日本特开2016-157856号公报
[0022]
专利文献8:国际公开第2018/066483号
[0023]
非专利文献
[0024]
非专利文献1:j.l.dye,science 301 607-608(2003)。
[0025]
非专利文献2:s.matsuishi,y.toda,m.miyakawa,k.hayashi,t.kamiya,m.hirano,i.tanaka and h.hosono,science 301,626(2003)。
[0026]
非专利文献3:m.kitano,y.inoue,y.yamazaki,f.hayashi,s.kanbara,s.matsuishi,t.yokoyama,s.kim,m.hara and hideo hosono,nature chem.4,934(2012)。
[0027]
非专利文献4:k.lee,s.w.kim,y.toda,s.matsuishi and h.hosono,nature 494,336(2013).
[0028]
非专利文献5:x.zhang,z.xiao,h.lei,y.toda,s.matsuishi,t.kamiya,s.ueda and h.hosono,chem.mat.26,6638(2014)。
[0029]
非专利文献6:日比野俊行、水滑石的合成和利用、粘土科学第45卷第2号、102-109(2006)。
技术实现要素:
[0030]
发明所要解决的课题
[0031]
由于专利文献1等中记载的电子化合物在高温条件下进行制造,因此存在装置方面、成本方面的负担大的问题。
[0032]
另一方面,由于层状双氢氧化物的层状结构于高温不稳定,因此不能在还原气氛中进行高温处理。没有涉及由层状双氢氧化物形成的电子化合物的方案。
[0033]
需要能够在更低温条件下、工业上廉价地制造的电子化合物。
[0034]
用于解决课题的手段
[0035]
本技术的发明人发现通过与位于层状双氢氧化物的层间的阴离子进行交换,使电
子(e-)插入,即使没有高温处理也可进行制造、能够降低制造成本的本发明的层状双氢氧化物电子化合物,从而完成了本发明。
[0036]
进而,在将本发明的层状双氢氧化物电子化合物作为催化剂使用的情况下,通过避免了高温处理,其表面积增大,结果,也能够使反应活性点增加。
[0037]
即本发明的要旨为:
[0038]
[1]层状双氢氧化物电子化合物,其在层间包含电子,所述层状双氢氧化物电子化合物的电子密度为2.0
×
10
18
cm-3
以上。[2]如[1]所述的层状双氢氧化物电子化合物,其中,上述层状双氢氧化物电子化合物为通式(1)表示的层状双氢氧化物电子化合物。
[0039]
[m
p 1-xnq x
(oh)2]
a
[a
r-(b-y)
e-y
]
·
mh2o
ꢀꢀꢀꢀ
(1)
[0040]
(式(1)中,
[0041]
m为能形成至少1价金属阳离子的金属元素,
[0042]
n为与m不同的能形成至少1价金属阳离子的金属元素,
[0043]
a为能形成至少1价阴离子的原子或原子团,
[0044]
p为1或2,
[0045]
q为3或4,
[0046]
r为1~3,
[0047]
0《x《0.9,
[0048]
a=p
×
(1-x) x
×
q-2,
[0049]
b≥a/r,
[0050]
0《y≤b,并且
[0051]
0≤m≤10。)
[0052]
[3]层状双氢氧化物电子化合物的制造方法,其包括将原料层状双氢氧化物与电子交换剂混合而生成层状双氢氧化物电子化合物的工序,上述电子交换剂是利用电子对存在于上述原料层状双氢氧化物的层间的阴离子进行交换的电子交换剂。
[0053]
[4]如[3]所述的层状双氢氧化物电子化合物的制造方法,其中,上述电子交换剂为冠醚化合物与具有碱金属的thf系有机溶剂的混合液。[5]如[3]或[4]所述的层状双氢氧化物电子化合物的制造方法,其中,上述层状双氢氧化物电子化合物为通式(1)表示的层状双氢氧化物电子化合物,
[0054]
上述原料层状双氢氧化物为通式(2)表示的层状双氢氧化物。
[0055]
[m
p 1-xnq x
(oh)2]
a
[a
r-(b-y)
e-y
]
·
mh2o
ꢀꢀꢀꢀ
(1)
[0056]
(式(1)中,
[0057]
m为能形成至少1价金属阳离子的金属元素,
[0058]
n为与m不同的能形成至少1价金属阳离子的金属元素,
[0059]
a为能形成至少1价阴离子的原子或原子团,
[0060]
p为1或2,
[0061]
q为3或4,
[0062]
r为1~3,
[0063]
0《x《0.9,
[0064]
a=p
×
(1-x) x
×
q-2,
[0065]
b≥a/r,
[0066]
0《y≤b,并且
[0067]
0≤m≤10。)
[0068]
[m
p 1-xnq x
(oh)2]
a
[a
r-b
]
·
mh2o
ꢀꢀꢀꢀ
(2)
[0069]
(式(2)中,
[0070]
m、n、a、p、q、r、x、a、b、y、m与式(1)中的m、n、a、p、q、r、x、a、b、y、m含义相同)
[0071]
[6]如[4]~[5]中任一项所述的层状双氢氧化物电子化合物的制造方法,其中,上述冠醚化合物为选自由15-冠-5-醚、12-冠-4-醚及18-冠-6-醚组成的组中的至少1种冠醚化合物。
[0072]
[7]如[4]~[5]中任一项所述的层状双氢氧化物电子化合物的制造方法,其中,上述碱金属为钠。
[0073]
[8]如[4]~[5]中任一项所述的层状双氢氧化物电子化合物的制造方法,其中,上述冠醚化合物为选自由15-冠-5-醚、12-冠-4-醚及18-冠-6-醚组成的组中的至少1种冠醚化合物,
[0074]
上述碱金属为钠。
[0075]
[9]如[4]~[8]中任一项所述的层状双氢氧化物电子化合物的制造方法,其包括:
[0076]
将碱金属的thf系溶剂与上述冠醚混合而得到混合液的混合工序;
[0077]
向上述混合液添加原料层状双氢氧化物,生成层状双氢氧化物电子化合物的生成工序;
[0078]
对通过上述生成工序而得到的层状双氢氧化物电子化合物进行洗涤的洗涤工序;和
[0079]
对通过上述洗涤工序而得到的层状双氢氧化物电子化合物进行干燥的干燥工序。
[0080]
发明效果
[0081]
由于本发明的层状双氢氧化物电子化合物即使没有高温处理也可制造,因此能够降低制造成本。
附图说明
[0082]
[图1]为示出本发明的一实施方式的层状双氢氧化物电子化合物的层状结构的示意图。
[0083]
[图2]为对本发明的一实施方式的层状双氢氧化物电子化合物的制造方法进行说明的示意图。
[0084]
[图3]为对本发明的一实施方式的制造层状双氢氧化物电子化合物的工序进行说明的示意图。
[0085]
[图4]为在实施例1及2中得到的层状双氢氧化物电子化合物的吸收光谱。
[0086]
[图5]为在实施例1中得到的层状双氢氧化物ft-ir的吸收光谱。
[0087]
[图6]为在实施例1及2中得到的层状双氢氧化物xrd图案。
[0088]
[图7]为在实施例1及2中得到的层状双氢氧化物esr光谱。
[0089]
[图8]为示出作为层状双氢氧化物的一种的水滑石的层状结构的示意图。
具体实施方式
[0090]
(层状双氢氧化物电子化合物)
[0091]
本发明的层状双氢氧化物电子化合物在层间包含电子,且电子密度为2.0
×
10
18
cm-3
以上。优选为2.0
×
10
18
cm-3
以上2.0
×
10
22
cm-3
以下的范围。此外,通式(1)表示的权利要求1所述的层状双氢氧化物电子化合物是优选的。
[0092]
[m
p 1-xnq x
(oh)2]
a
[a
r-(b-y)
e-y
]
·
mh2o
ꢀꢀ
(1)
[0093]
(式(1)中,
[0094]
m为能形成至少1价金属阳离子的金属元素,
[0095]
n为与m不同的能形成至少1价金属阳离子的金属元素,
[0096]
a为能形成至少1价阴离子的原子或原子团,
[0097]
p为1或2,
[0098]
q为3或4,
[0099]
r为1~3,
[0100]
0《x《0.9,
[0101]
a=p
×
(1-x) x
×
q-2,
[0102]
b≥a/r,
[0103]
0《y≤b,并且
[0104]
0≤m≤10。)
[0105]
在此,m
p
是指金属阳离子,n
q
是指金属阳离子,a
r-是指阴离子。
[0106]
上述式(1)中,m选自由作为2价金属的mg、zn、fe、ca、ni、cu、co、mn及cd、以及作为1价金属的li组成的组中的至少1种是优选的。m选自由mg、ca及zn组成的组中的至少1种是更优选的。
[0107]
上述式(1)中,n选自由作为3价金属的al、ga、y、in、fe、co、ni、mn、cr、ti、v及la、以及作为4价金属的sn、ti及zr组成的组中的至少1种是优选的。n为al是更优选的。
[0108]
x为0.18《x《0.9是优选的,为0.18《x《0.5是更优选的,为0.18《x《0.4是进一步优选的,为0.2《x《0.33是最优选的。
[0109]
上述式(1)表示的层状双氢氧化物为zn/al、mg/al、znmg/al、ni/ti、mg/fe、ca/al、ni/al或cu/al层状双氢氧化物。
[0110]
层状双氢氧化物中的a可以为能形成任意的适当的有机或无机阴离子(例如,卤化物阴离子(例如,氯化物离子)、无机氧阴离子(例如,碳酸根离子、碳酸氢根离子、磷酸氢根离子、磷酸二氢根离子、亚硝酸根离子、硼酸根离子、硝酸根离子、磷酸根离子、硫酸根离子)等)的原子或原子团、阴离子性表面活性剂(十二烷基硫酸钠、脂肪酸盐或硬脂酸钠等)、阴离子性生色团、及/或阴离子性uv吸收剂,例如,4-羟基-3-10甲氧基苯甲酸、2-羟基-4-甲氧基二苯甲酮-5-磺酸(hmba)、4-羟基-3-甲氧基肉桂酸、对氨基苯甲酸及/或尿刊酸(urocanic acid)。a优选为能形成选自碳酸根离子、碳酸氢根离子、磷酸氢根离子、磷酸二氢根离子、亚硝酸根离子、硼酸根离子、硝酸根离子、硫酸根离子或磷酸根离子或者它们之中2个以上的混合物的无机氧阴离子等的原子或原子团。更优选地,a为能形成选自碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子的无机氧阴离子等的原子或原子团。进一步优选地,a为能形成卤化物阴离子的原子或原子团。
[0111]
在本发明的一实施方式中,m为ca、mg、zn或fe,n为al,a为能形成碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子等的原子团。优选地,m为ca、mg或zn,n为al,a为能形成碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子等的原子团。更优选地,m为ca、mg或zn,n为al,a为能形成氯化物离子的原子。
[0112]
在本发明的一实施方式中,通式(3)表示的层状双氢氧化物电子化合物是优选的。
[0113]
[m
2 1-xn3 x
(oh)2][a
r-((x/r)-y)
e-y
]
·
mh2o
ꢀꢀ
(3)
[0114]
(式(3)中,m、n、a、r、x、y、m与式(1)中的m、n、a、r、x、y、m含义相同。)
[0115]
在本发明的一实施方式中,通式(4)表示的层状双氢氧化物电子化合物是更优选的。
[0116]
[mg
2 1-x
al
3 x
(oh)2][cl-((x-y)
e-y
]
·
mh2o
ꢀꢀ
(4)
[0117]
(式(4)中,x、y、m与式(1)中的x、y、m含义相同,y≤x。)
[0118]
在本发明的一实施方式中,通式(5)表示的层状双氢氧化物电子化合物是进一步优选的。
[0119]
[mg
1-x
al
x
(oh)2][e-x
]
·
mh2o(5)
[0120]
(式(5)中,x、y、m与式(1)中的x、y、m含义相同。)
[0121]
m为0≤m≤7.5是优选的,为0≤m≤5是更优选的,为0≤m≤3是进一步优选的,为0≤m≤1是最优选的。需要说明,对于使用实施了预先脱水处理的原料层状双氢氧化物而制备得到的层状双氢氧化物电子化合物而言,可期待其抑制了利用离子交换而被导入的溶剂化电子的失活的效果,因此是优选的,具体而言,例如,只要是实质上为m=0的层状双氢氧化物电子化合物,就能够作为长时间、于常温稳定的电子化合物而利用。
[0122]
在本发明的一实施方式中,层状双氢氧化物电子化合物的bet比表面积为10m2/g以上是优选的,为30m2/g以上是更优选的,为50m2/g以上是进一步优选的,为100m2/g以上是最优选的。
[0123]
bet比表面积可以通过氮吸附法等来进行评价。在实施例中详细说明。
[0124]
在本发明的一实施方式中,层状双氢氧化物电子化合物的振实密度只要在作为目标的使用情况下具有其效果,就没有特别限制,例如,是通常的范围即可。
[0125]
在本发明的一实施方式中,层状双氢氧化物电子化合物的电子密度可举出例如2.0
×
10
18
cm-3
以上2.0
×
10
22
cm-3
以下的范围。优选地,可举出5.0
×
10
18
cm-3
以上2.0
×
10
21
cm-3
以下的范围。需要说明,原料层状双氢氧化物为mg6al2oh
16
cl2的情况下,由于正电荷比成为mg:al=2:1,因此,其层状双氢氧化物电子化合物的电子密度的具体的上限值可举出例如1.1
×
10
22
cm-3
。
[0126]
层状双氢氧化物电子化合物的电子密度可通过碘滴定法来测定。
[0127]
该碘滴定法是在5mol/l的碘水溶液中加入待评价对象样品,加入盐酸使其溶解后,利用硫代硫酸钠滴定检出该溶液中包含的未反应的碘的量的方法。在这种情况下,通过样品的溶解,碘水溶液中的碘通过以下的反应而离子化。
[0128]
i2 e-→
2i-ꢀꢀꢀꢀ
(6)
[0129]
此外,在利用硫代硫酸钠来滴定碘水溶液的情况下,通过下述式(7)所示的反应,未反应的碘转化为碘化钠。
[0130]
2na2s2o3 i2→
2nai na2s4o6ꢀꢀꢀꢀ
(7)
[0131]
通过从最初的溶液中存在的碘量减去利用式(7)滴定检出的碘量,计算出通过式(6)的反应所消耗的碘量。基于此,能够测定评价对象的层状双氢氧化物电子化合物的电子密度。
[0132]
例如,通过上述方法,测定在实施例1中所得的层状双氢氧化物电子化合物(238h)的电子离子密度,其结果为6.53
×
10
20
cm-3
。
[0133]
本发明的一实施方式的层状双氢氧化物电子化合物为黑色粉末状。这是因为其在可见光区域具有强的吸收。
[0134]
本发明的层状双氢氧化物电子化合物的可见
·
紫外吸收光谱通过使用积分球的漫反射法进行测定。照射于试样的光一部分被吸收一部分被反射。通过检出该被反射的光,能够知晓试样吸收了哪个波长的光。测定通过紫外可见分光光度计(日立、u4000)来进行,测定了185~2500nm的范围。
[0135]
《可见
·
紫外吸收光谱的测定方法>
[0136]
图4示出作为原料的离子交换前的含有氯化物离子的层状双氢氧化物、实施例1的层状双氢氧化物电子化合物(238h)、实施例2的层状双氢氧化物电子化合物(167h)的吸收光谱。原料的层状双氢氧化物为白色的粉末,该波长区域内几乎观察不到吸收,而实施例1及实施例2的层状双氢氧化物电子化合物在600~2000nm范围观察到强的吸收。这与由c12a7电子化合物的电子引起的吸收非常相似。也即,认为通过发生了原料中包含的氯化物离子(cl-)与溶剂化电子之间的离子交换,在层间插入了电子。此外,通过该实验还可见,层状双氢氧化物的骨架的氧离子脱离而形成了氧缺陷(f中心),在600~2000nm范围不呈现强的吸收。
[0137]
本发明的层状双氢氧化物电子化合物可以通过傅里叶变换红外分光法(ft-ir)进行分析。
[0138]
例如,图5示出了实施例1的层状双氢氧化物电子化合物(238h)和原料层状双氢氧化物的ftir吸收光谱。均观测到3600cm-1
的由oh基而引起的吸收,可见层状双氢氧化物在电子化合物化后也残留有oh基。
[0139]
详细的测定方法在实施例部分进行说明。
[0140]
本发明的层状双氢氧化物电子化合物可以通过粉末xrd图案来观察相对原料层状双氢氧化物的结构变化。例如,在实施例1(238h)、实施例2(167h)中得到的层状双氢氧化物电子化合物的xrd图案(图6)中,与原料层状双氢氧化物的xrd图案进行比较。即使将原料层状双氢氧化物进行电子化合物化,也维持了基本的晶体结构。但是,观测到衍射峰位置稍微向高角度侧偏移,因此可以推测由于离子半径比氯化物离子小的电子进入了层间,由此使层间距离减少。
[0141]
另外,这样的离子交换的平衡常数的大小随着氯化物离子等阴离子所具有的离子半径的减少而增加,例如,可以以oh-》f-》cl-》br-》no
3-》i-的顺序进行例示。
[0142]
详细的测定方法在实施例部分进行说明。
[0143]
本发明的层状双氢氧化物电子化合物的利用电子自旋共振(esr)的分析的结果如下所述。
[0144]
例如,图7示出实施例1的层状双氢氧化物电子化合物(238h)的esr光谱。由于通常的层状双氢氧化物不具有未成对电子,因此看不到esr信号,而就层状双氢氧化物电子化合
物(238h)而言,观察到来源于未成对电子的信号。该光谱与在c12a7电子化合物中所见到的光谱相同。由此也认为,通过本发明的方法,能够将层状双氢氧化物中的氯化物离子交换为电子。
[0145]
在图1中示出了本发明的一实施方式的层状双氢氧化物电子化合物结构的示意图。从xrd及ft-ir的结果认为,由层状双氢氧化物的mg-o-al形成的基本骨架几乎没有变化,具有多个oh基的方面也没有变化。另一方面,根据层间隔因由溶剂化电子引起的离子交换而稍微缩小的方面以及esr及碘滴定的结果,表明在层间存在电子,成为了电子化合物。
[0146]
[层状双氢氧化物电子化合物的制造方法]
[0147]
本发明的层状双氢氧化物电子化合物的制造方法包括将原料层状双氢氧化物和利用电子对存在于上述原料层状双氢氧化物的层间的阴离子进行交换的电子交换剂混合而生成层状双氢氧化物电子化合物的工序。
[0148]
上述电子交换剂为冠醚化合物、与具有碱金属的thf系有机溶剂的混合液是优选的。也即,本发明的层状双氢氧化物电子化合物的制造方法包括将冠醚化合物、和具有碱金属的thf系有机溶剂、原料层状双氢氧化物混合而生成层状双氢氧化物电子化合物的工序是优选的。
[0149]
上述层状双氢氧化物电子化合物为通式(1)表示的层状双氢氧化物电子化合物是优选的。
[0150]
[m
p 1-xnq x
(oh)2]
a
[a
r-(b-y)
e-y
]
·
mh2o
ꢀꢀꢀꢀ
(1)
[0151]
(式(1)中,
[0152]
m为能形成至少1价金属阳离子的金属元素,
[0153]
n为与m不同的能形成至少1价金属阳离子的金属元素,
[0154]
a为能形成至少1价阴离子的原子或原子团,
[0155]
p为1或2,
[0156]
q为3或4,
[0157]
r为1~3,
[0158]
0.2《x《0.33,
[0159]
a=p
×
(1-x) x
×
q-2,
[0160]
b≥a/r,
[0161]
0《y≤b,并且
[0162]
0≤m≤10。)
[0163]
本发明的层状双氢氧化物电子化合物的制造方法涉及的层状双氢氧化物电子化合物的优选形态与上述说明的“层状双氢氧化物电子化合物”的优选形态相同。
[0164]
图2为对本发明的一实施方式的层状双氢氧化物电子化合物的制造方法进行说明的示意图。图2中示出了从在层间包含氯化物离子(cl-)的原料层状双氢氧化物电子化合物出发,使用冠醚化合物和钠来合成层状双氢氧化物电子化合物。
[0165]
(原料层状双氢氧化物)
[0166]
本发明的层状双氢氧化物电子化合物的制造方法涉及的原料层状双氢氧化物为通式(2)表示的原料层状双氢氧化物是优选的。
[0167]
[m
p 1-xnq x
(oh)2]
a
[a
r-b
]
·
mh2o
ꢀꢀꢀꢀ
(2)
[0168]
(式(2)中,m、n、a、p、q、r、x、a、b、m与式(1)中的m、n、a、p、q、r、x、a、b、m含义相同。)
[0169]
在此,m
p
是指金属阳离子,n
q
是指金属阳离子,a
r-是指阴离子。上述式(2)中,m选自由作为2价金属的mg、zn、fe、ca、ni、cu、co、mn及cd、以及作为1价金属的li组成的组中的至少1种是优选的。m为由选自mg、ca及zn组成的组中的至少1种是更优选的。
[0170]
上述式(2)中,n选自由作为3价金属的al、ga、y、in、fe、co、ni、mn、cr、ti、v及la、以及作为4价金属的sn、ti及zr组成的组中的至少1种是优选的。n为al是更优选的。
[0171]
x为0.18《x《0.9是优选的,为0.18《x《0.5是更优选的,为0.18《x《0.4是进一步优选的。
[0172]
作为上述式(2)表示的具体的原料层状双氢氧化物,可举出zn/al、mg/al、zn/mg/al、ni/ti、mg/fe、ca/al、ni/al或cu/al等的(原料)层状双氢氧化物。
[0173]
原料层状双氢氧化物中的a也可以为能形成任意的适当的有机或无机阴离子(例如,卤化物(例如,氯化物)、无机氧阴离子(例如,碳酸根离子、碳酸氢根离子、磷酸氢根离子、磷酸二氢根离子、亚硝酸根离子、硼酸根离子、硝酸根离子、磷酸根离子、硫酸根离子)等)的原子或原子团、阴离子性表面活性剂(十二烷基硫酸钠、脂肪酸盐或硬脂酸钠等)、阴离子性生色团、及/或阴离子性uv吸收剂,例如,4-羟基-3-10甲氧基苯甲酸、2-羟基-4-甲氧基二苯甲酮-5-磺酸(hmba)、4-羟基-3-甲氧基肉桂酸、对氨基苯甲酸及/或尿刊酸。a优选为能形成选自碳酸根离子、碳酸氢根离子、磷酸氢根离子、磷酸二氢根离子、亚硝酸根离子、硼酸根离子、硝酸根离子、硫酸根离子或磷酸根离子或者它们之中的2个以上的混合物的无机氧阴离子等的原子团。更优选地,a为能形成选自碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子的无机氧阴离子等的原子团。进一步优选地,a为能形成氯化物离子的原子。
[0174]
在本发明的一实施方式中,m为ca、mg、zn或fe,n为al,a为能形成碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子等的原子团。优选地,m为ca、mg或zn,n为al,a为能形成碳酸根离子、碳酸氢根离子、硝酸根离子或亚硝酸根离子等的原子团。更优选地,m为ca、mg或zn,n为al,a为能形成碳酸根离子的原子团。
[0175]
在本发明的一实施方式中,通式(8)表示的原料层状双氢氧化物是优选的。
[0176]
[m
2 1-xn3 x
(oh)2][a
r-(x/r)
]
·
mh2o
ꢀꢀꢀꢀ
(8)
[0177]
(式(8)中,m、n、a、r、x、m与式(1)中的m、n、a、r、x、m含义相同。)
[0178]
在本发明的一实施方式中,通式(9)表示的原料层状双氢氧化物是更优选的。
[0179]
[mg
2 1-x
al
3 x
(oh)2][cl-(x-y)
]
·
mh2o
ꢀꢀꢀꢀ
(9)
[0180]
(式(9)中,x、y、m与式(1)中的x、y、m含义相同,y≤x。)
[0181]
m为0≤m≤7.5是优选的,0≤m≤5是更优选的,式0≤m≤3是进一步优选的,0≤m≤1是最优选的。需要说明,就原料层状双氢氧化物而言,可以使用实施了预先脱水处理的物质。作为上述的脱水处理,可举出例如,进行200℃左右的加热下约6小时的真空排气的方法。这样的情况下,得到了实质上m=0的原料层状双氢氧化物,可期待对由于离子交换而导入的溶剂化电子的失活进行抑制的效果。
[0182]
在本发明的一实施方式中,原料层状双氢氧化物的bet比表面积为10m2/g以上是优选的,为30m2/g以上是更优选的,为50m2/g以上是进一步优选的,为100m2/g以上是最优选的。
[0183]
bet比表面积可以通过氮吸附法等来进行评价。在实施例中详细说明。
[0184]
在本发明的一实施方式中,原料层状双氢氧化物的振实密度只要在所制造的层状双氢氧化物电子化合物在作为目标的使用情况下具有其效果,就没有特别限制,例如,只要是通常的范围即可。
[0185]
(电子交换剂)
[0186]
就本发明的制造方法涉及的电子交换剂而言,只要能够从上述原料层状双氢氧化物中利用电子使存在于层间的阴离子进行交换则没有限定。于100℃以下利用电子使存在于层间的阴离子进行交换是优选的,于50℃以下利用电子使存在于层间的阴离子进行交换是更优选的。电子交换剂可以根据存在于层间的阴离子的种类而进行适当的选择。可举出例如冠醚化合物与具有钠等碱金属的thf系有机溶剂的混合液;液体氨与钠等碱金属的混合物;萘酸钠等的碱金属萘酸盐。特别是,在上述原料层状双氢氧化物的层间阴离子为氯化物离子的情况下,电子交换剂为冠醚化合物与具有钠等碱金属的thf系有机溶剂的混合液是优选的。
[0187]
(冠醚化合物)
[0188]
本发明的一实施方式涉及的冠醚化合物只要是环状的聚醚,并且是通过供电子性的氧原子使环整体成为多齿配体并具有将碱金属的离子引入环的空穴内的功能的化合物即可,没有特别限定。
[0189]
作为这些化合物,可举出例如,12-冠-4、15-冠-5、18-冠-6、苯并18-冠-6、苯并15-冠-5、二苯并18-冠-6、二苯并18-冠-3、二苯并24-冠-8、二苯并30-冠-10、二环己烷并18-冠-6、二环己烷并24-冠-8等。其中,优选地可举出12-冠-4、15-冠-5、18-冠-6、苯并18-冠-6、二苯并18-冠-6、二环己烷并18-冠-6等,进一步优选地可举出12-冠-4、15-冠-5、18-冠-6等,特别优选地可举出18-冠-6。
[0190]
所引入的碱金属离子优选为例如钾离子、钠离子、锂离子等。更优选为钾离子、钠离子等。此外,冠醚化合物也可以根据需要并用2种以上。在上述原料层状双氢氧化物的层间阴离子为氯化物离子的情况下,包含选自由15-冠-5-醚、12-冠-4-醚及18-冠-6-醚组成的组中的至少1种冠醚化合物是优选的。
[0191]
(thf系有机溶剂)
[0192]
thf系有机溶剂选自由thf、methf及dimethf组成的组中的至少1种是优选的。
[0193]
(反应条件)
[0194]
本发明的制造方法中的反应温度为-50~100℃是优选的,为0~50℃是更优选的,为10~30℃是进一步优选的。反应压力没有特别限制,例如可以为大气压。
[0195]
反应时间通常为20~500小时,50~400小时是优选的,170~300小时是更优选的。
[0196]
反应体系的气氛没有特别限制,从安全性的观点出发避免氧气,此外从避免对粒径
·
纵横比(aspect ratio)产生影响的二氧化碳等的混入的观点出发,使反应体系在氮、氩等的非活性气体气氛下进行是优选的。
[0197]
反应可以在搅拌下进行,也可以在静置下进行,还可以进行外部循环等。
[0198]
反应完成后,将反应完成物固液分离,利用规定的溶剂进行洗涤,由此能够得到作为目标的层状双氢氧化物电子化合物。
[0199]
(加入量)
[0200]
在本发明的制造方法的一实施方式中,例如,在将冠醚化合物与碱金属的thf系溶
剂混合而使用混合液作为电子交换剂而使用作为1价阴离子的氯化物离子(cl-)的情况下,相对于层状双氢氧化物的氯化物离子1摩尔数而言,冠醚为1摩尔以上、碱金属为1摩尔以上是优选的。冠醚为5摩尔以上、碱金属为5摩尔以上是更优选的。此外,从得到电子密度更高的电子化合物的观点出发,冠醚为10摩尔以上、碱金属为10摩尔以上是进一步优选的。
[0201]
thf系溶剂的使用量没有特别限定,但相对于碱金属0.23g而言,为10ml是优选的,为20ml是更优选的。
[0202]
本发明的层状双氢氧化物电子化合物的制造方法进一步包括洗涤工序和干燥工序是优选的。也即,本发明的层状双氢氧化物电子化合物的制造方法的一实施方式优选地包括将上述冠醚、碱金属的thf系溶剂混合而得到混合液的混合工序;在上述混合液中添加原料层状双氢氧化物,生成层状双氢氧化物电子化合物的生成工序和对通过上述生成工序而得到的层状双氢氧化物电子化合物进行洗涤的洗涤工序;对通过上述洗涤工序而得到的层状双氢氧化物电子化合物进行干燥的干燥工序。图3为对本发明的一实施方式的制造层状双氢氧化物电子化合物的工序进行说明的示意图。
[0203]
作为本发明的一实施方式中的洗涤工序,离子交换完成后、向特氟龙(注册商标)制的离心管投入溶液,使用离心分离机以20000g、保持时间5分钟的条件进行离心分离。取出除去上清液,投入thf,搅拌离心管后,在相同条件下进行离心分离。重复该操作3次,除去杂质冠醚。这些操作在ar气氛的手套箱中进行。
[0204]
作为本发明的一实施方式中的干燥方法,可举出真空干燥、加热干燥、吹送干燥等。
[0205]
例如,对于通过上述洗涤工序而得到的层状双氢氧化物电子化合物而言,一边于室温~80℃(作为一例,50℃)进行12~24小时加热一边进行真空排气处理,由此得到粉末状的层状双氢氧化物电子化合物。
[0206]
作为本发明的层状双氢氧化物电子化合物的用途,可举出以下的实例。但是,不限于以下的实例。
[0207]
《作为高功能催化剂的用途>
[0208]
在例如包含氢(h2)活化的化学反应、包含氮活化(n2)的化学反应、氨化反应、从二氧化碳出发制造(作为化学原料有用的)一氧化碳的反应、从酮化合物出发制造仲醇或二酮化合物的还原反应、从羰基化合物出发制造二醇或聚二醇的还原偶联反应等化学反应中,将本发明的层状双氢氧化物电子化合物用作化学反应的催化剂。
[0209]
作为包含氢(h2)活化的化学反应,可举出例如,烯烃、芳香族化合物、炔系化合物、醛、羧酸、酯、亚胺、腈、硝基化合物、硝酸、羧酸酰氯(carboxylic acid chloride)、醚及/或缩醛(acetal)的化合物的氢化反应。
[0210]
在将本发明的层状双氢氧化物电子化合物作为化学反应的催化剂利用的情况下,优选地可举出例如作为用于200℃以下的化学反应的催化剂的利用。此外,优选地可举出例如作为碱催化剂或碱催化剂成分、还原剂的用途。
[0211]
本发明的层状双氢氧化物电子化合物为例如可用作能够从水等出发产生氢的氢产生催化剂。
[0212]
《作为电子材料的用途>
[0213]
作为本发明的层状双氢氧化物电子化合物在电子材料中的用途,可举出例如,包
含具有电子化合物的导电性物质的用于冷电子发射源及有机el元件的电子注入层;或oxide-tft(氧化物tft)的源漏电极的导电性载流子材料等。
[0214]
《作为电池用材料的用途>
[0215]
作为本发明的层状双氢氧化物电子化合物的电子材料的用途,可举出例如,包含具有电子化合物的导电性物质的太阳能电池;或包含具有电子化合物的导电性物质作为铂替代催化剂的固体高分子型燃料电池等。
[0216]
实施例
[0217]
以下基于实施例对本发明进行更详细地说明。
[0218]
(比表面积的测定方法)
[0219]
以下的实施例及比较例的比表面积测定是于液氮温度使氮气吸附而测定得到的。分析条件如下所述。
[0220]“测定条件”[0221]
装置:microtracbel公司制belsorp-mini ii
[0222]
吸附气体:氮(99.99995%)
[0223]
吸附温度:液氮温度(-196℃)
[0224]
(电子浓度的测定方法)
[0225]
以下的实施例及比较例的电子浓度测定通过碘滴定法进行。条件如下所述。
[0226]
向碘溶液(0.05mol/l)3ml加入层状双氢氧化物10mg左右,向其中加入浓盐酸(35-37%)0.1ml,充分搅拌。其后,利用5mmol/l的硫代硫酸钠水溶液进行滴定。
[0227]
(紫外
·
可见吸收光谱分析)
[0228]
以下的实施例及比较例的紫外
·
可见吸收光谱通过漫反射法进行测定。分析条件如下所述。
[0229]“测定条件”[0230]
装置:日立high-technologies公司制u-4000
[0231]
测定波长:185~2500nm
[0232]
(傅里叶变换红外分光法(ft-ir)分析)
[0233]
以下的实施例及比较例的红外吸收光谱通过漫反射法进行测定。分析条件如下所述。
[0234]“测定条件”[0235]
装置:岛津制作所公司制irtracer-100
[0236]
测定波数:400~4000cm-1
[0237]
(粉末xrd分析)
[0238]
以下的实施例及比较例的x射线衍射图案使用以下的装置进行测定。分析条件如下所述。
[0239]“测定条件”[0240]
装置:bruker公司制d8 advance
[0241]
测定范围:10~50
°
[0242]
(电子自旋共振esr分析)
[0243]
以下的实施例及比较例的esr分析使用以下的装置进行测定。分析条件如下所述。
[0244]“测定条件”[0245]
装置:bruker公司制emx 8/2.7
[0246]
测定温度:室温
[0247]
(合成例1)
[0248]
就成为原料的mg6al2(oh)
16
cl2·
nh2o而言,其通过在碱性下使包含mg
2
、al
3
及cl-的溶液共沉淀来合成。alcl3·
6h2o(和光纯药公司制,试剂特级)与mgcl2·
6h2o(和光纯药公司制,试剂特级)以摩尔比3:1的比例称量,在电阻率18.2mω的超纯水中溶解搅拌。在超纯水中溶解粒状naoh(和光纯药公司制,试剂特级),制备2mol/l及0.001mol/l(ph10)的naoh水溶液。4口的特氟龙(注册商标)制圆底烧瓶中加入0.001mol/l(ph10)的naoh水溶液。圆底烧瓶的4口中,安装2个透明圆筒分液漏斗、回流管和ph计,在2个分液漏斗中分别加入溶解有alcl3及mgcl2的水溶液和2mol/l的naoh水溶液。在装置整体中通入n2气30分左右,赶出co2气体。在0.001mol/l的naoh水溶液中,在确认ph不从10大幅变动的同时,将溶解有alcl3·
6h2o及mgcl2·
6h2o的水溶液和2mol/l的naoh水溶液交替滴加,生成ldh的白色沉淀。此时以500rpm左右进行搅拌,以使溶液变得均匀的方式进行。滴加完成后,一边向回流管内通入自来水,一边将圆底烧瓶于70℃的油浴中加热半天。加热后将ldh的白浊液加入特氟龙(注册商标)制的离心管,利用离心分离机在20000g、保持时间5分钟的条件下进行离心分离。用移液管(pipette)将透明的上清液除去,在离心管中加入超纯水,进行搅拌,再次成为白浊液后,再次在相同条件下进行离心分离。通过重复三次离心分离及上清液除去的操作,将作为杂质的nacl取出除去。将得到的粉体于50℃左右进行加热,并且同时进行半天左右真空排气加热处理来进行干燥,由此得到白色粉末ldh-1。
[0249]
将其通过红外线分光分析、粉末x射线解析等方法进行分析。其结果,确认了使脱碳酸根离子被氯化物离子取代。原料层状双氢氧化物(ldh-1)的组成可由式:mg6al(oh)
16
(cl-)2表示。
[0250]
(合成例2)
[0251]“本发明的电子交换剂的制备”[0252]
《钠及thf液的准备>
[0253]
钠(na):富士胶片和光纯药公司制、纯度98%、使用量0.115g、块状(1cm
×
1cm左右)
[0254]
前处理工序:在手套箱中取出浸在油中的na块,进行用刮刀削除表面的操作。
[0255]
thf:富士胶片和光纯药公司制、纯度99.5%(已完成脱氧的物质)、加入量20ml
[0256]
《钠、thf液、15-冠-5-醚的混合>
[0257]
15-冠-5-醚:富士胶片和光纯药公司制、纯度和光一级、使用量1.1g
[0258]
在ar气氛的手套箱内用刮刀将金属na块(富士胶片和光纯药公司制,98%)的面削除,获得未氧化的纯na块。以摩尔比成为1:1的方式称量na和冠醚,投入小瓶(vial)管中。向其中投入thf(富士胶片和光纯药公司制,脱氧,不含稳定剂,99.5%)20ml。冠醚使用15-冠-5-醚(富士胶片和光纯药公司制,和光一级)。在小瓶中加入特氟龙(注册商标)制的搅拌子,开始搅拌,在1天~3天左右得到溶剂化电子溶液的深蓝色液体(混合液m1)。
[0259]
(实施例1)
[0260]
《生成工序>
[0261]
将在合成例1中得到的上述ldh-1于200℃、6小时的条件下进行真空排气,除去材料中所包含的水,放入ar气氛的手套箱内。向通过上述的方法制备得到的混合液m1中加入ldh 0.135g。其后,于室温进行搅拌238小时。
[0262]
离子交换完成后,向特氟龙(注册商标)制的离心管投入溶液,使用离心分离机以20000g、保持时间5分钟的条件进行离心分离。取出除去上清液,投入thf,搅拌离心管后,在相同条件进行离心分离。重复该操作3次,除去杂质冠醚。这些操作在ar气氛的手套箱中进行。最后于50℃进行12-24小时加热,并且同时进行真空排气处理,由此得到粉末状的层状双氢氧化物电子化合物。
[0263]
《洗涤工序和干燥工序>
[0264]
离子交换完成后,向特氟龙(注册商标)制的离心管投入溶液,使用离心分离机以20000g、保持时间5分钟的条件进行离心分离。取出除去上清液,投入thf,搅拌离心管后,在相同条件下进行离心分离。重复该操作3次,除去杂质冠醚。这些操作在ar气氛的手套箱中进行。最后于50℃进行12~24小时加热,并且同时进行真空排气处理,由此得到黑色粉末状的层状双氢氧化物电子化合物(ldhe-1)。
[0265]
《评价>
[0266]
利用在上文中说明的评价方法对在实施例1中得到的上述ldhe-1进行评价。电子密度为6.53
×
10
20
cm-3
。图3~图7分别示出吸收光谱、红外光谱、ft-ir的吸收光谱、xps图案、esr光谱结果。
[0267]
从上述的分析结果可知,就在实施例1中得到的层状双氢氧化物电子化合物(ldhe-1)而言,其利用电子对原料层状双氢氧化物(ldh-1)的氯化物离子进行了取代。可知为由式:mg6al(oh)
16
(cl-)
2-y
(e-)y表示的层状双氢氧化物电子化合物。此外,推测原料层状双氢氧化物的层间cl-的低于1/5被取代为电子。也即,推测y为约小于0.4。
[0268]
(实施例2)
[0269]
除了在生成工序中,于室温进行167小时放置以外,通过与实施例1相同的方法而得到层状双氢氧化物电子化合物(ldhe-2)。利用与实施例1同样的评价方法进行评价。其结果示于图3~图7中。
[0270]
根据上述分析的结果可知,在实施例2中得到的层状双氢氧化物电子化合物(ldhe-2)中,利用电子对原料层状双氢氧化物(ldh-1)的氯化物离子进行了取代,为由式:mg6al(oh)
16
(cl-)
2-y
(e-)y表示的层状双氢氧化物电子化合物。此外,推测原料层状双氢氧化物的层间cl-的低于1/10被取代为电子。也即,推测y为约小于0.2。
[0271]
(实施例3)
[0272]
除了在生成工序中,于室温进行200小时放置以外,通过与实施例1相同的方法而得到层状双氢氧化物电子化合物(ldhe-3)。利用与实施例1同样的评价方法进行评价。可知在实施例2中所得的层状双氢氧化物电子化合物(ldhe-3)中,利用电子对原料层状双氢氧化物(ldh-1)的氯化物离子进行了取代,为由式:mg6al(oh)
16
(cl-)
2-y
(e-)y表示的层状双氢氧化物电子化合物。
[0273]
此外,推测原料层状双氢氧化物的层间cl-的低于1/8被取代为电子。也即,推测y为约0.20。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。