1.本发明属于属于抗冻肽技术领域,具体涉及一种河豚鱼皮抗冻肽及其制备方法和应用。
背景技术:
2.低温环境会对细胞造成一系列损伤包括细胞脱水、细胞膜破裂、内容物泄露等,导致细胞不可逆的损伤或者死亡,因此生物体为抵御外界寒冷环境会应激性产生一种特殊的蛋白质——抗冻蛋白。但含有天然抗冻蛋白的生物一般都处于高寒、高海拔地区,而且生物体内的抗冻蛋白含量极其微量,将微量的抗冻蛋白从生物体内纯化出来十分困难,这就导致了天然抗冻蛋白的生产成本极其昂贵。基于抗冻蛋白作用机理,仿生抗冻蛋白材料应运而生,但合成的抗冻材料是否存在安全隐患有待于评估,无法直接作用于食品体系,因此仍然需寻找安全、无毒、健康可食用的低温保护剂。抗冻肽(antifreeze peptides,afps)是一类小分子蛋白或蛋白质水解物,它是抗冻蛋白中局部具有抗冻活性的特异多肽链结构域。抗冻肽在结冰或亚结冰状态下能保护生物体免受伤害蛋白质,它能非依数性降低溶液冰点、有效降低冰晶生长率、抑制冰晶重结晶的发生,抑制冻结所造成的低温损伤。
3.河豚是我国重要的江海洄游习性的底栖鱼类,主要生活在水的中层或底层。在河豚鱼制品的生产过程中,由于河豚鱼皮带刺坚硬,食用口感差,通常直接弃去,不仅浪费资源,而且污染环境。河豚鱼皮胶原蛋白含量丰富,具有较高的食用价值和药用开发价值,应用前景很广。利用河豚鱼皮开发制备抗冻肽,不仅充分利用资源,提高鱼类加工的附加值,而且符合绿色协调可持续发展的理念,促进鱼类加工业的发展。目前,利用河豚鱼皮制备抗冻肽的工艺迄今为止尚未见报道。
4.因此,本发明从河豚鱼皮酶解物中制备具有特定氨基酸序列的高效抗冻肽。以食品加工副产物为原料进行抗冻肽的酶解可控制备,既可降低抗冻肽生产成本,又有利于实现抗冻肽的规模化生产和应用,可以应用于食品、保健品和低温组织工程等行业。
技术实现要素:
5.本发明的目的在于提供一种河豚鱼皮抗冻肽及其制备方法和应用。
6.为实现上述目的,本发明采用如下技术方案:本发明首先提供了一种河豚鱼皮抗冻肽,所述河豚鱼皮抗冻肽选自下述任一种:1)氨基酸序列为egpraggapg、分子量为867.4198 da的河豚鱼皮抗冻肽;2)氨基酸序列为gdagpsgpagptg、分子量为1039.457 da的河豚鱼皮抗冻肽;3)氨基酸序列为geagpagpag、分子量为1576.7229 da的河豚鱼皮抗冻肽。
7.本发明进一步提供了一种制备上述的河豚鱼皮抗冻肽的方法,所述方法包括如下步骤:1)河豚鱼皮酶解液的制备:取河豚鱼皮粉碎后加水搅拌形成鱼皮浆料液,调节ph值至弱酸性后加入木瓜蛋白
酶进行酶解,酶解结束后进行灭酶处理,离心收集上清液,即得河豚鱼皮酶解液;2)河豚鱼皮酶解液的分离纯化:依次采用冰亲和吸附装置、sp-sephadex c-25阳离子交换色谱和sephadex g-25凝胶过滤色谱对河豚鱼皮酶解液进行分离纯化,收集抗冻活性最强的组分f2冻干后备用;3)抗冻肽的鉴定及筛选:采用纳升液相色谱-四极杆轨道阱质谱仪对组分f2进行氨基酸序列测定,使用计算机方法辅助筛选组分f2中具有无毒性、亲水性及冷冻保护活性的小分子肽,即得到所述的河豚鱼皮抗冻肽。
8.上述步骤1)中,木瓜蛋白酶的用量为40 u/g河豚鱼皮,酶解条件为65 ℃酶解5.14 h。
9.上述步骤2)中,sp-sephadex c-25阳离子交换色谱的分离纯化条件为:平衡液为0.02 m ph5.0的乙酸-乙酸钠缓冲液,用含0~0.5 m nacl的0.02 m ph5.0的乙酸-乙酸钠缓冲液作为洗脱液进行线性梯度洗脱,洗脱速度为0.5 ml/min,检测波长为214 nm。
10.上述步骤2)中,sephadex g-25凝胶过滤色谱的分离纯化条件为:先用去离子水平衡,再用去离子水进行洗脱,流速为0.5 ml/min,检测波长为214 nm。
11.上述步骤3)中,使用计算机方法辅助筛选具有无毒性、亲水性及冷冻保护活性的小分子肽的方法具体为:将纳升液相色谱-四极杆轨道阱质谱仪测定得到的氨基酸序列输入toxinpred数据库,选择无毒、亲水性》0的小分子肽;再将前一步得到的无毒、亲水性》0的小分子肽输入cryoprotect数据库,选择具有冷冻保护活性的小分子肽,得到3个小分子肽,即为所述的河豚鱼皮抗冻肽。
12.本发明还提供了上述的河豚鱼皮抗冻肽在制备冷冻保护剂中的应用。
13.本发明的显著优点在于:本发明立足于现有抗冻添加剂多有高热量、难获取的缺点,致力于寻找一种天然高效的抗冻剂,以河豚鱼皮为出发点,着眼于蛋白酶酶解的过程控制,制备出具有特定氨基酸序列的活性多肽,使得抗冻活性得以高效的实现。本发明采用的酶解技术简单高效,能对酶解产物进行活性跟踪从而达到定向酶切,避免了成本浪费,本发明进一步提出通过计算机辅助筛选进行抗冻肽的筛选,具有操作简便、生产成本低、准确性高的优点。本发明得到的多肽具备抗冻活性,为其应用于食品、保健品及低温组织工程行业提供了理论基础。
附图说明
14.图1为冰亲和吸附装置的结构示意图。
15.图2为sp-sephadex c-25离子交换色谱图及组分p1、p2和p3的菌体低温保护活性。a:sp-sephadex c-25离子交换色谱图。b:组分p1、p2和p3的菌体低温保护活性。
16.图3为sephadex g-25凝胶过滤色谱图及组分f1、f2和f3的菌体低温保护活性。a:sephadex g-25凝胶过滤色谱图。b:组分f1、f2和f3的菌体低温保护活性。
17.图 4为河豚鱼皮抗冻肽的二级质谱图。a:egpraggapg。b:gdagpsgpagptg。c:geagpagpag。
18.图5为河豚鱼皮抗冻肽的二级结构。a:egpraggapg。b:gdagpsgpagptg。c:geagpagpag。
19.图6为河豚鱼皮抗冻肽的菌体低温保护活性。a:egpraggapg。b:gdagpsgpagptg。c:geagpagpag。
具体实施方式
20.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
21.本发明中,菌体低温保护活性的测定方法如下:取50 μl二次活化的嗜热链球菌单菌落接种到4 ml m17液体培养基中,培养4 h(37 ℃,180 rpm),5000 rpm离心10 min,收集菌泥,用生理盐水洗涤两次后重悬于等体积的生理盐水中,获得嗜热链球菌菌液。取540 μl 200 μg/ml样品与60 μl菌液混匀,以生理盐水替换样品做空白组。吸取50 μl混合液到4 ml m17培养液中,培养7 h(37 ℃,180 rpm),检测600 nm处的吸光值a1,剩余的菌液于-20 ℃冷冻24 h且在起始时间内间隔2 h进行两次冻融循环。之后将菌液37 ℃水浴解冻10 min,再次取50 μl接种培养7 h后测吸光值a2。根据公式(1)计算存活率。
22.式中: a1表示冷冻前菌液od
600
;a2表示冷冻后菌液od
600
。
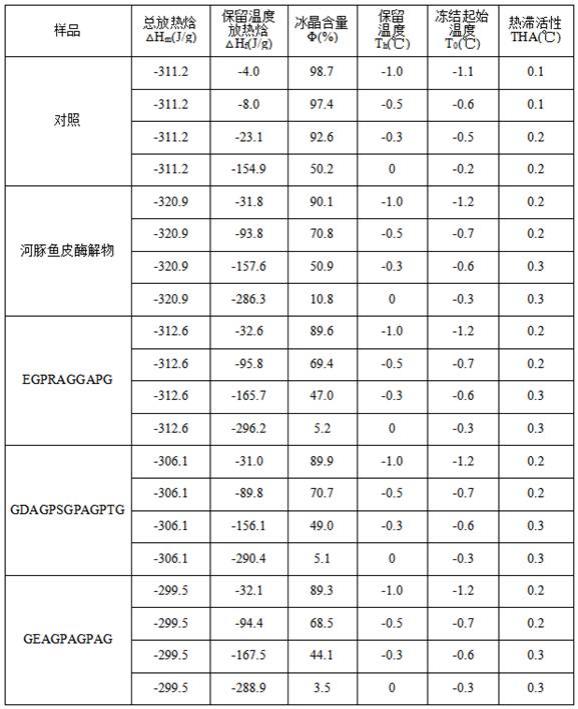
23.本发明中,冰晶含量抑制效果、热滞活性的测定方法如下:取5 μl 15 mg/ml样品到铝样品盘,参比组为空白铝样品盘,将二者同时置入差示扫描量热仪中,以-2 ℃/min速率降温至-30 ℃,平衡5 min,再以2 ℃/min速率升温至保留温度(-1.0 ℃、-0.5 ℃、-0.3 ℃、0 ℃),使样品处于部分熔融状态,平衡5 min。根据dsc热流曲线分析样品的抗冻活性。冰晶含量(φ)和tha分别按照公式(2)和(3)计算。tha= th-t0ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(3)式中:φ为样品中的冰晶含量,
△
hf为保留温度停留后继续降温过程中体系的放热焓,
△hm
为样品结晶的总放热焓。th为保留温度,即样品熔融峰所涵盖温度区间的某一温度,样品处于部分熔融状态;t0体系融化部分再次冻结时的起始温度,由热流曲线拐点两端最大斜率切线和最小斜率切线的相交点来确定。
24.实施例1河豚鱼皮抗冻肽的制备,具体步骤如下:步骤1:利用粉碎机将河豚鱼皮粉碎成絮状,称取37.3 g河豚鱼皮絮状物加入1 l去离子水形成鱼皮浆料液,用0.02 mol/l 盐酸溶液调节ph至6.88,然后加入1.865 g木瓜蛋白酶(800 u/mg),在65 ℃条件下酶解5.14 h,酶解结束后在沸水浴中煮沸10 min进行灭酶处理,然后冷却至室温,再以10000 rpm的速度离心10 min,取上清液再次以10000 rpm的速度离心10 min,再次收集得到的上清液即为河豚鱼皮酶解液。
25.步骤2:搭建冰亲和吸附装置,该冰亲和吸附装置由反应容器及可控温的低温反应槽构成,结构如图1所示。将2 l河豚鱼皮酶解液倒入冰亲和吸附装置的反应容器中,设置低温反应槽温度为-6 ℃,待反应容器中酶解液结冰厚度达到1 cm后,调整低温反应槽温度
为-4 ℃,酶解液中的高活性抗冻组分能够与容器内壁上的冰吸附结合,持续吸附5 h后,弃去未结冰的酶解液,用适量去离子水环绕反应容器内壁四周慢慢清洗,使吸附的冰晶和抗冻组分充分溶解,将溶解后的产物冻干,即获得抗冻组分的冻干粉。
26.步骤3:取经过冰亲和吸附得到的抗冻组分冻干粉300 mg,加入5 ml ph 5.0的0.02 mol/l乙酸-乙酸钠缓冲液,搅拌直至完全溶解,以10000 rpm的速度离心10 min,取上清液过0.22 μm滤膜,将滤液用ph 5.0的0.02 mol/l乙酸-乙酸钠缓冲液稀释样品至100 ml,利用sp-sephadex c-25强阳离子交换色谱进行分离纯化,平衡液为0.02 m的乙酸-乙酸钠缓冲液(ph5.0),用含nacl(0~0.5 m)的0.02 m的乙酸-乙酸钠缓冲液(ph5.0)作为洗脱液进行线性梯度洗脱,洗脱速度为0.5 ml/min,检测波长为214 nm,可得到3个峰(图2a),测定组分p1、p2和p3的菌体低温保护活性测定(图2b),将菌体低温保护活性最高的组分p1收集冻干后备用。
27.步骤4:称取500 mg组分p1冻干粉,加入5 ml去离子水,搅拌直至完全溶解,以10000 rpm的速度离心10 min,取上清液过0.22 μm滤膜,利用sephadex g-25凝胶过滤色谱进行分离纯化,先用去离子水平衡,再用去离子水进行洗脱,流速为0.5 ml/min,检测波长为214 nm,可得到3个峰(图3a),测定组分f1、f2和f3的菌体低温保护活性(图3b),将菌体低温保护活性最高的组分f2收集冻干后备用。
28.步骤5:取100 μg组分f2冻干粉使用纳升液相色谱-四极杆轨道阱质谱仪进行氨基酸序列测定,共得到95条序列。
29.步骤6:将质谱分析得到的95条序列输入toxinpred数据库,选择无毒、亲水性》0的小分子肽;共筛选得到28个小分子肽;将前一步得到的无毒、亲水性》0的小分子肽的序列输入cryoprotect数据库,选择具有冷冻保护活性的小分子肽,得到3个小分子肽,其氨基酸全序列分别为:egpraggapg(亲水性0.5,分子量为867.4198 da)、gdagpsgpagptg(亲水性0.15,分子量为1039.457 da)、geagpagpag(亲水性0.15,分子量为1576.7229 da),即为本发明的河豚鱼皮抗冻肽。egpraggapg,gdagpsgpagptg和geagpagpag二级质谱图见图4。
30.步骤7:使用rpbs结构生物学数据库中pep-fold 3.5多肽结构预测建模程序对筛选得到的3个无毒、亲水性》0且具有冷冻保护活性的肽序列进行建模,选择模拟次数100,模型排序依据sopep,从结果中选择评分最高的建模结果,从建模结果可以看到,肽序列egpraggapg的二级结构具有α螺旋结构(图5a),肽序列gdagpsgpagptg二级结构为无规卷曲构象(图5b),肽序列geagpagpag的二级结构为无规卷曲构象(图5c)。
31.步骤8:固相合成上述无毒、亲水性》0且具有冷冻保护活性的三条肽序列后,测定其抗冻活性,以菌体低温保护活性(图6)、热滞活性(表1)和冰晶含量抑制(表1)进行评价。河豚鱼皮抗冻肽egpraggapg对菌体的低温保护活性为74.03%,其具有良好的抑制冰晶生长的效果,热滞活性在0.2~0.3 ℃之间。河豚鱼皮抗冻肽gdagpsgpagptg对菌体的低温保护活性为62.62%,其具有良好的抑制冰晶生长的效果,热滞活性在0.2~0.3 ℃之间。河豚鱼皮抗冻肽geagpagpag对菌体的低温保护活性为41.24%,其具有良好的抑制冰晶生长的效果,热滞活性在0.2~0.3 ℃之间。
32.表1 河豚鱼皮抗冻肽的热滞活性和冰晶含量抑制效果
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。