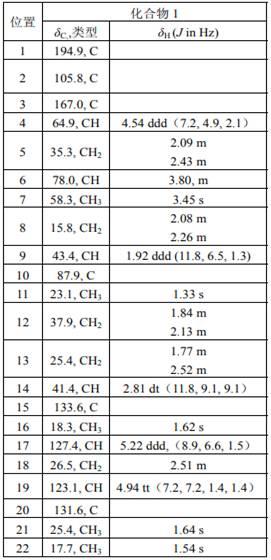
细菌基因组dna提取试剂盒及其使用方法
技术领域
1.本发明涉及生物技术领域,具体地涉及一种用于细菌基因组dna提取的试剂盒及其使用方法。
背景技术:
2.伴随着生物化学及分子生物学如分子克隆技术、pcr技术、基因工程以及全基因dna测序技术等的发展,对生物dna的研究也越来越广泛与深入。而基因组dna的提取往往是对生物dna研究的第一步,也是研究的基础,dna的提取质量直接决定着下游实验的成败。
3.细菌属于原核生物,其细胞结构比较简单,具有肽聚糖构成的坚韧细胞壁。对细菌dna提取的第一步需要破坏这层细胞壁,而释放细胞内的核酸等内容物,目前对细菌基因组dna提取的方法主要有:机械破碎法、酶法和化学法等进行细胞破碎以及dna提取。其中机械法主要是利用机械作用力如超声破碎、反复冻融、微珠震荡等方法对细菌细胞壁进行破碎;酶法主要通过生物酶如溶菌酶等对细菌细胞壁进行溶解破碎;化学法通过化学试剂如强碱naoh、表面活性剂sds(十二烷基磺酸钠)、ctab等化学试剂对细菌进行破裂、蛋白变性等结合有机溶剂抽提蛋白杂质,从而获得较高纯度的dna。
4.细菌的基因组研究愈发广泛及重要,因此其基因组的高效率、高质量的提取也至关重要。现有的各种细菌基因组提取方式有着不同的缺陷,如耗时长、使用有毒试剂、产物纯度低等。因此,需研发一种针对细菌基因组提取的试剂盒,有效解决细菌基因组提取的相应问题。
技术实现要素:
5.本发明的目的在于提供一种细菌基因组dna提取的试剂盒,有效解决细菌基因组提取的相应问题。
6.因此,在第一方面,本发明提供了一种细菌基因组dna提取试剂盒,包括悬浮液、结合液、去蛋白液、漂洗液和洗脱液,
7.所述悬浮液包括第一tris-edta缓冲液中1-2%,优选1.5%的十二烷基肌氨酸钠;
8.所述结合液包括柠檬酸钠缓冲液中2-5m,优选2.5m的guhcl和20-60mm,优选40mm的尿素;
9.所述去蛋白液包括第一tris-hcl缓冲液中2-3m,优选2.5m的guhcl,加入终浓度30-60%,优选55%体积的乙醇;
10.所述漂洗液包括第二tris-hcl缓冲液中加入终浓度75-80%,优选80%体积的乙醇;
11.所述洗脱液包括第二tris-edta缓冲液。
12.在一个实施方案中,所述试剂盒还包括dna吸附柱和蛋白酶k。
13.在一个实施方案中,所述dna吸附柱为硅基质膜吸附柱。
14.在一个实施方案中,所述第一tris-edta缓冲液的ph为7.5~8.5,优选为8,包括
20-100mm,优选25~50mm的tris-hcl和10-20mm的edta。
15.在一个实施方案中,所述柠檬酸钠缓冲液的ph为5.0-6.0,优选5.0-5.5,更优选为5.0-5.05,浓度20-60mm,优选为50mm。
16.在一个实施方案中,所述第一tris-hcl缓冲液的ph为6.8-7.5,优选7.0,浓度为20-50mm,优选为30mm。
17.在一个实施方案中,所述第二tris-hcl缓冲液的ph为6.8-7.5,优选7.0,浓度为10-20mm,优选为15mm。
18.在一个实施方案中,所述第二tris-edta缓冲液的ph为7.5~8.5,优选为8,包括5~20mm,优选10mm的tris-hcl和0.1~10mm,优选1mm的edta。
19.在第二方面,本发明提供了一种细菌基因组dna提取方法,包括:
20.1)对细菌样本破碎细菌细胞、降解蛋白并释放细菌基因组dna;
21.2)加入本发明的结合液进行孵育;
22.3)用乙醇沉淀dna;
23.4)将所述沉淀dna的液体转移至吸附柱中进行离心,去液相;
24.5)在所述吸附柱中加入本发明的去蛋白液和无水乙醇混合物进行离心,去液相;
25.6)所述吸附柱中加入本发明的漂洗液和无水乙醇混合物进行离心,去液相,优选重复1-2次,然后晾干;
26.7)从所述吸附柱洗脱dna。
27.在一个实施方案中,在1)中,用本发明的悬浮液破碎革兰氏阴性菌的细胞壁,用溶菌酶破碎革兰氏阳性菌的细胞壁。
28.在一个实施方案中,在1)中,用蛋白酶k降解蛋白。
29.在一个实施方案中,在2)中,在56℃下孵育10~15min。
30.在一个实施方案中,在4)-6)中,离心以12,000rpm(约13,400
×
g)进行1min。
31.在一个实施方案中,在7)中,洗脱以te buffer或灭菌水进行,优选温度在65℃。
32.本发明的试剂盒中的各组分协同配合,共同实现了本发明优异的dna提取效果。在研发过程中,发明人发现并非所有的同类试剂都能起到很好的效果,比如悬浮液中,如果将sls替换为sds、tween20、triton x-100或者替换为其他试剂如盐酸胍,都会存在或抑制提取或rna残留多或扩增效果差的问题,又或者将sds和盐类如氯化钠搭配使用,其效果也会变差。比如在结合液中,如果使用guscn、醋酸钠、np-40、peg-8000,或者加入tris-hcl、tritonx-100、aeo-15等都会导致溶液出现絮状沉淀、提取效果变差或者效果不稳定等问题。去蛋白液的主要作用是创造高盐低ph的条件,使核酸保持吸附在硅基质膜上,同时促使蛋白溶于去蛋白液中从硅基质膜上洗脱下来;然而不恰当的去蛋白液选择会导致盐类残留、抑制pcr等问题;在本发明的体系中,去蛋白液的盐的选择要综合考虑悬浮液、结合液的成分,只有相互配合,才能达到理想的去杂效果,提高产物纯度;例如,使用氯化钠或者guscn或者将其与盐酸胍配合使用,又或者添加一些辅助成分如尿素、tritonx-100其结果都会变差。另外,组分与组分之间也会相互影响,例如悬浮液和结合液的各自成分需相互配合达到一个平衡的效果,才能有效裂解细菌菌体,如果悬浮液中使用sds,添加结合液后就可能会出现溶液浑浊、堵塞柱子等情况。除此之外,各试剂的用量和ph等细节,也会对结果产生影响。例如,当盐酸胍浓度过高时,会使rna残留量明显增加;盐酸胍会对ph测量产生影
响,需要通过柠檬酸钠缓冲液的ph来调整结合液的ph。
33.本发明获得一种利用dna吸附柱针对细菌基因组dna提取的试剂盒及方法,利用该试剂盒能够快速提取多种革兰氏阴性菌及阳性菌基因组dna,且保证所得到的基因组dna具有较高的纯度及兼容下游应用。
附图说明
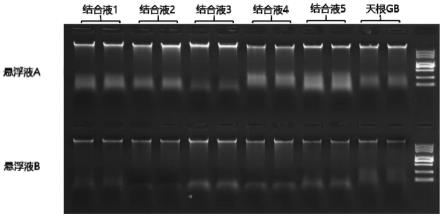
34.图1示出了不同配方悬浮液和结合液搭配使用提取得到的细菌基因组dna的凝胶电泳图;
35.图2示出了悬浮液a和不同结合液搭配使用提取得到的细菌基因组dna的凝胶电泳图;其中,(a)图为提取得到的大肠杆菌基因组dna的凝胶电泳图,(b)图为提取得到的农杆菌基因组dna的凝胶电泳图;
36.图3示出了使用不同配方的去蛋白液提取得到的细菌基因组dna的凝胶电泳图;其中,(a)图为提取得到的大肠杆菌基因组dna的凝胶电泳图,(b)图为使用不同引物进行pcr扩增后的凝胶电泳图;
37.图4示出了使用不同配方的去蛋白液提取得到的细菌基因组dna的凝胶电泳图;其中,(a)图为提取得到的大肠杆菌基因组dna的凝胶电泳图,(b)图为使用不同引物进行pcr扩增后的凝胶电泳图;
38.图5示出了调整去蛋白液中缓冲液后提取得到的细菌基因组dna的凝胶电泳图;
39.图6示出了本试剂盒和市售试剂盒提取不同细菌的基因组dna的凝胶电泳图。
具体实施方式
40.下面对本发明进行详细的描述。需理解,以下描述仅以示例方式来对本发明进行说明,无意于对本发明的范围进行限制,本发明的保护范围以随附权利要求为准。并且,本领域技术人员理解,在不背离本发明的精神和主旨的情况下,可以对本发明技术方案进行修改。
41.若并未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
42.除非另外定义,否则本文所使用的所有技术和科学术语具有与本发明所述主题所属领域的普通技术人员通常理解的相同含义。在对本发明进行详细描述之前,提供以下定义以更好地理解本发明。
43.在提供数值范围的情况中,例如浓度范围、百分比范围或比率范围,应当理解,除非上下文另有明确规定,否则在该范围的上限与下限之间的、到下限单位的十分之一的各中间值以及在所述范围内的任何其他所述值或中间值包含在所述主题内。这些较小范围的上限和下限可独立地包括在较小范围中,并且此类实施方案也包括在所述主题内,受限于所述范围中的任何特定排除的极限值。在所述范围包括一个或两个极限值的情况中,排除那些所包括的极限值中的任一个或两个的范围也包括在所述主题中。
44.本发明的试剂盒采用独特的缓冲液系统配合特异性吸附dna的离心柱,能够快速1h内高效提取各种革兰氏阴性/阳性菌的基因组dna,并最大限度的去除杂质蛋白及细胞中其他代谢物质。本试剂盒无需使用酚/氯仿抽提,无需进行耗时的异丙醇或乙醇沉淀过程,
操作安全。使用本试剂盒获得的基因组dna完整性好、纯度高,可直接用于pcr、酶切和杂交等实验。
45.不希望拘囿于任何理论,本发明人认为,本发明的试剂盒通过准确的试剂成分加样顺序和精确的ph和浓度,实现了比现有技术常规方法更好的细菌dna提取效果,即细菌基因组dna完整性好、纯度高。
46.实施例。
47.实施例1、试剂盒的试剂成分和浓度。
48.配方1:
49.悬浮液:tris-hcl(ph8),50mm;edta(ph8),10mm;十二烷基肌氨酸钠(sls),1.5%。
50.结合液:柠檬酸钠(ph5.0-5.05),50mm;guhcl,2.5m;尿素,40mm。
51.去蛋白液:tris-hcl(ph7),30mm;guhcl,2.5m;乙醇,55%。
52.漂洗液:tris-hcl(ph7),15mm;乙醇,80%。
53.洗脱液(te ph8):tris-hcl(ph8),10mm;edta(ph8),1mm。
54.配方2:
55.悬浮液:tris-hcl(ph8),25mm;edta(ph8),10mm;十二烷基肌氨酸钠(sls),1.5%。
56.结合液:柠檬酸钠(ph5.0),50mm;guhcl,2.5m;尿素,40mm。
57.去蛋白液:tris-hcl(ph7),30mm;guhcl,2.5m;乙醇,55%。
58.漂洗液:tris-hcl(ph7),15mm;乙醇,80%。
59.洗脱液(te ph8):tris-hcl(ph8),10mm;edta(ph8),1mm。
60.配方3:
61.悬浮液:tris-hcl(ph8),25mm;edta(ph8),10mm;十二烷基肌氨酸钠(sls),1.5%。
62.结合液:柠檬酸钠(ph5.2),50mm;guhcl,2.0m;尿素,20mm。
63.去蛋白液:tris-hcl(ph7.5),50mm;guhcl,3m;乙醇,60%。
64.漂洗液:tris-hcl(ph7.5),10mm;乙醇,80%。
65.洗脱液(te ph8):tris-hcl(ph8),10mm;edta(ph8),1mm。
66.配方4:
67.悬浮液:tris-hcl(ph8),50mm;edta(ph8),10mm;十二烷基肌氨酸钠(sls),1.5%。
68.结合液:柠檬酸钠(ph5.03),50mm;guhcl,2.5m;尿素,40mm。
69.去蛋白液:tris-hcl(ph6.8),20mm;guhcl,2.5m;乙醇,45%。
70.漂洗液:tris-hcl(ph6.8),20mm;乙醇,75%。
71.洗脱液(te ph8):tris-hcl(ph8),10mm;edta(ph8),1mm。
72.配方5:
73.悬浮液:tris-hcl(ph8),50mm;edta(ph8),20mm;十二烷基肌氨酸钠(sls),1.0%。
74.结合液:柠檬酸钠(ph5.5),40mm;guhcl,2.5m;尿素,30mm。
75.去蛋白液:tris-hcl(ph7),30mm;guhcl,2.5m;乙醇,55%。
76.漂洗液:tris-hcl(ph7),15mm;乙醇,80%。
77.洗脱液(te ph8):tris-hcl(ph8),10mm;edta(ph8),1mm。
78.实施例2、细菌基因组dna提取方法步骤。
79.1.样品准备。
80.1.1革兰氏阴性菌。
81.1)取细菌培养物1~5ml(不超过1
×
109个细胞)置于离心管中,12,000rpm(~13,400
×
g)离心1min,尽量吸净上清。
82.2)加入200μl本发明的悬浮液,振荡至菌体彻底悬浮。
83.3)可选加入5μl rnase a,振荡15s,室温放置5~15min。
84.4)向管中加入20μl蛋白酶k溶液,混匀。
85.1.2革兰氏阳性菌。
86.1)取细菌培养物1~5ml(不超过1
×
109个细胞)置于离心管中,12,000rpm(~13,400
×
g)离心1min,尽量吸净上清。
87.2)加入180μl溶菌酶,振荡至菌体彻底悬浮,37℃孵育30min或更长时间。菌酶浓度为20mg/ml,溶菌酶缓冲液配制方法为:20mm tris,ph8.0;2mm na
2-edta;1.2%triton x-100。
88.3)可选加入5μl rnase a,振荡15s,室温放置5~15min。
89.4)向管中加入20μl蛋白酶k溶液,混匀。
90.2.加入220μl本发明的结合液,振荡混匀,56℃孵育10~15min。
91.3.加入220μl无水乙醇,振荡混匀,此时可能会出现絮状沉淀。
92.4.将上一步所得混合溶液转移至已装入收集管的吸附柱中,12,000rpm(~13,400
×
g)离心1min,倒废液,将吸附柱放回收集管中。吸附柱可以是包括硅基质膜吸附柱,其优势:操作简单,将核酸分离纯化过程变成简单的过滤操作,对操作要求低,重复性好;纯化效果好,得率高;安全性高,无需接触大量有毒试剂。
93.5.在500μl去蛋白液中加入无水乙醇,乙醇的体积终浓度为55%,12,000rpm(~13,400
×
g)离心1min,弃废液。
94.6.在600μl漂洗液加入无水乙醇,乙醇的体积终浓度为55%,12,000rpm(~13,400
×
g)离心1min,弃废液,优选重复一次。
95.7.将吸附柱放回收集管中,12,000rpm(~13,400
×
g)离心2min,倒掉废液,将吸附柱开盖置于室温数分钟,以充分晾干。
96.8.取出吸附柱,放入一个干净的1.5ml离心管中,在吸附膜的中央悬空滴加50~100μl te buffer或灭菌水进行洗脱(优选65℃),室温放置2~5min,12,000rpm(~13,400
×
g)离心2min。优选将离心得到的溶液重新加入吸附柱中,室温放置2min,12,000rpm(~13,400
×
g)离心2min。
97.实施例3、试剂盒的不同试剂成分和浓度的比较。
98.本发明的试剂盒的试剂成分和浓度相互配合,经过本发明的细菌基因组dna提取方法步骤,能够快速1h内高效提取各种革兰氏阴性/阳性菌的基因组dna,并最大限度的去除杂质蛋白及细胞中其他代谢物质。
99.1、悬浮液和结合液。
100.1)用调整到以下成分的悬浮液和结合液对大肠杆菌和农杆菌基因组dna提取进行了测试。在探索悬浮液和结合液成分时,使用的去蛋白液为擎科生物植物基因dna提取试剂盒(tsp101-50)中的buffer pw,漂洗液为对应的wash buffer,洗脱液为对应的te buffer。成分和浓度如表1和表2所示。
101.表1
[0102][0103]
表2
[0104][0105]
表3和图1示出了悬浮液与结合液配合的效果。260代表核酸在最高吸收峰260nm波长处的吸光值;280最能反应蛋白质浓度(蛋白质有多个吸收峰,280用的较多);230最能反应碳水化合物、盐(如胍盐)等杂质的含量。260/230和260/230在一定程度上可以反应核酸的纯度。
[0106]
对于sls和sds,发明人在实验中发现,使用sds的悬浮液在裂解后溶液无法变澄清,会有堵塞柱子的可能,而使用sls的处理表现要更为稳定,且在其他实验中也验证了单独使用sls的效果也优于混合使用sds和sls。从表3的260/230可以看出,自配b悬浮液的值在1.27~1.876,而根据经验,其值在2.0左右时说明纯度较好,值过低,则可能是杂质含量过高。从图1也可以看出,悬浮液a的条带亮度整体都比悬浮液b好。说明使用十二烷基肌氨酸钠的处理提取产物整体得率更高,效果稳定。
[0107]
对于结合液,260/280中,除了悬浮液b 天根gb的值偏低,其他都在合理范围内;260/230中,悬浮液b组整体偏低,悬浮液a组,结合液2偏低,结合图1的电泳图,可以看出,结合液1和3效果较好一些,可能由于结合液2中选用乙酸钠溶液作为缓冲液成分,导致裂解后溶液不能变得清澈且加入乙醇后出现大量絮状沉淀堵柱子;结合液4为根据检测结果配制,结合液5是在结合液1的基础上增加了1%aeo-15,根据本次实验结果,添加aeo-15并不能提高提取效果。
[0108]
除此之外,可以看出,悬浮液a和b与几种不同的结合液配合使用的时候,变化趋势
并不一致,说明悬浮液和结合液是相互协同,搭配使用。
[0109]
表3
[0110][0111]
2)在此基础上,分别添加不同缓冲液或不添加缓冲液配制结合液比较提取大肠杆菌基因组dna的效果。与前一次实验结果一致,添加aeo-15会提高样品中rna的残留量,导致测值偏好以及纯度测值结果偏高。不添加缓冲液或使用tris-hcl、柠檬酸钠效果较好。发明人进一步比较柠檬酸钠缓冲液和tris-hcl缓冲液的使用效果,发现使用柠檬酸钠缓冲液的效果较好。利用大肠杆菌和农杆菌进一步比较柠檬酸钠缓冲液和tris-hcl缓冲液的使用效果,使用柠檬酸钠缓冲液的效果较好。成分和浓度如表4所示。对大肠杆菌/农杆菌基因组dna的提取效果,如表5和图2(其中,(a)图为大肠杆菌,(b)图为农杆菌)所示。
[0112]
表4
[0113][0114]
表5
[0115][0116]
除上述探讨不同组分组合的实验结果,发明人还对各组分的用量、ph值等条件进行了实验,确定悬浮液和结合液的最佳配比为:悬浮液:tris-hcl(ph8),50mm;edta(ph8),10mm;十二烷基肌氨酸钠(sls),1.5%。结合液:柠檬酸钠(ph5.0-5.05),50mm;guhcl,2.5m;尿素,40mm。其中,悬浮液的用量为200μl,结合液用量为220μl,即两者体积用量比为1:1.1。
[0117]
2、去蛋白液的成分和含量。
[0118]
前期裂解体系试剂成分对后续吸附柱纯化过程有一定影响,因此结合液中盐的种类和含量需与后期去蛋白液中使用的盐的种类和含量相配合,才可达到理想的去杂效果,提高产物纯度。用调整到以下成分的蛋白液对大肠杆菌基因组dna提取进行了测试。下面针对以上几种方案中效果较好的处理进行进一步比较测试。
[0119]
1)一组去蛋白液和对大肠杆菌的结果。成分和浓度如表6所示,结果如表7和图3(其中(a)图为提取的大肠杆菌基因组dna的凝胶电泳图,(b)图为使用金牌mix用不同引物
扩增后的凝胶电泳图)所示。显然,添加tritonx-100并不能起到更好的效果。
[0120]
表6
[0121][0122]
表7
[0123][0124]
2)进一步探讨了添加nacl,或者guhcl nacl的组合效果。成分和浓度如表8所示,结果如表9和图4(其中(a)图为提取的大肠杆菌基因组dna的凝胶电泳图,(b)图为使用金牌mix用不同引物扩增后的凝胶电泳图)所示。可以看出,添加氯化钠后,会明显影响纯度,另外,使用nacl和guhcl混合配制去蛋白液提取效果与只使用guhcl相近,但可能会有部分杂质残留对pcr产生影响。
[0125]
表8
[0126][0127]
表9
[0128][0129]
在此基础上,还尝试去蛋白液中添加尿素,此处理会提高产物产量,但会明显影响产物260/230比值,且可能对pcr产生影响。还尝试了guscn代替guhcl或与guhcl混合使用的实验,发现guscn会有残留,影响后续pcr;因此本发明的去蛋白液选择使用guhcl。
[0130]
3、去蛋白液中缓冲液浓度及ph影响。
[0131]
对农杆菌基因组dna的提取效果,如表10和图5所示。
[0132]
表10
[0133][0134]
比较去蛋白液中tris-hcl缓冲液的浓度及ph对提取效果的影响,其浓度为30mm时效果较好;其ph为6.8/7.0的差异不显著,为了后期生产简化,使用与漂洗液中tris-hcl缓冲液相同的ph,为7.0。
[0135]
本发明中确定了去蛋白液中的主要成分主要有以下三种:盐、缓冲液、醇类。使用2.5m guhcl来制造高盐环境,与结合液中盐浓度相配合,有效去除蛋白杂质;缓冲液选择使用tris-hcl,ph定为7.0,浓度为30mm;此外使用55%左右的乙醇。
[0136]
4、与市售产品的比较。
[0137]
本发明试剂盒(配方1,产品编号tsp701)和市售的同类试剂盒进行比较。
[0138]
选择若干种革兰氏阴性菌和革兰氏阳性菌,采用本发明试剂盒(配方1)和市售同类试剂盒进行比较,结果如图6所示。可以看出,对于模式菌(大肠杆菌、枯草芽孢杆菌和金
黄色葡萄球菌),本试剂盒和市售试剂盒效果相似;对于一些常见功能菌,如农杆菌、苏云金芽孢杆菌、醋酸菌和乳酸乳球菌等,本试剂盒的效果优于市售产品;对于其它菌株,如铜绿假单胞菌、黄单胞杆菌、鼠伤寒沙门氏菌、产气肠杆菌,本试剂盒明显优于t公司,如表皮葡萄球菌、无乳链球菌、地衣芽孢杆菌和红球菌,本试剂盒明显优于t公司和o公司。总的来讲,本试剂盒普适性好,对于不同种类细菌,均有较好的提取效果。
[0139]
尽管已参照具体实施方式公开了本发明,但是显而易见的是,在不背离本发明的真正精神和范围的情况下,本领域的其他技术人员可以设计本发明的其它实施方式和变化,所附权利要求书目的在于被解释为包括所有这样的实施方式和等价的变化。此外,本文引用的所有参考文献的内容据此引入本文以供参考。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。