野葡萄vympbq基因及其编码的蛋白和应用
技术领域
1.本发明涉及一种野葡萄vympbq基因及其编码的蛋白和应用,属于基因工程技术领域。
背景技术:
2.植物维生素e的生物合成过程至少有5种酶直接参与,它们分别为:4-羟苯丙酮二加氧酶(hppd)、尿黑酸叶绿醇转移酶(hpt)、2-甲基-6-植基-1,4-苯醌甲基转移酶(mpbq-mt)、生育酚环化酶(tc)和γ-生育酚甲基转移酶(γ-tmt)。其中mpbq-mt是催化α-生育酚和α-生育三烯酚合成前体2,3-二甲基-6-植基-1,4-苯醒(dmpbq)和2,3-二甲基-6-牻牛儿基牻牛儿基苯醌(dmggbq)生成的关键酶。mpbq-mt催化2-甲基-6-植基-1,4-苯醌(mpbq)生成dmpbq,同时催化2-甲基-6-牻牛儿基牻牛儿基苯醌(mggbq)生成dmggbq。拟南芥中编码mpbq的基因已被克隆,进一步研究发现,在拟南芥和集胞藻6803(synechocystis sp.pcc6803)中mpbq虽然功能相同且底物特异性相近,但二者的氨基酸序列同源性却较低。聂腾坤等以大豆品种合丰25和bayfield为材料,克隆大豆2-甲基-6-植基-1,4-苯醌甲基转移酶(mpbqmtase)基因,获得1 029bp的mpbq-mt基因cdna序列。
3.葡萄是世界第二大水果,拥有悠久的栽培历史,种类繁多,具有重要的食用价值和经济价值。近年来,随着全球气候的恶变,世界各地干旱事件频繁发生,在非干旱季节或非干旱地区干旱危害也频繁出现。干旱对葡萄生长发育过程和产量品质有严重的影响,已经成为制约葡萄生长和提高果品质量的主要因素之一,尤其是近年来全球气候的变化和我国南方干旱的频频出现,使葡萄产业受到很大的威胁。在世界范围内都面临缺水问题的大背景之下,发掘抗旱葡萄资源、研究葡萄抗旱基因对提高葡萄抗旱性、培育抗旱新品种及节水栽培等都具有重要的科学价值和意义。
技术实现要素:
4.本发明的目的是提供一种野葡萄vympbq基因,为提高葡萄抗旱性提供新的候选基因。
5.本发明还提供了上述野葡萄vympbq基因编码的蛋白以及野葡萄vympbq基因在提高植物抗旱能力中的应用。
6.为了实现以上目的,本发明所采用的技术方案是:
7.野葡萄vympbq基因,所述野葡萄vympbq基因的开放阅读框为1023bp,核苷酸序列如seq id no.1所示。野葡萄vympbq基因能够增加转基因植株中抗逆相关物质的积累和抗旱相关基因的表达,促进转基因植株抗旱性增强。
8.进一步地,所述野葡萄vympbq基因的cdna的核苷酸序列如seq id no.2所示,全长1172bp,开放阅读框序列为1023bp。
9.上述野葡萄vympbq基因编码的蛋白,氨基酸序列如seq id no.3所示。
10.上述野葡萄vympbq基因在提高植物抗旱能力中的应用。野葡萄vympbq基因,能够
增加转基因植株中抗逆相关物质的积累和抗旱相关基因的表达,促进转基因植株抗旱性增强。
11.进一步地,所述应用包括以下步骤:利用基因工程手段在植物中过量表达野葡萄vympbq基因。
12.进一步地,所述植物为拟南芥或葡萄。
附图说明
13.图1为本发明的实验例1中vympbq基因的表达特性分析结果示意图,其中图1a为vympbq基因在葡萄不同组织中的表达分析结果图;图1b为vympbq基因在干旱处理后的表达分析结果图;
14.图2为本发明的实验例2中vympbq转基因拟南芥植株的抗旱性鉴定结果对比图;
15.图3为本发明的实验例3中vympbq转基因拟南芥植株的生理特性分析结果图,其中图3a为转基因拟南芥与对照在干旱胁迫后的存活率对比图;图3b为转基因拟南芥与对照在干旱胁迫后的相对电导率对比图;图3c为转基因拟南芥与对照在干旱胁迫后的叶片相对失水率对比例图;图3d为转基因拟南芥与对照在干旱胁迫后的叶绿素含量对比图;
16.图4为本发明的实验例4中转基因拟南芥植株中抗旱相关基因的表达分析结果图。
具体实施方式
17.以下结合具体实施方式对本发明的技术方案作进一步的说明。
18.实施例1葡萄vympbq基因的克隆
19.用plus植物总rna提取试剂盒(天根)提取燕山葡萄叶片总rna。普通反转录用primescriptii1st strand cdna synthesis kit(takara)合成cdna第一链。具体操作步骤如下:在pcr管中加入:random 6mers(50μm)1μl,dntp mixture(10mm each)1μl,total rna 2μg,rnase free dh2o补齐至10μl,充分混匀,瞬时离心使溶液至pcr管底部。在pcr仪上65℃反应5min,冰上急冷。
20.根据vympbq基因序列设计引物:
21.flvympbq-f:caattatcaccgtgaaatagcacaaaatac,
22.flvympbq-r:atcttccatacggaatgctaaccagtgt。
23.进行目的基因的pcr检测,pcr反应体系如下:1μl的反转录模板;正反向引物各1μl;dntp mix 2.5μl,dna polymerase 1.0μl,双纯水补齐至50μl。反应程序为:95℃,30s;进入循环,共计40个循环(95℃,5s;57℃,30s;72℃,30s);72℃,5min。
24.扩增产物经1%琼脂糖凝胶电泳后,切下目的片段,凝胶回收纯化,并克隆到pmd18-t载体上,经菌落pcr检测,送至金唯智公司测序验证,得到pmd18-t-vympbq质粒。测序结果表明,vympbq基因编码序列全长为1172个核苷酸,核苷酸序列如seq id no.2所示,开放阅读框为1023个核苷酸,核苷酸序列如seq id no.1所示,可编码一个含340个氨基酸的蛋白,氨基酸序列如seq id no.3所示。
25.实施例2葡萄vympbq基因过量表达载体的构建
26.为研究葡萄vympbq基因的功能,将vympbq基因共1023bp的orf片段正确插入植物过量表达载体pcambia2300-gfp上。
27.根据前期克隆到的vympbq基因序列,设计可以扩增vympbq基因orf的上下游引物vympbq-orf-f和vympbq-orf-r;根据pcambia2300-gfp载体上的酶切位点,在引物vympbq-orf-f的5’端加上酶切位点xbai,具体序列为gggtctagaatggcttctgtaatgctaagtggagc,在引物vympbq-orf-r的5’端加上酶切位点kpni,具体序列为gggggtaccttagataggccaaccttttggaacaa。
28.以实施例1中得到的pmd18-t-vympbq质粒为模板,用vympbq-orf-f与vympbq-orf-r进行扩增,回收目的条带后连接到pmd19-t克隆载体,转化top10感受态细胞,在附加amp的lb培养基上进行蓝白斑筛选,分别经过菌液pcr与质粒酶切检测,pmd19-t-vympbq阳性克隆送公司测序。用xbai、kpni双酶切重组克隆载体pmd19-t-vympbq与植物表达载体pcambia2300-gfp,回收线性化载体与目标片段,连接并转化top10,经kan抗生素筛选,挑取单克隆摇菌,菌液检测后提质粒酶切检测,形成植物表达载体pcambia2300-vympbq。
29.实施例3葡萄vympbq基因在拟南芥中的过量表达
30.取出在75%的乙醇中的电击杯,擦干,置于紫外灯下处理20min;取出农杆菌gv3101感受态细胞,置于冰上融化,完全溶化后转移至电击杯中,加入10μl质粒pcambia2300-vympbq(10ng/μl),充分混匀,置于冰中5min;电击杯表面擦干,置于电击仪中,设置好参数后进行电转,然后取出电击杯;将电击杯中的转化液取出至1.5ml的离心管中,加入1ml lb培养基,28℃条件下培养1h;离心机中瞬时离心15s,去除部分上清液,悬浮后涂布在含有抗生素(含60mg/l的gent,100mg/l的kan)的lb平板上,置于28℃培养。挑取单菌落进行pcr检测,阳性克隆即为含有重组植物表达载体pcambia2300-vympbq的农杆菌。
31.将含有重组植物表达载体的农杆菌划线培养在lb平板(含60mg/l的gent,100mg/l的kan)上划线,置于28℃条件下培养24h;挑取单克隆在10ml lb液体培养基(附加相应的抗生素)中,在28℃条件下培养24h;取5ml菌液转移至50ml新鲜的lb液体培养基中,在28℃条件下继续培养,至菌液od600达到0.6左右;转移至离心瓶或离心管中,室温条件下,转速为4000rpm离心10min,去除上清液收集菌体;重悬于渗透缓冲液(0.5
×
ms,5%蔗糖,0.03%silwet l-77(ge health)),调od600至0.8;将拟南芥花序上已有的果荚去掉,花序完全浸入渗透液中10-30s(或用移液器直接将渗透液滴在花序上),立即去掉拟南芥叶或茎秆上的渗透液,将植株平放在托盘中,用塑料薄膜覆盖托盘,24h后取下薄膜,于温室中继续培养;为提高转化效率,7天之后用同样方法再次侵染;经过转化的拟南芥植株进行正常管理,待果荚现白色时进行收种子。
32.将收获的转基因种子用0.2%的tritonx-100浸泡10min;再用10%的次氯酸钠表面消毒,12min;灭菌水洗涤五次,每2min一次;用水将种子铺在含50mg/l卡那霉素的ms(0.5
×
ms,1%蔗糖,1%琼脂,ph 5.7)平板上,4℃黑暗培养两天;然后转移至22℃,16h光照的条件下培养。经除草剂筛选后仍然长势良好,真叶叶片及生长点呈深绿色且根部伸扎入培养基的幼苗即可初步确定为阳性苗。
33.对上述初步确定的阳性植株及对照植株(转入pcambia2300-gfp空载体),进一步在dna水平进行鉴定,采用sds微量提取法提取拟南芥叶片中总dna。分别以上述所提取的vympbq转基因植株及对照植株的dna为模板,在vympbq基因上设计上游引物(5'aaccctggacactggacaga3'),下游引物(5'aattgcaccaagaatgagcc3')组成引物对,进行pcr检测;反应体系(25μl)为:10
×
buffer 2.5μl;d ntps 0.5μl;taq酶0.3μl;ddh2o 16.2μl;
primer f 1.5μl;primerr 1.5μl;dna 2.5μl。反应程序为:94℃预变性5min;35个循环,94℃变性30s,58℃退火30s,72℃延伸1min;72℃延伸10min,4℃保存,pcr产物在1%琼脂糖凝胶上进行电泳检测。结果表明:在初步筛选得到的vympbq转基因植株能扩增出目的基因大小的特异性片段,而对照植株没有扩增出任何片段,进一步地确定筛选到的初步筛选到的vympbq转基因植株为转基因阳性植物。可见通过利用强启动子(花椰菜花叶病毒35s启动子)驱动原理的转基因技术,将vympbq基因的超量表达载体转入拟南芥中,获得了转基因拟南芥植株。
34.实验例1野葡萄vympbq基因的表达特性分析
35.燕山葡萄组培苗继代培养16d后,选择生长健壮表现一致的幼苗后续干旱处理。干旱处理时,将葡萄幼苗从培养基中拔出,置于滤纸上暴露在室温为(32
±
1)℃、相对湿度为55%、光周期为光照14h/黑暗10h的条件下处理,在0、2、6、12、24h取叶片进行分析。正常培养的组培苗作为干旱处理的对照。
36.在大田生长8~10a的燕山葡萄,在转色期取葡萄果实,于盛花期取根系(第一新生侧根)、茎(新展开叶下第4~5片叶的茎段)、叶(新展开叶下第4~5片)、花序和卷须(新生枝条的第1个枝)等组织进行分析。
37.用plus植物总rna提取试剂盒(天根)提取燕山葡萄取样组织中的总rna。普通反转录用primescriptii1st strand cdna synthesis kit(takara)合成cdna第一链。具体操作步骤如下:在pcr管中加入:random 6mers(50μm)1μl,dntp mixture(10mm each)1μl,total rna 2μg,rnase free dh2o补齐至10μl,充分混匀,瞬时离心使溶液至pcr管底部。在pcr仪上65℃反应5min,冰上急冷。
38.根据vympbq基因序列设计实时荧光定量pcr引物,正向引物序列为qrt-vympbq-f(5'ccagaacaatagcacccaaat3'),反向引物序列为qrt-vympbq-r(5'cctagagtagtgaacccagtccc3')。以vygapdh基因为内参,其正向引物序列为qrt-vygapdh-f(5'cccttgtcctcccaactct3'),反向引物序列为qrt-vygapdh-r(5'ccttctcagcactgtccct3')。
39.实时荧光定量pcr按照takarapremix ex taq
tm ii(perfect real time)说明在bio-rad iq5 real-time pcr detection system(bio-radlaboratories,hercμles,ca)上进行。25μl的反应体系:1μl的反转录模板;正反向引物各1μl;12.5μl的premix ex taq
tm
;9μl的双纯水;反应程序为:95℃,30s;进入循环,共计40个循环(95℃,5秒;57℃,30s;72℃,30s)。结果采用2-δδc(t)
法进行分析,如图1所示。
40.由图1可知,vympbq主要在叶片中大量表达,其次是在花、根、茎中表达量较高,在果实和卷须中的表达量最低。经过干旱处理后,vympbq表达量逐渐增加,在干旱处理后的12h达到峰值,随后在24h表达量又有所降低。
41.以下实验例2~4中的vympbq转基因t3代植株均为实施例3中筛选的vympbq转基因植株的转基因t3代阳性纯合植株。
42.实验例2转基因拟南芥植株的抗旱性鉴定
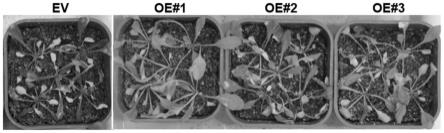
43.将vympbq转基因t3代植株和对照植株(转入pcambia2300-gfp空载体)在ms培养基上生长7天后,转移至营养钵中,正常浇水20天使其生长成健壮的幼苗。然后停止给拟南芥幼苗浇水即进行干旱处理,直到第14天部分拟南芥植株叶片出现明显的失水萎焉症状。干
旱处理后拟南芥植株的表现型通过拍照记录,结果见图2。由图2可知,对照植株(图2中标记为ev)表现出对干旱敏感,呈现失水萎蔫的状态;3个vympbq转基因株系(图2中标记为oe#1、oe#2和oe#3)相对于对照植株更加抗旱,这说明过量表达vympbq导致拟南芥植株更加抗旱。
44.实验例3转基因拟南芥植株生理生化特性分析
45.对vympbq转基因t3代植株和对照植株(转入pcambia2300-gfp空载体)分别进行失水率测定,相对电导率测定以及叶绿素含量的测定,以及存活率的统计。
46.失水率的测定:vympbq转基因t3代植株和对照植株正常生长3周后,分别取约0.2g的莲座叶进行失水率的测定。将采取的莲座叶放置于干燥的滤纸上,每隔10min测量一次叶片的鲜重(fw),直到测至50min时失水率测定结束。将每一次测定的失水量与第一次测定的鲜重的比值作为失水率,结果见图3。
47.相对电导率的测定:将叶片装入离心管中,用超去离子水定容至10ml,室温下振荡1小时后测定溶液的电导值,记为煮前c1。随后将溶液连同叶片置于沸水中煮沸10min后,等温度降至室温后测定电导值,记为c2。将c1与c2的比值(c1/c2)作为相对电导率,结果见图3。
48.叶绿素含量的测定:将新鲜的各株系拟南芥叶片剪成0.2cm左右的细丝或小块混合均匀后,称取0.1-0.2g,放入50ml的离心管中,在容量瓶或试管中加入0.5ml纯丙酮和10-15ml 80%的丙酮,并仔细将粘附在瓶壁边缘的叶子碎末洗到丙酮溶液中,盖上瓶塞,室温下置摇床浸提过夜,次日取出容量瓶,观察叶组织已全部变白时,表示叶绿素已浸提干净,然后用80%丙酮定容至25ml,离心后,波长645nm、663nm、652nm比色测定,计算叶绿素总含量,计算公式如下:叶绿素总含量(mg/g鲜重)=(20.21
×
a645 8.02
×
a663)
×
v提
×d÷m÷
1000=0.01
×
(20.21
×
a645 8.02
×
a663)
×d÷
m,其中v提:提取液体积,10ml;d:稀释倍数;m:样本质量,g。计算结果见图3。
49.存活率统计:干旱处理20天后存活的拟南芥植株除以处理前所有植株的总数,上述结果乘以100%即为存活率,结果见图3。
50.由图3可知,相对于转化空载体的拟南芥植株,超量表达vympbq基因导致转基因拟南芥中抗逆相关物质的积累,转基因植株抗旱性增强。
51.实验例4转基因拟南芥抗旱相关基因表达分析
52.用plus植物总rna提取试剂盒提取vympbq转基因t3代植株和对照植株(转入pcambia2300-gfp空载体)叶片总rna。普通反转录用primescript
ii
1st strand cdna synthesis kit(takara)合成cdna第一链,具体操作步骤如下:
53.在pcr管中加入:random 6mers(50μm)1μl,dntp mixture(10mm each)1μl,total rna 2μg,rnase free dh2o补齐至10μl,充分混匀,瞬时离心使溶液至pcr管底部。在pcr仪上65℃反应5min,冰上急冷。
54.拟南芥atactin为内参基因
55.正向引物序列qrt-atactin-f:5
’‑
cggtggttctatcttggcatc-3’,
56.反向引物序列qrt-atactin-r:5
’‑
gtctttcgcttcaataacccta-3’。
57.atcor15a基因
58.正向引物序列qrt-atcor15a-f:5
’‑
cagcggagccaagcagagcag-3’,
59.反向引物序列qrt-atcor15a-r:5
’‑
catcgaggatgttgccgtcacc-3’。
60.aterd15基因
61.正向引物序列qrt-aterd15-f:5
’‑
ccagcgaaatggggaaacca-3’,
62.反向引物序列qrt-aterd15-r:5
’‑
acaaaggtacagtggtggc-3’。
63.atrd29a基因
64.正向引物序列qrt-atrd29a-f:5
’‑
gttactgatcccaccaaagaaga-3’,
65.反向引物序列qrt-atrd29a-r:5
’‑
ggagactcatcagtcacttcca-3’。
66.atp5cs1基因
67.正向引物序列qrt-atp5cs1-f:5
’‑
cgacggagacaatggaattgt-3’,
68.反向引物序列qrt-atp5cs1-r:5
’‑
gatcagaaatgtgtaggtagc-3’。
69.实时荧光定量pcr按照takarapremix ex taq
tm ii(perfect realtime)说明在bio-rad iq
5 real-time pcr detection system(bio-rad laboratories,hercμles,ca)上进行。25μl的反应体系:1μl的反转录模板;正反向引物各1μl;12.5μl的premix ex taq
tm
;9μl的双纯水。反应程序为:95℃,30s;进入循环,共计40个循环(95℃,5s;57℃,30s;72℃,30s)。结果采用2-δδc(t)
法进行分析,如图4所示。根据已有的知识,拟南芥中的atcor15a、aterd15、atrd29a、atp5cs1为抗旱标志基因。由图4可知,在vympbq转基因t3代植株的3个株系中(图2中标记为oe#1、oe#2和oe#3),atcor15a、aterd15、atrd29a、atp5cs1抗旱标志基因的表达量显著高于对照植株(图2中标记为ev),这表明过量表达vympbq导致拟南芥中atcor15a、aterd15、atrd29a、atp5cs1抗旱标志基因表达量增加,从而增加了转基因植株的抗旱性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
