细胞表面表达抗人dsg3 scfv的模式细胞及其构建方法
技术领域
1.本发明属于分子生物学领域,具体涉及一种细胞表面表达抗人dsg3 scfv的模式细胞及其构建方法。
背景技术:
2.近年来,嵌合抗原受体(chimeric antigen receptor,car)-t细胞为肿瘤治疗带来了令人瞩目的革新性进展和疗效。利用cd8 t细胞活化后会分化为具有高效杀伤靶细胞的ctl细胞这一特性,利用基因修饰技术使cd8 t细胞表面表达一个人工设计的跨膜蛋白分子:胞外区是特异性识别抗原分子的单链抗体(single chain fragment variable,scfv),又称抗原受体(antigen receptor),胞内区是tcr/cd3ζ和共刺激分子胞内区部分。此人工嵌合抗原受体chimeric antigen receptor分子,通俗简称为car分子。t细胞装备上car分子后,可利用胞外区抗原受体直接特异性识别肿瘤抗原,无需mhc分子递呈,同时将识别信号传递到胞内,无需共刺激分子提供的第二活化信号,直接激活t细胞,成为ctl细胞,杀伤肿瘤细胞,达到清除肿瘤的目的。car-t克服了mhc限制性与共刺激分子第二信号的需求,可更有效杀伤特异性肿瘤细胞。此外,car-t细胞不仅不会像传统药物那样被机体代谢清除,而且还会保留细胞免疫的记忆功能:在杀伤靶细胞后有一部分ctl效应细胞成为效应记忆型t细胞在体内长存,可随时对全身出现的肿瘤细胞进行特异性杀伤清除,达到一次性治愈目的。car-t的出现也颠覆了人们对药物的定义:不再局限于化学小分子或生物大分子,不再进入体内后不再被代谢清除,而是多功能的具有自我增殖的活体细胞,像终身免疫的疫苗一样可一次治疗终身受益。2013年,美国《科学》杂志将car-t肿瘤免疫治疗评为“年度十大科学突破”之首。2017年8月30日,美国fda批准诺华公司kymriah产品cd19.car-t细胞可用于治疗25岁以下青少年难治或二次复发的b细胞前体急性淋巴细胞白血病(acute lymphocytic leukemia,all)。该药物成为fda批准的首款活体药物,也是全球范围内批准的首款car-t产品。2018年5月1日,fda批准了kymriah产品的第二个临床适应症治疗:非霍奇金淋巴瘤(non-hodgkin's lymphoma,nhl)。大量的临床试验数据已表明,特异性结合靶向分子的car-t细胞可以成功应用于临床,并能一次性治愈疾病。2021年6月,我国首个批准上市的细胞治疗类产品阿基仑赛注射液—自体cd19.car-t,用于治疗既往接受二线或以上系统性治疗后复发或难治性大b细胞淋巴瘤成人患者(包括弥漫性大b细胞淋巴瘤非特指型、原发纵隔大b细胞淋巴瘤、高级别b细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大b细胞淋巴瘤)。
3.细胞药物的活性评价中有一个很重要的指标:对靶细胞的杀伤能力测定。一般将细胞药物与靶细胞共孵育,检测在一定效靶比情况下的靶细胞清除率来反映细胞药物的特异性杀伤活性。本专利申请的模式细胞便是一种靶细胞,可作为体外检测和评价抗天疱疮细胞药物活性的评价工具。
4.天疱疮(pemphigus)是一种慢性、复发性的由表皮细胞松解引起的重症自身免疫性疾病,临床上表现为皮肤、粘膜水疱、大疱,疱壁易破,严重病例水疱破裂后可形成广泛的
糜烂面,导致皮肤屏障破坏、细菌感染、电解质失衡、低蛋白血症等并发症,可引起患者死亡。其发病率相对较低,但死亡率高,超过70%至将近100%的患者在1-5年内死亡。尽管随着糖皮质激素及免疫抑制剂的应用使其死亡率明显下降,但长期大剂量应用免疫抑制剂后会引发感染、多重器官功能衰竭等并发症,导致目前引起患者死亡的主要原因并不是疾病本身,而是来自于糖皮质激素及免疫抑制剂的副作用。该病反复发作,患者不仅体无完肤,且伴随疼痛,目前临床糖皮质激素及免疫抑制剂治疗所带来的副作用也给患者及其家庭、社会造成严重影响和负担。每周一次的1000ml~2000ml的血浆置换疗法也只是疾病进展迅速,血清天疱疮抗体滴度高,对大剂量皮质激素治疗不敏感时采用,仅起到暂时缓解症状作用。由于免疫系统b细胞所有克隆都表达cd20分子,因此美国有临床研究用近几年美国罗氏公司研发的以cd20为靶点消除b细胞的单抗药物利妥昔(商品名:美罗华)来治疗天疱疮,虽然可以短期缓解95%天疱疮患者症状,但复发率高达81%,可发生致死性感染,且价格昂贵(1~2万/支),需要长期用药,负担过于沉重以致国内鲜于应用临床。
5.虽然病因至今尚未阐明,但作为一种器官特异性自身免疫性疾病的天疱疮,患者血清均存在的天疱疮抗体igg无疑是致病关键。该自身抗体作用于用以维持角质形成细胞间机械完整性的桥粒结构成分之一的桥粒芯糖蛋白(desmoglein,dsg),引发自身组织损伤的免疫反应,导致棘层松解,表皮内裂隙、水疱,粘膜功能丧失。直接免疫荧光检测沉积于上皮组织的自身igg抗体是临床上确诊天疱疮的金标准。由于抗体作用抗原的部位不同,临床表现略有不同。临床最为常见的主要是寻常型天疱疮(pemphigus vulgaris,pv)。寻常型天疱疮pv的自身抗原为dsg3,主要存在于皮肤黏膜基底层和棘层,自身抗体igg与之结合后,发生病理性免疫应答,导致基底层和棘层细胞松解。由此可见,anti-dsg3抗体是临床常见的寻常型天疱疮的致病关键因子。彻底清除anti-dsg3抗体有望治愈寻常型天疱疮。机体抗体的产生来自成熟b细胞分化的浆细胞。每个b细胞克隆只产生一种特异性针对特定抗原的抗体分子。因此彻底清除患者体内产生anti-dsg3抗体这个b细胞克隆,便能彻底根除患者自身抗体的来源,达到治愈目的。寻常型天疱疮患者体内anti-dsg3-bcr b细胞克隆表面bcr特异性识别的抗原为皮肤黏膜角质形成细胞间的桥粒芯糖蛋白dsg3。
6.由于人体内自身抗体的b细胞克隆数量少,比例极低,很难从患者体内b细胞中单独分选出该自身反应性b细胞克隆,因此需要利用模式细胞作为靶细胞来验证该细胞药物的关键活性作用。细胞药物活性评价最重要的一个指标便是细胞药物(效应细胞)对靶细胞的特异性杀伤实验(在一定效靶比情况下的靶细胞清除率)。本专利所申请的是细胞药物研发中重要的靶细胞,一种基因修饰的细胞作为检测细胞药物活性的工具。
技术实现要素:
7.本发明所要解决的技术问题为:如何构建一种基因修饰的表面表达抗人dsg3 scfv的细胞,作为体外检测和评价抗天疱疮细胞药物活性的评价工具。
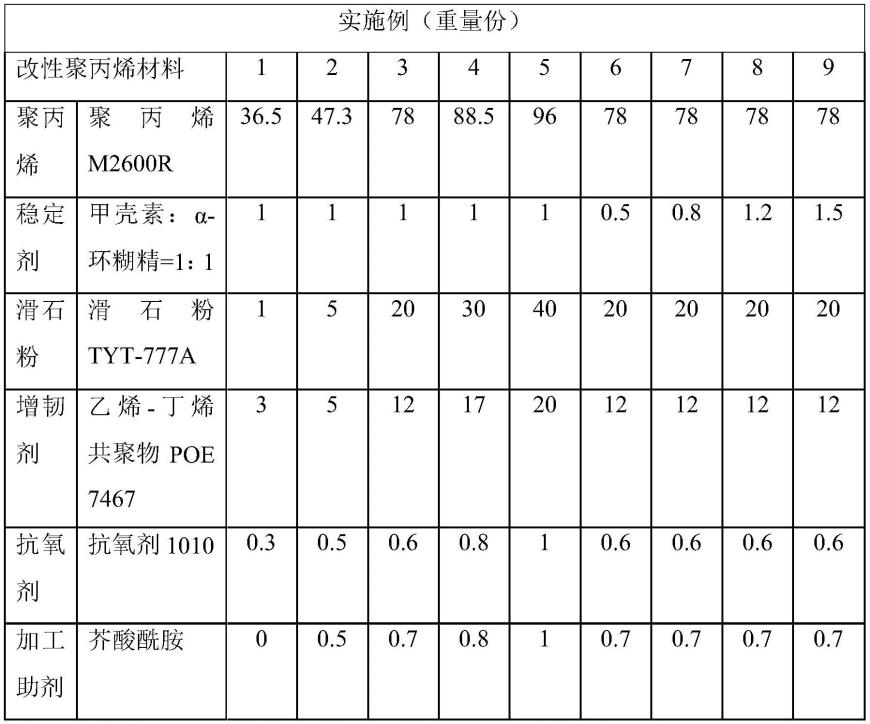
8.本发明的技术方案为:一种经人工修饰的模式细胞,该细胞膜表面表达人工设计多肽,所述人工设计多肽包含引导区、人源化dsg3特异单链抗体scfv、铰链区和跨膜区,其中人源化dsg3特异单链抗体scfv的氨基酸序列如seq id no.1所示。
9.进一步地,所述引导区的氨基酸序列如seq id no.2所示。
10.进一步地,所述铰链区的氨基酸序列如seq id no.3所示。
11.进一步地,所述跨膜区的氨基酸序列如seq id no.4所示。
12.进一步地,所述人工设计多肽的氨基酸序列如seq id no.5所示。
13.一种经人工修饰的模式细胞,该细胞含有编码seq id no.5所示多肽的基因片段。
14.进一步地,所述基因片段如seq id no.6所示。
15.人工设计多肽的dna序列可以通过dna合成获得,也可以通过基因工程技术进行片段剪接最终获得。
16.本发明提供的模式细胞可通过慢病毒载体转导入细胞基因组中,实现稳定性固有表达在细胞膜上,也可以通过腺病毒转染或质粒电转、mrna形式电转等方式,实现诱导性表达或瞬时表达在细胞膜上。
17.由于本发明提供的模式细胞不局限于人的细胞株,也包含酵母等真核细胞、细菌等原核细胞。
18.模式细胞的构建方法,将包含seq id no.6所示的核苷酸序列插入表达载体中,然后将该表达载体转染细胞。
19.进一步地,所述表达载体为慢病毒载体或腺病毒载体。
20.模式细胞的构建的具体步骤如下:
21.(1)人工合成seq id no.7所示的dna片段,
22.(2)以步骤(1)得到的dna片段为模板,以seq id no.8和seq id no.9所示的引物对作为引物,进行pcr扩增,
23.(3)将步骤(2)的扩增片段插入慢病毒载体phage2,
24.(4)将步骤(3)得到的慢病毒载体在大肠杆菌中克隆,并筛选阳性单克隆,
25.(5)将步骤(4)得到的阳性单克隆与辅助包装质粒plp1、plp2、plp-vsvg转染293ft细胞制备慢病毒,
26.(6)将步骤(5)得到的慢病毒转导进nalm6细胞,即得模式细胞。
27.与现有技术相比,本发明具有以下有益效果:
28.本发明的模式细胞表面表达人工设计的膜型抗dsg3单链抗体,可与表达抗dsg3自身抗体受体(chimeric autoantibody receptor,caar)的t细胞,即caar-t细胞结合,用于鉴定嵌合自身抗体受体(chimeric autoantibody receptor,caar)caar-t细胞的杀伤评价体系,为caar-t细胞的应用提供简便易得的实验工具。
附图说明
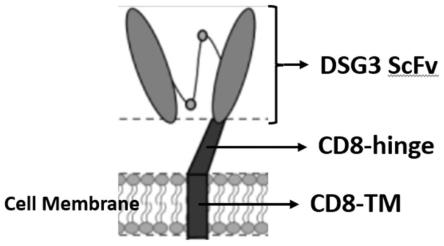
29.图1为人工设计的膜型多肽结构示意图;
30.图2为人工设计的膜型多肽编码区组成示意图;
31.图3为流式检测所获得的膜表面表达dsg3-scfv
的模式细胞;左图,野生型nalm6细胞,不表达dsg3-scfv。右图,野生型nalm6细胞经dsg3-scfv慢病毒转导之后,通过有限稀释筛选,得到的单克隆细胞系,表达dsg3-scfv。
具体实施方式
32.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
33.一种膜表面表达人工设计多肽的模式细胞,其结构示意图如图1所示。该人工设计多肽包含引导区、人源化dsg3特异单链抗体scfv、铰链区和跨膜区。
34.其中的人源化dsg3特异单链抗体scfv氨基酸序列为:
35.qvqlvqsgaelvrpgasvklscqasgytftshyihwvrqapgqerewgwinpsggktntnqnfkdkatltvdksssaaytsedsavyfcardqslgmdvwgqgtlvtsaggggsggggsdiqmtqspsslsasvgdrvtitcssdigrynfwyqqkpgkapkkliyevsgvpsrfsgsgtdftltissedfatyyctqstdfpwtfgqgtkvdik(seq id no.1)。
36.引导区序列优选为:malpvtalllplalllhaarp(seq id no.2)。
37.铰链区序列优选为:tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacd(seq id no.3)。
38.跨膜区序列优选为:iyiwaplagtcgvlllslvitlyc(seq id no.4所示)
39.人工设计多肽的完整序列优选为:
40.malpvtalllplalllhaarpqvqlvqsgaelvrpgasvklscqasgytftshyihwvrqapgqerewgwinpsggktntnqnfkdkatltvdksssaaytsedsavyfcardqslgmdvwgqgtlvtsaggggsggggsdiqmtqspsslsasvgdrvtitcssdigrynfwyqqkpgkapkkliyevsgvpsrfsgsgtdftltissedfatyyctqstdfpwtfgqgtkvdiktttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyc(seq id no.5所示)。
41.由于核苷酸密码子的简并性,下面是编码人工设计多肽的其中一种编码序列:
42.atggccctgcccgtgaccgccctgctgctgcccctggccctgctgctgcacgccgccaggccccaggtgcagctggtgcagagcggcgccgagctggtgaggcccggcgccagcgtgaagctgagctgccaggccagcggctacaccttcaccagccactacatccactgggtgaggcaggcccccggccaggagagggagtggggctggatcaaccccagcggcggcaagaccaacaccaaccagaacttcaaggacaaggccaccctgaccgtggacaagagcagcagcgccgcctacaccagcgaggacagcgccgtgtacttctgcgccagggaccagagcctgggcatggacgtgtggggccagggcaccctggtgaccagcgccggcggcggcggcagcggcggcggcggcagcgacatccagatgacccagagccccagcagcctgagcgccagcgtgggcgacagggtgaccatcacctgcagcagcgacatcggcaggtacaacttctggtaccagcagaagcccggcaaggcccccaagaagctgatctacgaggtgagcggcgtgcccagcaggttcagcggcagcggcaccgacttcaccctgaccatcagcagcgaggacttcgccacctactactgcacccagagcaccgacttcccctggaccttcggccagggcaccaaggtggacatcaagaccaccacccccgcccccaggccccccacccccgcccccaccatcgccagccagcccctgagcctgaggcccgaggcctgcaggcccgccgccggcggcgccgtgcacaccaggggcctggacttcgcctgcgacatctacatctgggcccccctggccggcacctgcggcgtgctgctgctgagcctggtgatcaccctgtactgc(seq id no.6所示)。
43.人工设计多肽的dna序列可以通过dna合成获得,也可以通过基因工程技术进行片段剪接最终获得。
44.本发明提供的模式细胞可通过慢病毒载体转导入细胞基因组中,实现稳定性固有表达在细胞膜上,也可以通过腺病毒转染或质粒电转、mrna形式电转等方式,实现诱导性表达或瞬时表达在细胞膜上。
45.本发明提供的模式细胞不局限于人的细胞株,也包含酵母等真核细胞、细菌等原核细胞。
46.实施例1
47.通过人工合成包含seq id no.6所示核苷酸的dna片段,该dna片段的具体序列如seq id no.7所示,结构如图2所示。该片段包括cd8-leader引导区,scfv区(人源化dsg3特异单链抗体scfv片段),cd8-hinge铰链区和cd8-tm区(跨膜区)。seq id no.7具体序列如下:
48.gtcgacgccaccatggccctgcccgtgaccgccctgctgctgcccctggccctgctgctgcacgccgccaggccccaggtgcagctggtgcagagcggcgccgagctggtgaggcccggcgccagcgtgaagctgagctgccaggccagcggctacaccttcaccagccactacatccactgggtgaggcaggcccccggccaggagagggagtggggctggatcaaccccagcggcggcaagaccaacaccaaccagaacttcaaggacaaggccaccctgaccgtggacaagagcagcagcgccgcctacaccagcgaggacagcgccgtgtacttctgcgccagggaccagagcctgggcatggacgtgtggggccagggcaccctggtgaccagcgccggcggcggcggcagcggcggcggcggcagcgacatccagatgacccagagccccagcagcctgagcgccagcgtgggcgacagggtgaccatcacctgcagcagcgacatcggcaggtacaacttctggtaccagcagaagcccggcaaggcccccaagaagctgatctacgaggtgagcggcgtgcccagcaggttcagcggcagcggcaccgacttcaccctgaccatcagcagcgaggacttcgccacctactactgcacccagagcaccgacttcccctggaccttcggccagggcaccaaggtggacatcaagaccaccacccccgcccccaggccccccacccccgcccccaccatcgccagccagcccctgagcctgaggcccgaggcctgcaggcccgccgccggcggcgccgtgcacaccaggggcctggacttcgcctgcgacatctacatctgggcccccctggccggcacctgcggcgtgctgctgctgagcctggtgatcaccctgtactgctaagcggccgc。
49.2、将该dna片段pcr扩增,dna电泳回收片段后,插入的表达载体中,表达载体选择慢病毒载体phage2。
50.(1)pcr扩增得到含cd8 leader-dsg3.scfv-cd8hinge-tm的外源dna片段,以备插入慢病毒表达载体中:以seq id no.8和seq id no.9所示的引物对为引物,以合成的seq id no.7所示的dna片段为模板进行pcr。
51.pcr反应体系50μl:primestar max premix 1倍工作浓度,上游引物和下游引物的浓度均为0.2~0.3μm,模板5μl。pcr反应条件:98℃变性10s,pcr 35个循环:95℃30s,60℃10s,72℃1min,循环结束后72℃5min,4℃静置。
52.(2)dna电泳:在dna样品中加入10
×
体积的载样缓冲液(loading buffer),混匀后,用枪将样品混合液缓慢加入被浸没的凝胶加样孔内,新鲜的tae缓冲液或tbe缓冲液当做运行缓冲液。接通电源,使dna样品由负极往正极泳动。电泳条件:60~100v电压,电泳20~40min(根据指示剂泳动的位置,判断是否终止电泳)。电泳完毕,关上电源,在凝胶成像仪上观察电泳带及其位置,并与核酸分子量标准marker比较被扩增产物的大小。
53.(3)目的片段回收:当条带足量分离时,使用宽、干净、锋利的解剖刀仔细的分离目的条带。去除额外的琼脂糖以得到最小化的凝胶片段。在干净的1.5ml微量离心管中将其称重,假设密度为1g/ml,凝胶体积如下:质量为0.3g的凝胶切片体积为0.3ml。添加等体积的takara胶回收试剂盒结合缓冲液binding buffer,50-60℃中孵育7min或直到凝胶完全融化。将融化的dna/琼脂糖溶液移入已插入mini柱的收集管中,室温10,000g离心1min。添加300μl结合液(xp2),室温13000g离心1min。弃去滤液并重新使用收集管。添加700μl spw洗液,以最大转数室温离心1min进行洗涤。洗涤2次后,将mini column以最大速度离心2min,以干燥柱基质,然后将mini column转移到干净的1.5ml微量离心管中,将15-30μl洗脱液或去离子水直接加入柱膜中心,室温2min,以最大
转数离心1min。收集获得的dna液储存在-20℃。
54.(4)慢病毒表达载体双酶切,反应体系20μl,30℃金属浴1h,37℃金属浴1h。
55.(5)利用takara t4 dna连接酶in-fusion hd enzyme premix将慢病毒表达载体phage2与扩增的目的dna片段:含编码cd8 leader-dsg3.scfv-cd8hinge-tm区域的dna序列进行连接反应:各成分按takara t4 dna连接酶说明书进行加入,50℃孵育15min,然后置冰上待用。
56.(6)将慢病毒表达载体与目的dna片段连接产物与感受态细胞dh5a在无菌ep管里混匀,42℃水浴热激90s,在期间不能够摇动细菌,立即冰上放置3-5min。吸取100μl菌液涂布含含有ampicillin(浓度100μg/ml)的固体培养基平板上,细菌于37℃倒置培养过夜(16h-22h)。挑取单克隆至3ml含氨苄抗性lb培养液中,37℃震荡培养16h。然后按照质粒提取试剂盒说明书步骤提取质粒。过柱纯化后酶切和测序鉴定,确定重组慢病毒表达载体质粒已构建成功。本实例选用的是慢病毒表达载体phage2,也可以选用其它慢病毒表达载体plvx进行构建。
57.3、慢病毒制备与浓缩:将辅助包装质粒plp1、plp2、plp-vsvg和构建的载体质粒phage2-dsg3scfv和适量的opti-mem混合于a管中。将lipofectamine 3000reagent与适量opti-mem混合于b管中。a和b管混匀,室温孵育15-20min。将孵育好的转染混合液轻轻滴加到293ft细胞培养皿中,混匀,培养箱37℃5%co2孵育6h,弃细胞培养皿中转染液,加入15ml含10%fbs的dmem完全培养液,继续培养箱孵育24h。收集病毒上清液,离心去除细胞碎片,用0.45μm滤器过滤,置4℃保存。培养皿中补加15ml含10%fbs的dmem完全培养液,继续孵育至48h。再次收集48h的病毒上清液,与24h上清液混合,用超滤管超滤浓缩后超速离心浓缩病毒(40000g离心3h)。测定滴度,置于-80℃保存。
58.4、慢病毒转导细胞,获得表达人工膜蛋白的模式细胞。细胞可以选择任一种真核细胞进行转导。本实例选用b细胞来源的nalm6细胞株,按照不同moi比例在nalm6细胞培养悬液中加入病毒,培养箱37℃5%co2孵育96h进行感染。通过有限稀释筛选,得到的单克隆细胞系,表达dsg3-scfv 细胞。图3为流式检测所获得的膜表面表达dsg3-scfv 的模式细胞,左图,野生型nalm6细胞,不表达dsg3-scfv。右图,野生型nalm6细胞经dsg3-scfv慢病毒转导之后,通过有限稀释筛选,得到的单克隆细胞系,表达dsg3-scfv。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。