maturation reporter system identifies novel drugs that promote platelet production,blood adv.,2(17),2262-2272,2018.
13.非专利文献3:kahr w.h.,et al.,loss of the arp2/3complex component arpc1b causes platelet abnormalities and predisposes to inflammatory disease,nat commun.,8:14816,2017.
技术实现要素:
14.发明所要解决的问题
15.但是,非专利文献2的方法中,在向ips细胞的初始化诱导及再次向巨核细胞的分化中需要大量的劳动及时间,效率差。另外,非专利文献3的方法中,由于导入基因插入到巨核细胞的基因组dna中、无法除去,存在外源基因的表达成为新抗原的风险、对内源基因功能造成不良影响的风险。更详细而言,使用慢病毒载体的基因组编辑中,会向基因组上插入cas9基因、sgrna等。因此,对得到的巨核细胞预料到脱靶突变导入风险、cas9蛋白表达所致的抗原性、基因组内源性对基因功能的影响(致癌基因的活化等),成为不适合临床应用的巨核细胞。另外,关于慢病毒的使用,存在实施设施受限制、制造成本提高之类的问题,需要其它更简便的方法。
16.基于这样的背景,本发明的目的在于提供制造基因改造巨核细胞和改造血小板的技术。
17.用于解决问题的方法
18.本发明包括以下方式。
19.[1]一种基因改造巨核细胞的制造方法,其包括向巨核细胞中导入crispr-associated(crispr相关,cas)家族蛋白和指导rna(grna)来改造对象基因的步骤,上述步骤中,要导入到上述巨核细胞中的上述cas家族蛋白与上述grna预先形成了复合物。
[0020]
[2]根据[1]所述的制造方法,其中,上述cas家族蛋白和上述grna的导入通过适合于蛋白质导入的脂质体转染法或电穿孔法进行。
[0021]
[3]根据[1]或[2]所述的制造方法,其中,上述cas家族蛋白和上述grna的导入通过电穿孔法进行。
[0022]
[4]根据[1]~[3]中任一项所述的制造方法,其中,上述对象基因为(i)人白细胞抗原(hla)-a、hla-b和hla-c基因、或(ii)β2-微球蛋白(b2m)基因,上述改造为上述对象基因的破坏。
[0023]
[5]根据[1]~[4]中任一项所述的制造方法,其中,上述巨核细胞是使多能干细胞分化而得到的巨核细胞。
[0024]
[6]一种基因改造巨核细胞,其中,(i)hla-a、hla-b和hla-c基因、或(ii)b2m基因已被破坏。
[0025]
[7]一种改造血小板的制造方法,其包括:向巨核细胞中导入cas家族蛋白和grna来改造对象基因,从而得到基因改造巨核细胞的步骤;以及由上述基因改造巨核细胞产生血小板而得到改造血小板的步骤,得到上述基因改造巨核细胞的步骤中,要导入到上述巨核细胞中的上述cas家族蛋白与上述grna预先形成了复合物。
[0026]
[8]根据[7]所述的制造方法,其中,上述cas家族蛋白和上述grna的导入通过适合
于蛋白质导入的脂质体转染法或电穿孔法进行。
[0027]
[9]根据[7]或[8]所述的制造方法,其中,上述cas家族蛋白和上述grna的导入通过电穿孔法进行。
[0028]
[10]根据[7]~[9]中任一项所述的制造方法,其中,上述巨核细胞是使多能干细胞分化而得到的巨核细胞。
[0029]
[11]根据[7]~[10]中任一项所述的制造方法,其中,上述对象基因为(i)hla-a、hla-b和hla-c基因、或(ii)b2m基因,上述改造为上述对象基因的破坏。
[0030]
[12]一种hla缺损血小板,其中,hla-a蛋白、hla-b蛋白和hla-c蛋白发生了缺损。
[0031]
[13]根据[12]所述的hla缺损血小板,其利用[11]所述的制造方法来制造。
[0032]
[14]一种基因改造巨核细胞的制造方法,其包括向巨核细胞中导入cas家族蛋白和grna来改造对象基因的步骤,上述步骤中,上述cas家族蛋白和上述grna的导入通过电穿孔法进行。
[0033]
[15]根据[14]所述的制造方法,其中,上述巨核细胞是使多能干细胞分化而得到的巨核细胞。
[0034]
[16]根据[14]或[15]所述的制造方法,其中,相对于巨核细胞数每1000个使用cas家族蛋白0.1~1pmol和grna0.1~1pmol来进行电穿孔法。
[0035]
[17]根据[14]~[16]中任一项所述的制造方法,其中,上述对象基因为(i)人白细胞抗原(hla)-a、hla-b和hla-c基因、或(ii)β2-微球蛋白(b2m)基因,上述改造为上述对象基因的破坏。
[0036]
[18]一种基因改造巨核细胞,其利用[17]所述的制造方法来制造,(i)hla-a、hla-b和hla-c基因、或(ii)b2m基因已被破坏。
[0037]
[19]一种改造血小板的制造方法,其包括:通过使用电穿孔法向巨核细胞中导入cas家族蛋白和grna来改造对象基因、从而得到基因改造巨核细胞的步骤;以及由上述基因改造巨核细胞产生血小板而得到改造血小板的步骤。
[0038]
本发明还可以包含以下方式。
[0039]
[p1]一种基因改造巨核细胞的制造方法,其包括向巨核细胞中导入crispr相关(cas)家族蛋白和指导rna(grna)来改造对象基因的步骤。
[0040]
[p2]根据[p1]所述的基因改造巨核细胞的制造方法,其中,上述cas家族蛋白和grna的导入通过电穿孔法进行。
[0041]
[p3]根据[p1]或[p2]所述的基因改造巨核细胞的制造方法,其中,上述对象基因为(i)人白细胞抗原(hla)-a、hla-b和hla-c基因、或(ii)β2-微球蛋白(b2m)基因,上述改造为上述对象基因的破坏。
[0042]
[p4]根据[p1]~[p3]中任一项所述的基因改造巨核细胞的制造方法,其中,上述巨核细胞是使多能干细胞分化而得到的巨核细胞。
[0043]
[p5]一种基因改造巨核细胞,其中,(i)hla-a、hla-b和hla-c基因、或(ii)b2m基因已被破坏。
[0044]
[p6]一种改造血小板的制造方法,其包括:向巨核细胞中导入cas家族蛋白和grna来改造对象基因、从而得到基因改造巨核细胞的步骤;以及由上述基因改造巨核细胞产生血小板而得到改造血小板的步骤。
[0045]
[p7]根据[p6]所述的改造血小板的制造方法,其中,上述cas家族蛋白和grna的导入通过电穿孔法进行。
[0046]
[p8]根据[p6]或[p7]所述的改造血小板的制造方法,其中,上述对象基因为(i)hla-a、hla-b和hla-c基因、或(ii)b2m基因,上述改造为上述对象基因的破坏。
[0047]
[p9]根据[p6]~[p8]中任一项所述的改造血小板的制造方法,其中,上述巨核细胞是使多能干细胞分化而得到的巨核细胞。
[0048]
[p10]一种hla缺损血小板,其中,hla-a蛋白、hla-b蛋白和hla-c蛋白发生了缺损。
[0049]
发明效果
[0050]
根据本发明,可以提供制造基因改造巨核细胞和改造血小板的技术。
附图说明
[0051]
图1为示出实验例1中的流式细胞术分析的结果的图。
[0052]
图2为示出实验例2中的流式细胞术分析的结果的图。
[0053]
图3(a)为示出实验例3中的流式细胞术分析的设门设定的图。(b)为示出实验例3中的流式细胞术分析的结果的图。
[0054]
图4(a)及(b)为示出实验例4中的流式细胞术分析的结果的图。
[0055]
图5(a)及(b)为示出实验例5中的流式细胞术分析的结果的图。
[0056]
图6(a)及(b)为示出实验例5中的流式细胞术分析的结果的图。
[0057]
图7(a)及(b)为示出实验例5中的流式细胞术分析的结果的图。
[0058]
图8(a)及(b)为示出实验例5中的流式细胞术分析的结果的图。
具体实施方式
[0059]
[基因改造巨核细胞的制造方法]
[0060]
一个实施方式中,本发明提供基因改造巨核细胞的制造方法,其包括向巨核细胞中导入cas家族蛋白及grna来改造对象基因的步骤。本实施方式的制造方法中,要导入到巨核细胞中的cas家族蛋白与grna预先形成了复合物。
[0061]
通常,与向细胞中直接导入蛋白质相比,向细胞中导入表达载体并使其在细胞内表达时,细胞内蛋白质量会更多。因此,为了高效率地进行基因组编辑而以表达载体的形态将cas家族蛋白及grna导入到细胞中是本领域技术人员的技术常识。与此相对地,如后述实施例中所述,发明人明确了:通过向巨核细胞中导入cas家族蛋白与grna的复合物而进行基因组编辑,能够高效地改造对象基因。
[0062]
另外,如后述实施例中所述,与导入质粒dna进行基因组编辑的情况相比,通过导入cas家族蛋白与grna的复合物,能够在早期高效率地进行基因改造。
[0063]
(巨核细胞)
[0064]
本实施方式的制造方法中,巨核细胞可以来自人,也可以来自非人动物,根据目的适宜选择即可。可以为从人或非人动物采集的巨核细胞,可以为由采自人或非人动物的造血干细胞分化诱导而得到的巨核细胞,可以为对来自人或非人动物的多能干细胞进行分化诱导而得到的巨核细胞。作为多能干细胞,可列举胚胎干细胞(es细胞)、诱导多能干细胞(ips细胞)等。
[0065]
巨核细胞也可以进行过基因操作。例如,可以为通过在多西环素存在下强制表达bmi1基因、c-myc基因及bcl-xl基因而永生化的巨核细胞等。这样的巨核细胞可以在多西环素存在下进行扩大培养,可以通过除去多西环素而产生血小板。
[0066]
(cas家族蛋白)
[0067]
作为cas家族蛋白,可列举例如cas9、cpf1(别名cas12a)、c2c1(别名cas12b)、c2c2(别名cas13a)、casx、casy、cas1、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas10等。crispr-cas系统可分为i类和ii类。以往通常使用以cas9为核心的ii类系统,但是现在也可以利用i类系统。
[0068]
cas家族蛋白可以是这些蛋白质经过了改造的物质。例如,可以是将存在的2个野生型核酸酶结构域中的一者改造为无活性型的切口酶改造型核酸酶,也可以是将两者改造为无活性型的dcas9等。或者,可以是靶特异性提高的cas9-hf、hifi-cas9、ecas9等。另外,可以是在这些cas9上融合有其它蛋白质(酶等)的物质。
[0069]
作为cas9蛋白,可列举例如来自化脓性链球菌、金黄色葡萄球菌、嗜热链球菌、嗜热脂肪芽孢杆菌等的蛋白质。作为cpf1蛋白,可列举例如来自氨基酸球菌属、毛螺菌属、衣藻、新凶手弗朗西斯菌等的蛋白质。
[0070]
(grna)
[0071]
grna使用与所用cas家族蛋白对应的grna。利用grna来决定cas家族蛋白诱导双链dna断裂的基因组dna上的位置、即要改造的对象基因。
[0072]
本说明书中,grna的靶碱基序列是指与grna的间隔碱基序列所杂交的dna形成互补链的单链dna上的碱基序列。grna的间隔序列与靶序列的反义链互补结合。因此,grna的间隔碱基序列与靶序列的有义链的碱基序列的序列一致性高,grna的间隔碱基序列与靶序列的反义链的碱基序列大致互补。
[0073]
grna可以是crispr rna(crrna)与反式激活型crispr rna(tracrrna)的复合物,也可以是tracrrna和crrna组合而成的单一的grna(sgrna)。
[0074]
作为以rna的形态制备grna的方法,可列举:在编码grna的核酸片段的上游添加t7等启动子而制作构建体、并通过试管内转录反应进行合成的方法;进行化学合成的方法等。在化学合成grna的情况下,可以使用经化学修饰的rna。
[0075]
例如,当从靶碱基序列除去pam序列的碱基序列为“5
’‑
nnnnnnnnnnnnnnnnnnnn-3
’”
(序列号1)时,特异性切断靶碱基序列的sgrna的碱基序列可以设为“5
’‑
nnnnnnnnnnnnnnnnnnnnguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuuu-3
’”
(序列号2)。
[0076]
sgrna的碱基序列只要作为sgrna起作用,则也可以相对于序列号2记载的碱基序列具有突变。更具体而言,可以为在序列号2记载的碱基序列中缺失、置换或添加了1个或数个碱基的碱基序列。在此,1个或数个碱基可以为例如1~10个碱基、例如1~5个碱基、例如1~3个碱基。
[0077]
grna为crrna与tracrrna的复合物时,crrna及tracrrna的碱基序列可以设为下述碱基序列。
[0078]
首先,将从靶碱基序列除去pam序列的碱基序列作为间隔碱基序列。接着,设计在间隔碱基序列的3’末端连接有支架序列(scaffold sequence)的碱基序列,作为crrna的碱
基序列。例如,当从靶碱基序列除去pam序列的碱基序列(间隔碱基序列)为“5
’‑
nnnnnnnnnnnnnnnnnnnn-3
’”
(序列号1)时,crrna的碱基序列可以设为“5
’‑
nnnnnnnnnnnnnnnnnnnnguuuuagagcuaugcuguuuug-3
’”
(序列号3)。另外,tracrrna的碱基序列例如可以设为“5
’‑
caaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc-3
’”
(序列号4)。
[0079]
crrna的碱基序列只要作为crrna起作用,则可以相对于序列号3记载的碱基序列具有突变。更具体而言,可以为在序列号3记载的碱基序列中缺失、置换或添加了1个或数个碱基的碱基序列。在此,1个或数个碱基可以为例如1~10个碱基、例如1~5个碱基、例如1~3个碱基。
[0080]
另外,tracrrna的碱基序列只要作为tracrrna起作用,则可以为在序列号4记载的碱基序列中缺失、置换或添加了1个或数个碱基的碱基序列。在此,1个或数个碱基可以为例如1~10个碱基、例如1~5个碱基、例如1~3个碱基。
[0081]
(cas家族蛋白及grna的导入)
[0082]
向巨核细胞中导入cas家族蛋白及grna的方法(转染方法)没有特别限定,可列举例如脂质体转染法、电穿孔法(electroporation method)、显微注射法等。本说明书中,“转染”是指:通过病毒感染以外的方法向细胞中导入核酸、蛋白质。在进行转染时,可以适宜地使用市售转染试剂。
[0083]
作为转染试剂,优选能够将蛋白质导入到细胞中的试剂,例如,可以利用lipofectamine crisprmax(赛默飞世尔科技公司)、pro-deliverin crispr转染试剂(oz biosciences公司)、avalanche(r)-crispr转染试剂(ez biossytems公司)等。
[0084]
另外,电穿孔法可以利用nepa21(
ネッパジーン
株式会社)、neon(赛默飞世尔科技公司)、4d-nucleofector(
ロンザ
公司)、maxcyte系统(maxcyte公司)等设备进行。
[0085]
cas家族蛋白及grna优选以复合物的形态导入到巨核细胞中。cas家族蛋白及grna可以通过混合而形成复合物。可以在导入到巨核细胞中前将cas家族蛋白和grna混合,孵育数分钟(例如1~10分钟、1~7分钟、1~5分钟、3~5分钟、5分钟左右)、例如孵育约5分钟,由此促进复合物形成。
[0086]
(对象基因)
[0087]
本实施方式的制造方法中,将对象基因上的碱基序列设定为grna的靶碱基序列。本实施方式的制造方法中,对象基因可以为(i)hla-a基因、hla-b基因及hla-c基因的组合。或者,对象基因可以为(ii)b2m基因。另外,“改造对象基因”可以为破坏对象基因。
[0088]
在此,对象基因的破坏是指:在由cas家族蛋白与grna的复合物引起的对象基因的切断部位导入缺失、插入的结果是,产生移码、终止密码子的导入、大规模缺失等,从而变得不能由对象基因表达功能性蛋白质。
[0089]
细胞在用于辨别自己和非己中发挥最重要的作用的是被称为hla(human leukocyte antigen、人白细胞抗原)或主要组织相容性复合物(major histocompatibility complex、mhc)的细胞表面蛋白。
[0090]
hla可分为i类和ii类。i类hla蛋白在体内几乎全部种类的细胞中表达。i类hla蛋白与β2-微球蛋白(b2m)形成异二聚体而向细胞表面表达,承担着对cd8阳性细胞杀伤性t细胞提呈肽、诱导活化的功能。所提呈的抗原肽为内源性的,大多具有8~10个氨基酸的长度。
[0091]
分类为i类hla的是主要hla-a基因、hla-b基因、hla-c基因、hla-e基因、hla-f基因、hla-g基因这6种基因。此外还已知多种假基因(hla-h、hla-j、hla-k、hla-l、hla-p、hla-t、hla-u、hla-v、hla-w、hla-x、hla-y等)。这些中,特别是个体间的序列多样性大的是hla-a基因、hla-b基因、hla-c基因这3种,在移植免疫中识别自己和非己中发挥着主要作用。
[0092]
ii类hla蛋白主要在巨噬细胞、树突细胞、活化t细胞、b细胞等免疫细胞中表达。ii类hla蛋白的α链和β链形成异二聚体,承担着对cd4辅助性t细胞提呈肽、诱导活化的功能。所提呈的抗原肽是外源性的,大多具有15~24个氨基酸的长度。
[0093]
分类为2类hla的是hla-dr(α链:hla-dra、β链:hla-drb)、hla-dq(α链:hla-dqa1、β链:hla-dqb1)、hla-dp(α链:hla-dpa1或hla-dpa2、β链:hla-dpb1或hla-dpb2)。此外,还已知存在多种假基因(hla-dma、hla-dmb、hla-doa、hla-dob)。
[0094]
hla-a蛋白、hla-b蛋白及hla-c蛋白与进行细胞移植时的排斥反应的相关性高。因此,通过制造破坏了巨核细胞的hla-a基因、hla-b基因及hla-c基因的基因改造巨核细胞、进而产生血小板,从而能够使血小板表面的hla蛋白的表达消失。由此,可期待能够降低血小板移植时的抗原性。另外,对于具有针对i类hla的抗体的患者,也能够提供可移植的血小板制剂。
[0095]
用于破坏巨核细胞的hla-a基因、hla-b基因及hla-c基因的grna的靶碱基序列确定该巨核细胞的hla等位基因,可以基于所确定的hla-a基因、hla-b基因及hla-c基因的碱基序列进行设计。
[0096]
hla等位基因的确定可以通过pcr-rsso法(pcr-reverse sequence specific oligonuclotide,pcr-反向序列特异性寡核苷酸)、pcr-ssp(sequence specific primer,序列特异性引物)法、pcr-sbt(sequence based typing,基于序列的分型)法、下一代测序法等以往进行的方法来进行,可以使用市售的hla分型试剂盒等来进行。另外,作为由全基因组测序(wgs)、外泌体测序(wes)、rna-seq等下一代测序的测序数据进行hla分型的软件,已知有hlareporter、hla-prg、hla-genotyper、phlat、optitype、nextype、athlates、hlaforest、soap-hla、hlaminer、seq2hla、gatk hla caller等,可以使用这些软件。
[0097]
另外,通过使i类hla蛋白的细胞表面提呈所需的b2m基因缺失,也能够使巨核细胞的hla-a蛋白、hla-b蛋白及hla-c蛋白缺损。
[0098]
另外,“改造对象基因”不限于破坏对象基因,也可以是对对象基因的碱基序列进行编辑。其结果是,由改造后的对象基因改造的蛋白质被表达。
[0099]
具体而言,可以通过在供体dna存在下特异性地切断对象基因而诱导双链dna断裂,在双链dna断裂的修复过程中诱导同源重组,从而改造对象基因。
[0100]
作为供体dna,可以使用与包含对象基因的双链dna断裂位置的前后的区域具有序列一致性且具有期望碱基序列的dna。供体dna可以为单链dna,也可以为双链dna。另外,供体dna可以为具有单一碱基序列的dna,也可以为具有多个碱基序列的dna的混合物。
[0101]
在此,具有序列一致性是指:在供体dna与成为靶的对象基因的包含双链切断的位置的区域之间90%以上的碱基序列一致。供体dna与基因组dna的包含双链切断的位置的区域优选95%以上的碱基序列一致,更优选99%以上的碱基序列一致。
[0102]
供体dna可以为50~5000个碱基左右的单链dna,可以为50~5000个碱基对左右的双链dna。供体dna为单链dna时,供体dna可以与基因组dna的双链中的任一链具有序列一致
性。
[0103]
在此,查询碱基序列相对于参考碱基序列的序列一致性例如可以如下求出。首先,对参考碱基序列和查询碱基序列进行比对。在此,各碱基序列可以包含空位,以使序列一致性达到最大。接着,计算参考碱基序列和查询碱基序列中一致的碱基的碱基数,根据下述式(f1),可以求出序列一致性。
[0104]
序列一致性(%)=一致的碱基数/查询碱基序列的总碱基数
×
100(f1)
[0105]
[基因改造巨核细胞]
[0106]
一个实施方式中,本发明提供基因改造巨核细胞,其中,(i)hla-a、hla-b及hla-c基因、或(ii)b2m基因已被破坏。
[0107]
本实施方式的基因改造巨核细胞中,hla蛋白的表达发生了缺失。另外,可以由本实施方式的巨核细胞产生hla缺损血小板。因此,根据本实施方式的基因改造巨核细胞,可以提供即使是异体移植也在移植时减少了hla抗原介导的免疫排斥反应的巨核细胞或血小板。血小板制剂即使由献血制作也会在数天内失活,因此如来自ips细胞的巨核细胞那样能够维持血小板生产能力且能够无限扩大培养的细胞的医疗/产业有用性是非常高的。
[0108]
以往,仅由hla型匹配的供体来源的ips细胞生产巨核细胞及血小板。与此相对地,根据本实施方式的方法,能够将单一的hla缺损血小板制剂移植给多个受体。其结果是,与自体移植相比,能够急剧降低血小板制剂的成本。
[0109]
[改造血小板的制造方法]
[0110]
一个实施方式中,本发明提供改造血小板的制造方法,其包括:向巨核细胞中导入cas家族蛋白及grna来改造对象基因,得到基因改造巨核细胞的步骤;以及由上述基因改造巨核细胞产生血小板而得到改造血小板的步骤。
[0111]
关于巨核细胞、cas家族蛋白、grna、对象基因等,与上述同样。巨核细胞可以是使多能干细胞分化而得到的巨核细胞。通过由基因改造巨核细胞产生血小板,可以制造改造血小板。在此,改造血小板是指:与野生型的血小板相比,对象基因所编码的蛋白质的表达等发生了变化的血小板。由巨核细胞产生血小板的方法没有特别限定,可以适宜利用通常所进行的方法。
[0112]
本实施方式的制造方法中,cas家族蛋白及grna向巨核细胞的导入优选利用电穿孔法进行。如后述实施例中所述,发明人明确了:通过向巨核细胞中导入cas家族蛋白与grna的复合物来进行基因组编辑,能够更高效地改造对象基因。
[0113]
本实施方式的制造方法中,对象基因为(i)hla-a、hla-b及hla-c基因、或(ii)b2m基因,上述改造可以为上述对象基因的破坏。关于hla-a基因、hla-b基因、hla-c基因、b2m基因,与上述同样。
[0114]
通过破坏这些基因,能够制造hla缺损巨核细胞。另外,能够由hla缺损巨核细胞产生hla缺损血小板。即,这种情况下,改造血小板为hla缺损血小板。
[0115]
一个实施方式中,本发明提供低抗原性血小板的制造方法,其包括以下步骤:(a)对人来源的多能干细胞进行分化诱导而制成永生化巨核细胞的步骤;(b)使用crisper-cas基因改造技术向上述永生化巨核细胞中导入cas家族蛋白与grna的复合物,由此使2种以上的i类hla蛋白进行改造或发生缺损的步骤;(c)使2种以上的i类hla蛋白进行了改造或发生了缺损的永生化巨核细胞增殖的步骤;以及(d)由增殖的巨核细胞产生血小板的步骤。
[0116]
[hla缺损血小板]
[0117]
一个实施方式中,本发明提供2种以上的i类hla蛋白发生了缺损的hla缺损血小板。2种以上的i类hla蛋白优选为选自由hla-a蛋白、hla-b蛋白及hla-c蛋白组成的组中的2种以上的蛋白质,更优选为hla-a蛋白、hla-b蛋白及hla-c蛋白。
[0118]
一个实施方式中,本发明提供hla-a蛋白、hla-b蛋白及hla-c蛋白发生了缺损的hla缺损血小板。或者,本发明还可以提供hla-a蛋白、hla-b蛋白和/或hla-c蛋白发生了缺损的上述hla缺损血小板。如上所述,本实施方式的hla缺损血小板中,hla蛋白发生了缺损。因此,即使是异体移植,也能够在移植时减少hla抗原介导的免疫排斥反应。另外,本实施方式的hla缺损血小板能够通过上述方法来大量生产。
[0119]
[其它实施方式]
[0120]
一个实施方式中,本发明提供血小板相关疾病的治疗方法,其包括:向巨核细胞中导入cas家族蛋白与grna的复合物来改造(i)hla-a、hla-b及hla-c基因、或(ii)b2m基因,得到hla缺损巨核细胞的步骤;由上述hla缺损巨核细胞产生血小板而得到hla缺损血小板的步骤;以及将有效量的上述hla缺损血小板给药于需要治疗的患者的步骤。在此,关于巨核细胞、cas家族蛋白、grna、对象基因等,与上述同样。
[0121]
本实施方式的治疗方法中,血小板相关疾病是指由于血小板数的减少或功能的异常而严重出血或预测会出血的病情。另外,患者可以为血小板输注无效症。另外,hla缺损血小板优选通过点滴静脉注射给药于患者。
[0122]
实施例
[0123]
接着示出实施例进一步详细地说明本发明,但是本发明不受以下实施例限定。
[0124]
[实验例1]
[0125]
(巨核细胞的hla-a/b/c基因敲除)
[0126]
向巨核细胞中导入cas9蛋白及sgrna,敲除了hla-a基因、hla-b基因及hla-c基因(以下有时称为“hla-a/b/c基因”)。
[0127]
作为巨核细胞,使用在多西环素(
クロンテック
公司)存在下强制表达bmi1基因、c-myc基因及bcl-xl基因的永生化人巨核细胞株(immkcl)(参照nakamura s.,et al.,expandable megakaryocyte cell lines enable clinically applicable generation of platelets from human induced pluripotent stem cells,cell stem cell,14(4),535-548,2014)。可以在多西环素存在下进行扩大培养,可以通过除去多西环素而产生血小板。
[0128]
作为cas9蛋白,使用市售品(制品名“truecut
tm cas9 protein v2”、产品目录编号“a36498”、赛默飞世尔科技公司)。
[0129]
作为sgrna,使用以hla-a基因为靶的合成sgrna(“hla-a-ex3g1”、将靶碱基序列示于序列号5)、以hla-b基因为靶的合成sgrna(“hla-b-ex2g1”、将靶碱基序列示于序列号6)、及以hla-c基因为靶的合成sgrna(“hla-c12:02-ex3g1”、将靶碱基序列示于序列号7)这3种sgrna。
[0130]
将15μg的cas9蛋白、1.25μg的hla-a-ex3g1、1.25μg的hla-b-ex2g1、及1.25μg的hla-c12:02-ex3g1混合,孵育后,通过电穿孔法导入到3
×
105个巨核细胞中。电穿孔中,使用4d-nucleofector
tm
(
ロンザ
公司)及p4 primary cell 4d-nucleofector
tm xkits(产品
目录编号“v4xp-4032”、
ロンザ
公司)。
[0131]
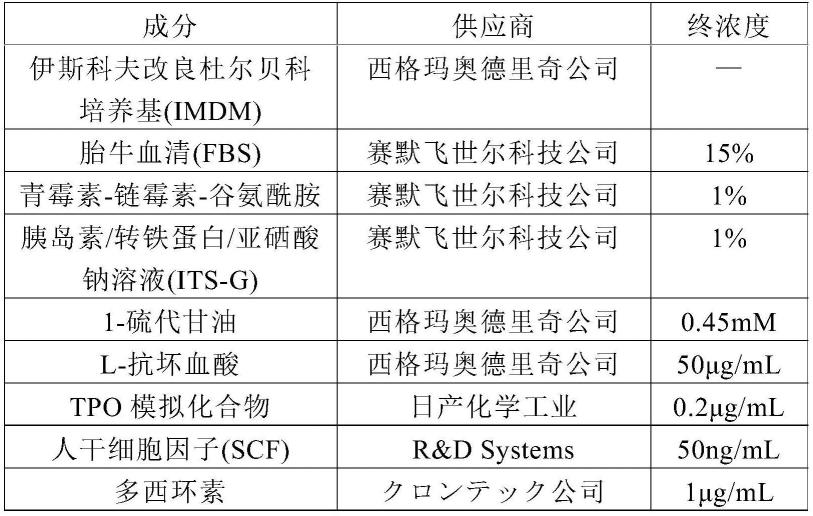
将电穿孔后的巨核细胞添加到培养基中,在37℃、5%co2的培养条件下培养。将培养基的组成示于下述表1。
[0132]
[表1]
[0133][0134]
从培养开始起3天后及6天后回收巨核细胞,用fitc标记抗hla-a/b/c抗体(产品目录编号“555552”、bd
バイオサイエンス
公司)染色。接着,用facs verse(bd
バイオサイエンス
公司)进行流式细胞术分析,测定hla-a/b/c基因全部被敲除的细胞群体的比例。
[0135]
图1为示出流式细胞术分析的结果的图。图1中,“野生型”表示野生型的巨核细胞的结果,“hla-a/b/c ko”表示进行了hla-a基因、hla-b基因及hla-c基因的敲除处理的巨核细胞的结果。另外,“染色”表示用fitc标记抗hla-a/b/c抗体进行了染色的结果,“未染色”表示未进行染色的结果。另外,“第3天”表示培养开始起3天后的测定结果,“第6天”表示培养开始起6天后的测定结果。
[0136]
结果获知:进行了hla-a/b/c基因的敲除处理的巨核细胞中,细胞群体整体的24.0%(3天后)及19.7%(6天后)变为hla-a蛋白、hla-b蛋白及hla-c蛋白(以下有时称为“hla-a/b/c蛋白”)阴性。该结果表示,利用本实验例的方法能够在巨核细胞中高效地实施基因组编辑。
[0137]
[实验例2]
[0138]
(巨核细胞的b2m基因敲除)
[0139]
向巨核细胞中导入cas9蛋白及sgrna,将b2m基因敲除。另外,为了比较,也进行了hla-a/b/c基因的敲除。作为巨核细胞,使用与实验例1同样的永生化人巨核细胞株(immkcl)。
[0140]
作为cas9蛋白,使用市售品(制品名“truecut
tm cas9 protein v2”、产品目录编号“a36498”、赛默飞世尔科技公司)。
[0141]
作为sgrna,使用以b2m基因为靶的合成sgrna(“b2m-ex1g2”、将靶碱基序列示于序列号8)、以hla-a基因为靶的合成sgrna(“hla-a-ex3g1”、将靶碱基序列示于序列号5)、以
hla-b基因为靶的合成sgrna(“hla-b-ex2g1”、将靶碱基序列示于序列号6)、及以hla-c基因为靶的合成sgrna(“hla-c12:02-ex3g1”、将靶碱基序列示于序列号7)。
[0142]
b2m基因的敲除中,将5μg的cas9蛋白及1.25μg的b2m-ex1g2混合,利用电穿孔法导入到3
×
105个巨核细胞中。hla-a/b/c基因的敲除中,将15μg的cas9蛋白、1.25μg的hla-a-ex3g1、1.25μg的hla-b-ex2g1及1.25μg的hla-c12:02-ex3g1混合,利用电穿孔法导入到3
×
105个巨核细胞中。电穿孔中,使用maxcyte stx(maxcyte公司)。
[0143]
将电穿孔后的巨核细胞添加到上述表1中示出组成的培养基中,在37℃、5%co2的培养条件下培养。在培养开始起6天后回收巨核细胞,用fitc标记抗hla-a/b/c抗体(产品目录编号“555552”、bd
バイオサイエンス
公司)染色。接着,用facs verse(bd
バイオサイエンス
公司)进行流式细胞术分析,测定hla-a/b/c基因全部被敲除的细胞群体的比例。
[0144]
图2为示出流式细胞术分析的结果的图。图2中,“野生型”表示野生型的巨核细胞的结果,“b2m ko”表示进行了b2m基因的敲除处理的巨核细胞的结果,“hla-a/b/c ko”表示进行了hla-a基因、hla-b基因及hla-c基因的敲除处理的巨核细胞的结果。另外,“未染色”表示未用fitc标记抗hla-a/b/c抗体染色的结果。
[0145]
结果获知,进行了b2m基因的敲除处理的巨核细胞中,细胞群体整体的48.9%变为hla-a/b/c蛋白阴性。另外获知,进行了hla-a/b/c基因的敲除处理的巨核细胞中,细胞群体整体的59.5%变为hla-a/b/c蛋白阴性。该结果进一步支持了利用本实验例的方法能够在巨核细胞中高效地实施基因组编辑。
[0146]
[实验例3]
[0147]
(hla-a/b/c基因敲除巨核细胞的亚克隆)
[0148]
为了纯化实验例1中进行了hla-a/b/c基因的敲除处理的巨核细胞,实施基于集落形成的亚克隆法。作为亚克隆用的培养基,使用下述表2中示出组成的培养基。
[0149]
[表2]
[0150][0151]
将实验例1中进行了hla-a/b/c基因的敲除处理的巨核细胞添加到上述表2中示出组成的培养基中并搅拌,播种到100mm培养皿中。播种细胞数调整为5
×
104个/培养皿。接着,在37℃、5%co2的培养条件下培养8~12天。
[0152]
接着,在显微镜观察下采集单集落,播种到在各孔中各分注了200μl上述表1中示出组成的培养基的96孔板的各孔中,进而在37℃、5%co2的培养条件下培养3~7天。
[0153]
接着,将增殖的巨核细胞回收,用fitc标记抗hla-a/b/c抗体(产品目录编号“555552”、bd
バイオサイエンス
公司)染色。接着,使用facs verse(bd
バイオサイエンス
公司)进行流式细胞术分析。
[0154]
首先,如图3(a)所示,使用野生型巨核细胞(野生型),对抗hla-a/b/c抗体未染色细胞及染色细胞进行流式细胞术分析,进行规定hla-a/b/c蛋白阴性细胞群体的设门设定。图3(a)中,“染色”表示用fitc标记抗hla-a/b/c抗体进行了染色的结果,“未染色”表示未进行染色的结果。另外,图中的椭圆表示规定hla-a/b/c蛋白阴性细胞群体的设门。
[0155]
接着,使用上述设门设定,评价利用亚克隆进行了克隆化的巨核细胞的hla-a/b/c蛋白的表达。图3(b)为示出各巨核细胞克隆的流式细胞术分析的结果的图。图3(b)中,被粗线包围的图为示出hla-a/b/c蛋白阴性的巨核细胞克隆的图。
[0156]
其结果是,如图3(b)所示,可知71个克隆中有13个克隆为hla-a/b/c蛋白阴性。由该结果可知,能够制作hla-a/b/c蛋白缺损血小板制剂的生产所必需的巨核细胞株。
[0157]
[实验例4]
[0158]
(由hla null巨核细胞产生血小板)
[0159]
与实验例1同样地敲除永生化人巨核细胞株(immkcl)的hla-a/b/c基因,使用facs aria(bd
バイオサイエンス
公司)对hla-a/b/c蛋白阴性巨核细胞(以下有时称为“hla null巨核细胞”)进行分选并回收。
[0160]
接着,洗涤所回收的巨核细胞并在不含多西环素的培养基中培养,由此解除bmi1基因、c-myc基因及bcl-xl基因的强制表达。具体而言,将野生型的巨核细胞及hla null巨核细胞以1
×
105个/ml的细胞密度、以25ml/烧瓶播种到e125烧瓶(产品目录编号“431143”、康宁公司)中的下述表3中示出组成的培养基中,在37℃、5%co2的条件下以100rpm进行振荡培养。其结果是,由巨核细胞诱导了血小板的产生。
[0161]
[表3]
[0162][0163]
培养6天后,取部分细胞悬浮液,用apc标记抗cd41抗体(产品目录编号“303710”、
バイオレジェンド
公司)、pe标记抗cd42b抗体(产品目录编号“303906”、
バイオレジェンド
公司)及fitc标记抗hla-a/b/c抗体(产品目录编号“555552”、bd
バイオサイエンス
公司)染色30分钟。
[0164]
接着,使用facs verse(bd
バイオサイエンス
公司)进行流式细胞术分析,研究血小板(cd41/cd42b双阳性细胞)的hla-a/b/c蛋白的表达。
[0165]
图4(a)及(b)为示出流式细胞术分析的结果的图。如图4(a)所示,首先基于前向散射光信号(fsc)/侧向散射光信号(ssc)对微小细胞群体设门,再对cd41阳性级分设门。
[0166]
接着,如图4(b)所示,在进行了设门的级分中,将cd42b阳性级分规定为血小板,研究hla-a/b/c蛋白的表达。图4(b)中,“野生型”表示来自野生型的巨核细胞的血小板的结果,“hla-a/b/c ko”表示来自hla null巨核细胞的血小板的结果。另外,“染色”表示用fitc标记抗hla-a/b/c抗体进行了染色的结果,“未染色”表示未进行染色的结果。
[0167]
其结果表明,来自野生型的巨核细胞的血小板的hla-a/b/c蛋白的表达为阳性,与此相对,来自hla null巨核细胞的血小板的hla-a/b/c蛋白的表达为阴性。
[0168]
[实验例5]
[0169]
(巨核细胞的基因组编辑效率的研究)
[0170]
通过各种方法向巨核细胞中导入cas9蛋白及grna而敲除b2m基因,研究基因组编辑效率。作为巨核细胞,使用与实验例1同样的永生化人巨核细胞株(immkcl)。
[0171]
下述表4示出所研究的cas9蛋白及grna的导入条件。cas9蛋白以cas9表达质粒的形态或cas9蛋白的形态使用。作为cas9表达质粒,使用phl-ef1a-sphccas9-ic-a。phl-ef1a-sphccas9-ic-a通过将li h.l.,et al.,precise correction of the dystrophin gene in duchenne muscular dystrophy patient induced pluripotent stem cells by talen and crispr-cas9,stem cell reports,4,143-154,2015.中记载的phl-ef1a-sphccas9-ip-a的sphccas9 cdna克隆到phl-ef1a-gw-ic-a载体中而制作。
[0172]
作为cas9蛋白,使用市售品(制品名“truecut
tm cas9 protein v2”、产品目录编号“a36498”、赛默飞世尔科技公司)。
[0173]
grna以以b2m基因为靶的grna的表达质粒的形态或sgrna的形态使用。作为以b2m基因为靶的grna的表达质粒,使用phl-h1-b2m-sgrna-mef1a-rih(参照suzuki d.,et al.,ipsc-derived platelets depleted of hla class i are inert to anti-hla class i and natural killer cell immunity,stem cell reports,14,49-59,2020)。
[0174]
作为sgrna,使用以b2m基因为靶的合成sgrna(“b2m-ex1g2”、将靶碱基序列示于序列号8)。
[0175]
另外,对将cas9蛋白及grna导入到细胞中之前孵育5分钟而形成了复合物的情况和未形成复合物的情况进行了研究。
[0176]
作为cas9蛋白及grna的导入方法,研究了脂质体转染法和电穿孔法。脂质体转染法中,使用了lipofectamine 2000(赛默飞世尔科技公司)和适合于蛋白质导入的lipofectamine crisprmax(赛默飞世尔科技公司)。电穿孔中,使用了4d-nucleofector
tm
(
ロンザ
公司)及amaxa
tm p4primary cell 4d-nucleofector
tm x kits(
ロンザ
公司)。
[0177]
[表4]
[0178][0179]
将导入cas9蛋白及grna后的巨核细胞在上述表1所示的组成的培养基中在37℃、5%co2的培养条件下培养。
[0180]
在导入cas9蛋白及grna起4天后及7天后,对各巨核细胞进行fitc标记抗hla-a/b/c抗体(产品目录编号“555552”、bd
バイオサイエンス
公司)染色。另外,将相同的细胞用碘丙啶(pi)染色。接着,使用facs verse(bd
バイオサイエンス
公司)进行流式细胞术分析,评价b2m基因被敲除的巨核细胞的比例。另外,还通过分析pi阳性细胞的比例而检测死细胞,评价对细胞的伤害。
[0181]
图5(a)及(b)、图6(a)及(b)为示出导入cas9蛋白及grna起4天后的分析结果。
[0182]
图5(a)为未导入cas9蛋白及grna的对照组的结果。图5(a)中,“染色”表示用fitc标记抗hla-a/b/c抗体进行了染色的结果,“未染色”表示未进行染色的结果。
[0183]
图5(b)为使用lipofectamine 2000导入cas9蛋白及grna的组的结果。图5(b)中,“质粒载体”示出以表达质粒的形态导入了cas9蛋白及grna的结果,“rnp分离(separate)”表示未形成cas9蛋白与grna的复合物的结果,“rnp预混合(pre-mix)”表示将cas9蛋白及grna混合后进行孵育而形成了复合物的结果。
[0184]
图5(a)及(b)中,“ssc”表示侧向散射光信号,“抗hla-abc”表示利用fitc标记抗hla-a/b/c抗体的染色强度。
[0185]
图6(a)为使用lipofectamine crisprmax导入了cas9蛋白及grna的组的结果,图6(b)为利用电穿孔法导入了cas9蛋白及grna的组的结果。
[0186]
图6(a)及(b)中,“质粒载体”表示以表达质粒的形态导入了cas9蛋白及grna的结果,“rnp分离”表示未形成cas9蛋白与grna的复合物的结果,“rnp预混合”表示将cas9蛋白及grna混合后进行孵育而形成了复合物的结果。另外,“ssc”表示侧向散射光信号,“抗hla-abc”表示利用fitc标记抗hla-a/b/c抗体的染色强度。
[0187]
图7(a)及(b)、图8(a)及(b)为示出导入cas9蛋白及grna起7天后的分析结果的图。
[0188]
图7(a)为未导入cas9蛋白及grna的对照组的结果。图7(a)中,“染色”表示用fitc标记抗hla-a/b/c抗体进行了染色的结果,“未染色”表示未进行染色的结果。
[0189]
图7(b)为使用lipofectamine 2000导入cas9蛋白及grna的组的结果。图7(b)中,“质粒载体”表示以表达质粒的形态导入了cas9蛋白及grna的结果,“rnp分离”表示未形成cas9蛋白与grna的复合物的结果,“rnp预混合”表示将cas9蛋白及grna混合后进行孵育而形成了复合物的结果。
[0190]
图7(a)及(b)中,“ssc”表示侧向散射光信号,“抗hla-abc”表示利用fitc标记抗hla-a/b/c抗体的染色强度。
[0191]
图8(a)为使用lipofectamine crisprmax导入了cas9蛋白及grna的组的结果,图8(b)为利用电穿孔法导入了cas9蛋白及grna的组的结果。
[0192]
图8(a)及(b)中,“质粒载体”表示以表达质粒的形态导入了cas9蛋白及grna的结果,“rnp分离”表示未形成cas9蛋白与grna的复合物的结果,“rnp预混合”表示将cas9蛋白及grna混合后进行孵育而形成了复合物的结果。另外,“ssc”表示侧向散射光信号,“抗hla-abc”表示利用fitc标记抗hla-a/b/c抗体的染色强度。
[0193]
其结果是,首先使用cas9及grna的表达质粒载体的分析中,脂质体转染法的情况下几乎观察不到基因组编辑(0.0%或0.1%、图5(b)、图6(a)、图7(b)、图8(a)的“质粒载体”),电穿孔法的情况下可微弱观察到(3.0%(图6(b))和4.6%(图8(b))、“质粒载体”)。由此,再次确认了向巨核细胞中的基因(质粒dna)导入的困难性。
[0194]
然后,在使用cas9蛋白及grna的分析中,使用lipofectamine 2000的情况下,无论是否孵育,基因组编辑效率均非常低(均为0.5%以下、图5(b)和图7(b)的“rnp分离”和“rnp预混合”)。认为该结果是由于,lipofectamine 2000并非适合于cas9蛋白或sgrna的导入的试剂。
[0195]
与此相对地,使用蛋白质导入用的脂质体转染试剂(lipofectamine crisprmax)的情况下,在无孵育时为0.1%(4天后)和0.0%(7天后),但在有孵育时基因组编辑效率增加到2.1%(4天后)和3.5%(7天后)(图6(a)和图8(a))。进而,使用电穿孔法导入的情况下,根据孵育的有无,在4天后基因组编辑效率从2.8%(无孵育)增加到45.3%(有孵育)(图6(b)),在7天后基因组编辑效率从2.4%(无孵育)增加到51.9%(有孵育)(图8(b)),大幅增加。
[0196]
因此可知,将cas家族蛋白和grna导入到巨核细胞中而进行基因组编辑时,在适合于蛋白质导入的脂质体转染法、电穿孔法中的任一方法中,形成cas家族蛋白与grna的复合物后导入时,基因组编辑效率都大幅增加(增加一个数量级)。特别地,使用电穿孔法导入上述复合物时得到的基因组编辑效率非常高,在巨核细胞中以这样高的效率进行基因组编辑的例子尚无报道。
[0197]
需要说明的是,pi染色的分析结果中,将cas9蛋白及grna通过脂质体转染法、电穿孔法中的任一方法导入时,不论是否形成了复合物,用pi染色的细胞的比例均相同程度地低(4天后为4.3%以下、7天后为1.5%以下)。因此可知,向巨核细胞中导入cas家族蛋白与grna的复合物来进行基因组编辑的方法对巨核细胞的损伤(细胞毒性)也足够低。
[0198]
产业上的可利用性
[0199]
根据本发明,能够提供制造基因改造巨核细胞和改造血小板的技术。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。