baf155突变基因及其制药用途
技术领域
1.本技术涉及预防或治疗心脏重塑的药物领域。具体地,本技术涉及baf155 突变体或其活性片段。本技术还涉及所述baf155突变体或其活性片段的制药用途。
背景技术:
2.占心血管疾病(cvd)近一半的非传染性疾病(ncds)已超过传染病成为全球主要病理。同时,心血管疾病仍然是全球最致命的病理学。随着中国生活水平的快速提高和生活方式的巨大改变,心血管疾病的患病率和死亡率显著增加。随着老龄化社会的到来,心脏病已成为全球最重要的健康问题之一。心室重构,包括心肌肥大和纤维化,构成心力衰竭的病因基础。聚(adp-核糖)聚合酶1(parp1)是cvd的重要损伤因素,尤其是各种因素引起的心脏重塑。 parp1上调和增强的parp1活性发生在心脏重塑中,导致受损心肌细胞消耗极高的能量。然而,目前尚不清楚parp1如何在心脏重塑中受到调节。
3.swi/snf(交配型转换/蔗糖非发酵)是一种多亚基atp依赖性染色质重塑复合物,是基因转录的基本表观遗传调节因子。baf155,也称为smarcc1,代表swi/snf亚基。作为解旋酶和atp酶,baf15通过改变基因周围的染色质结构来调节基因转录。据报道,baf155有助于多种生理和病理事件,包括癌症、发育等。
4.然而,虽然在心脏中,baf155丰度很高,但其在心肌中的作用尚未明确。
技术实现要素:
5.本技术的技术方案是基于以下研究的基础上提出的:
6.本技术人发现,在baf155心肌特异性敲除小鼠中,angii诱导的心脏重塑 (包括心脏肥大、纤维化和衰竭)显著减轻。相反,在小鼠中过表达baf155 会显著加重心脏重塑。研究发现,baf155在parp1-brct结构域中结合parp1,并通过干扰wwp2(一种重要的e3泛素连接酶)抑制parp1在k249的泛素化。申请人发现,baf155在生理条件下被鉴定为乙酰转移酶cbp和脱乙酰化酶 sirt2的新型底物。cbp/sirt2与baf155相互作用并在baf155的k948处乙酰化/脱乙酰化。baf155的相同赖氨酸位点被wwp2泛素化,从而通过蛋白酶体诱导baf155的下游降解。baf155的乙酰化和泛素化之间的串扰以竞争方式动态调节baf155-parp1复合物的稳定性。总之,申请人的研究确定了baf155 的新作用及其在心脏重塑中的上游和下游调节机制。具体而言,baf155与 parp1相互作用,通过抑制wwp2减少parp1的降解并加剧心脏重塑。baf155 受sirt2介导的脱乙酰化调节,这有助于调动wwp2降解baf155并解离 baf155-parp1心脏重塑损伤复合物。本技术的发现为心脏重塑损伤的治疗和预防提供了新的研究方向。
7.因此,本技术的目的是通过以下技术方案实现的:
8.本发明的第一方面提供一种baf155突变体或其活性片段,与野生型baf155 相比,所述baf155突变体或其活性片段包含k948r的突变。
9.其中,所述baf155突变体的序列如seq id no:1所示:
10.maaaaggggpgtavgatgsgiaaaaaglavyrrkdggpatkfwespe tvsqldsvrvwlgkhykkyvhadaptnktlaglvvqllqfqedafgkhvt npaftklpakcfmdfkaggalchilgaaykykneqgwrrfdlqnpsrmdrn vemfmniektlvqnncltrpniylipdidlklanklkdiikrhqgtftdekska shhiypysssqddeewlrpvmrkekqvlvhwgfypdsydtwvhsndvdaei edppipekpwkvhvkwildtdifnewmneedyevdenrkpvsfrqristknee pvrsperrdrkasanarkrkhspspppptptesrkksgkkgqaslygkrrsqk eedeqedltkdmedptpvpnieevvlpknvnlkkdsentpvkggtvadldeq deetvtaggkededpakgdqsrsvdlgednvteqtnhiiipsyaswfdyncih vierralpeffngknksktpeiylayrnfmidtyrlnpqeyltstacrrnltg dvcavmrvhafleqwglvnyqvdpesrpmamgppptphfnvladtpsglvp lhlrspqvpaaqqmlnfpeknkekpvdlqnfglrtdiyskktlakskgasag rewteqetllllealemykddwnkvsehvgsrtqdecilhflrlpiedpyle nsdaslgplayqpvpfsqsgnpvmstvaflasvvdprvasaaakaaleefsr vreevplelveahvkkvqeaarasgkvdptyglessciagtgpdepeklega eeekmeadpdgqqpekaenkvenetdegdkaqdgeneknsekeqdsevsed tkseeketeenkeltdtckeresdtgkkkveheisegnvataaaaalasaat kakhlaaveerkikslvallvetqmkkleiklrhfeeletimdrekealeqqr qqllterqnfhmeqlryaelrarqqmeqqqhgqnpqqahqhsggpglapl gaaghpgmmphqqpppyplmhhqmppphppqpgqipgpgsmmpgqhmpgr miptvaanihpsgsgptppgmppmpgnilgprvpltapngmyppppqqqppppp padgvppppapgppasaap
11.本发明的还提供了一种分离的核酸分子,其中所述核酸分子编码所述baf155 突变体或其活性片段。
12.本发明的还提供了一种载体,其中所述载体包含前述的分离的核酸分子。
13.本发明的还还提供了一种宿主细胞,其中所述宿主细胞包含前述的载体。
14.本发明还提供了一种药物组合物,其中所述药物组合物包含前述的baf155 突变体或其活性片段。
15.根据本发明所述的药物组合物,其中所述药物组合物还包含药学上可接受的稀释剂、赋形剂和/或载体。
16.本发明还提供了所述的baf155突变体或其活性片段或所述的药物组合物在制备用于预防或治疗心脏重塑的药物中的用途。
17.根据本发明所述的用途,其中所述心脏重塑为angii诱导的心脏重塑。
18.根据本发明所述的用途,其中所述心脏重塑选自心肌肥大、心脏纤维化和/ 或心脏衰竭中的一种或多种。
19.与现有技术相比,本技术具有以下有益效果:
20.baf155与parp1相互作用,通过抑制wwp2减少parp1的降解并加剧心脏重塑。baf155受sirt2介导的去乙酰化调节,这有助于调动wwp2降解 baf155并解离baf155-parp1心脏重塑损伤复合物以防止心脏重塑。从而为心脏重塑损伤的治疗和预防提供了新的思路和研究方向。
附图说明
21.以下,结合附图来详细说明本技术的实施方案,其中:
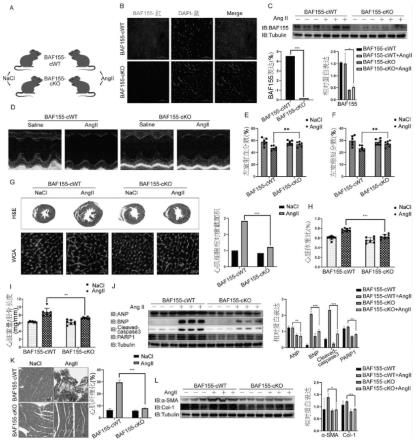
22.图1示出baf155的心脏特异性敲除减轻了小鼠的心脏重塑,其中:
23.其中,图1a为baf155-cwt小鼠和心肌特异性baf155敲除(baf155-cko) 小鼠暴露于持续的0.9%nacl和angii(2mg/kg/天)两周;
24.图1b-c分别示出为免疫荧光和蛋白质印迹的结果,显示baf155在心脏组织中被特异性敲除;
25.图1d示出与baf155-cwt小鼠相比,baf155-cko显著减轻了angii诱导的心功能不全;
26.图1e和图1f分别示出在小鼠中左心室射血分数(ef)%和缩短分数(fs)%的增加;
27.图1g为h&e和wga染色数据,显示在baf155-cwt小鼠中,angii提高了心肌细胞的大小以及心肌细胞的横截面积,而baf155-cko小鼠中给予angii 的这种变化并不显著;
28.图1h-i分别示出与baf155-cwt小鼠相比,baf155-cko显著抑制angii诱导的hw/bw和hw/tl比值升高,这表明baf155的心脏特异性敲除减轻了小鼠的心脏肥大;
29.图1j示出为与baf155-cwt小鼠相比,baf155-cko显著降低了angii诱导的小鼠anp、bnp、cleavedcaspase-3和parp1的表达;
30.图1k示出与baf155-cwt小鼠相比,baf155-cko小鼠的angii诱导的心肌纤维化水平显著降低;
31.图1l示出与baf155-cwt小鼠相比,baf155-cko小鼠的心肌纤维化相关蛋白α-sma和胶原蛋白i的表达降低;
32.图2示出为baf155过表达显著加重小鼠模型中的心肌肥大和心力衰竭,其中:
33.图2a示出为将baf155-wt和baf155转基因小鼠(baf155-tg)暴露于持续的0.9%nacl和angii(2mg/kg/天)两周;
34.图2b示出为蛋白质印迹显示baf155在心脏组织中特异性过表达;
35.图2c示出为与baf155-wt小鼠相比,baf155-tg显著加重了angii诱导的心功能不全;
36.图2d和图2e分别示出在在小鼠中左心室射血分数(ef)%和缩短分数(fs)%的增加;
37.图2f示出h&e和wga染色数据,与baf155-wt小鼠相比,angii给药导致baf155-tg小鼠心肌细胞大小和心肌细胞横截面积升高;
38.图2g-h示出与baf155-wt小鼠相比,baf155-tg显著加重了angii诱导的 hw/bw和hw/tl比值升高,这表明baf155的过表达导致小鼠心脏肥大;
39.图2i-图2k分别示出与baf155-wt小鼠相比,angii诱导的anp、bnp、 cleavedcaspase-3和parp1的表达在baf155-tg小鼠中均升高(图2i),同样,与baf155-wt小鼠相比,baf155-tg显著加重了angii诱导的小鼠心肌纤维化(图 2j),并上调了α-sma和胶原蛋白i(图2k);
40.图3示出parp1在生理条件下充当关键的baf155结合蛋白,并表明 baf155-parp1轴可能调节心脏重塑,其中:
41.图3a和3b为通过免疫共沉淀评估内源性baf155与parp1的相互作用;
42.图3c示出为baf155与parp1的相互作用是由angii诱导;
43.图3d示出为baf155与parp1的476-779个氨基酸结构域相互作用,即 parp-a-螺旋结构域;
44.图4示出baf155对parp1的调节机制,其中:
45.图4a示出baf155的表达升高导致parp1的同步表达;
46.图4b示出用56438shbaf155rna沉默的baf155显著下调parp1表达;
47.图4c示出在flag对照组中parp1的丰度逐渐降低,而baf155过表达在增加chx的情况下维持parp1表达,chx是用于抑制parp1蛋白合成的转录抑制剂;
48.图4d示出,在mg132处理后,与flag对照细胞相比,parp1的表达在baf155 过表达细胞中(速率和程度)增加;
49.图4e示出与flag-对照质粒组相比,用flag-baf155转染后parp1的泛素化水平降低;
50.图4f示出parp1的泛素化水平因baf155敲低而增加;
51.图4g示出baf155降低了parp1-wt组的泛素化水平,但在parp1-k249r 细胞中没有,表明baf155抑制了k249上的parp1泛素化;
52.图4h-4k分别示出在mg132的处理下,通过外源性免疫分析,阻断了parp1 和baf155的降解,导致baf155和parp1与wwp2的相互作用增强(4h);此外,在baf155敲低后,parp1与wwp2的结合增加(图4i),而baf155的过表达导致parp1与wwp2的结合减少(图4j);当wwp2过表达时,与flag对照组相比,过表达flag-baf155后parp1的泛素化水平下降(图4k);
53.图4l至图4o分别显示parp1与wwp2和sirt2的结合在用angii治疗后得到增强,并且在baf155-cko小鼠心脏组织中显著增加,与有或没有angii治疗的wt相比(图4l);就parp1的泛素化水平而言,申请人的数据显示angii 在wt小鼠心脏组织中诱导泛素化(图4m);此外,与wt小鼠相比,parp1的泛素化在baf155-cko小鼠心脏组织中显著增加(图4m);相反,与wt小鼠相比,在baf155-tg小鼠心脏组织中,parp1与wwp2和sirt2的结合比wt降低(图4n);与wt小鼠相比,baf155-tg小鼠心脏组织中parp1的泛素化显著降低(图4o);
54.图5示出baf155上的k948受sirt2特异性调控,其中:
55.图5a-c证明了内源性和外源性免疫共沉淀证实sirt2与baf155相互作用;
56.图5d和e示出在angii的诱导下,sirt2和baf155之间的相互作用得到增强;
57.图5f证明baf155的swirm结构域是sirt2的结合位点;
58.图5g示出用曲古抑菌素a(tsa)和烟酰胺(nam)治疗后,baf155的乙酰化水平增加;
59.图5h示出cbp的过表达显著增加了baf155的乙酰化水平;
60.图5i和5j示出cbp在内源性和外源性条件下都与baf155相互作用;
61.图5k示出与正常对照细胞相比,baf155的乙酰化水平在shsirt2细胞和用 agk2处理的细胞中上调;
62.图5l示出与wt动物相比,来自sirt2敲除动物的心脏组织样品中baf55 的baf155水平显著增强;
63.图5m-图5p示出wt-sirt2的过表达降低了baf155的外源乙酰化水平(图 5m),而转染sirt2的无活性突变体(h187yq167a)则没有效果(图5n);此外,与wt动物相比,来自sirt2敲除动物的心脏组织样本中baf155的乙酰化水平显著增强,无论是否由angii诱导(图5o);外源性baf155的乙酰化水平在angii 处理下降低,而外源性baf155的乙酰化水平随着angii诱导的外源性sirt2过表达而进一步下降(图5p);
64.图5q-图5u分别示出k948在整个进化过程中发现,从莫哈文果蝇到哺乳动物物种(图5q);特异性识别baf155的乙酰化k948的抗体(5r);施用tsa和 nam后,baf155-k948的乙
酰化水平增加(图5s);此外,外源转染四种乙酰转移酶后,只有cbp增加了baf155-k948的乙酰化水平(图5t);同时,外源转染 wt-sirt2而不是失活的sirt2(h187yq167a)降低了baf155-k948的乙酰化水平 (图5u);总之,以上数据表明k948受到cbp和sirt2的特异性调控;
65.图6示出baf155-k948在体内的sirt2去乙酰化,其中:
66.图6a在sirt2敲除小鼠(sirt2-ko)、sirt2过表达小鼠(sirt2-tg)和野生型动物(sirt2-wt)示出sirt2调节的小鼠心脏赖氨酸乙酰化变化;
67.图6b和图6c分别示出与wt相比,在sirt2敲除后baf155-k948的乙酰化水平在给予或不给予angii的情况下增加,而baf155-k948的乙酰化水平在 sirt2-tg小鼠心脏组织中降低;
68.图7示出sirt2通过wwp2促进baf155-k948和parp1-k294泛素化,其中:
69.图7a示出,baf155丰度在sirt2下调后增加;申请人使用shsirt2的三个片段(61965、61966和61967)观察到类似的趋势,并使用61966-shsirt2片段进行后续实验;
70.图7b示出与给予mg132的sirt2-ko动物相比,sirt2-wt小鼠心脏组织中 baf155上调的速率和程度升高;
71.图7c示出sirt2-wt小鼠心脏组织在chx给药后baf155表达显著降低,而sirt2-ko小鼠组随着时间的推移保持非常高的baf155表达;
72.图7d示出与通过泛素-蛋白酶体途径降解一致,与flag-对照质粒组相比,在 myc-sirt2过表达和mg132处理后检测到baf155的泛素化水平增强;
73.图7e示出baf155的泛素化水平在wt-sirt2-flag过表达后增加,但 h187yq167a-sirt2-flag(无脱乙酰活性的突变sirt2);
74.图7f和图7g分别示出示出随着四种乙酰转移酶的过表达,仅在过表达cbp 的细胞中观察到baf155丰度上调(图7f)和泛素化水平降低(7g);
75.图7h示出与baf155-k948r对应物相比,sirt2过表达增强了baf155-wt 细胞中的泛素化水平,表明baf155在k948处被sirt2去乙酰化,导致在同一位点泛素化并促进baf155的降解;
76.图7i-图7o证明wwp2参与sirt2介导的去乙酰化诱导的baf155降解, ha-wwp2在nc和shsirt2h9c2细胞系中表达;其中,baf155的丰度在nc细胞系中逐渐减少,而在shsirt2细胞中保持在高水平(图7i);与nc细胞相比,由wwp2介导的baf155泛素化水平在shsirt2处理中降低(图7j);此外, myc-sirt2过表达导致baf155和wwp2之间的结合升高,但与k948r-baf155 过表达无关(图7k);上述发现进一步表明sirt2通过wwp2促进了baf155的泛素化;此外,申请人旨在验证baf155-parp1损伤复合物受sirt2-wwp2调节;申请人发现parp1的泛素化水平在flag-sirt2和ha-wwp2过表达后显著增加,并随着flag-baf155的进一步过表达而降低(图7l);然后,过度表达k249r-parp1 (突变parp1没有由baf155和wwp2介导的泛素化位点),在parp1上观察到的泛素化水平可以忽略不计(图7l);上述结果表明,sirt2通过wwp2介导的 k948泛素化促进baf155的降解,wwp2主要通过k249泛素化调节parp1的降解;申请人进一步检查了sirt2对parp1-baf155复合物的影响;随着myc-sirt2 的过表达,parp1与baf155的结合减少(图7m);与先前报道的结果一致,在有或没有angii诱导的情况下,在shbaf155-h9c2细胞系中parp1的表达降低(图 7n),但在shsirt2-h9c2细胞中baf155
的表达增加而parp1的表达降低(图 7o);与shbaf155h9c2细胞相比,parp1在shbaf155和shsirt2h9c2细胞中的表达更高(图7n),但低于shsirt2h9c2细胞(图7o);这些发现表明sirt2 通过促进baf155的降解使baf155-parp1复合物不稳定;
77.图8示出sirt2敲除和转基因小鼠中差异蛋白的蛋白质组学分析表明,sirt2 在体内通过wwp2促进baf155和parp1的泛素化,其中:
78.图8a示出与给予或不给予angii的sirt2-wt小鼠样品相比,用angii治疗后baf155与parp1的结合增强,并且在sirt2-ko小鼠心脏组织中显著增强;
79.图8b和8c分别示出在sirt2-wt小鼠心脏组织中,与wt小鼠样品相比, baf155和parp1的泛素化水平在angii治疗后降低,并且在sirt2-ko小鼠心脏组织中显著降低;
80.图8d-图8h示出,与sirt2-wt动物相比,在给予或不给予angii的sirt2-ko 小鼠的心脏组织中,wwp2与baf155和parp1的结合降低(图8d);相反,与给予或不给予angii的sirt2-wt组相比,baf155与parp1的结合在sirt2-tg 小鼠心脏组织中降低(图8e);与sirt2-wt小鼠相比,sirt2-tg小鼠心脏组织中baf155和parp1的泛素化水平显著升高(图8f和8g);此外,与sirt2-wt 动物相比,在给予或不给予angii的sirt2-tg小鼠的心脏组织中,wwp2与 baf155和parp1的结合增加(图8h)。
具体实施方式
81.下面结合附图和实施例进一步说明本技术,应当理解,实施例仅用于进一步说明和阐释本技术,并非用于限制本技术。
82.实施例1
83.一、材料和方法
84.1.1baf155、wwp2和sirt2敲除和转基因小鼠
85.条件性心肌细胞特异性敲除(ko)小鼠,包括myh6cre 、 baf155fl/fl(baf155-cko)和myh6cre-、baf155fl/fl(baf155-cwt)、baf155-wt 和baf155-tg小鼠(cag启动子)获自上海南方模式生物科技股份有限公司;
86.条件性心肌细胞特异性敲除小鼠,包括myh6cre 、wwp2fl/fl(wwp2-cko) 和myh6cre-、wwp2fl/fl(wwp2-cwt)动物、sirt2-ko小鼠获得自dengcx,澳门大学健康科学学院。
87.sirt2转基因(sirt2-tg)小鼠(cag启动子)获得自上海南方模式生物科技股份有限公司。
88.在这项研究中,纳入了8至10周大的无特定病原体(spf)雄性小鼠。在angii 和nacl输注小鼠模型中,baf155-cko、baf155-cwt、baf155-wt、baf155-tg、 wwp2-cko、wwp2-cwt、sirt2-wt、sirt2-ko和sirt2-tg小鼠(每组6总共n=120)被随机分配到各组并进行麻醉(异氟醚在氧气中的浓度为2%;1,500 毫升/分钟)。随后按照制造商的指示在肩胛中部切开并皮下植入渗透性微型泵 (alzet),诱导了心脏重塑。在接下来的14天中,通过颈椎脱位对小鼠实施安乐死。所有动物研究均经中国医科大学实验动物部会批准(方案号2019026)。
89.1.2.蛋白质组学和乙酰化,泛素化蛋白质组学
90.1.2.1蛋白质提取
91.将标本在液氮中粉碎并置于5-ml管中,补充四倍体积的裂解缓冲液(8m尿素、1%蛋白酶抑制剂混合物、3μmtsa,50mmnam)并在冰上用scientz超声均质器超声处理3次.随后在12,000g和4℃下离心清除10分钟。使用bca试剂盒测量所得上清液的蛋白质浓度。
92.1.2.2胰蛋白酶消化
93.每个样品中等量的总蛋白质被酶解,并且调整体积以在整个样品组中保持一致。滴加tca至终浓度为20%,然后涡旋混合,4℃沉淀2h。以4500g离心5分钟,所得沉淀用预冷的丙酮洗涤两次。随后干燥沉淀,通过超声处理将沉淀重新悬浮在200mmteab中,将胰蛋白酶以1:50(蛋白酶:蛋白质,w/w)添加到每个样品中进行过夜消化。以5mm添加二硫苏糖醇(dtt),然后在56℃下孵育30 分钟。然后,加入11mm的碘乙酰胺(iaa),然后在室温下在黑暗中孵育15分钟。
94.1.2.3翻译后修饰肽的富集
95.将肽溶解在ip缓冲液(100mm nacl、1mm edta、50mm tris-hcl、0.5% np-40、ph 8.0)中,与预洗的抗赖氨酸乙酰化和抗泛素残留抗体树脂(ptm-104 和ptm-1104;hangzhou jingjie ptm-bio),并在4℃下轻轻摇晃过夜。分别用ip 缓冲液和去离子水洗涤抗体树脂。最后,富集肽用0.1%三氟乙酸洗脱3次,并用 c18ziptips清洗。
96.1.2.4lc-ms/ms分析
97.将胰蛋白酶肽溶解在液相色谱流动相a中,并在nanoelute超高性能液体系统上进行分离。流动相a和b分别为0.1%甲酸和2%乙腈的水溶液和0.1%甲酸的乙腈溶液。使用设置为xxx的梯度以450nl/min的恒定流速洗脱肽。洗脱梯度设置为:0-72min,7%-24%b;72-84分钟,24%-32%b;84-87分钟,32%-80%b; 87-90分钟,80%b.在注入毛细管离子源进行电离和tims-tofpro质谱仪(离子源电压,1.6kv;扫描范围,100-1700大)。为数据采集启用了并行累积串行碎片(pasef) 模式。选择电荷状态为0到5的前体进行碎裂,每个循环进行10次pasefms/ms 扫描。ms/ms扫描的动态排除时间为30秒,以防止对同一母离子进行多次扫描。
98.1.2.5数据库搜索
99.maxquant(v1.6.15.0)针对swissprot蛋白质序列数据库 (mus_musculus_10090_sp_20201214.fasta)搜索原始质谱数据,其中包含反向诱饵条目和常见污染蛋白质。胰蛋白酶/p消化最多允许2个缺失的切割,每个肽至少需要7个氨基酸。母离子的质量误差容限分别为10ppm和子离子为20ppm。半胱氨酸烷基化(氨基甲酰甲基[c])被认为是一种固定修饰。可变修饰是蛋氨酸氧化和n-末端乙酰化。赖氨酸乙酰化和赖氨酸上的二甘氨酸也被设置为可变修饰,用于相应的修饰富集分析。蛋白质和psm鉴定的fdr均为1%。
[0100]
1.2.6基因本体(go)分析
[0101]
uniprot-goa数据库(www.http://www.ebi.ac.uk/goa/)用于go注释。首先,获得的蛋白质识别根据其单端口id映射到goid。对于uniprot-goa中没有注释的蛋白质,interproscan用于基于蛋白质序列比对注释go功能。蛋白质被分配到作为go术语的生物过程、细胞成分和分子功能。在各个类别中,使用双尾fisher 检验来评估差异表达蛋白质与所有检测到的蛋白质的富集度;校正后的p《0.05表明有统计学意义。
[0102]
1.2.7亚细胞定位
[0103]
wolfpsort,最新版本的psort/psortii,用于预测真核蛋白的亚细胞定位。
[0104]
1.3组织病理学评估
[0105]
心肌组织样本经过福尔马林(4%)固定4小时,石蜡包埋和5μm切片。二甲苯脱蜡后,用分级乙醇进行再水化,然后进行h&e和masson三色(g1340;solarbio,中国)染色。
[0106]
通过免疫荧光检查冷冻的心肌组织切片。在用5μmwga(thermo,usa)染色后获得的图像中评估心肌细胞的横截面积。h9c2细胞被给予10-5μmangii或接受 nacl处理48小时。然后,将细胞用4%福尔马林固定并在室温下用wga(5μm)处理10分钟,然后进行荧光显微镜分析。
[0107]
1.4.超声心动图和左心室功能(lvef)评估
[0108]
myh6cre 、baf155fl/fl、myh6cre-、baf155fl/fl、baf155-wt和baf155-tg 组的心脏功能在visualsonicsvevo2100实时高分辨率活体显微成像系统 (visualsonic,加拿大)。用1.5%异氟醚麻醉24只小鼠,然后通过40mhz传感器连续供氧进行心脏功能分析。通过二维m模式记录检查lvef。心脏功能测定基于室间隔尺寸(ivsd)、左心室后壁尺寸(pwtd)、收缩期lv内部尺寸(lvd)、舒张期lv内部尺寸(lvdd)和lv质量测量值。此外,测定了左心室射血分数(ef%)和缩短分数(fs%)。
[0109]
1.5.细胞和治疗
[0110]
hek293t和h9c2细胞(atcc)在含10%fbs(hyclone)的高葡萄糖dulbecco改良eagle培养基中培养,温度为37℃,加湿5%co2培养箱。
[0111]
1.6.质粒构建、抗体和试剂
[0112]
表1列出了各种商购质粒
[0113]
表1
[0114][0115]
lipofectamine3000(invitrogen,usa)用于转染。慢病毒用于shrna转导。表2 列出了研究中使用的所有抗体。
[0116]
表2
[0117][0118][0119]
mg132(a2585),蛋白酶体抑制剂,和放线菌酮(chx,a8244)购自 apexbio(usa),并用dmso溶解。使用dmso中的angii(a9525;sigma,usa),浓度为10μm。agk2由selleck(美国)
提供。
[0120]
1.7.parp1和baf155泛素化定量
[0121]
使用1%sds缓冲液(trisph7.5、0.5mmedta和1mmdtt)裂解小鼠心肌组织样本,煮沸10分钟,然后将tris-hcl(ph8.0)饱和。用ha标记(ha)-泛素、全长人myc-parp1和突变体myc-parp1质粒转染的细胞;或全长人flag-baf155 和突变flag-baf155质粒也如上所述被裂解。细胞裂解物与抗parp1或抗baf155 抗体(1μg/mg细胞裂解物;4℃)和蛋白a/g(b23202)或抗myc(b26302)或抗标记免疫沉淀磁珠连续孵育(biotool,美国)12小时。
[0122]
1.8.免疫共沉淀
[0123]
小鼠心肌组织样本和细胞用flag裂解缓冲液[50mmtris、137mmnacl、 1mmedta、10mmnaf、0.1mmna3vo4、1%np-40、1mm二硫苏糖醇[dtt]和10%甘油裂解,ph7.8]含有蛋白酶抑制剂(bimake)。将得到的裂解物与30μl抗flag/myc 亲和凝胶(b23102/b26302,biotool;4℃下12小时或足够的抗体(1μg/mg细胞裂解物;2-3小时)和蛋白a/g用于免疫沉淀(b23202;biotool)在30μl在4℃下12小时。免疫沉淀的复合物通过sds-page分离,然后电转移到pvdf膜上。膜被封闭(5%牛血清白蛋白)在环境中1小时,然后连续孵育初级(4℃,过夜) 和二级(环境,1小时)抗体。泛素化的baf155和parp1,用抗myc、抗标志、抗parp1或抗-baf155抗体,分别用抗ha抗体进行检测。imagejv1.46(美国国立卫生研究院)用于信号量化,然后标准化为gapdh和微管蛋白表达。
[0124]
1.9.统计分析
[0125]
数据显示为平均值
±
标准差(sd)。通过f-和brown-forsythe检验分别评估两组和多组的方差同质性。进行夏皮罗-威尔克检验以评估正态性。两组的正态分布和偏态分布数据分别通过学生t检验和韦尔奇t检验进行比较。对分别涉及一个和两个参数的多组比较进行单向方差分析和双向方差分析,然后进行事后bonferroni 检验。p值针对多重比较进行了适当调整。采用spss22.0(spss,usa)进行统计分析,p《0.05表示有统计学意义。
[0126]
二结果与分析
[0127]
2.1.心肌特异性baf155敲除可显著缓解小鼠模型中的心肌肥大和心力衰竭
[0128]
为了确定baf155在小鼠心脏重塑中的功能,将baf155-cwt和心肌特异性 baf155敲除(baf155-cko)小鼠暴露于持续的0.9%nacl和angii(2mg/kg/天)两周(图1a)。免疫荧光和蛋白质印迹显示baf155在心脏组织中被特异性敲除(图 1b-c)。与baf155-cwt小鼠相比,baf155-cko显著减轻了angii诱导的心功能不全(图1d),这反映在小鼠中ef%(图1e)和fs%(图1f)的增加。h&e和 wga染色数据显示,在baf155-cwt小鼠中,angii提高了心肌细胞的大小以及心肌细胞的横截面积,而baf155-cko小鼠中给予angii的这种变化并不显著(图 1g)。与baf155-cwt小鼠相比,baf155-cko显著抑制angii诱导的hw/bw和 hw/tl比值升高(图1h-i),这表明baf155的心脏特异性敲除减轻了小鼠的心脏肥大。此外,与baf155-cwt小鼠相比,baf155-cko显著降低了angii诱导的小鼠anp、bnp、cleavedcaspase-3和parp1的表达(图1j)。同样,与baf155-cwt 小鼠相比,baf155-cko小鼠的angii诱导的心肌纤维化水平显著降低(图1k),心肌纤维化相关蛋白α-sma和胶原蛋白i的表达降低(图1l)。总体而言,这些结果表明baf155的心脏特异性敲除减轻了小鼠的心脏重塑。
[0129]
2.2.baf155过表达显著加重小鼠模型中的心肌肥大和心力衰竭
[0130]
接下来,将baf155-wt和baf155转基因小鼠(baf155-tg)暴露于持续的 0.9%nacl
和angii(2mg/kg/天)两周(图2a)。蛋白质印迹显示baf155在心脏组织中特异性过表达(图2b)。与baf155-wt小鼠相比,baf155-tg显著加重了angii 诱导的心功能不全(图2c),这反映在小鼠中ef%(图2d)和fs%(图2e)的增加。h&e和wga染色数据显示,与baf155-wt小鼠相比,angii给药导致 baf155-tg小鼠心肌细胞大小和心肌细胞横截面积升高(图2f)。与baf155-wt 小鼠相比,baf155-tg显著加重了angii诱导的hw/bw和hw/tl比值升高(图 2g-h),这表明baf155的过表达导致小鼠心脏肥大。此外,与baf155-wt小鼠相比,angii诱导的anp、bnp、cleavedcaspase-3和parp1的表达在baf155-tg 小鼠中均升高(图2i)。同样,与baf155-wt小鼠相比,baf155-tg显著加重了 angii诱导的小鼠心肌纤维化(图2j),并上调了α-sma和胶原蛋白i(图2k)。总体而言,这些结果表明baf155的过表达加重了小鼠的心脏重塑。
[0131]
2.3.parp1在生理条件下充当关键的baf155结合蛋白
[0132]
验证了baf155和parp1的生物学关联。首先,通过免疫共沉淀评估内源性 baf155与parp1的相互作用(图3a-b)。此外,baf155与parp1的相互作用是由angii诱导的(图3c)。此外,parp1与parp1的476-779个氨基酸结构域相互作用,即parp-a-螺旋结构域(图3d)。上述发现表明baf155-parp1轴可能调节心脏重塑。
[0133]
2.4.baf155通过抑制e3泛素连接酶wwp2稳定parp1并减少parp1-k249泛素化
[0134]
为了探索baf155对parp1的调节机制,申请人首先检查了baf155是否调节parp1蛋白的表达。如图4a所示,baf155的表达升高导致parp1的同步表达。一致地,用56438shbaf155rna(seq id no:2 tgggaagcgtcgaaatcagaa)沉默的baf155显著下调parp1表达(图4b)。此外,在flag对照组中parp1的丰度逐渐降低,而baf155过表达在增加chx 的情况下维持parp1表达,chx是用于抑制parp1蛋白合成的转录抑制剂(图 4c)。上述发现表明,baf155通过阻断蛋白酶体途径抑制parp1降解。此外,在 mg132处理后,与flag对照细胞相比,parp1的表达在baf155过表达细胞中(速率和程度)增加(图4d)。这些数据表明baf155的过表达通过抑制蛋白酶体途径的降解来维持parp1的表达。与通过泛素-蛋白酶体途径降解一致,与flag-对照质粒组相比,用flag-baf155转染后parp1的泛素化水平降低(图4e)。同时, parp1的泛素化水平因baf155敲低而增加(图4f)。
[0135]
申请人之前的研究发现,k249上的泛素化是parp1的关键修饰之一。因此,为了进一步证明parp1的泛素化被baf155抑制,申请人过表达parp1-wt、 parp1-k249r以及flag-control和flag-baf155。如图4g所示,baf155降低了 parp1-wt组的泛素化水平,但在parp1-k249r细胞中没有,表明baf155抑制了k249上的parp1泛素化。
[0136]
接下来,申请人旨在确定哪种e3泛素化连接酶介导baf155抑制的parp1 泛素化。在申请人之前的工作中,申请人发现wwp2是parp1的特异性e3泛素化连接酶,并泛素化parp1-k249位点。同时,wwp2也是baf155的e3泛素化连接酶。在mg132的处理下,通过外源性免疫分析,阻断了parp1和baf155 的降解,导致baf155和parp1与wwp2的相互作用增强(图4h)。此外,在 baf155敲低后,parp1与wwp2的结合增加(图4i),而baf155的过表达导致 parp1与wwp2的结合减少(图4j)。当wwp2过表达时,与flag对照组相比,过表达flag-baf155后parp1的泛素化水平下降(图4k)。
[0137]
申请人之前的研究发现parp1-k249的泛素化依赖于e3泛素化wwp2。有趣的是,parp1-k249的修饰依赖于sirt2在同一位点的上游脱乙酰化。因此,为了验证baf155对
parp1的分子调控机制,在小鼠心脏组织中进行了免疫沉淀。 parp1与wwp2和sirt2的结合在用angii治疗后得到增强,并且在baf155-cko 小鼠心脏组织中显著增加,与有或没有angii治疗的wt相比(图4l)。就parp1 的泛素化水平而言,申请人的数据显示angii在wt小鼠心脏组织中诱导泛素化 (图4m)。此外,与wt小鼠相比,parp1的泛素化在baf155-cko小鼠心脏组织中显著增加(图4m)。相反,与wt小鼠相比,在baf155-tg小鼠心脏组织中, parp1与wwp2和sirt2的结合比wt降低(图4n)。与wt小鼠相比,baf155-tg 小鼠心脏组织中parp1的泛素化显著降低(图4o)。
[0138]
2.5.蛋白质组学分析鉴定出baf155上的k948受sirt2特异性调控
[0139]
内源性和外源性免疫共沉淀证实sirt2与baf155相互作用(图5a-c)。此外,在angii的诱导下,sirt2和baf155之间的相互作用得到增强(图5d和e)。根据uniprot数据库,baf155包含五个功能域,包括chromo、swirm、sant、 glu-rich和pro-rich域。使用内源性sirt2和全长flag-tagged-baf155或各种截短的flag-baf155质粒,申请人证明baf155的swirm结构域是sirt2的结合位点(图5f)。
[0140]
接下来,申请人重点研究了baf155乙酰化的调控机制。在用曲古抑菌素 a(tsa)和烟酰胺(nam)治疗后,baf155的乙酰化水平增加,它们是组蛋白去乙酰化酶hdaci和iii以及去乙酰化酶的去乙酰化酶家族的抑制剂(图5g)。为了鉴定baf155的特异性乙酰转移酶,分别转染了四种乙酰转移酶,包括p300 (300-kdae1a结合蛋白)、cbp、pcaf(p300/cbp相关因子)和gcn5(kat2a)。如图5h所示,cbp的过表达,而不是其他乙酰转移酶的过表达,显著增加了 baf155的乙酰化水平。此外,cbp在内源性和外源性条件下都与baf155相互作用(图5i和5j)。因此,baf155被证明是cbp赖氨酸乙酰化的底物。接下来,申请人分析了用或不用20μmol/lagk2(一种常用的sirt2特异性抑制剂)处理的正常对照和shsirt2细胞的整体乙酰化变化。与之前的结果一致,与正常对照细胞相比,baf155的乙酰化水平在shsirt2细胞和用agk2处理的细胞中上调(图 5k)。上述调节在wt和sirt2敲除小鼠的心脏组织中得到验证,与wt动物相比,来自sirt2敲除动物的心脏组织样品中baf55的baf155水平显著增强(图 5l)。此外,wt-sirt2的过表达降低了baf155的外源乙酰化水平(图5m),而转染sirt2的无活性突变体(h187yq167a)则没有效果(图5n)。此外,与wt 动物相比,来自sirt2敲除动物的心脏组织样本中baf155的乙酰化水平显著增强,无论是否由angii诱导(图5o)。外源性baf155的乙酰化水平在angii处理下降低,而外源性baf155的乙酰化水平随着angii诱导的外源性sirt2过表达而进一步下降(图5p)。
[0141]
k948可能代表受sirt2调节的baf155的重要乙酰化位点。k948在整个进化过程中发现,从莫哈文果蝇到哺乳动物物种(图5q)。为了进一步研究乙酰化对k948的关键作用,产生了特异性识别baf155的乙酰化k948的抗体(图5r)。施用tsa和nam后,baf155-k948的乙酰化水平增加(图5s)。此外,外源转染四种乙酰转移酶后,只有cbp增加了baf155-k948的乙酰化水平(图5t)。同时,外源转染wt-sirt2而不是失活的sirt2(h187yq167a)降低了baf155-k948 的乙酰化水平(图5u)。总之,以上数据表明k948受到cbp和sirt2的特异性调控。
[0142]
2.6.对sirt2敲除和转基因小鼠中差异蛋白的乙酰化蛋白质组学分析证明了baf155-k948在体内的sirt2去乙酰化
[0143]
为了全面了解sirt2调节的小鼠心脏赖氨酸乙酰化变化,在sirt2敲除小鼠 (sirt2-ko)、sirt2过表达小鼠(sirt2-tg)和野生型动物(sirt2-wt)(图6a)。
[0144]
在生物学实验中验证了baf155-k948在sirt2敲除和转基因小鼠中的乙酰化蛋白质组学分析。免疫沉淀测定证实,与wt相比,在sirt2敲除后baf155-k948 的乙酰化水平在给予或不给予angii的情况下增加(图6b),而baf155-k948的乙酰化水平在sirt2-tg小鼠心脏组织中降低(图6c)。
[0145]
2.7.sirt2通过wwp2促进baf155-k948和parp1-k294泛素化
[0146]
为了研究sirt2对baf155-parp1凋亡复合物的调节作用,分析了sirt2-wt 和sirt2-ko心脏组织以及nc和shsirt2h9c2细胞中baf155的丰度。如图7a 所示,baf155丰度在sirt2下调后增加。申请人使用shsirt2的三个片段 (61965-shsirt2 seq id no:3ctatgcaaacttggagaaata、
[0147]
61966-shsirt2 seq id no:4gaccaaagagaaagaggaaca、
[0148]
61967-shsirt2 seq id no:5gtggaaaagagtacacgatga)观察到类似的趋势,并使用61966-shsirt2片段进行后续实验(图7a)。此外,与给予mg132 的sirt2-ko动物相比,sirt2-wt小鼠心脏组织中baf155上调的速率和程度升高(图7b)。同时,sirt2-wt小鼠心脏组织在chx给药后baf155表达显著降低,而sirt2-ko小鼠组随着时间的推移保持非常高的baf155表达(图7c)。与通过泛素-蛋白酶体途径降解一致,与flag-对照质粒组相比,在myc-sirt2过表达和mg132处理后检测到baf155的泛素化水平增强(图7d)。baf155的泛素化水平在wt-sirt2-flag过表达后增加,但h187yq167a-sirt2-flag(无脱乙酰活性的突变sirt2)(图7e)。相反,随着四种乙酰转移酶的过表达,仅在过表达 cbp的细胞中观察到baf155丰度上调(图7f)和泛素化水平降低(图7g)。
[0149]
为了直接显示sirt2促进baf155的泛素化,申请人确定了由sirt2调节的 baf155的去乙酰化位点。如图7h所示,与baf155-k948r对应物相比,sirt2 过表达增强了baf155-wt细胞中的泛素化水平,表明baf155在k948处被sirt2 去乙酰化,导致在同一位点泛素化并促进baf155的降解。简而言之,k948被sirt2 确认为baf155的主要去乙酰化位点。
[0150]
正如申请人上面提到的,baf155与parp1一样,共享相同的e3泛素连接酶 wwp2。接下来,为了探索wwp2是否参与sirt2介导的去乙酰化诱导的baf155 降解,ha-wwp2在nc和shsirt2h9c2细胞系中表达。有趣的是,baf155的丰度在nc细胞系中逐渐减少,而在shsirt2细胞中保持在高水平(图7i)。与nc 细胞相比,由wwp2介导的baf155泛素化水平在shsirt2处理中降低(图7j)。此外,myc-sirt2过表达导致baf155和wwp2之间的结合升高,但与 k948r-baf155过表达无关(图7k)。上述发现进一步表明sirt2通过wwp2促进了baf155的泛素化。此外,申请人旨在验证baf155-parp1损伤复合物受 sirt2-wwp2调节。申请人发现parp1的泛素化水平在flag-sirt2和ha-wwp2 过表达后显著增加,并随着flag-baf155的进一步过表达而降低(图7l)。然后,过度表达k249r-parp1(突变parp1没有由baf155和wwp2介导的泛素化位点),在parp1上观察到的泛素化水平可以忽略不计(图7l)。上述结果表明,sirt2 通过wwp2介导的k948泛素化促进baf155的降解,wwp2主要通过k249泛素化调节parp1的降解。申请人进一步检查了sirt2对parp1-baf155复合物的影响。随着myc-sirt2的过表达,parp1与baf155的结合减少(图7m)。与先前报道的结果一致,在有或没有angii诱导的情况下,在shbaf155-h9c2细胞系中parp1的表达降低(图7n),但在shsirt2-h9c2细胞中baf155的表达增加而parp1的表达降低(图7o)。与shbaf155h9c2细胞相比,parp1在shbaf155 和shsirt2h9c2细胞中的表达更高(图7n),但低于shsirt2h9c2细胞(图7o)。这些
发现表明sirt2通过促进baf155的降解使baf155-parp1复合物不稳定。3.8.对sirt2敲除和转基因小鼠中差异蛋白的蛋白质组学分析表明,sirt2在体内通过wwp2促进baf155和parp1的泛素化
[0151]
在小鼠心脏组织中进行了免疫沉淀;与给予或不给予angii的sirt2-wt小鼠样品相比,用angii治疗后baf155与parp1的结合增强,并且在sirt2-ko小鼠心脏组织中显著增强(图8a)。此外,在sirt2-wt小鼠心脏组织中,与wt 小鼠样品相比,baf155和parp1的泛素化水平在angii治疗后降低,并且在 sirt2-ko小鼠心脏组织中显著降低(图8b,8c)。此外,与sirt2-wt动物相比,在给予或不给予angii的sirt2-ko小鼠的心脏组织中,wwp2与baf155和 parp1的结合降低(图8d)。相反,与给予或不给予angii的sirt2-wt组相比, baf155与parp1的结合在sirt2-tg小鼠心脏组织中降低(图8e)。与sirt2-wt 小鼠相比,sirt2-tg小鼠心脏组织中baf155和parp1的泛素化水平显著升高(图 8f和8g)。此外,与sirt2-wt动物相比,在给予或不给予angii的sirt2-tg 小鼠的心脏组织中,wwp2与baf155和parp1的结合增加(图8h)。
[0152]
讨论和结论
[0153]
申请人将swi/snf染色质重塑复合物的亚基baf155(smarcc1)鉴定为 parp1的重要体内相互作用蛋白。申请人的工作表明,baf155通过干扰parp1 和wwp2、e3泛素连接酶以及parp1的以下泛素化之间的相互作用来稳定 parp1。因此,上述证据指出了一种可能的新机制,即通过共定位来维持parp1 的高局部浓度和激活状态,以稳定其相互作用的蛋白质。
[0154]
基于申请人的模型机制,低活性的sirt2在baf155的k948和parp1的k249 上保留了较高水平的乙酰化,从而使baf155和parp1保持相互作用状态并防止被wwp2泛素化。
[0155]
最后说明的是,以上优选实施例仅用以说明本技术的技术方案而非限制,尽管通过上述优选实施例已经对本技术进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本技术权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
