一种蜂巢状gelma微球在构建肿瘤模型中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种蜂巢状gelma微球在构建肿瘤模型中的应用。
背景技术:
2.现如今,恶性肿瘤的治疗手段包括手术切除、化疗、放疗以及免疫疗法,然而始终没有达到根治的效果。为此,开发新的治疗方式是当务之急。当前肿瘤治疗所面临的十大挑战,首当其冲的便是如何建立更为接近天然肿瘤的肿瘤模型。有许多文献表面上显示自身所研发的治疗手段对肿瘤细胞系以及该细胞系造模形成的荷瘤动物模型产生了极好的治疗效果,然而却未能应用到临床上,主要原因便是肿瘤模型与天然肿瘤的差异很大。因此,科研人员在寻找杀死肿瘤细胞的方法以及进行抗癌药物测试和研发时,使用更接近天然肿瘤的肿瘤模型能够更高效、更准确的找到癌症治疗药物。建立肿瘤模型是一直以来研究肿瘤疾病的主要方式,通过复制肿瘤最初的生存环境阐明恶性肿瘤的发生进展和转移的相关机制,从根源上寻找合适的治疗方法,这是建立肿瘤模型所追求的终极目标。现如今,人们常利用肿瘤模型进行新药的研发,探究能对肿瘤发挥积极作用的新物质并摸索最适用量。然而大部分科研成果难以转化为临床应用,主要是因为大多数肿瘤模型都不能体现肿瘤的复杂性和异质性。为此,研发更接近天然肿瘤生理特性的肿瘤模型显得尤为重要,其应该具备以下几点:(1)能够模拟真实肿瘤内细胞与细胞以及细胞与细胞外基质之间的相互作用;(2)能够更好的维持天然肿瘤细胞的生物学特性,包括干性,侵袭性和耐药性等;(3)具有天然肿瘤内非细胞成分的物理和化学因素,如营养交换和氧气梯度;(4)低成本,可批量生产,均一,保证结果的一致性。
3.目前建立肿瘤模型的主要手段是通过二维平板培养,即利用培养皿,通过添加不同营养成分培养特定肿瘤细胞,为进行体内外探究提供条件。该方法成本低且应用广泛,但其存在的缺陷逐渐被重视认识起来到:(1)使用二维平板培养肿瘤细胞,这种扁平生物学手段既不能模拟真实的肿瘤宏观结构,也不能反映肿瘤微环境的复杂性和异质性;(2)二维平板培养改变了细胞的生长,迁移和凋亡能力,不能提供细胞
‑
细胞和细胞
‑
细胞外基质相互作用的信息,显著降低了肿瘤的恶性表型;(3)以细胞系为基础的药物疗效和毒性测定不能准确预测肿瘤对抗癌药物的反应,无法得到有效有用的数据。据文献报道,当细胞从原生环境接种到平滑的基质时,通常表现出非自然行为,比如乳房上皮细胞在平滑的基质上生长时表现出肿瘤趋势,但转移到类似于其天然生态位的3d模型后回归到正常状态。
4.相较于传统的二维平板的培养方式,三维培养能够更好的模拟肿瘤的微环境,再现细胞与非细胞成分之间的相互作用来保持肿瘤细胞原始特性。此外,越来越多的证据表明,三维培养更好的模拟了肿瘤细胞在三维空间的体内结构,可以揭示肿瘤组织的复杂情况,在一定程度上能够再现肿瘤细胞原始的生物学特性。三维培养构建的肿瘤模型主要包括肿瘤细胞球和类器官,前者主要通过超低细胞粘附板培养肿瘤细胞从而形成肿瘤球体,但该方法所形成的3d肿瘤模型往往存在很大差异,不能作为可重复和可靠的方式筛选药
物。关于类器官的构建,现有方法难以标准化,尤其是需要在凝固基质的液滴中培养类有机物,这使得发展可靠的分析方法很麻烦,由于物理参数和生长因子可及性的局部差异,导致有机物的形状、大小和分布的变化。因此,需要寻找合适的支架材料用于三维培养肿瘤细胞,该支架材料应当具备同质性,利于肿瘤细胞粘附和增殖,生物残留物质和降解产物不会对肿瘤细胞产生影响,如plga支架降解后的酸性副产物会降低聚合物周围组织微环境的ph值,不利于细胞生长,显然不适宜选用。然而目前的三维支架材料受到结构异质性、低细胞负载率、生存率、残留的生长因子或不确定物质会对肿瘤细胞培养产生影响的限制。
5.微流控技术通过实现流体的精确控制和高水平的平台整合,推动了材料科学向全新的方向发展,为三维结构的高通量合成提供了具有集成小型化与自动化特征的强大工具。利用微流控技术制备的水凝胶微球应用广泛,具有多方面的优势:(1)在结构上具有同质性,确保实验结果的可重复;(2)在组分构成上具有强大的可塑性,可利用不同的原材料进行构造,如plga,peg和plla明胶、透明质酸、聚乳酸等;(3)在药物负载上具有多样性,不同药物可通过不同方法负载在微球表面并达到理想的释放效果,如直接混入或其他纳米材料包裹后利用化学键作用连接到微球上;(4)可大规模生产,成本低和均一性高;(5)水凝胶微球能够为细胞提供三维的生长环境,营造适合细胞生长的微环境和营养供给,甚至控制释放药物影响细胞生长。因此,利用微流控制备的水凝胶微球具有作为各类细胞立体生长平台的潜力。
6.骨肉瘤是临床常见的起源于成骨细胞的原发性恶性骨肿瘤,目前临床上对于骨肉瘤的早期诊断及预后检测缺乏理想的分子标志物,针对化疗药物不敏感和发生转移的患者,尚没有合适的治疗手段。同时肿瘤的异质性和复发患者对目前使用的化疗药物的耐药性增加是治疗骨肉瘤的主要困难。为了探索新的潜在药物和治疗手段,开发更接近天然肿瘤生理特性的骨肉瘤模型显得至关重要。
技术实现要素:
7.针对现有技术的不足,本发明提供了一种蜂巢状gelma微球在构建肿瘤模型中的应用,通过微流控技术形成类似蜂巢状的多孔gelma水凝胶微球,将其应用于骨肉瘤细胞的三维培养。体内外实验表明,基于蜂巢状多孔微球的三维培养能够维持骨肉瘤细胞的干性,更好的维持了骨肉瘤细胞的生物学特性,能够更好的模拟肿瘤细胞在体内真实的环境,并通过体内实验验证了利用三维培养平台得到的肿瘤细胞具有更强的成瘤性。为精准医疗及药物筛选,探究骨肉瘤新的治疗手段提供新的可行性选择。
8.本发明是通过以下技术方案实现的:
9.一种蜂巢状gelma微球在构建肿瘤模型中的应用,将所述蜂巢状gelma微球作为培养肿瘤细胞的三维支架;所述蜂巢状gelma微球以肉豆蔻酸异丙酯溶液为连续相,含有1%2
‑
羟基
‑
4'
‑
(2
‑
羟基乙氧)
‑2‑
甲基苯丙酮的gelma溶液为分散相,在恒定速度差下采用微流控技术批量制备同等大小的单分散液滴,将液滴暴露于6.9mw/cm2紫外光下进行光交联,经清洗后冷冻干燥的gelma微球形成蜂巢状结构。
10.优选地,所述蜂巢状gelma微球的制备方法包括以下步骤:
11.步骤1)gelma的制备:将明胶按1g/10ml溶于50℃的pbs中,加入pbs体积的8%的甲基丙烯酸酐,边搅拌边微量泵入,然后用pbs稀释5倍以终止反应;使用透析袋透析2周,每天
更换ddh2o,以彻底去除游离的甲基丙烯酸酐,直至液体澄清为止,反应产物即为甲基丙烯酰基取代度为100%的gelma,经冷冻干燥获得白色泡沫状冻干凝胶,置于
‑
20℃备用;
12.步骤2)蜂巢状gelma微球的制备:以混入1%2
‑
羟基
‑
4'
‑
(2
‑
羟基乙氧)
‑2‑
甲基苯丙酮的浓度为5%~10%的gelma溶液作为分散相,肉豆蔻酸异丙酯作为连续相,采用微流控技术分别以不同速度注入两相液体,在剪切力的作用下,分散相形成单个连续液体,不同速度差下形成的液滴尺寸不同,将收集的液滴暴露于6.9mw/cm2紫外光下进行光交联,经清洗后冷冻干燥形成多孔gelma水凝胶微球,即得。
13.优选地,步骤2)所述gelma溶液的浓度为7.5%。
14.优选地,所述肿瘤模型为骨肉瘤模型。
15.优选地,将所述肿瘤模型用于制备抗肿瘤药物。
16.优选地,将所述肿瘤模型用于筛选抗肿瘤药物。
17.优选地,所述抗肿瘤药物为抗骨肉瘤药物。
18.优选地,将所述肿瘤模型用于制备医用生物材料。
19.本发明的有益效果如下:
20.1、本发明受蜂巢结构启发,通过微流控技术构建了蜂巢状gelma微球,以此作为培养骨肉瘤细胞的三维支架,通过模拟天然肿瘤内细胞
‑
细胞和细胞
‑
ecm的相互作用,打造更接近天然肿瘤的生长环境,使其更能展现肿瘤细胞的结构和行为,维持生物学特性和基因稳定性。蜂巢状gelma微球的同质性保证了结果的统一,简易的制备方法确保了可大规模培养。在体外,我们比较了常见的二维平板培养和蜂巢状gelma微球三维培养两种方法对骨肉瘤细胞生物学特性的改变。体外结果表明,蜂巢状gelma微球三维培养的方法能够更好的维持骨肉瘤细胞的干性、增殖周期加速、促进细胞增殖、肿瘤侵袭性转移和血管生成等,对dox的耐药性增加了2.57倍。体内研究表明相较于普通培养板,利用该种方法培养获得的骨肉瘤细胞在体内成瘤周期更短、瘤体积更大、骨侵蚀性更强。这些结果表明蜂巢状gelma微球对肿瘤细胞的生物学特性具有很好的维持作用,同时,对该种方法培养的骨肉瘤细胞进行分析得到的数据也更准确。该支架的产生为利用骨肿瘤模型开展相应研究提供了有力的工具,节省了时间成本和经济成本,肿瘤的生物特性更好的被保留,为研究肿瘤的发生发展机制和大规模药物筛选等提供了有效的工具。
21.2、为了模拟肿瘤细胞原始的生存环境,本发明选用接近天然ecm的gelma为原材料制备gelma微球,其本身具有rgd序列,有利于肿瘤细胞的粘附和增殖,此外,冻干后形成多孔结构,蜂巢状的gelma微球为肿瘤细胞粘附提供更大的面积以及营养(细胞因子释放)均一,力学强度均一,生长速度均一的微环境。该支架的产生为肿瘤模型的构建提供一种新颖的制备手段。
附图说明
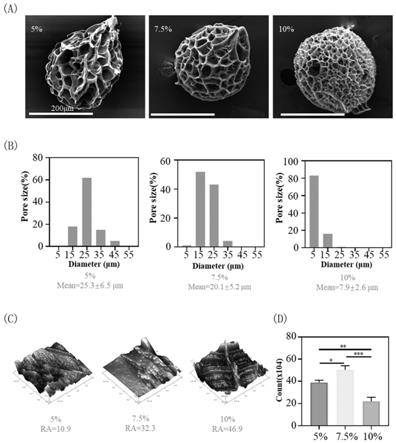
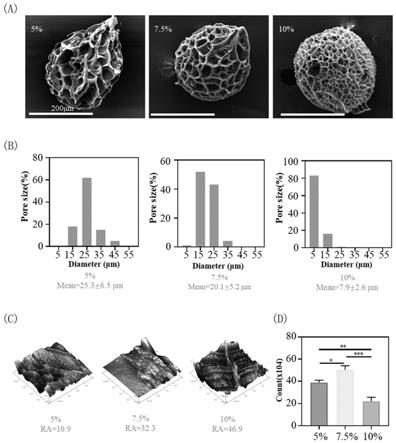
22.图1(a)为实施例2中5%、7.5%和10%gelma浓度微球的形貌特征sem图(200μm);
23.图1(b)为实施例2中5%、7.5%和10%gelma浓度微球的粒径分布;
24.图1(c)为实施例2中5%、7.5%和10%gelma浓度微球的粗糙度afm图;
25.图1(d)为实施例2中5%、7.5%和10%gelma浓度微球培养骨肉瘤细胞3天后细胞计数情况(
*
p<0.1,
**
p<0.01,
***
p<0.001);
26.图2(a)为实施例3中蜂巢状gelma微球冻干前后的大体观(200μm);
27.图2(b)为实施例3中蜂巢状gelma微球冻干前后的粒径分布;
28.图2(c)为实施例3中蜂巢状gelma微球培养k7m2细胞脱水后0、3和5d的sem图(100μm和200μm);
29.图3为实施例3中蜂巢状gelma微球培养mg63细胞在第1、3和7d进行骨架染色的倒置荧光显微镜图和激光共聚焦显微镜图(200μm);
30.图4为实施例3中蜂巢状gelma微球培养mg63细胞在第1、3和7d进行活死染色的倒置荧光显微镜图和激光共聚焦显微镜图(200μm);
31.图5(a)为实施例3中蜂巢状gelma微球放在2u/ml的ⅱ型胶原酶溶液中降解1、7、14、21d的光学显微镜图(200μm);
32.图5(b)为实施例3中蜂巢状gelma微球放在2u/ml的ⅱ型胶原酶溶液中的降解曲线;
33.图6(a)为实施例4中蜂巢状gelma微球培养7天(ms)的k7m2细胞与培养板培养(tcp)的k7m2细胞增殖情况比较(
****
p<0.0001,ns表示无差异);
34.图6(b)为实施例4中ms与tcp培养的k7m2细胞干性相关基因nango、sox
‑
2、nucleostemin的表达情况(
***
p<0.001,
****
p<0.0001);
35.图6(c)为实施例4中ms与tcp培养的k7m2细胞的细胞周期;
36.图6(d)为实施例4中ms与tcp培养的k7m2细胞不同细胞周期的定量分析结果(
**
p<0.01,
****
p<0.0001);
37.图7(a)为实施例5中ms与tcp培养的k7m2细胞在transwell培养板培养24h的光学显微镜图(200μm);
38.图7(b)为实施例5中ms与tcp培养的k7m2细胞在transwell培养板培养24h的定量分析结果(
***
p<0.001);
39.图7(c)为实施例5中ms与tcp培养的k7m2细胞进行划痕实验0和24h的光学显微镜图(200μm);
40.图7(d)为实施例5中ms与tcp培养的k7m2细胞进行划痕实验的定量分析结果(
****
p<0.0001);
41.图8为实施例5中ms与tcp培养的k7m2细胞迁移相关基因vegf、fapα、cxcl3、mmp
‑
2的表达情况(
**
p<0.01,
***
p<0.001);
42.图9(a)为实施例5中ms与tcp培养的k7m2细胞的cd24和cd44的表达情况;
43.图9(b)为实施例5中ms与tcp培养的k7m2细胞的cd24和cd44的定量分析结果(
***
p<0.001);
44.图10(a)为实施例6中ms与tcp培养的k7m2细胞emt相关基因n
‑
cadherin、twist1、snail的表达情况(
**
p<0.01,
****
p<0.0001);
45.图10(b)为实施例6中ms与tcp培养的k7m2细胞emt相关蛋白表达情况;
46.图10(c)为实施例6中ms与tcp培养的k7m2细胞emt相关基因n
‑
cadherin、twist1、snail的定量分析结果(
****
p<0.0001);
47.图10(d)为实施例6中ms与tcp培养的k7m2细胞在50nmol/ml和100nmol/ml dox干预下的凋亡情况;
48.图10(e)为实施例6中ms与tcp培养的k7m2细胞在50nmol/ml和100nmol/ml dox干预下的定量分析结果(
***
p<0.001,
****
p<0.0001);
49.图11(a)为实施例6中ms与tcp培养的mg63细胞在50nmol/ml dox干预下的凋亡情况;
50.图11(b)为实施例6中ms与tcp培养的mg63细胞在50nmol/ml dox干预下的定量分析结果(
****
p<0.0001);
51.图11(c)为实施例6中ms与tcp培养的mg63细胞bcl
‑
2、bax基因的表达情况(
****
p<0.0001,ns表示无差异);
52.图12(a)为实施例7中ms与tcp培养的k7m2细胞的上清联合m
‑
csf、rankl诱导小鼠bmm细胞破骨分化5d的trap染色结果(200μm);
53.图12(b)为实施例7中ms与tcp培养的k7m2细胞的上清联合m
‑
csf、rankl诱导小鼠bmm细胞破骨分化5d的定量分析结果(
***
p<0.001);
54.图12(c)为实施例7中ms与tcp培养的k7m2细胞的上清诱导小鼠bmm细胞破骨分化5d时破骨相关基因dc
‑
stamp、ctsk、trap的表达情况(
**
p<0.01,
***
p<0.001);
55.图12(d)为实施例7中ms与tcp培养的k7m2细胞rankl基因相关蛋白表达情况;
56.图12(e)为实施例7中ms与tcp培养的k7m2细胞rankl基因的定量分析结果(
**
p<0.01);
57.图12(f)为实施例7中ms与tcp培养的k7m2细胞rankl基因的表达情况;
58.图13(a)为实施例8中ms组与tcp组的肿瘤组织大体观;
59.图13(b)为实施例8中ms组与tcp组的定量分析结果(
*
p<0.1);
60.图13(c)为实施例8中ms组与tcp组的肿瘤增长曲线;
61.图13(d)为实施例8中ms组与tcp组的小鼠存活曲线;
62.图13(e)为实施例8中ms组与tcp组的肿瘤组织h&e染色结果(100μm);
63.图13(f)为实施例8中ms组与tcp组的肿瘤组织的tunel染色、ki67染色以及αsma免疫荧光染色结果(100μm);
64.图13(g)为实施例8中ms组与tcp组的肿瘤组织的tunel染色、ki67染色以及αsma免疫荧光染色的定量分析结果(
**
p<0.01,
***
p<0.001);
65.图14(a)为实施例8中ms组与tcp组的小鼠股骨二维重建图;
66.图14(b)为实施例8中ms组与tcp组的小鼠股骨三维重建图;
67.图14(c)为实施例8中micro
‑
ct分析ms与tcp组小鼠股骨骨形态学参数bmd、bv/tv、bs/bv和tb.th的定量分析结果(n=3,
*
p<0.05,
**
p<0.01,
***
p<0.001)。
具体实施方式
68.下面结合附图与具体实施例对本发明做进一步详细说明。本发明所用试剂和原料均市售可得或可按文献方法制备。以下实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
69.以下实施例所用细胞系:
70.k7m2细胞株:购自中国科学院细胞库,k7m2细胞在培养基(90%dmem培养基(含10%碳酸钙)、10%胎牛血清、100u/ml青霉素和100mg/l链霉素)中培养,放置于37℃,5%
co2的培养箱中;每2天更换新鲜培养基;在细胞扩增到铺满培养皿85%左右时,用胰蛋白酶消化然后以1:3的比例传代培养。
71.mg63细胞株:购自中国科学院细胞库,mg63细胞在培养基(90%dmem培养基(含10%碳酸钙)、10%胎牛血清、100u/ml青霉素和100mg/l链霉素)中培养,放置于37℃,5%co2的培养箱中;每2天更换新鲜培养基;在细胞扩增到铺满培养皿85%左右时,用胰蛋白酶消化然后以1:3的比例传代培养。
72.统计分析:所有数据均以平均
±
标准差表示。统计分析(graphpad软件,美国)的评估采用单因素阳差分析和tukey多重比较检验,以进一步评估各组间的差异。p<0.05表示具有统计学意义(
*
p<0.05,
**
p<0.01,
***
p<0.005)。p>0.05表示无显著性差异(ns)。
73.qrt
‑
pcr(荧光定量pcr):引物设计和合成:所用引物序列参照相关文献,由苏州金唯智生物科技有限公司合成。序列如表1所示,其中gapdh为内参序列。将骨肉瘤细胞k7m2分别在微球上和12孔板内培养7d,12孔板内的细胞作为对照组。用pbs洗涤3次后每孔加入trizol试剂,用移液枪移入1.5ml的ep管内,充分震荡混匀后室温下裂解15min,期间不时混匀。每管加入0.2ml的氯仿,充分震荡混匀后室温下静置10min,离心机4℃下12000rpm离心15min;将ep管中的上清液体移入到新的ep管中,注意吸取的时候切勿吸取到贴壁及中间的白色沉淀,加入等体积的异丙醇,轻轻颠倒混匀后室温静置10min;离心机4℃下12000rpm离心15min,ep管底可见白色沉淀;75%乙醇重悬洗涤rna沉淀,离心机4℃下7500rpm离心5min,吸去上清后室温晾干,然后再将rna溶解于适量的depc水(20μl)中;58℃水浴加热15min,nanodrop微量分光光度计检测吸光度及rna浓度,根据检测的浓度,调整提取的各组样品浓度为1μg/μl。将1μg样品加入ep管中,随后加入5x all
‑
in
‑
one rt mastermix 4μl和适量的depc水,液体总量为20μl。然后进行逆转录反应,反应条件如下:25℃10min,42℃15min,85℃5min,在冰盒上将cdna用depc水稀释5倍,取2.5μl加到96孔pcr反应管中,加入sybr green 5μl;上下游引物各0.5μl和适量的depc水,液体总量为10μl。pcr仪设置如下反应条件:95℃持续30s,60℃持续30s,72℃持续30s,如此循环40次。
74.以下实施例所用引物序列如下表1所示:
75.表1引物序列表
[0076][0077][0078]
实施例1蜂巢状gelma微球的制备
[0079]
实验材料:明胶购自罗赛洛(浙江)有限公司。甲基丙烯酸酐购自阿拉丁试剂(上海)有限公司。
[0080]
一种用于构建肿瘤模型的蜂巢状gelma微球的制备方法,具体步骤如下:
[0081]
(1)gelma的制备:将40.0g的明胶溶于400ml的pbs(50℃)中,在磁力搅拌器上加速溶解,加入32.0ml的甲基丙烯酸酐,边搅拌边用微量注射泵泵入,用于介导甲基丙烯基与明胶上活跃氨基酸残基上的氨基和羟基上发生置换反应,然后用1600ml的pbs稀释5倍以终止反应。使用截留分子量为10kda的透析袋透析2周,每天更换ddh2o,以彻底去除游离的甲基丙烯酸酐,直至液体澄清为止,反应产物即为甲基丙烯酰基取代度为100%的gelma,经冷冻干燥获得白色泡沫状冻干凝胶可放置
‑
20℃备用。
[0082]
(2)蜂巢状gelma微球的制备:以混入1%光引发剂(pi)(2
‑
羟基
‑
4'
‑
(2
‑
羟基乙氧)
‑2‑
甲基苯丙酮)的浓度分别为5%、7.5%和10%的gelma溶液作为分散相,肉豆蔻酸异丙酯作为连续相,通过微量注射推进泵分别以不同速度注入两相液体,在剪切力的作用下,分散相形成单个连续液体,不同速度差下形成的液滴尺寸不同,将收集的液滴暴露于6.9mw/cm2紫外光下交联1min,经乙醇和ddh2o清洗后,冷冻干燥形成多孔gelma水凝胶微球,
即得。
[0083]
以下实施例所述微球均为本实施例制得的多孔gelma水凝胶微球(蜂巢状gelma微球)。
[0084]
实施例2蜂巢状gelma微球表征的探究
[0085]
通过倒置荧光显微镜(明场)观察微球大体观并通过imagej计算微球的粒径分布;通过离子溅射仪对冷冻干燥后的微球进行喷金处理,随后在sem下进行观察并通过imagej计算孔径分布;通过afm观察蜂巢状gelma微球的表面粗糙度。
[0086]
1、在扫描电子显微镜(sem)下分别观察gelma浓度为5%、7.5%和10%的微球微观结构,直径均在350μm左右,然而不同浓度的gelma所产生的微球形成了不同大小的孔径,5%、7.5%和10%的微球平均孔径分别为25.3
±
6.5μm、20.1
±
5.2μm和7.9
±
2.6μm(支持信息如图1(a)的扫描电镜图像和图1(b)的定量分析结果所示)。
[0087]
2、为进一步比较不同浓度gelma形成的蜂巢状微球对细胞生存的影响,我们先是利用原子力学显微镜(afm)对不同浓度gelma微球的表面粗糙度进行探索,伴随着gelma浓度的增加,微球表面的粗糙度ra逐渐增加(5%gelma ra=10.9,7.5%gelma ra=32.3,10%gelma ra=46.5),当gelma浓度为7.5%时更接近细胞生长天然环境下的粗糙度。其次,将不同gelma浓度的微球分别铺满12孔板的板底,同时加入1ml 2
×
105/ml小鼠骨肉瘤细胞k7m2细胞悬液进行培养,待8h细胞贴壁后将微球转移至新的孔中并补加1ml培养基,培养24h后胰酶消化计数,可见7.5%gelma微球更有利于k7m2细胞的生长,这可能是粗糙度与孔径大小对细胞生长影响的综合结果。支持信息如图1(c)的afm图像和图1(d)的计数分析结果所示。在后续的实验中,我们均采用7.5%gelma微球进行骨肉瘤细胞的培养和研究其生物学特性。
[0088]
实施例3蜂巢状gelma微球表征的进一步探究
[0089]
1、利用光学显微镜观察冷冻干燥前后的微球大体观,可见冻干前后的微球大小均一,形状规则,冻干后直径明显缩小,平均直径从440nm缩小至365nm,冻干后的微球在接触到水后又会恢复至冻干前的直径大小,这一溶胀现象为后续培养细胞时通过溶胀作用吸附细胞提供条件(支持信息如图2(a)、图2(b)所示)。
[0090]
2、通过乙醇梯度脱水对培养k7m2细胞0、3、5天的微球进行脱水处理,在sem下进行观察,可见微球孔隙多且分布均匀,内外联通,细胞很好的生长在微球表面和孔隙内,蜂巢样的结构为细胞提供更多的粘附空间,有利于细胞之间的物质交换以及与外界的营养代谢,更加有利于细胞生存(如图2(c)所示)。
[0091]
gelma作为一种类似于ecm的水凝胶材料,其携带的rgd基团更是有利于细胞的粘附和增殖,在医用生物材料上得以广泛利用,如利用gelma制备的负载nk细胞的水凝胶微球用于肿瘤杀伤以及负载髓核细胞用于治疗椎间盘退变。
[0092]
3、对gelma微球的生物相容性进行验证,利用微球培养骨肉瘤细胞mg63,分别在第1、3、7天进行骨架和活死染色,并用倒置荧光显微镜和激光共聚焦显微镜进行观察(支持信息如图3、图4所示),结果显示微球具有良好的生物相容性,不会对细胞的生长产生毒性作用。
[0093]
4、进一步研究微球可降解性。
[0094]
微球的生物降解性:将3g微球分成三个等份,每份加入10ml pbs(2u/ml胶原酶
ii),37℃孵育,缓慢搅拌。每隔1周在显微镜下观察并冻干称重。每个时间点得到的三个结果,统计后绘制降解曲线。
[0095]
将微球放在2u/ml的ⅱ型胶原酶溶液中,在37℃摇床上放置,每周在光学显微镜下观察形态变化并称重,大约28天时降解超过80%(支持信息如图5(a)、图5(b)所示)。
[0096]
综上所述,经微流控技术获得蜂巢状gelma微球具有多孔性、可降解性和良好的生物相容性,可用于肿瘤细胞在内的多种的三维培养。
[0097]
实施例4蜂巢状gelma微球的三维培养对骨肉瘤细胞增殖及干性表达的影响
[0098]
1、建立肿瘤3d培养模型的关键是保持肿瘤的原生态。维持肿瘤细胞的干性不仅为研究肿瘤的发生发展提供依据,也为寻找肿瘤特异性药物提供依据。为了探究基于蜂巢状gelma微球的三维培养对骨肉瘤细胞增殖及干性的影响,我们将k7m2细胞分别用蜂巢状gelma微球(ms)和3d普通培养板(tcp)进行培养,培养七天后通过胰酶消化得到两种培养条件(ms和tcp)下的k7m2细胞,通过cck
‑
8法检测细胞增殖。
[0099]
细胞增殖试验:使用cck
‑
8试剂盒来评估微球上的细胞增殖。选择tcp作为对照。在每个时间点(1、2、3和4天),以10%(v/v)的比例在培养基中加入cck
‑
8试剂(dorinda,日本)。孵育4h后,将100μl培养基用移液枪移入清洗干净的96孔板中,使用酶标仪测量450nm处的吸光度。
[0100]
结果显示基于微球三维培养的k7m2细胞增殖速率显著高于平板培养(如图6(a)所示)。
[0101]
2、肿瘤干细胞是肿瘤起始、自我增殖和更新的主力,因此肿瘤细胞的增殖与肿瘤细胞的干性基因表达密切相关,sox2和nanog是escs转录调控的核心因子,其中sox2是高泳动类非组蛋白盒结构域蛋白,nanog属于同源盒结构域蛋白,sox2是通过保持oct4的适当表达水平稳定escs的多能性,nanog主要是通过阻断escs的分化维持多能性,nucleostemin(核干细胞因子)在维持细胞增殖、细胞周期调控、端粒的稳定性、基因组的完整性及干细胞和肿瘤细胞自我更新中发挥着极其重要的作用。通过qrt
‑
pcr比较两种培养条件下k7m2细胞的干性相关基因,包括sox2、nanog和nucleostemin。
[0102]
结果显示,基于蜂巢状gelma微球的三维培养促进了肿瘤干细胞相关基因的表达(如图6(b)所示)。
[0103]
3、比较两种培养条件下的细胞相应的细胞周期。
[0104]
细胞周期:收集两种培养条件下的k7m2细胞,利用细胞周期检测试剂盒(凯基生物,中国)进行检测,检测结果通过moditfit 5.0进行分析。
[0105]
流式细胞术:所有流式细胞术均在贝克曼流式仪器上进行,利用flowjo 10进行分析,下同。
[0106]
相较于细胞培养板培养,基于微球三维培养的k7m2细胞的g0/g1期细胞数目百分比减少,而s期和g2/m期细胞数目百分比增加,这表明基于微球的三维培养促进了k7m2细胞的dna合成并促使细胞周期从g1期向s期分化,从另一方面也揭示了细胞增殖能力的增强,与前面的结果相吻合(支持信息如图6(c)流式细胞术结果和图6(d)定量分析结果所示)。
[0107]
实施例5蜂巢状gelma微球的三维培养对骨肉瘤细胞迁移能力的影响
[0108]
1、骨肉瘤转移是骨肉瘤相关死亡的主要原因,研究表明,非转移性高级别骨肉瘤的患者中伴有继发性肺转移的五年生存率是23%,伴有继发性骨转移的4年生存率是0%,
为了探究基于蜂巢状gelma微球的三维培养对骨肉瘤细胞迁移能力的影响,利用transwell培养板来模拟肿瘤细胞的迁移,通过测定发生迁移的细胞数目来比较细胞的迁移能力,将两种培养条件下的k7m2细胞在transwell培养板培养24h,结晶紫染色后光学显微镜下观察小室下层细胞,并通过imagej计数来比较迁移细胞数目。结果显示基于蜂巢状gelma微球的三维培养促进了k7m2细胞的迁移能力(支持信息如图7(a)的光学显微镜图像和图7(b)的定量分析结果所示)。
[0109]
2、划痕实验通过模拟“伤口愈合”的速度反应细胞的迁移能力,经比较可见基于蜂巢状gelma微球三维培养的k7m2细胞“愈合”能力更强(支持信息如图7(c)的光学显微镜图像和图7(d)的定量分析结果所示)。
[0110]
3、为了从基因水平上进一步验证基于蜂巢状gelma微球的三维培养对骨肉瘤细胞迁移能力的增强,分别比较了两种培养条件下k7m2细胞迁移相关基因的表达,包括fapα、vegf、mmp
‑
2和cxcl3。在肿瘤微环境(tme)的形成及变化过程中,正常的成纤维细胞在诸多趋化因子的刺激作用下转变为基质成分的重要组成部分caf,caf表面特异性的成纤维细胞激活蛋白α(fapα)可以通过促进基质重建、参与血管内皮生长因子(vegf)等信号转导等途径增强肿瘤细胞沿纤维定向侵袭能力、参与肿瘤血管的生成等以形成肿瘤生物屏障并抑制效应t细胞的功能,进而促进肿瘤进展。血管内皮生长因子(vegf)是一种促进血管内皮细胞迁移和促进细胞外基质变性的特异性生长因子,其作用类似于基质金属蛋白酶
‑
2(mmp
‑
2)。而cxcl3是一种elr cxc趋化因子,通过对中性粒细胞的趋化作用,加速局部组织内部血管的形成速度,促进肿瘤的发生发展过程。结果表明蜂巢状gelma微球培养7天的k7m2细胞fapα、vegf、mmp
‑
2和cxcl3的基因表达水平均显著高于培养板生长的细胞(如图8所示)。
[0111]
4、cd24是在大多数b淋巴细胞和神经细胞表达的唾液糖蛋白,也表达于中性粒细胞和中性粒细胞前体,cd44是一种跨膜糖蛋白,多存在于细胞表面,主要作用是敢于肿瘤细胞的粘附,cd24和cd44均发现在部分肿瘤细胞上表达并且与肿瘤的侵袭和转移有关。我们通过流式分析两种培养条件下k7m2细胞的cd24和cd44的表达,发现基于微球三维培养的细胞cd24表达显著升高,cd44表达虽无显著性差异,但均有90%以上的表达(如图9(a)、图9(b)所示)。cd24和cd44均发现在部分肿瘤上表达且与肿瘤的侵袭和转移有关,其表达的升高可能是因为蜂巢状gelma微球的三维培养环境更有利于维持骨肉瘤细胞的恶性生物学行为。
[0112]
实施例6蜂巢状gelma微球的三维培养对骨肉瘤细胞emt表达和耐药性的影响
[0113]
1、上皮细胞间质转化(emt)是一个复杂的生物过程,通过此过程,上皮细胞失去极性和细胞黏附,获得间质细胞的运动性和侵袭性,与肿瘤的进展、侵袭及转移有关,n
‑
cadherin、snail、twist1表达的上调与emt息息相关,我们对两种培养条件下的k7m2细胞在基因和蛋白水平上进行探究,qrt
‑
pcr和wb结果均显示基于蜂巢状gelma微球三维培养的k7m2细胞上调了n
‑
cadherin、snail和twist的表达(如图10(a)、图10(b)、图10(c)所示)。这表明基于蜂巢状gelma微球的三维环境促进了骨肉瘤细胞k7m2的上皮
‑
间充质细胞转化过程,这可能与肿瘤的异形有关。通过emt,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型。
[0114]
2、为了进一步探究其抗凋亡能力的改变,我们选用了临床用于治疗骨肉瘤的一线化疗药物多柔比星(阿霉素,adriamycin,dox)作为干预手段,分别以高浓度(100nmol/ml)
和低浓度(50nmol/ml)处理两种培养条件下的k7m2细胞24h,再通过annexin
‑ⅴ
细胞凋亡试剂盒检测细胞凋亡情况,蜂巢状gelma微球培养的k7m2细胞在低浓度处理下早期凋亡仅有3.14%,相比于培养板培养情况下的21.6%,抗凋亡能力明显提高,在高浓度处理下,晚期凋亡细胞也远远低于培养板培养的k7m2细胞(支持信息如图10(d)的流式细胞术结果和图10(e)的定量结果所示)。由此可见,基于蜂巢状gelma微球的三维培养环境增强了骨肉瘤细胞k7m2抵抗药物介导的凋亡的能力,为化疗药物在体内的实际运用提供了更精准的使用剂量。
[0115]
3、为了进一步验证蜂巢状gelma微球在培养肿瘤细胞用于药物筛选方面的潜力,我们对蜂巢状gelma微球培养7天骨肉瘤细胞mg63进行了相同的探索,分别以50nmol/ml的dox处理两种培养条件下的mg63细胞24h,再通过annexin
‑ⅴ
细胞凋亡试剂盒检测细胞凋亡情况,蜂巢状gelma微球培养的mg63细胞在此浓度处理下早期凋亡仅有23.9%,相比于培养板培养情况下的43.1%,抗凋亡能力明显提高(如图11(a)、图11(b)所示)。细胞的凋亡与众多凋亡相关分子的调控有关,抗凋亡分子和促凋亡分子的平衡与失平衡决定了细胞最终的结局。b淋巴细胞瘤
‑
2(b
‑
cell lymphoma
‑
2,bcl2)和bcl2相关蛋白x(bcl2
‑
associated x protein,bax)是调控细胞凋亡的主要成员。bcl2会增强细胞对dna损伤因子的抵抗性以及化疗药物引起的细胞凋亡。当bax过表达时,会通过形成同源二聚体bax/bax而抑制bcl2抗凋亡的作用从而促进细胞凋亡。比较两种培养条件下的mg63细胞的基因表达情况,bcl2在3d蜂巢状gelma微球环境比细胞培养板环境下高3.22倍,而bax的表达则无明显统计学差异(如图11(c)所示)。进一步验证了基于蜂巢状gelma微球的三维培养环境对肿瘤细胞抗凋亡能力的增强。
[0116]
实施例7蜂巢状gelma微球的三维培养对骨肉瘤细胞促破骨能力的影响
[0117]
1、骨肉瘤的发生发展往往会引起骨侵蚀和骨转移,通过促进破骨细胞分化打破骨稳态导致骨量丢失。分别收集基于蜂巢状gelma微球三维培养和培养板二维培养k7m2细胞的培养上清液,联合巨噬细胞集落刺激因子(m
‑
csf)和核因子κb受体活化因子配体(rankl)与小鼠骨髓来源的单核
‑
巨噬细胞共培养,通过trap染色法来观察破骨细胞诱导分化的情况。在m
‑
csf和rankl的基础上添加两种培养上清的实验组相较于其他组有着更多的破骨细胞产生,而添加蜂巢状gelma微球培养上清组产生的破骨细胞更大(支持信息如图12(a)光学显微镜图像和图12(b)的定量分析结果所示)。因此,我们推测骨肉瘤细胞k7m2会分泌促进破骨分化的因子,而蜂巢状gelma微球的三维培养会使其分泌的因子更多。
[0118]
2、为了进一步验证这一说法,收集经两种上清处理的bmm细胞,检测破骨相关基因的表达,包括dc
‑
stamp、ctsk、trap等。结果显示基于蜂巢状gelma微球三维培养的k7m2细胞刺激的bmm细胞破骨相关基因均升高(如图12(c)所示)。
[0119]
3、rankl是破骨细胞分化过程中重要的生物分子,促进破骨相关基因的转录和表达,通过wb在蛋白水平上检测两种培养条件下k7m2细胞是否表达rankl,结果显示二者均表达rankl,且基于蜂巢状gelma微球三维培养的k7m2细胞表达的更为显著(如图12(d)、图12(e)所示)。我们进一步比较了两种培养条件下的k7m2细胞的rankl基因表达情况,发现蜂巢状gelma微球培养条件下的k7m2细胞相较于培养板培养的k7m2细胞有着更高的rankl基因表达(如图12(f)所示)。这说明蜂巢状gelma微球的三维培养环境促进了骨肉瘤细胞k7m2的rankl表达,从而激活破骨细胞参与骨肉瘤细胞的骨侵蚀。
[0120]
实施例8通过体内实验进一步验证蜂巢状gelma微球构建骨肉瘤模型的优势
[0121]
体内实验:动物实验遵循动物管理条例规定并得到苏州大学实验动物委员会的批准,从苏州大学实验动物中心购入5周龄的balb/c雌性小鼠。正常饲养动物一周,用75%酒精消毒液擦拭小鼠右侧腋下后,用1ml注射器分别在实验小鼠腋下皮下注射事先用无菌pbs溶液混匀的1
×
107cells/ml的两种培养条件下的k7m2细胞悬液100μl,每天观察小鼠肿瘤生长情况。在长出肿瘤后进行为期21天的观察,通过测量肿瘤的长度和宽度来评估肿瘤的大小;21天后,处死动物,收集组织进行组织病理学检查。动物实验经苏州大学实验动物委员会批准。
[0122]
组织病理学:收集肿瘤组织置于4wt%甲醛缓冲液中,然后脱水,石蜡包埋。通过切片仪获得厚度5μm的连续切片,预先准备好h&e、tunel、ki67和αsma进行染色。
[0123]
1、将两种培养条件下的k7m2细胞以1
×
106/只皮下注射6周龄的balb/c小鼠,注射基于蜂巢状gelma微球三维培养的k7m2细胞的小鼠(ms组)在第7天就形成肉眼可见的肿瘤凸起,而注射培养板培养的k7m2细胞的小鼠(tcp组)在第13天才形成肉眼可见的肿瘤凸起,此后每隔三天记录小鼠肿瘤体积变化,在第28天每组各取一半数量实验小鼠进行取材分析,取出的肿瘤组织大体观上有着明显的体积差异,ms组肿瘤大小明显高于tcp组,结合两组皮下荷瘤小鼠的肿瘤体积变化曲线,表明在造模时间相同的情况下,ms组小鼠肿瘤形成和生长速度要快与tcp组(如图13(a)、图13(b)、图13(c)所示)。各组剩余实验小鼠均正常饲养观察存活曲线,结果表明ms组小鼠的死亡率更高(如图13(d)所示)。从组织形态学进行分析,分别对两组小鼠肿瘤切片做h&e染色,可见ms组肿瘤组织更为紧密,而tcp组肿瘤组织的斑片状坏死区域更多(如图13(e)所示)。tunel染色和ki67染色结果表明ms组肿瘤组织相较于tcp组有着更少的细胞凋亡和更多的细胞增殖情况,αsma免疫荧光染色表明ms组肿瘤组织有更多的α
‑
平滑肌肌动蛋白(如图13(f)、图13(g)所示)。因此,基于蜂巢状gelma微球三维培养的k7m2细胞造模更具有原发肿瘤的特征。
[0124]
2、骨肉瘤的骨侵蚀性会导致骨肉瘤患者的骨量丢失,从而加剧骨转移的速度。为了探究两组实验小鼠的骨量丢失情况,通过micro
‑
ct扫描分析了实验小鼠的股骨远端骨量情况。
[0125]
micro
‑
ct:将小鼠右下肢从多聚甲醛中取出,吸干表面液体,放入micro
‑
ct成像仪(skyscan,阿尔特斯拉尔,比利时)中,观察检测位置是否放置妥当后,设置过滤片参数:al=0.5,调节分辨率为high,扫描角度设置为翻转1800
°
,设置像素大小为9μm,最后开始扫描。通过ct结果分析软件对股骨做相关参数的形态统计,包括bmd(mg/cm3)、bv/tv(%)、bs/bv(%)、tb.th(mm)等。
[0126]
首先比较两组实验小鼠micro
‑
ct扫描得到的二维和三维重建图像,ms组的骨量远低于tcp组(如图14(a)、图14(b)所示)。其次,在感兴趣部位定量分析相同体积股骨的骨密度,ms组同样低于tcp组。最后,在其他骨形态学相关指标方面,相较于tcp组,ms组在bv/tv和tb.th参数方面显著下降,bs/bv参数显著提高(如图14(c)所示),可见基于蜂巢状gelma微球三维培养的k7m2细胞造模小鼠骨侵蚀能力更强。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。