一种ii型草鱼呼肠孤病毒vp6重组乳酸菌的构建和应用
技术领域
1.本发明属于基因工程及分子免疫学技术领域,具体涉及一种ii型草鱼呼肠孤病毒vp6重组乳酸菌的构建和应用。
背景技术:
2.草鱼(ctenopharyngodon idella)是我国产量最高的淡水养殖鱼类,具有重要的经济地位。然而死亡率高达80%的草鱼出血病(grass carp hemorrhagic disease,gchd)频繁爆发,但目前尚无有效的治疗措施。gchd由草鱼呼肠孤病毒(grass carp reovirus,gcrv)感染草鱼引起,流行病学调查结果显示目前主要的流行毒株的基因型是gcrv-ii型。接种疫苗是保护草鱼抵御gcrv感染的最有效方法。
3.gcrv病毒基因组由11条大小不同且不连续的双链rna节段组成,可编码12种蛋白,包括7种为结构蛋白和5种为非结构蛋白。其中,结构蛋白vp1由gcrv s1节段编码,推测具有病毒rna转录时的甲基转移酶活性(methylase),参与病毒mrna复制过程中的加帽,但免疫家兔后产生的抗体中和活性不高。vp2蛋白由gcrv s2节段编码,推测具有rna聚合酶活性。vp3蛋白由gcrv s3节段编码,推测具有核苷水解酶活性和rna解旋酶活性,主要参与病毒转录过程中的能量供应。通过重组杆状病毒组装的ii型gcrv vp3、vp4和ns38 颗粒样病毒免疫草鱼后可产生免疫保护。但是同vp2类似,vp3免疫家兔后不产生中和抗体。ⅱ型的gcrv vp4蛋白均由s6节段编码,是主要的外衣壳蛋白,参与病毒基因组转录过程,并与病毒包涵体的形成有关。有研究表明,将可以表达gcrv vp4蛋白的枯草杆菌芽孢口服疫苗和dna疫苗免疫草鱼可产生特异性抗体并具有一定的免疫保护作用。ⅱ型的gcrv vp5 蛋白由s5节段编码,结构中具有一个呼肠孤病毒m2保守结构域,与病毒粒子进入宿主细胞过程有关,具有核苷水解酶活性但抗体无中和活性。vp6蛋白作为gcrv的核心蛋白,能连接内衣壳和外衣壳,具有较好中和活性,口服或注射疫苗均可使鱼体产生特异性抗体,可有效抑制gcrv感染,有研究表明该蛋白与哺乳动物正呼肠孤病毒的δ2蛋白具有较高的相似性。vp7蛋白与不完整的vp5蛋白可以形成异源二聚体,构成gcrv的外衣壳,具有蛋白裂解作用,使用重组vp7蛋白或者dna疫苗免疫草鱼可以有效抵抗gcrv的感染。
4.疫苗接种是防治gcrv感染的最有效途径,“草鱼出血病组织匀浆灭活疫苗”虽然有效,但存在灭活不完全导致散毒的风险,并且保护率较低需要反复接种才能获得理想的保护效果。草鱼出血病减毒活疫苗只需要进行一次免疫就能够获得很好的保护效果,但是弱毒疫苗存在毒力返强的风险。此外无论是灭活疫苗还是弱毒疫苗都需要通过注射免疫使草鱼获得保护,操作繁琐,不利于渔业生产中推广使用。
5.口服疫苗是将抗原等包封或生物载体等技术处理之后,通过投喂含有免疫制剂的饵料,使疫苗进入鱼体的消化道黏膜,通过刺激鱼体肠道黏膜免疫系统来产生免疫应答。鱼类口服接种疫苗不受时间、地点和鱼体大小的限制,适用于大群体接种,操作方便、省时、省力,便于大规模推广应用。但蛋白抗原在水体环境中稳定性差、利用率低,易被消化道内的蛋白酶降解,影响免疫保护效果。因此亟需一种可以有效免疫的口服制剂。
技术实现要素:
6.本发明的目的在于以乳酸菌模式菌株作为载体,构建可以表达gcrv vp6蛋白的重组乳酸菌。而后经口服灌胃免疫稀有鮈鲫,通过活菌计数确定后肠组织中的重组乳酸菌的驻留情况,通过检测免疫反应相关基因的表达水平、血清特异性抗体水平以及攻毒后对稀有鮈鲫的免疫保护率来评价疫苗的保护效果,以期开发一种安全有效的ii型gcrv益生菌口服疫苗,为草鱼的健康养殖提供保障。
7.本发明所采取的技术方案是:
8.本发明的第一方面,提供一种重组乳酸菌,所述重组乳酸菌包含编码草鱼呼肠孤病毒vp6 的基因序列,所述草鱼呼肠孤病毒vp6的氨基酸序列如seq id no.1所示。
9.在本发明的一些实施方式中,所述编码草鱼呼肠孤病毒vp6的基因序列如seq id no.2 所示。
10.在本发明的一些实施方式中,所述重组乳酸菌是通过将携带编码草鱼呼肠孤病毒vp6的基因序列的重组质粒导入乳酸菌中构建得到。
11.在本发明的一些实施方式中,所述重组乳酸菌保藏在中国典型培养物保藏中心,保藏地址:中国武汉,保藏编号是cctcc no:m 2022323,分类命名为:lactococcus lactis pnz8148-vp6,保藏时间为 2022年03月28日。
12.以乳酸菌作为载体制备草鱼出血病生态防控的产品,通过口服免疫,操作简便安全不易引起鱼体应激,适合大水面和小规格鱼类免疫。此外,乳酸菌还具有很好的生物安全性,乳酸菌是公认的食品安全级微生物,不需进行蛋白表达后处理,简化了生物工程生产的下游环节,大幅降低生产成本。乳酸菌是一类存在于动物黏膜系统中的共生细菌,对酸碱胆盐具有一定耐受性,能够很好的保护所携带抗原,可持续刺激鱼类黏膜免疫系统分泌黏膜抗体。同时,乳酸菌代谢产生的乳酸、细菌素等物质对水产养殖常见致病菌的具有明显抑制作用,通过占位等方式调节胃肠道菌群来维持胃肠道微生态平衡,并可以促进鱼体生长,提高鱼体免疫力。同时乳酸菌还具有多种益生功能:可以通过分泌产生的乳酸等有机酸和细菌肽等细菌素抑制致病菌生长;通过激活t、b淋巴细胞,提高免疫球蛋白和抗体水平增强免疫功能,提高鱼群的群体免疫力;合成蛋白酶、脂肪酶、纤维素酶等酶类,提高饲料利用率,并合成维生素b1、b2、b6、烟酸等多种b族维生素;乳酸菌的稳定性好,耐受消化道的酸性环境,可以携带抗原蛋白到肠道黏膜免疫组织,使鱼体获得特异性免疫保护。
13.本发明的第二方面,提供本发明第一方面所述重组菌在预防和或治疗草鱼呼肠股病毒引起的疾病中的应用。
14.在本发明的一些实施方式中,所述疾病为出血病。
15.在本发明的一些实施方式中,所述产品为制剂。
16.在本发明的一些实施方式中,所述制剂为口服制剂。
17.在本发明的一些实施方式中,所述产品中包含佐剂。
18.在本发明的一些实施方式中,所述产品可以作为微生物制剂进行生态防控,可以单独使用也可以添加到饲料里或者与其他成分复配,泼洒到环境中,对疾病起到一定的预防和/或治疗作用;也可以作为疫苗使用,而且对于鱼类,口服即可提高存活率,简单、有效、便捷。
19.在本发明的一些实施方式中,所述制剂的剂型为片剂、粉剂、颗粒剂、胶囊或缓释
剂等常见剂型。
20.本发明的第三方面,提供一种产品,包含本发明第一方面所述的重组乳酸菌。
21.在本发明的一些实施方式中,所述产品为制剂。
22.在本发明的一些实施方式中,所述制剂为口服制剂。
23.在本发明的一些实施方式中,所述产品中包含佐剂。
24.本发明的有益效果是:
25.本发明首先分析了gcrv vp6的功能域和结构进行分析,选取vp6的n端编码基因,并进行密码子优化,构建重组质粒pnz8148-vp6,通过电转化方式,转入乳酸菌l.lactisnz9000,获得重组乳酸菌,命名为l.lactis pnz8148-vp6。利用western blot和间接elisa 技术来确定重组菌中目的蛋白成功展示表达。对实验动物进行口服免疫,采集脾脏、肾和后肠组织,通过qpcr测定各组织中免疫相关基因的表达量水平,结果表明重组乳酸菌通过口服免疫能够刺激鱼体不同免疫组织产生免疫应答反应;通过elisa测定血清中特异性抗体 igm水平,结果表明重组乳酸能够刺激鱼体产生特异性免疫应答反应。在免疫后第42d,腹腔注射gcrv强毒,相对存活率(rps)为42.9%,口服l.lactis pnz8148-vp6具有较好的保护效果。
附图说明
26.图1为gcrv vp6功能域和结构分析。图1a为gcrv vp6功能域分析;图1b为gcrvvp6的n端的各级结构进行预测。
27.图2为重组质粒pnz8148-vp6的pcr和酶切鉴定。重组质粒pnz8148-vp6的鉴定结果。 (a)pcr鉴定。m:dna marker(dl5000);泳道1-3:vp6基因;(b)酶切鉴定。m: dna标准(dl5000);泳道1:nco i;泳道2:xba i;泳道3:双酶切;泳道4:pnz8148-vp6 质粒。
28.图3为重组乳酸菌gcrv vp6蛋白融合表达western-blot和分析图;m:蛋白marker;泳道1:l.lactis nz9000;泳道2:l.lactis pnz8148-vp6。
29.图4为重组乳酸菌gcrv vp6蛋白融合表达间接elisa分析图。
30.图5为间接elisa法对血清特异性抗体水平检测;该水平用450nm处吸光值表示。数据以平均
±
标准差表示。将l.lactis pnz8148-vp6组与pbs组进行比较。与对照组有显著差异的值用星号表示(单因素方差分析,*p《0.05,**p《0.01,***p《0.001)。
31.图6为口服免疫重组乳酸菌后gcrv攻毒保护检测;图6a为pcr特异性扩增感染gcrv 片段。泳道1:阴性对照;泳道2-7:pbs组;泳道8-13:l.lactis nz9000组;泳道14-19: l.lactis pnz8148-vp6组;m:dna marker(dl5000);泳道20:gcrv阳性对照。图6b为免疫后的稀有鮈鲫经gcrv-hunan1307攻毒后累积死亡率曲线。攻毒后14天,每天监测死亡率。*表示与pbs组相比,免疫组第14d的累计死亡率具有显著性差异(p《0.05)。
32.图7为重组乳酸菌在稀有鮈鲫肠道中的抗原驻留能力分析。菌落计数及pcr检测重组乳酸菌在与肠道内的驻留情况。图7a为实验鱼肠道内l.lactis pnz8148-vp6在耐氯霉素的m17 琼脂平板上生长。图7b为免疫后指定时间稀有鮈鲫肠道内的重组菌活菌计数。数据代表三尾鱼的means
±
sem。图7c为随机挑取平板上重组菌进行pcr特异性扩增vp6片段。m: dna marker(dl5000),泳道1-10:vp6基因。
33.图8为重组乳酸菌l.lactis pnz8148-vp6口服免疫后肠中的免疫分析图。图8a:
ifn2、图8b:il-1β、图8c:irf7、图8d:mhcii、图8e:mx、图8f:myd88、图8g:nf-κb、图8h:tlr3、图8i:tlr5。采用2-δδct法计算免疫相关基因的相对mrna表达水平。根据β-actin基因的表达情况,对各基因的mrna水平进行归一化处理。与pbs组进行比较, *表示具有显著性差异(p《0.05),**表示具有极显著性差异(p《0.01)。
34.图9为重组乳酸菌l.lactis pnz8148-vp6口服免疫后肾中的免疫分析图。图9a:ifn2、图9b:il-1β、图9c:irf7、图9d:mhcii、图9e:mx、图9f:myd88、图9g:nf-κb、图9h:tlr3、图9i:tlr5。采用2-δδct法计算免疫相关基因的相对mrna表达水平。根据β-actin基因的表达情况,对各基因的mrna水平进行归一化处理。与pbs组进行比较, *表示具有显著性差异(p《0.05),**表示具有极显著性差异(p《0.01)。
35.图10为重组乳酸菌l.lactis pnz8148-vp6口服免疫后脾中的免疫分析图。图10a:ifn2、图10b:il-1β、图10c:irf7、图10d:mhcii、图10e:mx、图10f:myd88、图10g: nf-κb、图10h:tlr3、图10i:tlr5。采用2-δδct法计算免疫相关基因的相对mrna表达水平。根据β-actin基因的表达情况,对各基因的mrna水平进行归一化处理。与pbs组进行比较,*表示具有显著性差异(p《0.05),**表示具有极显著性差异(p《0.01)。
具体实施方式
36.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
37.实验动物:稀有鮈鲫是由中国科学院水生生物所赠送,体长4
±
0.5cm。
38.菌、毒株:基因ii型草鱼呼肠孤病毒由珠江水产研究所水产病害与免疫研究室分离保存,其分离方法为:实验室采用psf细胞进行分离培养,具体方法:将病毒接种在致密单层psf 细胞上,28℃吸附2小时,弃掉吸附液后补加含有5%胎牛血清的m199培养基培养,28℃条件下继续培养5~7天通过反复冻融收获病毒,具体方法可见《草鱼呼肠孤病毒分子流行病学、全基因组序列及流行株灭活疫苗研究》【d】曾伟伟,华南农业大学。
39.主要试剂:pnz1848表达载体、大肠杆菌mc1061、乳酸乳球菌nz9000、稀有鮈鲫igm 单克隆抗体由本实验室制备,具体方法参见weiwei zeng,et al.development of a vp38recombinant protein-based indirect elisa for detection of antibodies against grass carp reovirusgenotype ii(ielisa for detection of antibodies against gcrv ii).jfd(2018)41:1811-1819.chenjm,et al.establishment of a rare minnow(gobiocypris rarus)model for evaluation of experimentalvaccines against a disease induced by grass carp reovirus genotype ii.fish shellfish immunol (2021)117:53-61.doi:10.1016/j.fsi.2021.07.014;其中第一篇文章是抗体制备的实验,制备的是草鱼抗体,第二篇文章公开了该草鱼抗体可以在稀有鮈鲫中使用,因此本专利中也是用该抗体进行相关检测。trizol reagent、primescript
tm
rt reagent kit、takara nco i、xba i限制性内切酶、takara ex基因组dna提取试剂盒、premix ex taqtm(probe qpcr)、competentcell preparation kit均购买于宝日医生物技术有限公司,sybr green pro taq hs预混型qpcr 购买于艾科瑞生物科技有限公司,lb肉汤和m17肉汤培养基购买于
北京陆桥技术有限责任公司,氯霉素购买于北京索莱宝科技有限公司,乳酸链球菌素nisin购买于上海麦克林生化科技有限公司,sds-page和western blot相关试剂均购买于苏州新赛美生物科技有限公司。
40.实施例1 gcrv vp6的生物信息学分析
41.根据ncbi中提交的基因ii型gcrv hunan 1307株病毒vp6基因(genbank登录号为 ku254575)的核酸序列,通过expasy在线氨基酸翻译网站获得该核酸序列的氨基酸序列 (https://web.expasy.org/translate/)。
42.利用smart工具网站来预测gcrvvp6蛋白的特定功能结构域。
43.通过psipred-memsat3在线分析服务器对蛋白质二级结构进行分析。
44.通过expasy网站上的swiss-model软件对gcrv vp6蛋白的三级结构进行比对折叠,模拟或构建蛋白质的空间构建图。
45.使用tmhmm2.0在线服务器(https://www.cbs.dtu.dk/services/tmhmm)分析vp6的跨膜区。
46.图1a为gcrv vp6功能域分析,vp6蛋白包含两个功能结构域,分别位于蛋白的n端和c端,均由单独的三聚体形成。n端纤维尾巴的三聚体形成不需要atp或伴侣蛋白的参与,直接排列成三卷螺旋状固定于病毒粒子上;c端的球状头部与蛋白受体相互作用,其翻译后的组装与hsp90的磷酸化有关。此外,在n端尾部发现了一个小区域与靶细胞表面的唾液酸结合,推测可能与促进细胞凋亡相关。因此vp6的n端在病毒感染过程中的重要作用,可能是潜在的具有良好免疫原性的抗原蛋白。
47.图1b为gcrv vp6的n端的各级结构进行预测。vp6的n端包含两种二级结构,分别是α-螺旋和无规卷曲;vp6的n端是通过几个长短不一的无规卷曲将5个α-螺旋连接在一起,形成一个简单的三级结构,vp6的n端没有跨膜区,也没有更高级结构或复杂的修饰加工,比较适合在原核表达系统中进行表达。
48.实施例2表达gcrv vp6的重组质粒的制备
49.重组表达载体pnz8148-vp6的合成与鉴定。
50.根据试剂盒说明书制备e.coli mc1061感受态细胞:
51.(1)试验前4℃预冷低温离心机,整个试验注意保持低温。
52.(2)将保存于-80℃的mc1061甘油菌株取出进行划线于lb固体平板,于37℃静置培养过夜。
53.(3)挑取单菌落于lb培养基,37℃,振荡培养过夜。
54.(4)将菌液以1:20接种于lb培养基中,37℃,振荡培养3~5h,od600nm约为0.35~0.5。
55.(5)将菌液分装,每管1ml菌液,4℃,4000r/min离心5min,弃上清。
56.(6)加入solution a(冰上预冷),每管100μl,轻柔混合均匀。
57.(7)4℃,4000r/min离心5min,弃上清。
58.(8)加入solution b(冰上预冷),每管100μl,轻柔混合均匀。
59.(9)-80℃保存。
60.根据表达载体pnz8148的基因序列,选择nco i和xba i两个酶切位点将gcrv vp6 n 端基因插入其中,在xba i前加入一段his标签(由6至10个组氨酸残基组成)同时根据乳
酸菌表达的偏好性对插入序列进展密码子优化,优化是根据乳酸乳球菌在蛋白表达过程中对编码氨基酸密码子的偏好性,以及插入片段中整体gc含量,对部分碱基进行调整,密码子优化依据密码子的简并性原则,更利于插入片段在乳酸乳球菌中表达,密码子优化采用人工合成的方式实现的。
61.所述his标签的序列为:catcatcatcatcaccac(seq id no.3)。
62.所述gcrv vp6的核苷酸序列为:atagtatctgaagcatatcaatccatcgcaatggg accgctcacct tgcaagatggttactatcgagcacttagcgtgattaccttaatttacct tgcgtcgctgacaggccgccttggtcctgacagaacttattacgggttttatgttcaatt cccaaaaaagcgtaaatttgaagatttagggtattttgcttataatgctgatggaagaaa tgttgctgttttacaatcaatcaatgcctatatttattgtgcaagtcctgattggcaatatt cttgtgctctttattatctccatgtcttgtcagctttgagtctttcttggactgacccagt tggaatgattgacggttttagttgcgtaaatcaatttacagatgttccaggttggtcagc gacaaatcgagccttacatacacattcattcaactggtttaatttacttgaggatgctatt gatactttggtcgcccgccgttattggactaacgcagaaggacaggcaattcgtcaaga atggacagcagctagagatcgttggcgtgttattatggatgcaactcgtgatgaagatga cttagtggtttttaggacaccagatgattgtcgtcgtcggctaaaaccttatggtgacaa taattggacgagagct(seq id no.2);
63.所述gcrv vp6的氨基酸序列为:mgpltlqdgyyralsvitliylasltgrlgpdrty ygfyvqfpkkrkf edlgyfaynadgrnvavlqsinayiycaspdwqyscalyylhvlsal slswtdpvgmidgfscvnqftdvpgwsatnralhthsfnwfnlledaidtlvarrywtna egqairqewtaardrwrvimdatrdeddlvvfrtpddcrrrlkpygdnnwtr(seq idno.1)。
64.重组表达载体pnz8148-vp6由金斯瑞生物科技股份有限公司合成。根据说明书对收到的质粒冻干粉末进行稀释用于后续操作。
65.将合成的重组表达载体pnz8148-vp6转化至e.coli mc1061感受态细胞中,转化步骤如下:
66.(1)试验前将水浴锅预热至42℃。
67.(2)取出保存于-80℃冰箱的感受态细胞,在冰上融化30min,超净工作台中加入1ng 的pnz8148-vp6质粒,轻柔混合,冰中静置25min。
68.(3)42℃水浴锅中热激45s,迅速放入冰中静置5min。
69.(4)试管中加入m17培养基,37℃振荡复苏1h。
70.(5)1000r/min离心1min,弃掉部分上清。
71.(6)将剩余菌液混合并均匀涂布至lb固体平板(含5μg/ml氯霉素)。
72.(7)37℃过夜培养。
73.挑取单克隆,接种到含有氯霉素抗性lb培养基中,37℃、200r/min震荡培养12h,提取质粒后进行酶切验证和pcr鉴定,并送至测序公司进行测序。pcr和酶切鉴定结果表明成功构建重组质粒pnz8148-vp6(图2)。
74.实施例3表达gcrv vp6的重组乳酸菌的制备
75.制备l.lactis nz9000感受态细胞,将制备好的感受态细胞保存至-80℃。提取pnz8148
ꢀ‑
vp6质粒后将其电转化至上述感受态细胞中,转化步骤如下:
76.(1)试验前将电转杯、恢复培养基(含有0.5m蔗糖,0.02m的mgcl2,0.002m的cacl2的m17液体培养基)预冷。
77.(2)将l.lactis nz9000感受态细胞在冰中融化10min,超净工作台中加入1μg质粒,轻柔混合,冰中静置10min。
78.(3)将混合物转入2mm预冷电转杯中,擦干电转杯外水珠,避免爆杯。
79.(4)迅速点击,电击条件为:25000v,5ms。
80.(5)迅速加入900μl预冷恢复培养基,均匀混合后置于冰上10min,30℃厌氧培养4h, 3500r/min离心1min,弃掉800μl上清。
81.(6)将剩余菌液吹悬后均匀涂布至含有5μg/ml氯霉素的m17固体平板,30℃厌氧静置过夜培养。提取单菌落于含有10μg/ml氯霉素的m17液体培养基中,30℃静置培养。将鉴定正确的重组乳酸菌命名为l.lactis pnz8148-vp6。所述重组菌株保藏在中国典型培养物保藏中心,保藏时间为2022年3月28日;保藏编号是cctcc no:m2022323,分类命名为: lactococcus lactis pnz8148-vp6。
82.重组乳酸菌的表达。挑取含有阳性重组质粒pnz8148-vp6的转化菌,接种于10ml m17 液体培养基(含10μg/mlcm),30℃厌氧静置培养过夜。取培养菌液按1:50比例接种于 300ml含有10μg/ml氯霉素的m17液体培养基中,30℃厌氧静置培养4h使其处于对数生长期,分别加入1ng/ml、10ng/ml、20ng/ml、40ng/ml、80ng/ml和100ng/ml诱导剂乳链球菌肽nisin,30℃诱导4h,以未经诱导的重组乳酸乳球菌作为对照。
83.表达产物的免疫印记(western-blot)分析。将诱导前和诱导后样品以4℃,12000r/min 离心15min,弃上清,用6ml1
×
pbs溶液悬浮,进行超声破碎,破碎功率为200w,工作2s,休息5s,共30min。按比例加入sds凝胶上样缓冲液,混匀后煮沸10min,在12%sds-page 上进行蛋白电泳分析。经sds-page电泳后将凝胶上的蛋白转移至nc膜,于5%脱脂奶粉中封闭,4℃过夜或37℃2h。加入pbst(pbs 0.05%tween-20)清洗3次,每次5min。以 vp6蛋白的单克隆抗体作为一抗,4℃孵育过夜(≥15h)。加入pbst清洗3次,每次5min。加入hrp标记的羊抗鼠igg作为二抗,室温孵育1h。加入pbst清洗3次,每次5min。按照dab显色试剂盒说明书进行显色并观察结果。重组乳酸菌经诱导后,在表达蛋白带的预期位置出现明显的反应,对照组没有(图3)。
84.表达产物的间接elisa分析。将诱导后超声破壁的l.lactis pnz8148-vp6以及完整菌体分别作为抗原包被96孔elisa反应板(酶标板),以l.lactis nz9000为阴性对照,每孔 100μl,4℃包被过夜。pbst清洗3次,每次5min。每孔加入300μl含有5%脱脂奶粉封闭。清洗,同步骤2。每孔100μl加入稀释的vp6蛋白的单克隆抗体,4℃孵育过夜。清洗,同步骤2。每孔100μl加入稀释的hrp标记羊抗鼠igg,室温孵育1h。清洗,同步骤2。按照说明书加入染液,37℃避光显色5-10min,加50μl终止液后,酶标测定仪测定od450nm值。所有数据表示为平均值
±
标准误差。数据经过student's t检验分析,p《0.05被认为具有统计学意义。l.lactis pnz8148-vp6组的od450nm值与对照组相比均具有显著性差异(p<0.05)。同时,经破碎的菌体包被与菌体直接包被结果没有显著性差异(p≥0.05)。表明菌体表面携带 vp6蛋白(图4)。
85.实施例4融合表达gcrv vp6蛋白口服免疫保护评价
86.将健康稀有鮈鲫随机分为3组,每组100尾,分别为pbs空白对照组,l.lactis nz9000 空菌对照组,l.lactis pnz8148-vp6免疫组。免疫方式为灌胃口服免疫,隔2周免疫一次,共免疫2次,每次连续灌胃3d,免疫剂量为10μl 2
×
109cfu/ml/鱼/d。
87.免疫后的第7d、14d、21d和28d从各组中随机取5尾稀有鮈鲫收集脾脏、肾脏及后肠组织进行细胞内免疫相关细胞因子表达量的检测,血清样品在免疫后的第3w和6w收集,每组每次分别采集10条鱼,用于血清igm特异性抗体水平检测。样品收集后放于-80℃保存。
88.分别于免疫后第3w和6w采集免疫鱼和对照鱼(每组10尾)的血清进行抗体效价检测。稀有鮈鲫采用断尾取血法,具体操作为:将稀有鮈鲫断尾后使用肝素化微毛细血管采集其血液。将收集到的血液于4℃静置保存过夜,5000r/min离心5min,收集上层血清,保存于-20℃备用。
89.将纯化的gcrv病毒用elisa包被缓冲液稀释至蛋白终浓度为100ng/ml,向酶标板每个孔中加入50μl稀释后的病毒,每个样品设置3个平行,4℃包被过夜。pbst清洗3次,每次清洗5min。每孔加入250μl 5%脱脂奶粉,37℃封闭2h。清洗,同步骤2。使用pbs溶液将血清样品进行200倍稀释,每孔加入50μl,37℃孵育1h。清洗,同步骤2。每孔加入 100μl igm单克隆抗体(1:10000稀释),37℃孵育1h。清洗,同步骤2。每孔加入100μl hrp标记的羊抗鼠igg抗体,室温孵育45min。清洗,同步骤2。按照说明书加入染液,37℃避光显色5-10min,加终止液后,酶标测定仪测定od450nm值。所有数据表示为平均值
±
标准误差。数据经过student's t检验分析,p《0.05被认为具有统计学意义。结果表明,口服表达vp6的乳酸菌可诱导鱼类产生特异性抗体(图5)。
90.攻毒实验评价。在免疫后第42d,每尾鱼腹腔注射20μl 10ld50浓度的gcrv hunan1307 强毒株(ld50为10-5.25ld50/20μl),保持攻毒鱼在28℃~30℃水温环境中饲养。攻毒后连续14d内对所有实验鱼进行监测,记录发病率与死亡率,计算相对保护率。结果表明,口服免疫重组乳酸菌可提高实验鱼在gcrv感染中的存活率,l.lactis pnz8148-vp6的相对保护率为42.9%(图6)。
91.实施例5重组乳酸菌口服草鱼后免疫调节作用评价
92.重组乳酸菌鱼类肠道驻留能力评价。在第一次免疫后的第3h、6h、12h、24h、48h和72h 收集后肠组织进行活菌计数以确定重组乳酸菌是否可以长时间驻留在后肠部位进行抗原呈递。每个样品中加入500μl 1
×
pbs溶液,组织匀浆后进行1、101、102、103、104、105倍比稀释,每个样品吸取200μl涂布至含有5μg/ml氯霉素的m17固体平板,28℃静置厌氧过夜培养,进行菌落计数。结果表明重组乳酸菌口服面以后在鱼肠道内可以驻留72小时以上(图7)。
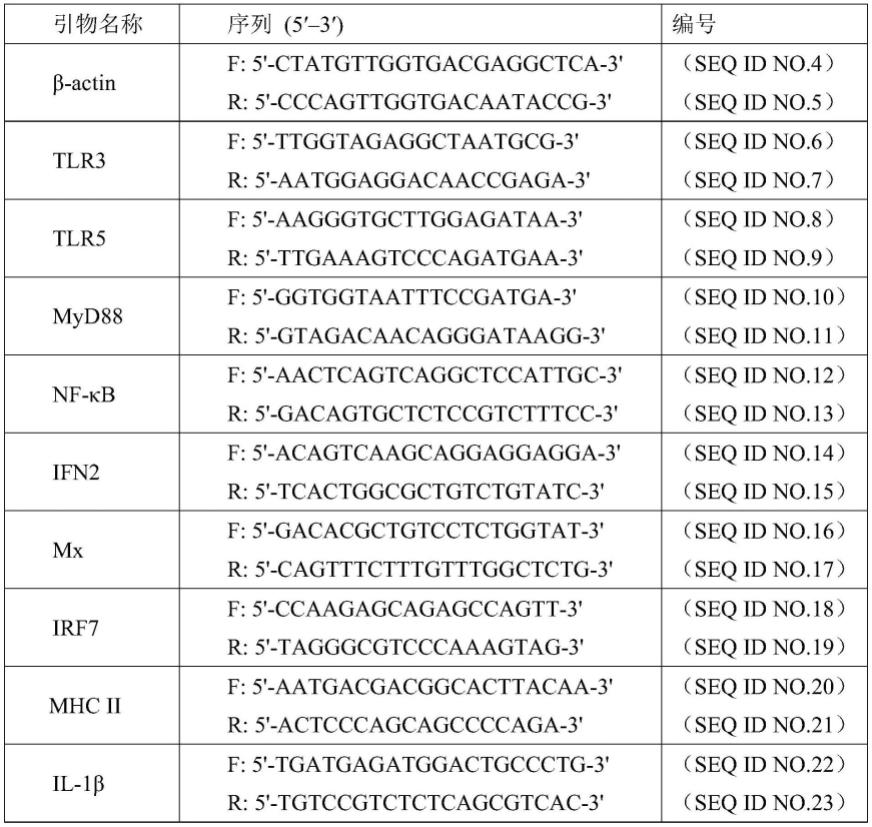
93.重组乳酸菌口服免疫后对鱼类免疫增强作用检测。分别在免疫后第7d、14d、21d和28d 从各组中随机取5尾稀有鮈鲫收集脾脏、肾脏及后肠组织,提取各组织的总rna后进行反转录,以β-actin作为内参基因,以获得的cdna作为模板通过qrt-pcr测定各组织中tlr3、tlr5、myd88、nf-κb、ifn2、mx、irf7、mhcii和il-1β的相对表达量。各基因引物序列信息如表1所示,引物序列由上述测序公司合成。实验进行三次生物学重复。qrt-pcr反应体系如下:10μl 2
×
sybr green taq hs premix,引物各0.4μl,0.4μl rox,2μl cdna模板以及加ddh2o补齐至20μl,95℃预变性5min后进入循环:95℃,15s变性;60℃,45 s退火;共循环35次。测定结果使用2-δδct算法进行分析。所有数据为平均值
±
标准误差。数据经过student's t检验分析,p《0.05被认为具有统计学意义。结果表明重组乳酸菌口服免疫后可以在鱼类肠黏膜免疫组织中被抗原呈递细胞直接识别呈递抗原;在脾肾等免疫器官中被淋巴细胞加工,并引起免疫应答反应(图8-图10)。
94.表1荧光定量pcr中的引物序列
[0095][0096]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。