1.本发明属于生物医药技术领域,具体涉及一种强效抗新冠突变株包括奥密克戎四种亚型的双特异人源抗体。
背景技术:
2.随着新冠病毒在人群中持续传播,多种变异株给全球构筑的疫苗免疫防线带来极大威胁。omicron变异株的出现,以其强大的免疫逃逸能力引发了人们对抗体疗法和疫苗有效性的前所未有的担忧。因此,抗omicron变异株的广谱抗体研发至关重要。然而广谱抗体筛选的限速步骤是需要解决保守抗原表位免疫原性差导致候选抗体少的问题。主流人源广谱抗体研究思路是通过免疫原改造、序贯免疫等方式提高受试者广谱抗体产生概率,同时利用单细胞与高通量测序提升痕量广谱抗体的挖掘能力的“先产生后挖掘”模式,例如s309抗体就是这一思路的优秀案例
1.,此外s309所结合的刺突蛋白受体结合域(rbd)背侧面表位,近期被证明是受omicron变异株影响最小的保守表位
2.。
3.除了单抗,对于covid-19高危患者的中轻型症状会通过两种mab抗体联合用药来治疗,然而类似于这种mab组合的效果可以通过单个双特异性抗体(bsab)来实现。它是根据抗体的独特结构而设计出同时结合两种不同抗原的特殊抗体,而bsab抗体的理论最早由nisonoff和他的合作者在1960年首次提出
6.,之后在1964年有学者提出了bsab这一技术,在八九十年代随着抗体生物学与抗体工程的不断发展,不断解决了bsab分子在粘合、交联、装配等方面的问题
7.,直至2009年才获批得到世界上第一个用于治疗恶性腹水疾病的双特异性抗体药物
8.,对于双特异性抗体药物的应用中有90%用于癌症的治疗,近年来双特异性抗体药物在感染、炎症、神经退行性疾病、眼科、代谢性疾病等中的研究也不断增加,这些研究为我们在开发用于治疗covid-19的bsab的抗体药物提供一定的依据。
4.bsab按结构区分主要有两大类:含fc区的双特异性抗体(igg-like双特异性抗体)与不含fc区的双特异性抗体(non-igg-like双特异性抗体)。含fc区双特异性抗体保持了传统的单克隆抗体的结构,具有两个fab区和一个fc区。但与传统单克隆抗体不同,这两个fab是可以结合不同抗原。此类抗体主要有triomabs、dvd-ig、2in 1-igg、kih igg、crossmab等;不含fc区双特异性抗体缺失了fc区,由两个抗体的vh区及vl区组成或者由fab片段组成。此类双特异性抗体主要有bite,dart,tandabs,bi-nanobody等。
5.以此为基础,相关研究也报道了一些用于治疗covid-19的bsab。第一个针对sars-cov-2的bsab是通过将非中和性结合剂与双特异性支架中的中和性结合剂连接而构建的。具体而言
9.,作者首先通过噬菌体展示鉴定了与rbd结合但不阻断ace2结合的fab,然后将它们组装成具有阻断ace2的人源可变重链(vh)结合剂的特异性igg支架,产生vh/fab bsab-bis-4(vh b01、fab d 01),其中mabfab d 01单独使用对sars-cov-2没有中和作用,但设计构建的bis-4在中和病毒的效价上高出了20~25倍,且中和sars-cov-2可达到0.107nm。第二个是采用knob-into-hole技术设计的igg-like的bsab-cov-x2,它是由
component of a peptic digest of rabbit antibody.science,1960.132(3441):p.1770-1.
15.7.labrijn,a.f.,et al.,bispecific antibodies:a mechanistic review of the pipeline.nat rev drug discov,2019.18(8):p.585-608.
16.8.heiss,m.m.,et al.,the trifunctional antibody catumaxomab for the treatment of malignant ascites due to epithelial cancer:results of a prospective randomized phase ii/iii trial.int j cancer,2010.127(9):p.2209-21.
17.9.lim,s.a.,et al.,bispecific vh/fab antibodies targeting neutralizing and non-neutralizing spike epitopes demonstrate enhanced potency against sars-cov-2.mabs,2021.13(1):p.1893426.
18.10.de gasparo,r.,et al.,bispecific igg neutralizes sars-cov-2variants and prevents escape in mice.nature,2021.593(7859):p.424-428.
19.11.cho et al.,eabj5413(2021)bispecific antibodies targeting distinct regions of the spike protein potently neutralize sars-cov-2variants of concern.sci.transl.med.,2021.10.5413.
20.12.wu,x.,et al.,a potent bispecific nanobody protects hace2 mice against sars-cov-2infection via intranasal administration.cell rep,2021.37(3):p.109869.
21.13.peng,l.,et al.,monospecific and bispecific monoclonal sars-cov-2 neutralizing antibodies that maintain potency against b.1.617.biorxiv,2021.
22.14.ojha,r.,et al.,designing of a bispecific antibody against sars-cov-2spike glycoprotein targeting human entry receptors dpp4 and ace2.hum immunol,2022.
23.15.hanke,l.,et al.,a bispecific monomeric nanobody induces spike trimer dimers and neutralizes sars-cov-2in vivo.nat commun,2022.13(1):p.155.
24.16.li,z.,et al.,an engineered bispecific human monoclonal antibody against sars-cov-2.nat immunol,2022.23(3):p.423-430。
技术实现要素:
25.利用imcas-123与imcas-364抗体不同表位的特性,基于参考文献中长linker高效产monomer形式的特点,构建成功了双特异性抗体。其亲和力比原有imcas-123与imcas-364对不同变异株受体结合域亲和力均产生5-10倍提升。由此完成了本发明。
26.本发明提供一种强效抗新冠突变株的双特异人源抗体,其是由第一抗体重链、第二抗体重链、第二抗体轻链和第一抗体重链由连接肽linker连接而成。其中,
27.所述第一种抗体(imcas-364)的重链可变区包括的cdr1氨基酸序列是:seq id no.1:gftfsryg;cdr2氨基酸序列是seq id no.2:iwydgsnk;cdr3氨基酸序列是seq id no.3:akqegtycsggscysgldy;
28.所述第一种抗体(imcas-364)的轻链可变区包括的cdr1氨基酸序列是seq id no.4:qsissy;cdr2氨基酸序列是seq id no.5:aas;cdr3氨基酸序列是seq id no.6:
no.21:
39.metdtlllwvlllwvpgstgdqvqlqesgggvvqpgrslrlscaasgftfsrygmhwvrqapgkglewvaviwydgsnkyyadsvkgrftisrdnskntlylqmnslraddtavyycakqegtycsggscysgldywgqgtlvtvssasradaaaaggpgsdiqmtqspssvsasvgdsvtitcrasqgisrwlawyqqrpgkapklliyaagnletgvpsrfsgsgsgtdftltisdlqaedfatyycqqadsfpltfgggtkvdikgradaaaaggggsggggsggggsggggsqvqlvesggglvqpggslrlscaasgftfssyamswvrqapgkglewvsaisgsggstyyadsvkgrftisrdnskntlylqmnslraedtavyycakdhlitmvqpeyfhhwgqgtlvtvssasradaaaaggpgdiqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqsystpltfgggtkvdikgtkgpsvtsgqagqhhhhhh*
40.本发明还提供上述强效抗新冠突变株的双特异人源抗体编码核酸。优选地,其核苷酸序列seq id no.22:
41.atgcaggtgcagctgcaagagagcggcggcggtgtcgtgcagcctggccggagcctgagactgagctgcgccgctagcggcttcaccttttctagatacggcatgcactgggtgagacaggctcctggcaaggggctggaatgggtggccgtgatctggtacgacggctccaacaagtactacgccgatagcgtgaagggcagattcaccatctcccgggacaacagcaaaaataccctgtacctgcagatgaactccctgcgggccgacgacacggccgtgtactactgcgccaaacaggagggcacatattgcagcggcggaagctgctacagcggactggactactggggacagggcacactggtgaccgtgagcagcgcttctcgggccgatgccgctgctgccggcggccccggctctgatatccagatgacccagtccccaagctctgtgagcgcctctgttggcgacagcgtgacaatcacatgccgcgccagccagggcatcagcagatggctggcctggtatcagcaaagacctggcaaggcccctaaactgctgatctacgccgctgggaacctggaaaccggcgtgcctagcaggttcagcggctccggtagcggcaccgactttacacttaccatcagcgacctgcaagcagaggacttcgccacatactattgtcagcaggccgactcattccccctgaccttcggcggcggcacaaaggtggacattaagggcagagccgacgccgcggccgccggcggaggaggctcgggcggcggaggtagcggcggcggaggttctggaggcggcggctcacaggtgcagctggtcgagagcggcggcggcctggtgcagcctggcggcagcctcagactgagctgtgccgccagcggattcacctttagtagctacgccatgagctgggttagacaggcccctggcaaaggcctggagtgggtgtccgccatcagcggctccggaggcagcacctactacgccgacagcgtcaagggcagatttaccatcagcagagataatagcaagaacaccctgtacctgcagatgaacagcctccgggccgaagataccgctgtgtactactgtgccaaggaccacctgatcaccatggtgcagcccgagtacttccaccactggggccaaggaaccctggtgacagtgtcttccgccagcagagccgatgccgccgccgccggcggacccggcgacattcagatgacacagagcccttcttctctgtctgcttctgtcggcgatcgggtgaccatcacctgcagagccagccagagcatctccagctacctgaactggtaccagcaaaagcccggcaaggccccaaagctgctgatctacgcggcctctagcctgcagagcggagtgcccagccggttcagcggcagcggctctggcaccgacttcaccctgacaatcagcagcctgcaacctgaggacttcgccacatactactgccagcagagttatagcacacctctgaccttcggcggtggaacaaaggtggacatcaagggtaccaagggccctagcgtgaccagcggccaggccggc。
42.或者为seq id no.23:
43.atggaaactgacaccctgctgctctgggtgctgctgctgtgggtgccaggctctaccggagatcaggtgcagctgcaagagagcggcggcggtgtcgtgcagcctggccggagcctgagactgagctgcgccgctagcggcttcaccttttctagatacggcatgcactgggtgagacaggctcctggcaaggggctggaatgggtggccgtgatctggtacgacggctccaacaagtactacgccgatagcgtgaagggcagattcaccatctcccgggacaacagcaaaaataccctgtacctgcagatgaactccctgcgggccgacgacacggccgtgtactactgcgccaaacaggagggcacatat
tgcagcggcggaagctgctacagcggactggactactggggacagggcacactggtgaccgtgagcagcgcttctcgggccgatgccgctgctgccggcggccccggctctgatatccagatgacccagtccccaagctctgtgagcgcctctgttggcgacagcgtgacaatcacatgccgcgccagccagggcatcagcagatggctggcctggtatcagcaaagacctggcaaggcccctaaactgctgatctacgccgctgggaacctggaaaccggcgtgcctagcaggttcagcggctccggtagcggcaccgactttacacttaccatcagcgacctgcaagcagaggacttcgccacatactattgtcagcaggccgactcattccccctgaccttcggcggcggcacaaaggtggacattaagggcagagccgacgccgcggccgccggcggaggaggctcgggcggcggaggtagcggcggcggaggttctggaggcggcggctcacaggtgcagctggtcgagagcggcggcggcctggtgcagcctggcggcagcctcagactgagctgtgccgccagcggattcacctttagtagctacgccatgagctgggttagacaggcccctggcaaaggcctggagtgggtgtccgccatcagcggctccggaggcagcacctactacgccgacagcgtcaagggcagatttaccatcagcagagataatagcaagaacaccctgtacctgcagatgaacagcctccgggccgaagataccgctgtgtactactgtgccaaggaccacctgatcaccatggtgcagcccgagtacttccaccactggggccaaggaaccctggtgacagtgtcttccgccagcagagccgatgccgccgccgccggcggacccggcgacattcagatgacacagagcccttcttctctgtctgcttctgtcggcgatcgggtgaccatcacctgcagagccagccagagcatctccagctacctgaactggtaccagcaaaagcccggcaaggccccaaagctgctgatctacgcggcctctagcctgcagagcggagtgcccagccggttcagcggcagcggctctggcaccgacttcaccctgacaatcagcagcctgcaacctgaggacttcgccacatactactgccagcagagttatagcacacctctgaccttcggcggtggaacaaaggtggacatcaagggtaccaagggccctagcgtgaccagcggccaggccggccagcaccatcaccaccaccactga。
44.本发明还提供上述核酸的表达载体,重组细胞。
45.本发明还进一步提供所述强效抗新冠突变株的双特异人源抗体在制备治疗新冠病毒引起疾病的药物中的应用,所述新冠病毒选自sars-cov-2、非典型性肺炎株。更优选地,所述的sars-cov-2选自原型株,阿尔法变异株,贝塔变异株,德尔塔变异株,伽玛变异株,奥密克戎变异株(更具体为ba.1、ba.2、ba.3和ba.1.1亚型)。
46.相应的,本发明提供上述应用中的药物组合物,其述的强效抗新冠突变株的双特异人源抗体作为有效成分。优选地,还包括药学上可接受的载体,以及与其他药物联合应用。
47.本发明利用imcas-123与imcas-364抗体不同表位的特性,构建成功了双特异性抗体。其中和效果在对omicron不同亚型得到极大提升。实现了对奥密克戎突变株全部亚型的强效保护包括ba.1(0.04μg/ml)、ba.2(0.05μg/ml)、ba.3(0.04μg/ml)、ba.1.1(0.08μg/ml),是一种高效抵御全部现有新冠突变株和未来新冠突变株有效的抗体药物,由此完成了本发明。
附图说明
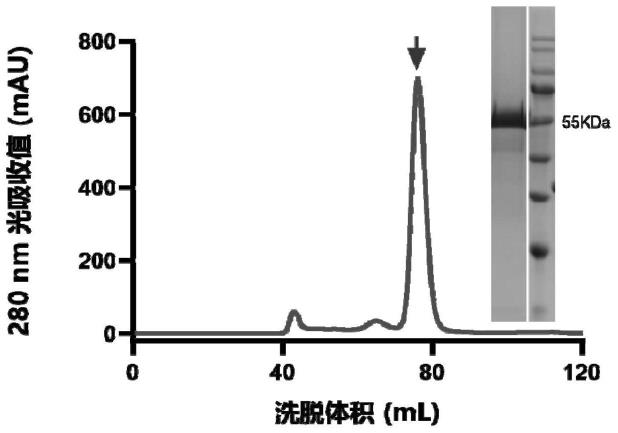
48.图1本发明双特异抗体tand ab 123-64蛋白纯化结果。
49.图2双特异性抗体tandab 123-64与新冠病毒受体结合域蛋白的亲和力。
50.图3双特异性抗体tand ab 123-64与sars-cov-2假病毒中和实验。
具体实施方式
51.为了突破“先产生后筛选”的传统模式,快速使候选抗体聚焦保守表位,本发明基
于噬菌体抗体库展示技术对弱免疫原性抗体筛选的平台,利用原型株刺突蛋白受体结合域与beta变异株刺突蛋白受体结合域抗原差减筛选,快速聚焦了表位分类中classiii与classvi保守靶位的抗体,成功在体外分离到结合在受体结合域不同表位的能对vocs实现广谱中和的全人源抗体。其中,imcas-123抗体对原型株、alpha、beta、delta、omicron变异株亲和力达到nm水平(见中国专利申请202210228772.5),对高传播力omicron变异株假病毒中和达到0.04μg/ml,是对omicron三种亚型ba.1ba.2ba.3均可中和的抗体。结构生物学证明imcas-123与regn10987结合表位相似,但imcas-123不结合q498(omicron此位点发生突变),此外imcas-123与s309均结合t345、l441保守位点同时,还额外结合y351保守位点。同样筛选到另外一株广谱抗体imcas-364,其对原型株、alpha、beta、delta、omicron亲和力同样达到nm水平(见中国专利申请202210295369.4)。
52.通过已知表位抗体竞争实验,证实imcas-364结合于rbd内侧面且不与受体ace2发生竞争的稀有靶位(区别于cova1-16抗体与ace2竞争),这是首次发现结合在这个靶位的抗体,不竞争ace2同时可以中和新冠病毒(区别于cr3022抗体只中和sars)。imcas-364具备与rbm结合抗体与受体结合域背侧结合抗体配对研发双特异抗体的良好潜力,同时imcas-364具备结合非典型肺炎(sars)病毒亲和力在nm级的能力,是良好的泛sars类冠状病毒中和抗体的开发源头。
53.利用imcas-123与imcas-364抗体不同表位的特性,根据新冠病毒表面s蛋白三聚体上三个rbd表位90埃的分子距离特点,考虑传统igg1形式抗体跨度为150埃,无法在一个三聚体分子内部形成二价结合。采用单链diabody的构建方式,其理论分子长度60-70埃,可以有效嵌合如三聚体内部,实现病毒与受体结合过程中,由于两个rbd被双特异分子结合从而锁死构象变化,实现入侵阻断。构建过程中基于一篇在大肠杆菌系统中构建tand形式四聚体分子的参考文献中,提到有关长linker产生大量单链自发回折从而导致双链无法高效配对的缺点[7],反向利用这个单链自回折缺点,分别基于已知imcas-123和imcas-364两个轻重链可变区序列,构建关键部分图谱如下ecori-信号肽-364vh-linker1-123vl-linker2-123vh-linker1-364vl-sfii-6xhis-终止密码子-xhoi,构建采用基因合成方式,通过ecori和xhoi连入pcaggs表达载体。构建成功一个可在哺乳细胞中表达的大小55kda的单链双特异性抗体,纯化简单,其质粒顺转产量达22mg/l。
[0054]
下面通过具体实施例对本发明进行说明,但并不构成对本发明限制。其中实验方法如元特殊说明,均为常规方法。
[0055]
实施例一、双特异性抗体tandab123-64的构建
[0056]
本实施例阐述将imcas-123与imcas-364抗体的重链可变区和轻链可变区按下述顺序通过linker进行串联连接:364vh-linker1-123vl-linker2-123vh-linker1-364vl。
[0057]
具体构建步骤如下:
[0058]
利用imcas-123与imcas-364抗体不同表位的特性,根据新冠病毒表面s蛋白三聚体上三个rbd表位90埃的分子距离特点,考虑传统igg1形式抗体跨度为150埃,无法在一个三聚体分子内部形成二价结合。根据文献我们采用单链双特异的构建方式,其理论分子长度60-70埃,可以有效嵌合如三聚体内部,实现病毒与受体结合过程中,由于两个rbd被双特异分子结合从而锁死构象变化,实现入侵阻断。
[0059]
构建过程中基于一篇在大肠杆菌系统中构建tand形式二聚体四价抗体分子的参
考文献中,提到有关长linker产生大量单链自发回折从而导致双链无法高效配对的缺点,我们反向利用这个单链自回折缺点,分别基于已知imcas-123和imcas-364两个轻重链可变区序列,开展构建
[0060]
构建关键部分图谱如下:ecori酶切位点-gccacc-信号肽-364vh-linker1-123vl-linker2-123vh-linker1-364vl-sfii-6xhis-终止密码子-酶切位点xhoi,构建采用基因合成方式,根据293f表达系统的密码子优化由南京金斯瑞公司完成,基因合成并通过ecori和xhoi连入pcaggs表达载体由同一公司完成并返回构建后质粒。
[0061]
实施例二、双特异性抗体tandab123-64纯化步骤
[0062]
(一)质粒转化
[0063]
(1)从-80
°
冰箱取出top 10感受态细胞,冰浴10min;
[0064]
(2)取0.1ug质粒放入30μl感受态细胞中,轻轻旋转混匀内容物,冰浴30min;
[0065]
(3)42℃热休克90s,冰浴3min,该过程不要摇动离心管;
[0066]
(4)每个离心管加入500μl 37℃预热的无抗lb培养基,180rpm 37℃恒温振荡培养30min;
[0067]
(5)取100μl菌液涂布于含有amp的lb固体培养基中,平板于37℃正放2~3小时,然后倒置培养16~24小时;
[0068]
(6)将疑似阳性克隆的单菌落选出,接种到含有amp的lb培养液内(4ml/管),37℃200rpm振荡培养12~16小时。
[0069]
(二)质粒提取
[0070]
(1)取阳性克隆培养后的培养液3ml,加入到含有1
‰
氨苄抗生素的lb培养基中,180rpm37℃恒温过夜振荡培养;
[0071]
(2)将培养好的菌液离心,弃上清,收集沉淀;
[0072]
(3)使用天根公司的无内毒素质粒大提质粒试剂盒进行大提质粒,根据其说明书进行;
[0073]
(4)将大提后的质粒进行核酸电泳鉴定,测浓度,放-20℃冰箱暂存待用。
[0074]
(三)293f细胞转染
[0075]
(1)转染buffer:20mm hapes,150mm nacl,ph=7.4;转染试剂:pei;
[0076]
(2)按照1ml细胞转染1ug质粒的比例,将500ug质粒溶于转染buffer中,总体积为12.5ml,按照pei:质粒=3:1的比例将pei溶于相同溶液中至12.5ml,静置5min;
[0077]
(3)将上述的两种溶液混合均匀,静置15min;
[0078]
(4)将静置后的混合溶液用移液枪缓慢滴入到500ml密度为3
×
106cells/ml的293f细胞中,在此过程中要边滴边摇细胞;
[0079]
(5)将转染后的细胞放入不通co2的摇床中继续培养,24小时后取出,加入17.5ml补料液,继续培养48小时后再次加入补料液,转染5天后收细胞,进行蛋白纯化。
[0080]
(四)蛋白纯化
[0081]
1、细胞收集和前处理
[0082]
用高速冷冻离心机收集293f细胞,8℃6500rpm/min离心90min弃掉沉淀,收集上清,上清用0.22μm滤器过滤掉杂质。
[0083]
2、ni-nta亲和层析柱
[0084]
使用蠕动泵,分别用25ml(5倍层析柱体积)的水和亲和层析缓冲液a液(20mm tris,150mm nacl,ph=8.0)平衡histrap
tm
hp亲和层析柱,平衡好后全部上清以2ml/min流速流过层析柱,收集下液。将结合好目的蛋白的his柱接入akta层析系统,用a液与b液(20mm tris,150mm nacl,1m咪唑,ph=8.0)按不同的比例混合后对亲和柱进行梯度洗脱,分别为0、20、50、100、300、500mm和1m咪唑浓度,分别收集不同咪唑浓度洗脱后的样品,通过sds-page进行鉴定。
[0085]
3、凝胶过滤层析
[0086]
根据分子质量和形状的差异,通过凝胶过滤层析(gel filtrationchromatograph,gf)的方法进行分离纯化。根据分子量大小,tandab 123-64选用hiload 16/600superdex200 pg(简称大200)。
[0087]
将his亲和层析洗脱的目的蛋白用10kda的超滤管进行浓缩换液到pbs溶液中,4℃12000rpm/min,每次离心10min,离心3次,以去掉沉淀,通过2ml loop环注入到分子筛中,按1ml/min的流速流经分子筛,按每管1.8ml的体积收集uv280值在5mau以上的样品。收集到的样品分别制样跑sds-page,根据电泳结果、出峰位置以及峰形选取样品管进行浓缩(如图1所示)。将浓缩后的蛋白进行分装,经过液氮速冻后放于-80℃冰箱储存。分子筛过完120ml buffer后,走1个柱体积的水和20%乙醇,室温放置保存。
[0088]
实施例三、表面等离子共振技术检测蛋白与抗体亲和力(biacore)
[0089]
利用表面等离子共振现象检测分子间相互作用,在ge healthcare集团生产的生物大分子相互作用分析系统biacore 8k上完成。使用生物素-链霉亲和素偶联法(sa芯片)捕获原型株病毒受体结合域蛋白,贝塔变异株病毒受体结合域蛋白,德尔塔变异株病毒受体结合域蛋白,奥密克戎变异株(ba.1、ba.2、ba.3和ba.1.1亚型)病毒受体结合域蛋白以及非典型性肺炎病毒受体结合域蛋白作为固定相,流动相为需要检测的tandab 123-64新冠双特异性中和抗体蛋白,之后通过bia evaluation软件分析动力学参数并作图。
[0090]
实验步骤:利用生物素-链霉亲和素的偶联作用,首先将原型株病毒受体结合域蛋白,贝塔变异株病毒受体结合域蛋白,德尔塔变异株病毒受体结合域蛋白,奥密克戎变异株(ba.1、ba.2、ba.3和ba.1.1亚型)病毒受体结合域蛋白以及非典型性肺炎病毒受体结合域蛋白与生物素化试剂按比例室温放置30分钟,将蛋白进行生物素化标记,之后用浓缩管换液至pbs,去除多余的生物素化试剂。将生物素化的抗原蛋白原型株病毒受体结合域蛋白,贝塔变异株病毒受体结合域蛋白,德尔塔变异株病毒受体结合域蛋白,奥密克戎变异株(ba.1、ba.2、ba.3和ba.1.1亚型)病毒受体结合域蛋白以及非典型性肺炎病毒受体结合域蛋白以10μg/ml的浓度固定在sa芯片(ge)上,然后将浓度梯度为2.5nm,5nm,10nm,20nm和40nm的抗体tandab 123-64注入芯片,分析在恒温25℃进行,使用的缓冲液是0.05%pbst。芯片表面的再生使用的是10mm的glynice溶液ph=1.7。结合曲线如图所示,不同浓度的曲线组成图示的动力学曲线。结合动力学常数的计算是利用bia evaluation software version 3.2(biacore,inc.)软件进行的。
[0091]
实验结果如图2所示,其中可知,所构建的实现了双特异抗体tand ab 123-64对奥密克戎突变株全部亚型的强效保护包括ba.1(0.04μg/ml)、ba.2(0.05μg/ml)、ba.3(0.04μg/ml)、ba.1.1(0.08μg/ml)。
[0092]
实施例四、抗体tand ab 123-64与sars-cov-2假病毒中和实验
[0093]
一、准备部分:
[0094]
样品:tandab 123-64双特异性中和抗体
[0095]
假病毒(原型株,阿尔法变异株,贝塔变异株,德尔塔变异株,伽玛变异株,奥密克戎变异株(ba.1、ba.2、ba.3和ba.1.1亚型),非典型性肺炎株
[0096]
耗材:枪头(无菌),圆底96孔板,10cm细胞培养皿,平底12孔板,平底96孔板,流式固定液,流式管
[0097]
试剂:dmem培养基 10%fbs(044)
[0098]
二、假病毒包装:
[0099]
pcaggs-sars-cov-2-s各突变体质粒各30μg,转染293t细胞10cm2盘(细胞量80%-90%),4h后换液dmem(10%fbs),转染后24h,加入vsv-δg-gfp假病毒5ml,2h后换液,加入dmem 10%,含vsvg抗体1:1000(10mg/ml由i1hybridomacrl2700
tm
细胞表达,终浓度10μg/ml),加入假病毒后20h收上清,3000rpm,10min离心,过0.45滤膜。分装冻-80。未转染s蛋白的细胞,后续同样加入vsv-δg-gfp假病毒和抗体的组作为假病毒包装对照。
[0100]
三、假病毒颗粒定量:
[0101]
假病毒用0.5u/μlbasemuncher endonuclease(abcam,ab270049)处理1.5小时。
[0102]
提取rna,用l蛋白的引物进行qpcr。并根据结果进行一致化处理。
[0103]
四、假病毒滴度测定:
[0104]
将vero细胞铺96孔板,24小时长到90%;
[0105]
将假病毒用dmem(含有10%的044fbs)3倍梯度稀释,100μl/孔加入96孔板,每个样做三孔平行;
[0106]
15h之后用cq1-双转盘激光共聚焦细胞成像分析系统拍照读数,计算滴度。
[0107]
五、中和实验:
[0108]
将vero细胞铺96孔板,24小时长到90%;实验当天从-80℃取出灭活血清,冰上融化(血清需提前56℃30min灭活)。用dmem培养基(含有10%的044fbs)稀释抗体(初始40μg/ml)(2个重复,4倍稀释,10个梯度),同时用相同的dmem培养基稀释假病毒到1000tu/50μl/assay。
[0109]
将稀释好的抗体以及假病毒加入96孔板(体积比为1:1,即1个重复孔60μl抗体稀释液 60μl假病毒稀释液),吹打混匀1次。将96孔板放入37℃孵育1h;孵育时间至40-50min,取出培养箱中事先准备好的vero细胞,吸尽vero细胞上清,加入抗体与病毒的混合稀释液100μl,37℃孵育15h后,用cq1-双转盘激光共聚焦细胞成像分析系统读数法检测绿色荧光并拍照、计数,用graphpadprism9.3.1软件进行数据处理。
[0110]
实验结果如图3所示,其中可知其半数抑制率如下:
[0111]
ptalphabetadeltagammaba.1ba.2ba.3ba.1.1sars0.018760.021490.025600.10900.014880.045950.051930.037790.0819918.05
[0112]
由此可以得出本发明构建的双特异抗体tand ab 123-64可以作为一种高效抵御全部现有新冠突变株和未来新冠突变株有效的抗体药物。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。