1.本发明涉及一种通过强化电子传递提高重组大肠杆菌催化合成胆绿素的方法,具体涉及一种以表达了来源于clostridium tetani的血红素加氧酶ho、e.coli的谷氨酸脱氢酶gdha、黄素氧还蛋白yqca、铁氧还蛋白fpr以及膜锚蛋白blc和ho的融合表达的重组大肠杆菌,以及该菌株在全细胞转化氯化血红素制备胆绿素的技术,属于生物工程技术领域。
背景技术:
2.胆绿素(biliverdin,bv),又称去氢胆红素,分子量584.66,分子式c
33h34
n4o6,溶于甲醇、乙醚、氯仿、二硫化碳,苯,难溶于水,是一种四吡咯色素,是血红素分解代谢的产物。
3.胆绿素,作为胆红素的前体,一种与红细胞和血红蛋白转换相关的降解中间产物,具有抗炎,抗氧化等作用,被认为是一种新型的抗氧化剂。胆绿素在医院领域被广泛应用研究,胆绿素不仅可以充当保护细胞的抗氧化剂,还被广泛应用在患者术后的恢复,如肝脏或小肠移植后的缺血再灌注损伤、血管损伤、血管内膜增生等症状,体现了胆绿素其优异的抗炎功效。除此之外,研究人员发现胆绿素还能够抑制丙型肝炎和其他病毒的体外复制,展现出其出色的应用价值。越来越多的胆绿素临床应用潜在表明,未来需要大量的高质量的胆绿素制剂。
4.而目前商业化的胆绿素制备方法主要是将从哺乳动物胆汁中提取的胆红素通过化学氧化。但是化学法生产胆绿素会带来诸多问题,如:产生的大量化学试剂废液如果处理不当会严重破坏生态环境、长期使用化学试剂也会影响工作人员自身健康而且化学方法生产会引入带来的胆绿素的同分异构体,造成产物纯度不高,加大下游分离纯化难度。随着环境友好型发展理念的提出,胆绿素的制备方法从早期的通过化学氧化来源于哺乳动物胆汁的胆红素产生到对微生物细胞工厂的探索。国内外也有一些利用微生物来合成胆绿素的研究报道,但是由于受到内源性血红素生物合成速率的限制,胆绿素的产量受到严重影响,胆绿素的转化效率还较低。
技术实现要素:
5.本发明在重构了辅酶循环系统的重组大肠杆菌e.coli bl21/petduet-ecgdha-ctho的基础上,通过进一步强化电子传递链系统相关基因黄素氧还蛋白yqca和铁氧还蛋白fpr基因的表达,以强化反应过程中的电子传递链,并通过e.coli来源的膜锚蛋白blc将clostridium tetani来源的ho锚定在膜表面,来增大血红素加氧酶和血红素的接触以期能够提高转化效率、缩短转化时间,从而实现微生物法高效催化合成胆绿素。
6.本发明的第一个目的是提供一种重组大肠杆菌,其特征在于,表达了来源于clostridium tetani的血红素加氧酶ho、e.coli的谷氨酸脱氢酶gdha、黄素氧还蛋白yqca、铁氧还蛋白fpr,并利用膜锚蛋白blc实现所述血红素加氧酶的表面展示。
7.在一种实施方式中,所述谷氨酸脱氢酶gdha的genbank:aac74831.1;黄素氧还蛋
白yqca的genbank:aac75832.1;铁氧还蛋白fpr的genbank:aac76906.1;膜锚蛋白blc的genbank:aac77109.1。
8.在一种实施方式中,以e.coli bl21(de3)为表达宿主。
9.在一种实施方式中,所述重组大肠杆菌以petduet为表达载体,在petduet上依次连接编码所述谷氨酸脱氢酶gdha、黄素氧还蛋白yqca、膜锚蛋白blc、血红素加氧酶ho、铁氧还蛋白fpr的基因。
10.在一种实施方式中,在所述黄素氧还蛋白基因yqca前连接t7启动子,以实现黄素氧还蛋白基因yqca、膜锚蛋白基因blc、血红素加氧酶基因ctho的共表达。
11.在一种实施方式中,在铁氧还蛋白基因fpr前连接t7启动子,以实现铁氧还蛋白fpr的表达。
12.在一种实施方式中,所述黄素氧还蛋白基因、铁氧还蛋白基因、膜锚蛋白基因、谷氨酸脱氢酶基因的核苷酸序列分别如seq id no:1~3和seq id no:5所示。
13.本发明的第二个目的是提供一种全细胞转化生产胆绿素的方法,所述方法是利用所述的重组大肠杆菌以血红素为底物,生产胆绿素。
14.在一种实施方式中,所述方法具体为:
15.(1)将所述重组大肠杆菌培养至od
600
=6
±
0.5,降温至28~30℃,添加终浓度为0.1~0.5mmol
·
l-1
的iptg,培养10-12h;
16.(2)将培养后的发酵液离心并收集菌体;
17.(3)反应体系中菌体od
600
为25
±
1、氯化血红素终浓度为50~100mg/l、谷氨酸终浓度为10~15g/l,在30~35℃,100~150rpm/min,ph 6.5~7.0下反应15~20h。
18.在一种实施方式中,步骤(1)中的重组大肠杆菌在gy培养基中培养;所述gy培养基的组分为:甘油20g/l,酵母粉20g/l,(nh4)2so
4 5g/l,nacl 5g/l,na2hpo
4 15g/l,kh2po
4 3g/l,mgso
4 0.5g/l。
19.在一种实施方式中,将步骤(2)中收集到的菌体通过ph为7.0~7.4的pbs磷酸缓冲溶液进行重悬。
20.在一种实施方式中,所述氯化血红素以1g/l氯化血红素水溶液的形式加入,所述1g/l氯化血红素水溶液的配置方法为:100mg/l的氯化血红素溶解在100ml质量浓度0.25%的na2co3水溶液,即得1g/l氯化血红素水溶液。
21.本发明的第三个目的是提供所述重组大肠杆菌在制备胆绿素及其衍生物中的应用。
22.本发明的有益效果:
23.(1)本发明在大肠杆菌bl/21 petduet-ecgdha-ctho的基础上,成功强化了电子传递链相关基因yqca和fpr的表达。
24.(2)本发明在大肠杆菌中成功实现ho的膜表面展示,成功构建重组菌株bl/21 petduet-ecgdha/t7yqca-blc/ctho/t7fpr。
25.(3)本发明的重组菌株bl/21 petduet-ecgdha/t7yqca-blc/ctho/t7fpr在无需外源添加辅酶nadph的条件下,进一步缩短转化时间,提高转化效率,实现胆绿素的高效合成,可实现在反应20h,胆绿素产量达到77.6mg/l。
附图说明
26.图1为e.coli bl21/petduet-yqca和e.coli bl21/petduet-fpr菌落pcr验证图谱;m:dl marker 5000,1-2:e.coli bl21/petduet-yqca菌落pcr,3-4:e.coli bl21/petduet-fpr菌落pcr。
27.图2为e.coli bl21/petduet-ecgdha/t7yqca-ctho菌落pcr验证图谱;m:dl marker5000,1-2:e.coli bl21/petduet-ecgdha/t7yqca-ctho菌落pcr。
28.图3为e.coli bl21/petduet-ecgdha/t7yqca-ctho/t7fpr菌落pcr验证图谱;m:dl marker 5000,1-2:e.coli bl21/petduet-ecgdha/t7yqca-ctho/t7fpr菌落pcr。
29.图4为e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr菌落pcr验证图谱;m:dl marker 5000,1-3:e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr菌落pcr。
30.图5为e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr胞内上清蛋白胶图;m:蛋白marker,1:e.coli bl21/petduet空载,2:e.coli bl21/petduet-ecgdha/t7yqca-ctho/t7fpr。
31.图6为e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr膜蛋白提取上清蛋白胶图;m:蛋白marker,1:e.coli bl21/petduet空载,2:e.coli bl21/petduet-ecgdha/t7yqca-ctho/t7fpr。
32.图7为e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr菌落pcr验证;m:dl marker 10000,1-9:e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr菌落pcr。
33.图8为e.coli bl21/petduet-gfp和e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr在clsm下的荧光显示图;(a)e.coli bl21/petduet-gfp;(b)e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr。
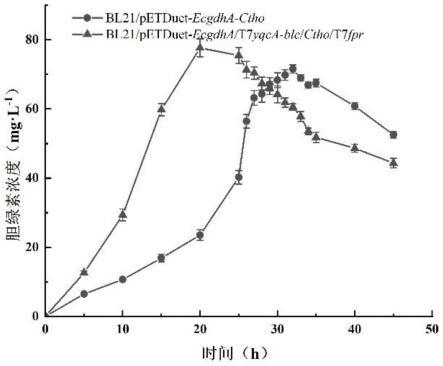
34.图9为e.coli bl21/petduet-ecgdha-ctho和e.coli bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr 5l发酵罐转化能力比较。
35.图10为胆绿素的hplc分析图谱。
具体实施方式
36.本发明所用到的培养基如下:
37.lb液体培养基:胰蛋白胨10g/l,酵母粉5g/l,nacl 10g/l。
38.lb固体培养基:胰蛋白胨10g/l,酵母粉5g/l,nacl 10g/l,琼脂粉2g/l。
39.gy培养基:甘油20g/l,酵母粉20g/l,(nh4)2so
4 5g/l,nacl 5g/l,na2hpo
4 15g/l,kh2po
4 3g/l,mgso
4 0.5g/l。
40.hplc液相检测方法:uv检测器,c18柱(agilent 5μm,4.6mm
×
250mm),流动相为(甲醇:乙腈:水:乙酸=40:40:19:1),流速1ml/min,检测波长370nm,柱温35℃,进样量10μl。
41.本发明中高保真pcr酶、同源重组酶克隆试剂盒、pbs磷酸盐试剂均购自南京诺维赞生物科技有限公司;琼脂糖凝胶dna回收试剂盒、小量质粒提取试剂盒、细菌dna基因组提取试剂盒均购于上海捷瑞生物工程有限公司;氨苄霉素、异丙基-β-d-硫代半乳糖苷(iptg)均购自生工生物工程(上海)股份有限公司,氯化血红素购自西安雅图生物科技有限公司,desalting重力脱盐柱购自武汉晶诚生物科技股份有限公司,膜蛋白提取试剂盒购自南京
莱富赛生物科技有限公司。
42.表1本发明所用到的引物
[0043][0044][0045]
实施例1:重组菌bl21/petduet-yqca和bl21/petduet-fpr
[0046]
以e.coli bl21(de3)基因组为模板,分别使用引物mcs1-yqca-f、mcs1-yqca-r和mcs2-fpr-f、mcs2-fpr-r扩增yqca(核苷酸序列如seq id no:1所示)和fpr基因(核苷酸序列如seq id no:2所示),回收的扩增产物与线性化的质粒petduet按照一定比例混合用同源重组试剂盒进行连接,连接至petduet的多克隆位点处。将连接产物转化至e.coli bl21(de3)感受态细胞中37℃孵育2h,涂布于氨苄抗性的lb固体平板,37℃过夜培养。
[0047]
菌落pcr鉴定,结果如图1,挑取阳性转化子至氨苄抗性的lb液体培养基中培养10-12h,提取质粒,送至苏州金唯智生物科技有限公司测序验证,成功构建分别含有表达载体petduet-yqca和petduet-fpr的重组菌bl21/petduet-yqca和bl21/petduet-fpr。
[0048]
实施例2:重组菌bl21/petduet-ecgdha/t7yqca-ctho的构建
[0049]
以质粒petduet-ecgdha-ctho和质粒petduet-yqca为模板,分别使用反向pcr引物
mcs1-f、t7pro-gdha-r和引物t7pro-f、mcs1-yqca-r进行扩增,将线性化的质粒petduet-ecgdha-ctho与目的基因片段t7yqca通过同源重组体系连接,构建质粒petduet-ecgdha/t7yqca-ctho。
[0050]
将质粒petduet-ecgdha/t7yqca-ctho通过化学转化的方法转化至e.coli bl21(de3)感受态细胞中,37℃孵育2h,涂布于氨苄抗性的lb固体平板,37℃过夜培养。
[0051]
菌落pcr鉴定,结果如图2,挑取阳性转化子至氨苄抗性的lb液体培养基中培养10-12h,提取质粒,送至苏州金唯智生物科技有限公司测序验证,成功构建含有表达载体petduet-ecgdha/t7yqca-ctho的重组菌bl21/petduet-ecgdha/t7yqca-ctho。
[0052]
实施例3:重组菌bl21/petduet-ecgdha/t7yqca-ctho/t7fpr的构建
[0053]
以质粒petduet-ecgdha/t7yqca-ctho和质粒petduet-fpr为模板,分别使用反向pcr引物mcs2-f、t7pro-ho-r和引物t7pro-f、mcs2-fpr-r进行扩增,将线性化的质粒petduet-ecgdha/t7yqca-ctho与目的基因片段t7fpr通过同源重组体系连接,构建质粒petduet-ecgdha/t7yqca-ctho/t7fpr。
[0054]
将质粒petduet-ecgdha/t7yqca-ctho/t7fpr通过化学转化的方法转化至e.coli bl21(de3)感受态细胞中,37℃孵育2h,涂布于氨苄抗性的lb固体平板,37℃过夜培养。
[0055]
菌落pcr鉴定,结果如图3,挑取阳性转化子至氨苄抗性的lb液体培养基中培养10-12h,提取质粒,送至苏州金唯智生物科技有限公司测序验证,成功构建含有表达载体petduet-ecgdha/t7yqca-ctho/t7fpr的重组菌bl21/petduet-ecgdha/t7yqca-ctho/t7fpr。
[0056]
实施例4:重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr的构建
[0057]
以e.coli bl21(de3)基因组为模板,使用引物mcs2-blc-f、linker-blc-r扩增目的基因blc;以质粒petduet-ecgdha-ctho为模板,使用引物linker-ho-f、t7pro-ho-r扩增hoct基因;以质粒petduet-ecgdha/t7yqca-ctho/t7fpr为模板,使用反p引物mcs2-f、mcs2-r线性化载体。将回收的目的片段blc、hoct、t7fpr与线性化的质粒petduet-ecgdha/t7yqca-ctho/t7fpr按照同源重组体系连接,构建质粒petduet-ecgdha/t7yqca-blc/ctho/t7fpr。
[0058]
将质粒petduet-ecgdha/t7yqca-blc/ctho/t7fpr通过化学转化的方法转化至e.coli bl21(de3)感受态细胞中,37℃孵育2h,涂布于氨苄抗性的lb固体平板,37℃过夜培养。
[0059]
菌落pcr鉴定,结果如图4,挑取阳性转化子至氨苄抗性的lb液体培养基中培养10-12h,提取质粒,送至苏州金唯智生物科技有限公司测序验证,成功构建含有表达载体petduet-ecgdha/t7yqca-blc/ctho/t7fpr的重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr。
[0060]
将重组菌株bl/21 petduet-ecgdha/t7yqca-blc/ctho/t7fpr,于氨苄抗性的lb固体培养平板划线活化,37℃恒温过夜培养,挑取单菌落接入含有氨苄霉素(50μg/ml)抗性的10ml lb液体培养基中,培养10-12h,按照1%(v/v)的接种量转接至相同浓度抗生素的50ml lb培养基中继续培养2
–
3h,待od
600
达到0.6
–
0.8时加入终浓度为0.5mmol/l的iptg,30℃过夜诱导培养。
[0061]
收集菌体,使用试剂盒提取膜蛋白后,再破碎细胞,经sds-page蛋白电泳分析,结
果如图5、图6,重组菌株在16kda、27kda和45kda都明显的条带,分别与yqca、fpr和gdha的分子量大小一致,膜蛋白提取上清在约44kda处有明显条带,与blc-hoct的融合蛋白分子量大小一致。
[0062]
实施例5:重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr的构建
[0063]
以质粒petduet-ecgdha/t7yqca-blc/ctho/t7fpr为模板,使用引物mcs2-f、linker2-ho-r对其进行线性化处理;以质粒petduet-gfp为模板,使用引物linker2-gfp-f、t7pro-gfp-r对目的基因gfp进行扩增。将目的基因片段gfp、t7fpr和线性化载体petduet-ecgdha/t7yqca-blc/ctho/t7fpr按照同源重组体系连接,构建质粒petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr。
[0064]
将质粒petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr通过化学转化的方法转化至e.coli bl21(de3)感受态细胞中,37℃孵育2h,涂布于氨苄抗性的lb固体平板,37℃过夜培养。
[0065]
菌落pcr鉴定,结果如图7挑取阳性转化子至氨苄抗性的lb液体培养基中培养10-12h,提取质粒,送至苏州金唯智生物科技有限公司测序验证,成功构建表达载体petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr。
[0066]
重组菌株bl/21 petduet-ecgdha/t7yqca-blc/ctho/gfp/t7fpr,于氨苄抗性的lb固体培养平板划线活化,37℃恒温过夜培养,挑取单菌落接入含有氨苄霉素(50μg/ml)抗性的10ml lb液体培养基中,培养10-12h,按照1%(v/v)的接种量转接至相同浓度抗生素的50ml lb培养基中继续培养2
–
3h,待od
600
达到0.6
–
0.8时加入终浓度为0.5mmol/l的iptg,30℃过夜诱导培养。
[0067]
诱导后的菌体稀释至适当浓度,通过激光共聚焦显微镜观察蛋白表达情况,结果如图8,血红素加氧酶ho已被锚定在细胞膜表面。
[0068]
实施例6:重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr全细胞催化血红素合成胆绿素
[0069]
从-80℃冰箱取出重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr,于氨苄抗性的lb平板划线活化,37℃恒温过夜培养。
[0070]
从平板上挑取单菌落接入10ml lb液体培养基,于37℃、200r
·
min-1
过夜培养。
[0071]
按1%(v/v)的接种量转接至gy培养基,相同条件下培养6-8h后转接至5l发酵罐中培养。
[0072]
当od
600
达到6左右,降温至28℃时,添加iptg(终浓度为0.5mmol
·
l-1
)继续诱导培养10-12h。发酵液经8000r
·
min-1
离心15min后,弃掉上清,收集菌体。
[0073]
上述所得菌体使用pbs磷酸盐缓冲液(ph 7.4)重悬,控制菌体在反应体系中的od
600
为25,加入终浓度为100mg/l的氯化血红素水溶液及终浓度为15g/l的谷氨酸,定容至1l,于35℃,150rpm/min,ph 7.0进行全细胞转化,结果如图9。
[0074]
按照上述方法,重组菌bl21/petduet-ecgdha/t7yqca-blc/ctho/t7fpr催化血红素合成胆绿素,转化时间可缩短至20h,此时胆绿素产量为77.6mg/l,摩尔转化率为86.5%。胆绿素样品hplc分析图谱见图10。
[0075]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范
围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。