1.本发明涉及细胞群以及其取得方法。本发明的细胞群是通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群。本发明还涉及:含有在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群的、缺血性疾病、炎症性疾病或难治疗性创伤的治疗用组合物。
背景技术:
2.近年,以缺血性疾病为对象,开始进行了骨髓单个核细胞移植治疗、使用了基于外周血干细胞采集的血管内皮祖细胞(endothelial progenitor cell;epc)的细胞移植治疗法。因此,特别需要大量培养epc的技术。来自cd34和/或cd133阳性细胞的血管内皮祖细胞的活体外扩增方法可以提供高效的epc的培养技术(专利文献1)。并且,通过血管内皮细胞分化动态解析方法,明确了内皮细胞样大群落(分化型epc群落)形成细胞和内皮细胞样小群落(未分化型epc群落)形成细胞的存在,可以预测、把握细胞移植的治疗效果(专利文献2)。且已公开了从骨髓单个核细胞高效地扩增cd34和/或cd133阳性细胞的方法(专利文献3)。
3.如国际公开wo2014/0561154所示,公开了从来源于骨髓、脐带血或外周血的单个核细胞组分扩增富集了血管内皮祖细胞或抗炎症
·
免疫耐受诱导细胞的细胞群的方法(以下,本说明书中,也称为“qq-mnc法”))。该方法通过在包含(1)干细胞因子(stem cell factor;scf)、(2)白细胞介素6(interleuk in-6;il-6)、(3)fms样酪氨酸激酶3配体(fms-like tyrosine kinase 3ligand;fl)、(4)血小板生成素(thrombopoietin;tpo)以及(5)血管内皮细胞生长因子(vascular endothelial growth factor;vegf)的5种因子的无血清培养基中,培养单个核细胞,而在活体外扩增包含epc的细胞群。
4.现有技术文献
5.专利文献
6.专利文献1:国际公开wo2006/090882
7.专利文献2:国际公开wo2006/090886
8.专利文献3:国际公开wo2006/093172
9.专利文献4:国际公开wo2014/0561154
技术实现要素:
10.本发明所要解决的技术问题
11.本发明者们进行了锐意研究的结果,通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及
血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞,而成功地取得了具有血管再生能力以及创伤治愈能力,并且与通过qq-mnc法得到的细胞群不同的新的细胞群,从而想到了本发明。
12.本发明以提供一种细胞群为目的。本发明的细胞群是通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群。
13.本发明还以提供一种细胞群的取得方法为目的。本发明的方法包含:在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞。
14.本发明还以提供一种缺血性疾病、炎症性疾病或难治疗性创伤的治疗用组合物为目的。本发明的组合物包含:在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群。
15.解决技术问题的技术手段
16.本发明包括但不限于以下方式。
17.[方式1]一种细胞群,其通过在培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到,所述培养基包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清。
[0018]
[方式2]根据方式1所述的细胞群,其中,培养基包含:选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的3种因子或4种因子。
[0019]
[方式3]根据方式1或2所述的细胞群,其中,血清为牛的血清或人类的血清。
[0020]
[方式4]根据方式1~3中任一项所述的细胞群,其中,血清以0.5容量%以上10容量%以下的浓度而被包含在培养基中。
[0021]
[方式5]根据方式1~4中任一项所述的细胞群,其中,为cd206( )、cd34( )或cd3( )的细胞的合计为60%以上,并且,为ccr2(-)的细胞为95%以上。
[0022]
[方式6]根据方式5所述的细胞群,其中,cd206( )中为cxcr4( )的细胞为50%以上。
[0023]
[方式7]根据方式5或6所述的细胞群,其中,cd206( )中为cxcr4( )的细胞为80%以上。
[0024]
[方式8]根据方式1~7中任一项所述的细胞群的取得方法,其包含:在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞。
[0025]
[方式9]根据方式8所述的方法,其中,在细胞群中,为cd206( )、cd34( )或cd3( )的细胞的合计为60%以上,并且,为ccr2(-)的细胞为95%以上。
[0026]
[方式10]根据方式8或9所述的方法,其中,在细胞群中,cd206( )中为cxcr4( )的
细胞为50%以上。
[0027]
[方式11]根据方式8~10中任一项所述的方法,其中,培养基包含:选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的3种因子或4种因子。
[0028]
[方式12]根据方式8~11中任一项所述的方法,其中,血清为胎牛血清。
[0029]
[方式13]根据方式8~12中任一项所述的方法,其中,血清以0.5容量%以上10容量%以下的浓度而被包含在培养基中。
[0030]
[方式14]一种缺血性疾病、炎症性疾病或难治疗性创伤的治疗用组合物,其包含方式1~7中任一项所述的细胞群。
[0031]
[方式15]根据方式14所述的治疗用组合物,其中,缺血性疾病为四肢缺血。
[0032]
[方式16]根据方式14或15所述的治疗用组合物,其中,缺血性疾病为伴随有溃疡的四肢缺血。
[0033]
[方式17]根据方式14~16中任一项所述的治疗用组合物,其促进血管新生和/或创伤治愈。
附图说明
[0034]
[图1]图1表示关于通过健康人的外周血而制备的re-01的构成细胞成分的、基于流式细胞术(facs)的分级分离的结果。作为比较例,还表示了培养前的外周血单个核细胞的facs的结果。
[0035]
[图2]图2表示关于通过与图1不同的其他健康人的外周血而制备的re-01的构成细胞成分的流式细胞术(facs)的解析结果。
[0036]
[图3]图3表示关于通过53岁糖尿病女性患者的外周血而制备的re-01的构成细胞成分的流式细胞术(facs)的解析结果。作为比较例,使用了通过包含5种因子的无血清培养基进行培养而得到的细胞群(mnc-qq)。
[0037]
[图4]图4表示使用人类脐带静脉内皮细胞(huvec),对re-01的血管形成能力进行了调查的结果。作为比较例,对使用mnc-qq代替re-01的情况、仅使用huvec的情况进行了调查。图4a表示形成的管腔数从培养开始起的时间变化,图4b表示培养开始起2.75小时后的形成的管腔数。图4c表示培养开始起2.75小时后的被包入管腔结构中的荧光标记的试验细胞数。
[0038]
[图5]图5表示关于通过重症下肢缺血(critical limb ischemia)的患者的外周血而制备的re-01的构成细胞成分的、基于流式细胞术(facs)的分级分离的结果。
具体实施方式
[0039]
1.细胞群
[0040]
本发明涉及一种细胞群。
[0041]
本发明的细胞群通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到。
[0042]
所述细胞群通过培养来源于骨髓、脐带血或外周血的单个核细胞而得到。用于取
得所述细胞群的“单个核细胞”是指,外周血、骨髓或脐带血等中包含的具有圆形核的细胞的总称,包含淋巴细胞、单核细胞、巨噬细胞、血管内皮祖细胞、造血干细胞等。例如,从动物处采集骨髓、脐带血或外周血,将其例如通过使用单个核细胞分离用采血管、或供至密度梯度离心法而提取该组分,从而得到单个核细胞。作为密度梯度离心法,只要形成单个核细胞组分就无特别限定。例如,可以使用histopaque-1077(sigma-aldrich)。
[0043]
作为骨髓、脐带血或外周血来源的动物种类无特别限定。动物种类中包含:包括可以适用针对缺血性疾病、炎症性疾病或难治性创伤等疾病的细胞移植疗法的人类的一般哺乳动物。从临床应用这一目的出发,优选为人类。
[0044]
作为骨髓、脐带血或外周血来源的对象无特别限定。作为一种方式,例如,可以为健康者、糖尿病患者或重症下肢缺血的患者。
[0045]
干细胞因子(scf)是由248个氨基酸构成的分子量约为30000的糖蛋白。由于选择性剪接而存在可溶型和膜结合型,用于取得所述细胞群的scf只要对单个核细胞的培养有用,就可以为任意类型的scf。优选为可溶型。scf的来源等无特别限定。不受限定地,优选为预期具有稳定供给的重组体,特别优选为人类重组体。已知有可以商业获得的产品。培养培养基中的scf的浓度根据使用的scf的种类而不同,只要对单个核细胞的培养有用则无特别限定。如果为人类重组scf,则不受限定地,例如为10~1000ng/ml,优选为50~500ng/ml,更优选为约100ng/ml。
[0046]
白细胞介素6(il-6)是作为诱导b细胞向抗体产生细胞的最终分化的因子而被分离出的分子量为21万的糖蛋白。已知il-6一般与免疫应答、造血系统、神经系细胞的增殖分化、急性期反应等有关。为了取得所述细胞群而使用的il-6无特别限定,可以适宜选择。如果在人类的单个核细胞的培养中使用,则优选人类il-6,特别优选预期具有稳定供给的重组体。已知有可以商业获得的产品。培养培养基中的il-6的浓度根据使用的il-6的种类而不同,只要对单个核细胞的培养有用就无特别限定。在人类重组il-6的情况下,不受限定地,例如为1~500ng/ml,优选为5~100ng/ml,更优选为约20ng/ml。
[0047]
fms样酪氨酸激酶3配体(fl)作为在初期造血控制中起到重要作用的受体型酪氨酸激酶的配体而广为人知。已知有数种基于选择性剪接的产物,有报道称其刺激造血系干细胞的增殖。就用于取得所述细胞群的fl而言,只要对单个核细胞的培养有用,就可以是任意类型的fl。已知有可以商业获得的产品。培养培养基中的fl的浓度根据使用的fl的种类而不同,只要对单个核细胞的培养有用就无特别限定。在人类重组flt-3配体的情况下,不受限定地,例如为10~1000ng/ml,优选为50~500ng/ml,更优选为约100ng/ml。
[0048]
血小板生成素(tpo)是造血系细胞因子的一种,已知其在由造血干细胞形成巨核细胞的过程中特异性地发挥作用,促进巨核细胞的产生。为了取得所述细胞群而使用的tpo的来源等无特别限定。优选为预期具有稳定供给的重组体,特别优选为人类重组体。已知有可以商业获得的产品。培养培养基中的tpo的浓度根据使用的tpo的种类而不同,只要对单个核细胞的培养有用就无特别限定,在人类重组tpo的情况下,不受限定地,例如为1~500ng/ml,优选为5~100ng/ml,更优选为约20ng/ml。
[0049]
血管内皮细胞生长因子(vegf)是对血管内皮祖细胞(epc)发挥特异性作用的生长因子,已知主要在血管周围的细胞中产生。通过选择性剪接会产生尺寸不同的数种vegf蛋白,就为了取得所述细胞群而使用的vegf而言,只要使epc的群落可以形成,就可以为任意
类型的vegf。优选为vegf165。vegf的来源等无特别限定。优选为预期具有稳定供给的重组体,特别优选为人类重组体。已知有可以商业获得的产品。培养培养基中的vegf的浓度根据使用的vegf的种类而不同,只要对单个核细胞的培养有用就无特别限定。在人类重组vegf165的情况下,不受限定地,例如为约5~500ng/ml,优选为约20~100ng/ml,更优选为约50ng/ml。
[0050]
就单个核细胞的培养中使用的培养培养基中添加的各种因子而言,不受限定地,可以统一为来源于与作为单个核细胞的来源的动物同种的动物的因子。通过如此将单个核细胞和各种因子的来源统一,能够得到适用于同种异体移植等同种移植的细胞培养物。此外,通过使用来源于意图进行细胞移植的个体的单个核细胞,也可以得到适用于同种同体移植的细胞培养物。
[0051]
可以将所述的各成分以给定的浓度溶解在培养培养基中,或预先制备各成分的浓缩液(储备溶液),通过以培养培养基稀释至给定的浓度,而制备用于培养单个核细胞的培养培养基。例如可以通过将必要的成分以使得其为给定的浓度的方式溶解于市售的培养培养基后,通过过滤灭菌等进行灭菌,或将通过过滤灭菌等进行了灭菌的储备溶液以无菌的方式添加至市售的培养培养基中,并进行稀释,从而制备培养培养基。过滤灭菌可以依照该领域中通常实施的方法进行,例如使用0.22μm、0.45μm的微孔过滤器(millipore filter)等。
[0052]
本发明中使用的“培养培养基”可以利用该领域中通常使用的培养基,例如可以使用作为造血干细胞的增殖用培养基而广为人知的培养基。就作为培养培养基而使用的基础培养基而言,例如,可以举出stemline ii、dmem、mem、imdm、rpmi、scgm、ebm等。
[0053]
为了取得所述细胞群,用于培养单个核细胞的培养基在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子的基础上,还包含血清。
[0054]
血清的种类无特别限定。不受限定地,在一种方式中,血清为牛的血清或人类的血清。在一种方式中,血清为胎牛血清和/或人类血清白蛋白。培养基中的血清的浓度无特别限定。在一种方式中,血清在培养基中含有0.1容量%以上、0.3容量%以上、0.5容量%以上。培养基中的血清的浓度的上限无特别限制。在一种方式中,为30容量%以内、20容量%以内、10容量%以内、5容量%以内。不受限定地,血清以0.1容量%以上20容量%的浓度而被包含在培养基中,以0.5容量%以上10容量%的浓度而被包含在培养基中。
[0055]
单个核细胞培养通过将含有单个核细胞的细胞悬浮液添加至包含所述因子以及血清的培养基中而进行。作为细胞悬浮液,也可以使用含有单个核细胞的体液本身(例如,骨髓液、脐带血、外周血)。单个核细胞的培养条件无特别限定,可以在通常该领域中实施的条件下实施。不受限定地,例如,在5%co2氛围中,约37℃下进行培养。就培养期间而言,不受限定地,例如为3天以上、5天以内、6天以内、7天以内、10天以内。例如,3天-10天、3天-6天。就单个核细胞的培养基中的浓度而言,只要可以进行单个核细胞的培养就无特别限定,例如为约0.1~10
×
106细胞/ml,更优选为约0.5~5
×
106细胞/ml。
[0056]
本说明书中,“细胞群”是指,用含有所述因子以及血清的培养基培养单个核细胞而得到的细胞的总称。
[0057]
单个核细胞的培养中使用的培养培养基包含:选自干细胞因子、白细胞介素6、fms
样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的因子中的4种以下的因子。
[0058]
一种方式中,培养基包含:选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子中的2种以上的因子、或3种以上的因子。一种方式中,培养基包含:选自所述5种因子中的2种以上4种以下的因子。一种方式中,培养基包含:选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子中的3种因子或4种因子。
[0059]
不受限定地,单个核细胞的培养中使用的培养培养基,因此本发明的培养方法中使用的培养培养基例如包含:i)fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的组合;或ii)干细胞因子、fms样酪氨酸激酶3配体、以及血管内皮细胞生长因子的组合。培养基更优选包含:约80~120ng/ml的fms样酪氨酸激酶3配体、约15~25ng/ml的血小板生成素以及约40~60ng/ml的血管内皮细胞生长因子的组合。
[0060]
一种方式中,通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群与培养前的单个核细胞的细胞群相比,包含更多的为cd206( )、cd34( )或cd3( )的细胞。不受限定地,通过培养,为cd206( )、cd34( )或cd3( )的细胞的比例扩增至1.5倍以上、2倍以上、3倍以上。不受限定地,在细胞群中,为cd206( )、cd34( )或cd3( )的细胞的合计为细胞群整体的50%以上、60%以上、70%以上、80%以上、90%以上。并且细胞群与培养前的单个核细胞的细胞群相比,包含更多为ccr2(-)的细胞。不受限定地,通过培养,为ccr2(-)的细胞的比例扩增至1.5倍以上、2倍以上、3倍以上。不受限定地,细胞群中,为ccr2(-)的细胞为细胞群整体的60%以上、80%以上、90%以上、95%以上。不受限定地,一种方式中,为cd206( )、cd34( )以及cd3( )的细胞为60%以上,并且,为ccr2(-)的细胞为95%以上。
[0061]
通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞,能够稳定地得到包含更多的cd206( )、cd34( )以及cd3( )的细胞群。并且与通过qq-mnc法得到的细胞群相比,包含抗炎症性巨噬细胞m2的cd206阳性中的cxcr4阳性细胞的比例显著增加。不受限定地,本发明者们通过所述培养,观察到了以下的效果。
[0062]
包含抗炎症性巨噬细胞m2的cd206阳性增加;
[0063]
包含血管内皮祖细胞(epc)的cd34阳性细胞、cd133阳性细胞增加;
[0064]
t细胞,特别是辅助性t细胞、血管生成性t细胞(angiogenic t细胞)等cd3阳性细胞增加。
[0065]
另一方面,观察到了作为炎症性单核细胞/巨噬细胞的ccr2阳性细胞、b细胞(cd19阳性细胞)以及nk细胞(cd56阳性细胞)有所减少。
[0066]
不受限定地,在一种方式中,通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群与通过qq-mnc法得到的细胞群相比,表现出更高的回收率。并且,生存率更高。并且,回收后的稳定性也更优
异。这些效果能够带来更高的治疗效果。
[0067]
一种方式中,在通过在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞而得到的细胞群中,与培养前的单个核细胞的细胞群相比,包含更多的cd206( )中为cxcr4( )的细胞。不受限定地,通过培养,cd206( )中为cxcr4( )的细胞的比例扩增至1.5倍以上、2倍以上、3倍以上。不受限定地,cd206( )中为cxcr4( )的细胞为50%以上、60%以上、70%以上、80%以上。在一种方式中,cd206( )中为cxcr4( )的细胞为50%以上。在一种方式中,cd206( )中为cxcr4( )的细胞为80%以上。
[0068]
本发明的细胞群与通过qq-mnc法得到的细胞群相比,特别包含更多的该cd206( )中为cxcr4( )的细胞。
[0069]
2.细胞群的取得方法
[0070]
本发明还涉及细胞群的取得方法。
[0071]
本发明的方法包含:在包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基中培养来源于骨髓、脐带血或外周血的单个核细胞。
[0072]“细胞群”、“单个核细胞”、“干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子”的各因子、“血清”、“培养基”等如上述“1.细胞群”中所说明的。
[0073]
细胞群中的、为cd206( )、cd34( )以及cd3( )的细胞的比例,为ccr2(-)的细胞的比例,cd206( )中为cxcr4( )的细胞的比例也如上述“1.细胞群”中所说明的。
[0074]
在一种方式中,通过所述方法得到的细胞群中,为cd206( )、cd34( )以及cd3( )的细胞为80%以上,并且,为ccr2(-)的细胞为95%以上。
[0075]
在一种方式中,通过所述方法得到的细胞群中,cd206( )中为cxcr4( )的细胞为50%以上。
[0076]
一种方式中,在所述方法中,培养基包含:选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的3种因子或4种因子。
[0077]
一种方式中,在所述方法中,血清为牛的血清或人类的血清。一种方式中,血清为胎牛血清。一种方式中,血清以0.5容量%以上10容量%的浓度而被包含在培养基中。
[0078]
3.治疗用组合物
[0079]
本发明还涉及缺血性疾病、炎症性疾病或难治疗性创伤的治疗用组合物。本发明的治疗用组合物包含“1.细胞群”中说明的细胞群。作为细胞群的来源的单个核细胞可以来源于使用治疗用组合物的对象(自体),也可以来源于使用治疗用组合物的对象以外的来源(异体)。
[0080]“缺血性疾病”是由于血量的减少导致组织内的血流下降,产生细胞的变性、萎缩、纤维化等组织损伤,从而引发的疾病。缺血根据其原因,大致分为阻塞性缺血、压迫性缺血、痉挛性缺血、代偿性缺血。如果缺血持续则会发生细胞的变性、萎缩、纤维化。“缺血性疾病”中包含四肢缺血、缺血性溃疡、缺血性心脏病、脑梗塞等。“脑梗塞”(或脑软化症)是由于向脑供应营养的动脉的阻塞或狭窄,导致脑缺血,脑组织由于氧或营养不足而坏死,或变为接近坏死的状态,分类为脑血栓和脑栓塞。“四肢缺血”是向手脚供给血液的动脉狭窄或阻塞
的疾病,该阻塞性动脉硬化症如果重症化,则变为重症的四肢缺血,产生疼痛等症状和难治性的溃疡,最坏的情况,可能需要截肢。不受限定地,在一种方式中,四肢为下肢。
[0081]
不受限定地,在一种方式中,缺血性疾病为四肢缺血。缺血性疾病为伴随有溃疡的四肢缺血。
[0082]“炎症性疾病”是由于某些原因而产生组织损伤等异常而引起症状的疾病的总称。炎症性疾病中包含克罗恩病、肝硬化、肝炎、溃疡性大肠炎、炎症性肠疾病等。
[0083]
所述治疗用组合物促进血管新生和/或创伤治愈。因此,可以适用于能够通过血管新生和/或创伤治愈进行治疗的疾病。作为“能够通过血管新生和/或创伤治愈治疗的疾病”,例如,可以举出缺血性疾病(例如,心肌梗塞、狭心症等缺血性心脏病、下肢缺血性动脉硬化症等下肢缺血、伯格氏病(buerge r病)、血管损伤。此外,可以用于治愈皮肤溃疡等创伤、或人工血管的制作。治疗用组合物的适用的效果可以通过本身公知的方法进行确认。例如在能够通过血管新生治疗的疾病为下肢缺血性疾病的情况下,例如可以通过调查下肢血流量以及坏死改善率来对移植后的治疗效果进行评价。血流量的增加的测定可以通过测定激光多普勒成像分析的值来进行。此外,坏死改善率可以以保肢分数(limb salvage score)的形式通过肉眼观察而测定。
[0084]
所述治疗用组合物的使用方式无特别限定。可以为作为有效成分的细胞群本身,也可以是将细胞群悬浮于液状介质而得的产物。液体介质只要是可以注入人体的液体就无特别限制,例如,可以使用等张电解质输液、磷酸缓冲液、生理盐水或作为无血清培养基的dmem等。此外,液体介质中也可以包含白蛋白等有助于细胞生存的化合物。作为包含白蛋白的化合物,可以优选地举出来源于患者的血清。此外,在冷冻保存的情况下,也可以是用冷冻细胞保存液等进行悬浮的产物。
[0085]
所述治疗用组合物的适用对象只要是需要缺血性疾病、炎症性疾病或难治疗性创伤的治疗的对象,就无特别限定。不受限定地,包含人类、猴子、黑猩猩、狗、猫、牛、马、老鼠、豚鼠等。
[0086]
4.试剂盒
[0087]
本发明还涉及用于培养来源于骨髓、脐带血或外周血的单个核细胞,并取得细胞群的试剂盒。
[0088]
所述试剂盒包含:包含选自干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子的4种以下的因子、以及血清的培养基。各因子、血清可以预先添加至培养基中,或收纳在各自的容器中,在使用时添加至培养基中。
[0089]“细胞群”、“单个核细胞”、“干细胞因子、白细胞介素6、fms样酪氨酸激酶3配体、血小板生成素以及血管内皮细胞生长因子”的各因子、“血清、“培养基”等如上述“1.细胞群”中所说明的。
[0090]
5.治疗方法等
[0091]
本发明还涉及一种缺血性疾病、炎症性疾病或难治疗性创伤的治疗方法,其包含:将“1.细胞群”中说明的细胞群适用于有需要的对象。
[0092]
本发明还涉及“1.细胞群”中说明的细胞群在缺血性疾病、炎症性疾病或难治疗性创伤的治疗方法中的使用,其包含对有需要的对象进行适用,或,在缺血性疾病、炎症性疾病或难治疗性创伤的治疗用组合物中的使用。
[0093]“缺血性疾病”、“炎症性疾病”或“难治疗性创伤”、“细胞群的适用方式”、“适用对象”等,如“3.治疗用组合物”所记载的。
[0094]
实施例
[0095]
以下,将基于实施例对本发明进行详细的说明,但本发明不限于这些实施例。本领域技术人员可以根据本说明书的记载容易地对本发明进行修饰
·
变更,这些修饰
·
变更也包含在本发明的技术范围中。
[0096]
实施例1re-01细胞群的培养
[0097]
本实施例中,从外周血分离单个核细胞并进行培养。
[0098]
(1)单个核细胞的分离
[0099]
从健康人或糖尿病患者的志愿者处,使用bd vacutainer(注册商标)cpt(商标)bd公司制)单个核细胞分离用采血管采集了100ml的外周血。采血后,就这样将采血管离心后,输送,到达后直到培养开始为止,进行了冷藏保管。将包含单个核细胞以及血浆的cpt(商标)采血管内的凝胶屏障上方的部分回收至离心管中,以少量的edta-pbs清洗凝胶屏障上方部分等采血管内,并将其回收至同一离心管中。对于回收了细胞的离心管,用edta-pbs进行增容后,进行离心分离(300
×
g,室温,15分钟),回收作为沉淀物的的细胞。就回收的细胞而言,为了除去混入的红细胞而在ack溶血缓冲液(15ml/管)(gibco,thermo-fisher公司制)中,在室温下孵育了5分钟。ack溶血缓冲液的组成为nh4cl 8290mg/l;khco
3 1000mg/l;edta.na2·
2h2o 37mg/l。然后,通过用edta-pbs增容,并离心分离(200
×
g,室温,10分钟)或(100
×
g,室温,15分钟)重复了2次回收细胞的操作。
[0100]
(2)血清培养基中的培养
[0101]
将(1)中回收的单个核细胞悬浮至1ml的增殖培养基(添加有50ng/ml ve gf
165
,20ng/ml tpo,100ng/ml flt-3配体,100单位/ml青霉素,100μg/ml链霉素,0.5%fbs的stemline(注册商标)ii hematopoietic stem cell expansion medium(sigma-aldrich公司制,cat no.s0192))中,使用其一部分进行了使用了台盼蓝的细胞数计数。以在得到的细胞增殖培养基中,细胞浓度为1
×
106/ml的方式进行制备,向6孔培养板的各孔中分别接种2ml。在通常的培养条件(37℃,5%co2)下培养了5天。5天的培养结束后,回收至离心管中,实施了3次250
×
g(~1000rpm)下7~10分钟的离心清洗。离心后,除了用于细胞数测定、生存率测定、qc(确认)试验的样品,剩余的细胞悬浮至plasmalyte a,2.5%人类白蛋白血清中,以浓度为8
×
105细胞/ml的方式进行了调整。以下,也将得到的细胞群称为“re-01”。
[0102]
实施例2re-01细胞群的特性评价
[0103]
(1)流式细胞术解析
[0104]
在本实施例中,实施例1中,对于从健康人的外周血出发,通过使用了包含3种因子以及血清的培养基的培养而得到的细胞群(称为“re-01”),为了进一步明确细胞群的特征,进行了流式细胞术解析。
[0105]
向悬浮于facs缓冲液(组成:添加了2%fbs的2mm edta-pbs)中的细胞(1.5
×
106细胞/300μl-facs缓冲液)中添加fc阻断试剂(miltenyi公司制)10μl,在4℃孵育了30分钟。将孵育后的细胞群等量地分注至各染色反应用管中(100μl/管
×
3管)。向各试样(aliquot)中分别添加一次抗体2μl,在4℃下培养20分钟。然后用1ml的facs缓冲液清洗2次,将染色了的细胞悬浮至facs缓冲液中(5
×
105细胞/200~300μl-facs缓冲液)。流式细胞术测定使用
bd facsaria(商标)iii细胞分选器(bd公司制)进行。
[0106]
具体而言,使用针对得到的细胞群中的各细胞表面标记的抗体,对各细胞表面标记的表达进行了调查。需要说明的是,针对各细胞表面标记的抗体都使用了下述的市售品。
[0107]
抗cd206抗体:pe/cy7标记抗人类cd206(mmr)抗体(biolegend公司制);
[0108]
抗cd34抗体:pe标记抗人类cd34抗体(bio legend公司制);
[0109]
抗cd3抗体:alexa fluor700标记抗cd3抗体(bio legend公司制);
[0110]
抗cxcr4抗体:apc标记抗人类cd184(cxcr4)抗体(bd公司制);
[0111]
抗ccr2抗体:percp/cy5.5标记人类cd192(ccr2)抗体(biolegend公司制)。
[0112]
结果示于图1。如图1所示,re-01在基于facs的scatter解析中,根据构成的细胞成分的尺寸(横轴:fsc)和细胞内包含的颗粒等细胞构成成分的密度(纵轴:ssc)大致分为3个活细胞集团(本说明书中,分别称为“a区域”、“b区域”、“c区域”)。在培养前的外周血单个核细胞中,只出现了a、b区域,没有观察到c区域。a区域中主要包含淋巴细胞,b区域中包含单核细胞。在通过使用了增殖培养基(实施例1的(2)血清培养基)的培养而得到的re-01中,除了血管内皮祖细胞(cd34阳性细胞)从a区域向b区域移动之外,还出现了大量包含m2巨噬细胞(cd206阳性细胞)的c区域。
[0113]
此外,从自其他健康人处采集的单个核细胞出发,通过实施例1所述的使用了包含3种因子以及血清的培养基的培养而得到的re-01的流式细胞术解析的结果示于图2。在不同个体的健康人的情况下也同样地,出现了a、b、c的3个区域。此外,为cd206( )、cd34( )或cd3( )的细胞的合计为86.57%,并且,ccr2( )为0.33%,因此为ccr2(-)的细胞为99.67%。并且,cd206( )中为cxcr4( )的细胞为92.97%。
[0114]
实施例3re-01细胞群与mnc-qq细胞群的比较
[0115]
(1)re-01与mnc-qq的培养
[0116]
将从健康人和糖尿病患者处采集的单个核细胞,以与实施例1同样的方式,进行使用了包含3种因子以及血清的培养基的培养,得到了re-01。
[0117]
作为比较例,以与re-01细胞同样的方式分离单个核细胞后,使用了stemline(注册商标)ii hematopoietic stem cell expansion medium(sigma-aldrich公司制,cat no.s0192)。不添加血清,将100单位/ml青霉素、100μg/ml链霉素和50ng/ml vegf
165
、20ng/ml tpo、100ng/ml flt-3配体、100ng/ml scf、20ng/ml il-6的5种类的各因子以无菌方式添加,从而进行了制备。以使得到的细胞在增殖培养基中为1
×
106/ml方式进行制备,向6孔培养板的各孔中分别接种2ml,在通常的培养条件(37℃,5%co2)下培养了7天。7天的培养结束后,回收至离心管中,实施了3次250
×
g(~1000rpm)下7~10分钟的离心清洗。离心后,除了用于细胞数测定、生存率测定、qc(确认)试验的样品,剩余的细胞悬浮至plasmalyte a,2.5%人类白蛋白血清中,以浓度为8
×
105细胞/ml的方式进行了制备。以下,也将得到的细胞群称为“mnc-qq”。
[0118]
(2)流式细胞术解析
[0119]
在实施例1中,对于从糖尿病患者的外周血出发,通过使用了包含3种因子以及血清的培养基的培养而得到的细胞群、和通过使用了包含所述(1)的5种因子的无血清培养基的培养而得到的细胞群(mnc-qq),进行流式细胞术,对两者进行了比较。具体而言,使用针对得到的细胞群中的各细胞表面标记的抗体,对各细胞表面标记的表达进行了调查。
[0120]
结果如图3所示。re-01与mnc-qq相比,培养后的回收率以及生存率更高。并且,作为培养后新形成的细胞群的c区域的细胞的比例更多,特别是作为承担细胞群的有效性的细胞种之一的cd206 细胞的比例更多。并且,惊人的是cd206 中的cxcr4 的比例显著更多,可以看出re-01与mnc-qq的细胞群在其细胞组成上有所不同。
[0121]
(3)acldl摄取能力
[0122]
使用在实施例1中通过糖尿病患者的外周血单个核细胞而制备的、通过使用了包含3种因子以及血清的培养基的培养而得到的细胞群(re-01),与作为比较例的、通过使用了包含5种因子的无血清培养基的培养而得到的细胞群(mnc-qq),对其acldl(乙酰化低密度脂蛋白)摄取能力进行了探讨。
[0123]
将回收至1.5ml管中的re-01或mnc-qq(1
×
105个)悬浮至基础培养基(stemline ii)500μl中,添加以alexa fluor488标记了的acldl 5μl,在37℃下孵育60分钟。向孵育结束后的管中添加facs缓冲液1ml,并倒转混和。然后,进行5分钟的离心操作(250
×
g,4℃),将细胞以沉淀的形式回收。将回收的细胞(re-01)悬浮至300μl的facs缓冲液中,在冰中冷却保存至测定。在即将测定前添加dapi(2μl),通过使用了流式细胞仪的测定,求出了摄取了acldl和dapi的细胞的比例。
[0124]
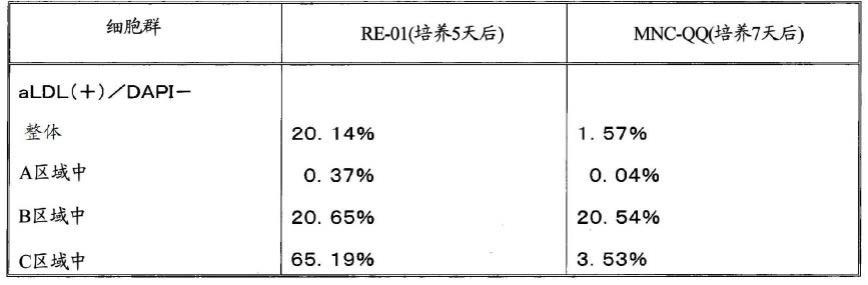
结果示于以下的表1。
[0125]
[表1]
[0126][0127]
如表1所示,可以看出,整体,特别是c区域中acldl的摄取较高。这一点也佐证了:对于2个细胞群(re-01以及mnc-qq)而言,实施例2中所示的组成的不同会带来功能的不同。
[0128]
(4)血管形成能力
[0129]
在本实施例中,使用对于从健康人的血液中采集的单个核细胞,以与实施例1同样的方法使用血清培养基培养而得到的细胞群(re-01),对其血管形成能力进行了探讨。作为比较例,使用了通过使用了包含5种因子的无血清培养基的培养而得到的细胞群(mnc-qq)。将具有管腔形成能力的人类脐带静脉内皮细胞(huvec)(从lonza公司,瑞士,巴塞尔处获得)以8~10传代的形式使用,将各群的细胞和huvec共培养。向96孔的板中分注基底膜基质(corning(注册商标)matrigel(注册商标)(corning公司制,美国,ny))50μl/孔,在37℃下,镀层30分钟。另一方面,为了用dii-ac-ldl标记各细胞群,将其悬浮于imdm 500μl dii-ac-ldl 5μl中,在37℃下,孵育1小时。
[0130]
标记后,以使各细胞群为1
×
103/20μl,以及,使huvec为5
×
103/20μl的方式,分别再悬浮至pbs中。将调整了细胞数的悬浮液以使试验细胞群与huvec为1:1的方式进行混和,向matrigel中分别添加50μl。在37℃、5%co2下,10小时以上,在延时荧光显微镜(olympus
vegf
165
,20ng/ml tpo,100ng/ml flt-3配体,100单位/ml青霉素,100μg/ml链霉素,0.5%fbs,0.5%人类白蛋白血清的iscove’s modified dulbecco’s medium(imdm))中,使用其一部分进行了使用了台盼蓝的细胞数计数。以在得到的细胞增殖培养基中,细胞浓度为1
×
106/ml的方式进行制备,向6孔培养板的各孔中分别接种2ml。在通常的培养条件(37℃,5%co2)下培养了5天。5天的培养结束后,回收至离心管中,实施了3次250
×
g(~1000rpm)下7~10分钟的离心清洗。离心后,除了用于细胞数测定、生存率测定、qc(确认)试验的样品,剩余的细胞悬浮至plasmalyte a,2.5%人类白蛋白血清中,以浓度为8
×
105细胞/ml的方式进行了调整。
[0144]
(3)流式细胞术解析
[0145]
在本实施例中,对于(1)、(2)中,将从重症下肢缺血的患者外周血中分离的单个核细胞通过使用了包含3种因子以及血清的培养基的培养而得到的细胞群(以与实施例1同样地称为“re-01”),为了进一步明确细胞群的特征,进行了流式细胞术解析。
[0146]
向悬浮于facs缓冲液(组成:添加了2%fbs的2mm edta-pbs)中的细胞(1.5
×
106细胞/300μl-facs缓冲液)中添加fc阻断试剂(miltenyi公司制)10μl,在4℃孵育了30分钟。将孵育后的细胞群等量地分注至各染色反应用管中(100μl/管
×
3管)。向各试样(aliquot)中分别添加一次抗体2μl,在4℃下培养20分钟。然后用1ml的facs缓冲液清洗2次,将染色了的细胞悬浮至facs缓冲液中(5
×
105细胞/200~300μl-facs缓冲液)。流式细胞术测定使用bd facsaria(商标)iii细胞分选器(bd公司制)进行。
[0147]
具体而言,使用针对得到的细胞群中的各细胞表面标记的抗体,对各细胞表面标记的表达进行了调查。需要说明的是,针对各细胞表面标记的抗体都使用了下述的市售品。
[0148]
抗cd206抗体:pe/cy7标记抗人类cd206(mmr)抗体(biolegend公司制);
[0149]
抗cd34抗体:pe标记抗人类cd34抗体(bio legend公司制);
[0150]
抗cd3抗体:alexa fluor700标记抗cd3抗体(bio legend公司制);
[0151]
抗cxcr4抗体:apc标记抗人类cd184(cxcr4)抗体(bd公司制);
[0152]
抗ccr2抗体:percp/cy5.5标记人类cd192(ccr2)抗体(biolegend公司制)。
[0153]
结果示于图5。如图5所示,即使是培养从重症下肢缺血的患者外周血中分离的单个核细胞而得的细胞群,也与实施例2同样地出现了a、b、c的3个区域。此外,为cd206( )、cd34( )或cd3( )的细胞的合计为83.72%,并且,ccr2( )为1.63%,因此为ccr2(-)的细胞为98.37%。并且,cd206( )中为cxcr4( )的细胞为83.72%。
[0154]
综上所述,可以看出,即使是来源于重症下肢缺血的患者,也与实施例1的健康人或糖尿病患者同样地,可以通过使用了包含3种因子以及血清的培养基的培养而得到re-01细胞群,特别是,为cd206( )、cd34( )或cd3( )的细胞的合计为80%以上,为ccr2(-)的细胞为95%以上,并且,cd206( )中为cxcr4( )的细胞为80%以上的re-01细胞群。
[0155]
工业实用性
[0156]
通过本发明,可以提供一种具有高血管再生能力以及创伤治愈能力的新型细胞群。本发明的细胞群例如可作为难治的四肢缺血疾病的患者的治疗药而使用。由此,例如,能够避免截肢等,带来患者qol的提高,看护负担的轻减等生活创新,社会意义极大。此外,新型的细胞群的提供在带来新治疗战略的构建的同时,也可能带来对血管病变整体的新发现。并且,令人震惊的是,该细胞群在高有效性的基础上,与既存的qq-mnc法相比,还在较短
培养期间内稳定地达成了较高的回收率和生存率,且在制造后也更为稳定,因此在工业上也具有非常大的优势。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。