1.经修饰的肽作为药物相关化合物越来越受到关注。修饰例如脂肪酸或桥接分子以诱导肽大环化合物增强了期望肽序列的药代动力学,同时防止被体内蛋白酶降解。因此,肽修饰是现代肽治疗剂的一个关键特征。然而,这些修饰的引入通常很困难,并且使得经修饰的肽的处理和纯化非常困难或不可能。特别是因为已经为未经修饰的肽开发和建立了最先进的纯化方法。
背景技术:
2.通过固相肽合成(spps)生产肽是在可预见的时间范围内获得大批不同肽或获得更大量的单一肽的强大又快速的方法。因此,其被广泛用于制造更多数目或大量的肽。该程序由以下组成:将第一个n-末端保护的氨基酸偶联至合成树脂,然后重复以下循环:n-末端去保护、偶联下一个n-末端保护的氨基酸以及将未反应的肽序列封端。最后,将合成的肽从合成树脂上裂解下来并纯化。这些直链肽可以进一步修饰以改善它们的特性。
3.由于被蛋白酶和肽酶快速降解,直链未经修饰的肽显示出低的体内稳定性。此外,它们在哺乳动物体内表现为没有细胞渗透性和快速肾脏清除率(witt et al.(2001),peptides(22),2329-43)。主要使用两种修饰来改善体内肽的稳定性和效力:利用脂肪酸脂化和直链肽环化以形成大环。
4.脂化是肽类药物最重要的修饰之一。连接到肽的脂肪酸会影响它们的疏水性、二级结构和它们的聚集行为,同时保持它们对蛋白质靶标的特异性。脂肪酸增强代谢稳定性、膜渗透性、生物利用度,并改变经修饰的肽的药代动力学和药效学特性(l.zhang,g.bulaj(2012)current medicinal chemistry 19(11),1602-18)。药物实例包括glp-1受体激动剂,诸如利拉鲁肽(liraglutide)司马鲁肽(semaglutide)和胰岛素衍生物,诸如地特胰岛素(detemir)和德谷胰岛素(degludec)所有这些都在赖氨酸侧链上带有脂肪酸。脂化药物的脂肪酸可以通过三个高亲和力结合结构域与白蛋白相互作用并结合。除了在生物体中不同的循环时间外,连接的白蛋白对这些脂化肽具有保护作用。
5.大规模生产脂化药物的方法目前取决于两个主要步骤:首先,生物步骤,其中由合适的细胞系(主要是酵母)表达前体肽。其次,在回收和纯化前体肽后,在较高ph的溶液中通过化学手段实现与脂肪酸或脂肪酸间隔基构建单元的酰化,然后是最终纯化步骤。在药物开发的早期阶段,固相肽合成被用于合成大量的候选脂化药物。脂质酰化主要通过使用正交保护基团策略来实现。传统上,在spps过程中,将正交保护的赖氨酸残基并入肽序列中。选择性分离该保护基团,并通过将预先或原位活化的脂质添加到固定在合成树脂上的其他保护肽中来引入脂质。替代地,肽可以在经由化学或生物手段生产后在溶液中脂化。无论是必须采用选择性酰化技术还是n-末端必须被正交保护并且必须在成功脂化后去保护。
6.与直链肽相比,环肽都具有许多优点。它们对外切蛋白酶和内切蛋白酶二者的耐受性明显更强。此外,它们对期望蛋白质靶标表现出卓越的结合亲和力,最可能是因为它们对靶标受体表现出更严格和拱形的结合动机。成功的环肽药物是抗癌药物奥曲肽(octreotide)免疫抑制剂环孢素或神经肽激素催产素(或其他)。形成肽环的方法可以分为两大类:a)单组分系统,其中肽可以通过利用其内在官能团来环化以形成由例如酰胺或二硫化物连接的环。通过并入非天然氨基酸,可以产生其他共价连接。b)双组分系统,其中肽的官能团用于与桥接支架的反应。可以使用有机分子与肽一起形成单、双或多环。最常见的方法是利用肽的亲核官能团,特别是硫醇,以使其与带有亲电子反应点的支架反应。当使用spps时,肽在合成树脂上环化,或在肽从合成树脂上分离后在溶液中环化。这两种方法都有其缺陷。固体载体上的修饰需要正交保护的氨基酸,这很昂贵,并且在修饰前需要额外的去保护步骤。一旦去保护,在固体载体上的伪超高稀释有助于防止一个支架与两个或更多个直链肽发生不希望的反应。此外,可以使用过量的试剂,因为其可以容易地被洗掉。在溶液中环化的缺点是会发生副反应,诸如两个直链肽通过一个支架桥接,并且去除多余的试剂很麻烦。因此,修饰在高度稀释的溶液中进行,其中使用一当量的支架。
7.已经公开了许多用于溶液中肽修饰的方法;在本发明的上下文中,将仅讨论使用附着于固体载体的肽以能够修饰肽的那些公开内容。
8.wo/2004/077062使用膜作为固体载体来合成许多作为候选药物的期望肽。在多肽的标准spps和保护基团去除之后,添加分子支架,例如三(溴甲基)苯,以使所述载体上的肽环化。因此,环化的肽用于筛选与蛋白质的结合。这种方法不能用于药物发现以外的其他方式,因为产生的肽仍然与在其上产生它们的合成载体共价结合。因此,不可能在结合测试之前分析肽。因此,研究必须相信所有预先形成的步骤都产生了预期的环肽,导致出现假阳性和甚至更可能的假阴性结果的可能性。
9.(wo2009/098450和heinis et al.(2009),nat chem biol 5(7),502-7)公开了一种修饰已由噬菌体合成并展示在噬菌体表面的肽的方法。因此产生了在其序列中具有三个半胱氨酸残基的大肽文库,并且用三-(溴甲基)苯(tbmb)溶液处理噬菌体以将展示的肽环化为双环。然后将噬菌体与生物素化的靶蛋白一起孵育,并进行进一步的筛选轮。在噬菌体滴度增加后,对噬菌体的dna进行测序以推导出选定的序列。除了大量的双环肽变体(4.4x109)之外,该方法用于合成目的的缺点是不能将其用于生产肽。其仅具有诊断用途。在诊断方面也有缺点,即无法分析进行结合实验的肽,导致出现假阳性和甚至更可能的假阴性结果的可能性。
10.(bellmann-sickert et al.(2011)j med chem 54(8),2658-67和vil
à
et al.(2013)org biomol chem 11,3365-74)公开了一种方法,其中利用赖氨酸残基的正交保护在合成树脂上合成肽,在选择性去保护后,将脂肪酸与保护的肽偶联。然而,必须使用昂贵的构建单元,并且获得了已经被脂肪酸修饰的粗肽,由于通常溶解度差,使得处理和纯化变得困难。
11.为了克服现有技术存在的缺点,即缺乏分离和分析经修饰的肽以及使用没有正交保护的标准氨基酸构建单元,本发明利用了接头分子,其能够固定肽前体并随后当它们固
定在纯化/修饰固体载体上时修饰肽。与其他方法尤其是在溶液中使用修饰的那些相比,本发明同时去除了干扰的截短肽和过量的用于修饰的有机分子,并因此是用于修饰并同时纯化期望肽的方法。
技术实现要素:
12.本发明的第一方面涉及用于修饰和纯化肽的方法。所述方法包括以下步骤:
[0013]-提供粗接头标记的肽l-p,其中粗肽与接头分子l共价结合,
[0014]-在固定步骤中,将所述接头标记的肽l-p偶联到固体载体上,产生固定的接头标记的肽s-l-p,
[0015]-在修饰步骤中,用一种或多种有机分子修饰所述固定的接头标记的肽s-l-p,产生固定的接头标记的肽s-l-mp,
[0016]-在释放步骤中,添加还原剂产生还原的中间体ri,并且随后分解所述还原的中间体ri,产生经修饰的肽mp,
[0017]
其中所述接头l是式1的化合物,x-t
b-v
a-u-y-z(1),其中
[0018]-x选自式2、2a、3、3a或4的部分(moiety),特别是式2、2a、3或3a的部分,更特别是式2或2a的部分,
[0019]
其中,
[0020]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0021]-r3选自h或b,
[0022]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0023]-b是酸不稳定的胺保护基团,
[0024]-t是直链或支链间隔基,其中b是0或1,
[0025]-v是吸电子部分,其中a是0或1,其中a和b之和为1或2,
[0026]-u是苯基或五元或六元杂芳基部分,其与部分v、wq和en中的至少一个结合并且可以任选地被c
1-6-烷基取代,其中
[0027]-w选自-n3、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-o-c(=o)-o-ch
2-n3、-n=n-苯基、-n=n-r8、
[0028]
其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,其中q是0、1、2、3或4,
[0029]-e是酸性条件下的吸电子基团,其中n是0、1、2、3或4,
[0030]-y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,其中m是1、2或3,
[0031]-z是吸电子离去基团。
[0032]
在某些实施方式中,所述用于修饰和纯化肽的方法包括以下步骤
[0033]-提供粗接头标记的肽l-p,其中粗肽与接头分子l共价结合,
[0034]-在固定步骤中,将所述接头标记的肽l-p偶联到固体载体上,产生固定的接头标记的肽s-l-p,
[0035]-在修饰步骤中,用一种或多种有机分子修饰所述固定的接头标记的肽s-l-p,产生固定的接头标记的肽s-l-mp,
[0036]-在释放步骤中,添加还原剂产生还原的中间体ri,并且随后分解所述还原的中间体ri,产生经修饰的肽mp,
[0037]
其中所述接头l是式1的化合物,x-t
b-v
a-u-y-(1),其中-x选自式2、2a、3、3a或4的部分,特别是式2、2a、3或3a的部分,
[0038]
更特别是式2或2a的部分,
[0039]
其中,
[0040]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0041]-r3选自h或b,
[0042]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0043]-b是酸不稳定的胺保护基团,
[0044]-t是直链或支链间隔基,其中b是0或1,
[0045]-v是吸电子部分,其中a是0或1,其中a和b之和为1或2,
[0046]-u是苯基或五元或六元杂芳基部分,其与部分v、wq和en中的至少一个结合并且可以任选地被c
1-6-烷基取代,其中
[0047]-w选自-n3、-no2、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、
[0048]-o-c(=o)-o-ch
2-n3、-n=n-苯基、-n=n-r8、
[0049]
其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或
[0050]-(ch2)
p-nme2,其中q是0、1、2、3或4,特别地其中q是1、2、
[0051]
3或4,
[0052]-e是酸性条件下的吸电子基团,其中n是0、1、2、3或4,
[0053]
在u是苯基部分且y是-(ch2)
m-o-c(=o)-的情况下,在酸性条件下v、w、e的哈米特常数之和大于0.45,并且其中
[0054]-w相对于y在邻位或对位,y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,
[0055]
其中m是1、2或3。
[0056]
在某些实施方式中,x选自式2、3或4的部分,特别是式2或3,更特别地x是式2,
[0057]
通过固相肽合成获得的肽通常在从合成树脂上裂解下来后进行纯化。取决于预期用途,例如作为肽药物或候选药物,肽可以被进一步修饰。如上所述,本发明允许在同一树脂上进行肽修饰和纯化,而无需使用正交保护策略来修饰氨基酸。本发明概括在图1中。
[0058]
在本发明的上下文中,术语“氨基酸”涉及包含至少一个胺部分和至少一个羧基部分的分子。特别是当在肽的上下文中使用时,术语“氨基酸”涉及α-氨基酸,也称为α-氨基酸或2-氨基酸,具有通式h2nchrcooh(游离氨基酸)或-hnchrcoo-(肽中的氨基酸),即胺和羧酸部分连接到第一个(α-)碳原子。r表示氨基酸的侧链。术语“氨基酸”涉及α-氨基酸的d-或l-异构体,特别是l-异构体。特别地,不是α-氨基酸而是上述广义上的氨基酸的部分在本说明书中通过特定的式描述。
[0059]
在于合成载体例如合成树脂上进行固相肽合成后,得到粗肽p。虽然仍与合成树脂结合,但粗肽可偶联至式1的无痕可裂解接头分子l。
[0060]
式1的接头分子适于纯化固相肽合成(spps)后的肽。
[0061]
用于使用接头分子纯化spps后的肽的常用方法是在最后的偶联步骤中将接头分子偶联至肽的n-末端。在该偶联步骤中,肽的n-末端将亲核攻击接头分子以与接头的部分y形成共价的氨基甲酸酯或酰胺键,同时释放吸电子离去基团z。替代地,肽的氨基酸侧链的合适部分诸如
–
nh2或-oh可用于将接头分子偶联至肽。如果n-末端通过本文所述的方法被修饰,则可以使用此选项。用于将接头偶联至氨基酸侧链的合适氨基酸是赖氨酸或丝氨酸。
[0062]
随后,通过添加tfa将肽-接头-构建体从合成树脂上裂解下来。如果部分x包含酸不稳定的胺保护基团b,则通过添加tfa同时除去部分b。
[0063]
当肽-接头构建体例如通过使用tfa被裂解下来时,根据本发明的接头在酸性条件下是稳定的。
[0064]
接头的部分x可以偶联至在纯化期间使用的官能化的固相,诸如树脂。部分x可以
通过与官能化的固相的合适部分(诸如醛、酮、氨基-氧基或肼)反应形成腙键或肟键。
[0065]
部分t表示在通常应用的纯化条件下是非反应性的间隔基。
[0066]
部分t直接或经由部分v结合到部分u。
[0067]
部分u有助于接头分子在酸性条件(特别地tfa》50%,在水存在下,ph《0)下的稳定性。这是通过使用结合至吸电子部分e、w和v中的至少一个的杂环部分或苯基部分来实现的。
[0068]
如果将吸电子部分(e、w、v)附连至苯基部分,则与肽连接的接头分子的苄基位置获得较小的电子密度,并且因此较不容易受到酸催化的降解的影响。为了使本发明的接头分子在酸性条件下具有足够的稳定性,必须满足一定的吸电子阈值。该阈值表示为酸性条件下v、w、e的哈米特常数(ζm和ζ
p
)之和大于0.45。哈米特常数根据hansch and taft(1991),chem.rev.91:165-195计算。正的哈米特常数反映了取代基对苯基部分施加吸电子作用的能力,而负值表示取代基施加给电子作用。
[0069]
哈米特常数是苯甲酸衍生物间位(ζm)和对位(ζ
p
)的苯基核的取代基导致不同的酸度(pka)的凭经验确定的常数。在本发明的上下文中,相对于结合的部分y确定位置。对于邻位的取代基,对位的哈米特值是良好的近似值,并且因此在本发明的上下文中用于计算取代基v、w和e的哈米特值之和。
[0070]
值得注意的是,在酸性条件下计算取代基v、w和e的哈米特常数。例如,胺部分在中性ph下特征在于哈米特常数ζm=-0.16并且ζ
p
=-0.66,并且因此为推电子取代基。在酸性条件下,胺部分被质子化。对于质子化的胺,哈米特常数是ζm= 0.86并且ζ
p
= 0.60,表明质子化的胺是吸电子取代基,这还包括能够通过共轭π系统以其质子化形式从u吸出电子的芳香族胺,无论是直接作为u上的取代基还是在u的π共轭中。
[0071]
哈米特常数之和的阈值大于0.45适用于u是苯基部分且y是-(ch2)
m-o-c(=o)-,其中m=1,因为-o-c(=o)-构成苄基位置中的良好的离去基团,有助于酸催化的降解。因此,芳环中的电子密度应足够低,以防止y中的苄基位置的阳离子稳定。
[0072]
如果部分y是-(ch2)
m-c(=o)-,则该阈值不是必需的,因为-c(=o)-在苄基位置不是良好的离去基团。
[0073]
为了包括杂环部分u的接头分子在酸性条件下的稳定性,选择特定部分v、w和e的这样的额外阈值不是必需的。由于杂环部分本身与苯基部分相比更加缺电子,因此v、w和e的任何组合似乎对于接头分子在酸性条件下的稳定性均足够。尤其是当u是含氮杂环时,在肽的酸性释放期间氮将被质子化,从而使u的芳香族系统的电子密度尤其低。因此,不能稳定苄基阳离子。
[0074]
部分y是-c(=o)-或-o-c(=o)-部分。在偶联接头分子时,在接头分子与肽的n-末端之间形成酰胺(-c(=o)-nh-)或氨基甲酸酯(-o-c(=o)-nh-)部分。纯化之后,肽通过1.4或1.6消除或亲核攻击在还原性条件下从接头分子中释放,并因此从纯化介质中释放。还原性刺激将w转化为其还原版本,现在起给电子基团和亲核试剂的作用,从而使肽能够释放。
[0075]
在从合成树脂上裂解后,提供了接头标记的肽l-p。
[0076]
在某些实施方式中,通过以下提供接头标记的肽l-p:将已在合成载体sr上合成的粗肽p与接头l连接,产生接头标记的、负载的粗肽l-p-sr,然后从合成载体sr上裂解接头标记的肽l-p,产生接头标记的肽l-p。
[0077]
在某些实施方式中,通过以下提供接头标记的肽l-p:将已在合成载体sr上合成的粗肽p与游离接头lf通过释放吸电子离去基团z连接,产生接头标记的、负载的粗肽l-p-sr,其中lf是接头x-t
b-v
a-u-y-z,其中x、t、b、v、a、u和y如上文所定义,并且z是吸电子离去基团,然后从合成载体sr上裂解接头标记的肽l-p,产生接头标记的肽l-p。
[0078]
在某些实施方式中,lf是接头x-t
b-v
a-u-y-z,其中x选自式2、2a、3、3a和4,并且其中t、b、v、a、u和y如上文所定义。
[0079]
在某些实施方式中,游离接头lf可偶联至粗肽p的n末端或偶联至肽p的氨基酸侧链的游离胺或羟基。
[0080]
在某些实施方式中,游离接头lf可偶联至粗肽p的n末端,或偶联至选自赖氨酸、鸟氨酸、α-氨基甘氨酸、α,γ-二氨基丁酸、α,β-二氨基丙酸、2,6-二氨基-4己炔酸、β-(1-哌嗪基)丙氨酸、4,5-脱氢赖氨酸和d-羟基赖氨酸,特别是选自赖氨酸和鸟氨酸的氨基酸的侧链中的胺,或者偶联至选自丝氨酸、酪氨酸和苏氨酸的氨基酸的侧链中的羟基部分。
[0081]
在某些实施方式中,游离接头lf可偶联至粗肽p的n末端或偶联至赖氨酸侧链中的胺或偶联至丝氨酸侧链中的羟基部分。
[0082]
在某些实施方式中,游离接头lf可偶联至粗肽p的n末端。
[0083]
由于离去基团z在将接头l偶联至粗肽的n末端时被释放,因此接头标记的、负载的粗肽包含部分x-t
b-v
a-u-y-p-sr,并且释放的接头标记的肽包含部分x-t
b-v
a-u-y-p。
[0084]
在常用的酸性条件下进行从合成载体释放接头标记的肽。与现有技术的接头分子相比,式1的接头在酸性条件诸如tfa条件下是稳定的。在该步骤中仅去除了部分x的酸不稳定的胺保护基团b。
[0085]
在某些实施方式中,在酸性条件下实现接头标记的肽l-p-的裂解。
[0086]
在某些实施方式中,通过使用tfa、hbr、hcl或乙酸实现接头标记的肽l-p-的裂解。
[0087]
使用技术人员已知的标准方法将接头标记的肽固定在固体载体诸如纯化树脂上。合适的固体载体包含官能团,诸如醛、酮、氨基-氧基或肼部分。该官能团与接头的部分x形成肼键或肟键。
[0088]
如上所述,肽通常在合成树脂上合成,并且接头在仍与合成树脂结合的同时与肽偶联。随后,通过添加tfa从合成树脂上裂解下接头标记的肽,其中部分x的酸不稳定的保护基团b被同时去除。如果肽是在溶液中合成的,或者如果提供没有与合成载体sr结合的肽,则在固定步骤中将接头标记的肽l-p偶联到固体载体之前,通过使用如上所述的酸去除酸不稳定的保护基团b。
[0089]
在某些实施方式中,在酸性条件下去除酸不稳定的保护基团b,并且在固定步骤中将接头标记的肽l-p偶联至固体载体以产生固定的接头标记的肽s-l-p。
[0090]
为了固定接头标记的肽,可以使用合适的醛修饰的珠,诸如琼脂糖或羟基化聚(丙烯酸甲酯)珠。特别地,对于修饰诸如二硫化物形成或硫醚装订,使用羟基化聚(丙烯酸甲酯)珠或琼脂糖,特别是羟基化聚(丙烯酸甲酯)珠。
[0091]
在某些实施方式中,固体载体是醛修饰的。
[0092]
在某些实施方式中,固体载体是醛修饰的并且选自琼脂糖、羟基化聚(丙烯酸甲酯)、聚(丙烯酸缩水甘油酯)、聚(甲基丙烯酸缩水甘油酯)、聚赖氨酸、聚乙二醇、聚酰胺、聚丙烯酰胺、聚苯乙烯和这些的共聚物。
[0093]
在某些实施方式中,固体载体是醛修饰的并且选自琼脂糖和羟基化聚(丙烯酸甲酯)珠。
[0094]
在某些实施方式中,固定步骤在ph《5,特别地在ph 3-4,更特别地在ph 3.5下进行。
[0095]
在某些实施方式中,固定步骤在dmso/柠檬酸钠/盐酸胍中、在tfa/水中、在六氟异丙醇(hfip)中或在三氟乙醇中进行,特别是在dmso/柠檬酸钠/盐酸胍中、在tfa/水中或在hfip中进行。
[0096]
在某些实施方式中,固定步骤在ph 3.5的具有8m盐酸胍的dmso/柠檬酸钠中、在tfa含量为40-95%的tfa和水中、在六氟异丙醇(hfip)中和在三氟乙醇中进行。
[0097]
在某些实施方式中,固定步骤在ph 3.5的具有8m盐酸胍的dmso/柠檬酸钠(9:1)、tfa/水(1:1)、tfa/水(83:27)和hfip中进行。
[0098]
随后,可以在修饰步骤中对肽进行修饰(见下文)。
[0099]
最后,经由还原的中间体ri释放具有游离n末端的经修饰的肽mp。
[0100]
在某些实施方式中,释放步骤中的还原剂选自三苯基膦、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、三甲基膦、三乙基膦或三(2-羧乙基)膦,特别是二硫苏糖醇、二硫赤藓糖醇或三苯基膦。
[0101]
在某些实施方式中,释放步骤中的还原剂选自三苯基膦、二硫苏糖醇(dtt)、三甲基膦、三乙基膦或三(2-羧乙基)膦。
[0102]
在某些实施方式中,释放步骤中的还原剂是三苯基膦或二硫苏糖醇。
[0103]
还原的中间体ri分解以释放具有游离n末端的经修饰的肽mp。
[0104]
如上所述,部分u、v、w和e有助于接头在酸性条件下的稳定性。例如,包含含有胺或杂环诸如吡啶的部分u或v的接头在酸性条件(特别地tfa》50%,在水存在下,ph《0)下是稳定的,因为胺或杂环被质子化。此外,质子化接头改善了接头-肽复合物的溶解度。如果ph高于接头的pka,则接头将在所期望的肽释放期间中作为最后步骤迅速分解。
[0105]
在某些实施方式中,还原的中间体ri通过ph改变而分解。
[0106]
在某些实施方式中,还原的中间体ri通过将ph改变至高于接头的pka的ph而分解。
[0107]
在某些实施方式中,还原的中间体ri通过将ph改变至低于接头还原期间所使用的ph的ph而分解。例如,通过在ph 8下添加还原剂获得还原的中间体ri。随后,还原的中间体在ph《8,特别地在-0.7至0.7之间的ph下分解。
[0108]
如上所述,主要使用两种修饰来改善体内肽的稳定性和效力:利用脂肪酸脂化和直链肽环化以形成大环。
[0109]
脂化涉及脂肪酸与肽的偶联。这种修饰会影响肽的疏水性、二级结构和聚集行为。此外,可以增强肽的代谢稳定性和膜渗透性。
[0110]
肽可由天然和/或非天然氨基酸构成。如果肽的氨基酸在其侧链中包含亲核胺,则其可以与有机分子的羧酸部分(例如脂肪酸的羧酸部分)形成酰胺键。
[0111]
在某些实施方式中,肽包含含有至少一个亲核胺的氨基酸。
[0112]
在某些实施方式中,肽包含在氨基酸侧链中含有至少一个亲核胺的氨基酸,或者亲核胺是肽的n-末端,即肽序列的第一个残基。形成n-末端的氨基酸可以是任何氨基酸。
[0113]
在某些实施方式中,肽包含选自以下的氨基酸:赖氨酸、鸟氨酸、α-氨基甘氨酸、α,
γ-二氨基丁酸、α,β-二氨基丙酸、2,6-二氨基-4己炔酸、β-(1-哌嗪基)丙氨酸、4,5-脱氢赖氨酸和d-羟基赖氨酸。
[0114]
在某些实施方式中,肽包含在氨基酸侧链中含有至少一个亲核胺的氨基酸,其中该氨基酸选自赖氨酸、鸟氨酸、α-氨基甘氨酸、α,γ-二氨基丁酸、α,β-二氨基丙酸、2,6-二氨基-4己炔酸、β-(1-哌嗪基)丙氨酸、4,5-脱氢赖氨酸和d-羟基赖氨酸。
[0115]
在某些实施方式中,肽包含选自赖氨酸和鸟氨酸的氨基酸。
[0116]
用于肽的脂化的有机分子可以是脂肪酸(fa-oh)或活化的脂肪酸(fa-a)。脂肪酸或活化的脂肪酸通过形成酰胺与亲核胺偶联。脂肪酸也可以经由一个或多个另外的接头/间隔基部分sp与亲核胺连接。同样在此,起始材料可以是脂肪酸-接头/间隔基化合物fa-sp
n-oh或活化的脂肪酸-接头/间隔基化合物fa-sp
n-a。部分fa和sp通过酰胺键连接。接头/间隔基sp-oh或活化的接头/间隔基sp-a也在酰胺化反应中与肽的亲核体偶联。在多个接头/间隔基部分sp的情况下,接头/间隔基部分通过酰胺键彼此连接。
[0117]
在某些实施方式中,有机分子是式5a、5b、5c或5d,特别是5a或5c的化合物,
[0118]
fa-sp
n-a(5a),fa-sp
n-oh(5b),fa-a(5c),或fa-oh(5d),其中
[0119]-fa是
–
c(=o)-c
1-24-烷基或
–
c(=o)-c
2-24-烯基,特别是
–
c(=o)-c
5-17-烷基或
–
c(=o)-c
5-17-烯基,更特别是
–
c(=o)-c
5-17-烷基,其中烷基或烯基部分可以未被取代或被一个或多个独立地选自-f和
–
cooh的取代基取代,
[0120]-sp是包含2至50个原子长度、末端-c(=o)-部分和-nh-部分的间隔基,其中间隔基经由-nh-部分连接到fa,
[0121]-n是1和10之间的整数,
[0122]-a选自:-f、-cl、-br、-i、-n3、-o(c=o)ch2(c=o)oh、-sr
14
、-ocf3、-och2cf3、-oso2cf3、-so2c6h4ch3、-so2cf3、-so2ch3、
[0123][0124]
特别地,-cl、更特别地
[0125]-其中r
14
是c
1-c
6-烷基-、芳基-或苄基取代基。
[0126]
在某些实施方式中,有机分子是式5a、5b、5c或5d,特别是5a或5c的化合物,
[0127]
fa
x-sp
n-a(5a),fa
x-sp
n-oh(5b),fa-a(5c),或fa-oh(5d),其中
[0128]-fa是
–
c(=o)-c
1-24-烷基或
–
c(=o)-c
2-24-烯基,特别是
–
c(=o)-c
5-17-烷基或
–
c(=o)-c
5-17-烯基,更特别是
–
c(=o)-c
5-17-烷基,其中烷基或烯基部分可以未被取代或被一个或多个独立地选自-f和
–
cooh的取代基取代,
[0129]-sp是包含2至50个原子长度、任选的末端-c(=o)-部分和x个独立地选自-nh-、-o-、-s-的连接部分的间隔基,其中所述间隔基经由所述连接部分连接到fa,
[0130]-x是1和5之间的整数,特别是1和3之间的整数,
[0131]-n是1和10之间的整数,特别是1和4之间的整数,更特别是1和2,
[0132]-a选自:-f、-cl、-br、-i、-n3、-o(c=o)ch2(c=o)oh、-sr
14
、-ocf3、-och2cf3、-oso2cf3、-so2c6h4ch3、-so2cf3、-so2ch3、
[0133][0134]
特别地,-cl、-br、-i、更特别地,-cl、-br、-i,
[0135]
其中r
14
是c
1-c
6-烷基-、芳基-或苄基取代基。
[0136]
在某些实施方式中,a是
[0137]
间隔基sp的末端-c(=o)部分连接到a或-oh。
[0138]c1-24-烷基部分和c
2-24-烯基部分可以是直链或支链的。c
2-24-烯基部分包含一个或多个碳-碳双键,特别地一个碳-碳双键。
[0139]
在某些实施方式中,fa的烷基或烯基部分是直链或支链的。
[0140]
在某些实施方式中,fa的烷基或烯基部分是直链的。
[0141]
在某些实施方式中,fa衍生自棕榈酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、硬脂酸、硬脂二酸、全氟辛酸、全氟癸酸、全氟月桂酸、全氟肉豆蔻酸,更特别地棕榈酸。如上所述,部分fa包含羰基部分。该羰基部分衍生自本文所述酸的羧酸部分。
[0142]
部分fa可包含一个或多个取代基。例如,部分fa可以衍生自全氟脂肪酸。在这种情况下,fa的烷基或烯基部分完全被-f取代。部分fa也可以衍生自脂肪二酸。在这种情况下,fa的烷基或烯基部分的末端甲基部分(ω碳)被一个-cooh部分取代。
[0143]
在某些实施方式中,部分fa是未取代的,部分fa被-f完全取代,或部分fa包含一个取代基-cooh。
[0144]
在某些实施方式中,部分fa是未取代的,部分fa被-f完全取代或部分fa在ω碳处包含一个取代基-cooh。
[0145]
在某些实施方式中,部分fa是未取代的或部分fa被-f完全取代。
[0146]
在某些实施方式中,部分fa是未取代的或部分fa包含一个取代基-cooh,特别是在ω碳处的一个取代基-cooh。
[0147]
在某些实施方式中,部分fa是未取代的或部分fa包含取代基-cooh或-cootbu,特别是-cootbu。
[0148]
在纯化/修饰后,
–
cootbu已被去除,并且部分fa被
–
cooh取代。
[0149]
在某些实施方式中,部分fa是未取代的或部分fa在ω碳处包含取代基-cooh或-cootbu,特别是-cootbu。
[0150]
在某些实施方式中,部分fa在ω碳处包含取代基-cooh或-cootbu,特别是-cootbu。
[0151]
在某些实施方式中,部分fa是未取代的
[0152]
间隔基sp可以衍生自天然或非天然氨基酸。如上所述,间隔基通过酰胺键与部分fa连接,并且还通过酰胺键与其他间隔基部分sp或肽的亲核胺连接。与部分fa的酰胺键是通过氨基酸的n-末端胺或氨基酸侧链中的胺与脂肪酸fa-oh的羧酸部分或fa-a的活化的羧酸部分反应形成的。与其他间隔基部分sp或与肽的亲核胺的酰胺键是通过c-末端羧酸部分或氨基酸侧链中的羧酸部分与其他间隔基sp的胺部分或肽的亲核胺反应形成的。氨基酸的侧链、n-末端或c-末端中的官能团可以被保护,例如羧酸部分可以被叔丁基保护基团保护。
[0153]
在某些实施方式中,sp独立地选自
[0154]-被1至5个,特别是1至3个连接部分取代的直链或支链烷基,其中特别地该连接部分是-o-,
[0155]
‑‑
nh-[c
r-烷基-o]
s-c
t-烷基-c(=o)-,其中r独立地选自1、2和3,s是1和10之间的整数,特别是1、2、3或4,并且t是1、2或3,以及
[0156]-氨基酸,其可以是保护的或未保护的,其中n-末端和/或侧链中的胺被-nh-替换并且c-末端和/或侧链中的羧酸部分被-c(=o)-替换。
[0157]
在n大于1的情况下,可以组合相同或不同的部分sp。
[0158]
在某些实施方式中,直链或支链烷基是c
1-12
烷基,特别是c
1-6
烷基,更特别是c
1-3
烷基。
[0159]
在某些实施方式中,sp独立地选自
[0160]-被1至x个连接部分取代的直链烷基,其中特别地该连接部分是-o-,
[0161]-2-(2-(2-氨基乙氧基)乙氧基)乙酸
[0162]-丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、glu-tbu、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸或缬氨酸。
[0163]
在某些实施方式中,直链烷基是c
1-12
烷基,特别是c
1-6
烷基,更特别是c
1-3
烷基。
[0164]
在某些实施方式中,sp独立地选自-o-乙基-、半胱氨酸、谷氨酸、glu-tbu或2-(2-(2-氨基乙氧基)乙氧基)乙酸。
[0165]
在某些实施方式中,sp是氨基酸,其可以是保护的或未保护的,其中n-末端或侧链中的胺被-nh-替换并且c-末端或侧链中的羧酸部分被-c(=o)-替换。
[0166]
在某些实施方式中,sp是氨基酸,其彼此独立地选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、glu-tbu、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸或2-(2-(2-氨基乙氧基)乙氧基)乙酸,特别是谷氨酸、glu-tbu或2-(2-(2-氨基乙氧基)乙氧基)乙酸,其中n-末端或侧链中的胺被-nh-替换并且c-末端或侧链中的羧酸部分被-c(=o)-替换。
[0167]
氨基酸谷氨酸可以是保护的(glu-tbu),例如c-末端羧酸部分可以被叔丁基保护基团保护。
[0168]
在某些实施方式中,n是1或2。
[0169]
在某些实施方式中,n是1。
[0170]
在某些实施方式中,有机分子选自pam2、pam-et、pam3cys和pam
2-et-cys,
[0171][0172]
在某些实施方式中,在修饰步骤中,在非亲核碱的存在下,将式5a或5c的有机分子偶联到至少一个亲核胺。
[0173]
在某些实施方式中,在修饰步骤中,在活化反应物的存在下,特别是在选自以下的活化反应物的存在下,将式5b或5d的有机分子偶联到至少一个亲核胺:四甲基脲鎓四氟硼酸盐(tbtu)、(3-(二乙氧基-磷酰氧基)-1,2,3-苯并[d]三嗪-4(3h)-酮)(depbt)、(2-(6-氯-1h-苯并三唑-1-基)-n,n,n
′
,n
’‑
四甲基脲鎓六氟磷酸盐)(hctu)、四甲基脲鎓六氟磷酸盐(hatu)、(n-(3-二甲氨基丙基)-n'-乙基碳二亚胺(edc)、二环己基碳二亚胺(dcc)、2-氰基-2-(羟亚氨基)乙酸乙酯(oxyma)、1-羟基苯并三唑(hobt)、1-羟基-7-氮杂-1h-苯并三唑(hoat)、nhs和二异丙基碳二亚胺(dic)。
[0174]
在某些实施方式中,在修饰步骤中,在活化反应物的存在下,特别是在选自以下的活化反应物的存在下,将式5b或5d的有机分子偶联到至少一个亲核胺:二异丙基碳二亚胺(dic)、(2-(6-氯-1h-苯并三唑-1-基)-n,n,n
′
,n
’‑
四甲基脲鎓六氟磷酸盐)(hctu)和四甲基脲鎓六氟磷酸盐(hatu)。
[0175]
除了脂化,还经常使用环化来改善体内肽的稳定性和效力:环肽对外切蛋白酶和内切蛋白酶具有高耐受性。由于其更刚性的构象,观察到对期望靶标的良好结合亲和力。环化可以通过分子内二硫化物形成或在使用支架分子的双组分系统(分子间环化)中实现。
[0176]
对于这两种环化方法,使用了肽的官能团,诸如硫醇部分。
[0177]
在某些实施方式中,肽包含至少两个含有亲核硫醇的氨基酸。
[0178]
在某些实施方式中,肽包含2至6个含有亲核硫醇的酸。
[0179]
在某些实施方式中,肽包含2个含有亲核硫醇的氨基酸。
[0180]
在某些实施方式中,肽包含至少两个独立地选自半胱氨酸、高半胱氨酸或青霉胺的氨基酸。
[0181]
在某些实施方式中,肽包含2至6个独立地选自半胱氨酸、高半胱氨酸或青霉胺的
氨基酸。
[0182]
在某些实施方式中,肽包含2个独立地选自半胱氨酸、高半胱氨酸或青霉胺的氨基酸。
[0183]
在双组分系统(分子间环化)中,肽的官能团用于与有机分子诸如桥接支架的反应。根据肽和支架分子中官能团的数目,通过肽和支架分子可以形成单、双或多环。最常见的方法是利用肽的亲核官能团,特别是硫醇,以使其与带有亲电子反应点的支架反应。这样的亲电子中心可以被硫醇亲核攻击。
[0184]
在某些实施方式中,有机分子是包含具有至少两个亲电子中心的支架的有机支架分子。
[0185]
支架可以是直链、支链、单环或多环系统,其是脂肪族的或芳香族的。特别地,更刚性的支架诸如环状系统适用于环化以将肽保持在期望的构象。支架可包含杂原子,例如o、s或n。支架进一步包含形成亲电子中心的取代基。例如,被两个乙基取代基取代的苯基可以形成支架并且乙基部分的br取代基形成亲电子中心。br取代基被称为苄基br。
[0186]
在某些实施方式中,有机分子是包含具有至少两个亲电子中心的支架的有机支架分子,其中亲电子中心由卤素取代基和/或迈克尔受体形成。
[0187]
在某些实施方式中,亲电子中心由至少两个苄基卤素取代基、至少两个丙烯酰胺或至少两个丙烯酸酯形成。
[0188]
在某些实施方式中,亲电子中心由至少两个丙烯酰胺或至少两个苄基卤素取代基形成。
[0189]
在某些实施方式中,有机分子选自间二溴苄(mdbx)、1,4-双(溴甲基)苯、1,3,5-三(溴甲基)苯(tbmb)、n,n
′‑
双(氯乙酰基)-1,2-乙二胺、n,n
′‑
双(氯乙酰基)-1,3-丙二胺、n,n
′‑
((乙烷-1,2-二基双(氧基))双(乙烷-2,1-二基))双(2-氯乙酰胺)、n,n
′‑
双(溴乙酰基)-1,2-乙二胺、n,n
′‑
双(溴乙酰基)-1,3-丙二胺、n,n
′‑
((乙烷-1,2-二基双(氧基))双(乙烷-2,1-二基))双(2-溴乙酰胺)、1,3,5-三丙烯酰基-1,3,5-三嗪烷(tata)、1,1',1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb),n,n
′
,n
″‑
(苯-1,3,5-三基)-三(2-溴乙酰胺)(tbab)、n,n
′
,n
″‑
苯-1,3,5-三基三丙-2-烯酰胺(taab)、2,4,6-三(溴甲基)-s-三嗪(tbmt)、n,n
′
,n
″‑
(次氮基三(乙烷-2,1-二基))三丙烯酰胺、n,n
′
,n
″‑
(次氮基三(乙烷-2,1-二基))三(2-氯乙酰胺)、n,n
′
,n
″‑
(次氮基三(乙烷-2,1-二基))三(2-溴乙酰胺)、n,n
′
,n
″‑
(次氮基三(乙烷-2,1-二基))三亚乙基磺酰胺、n,n
′
,n
″‑
((1,3,5-三嗪烷-1,3,5-三基)三(2-氧亚基乙烷-2,1-二基))三丙烯酰胺、n,n
′
,n
″‑
((1,3,5-三嗪烷-1,3,5-三基)三(2-氧亚基乙烷-2,1-二基))三(2-氯乙酰氨)、n,n
′
,n
″‑
((1,3,5-三嗪烷-1,3,5-三基)三(2-氧亚基乙烷-2,1-二基))三亚乙基磺酰胺、n,n
′
,n
″‑
(苯-1,3,5-三基三(亚甲基))三丙烯酰胺、n,n
′
,n
″‑
(苯-1,3,5-三基三(亚甲基))三(2-氯乙酰胺)、n,n
′
,n
″‑
(苯-1,3,5-三基三(亚甲基))三亚乙基磺酰胺、三丙烯酸三(2-羟乙基)异氰脲酸酯、1,3,5-三(环氧乙烷-2-基甲基)-1,3,5-三嗪烷-2,4,6-三酮。
[0190]
在某些实施方式中,有机分子选自间二溴苄(mdbx)、1,3,5-三(溴甲基)苯(tbmb)、三氮烷、1,3,5-三丙烯酰基-1,3,5-三嗪烷(tata)、1,1',1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)。
[0191]
在某些实施方式中,有机分子选自α,α
′‑
二溴-间-二甲苯(mdbx)、1,3,5-三(溴甲
基)苯(tbmb)、三氮烷、1,3,5-三丙烯酰基-1,3,5-三嗪烷(tata)、1,1',1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)。
[0192]
在双组分系统(分子间环化)中,在还原步骤中获得亲核硫醇。随后,亲核硫醇在环化步骤中攻击有机支架分子中的亲电子中心。
[0193]
在某些实施方式中,修饰步骤包括还原步骤,然后是环化步骤,其中
[0194]-在还原步骤中,用还原剂,特别是二硫苏糖醇(dtt)或三-(2-羧乙基)-膦(tcep)处理固定的接头标记的肽s-l-p,并且
[0195]-在环化步骤中,在碱性条件下将有机支架分子与至少两个亲核硫醇偶联。
[0196]
环化步骤在碱性条件下进行以使亲核硫醇去质子化。
[0197]
在某些实施方式中,环化步骤在ph≥8下进行。
[0198]
在某些实施方式中,环化步骤在na2co3、nahco3、nh4hco3、盐酸胍(gdmcl)、二异丙基乙胺(dipea)、三乙胺(net3)或n-甲基-吗啉(nmm)的存在下进行。
[0199]
在某些实施方式中,环化步骤在nh4hco3、盐酸胍(gdmcl)、二异丙基乙胺(dipea)、三乙胺(net3)或n-甲基-吗啉(nmm)的存在下进行。
[0200]
环化也可以通过分子内二硫键形成来实现。例如,肽中两个半胱氨酸残基的硫醇部分可以形成二硫化物。
[0201]
在某些实施方式中,亲核硫醇的数目是偶数,并且在修饰步骤中亲核硫醇被ph》7的碱性水溶液氧化以产生大环桥连肽。
[0202]
在某些实施方式中,亲核硫醇被ph》7的碱性水溶液氧化,和/或在空气的存在下(特别是在氧气的存在下)被氧化,和/或在氧化添加剂特别是选自以下的氧化添加剂的存在下被氧化:dmso、碘、n-氯代琥珀酰亚胺、tl(oac)3、tl(cf3coo)3、ch3sicl
3-ph(so)ph、[pt(乙二胺)2cl2]cl2、2,2'-二硫双(5-硝基吡啶)、5,5'-二硫双-(2-硝基苯甲酸)、反式-[pt-(cn)4cl2]
2-、谷胱甘肽-二硫化谷胱甘肽、k3fe(cn)6。
[0203]
氧化添加剂可以原样使用或溶解在合适的溶剂中。氧化可以在有机溶液、有机水溶液、酸性或碱性溶液中进行。
[0204]
在某些实施方式中,亲核硫醇在空气的存在下(特别是在氧气的存在下)被氧化,或者在氧化添加剂特别是选自以下的氧化添加剂的存在下被氧化:dmso、碘、n-氯代琥珀酰亚胺、tl(oac)3、tl(cf3coo)3、ch3sicl
3-ph(so)ph、[pt(乙二胺)2cl2]cl2、2,2'-二硫双(5-硝基吡啶)、5,5'-二硫双-(2-硝基苯甲酸)、反式-[pt-(cn)4cl2]
2-、谷胱甘肽-二硫化谷胱甘肽、k3fe(cn)6。
[0205]
在某些实施方式中,亲核硫醇在dmso、碘、n-氯代琥珀酰亚胺、tl(oac)3、[pt(乙二胺)2cl2]cl2、反式-[pt-(cn)4cl2]
2-、谷胱甘肽的存在下被氧化。
[0206]
在某些实施方式中,亲核硫醇在以下的存在下被氧化:空气(氧气)、dmso、碘、n-氯代琥珀酰亚胺、tl(oac)3、tl(cf3coo)3、ch3sicl
3-ph(so)ph、[pt(乙二胺)2cl2]cl2、2,2'-二硫双(5-硝基吡啶)、5,5'-二硫双-(2-硝基苯甲酸)、反式-[pt-(cn)4cl2]
2-、谷胱甘肽-二硫化谷胱甘肽、k3fe(cn)6。
[0207]
在某些实施方式中,亲核硫醇在dmso、碘、n-氯代琥珀酰亚胺、tl(oac)3、[pt(乙二胺)2cl2]cl2、反式-[pt-(cn)4cl2]
2-、谷胱甘肽的存在下被氧化。
[0208]
在某些实施方式中,亲核硫醇在n-氯代琥珀酰亚胺、dmso和谷胱甘肽-谷胱甘肽二
硫化物的存在下被氧化。
[0209]
在某些实施方式中,亲核硫醇在n-氯代琥珀酰亚胺、dmso和谷胱甘肽的存在下被氧化。
[0210]
在某些实施方式中,
[0211]-x选自式2、2a、3、3a或4的部分,特别是式2、2a、3或3a的部分,更特别是式2或2a的部分,
[0212][0213]
其中
[0214]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0215]-r3选自h或b,
[0216]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0217]-b是酸不稳定的胺保护基团,
[0218]-t是直链或支链间隔基,其包含以下部分中的至少一个,特别是1至5个:-c
1-12-烷基-、(-c2h4o-)
1-12
、-c(=o)-、-c(=o)-jr
9-、-jr
9-c(=o)-、-jr
9-、苯基、5元或6元杂芳基,其中
[0219]
j是c或n,特别是n,
[0220]
特别地,t是选自以下的间隔基:
[0221]-c
1-c
12-烷基-,特别是c
1-6-烷基,更特别是c
1-3-烷基,-r
5-c(=o)-、-r
5-c(=o)-nr
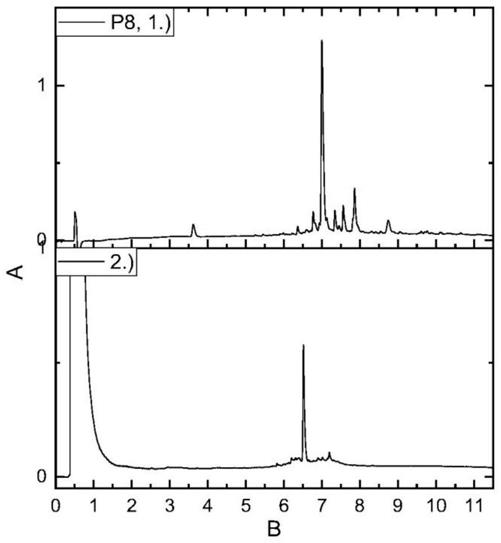
9-r
6-、-r
5-c(=o)-nr
9-、-c(=o)-nr
9-r
6-、-r
5-nr
9-c(=o)-r
6-、-r
5-nr
9-r5’-nr9’
c(=o)-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’-c(=o)-r
6-、-r
5-nr
9-、-r
5-nr
9-r
6-、-r
5-nr
9-r5’-nr9’-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’-r
6-、-r
5-c(=o)-o-r
6-、-c(=o)-o-r
6-、-r
5-苯基-r
6-、-r
5-苯基-、-苯基-r
6-、-苯基-、-r
5-吡咯基、-r
5-吡唑基、-r
5-咪唑基、r
5-哌嗪基-、-r
5-吡啶基、-r
5-嘧啶基、-r
5-吡嗪基、-r
5-哒嗪基、-r
5-吡咯基-r
6-、-r
5-吡唑基-r
6-、-r
5-咪唑基-r
6-、-r
5-哌嗪基-r
6-、-r
5-吡啶基-r
6-、-r
5-嘧啶基-r
6-、-r
5-吡嗪基-r
6-、-r
5-哒嗪基-r
6-、吡咯基-r
6-、吡唑基-r
6-、咪唑基-r
6-哌嗪基-r
6-、吡啶基-r
6-、嘧啶基-r
6-、吡嗪基-r
6-、哒嗪基-r
6-、吡咯基、吡唑基、咪唑基、哌嗪基、吡啶基、嘧啶基、吡嗪基和哒嗪基,其中
[0222]
r5、r5’
和r6彼此独立地选自c
1-c
12-烷基或(-c2h4o-)
1-12
,特别是c
1-c6烷基,特别是c
1-c3烷基,并且其中
[0223]
r9和r9’
彼此独立地选自h、c
1-4-烷基、-c
1-6-烷基-nh2、-c
1-6-烷基-nhb、-c
1-6-烷基-nb2、-r
15
、-c
1-6-烷基-r
15
、-c
1-6-烷基-nh-r
15
,特别地选自h和c
1-2-烷基,更特别地r9是h,其中
[0224]
b是独立选择的酸不稳定的胺保护基团,
[0225]r15
是能与醛部分反应的封闭剂,特别地r
15
选自半胱氨酰基、苏氨酰基、2-巯基乙醇、半胱胺、乙二硫醇、羟胺、o-甲基羟胺、n-甲基羟胺、二硫苏糖醇、肼,特别是半胱氨酰基和n-甲基羟胺,更特别是半胱氨酰基,其中
[0226]
封闭剂的胺和/或硫醇部分可以被独立选择的酸不稳定的胺保护基团b,特别是boc,和/或酸不稳定的硫醇保护基团,特别是三苯甲基保护,
[0227]-b是0或1,特别是1,
[0228]-v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-(ch2)
p-、-哌嗪基-(ch2)
p-、吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,特别是-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、
‑‑
nr
12-(ch2)
p-、-哌嗪基-(ch2)
p-、-吡啶基-、嘧啶基,更特别地选自-nh-c(=o)-、-c(=o)-nh-、-n-(ch3)-、-哌嗪基-(ch2)
p-、-吡啶基-、嘧啶基,其中
[0229]r11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,
[0230]r12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基,
[0231]
p是0、1或2,特别是0或1,
[0232]-a是0或1,其中a与b之和是1或2,
[0233]-u是苯基或五元或六元杂芳基部分,特别是苯基或六元杂芳基部分,更特别是苯基,其与部分v、wq和en中的至少一个结合并且可以任选地被c
1-6-烷基,特别是c
1-3-烷基取代,其中
[0234]
v如上所述定义,
[0235]
w选自-n3、-no2、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-o-c(=o)-o-ch
2-n3、-n=n-苯基、-n=n-r8、、特别是-n3、-n=n-r8、-o-ch
2-n3、-s-s-r8,其中
[0236]
r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4,
[0237]
e是酸性条件下的吸电子基团,
[0238]
n是0和4之间的整数,特别是0和2之间的整数,更特别是0或1,并且q是0和4之间的整数,特别是0和2之间的整数,更特别是0和1,其中n和q之和等于或小于4,并且其中
[0239]
在u是苯基部分且y是-(ch2)
m-o-c(=o)-的情况下,在酸性条件下v、w、e的哈米特常数之和大于0.45,并且其中
[0240]
w相对于y在邻位或对位,
[0241]-y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,其中m是1、2或3,特别是1或2,更特别是1,
[0242]
z是吸电子离去基团。
[0243]
在某些实施方式中,q是1和4之间的整数,特别是1和2,更特别是1。
[0244]
在某些实施方式中,e选自哌啶基、哌嗪基、吡啶基、嘧啶基、吡嗪基、哒嗪基、-n(c2h4)2nh2、-n(c2h4)2n-b、-n=n-苯基、-n=n-r8、-(ch2)
r-nh-c
1-6-烷基、-(ch2)
r-n(c
1-6-烷基)
2-、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h、-c(=o)nh2、-so2me、-some、-so2et、-soet,特别是吡啶基、嘧啶基、吡嗪基、哒嗪基、-n=n-苯基、-n=n-r8、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h,更特别是吡啶基、嘧啶基、哒嗪基或-br,其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4,b是酸不稳定的胺保护基团,并且r是0、1、2、3或4,特别是0、1或2。
[0245]
在某些实施方式中,
[0246]-x选自式2、2a、3、3a或4的部分,特别是式2、2a、3或3a的部分,更特别是式2或2a的部分,
[0247][0248]
其中
[0249]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0250]-r3选自h或b,
[0251]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0252]-b是酸不稳定的胺保护基团,
[0253]-t是直链或支链间隔基,其包含以下部分中的至少一个:-c
1-12-烷基-、(-c2h4o-)
1-12
、-c(=o)-、-c(=o)-jr
9-、-jr
9-c(=o)-、-jr
9-,其中
[0254]
j是c或n,特别是n,
[0255]
特别地,t是选自以下的间隔基:
[0256]-c
1-c
12-烷基-,特别是-c
1-6-烷基-,更特别是-c
1-3-烷基-,-r
5-c(=o)-、-r
5-c(=o)-nr
9-r
6-、-r
5-c(=o)-nr
9-、-c(=o)-nr
9-r
6-、-r
5-nr
9-c(=o)-r
6-、-r
5-nr
9-r5’-nr9’
c(=o)-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’-c(=o)-r
6-、-r
5-nr
9-、-r
5-nr
9-r
6-、-r
5-nr
9-r5’-nr9’-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’-r
6-、-r
5-c(=o)-o-r
6-、-c(=o)-o-r
6-、-r
5-苯基-r
6-、-r
5-苯基-、-苯基-r
6-、-苯基-,其中
[0257]
r5、r5’
和r6彼此独立地选自c
1-c
12-烷基或(-c2h4o-)
1-12
,特别是c
1-c6烷基,特别是c1-c3烷基,并且其中
[0258]
r9和r9’
彼此独立地选自h、c
1-4-烷基、-c
1-6-烷基-nh2、-c
1-6-烷基-nhb、-c
1-6-烷基-nb2、-r
15
、-c
1-6-烷基-r
15
、-c
1-6-烷基-nh-r
15
,特别地选自h和c
1-2-烷基,更特别地r9是h,其中
[0259]
b是独立选择的酸不稳定的胺保护基团,
[0260]r15
是能与醛部分反应的封闭剂,特别地r
15
选自半胱氨酰基、苏氨酰基、2-巯基乙醇、半胱胺、乙二硫醇、羟胺、o-甲基羟胺、n-甲基羟胺、二硫苏糖醇、肼,特别是半胱氨酰基和n-甲基羟胺,更特别是半胱氨酰基,其中
[0261]
封闭剂的胺和/或硫醇部分可以被独立选择的酸不稳定的胺保护基团b,特别是boc,和/或酸不稳定的硫醇保护基团,特别是三苯甲基保护。
[0262]-b是0或1,特别是1,
[0263]-v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、哌嗪基-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,特别是-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-哌嗪基-、-吡啶基-、嘧啶基,更特别地选自-nh-c(=o)-、-c(=o)-nh-、-n-(ch3)-、-哌嗪基-、-吡啶基-、嘧啶基,其中
[0264]r11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,
[0265]r12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基,
[0266]-a是0或1,其中a与b之和是1或2,
[0267]-u是苯基或五元或六元杂芳基部分,特别是苯基或六元杂芳基部分,更特别是苯基,其与部分v、wq和en中的至少一个结合并且可以任选地被c
1-6-烷基,特别是c
1-3-烷基取代,其中
[0268]
v如上所述定义,
[0269]
w选自-n3、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-o-c(=o)-o-ch
2-n3、-n=n-苯基、-n=n-r8、、特别是-n3、-n=n-r8、-o-ch
2-n3、-s-s-r8,其中
[0270]
r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4,
[0271]
e是酸性条件下的吸电子基团,
[0272]
n是0和4之间的整数,特别是0和2之间的整数,更特别是0或1,并且q是0和4之间的整数,特别是0和2之间的整数,更特别是0和1,其中n和q之和等于或小于4,并且其中
[0273]
在u是苯基部分且y是-(ch2)
m-o-c(=o)-的情况下,在酸性条件下v、w、e的哈米特常数之和大于0.45,
[0274]-y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,其中m是1、2或3,特别是1或2,更特别是1,
[0275]-z是吸电子离去基团。
[0276]
在某些实施方式中,
[0277]-x选自式2、2a、3、3a或4的部分,特别是式2、2a、3或3a的部分,更特别是式2或2a的部分,
[0278][0278]
其中
[0279]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0280]-r3选自h或b,
[0281]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0282]-b是酸不稳定的胺保护基团,
[0283]-t是选自以下的间隔基:
[0284]-c
1-c
12-烷基-,特别是c
1-6-烷基,更特别是c
1-3-烷基、-r
5-c(=o)-、-r
5-c(=o)-nr
9-r
6-、-r
5-c(=o)-nr
9-、-c(=o)-nr
9-r
6-、-r
5-nr
9-c(=o)-r
6-、-r
5-nr
9-r5’-nr9’
c(=o)-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’-c(=o)-r
6-、-r
5-c(=o)-o-r
6-、-c(=o)-o-r
6-、-r
5-苯基-r
6-、-r
5-苯基-、-苯基-r
6-、-苯基-,其中
[0285]
r5、r5’
和r6彼此独立地选自c
1-c
12-烷基,特别是c
1-c6烷基,特别是c
1-c3烷基,并且其中r9和r9’
彼此独立地选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r9是h,
[0286]-b是0或1,特别是1,
[0287]-v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-哌嗪基-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,特别是-nr
11-c(=o)-、-c(=o)-nr
11-、s(=o)-、-nr
12-、-哌嗪基-、-吡啶基-、嘧啶基,更特别地选自-nh-c(=o)-、-c(=o)-nh-、-n-(ch3)-、-哌嗪基-、-吡啶基-、嘧啶基,其中
[0288]r11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,
[0289]r12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基,
[0290]-a是0或1,其中a与b之和是1或2,
[0291]-u是苯基或五元或六元杂芳基部分,特别是苯基或六元杂芳基部分,更特别是苯
基,其与部分v、wq和en中的至少一个结合并且可以任选地被c
1-6-烷基,特别是c
1-3-烷基取代,其中
[0292]
v如上所述定义,
[0293]
w选自-n3、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-o-c(=o)-o-ch
2-n3、-n=n-苯基、-n=n-r8、、特别是-n3、-n=n-r8、-o-ch
2-n3、-s-s-r8,其中
[0294]
r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4,
[0295]
e是酸性条件下的吸电子基团,
[0296]
n是0和4之间的整数,特别是0和2之间的整数,更特别是0或1,并且q是0和4之间的整数,特别是0和2之间的整数,更特别是0和1,其中n和q之和等于或小于4,并且其中
[0297]
在u是苯基部分且y是-(ch2)
m-o-c(=o)-的情况下,在酸性条件下v、w、e的哈米特常数之和大于0.45,
[0298]-y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,其中m是1、2或3,特别是1或2,更特别是1,
[0299]-z是吸电子离去基团。
[0300]
在某些实施方式中,
[0301]-x选自式2、2a、3、3a或4的部分,特别是式2、2a、3或3a的部分,更特别是式2或2a的部分,最特别是2的部分
[0302][0302]
其中
[0303]-每个r1和r2彼此独立地选自h或b,其中至少r1或r2是b,
[0304]-r3选自h或b,
[0305]-r4选自h、c
1-c
12-烷基或芳基,其中醛或酮基基团可被酸不稳定的保护基团保护,
[0306]-b是酸不稳定的胺保护基团,
[0307]-t是选自以下的间隔基:
[0308]-c
1-c
12-烷基-,特别是c
1-6-烷基,更特别是c
1-3-烷基,-r
5-c(=o)-nr
9-r
6-、-c(=o)-nr
9-r
6-、-r
5-nr
9-r
5-nr9c(=o)-r
6-、-r
5-nr
9-c(=o)-r
6-、-r
5-c(=o)-o-r
6-、-c(=o)-o-r
6-、-r
5-苯基-r
6-、-r
5-苯基-、-苯基-r
6-、-苯基-,其中
[0309]
r5和r6彼此独立地选自c
1-c
12-烷基,特别是c
1-c6烷基,特别是c
1-c3烷基,并且其中r9选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r9是h,
[0310]-b是0或1,特别是1,
[0311]-v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,特别是-nr
11-c(=o)-、s(=o)-、-nr
12-、-吡啶基-、嘧啶基,其中
[0312]r11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,
[0313]r12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基,
[0314]-a是0或1,其中a与b之和是1或2,
[0315]-u是苯基或五元或六元杂芳基部分,特别是苯基或六元杂芳基部分,其与部分v、w和e中的至少一个结合,其中
[0316]
v如上所述定义,
[0317]
w选自-n3、-s(=o)-r8、-ssr8、-och2n3、-oc(=o)och
2-n3、
[0318]-n=n-苯基、-n=n-吡啶、吡啶、其中
[0319]
r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,其中p是1、2、3或4,
[0320]
e选自吡啶基、嘧啶基、吡嗪基、哒嗪基、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h、-c(=o)nh
2、-so2me、-some、-so2et、-soet,特别是吡啶基、嘧啶基、吡嗪基、哒嗪基、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h,其中
[0321]r13
选自-f、-cl、-br、-i、-pf6,并且其中
[0322]
在u是苯基部分且y是-(ch2)
m-o-c(=o)-的情况下,在酸性条件下v、w、e的哈米特常数之和大于0.45,
[0323]-y是-(ch2)
m-c(=o)-或-(ch2)
m-o-c(=o)-,其中m是1、2或3,特别是1或2,更特别是1,
[0324]-z是吸电子离去基团。
[0325]
在某些实施方式中,x选自式2或3的部分。
[0326]
在某些实施方式中,x选自式2的部分。
[0327]
当使用具有式4的部分的接头时,通过形成腙或肟键将部分x偶联到官能化固相所
需的反应时间较长,而当使用具有式2或3的部分的接头时,所需的反应时间较短。固体载体的醛或酮部分与式3的部分x之间腙键的形成是可逆的。由于这种可逆性,发明人观察到在纯化过程中的每个洗涤步骤之后肽材料的损失高达约10%。与此相反,当使用具有式2的部分的接头时几乎没有观察到肽材料的损失。
[0328]
在某些实施方式中,u被c
1-6-烷基取代。
[0329]
在某些实施方式中,u被c
1-3-烷基取代。
[0330]
在某些实施方式中,u被甲基取代。
[0331]
如果u被一个或多个烷基部分进一步取代,则考虑这些烷基部分的哈米特值。在u被苯基部分或杂原子进一步取代的情况下,v、w、e和任选的烷基取代基的哈米特值之和大于0.45。
[0332]
在某些实施方式中,e选自吡啶基、嘧啶基、吡嗪基、哒嗪基、-n=n-苯基、-n=n-r8、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h、-c(=o)nh2、-so2me、-some、-so2et、-soet,其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4。
[0333]
在某些实施方式中,e选自吡啶基、嘧啶基、吡嗪基、哒嗪基、-n=n-苯基、-n=n-r8、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h,其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或-(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4。
[0334]
在某些实施方式中,e选自吡啶基、嘧啶基、吡嗪基、哒嗪基、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h、-c(=o)nh
2、-so2me、-some、-so2et、-soet。
[0335]
在某些实施方式中,e选自吡啶基、嘧啶基、吡嗪基、哒嗪基、-f、-cl、-br、-i、-cn、-no2、-n3、-cf3、-so3h、-co2h。
[0336]
在某些实施方式中,e选自吡啶基、嘧啶基、哒嗪基或-br。
[0337]
在某些实施方式中,b选自
[0338]-boc(-c(=o)otbu)、eei(=cmeoet,1-乙氧基亚乙基)、三苯甲基(-c(ph)3)、mmt(-c(ph)2c6h4ome)、dmt(-c(ph)(c6h4ome)2)、cbz(-c(=o)och2ph)、苯亚甲基胺(=cph)、邻苯二甲酰亚胺(=(co)2c6h4)、对甲苯磺酰胺(-so2c6h4me)、苄胺(-ch2ph)、乙酰胺(-come)、三氟乙酰胺(-cocf3)、dde(1-(4,4-二甲基-2,6-二氧代环己-1-亚基)-3-乙基)和1-(4,4-二甲基-2,6-二氧代环己-1-亚基)-3-甲基丁基(ivdde),其中特别地b是boc或eei,其中更特别地b是boc,或者
[0339]-缩醛-或缩酮保护基团,其选自
[0340][0341]
其中r是0至12,特别是0至6,更特别是0、1或2,并且
[0342]r10
是-c
1-c
12-烷基-,特别是c
1-6-烷基,更特别是c
1-3-烷基。
[0343]
在某些实施方式中,b选自boc(-c(=o)otbu)、eei(=cmeoet,1-乙氧基亚乙基)、
三苯甲基(-c(ph)3)、mmt(-c(ph)2c6h4ome)、dmt(-c(ph)(c6h4ome)2)、cbz(-c(=o)och2ph)、苯亚甲基胺(=cph)、邻苯二甲酰亚胺(=(co)2c6h4)、对甲苯磺酰胺(-so2c6h4me)、苄胺(-ch2ph)、乙酰胺(-come)、三氟乙酰胺(-cocf3)、dde(1-(4,4-二甲基-2,6-二氧代环己-1-亚基)-3-乙基)和1-(4,4-二甲基-2,6-二氧代环己-1-亚基)-3-甲基丁基(ivdde)。
[0344]
在某些实施方式中,b是boc或eei(=cmeoet,1-乙氧基亚乙基)。
[0345]
在某些实施方式中,b是boc。
[0346]
在某些实施方式中,b选自缩醛或缩酮保护基团,其选自:
[0347][0348]
其中r是0至12,特别是0至6,更特别是0、1或2,并且r
10
是-c
1-c
12-烷基-,特别是c
1-6-烷基。
[0349]
在某些实施方式中,t是直链或支链间隔基,其包括以下部分中的至少一个:-c
1-12-烷基-、(-c2h4o-)
1-12
、-c(=o)-,-c(=o)-jr
9-、-jr
9-c(=o)-、-jr
9-,其中j是c或n,特别是n,其中r9独立地选自h、c
1-4-烷基、-c
1-6-烷基-nh2、-c
1-6-烷基-nhb、-c
1-6-烷基-nb2,特别地选自h和c
1-2-烷基,更特别地r9是h,其中b是独立选择的酸不稳定的胺保护基团。
[0350]
在某些实施方式中,间隔基t的总长度在0.5和100nm之间。
[0351]
在某些实施方式中,t选自-c
1-c
12-烷基-(特别是-c
1-6-烷基-,更特别是-c
1-3-烷基-)、-r
5-c(=o)-、-r
5-c(=o)-nr
9-、-r
5-nr
9-c(=o)-r
6-、-r
5-c(=o)-nr
9-r
6-、-r
5-c(=o)-nr
9-r5’-nr9’
c(=o)-r
6-,特别是c
1-3-烷基、-r
5-c(=o)-nr
9-、-r
5-nr
9-c(=o)-r
6-,更特别是c
1-3-烷基或-r
5-c(=o)-nr
9-,其中r5、r5’
、r6、r9’
和r9如上所定义。
[0352]
在某些实施方式中,t是直链或支链间隔基,其包括以下部分中的至少一个:-c
1-12-烷基-、-c(=o)-、-c(=o)-nr
9-、-nr
9-c(=o)-、-nr
9-,其中r9独立地选自h、c
1-4-烷基、-c
1-6-烷基-nh2、-c
1-6-烷基-nhb、-c
1-6-烷基-nb2、-r
15
、-c
1-6-烷基-r
15
、-c
1-6-烷基-nh-r
15
,特别地选自h和c
1-2-烷基,更特别地r9是h,其中b是独立选择的酸不稳定的胺保护基团,
[0353]r15
是能与醛部分反应的封闭剂,特别地r
15
选自半胱氨酰基、苏氨酰基、2-巯基乙醇、半胱胺、乙二硫醇、羟胺、o-甲基羟胺、n-甲基羟胺、二硫苏糖醇、肼,特别是半胱氨酰基和n-甲基羟胺,更特别是半胱氨酰基,其中
[0354]
封闭剂的胺和/或硫醇部分可以被独立选择的酸不稳定的胺保护基团b,特别是boc,和/或酸不稳定的硫醇保护基团,特别是三苯甲基保护,
[0355]
如上所述,间隔基t在通常应用的纯化条件下通常是非反应性的,除了在酸性条件下去除保护基团外。间隔基t可以增强接头分子的溶解性。特别地,在r9处包含保护或未保护的胺部分的支链间隔基有助于增强溶解性。在酸性条件下,胺保护基团b被去除,并且胺被质子化。
[0356]
在某些实施方式中,t是直链或支链间隔基,其包括以下部分中的至少一个:-c
1-12-烷基-、-c(=o)-、-c(=o)-nr
9-、-nr
9-c(=o)-、-nr
9-,其中r9独立地选自h、c
1-4-烷
基、-c
1-6-烷基-nh2、-c
1-6-烷基-nhb、-c
1-6-烷基-nb2,特别地选自h和c
1-2-烷基,更特别地r9是h,其中b是独立选择的酸不稳定的胺保护基团。
[0357]
间隔基t还可包括封闭功能。特别地,支链间隔基可以包括适于结合醛部分的封闭剂。当用于肽纯化的固相包括醛部分,例如琼脂糖珠时,接头化合物的部分x可以例如通过形成肟键共价结合到固相上。未反应的醛部分可能在后续纯化期间引起不想要的副反应。为防止这样的副反应,固相的未反应的醛部分可通过间隔基的封闭功能封闭,例如半胱氨酰基部分。
[0358]
在某些实施方式中,t是直链或支链间隔基,其包括以下部分中的至少一个:-c
1-12-烷基-、-c(=o)-、-c(=o)-nr
9-、-nr
9-c(=o)-、-nr
9-,其中r9独立地选自h、c
1-4-烷基、-r
15
、-c
1-6-烷基-r
15
、-c
1-6-烷基-nh-r
15
,特别地选自h和c
1-2-烷基,更特别地r9是h,其中b是独立选择的酸不稳定的胺保护基团,
[0359]r15
是能与醛部分反应的封闭剂,特别地r
15
选自半胱氨酰基、苏氨酰基、2-巯基乙醇、半胱胺、乙二硫醇、羟胺、o-甲基羟胺、n-甲基羟胺、二硫苏糖醇、肼,特别是半胱氨酰基和n-甲基羟胺,更特别是半胱氨酰基,其中
[0360]
封闭剂的胺和/或硫醇部分可以被独立选择的酸不稳定的胺保护基团b,特别是boc,和/或酸不稳定的硫醇保护基团,特别是三苯甲基保护,
[0361]
在某些实施方式中,t选自-c
1-c
12-烷基-(特别是c
1-6-烷基、更特别是c
1-3-烷基)、-r
5-c(=o)-nr
9-r
6-、-c(=o)-nr
9-r
6-、-r
5-nr
9-c(=o)-r
6-、-r
5-c(=o)-o-r
6-、-c(=o)-o-r
6-、-r
5-nr
9-r
5-nr9c(=o)-r
6-,特别地选自-c
1-c
12-烷基-(特别是c
1-6-烷基,更特别是c
1-3-烷基)、-r
5-nr
9-c(=o)-r
6-、-r
5-c(=o)-nr
9-r
6-、-r
5-nr
9-r
5-nr9c(=o)-r
6-,最特别是-r
5-nr
9-c(=o)-r
6-,其中r5、r6和r9如上所定义。
[0362]
如上所述,部分u、v、w和e有助于接头在酸性条件下的稳定性。例如,包含含有胺或杂环诸如吡啶的部分u或v的接头在酸性条件(特别地tfa》50%,在水存在下,ph《0)下是稳定的,因为胺或杂环被质子化。此外,质子化接头改善了接头-肽复合物的溶解度。如果ph高于接头的pka,则接头将在所期望的肽释放期间中作为最后步骤迅速分解。
[0363]
v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-哌嗪基-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,其中r
11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,r
12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基。
[0364]
v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-哌嗪基-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-,其中r
11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,r
12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基。
[0365]
v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-哌嗪基-、-吡啶基、嘧啶基,其中r
11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,r
12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基。
[0366]
v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-nr
12-、-哌嗪基-、-吡啶
基、嘧啶基,其中r
11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,r
12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基。
[0367]
v是吸电子部分,其选自-nh-c(=o)-、-c(=o)-hn-、-n-(ch3)-、-哌嗪基-、-吡啶基-、嘧啶基、吡嗪基、哒嗪基。
[0368]
v是吸电子部分,其选自-nh-c(=o)-、-c(=o)-hn-、-n-(ch3)-、-哌嗪基-、-吡啶基-、嘧啶基。
[0369]
在某些实施方式中,v是吸电子部分,其选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-、-吡啶基、嘧啶基、吡嗪基、哒嗪基、-c(=o)-、-c(=o)-o-。
[0370]
在某些实施方式中,v选自-nr
11-c(=o)-、-c(=o)-nr
11-、-s(=o)-、-nr
12-和-吡啶基-、嘧啶基,其中r
11
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
11
是h,并且r
12
选自h和c
1-4-烷基,特别地选自h和c
1-2-烷基,更特别地r
12
是甲基。
[0371]
在某些实施方式中,v选自-nr
11-c(=o)-、s(=o)-、-nr
12-、-吡啶基-、嘧啶基,其中r
11
选自h和c
1-4-烷基,并且r
12
选自h和c
1-4-烷基。
[0372]
在某些实施方式中,v选自-nr
11-c(=o)-、s(=o)-、-nr
12-、-吡啶基-、嘧啶基,其中r
11
选自h和c
1-2-烷基,并且r
12
选自h和c
1-2-烷基。
[0373]
在某些实施方式中,v选自-nh-c(=o)-、-n-(ch3)-、-吡啶基-、嘧啶基。
[0374]
在某些实施方式中,w选自-n3、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-n=n-r8,特别是-n3、-n=n-r8、-o-ch
2-n3、-s-s-r8,其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基、-c
1-c
6-烷基或(ch2)
p-nme2,特别是吡啶基或-c
1-c
6-烷基,其中p是1、2、3或4。
[0375]
在r8是c
1-6-烷基的情况下,烷基部分可以是直链或支链的,例如叔丁基。特别地在w是-s-s-r8的情况下,r8可以是吡啶基或-c
1-c
4-烷基,特别是吡啶基或叔丁基。
[0376]
包含部分w=-s-s-r8的接头可以用硫醇裂解。因此,当这样的接头用于肽纯化时,在酸性条件下(例如,tfa>50%,在水存在下,ph<0)从在spps期间使用的合成树脂上裂解肽-接头复合物可以在没有硫醇的情况下进行。
[0377]
在某些实施方式中,w选自-n3、-s(=o)-r8、-s-s-r8、-o-ch
2-n3、-n=n-r8,特别是-n3、-n=n-r8、-o-ch
2-n3、-s-s-r8,其中r8是吡啶基、嘧啶基、吡嗪基、哒嗪基或-c
1-c
6-烷基,或者特别是嘧啶基、吡啶基或-c
1-c
6-烷基,更特别是吡啶基或-c
1-c
6-烷基。
[0378]
在某些实施方式中,u选自苯基或五元或六元杂环,其中五元或六元杂环包含1或2个杂原子。
[0379]
在某些实施方式中,u选自苯基或五元或六元杂环,其中五元或六元杂环包含1个杂原子。
[0380]
在某些实施方式中,u选自苯基或六元杂环。
[0381]
在某些实施方式中,u选自苯基或六元杂环,其中六元杂环包含1或2个杂原子。
[0382]
在某些实施方式中,u的五元或六元杂芳基部分包含1或2个杂原子,特别地部分u的五元杂芳基部分选自吡唑、咪唑,并且部分u的六元杂芳基部分选自吡啶、哒嗪、嘧啶、吡嗪,特别是吡啶。
[0383]
在某些实施方式中,u选自苯基或六元杂环,其中六元杂环包含1个杂原子。在某些实施方式中,部分u的五元杂环选自吡唑、咪唑,并且部分u的六元杂环选自吡啶、哒嗪、嘧啶、吡嗪。
[0384]
在某些实施方式中,u选自苯基、吡啶、哒嗪、嘧啶、吡嗪,特别是苯基或吡啶,更特别是苯基。
[0385]
在某些实施方式中,u选自式5、6、7或8的部分,
[0386][0387]
其中
[0388]
t、v、y、w和e如上所述定义,
[0389]
在式5和6的情况下,u与部分t或v结合,
[0390]
在式7和8的情况下,u与部分v结合,
[0391]
a1、a2、a3、a4和d1、d2、d3、d4彼此独立地选自c、n、s和o,特别地选自c和n,其中a1、a2、a3和a4或d1、d2、d3和d4中的2至4个部分是c,特别地a1、a2、a3和a4或d1、d2、d3和d4中的3或4个部分是c,更特别地所有部分a1、a2、a3和a4或d1、d2、d3和d4是c,
[0392]
n是
[0393]
在式5和6的情况下,0和3之间的整数,
[0394]
在式7和8的情况下,0和4之间的整数,
[0395]
q是0和4之间的整数,其中n和q之和等于或小于4。
[0396]
在某些实施方式中,u选自式5或6的部分。
[0397]
在某些实施方式中,u选自式5、6、7或8的部分,其中
[0398]
t、v、y、w和e如上所述定义,
[0399]
在式5和6的情况下,u与部分t或v结合,
[0400]
在式7和8的情况下,u与部分v结合,
[0401]
a1、a2、a3、a4和d1、d2、d3、d4彼此独立地选自c、n、s和o,特别地选自c和n,
[0402]
n是
[0403]
在式5和6的情况下,0和2之间的整数,
[0404]
在式7和8的情况下,0和2之间的整数,特别是0和1,
[0405]
q是0和2之间的整数,特别是0和1。
[0406]
在某些实施方式中,u选自式9、10、11或12的部分,特别是式9或10的部分,
[0407][0407]
其中
[0408]
t、v、y、w、e、q和n如上所述定义,
[0409]
在式9和10的情况下,u与部分t或v结合,
[0410]
在式11和12的情况下,u与部分v结合,
[0411]
所有部分a2、a3和a4是c,或a2、a3和a4中的两个是c并且a2、a3和a4中的其他两个是n,特别地a2和a3均是c,并且
[0412]
d2是c或n,特别是c。
[0413]
在某些实施方式中,u选自式9、10、11或12的部分,
[0414][0414]
其中
[0415]
t、v、y、w、e、q和n如上所述定义,
[0416]
在式9和10的情况下,u与部分t或v结合,
[0417]
在式11和12的情况下,u与部分v结合,
[0418]
a2和a3均是c,或a2和a3中的一个是c并且a2和a3中的另一个是n,
[0419]
d2是c或n。
[0420]
如果部分u包括含n的杂芳基,则n原子在酸性条件下被质子化并因此增加接头分子的溶解性。
[0421]
在某些实施方式中,u选自式13、14、15、16、17、18、19、20或21的部分,特别是式13至19的部分,更特别是式15或19的部分,
[0422][0423][0423]
其中
[0436][0437]
特别是-oh、-cl、特别是-oh、
[0438]
其中r
14
是c
1-c
6-烷基-、芳基-或苄基取代基。
[0439]
在某些实施方式中,z选自:-f、-cl、-br、-i、-n3、-oh、-sr
14
、-ocf3、-och2cf3、-oso2cf3、-so2c6h4ch3、-so2cf3、-so2ch3[0440][0441]
特别是-oh、-cl、特别是-oh、
[0442]
其中r
14
是c
1-c
6-烷基-、芳基-或苄基取代基。
[0443]
在某些实施方式中,式1的化合物选自式x1、x2、x3、x4、x5、x7、x8、x9、x10、x11、x12、x14、x15、x16、x17、x18、x19、x20、x21、x22、x23 x24、x25或x26的化合物。
[0444]
[0445]
[0446]
[0447]
[0448][0449]
在某些实施方式中,式1的化合物是式x9、x12、x19、x22、x8、x18、x1、x14、x15、x20、x7、x11、x17、x21、x2、x16、x23或x24的化合物。
[0450]
在某些实施方式中,式1的化合物是式x9、x12、x19、x22、x8、x18、x1、x14、x15或x20的化合物。
[0451]
在某些实施方式中,式1的化合物是式x9、x12、x19、x22或x8的化合物。
[0452]
在某些实施方式中,式1的化合物是式x1或x2的化合物。
附图说明
[0453]
图1示出了本发明的在固体载体上的肽修饰的示意图。spps=固相肽合成,sr=spps的合成树脂,s=修饰和纯化载体,p=需要修饰的肽,l=还原性可裂解接头,pg=保护基团,ipg=中间保护基团,b=形成环肽的反应性支架,mp=经修饰的肽,fa=脂肪酸,sp=间隔基,a=fa或fa-sp的活化a)接头偶联,b)tfa裂解,c)固定,d1)装订修饰,d2)脂肪酸修饰,d3)二硫化物形成,e)经修饰的肽的释放,i)中间保护基团的去保护。
[0454]
图2示出了通过使用本发明的接头分子x1对肽p1(h-ak(palm-γe-oh)efiawlvrgrg-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)在接头(x1)偶联和最终tfa裂解后p1的色谱图。3.)如权利要求1-9所述的通过palm-γglu(oh)-otbu偶联修饰和纯化后的p1的色谱图。
[0455]
图3示出了通过使用本发明的接头分子x1对肽p2(h-haegtftsdvssylegqaakefiawlvrgrg-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1-9所述的通过palm-γglu(oh)-otbu偶联修饰和纯化后的p2的色谱图。
[0456]
图4示出了通过使用本发明的接头分子x1对肽p3(h-crvpgdahhadslc-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过间二溴苄偶联修饰和纯化后的p3的色谱图。
[0457]
图5示出了通过使用本发明的接头分子x1对肽p4(h-vrcpgaahhadslc-nh2)进行本
发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过间二溴苄偶联修饰和纯化后的p4的色谱图。
[0458]
图6示出了通过使用本发明的接头分子x1对肽p5(h-vrvpgcahcadsly-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过间二溴苄偶联修饰和纯化后的p5的色谱图。
[0459]
图7示出了通过使用本发明的接头分子x1对肽p6(h-acswparclhqdlca-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过1,3,5-三(溴甲基)苯偶联修饰和纯化后的p6的色谱图。
[0460]
图8示出了通过使用本发明的接头分子x1对肽p7(h-acregflrclhrptvcg-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过1,3,5-三(溴甲基)苯偶联修饰和纯化后的p7的色谱图。
[0461]
图9示出了通过使用本发明的接头分子x1对肽p8(h-acynefgcedfydica-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p1偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)偶联修饰和纯化后的p8的色谱图。
[0462]
图10示出了通过使用本发明的接头分子x1对肽p8(h-acynefgcedfydica-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p8偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和10至12所述的通过1,3,5-三丙烯酰基-1,3,5-三嗪烷偶联修饰和纯化后的p8的色谱图。
[0463]
图11示出了通过使用本发明的接头分子x1对肽p3(h-crvpgdahhadslc-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)与p3偶联之前,粗肽样品的trail裂解的色谱图。2.)如权利要求1至5和权利要求13所述的通过dmso/(nh4)2co
3 ph 8.7中的空气氧化修饰和纯化后的p3的色谱图。
[0464]
图12示出了通过使用1-溴丙基-2,3-二棕榈酸酯(pam
2-br)的本发明经修饰的肽p12a(h-kkkksc(c3h5o
2-二palm)-nh2)的esi-ms谱。a=强度,b=m/z。
[0465]
图13示出了通过使用1-碘丙基-2,3-二棕榈酸酯(pam
2-i)的本发明的经修饰的肽p12b(h-kkkksc(c3h5o
2-二palm)-nh2)的esi-ms谱。a=强度,b=m/z。
[0466]
图14示出了通过使用palm-oc2h4i(pam-et-i)的本发明的经修饰的肽p12d(h-kkkksc(c2h4o-palm)-nh2)的esi-ms谱。a=吸收(210nm),b=时间/min。
[0467]
图15示出了通过使用1-溴丙基-2,3-二棕榈酸酯(pam
2-ots)的本发明经修饰的肽p13a(h-kekfsinsednngc(c3h5o
2-d二palm)-nh2)的esi-ms谱。a=强度,b=m/z。
[0468]
图16示出了通过使用1-碘丙基-2,3-二棕榈酸酯(pam2-i)的本发明经修饰的肽p13b(h-kekfsinsednngc(c3h5o
2-二palm)-nh2)的esi-ms谱。a=强度,b=m/z。
[0469]
图17示出了通过使用palm-oc2h4i(pam-et-i)的本发明经修饰的肽p14d(h-kkkksc(c2h4o-palm)-nh2)的uv色谱图;保留时间=2.25min。a=吸收(210nm),b=时间/min。
[0470]
图18示出了通过使用1-甲苯磺酰基丙基-2,3-二棕榈酸酯(x3)的本发明经修饰的肽p2/c(h-kekfsinsednngc(丙基-二palm)-nh2)的esi-ms谱。a=强度,b=m/z。
[0471]
图19示出了通过使用1-碘丙基-2,3-二棕榈酸酯(pam2-i)的本发明经修饰的肽p14b(h-c(c3h5o2-二palm)rg-nh2)的esi-ms谱。a=强度,b=m/z。
[0472]
图20示出了通过使用1-甲苯磺酰基丙基-2,3-二棕榈酸酯(pam2-ots)的本发明经修饰的肽p14c(h-c(c3h5o2-二palm)rg-nh2)的esi-ms谱。a=强度,b=m/z。
[0473]
图21示出了通过使用palm-oc2h4i(pam-et-i)的本发明经修饰的肽p14d h-c(c2h4o-palm)rg-nh2的uv色谱图;保留时间=1.61min。a=吸收(210nm),b=时间/min。
[0474]
图22示出了通过使用本发明的接头分子x1对肽p2b(h-haegtftsdvssylegqaak(palm-glu-oh)efiawlvrgrg-oh)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p2b偶联之后,粗肽样品的tfa裂解后的色谱图。2.)使用palm-glu(osu)-otbu作为-osu活化的脂肪酸间隔基缀合物,如示例实施例8中所述在固体载体上脂化后p2b的色谱图。
[0475]
图23示出了通过使用本发明的接头分子x1对肽p15(h-haibegtftsdvssylegqaak(co2h-ste-glu(aeea-aeea-oh)-oh)efiawlvrgrg-oh)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p15偶联之后,粗肽样品的tfa裂解后的色谱图。2.)使用tbuoc(o)-ste-glu(aeea-aeea-osu)-otbu作为-osu活化的脂肪酸间隔基缀合物,如示例实施例9中所述在固体载体上脂化后p15的色谱图。
[0476]
图24示出了通过使用本发明的接头分子x1对肽p16(palm-sggk(palm)wsk(palm)ssvigwpavrer-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p16偶联之后,粗肽样品的trial裂解的色谱图。2.)使用palm-s作为活化的脂质,如示例实施例10中所述在固体载体上脂化后p16的色谱图。
[0477]
图25示出了通过使用本发明的接头分子x1对肽p17a(palm-sggkwsk(palm)ssvigwpavrer-nh2)p17b(myr-sggkwsk(myr)ssvigwpavrer-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p17偶联之后,粗肽样品的trial裂解的色谱图。2.)使用palm-s作为具有间隔基的活化脂质,如示例实施例10中所述在固体载体上脂化后p17a的色谱图。2.)使用myr-osu作为活化的脂质,如示例实施例11中所述在固体载体上脂化后p17a的色谱图。
[0478]
图26示出了通过使用本发明的接头分子x1对肽p6(h-acswparclhqdlca-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p6偶联之前,粗肽样品的trial裂解的色谱图。2.)在接头(lus1)偶联和从spps树脂tfa裂解后p6的色谱图。3.)使用醛修饰的琼脂糖作为固相和dmso 10vol.%固定缓冲液2作为用于固定的肽溶剂,在如实施例12中所述用tatb进行分子内双环化并进行纯化后p6的色谱图。4.)使用醛修饰的聚(丙烯酸甲酯)珠作为固相和纯hfip作为用于固定的肽溶剂,在如实施例13中所述用tatb进行分子内双环化并进行纯化后p6的色谱图。5.)使用醛修饰的琼脂糖作为固相和dmso 10vol.%固定缓冲液2中的1m sds作为用于固定的肽溶剂,在如所要求的实施例14中所述用tatb进行分子内双环化并进行纯化后p6的色谱图。6.)使用醛修饰的聚(丙烯酸甲酯)珠作为固相和纯hfip作为用于固定的肽溶剂,在如实施例16中所述于1℃下用tatb进行分子内双环化并进行纯化后p6的色谱图。
[0479]
图27示出了通过使用本发明的接头分子x1对肽p8(h-acynefgcedfydica-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p8偶联之前,粗肽样品的trial裂解的色谱图。2.)在接头(lus1)偶联和从spps树脂tfa裂解后p8的色谱图。3.)使用醛修饰的琼脂糖作为固相和dmso 10vol.%固定缓冲液2作为用于固定的肽溶剂,在如实施例12中所述用tatb进行分子内双环化并进行纯化后p8的色谱图。4.)使用醛修饰的聚(丙烯酸甲酯)珠作为固相和纯hfip作为用于固定的肽溶剂,在如实施例13中所述用tatb进行分子内双环化并进行纯化后p8的色谱图。5.)使用醛修饰的琼脂糖作为固相和dmso 10vol.%固定缓冲液2中的1m sds作为用于固定的肽溶剂,在如实施例14中所述用tatb进行分子内双环化并进行纯化后p8的色谱图。6.)使用醛修饰的聚(丙烯酸甲酯)珠作为固相和纯hfip作为用于固定的肽溶剂,在如实施例16中所述于1℃下用tatb进行分子内双环化并进行纯化后p8的色谱图。
[0480]
图28示出了通过使用本发明的接头分子x1对肽p3(h-crvpgdahhadslc-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)偶联和最终tfa裂解后p3的色谱图。2.)在如权利要求1-9所述的二硫化物形成和纯化后p3的色谱图。
[0481]
图29示出了通过使用本发明的接头分子x1对肽p4(h-vrcpgaahhadslc-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头与p3偶联之前,粗肽样品的trail裂解的色谱图。2.)在接头(x1)偶联和最终tfa裂解后p4的色谱图。3.)在如权利要求1-9所述的二硫化物形成和纯化后p4的色谱图。
[0482]
图30示出了通过使用本发明的接头分子x1对肽p9(h-cyfqncprg-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)偶联和最终tfa裂解后p9的色谱图。2.)在如权利要求1-9所述的二硫化物形成和纯化后p9的色谱图。
[0483]
图31示出了通过使用本发明的接头分子x1对肽py(h-kcntatcatqrlanflvhssnfgpilpptnvgsnty-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)偶联和最终tfa裂解后py的色谱图。2.)在如权利要求1-9所述的二硫化物形成和纯化后py的色谱图。
[0484]
图32示出了通过使用本发明的接头分子x1对肽pz(h-cceyccnpactgcy-nh2)进行本发明的肽修饰/纯化的实例。a=吸收(210nm),b=时间/min;1.)在接头(x1)偶联和最终tfa裂解后py的色谱图。2.)在如权利要求1-9所述的二硫化物形成和纯化后py的色谱图。
[0485]
图33示出了脂化肽p的形成。肽p固定在固体载体(灰色球)上并且肽包含赖氨酸。在第一步中,有机分子palm-glu-otbu与赖氨酸侧链偶联。棕榈酰(palm)对应于部分fa,由叔丁基(glu-otbu)保护的谷氨酸部分对应于间隔基sp-oh。在第二步中,在酸性条件下除去保护性叔丁基保护基团。
具体实施方式
[0486]
实施例
[0487]
一般方法
[0488]
固相肽合成(spps)接头偶联和tfa裂解:
[0489]
在标准固相肽合成条件下,在intavis multipep rsi上以100μmol规模合成肽序列p1-p8,其中在每个氨基酸偶联后用乙酸酐和吡啶处理合成树脂以封闭未反应的氨基。在
接头偶联之前将树脂预溶胀15min。通过使用4当量接头x1(301mg)、6当量oxyma(86mg)和6当量二异丙胺(diea,105μl)在1.3ml dmf中2h,将接头x1偶联到树脂上的p1-p17。使用的量基于spps树脂(rinkamide ram)的负载量。将反应混合物摇动120min,过滤,洗涤(3x dmf,3x dcm)并干燥。
[0490]
将干燥的树脂与tfa-裂解混合物((tfa/h2o/phoh/phsh/乙二硫醇,82.5:5:5:52.5,v/v/w/v/v,每100μmol合成规模10ml)孵育120min。通过过滤将裂解溶液与合成树脂分离并收集在溶液体积的10倍的falcon管中。通过添加9倍体积的冷冻二乙醚,使肽沉淀。将容器以5000rpm离心3.5min,倾析出上清液,并再次用二乙醚洗涤肽沉淀,然后倾析。然后将肽溶解在h2o/mecn/tfa(99.95:99.95:0.1,v/v/v)中,用液氮冷冻并在高真空下冻干。
[0491]
通过本发明方法修饰和纯化肽的一般程序
[0492]
粗接头标记的肽的溶解和固定
[0493]
将粗接头标记的肽混合物溶解在纯dmso(4.5ml用于100μmol合成规模)中。完全溶解后,添加10vol.%的固定缓冲液2(0.1m柠檬酸/na2co3ph 3.5,含8m盐酸胍,0.45ml用于100μmol合成规模)。
[0494]
将接头标记的肽固定在1.5倍量的负载有100μmol/1ml沉降珠(100μmol/2ml浆料珠)的醛修饰的琼脂糖上,或羟基化聚(丙烯酸甲酯)珠上。等分后,将珠材料用3xmilli-q水和3x固定缓冲液1(0.1m柠檬酸/na2co3ph 4.5)洗涤。然后将溶解的粗接头标记的肽混合物添加到琼脂糖并摇动。值得注意的是,珠在固定溶液中应具有自由和良好的波动。在90分钟的反应时间后,吸滤出固定溶液。
[0495]
洗涤
[0496]
固定后,去除上清液,并将用接头连接到肽的珠用dmso 5ml(用于100μmol规模)每个洗涤3次。然后添加l-半胱氨酸在0.1m柠檬酸/na2co3ph 4.5中的混合物,并将反应器摇动15min或更长时间。移除该混合物,并将珠用5ml(用于100μmol规模)的以下溶剂和溶液洗涤3次:
[0497]
1)具有0.9m盐酸胍的dmso
[0498]
3)0.1m nacl milli-q水中的70%乙醇
[0499]
固体载体上固定肽的修饰
[0500]
通常,在将接头标记的肽固定在修饰/纯化载体上并洗涤所述肽-载体缀合物之后,进行靶肽的修饰。
[0501]
在对肽进行脂肪酸修饰的情况下,在靶肽的固定和洗涤之后,可以用过量的醛构建赖氨酸侧链的亚胺,并且通过添加o-甲基羟胺盐酸盐或l-半胱氨酸将所述醛转化为肟。此后,在预活化时间后,将脂肪酸与偶联试剂和有机碱一起添加到载体上的肽。此后,洗涤掉过量的试剂并如下所述释放肽。
[0502]
在通过亲电子支架形成大环的情况下,在靶肽的固定和洗涤之后,可以通过添加少量的dtt减少构建的二硫化物。在洗涤掉dtt后,将亲电子支架添加到载体中。如有必要,可重复该步骤以增加向大环产物的转化。此后,洗涤掉过量的试剂并如下所述释放肽。
[0503]
在形成二硫化物的情况下,在靶肽的固定和洗涤之后,可以用过量的醛构建赖氨酸侧链的亚胺和半胱氨酸侧链的硫缩醛,并且通过添加盐酸胍将所述醛转化为噻唑烷。二硫化物在dmso和0.4m(nh4)2co3,6m gdmcl的1比1混合物中在载体上形成。此后,洗涤掉氧化
缓冲液并如下所述释放肽。
[0504]
经修饰的肽的释放
[0505]
将500mg二硫苏糖醇(dtt)溶解在5ml的5w.%nahco3 ph8中,添加到琼脂糖或聚(丙烯酸甲酯)材料中,5ml mecn已经在珠上并摇动15min。弃去上清液,并将琼脂糖材料用水洗涤3x并用mecn洗涤2x,以去除过量的dtt和氧化的dtt。随后,添加2ml tfa/h2o(2:3)并再摇动60min。然后将另外2ml纯tfa添加到溶液中,将混合物洗脱并收集在falcon管中。将其再洗脱两次,每次用2ml tfa/h2o(95:5)。通过添加9倍体积的深度冷冻二乙醚使接头肽沉淀,并然后以5000rpm离心3.5min,然后倾析出醚相。该肽现作为颗粒存在,并且如有必要可以冻干。
[0506]
用于fa-a和fa-sp-a的有机合成的实验说明
[0507]
1-溴丙基-2,3-二棕榈酸酯(pam
2-br)的合成
[0508]
将1,2-二棕榈酰基-sn-甘油(0.4g,0.7mmol,1当量)溶解在9ml dcm中并添加四溴甲烷(0.5g 1.5mmol,2.1当量)。将溶液冷却至0℃并在5min内分批添加三苯基膦(0.4g 1.5mmol,2.1当量)。在0℃下搅拌30min后,移除冰浴并在室温下继续搅拌3h。在减压下去除溶剂。添加环己烷并将混合物超声处理约10min。离心后,将上清液转移到干净的管中并且减压去除溶剂,得到粗产物。为了去除残余的o=pph3,在超声浴中用meoh处理产物。离心后,倾析溶剂。重复用甲醇洗涤两次,得到作为灰白色固体的1-溴丙基-2,3-二棕榈酸酯(pam
2-br)(0.17g,0.27mmol,39%)。
[0509]
rf=0.68(氯仿/乙酸乙酯96:4);uplc-ms:tr=5.69min(梯度0-3min 40-100%d(0.1%tfa于9:1mecn/iproh中)于c(0.1%tfa于8:1:1h2o/mecn/iproh中)中,3-6min 100%d);uplc-纯度(210nm)≥98%;esi-ms:(计算值[m na]
:653.41,655.41,实测值:653.21,655.68;计算值[m-ococ
15h31
]
·
:375.19,377.19,实测值:375.27,377.26)。
[0510]1h nmr(400mhz,cdcl3)δ5.21(qd,j=5.5,4.4hz,1h),4.29(ddd,j=17.5,11.9,5.0hz,2h),3.50(qd,j=10.9,5.5hz,2h),2.34(m,4h),1.62(m,4h),1.28(m,48h),0.88(t,j=6.9hz,6h)。
[0511]
1-碘丙基-2,3-二棕榈酸酯(pam
2-i)的合成
[0512]
将1,2-二棕榈酰基-sn-甘油(0.5g,0.88mmol,1当量)、咪唑(0.12g,1.76mmol,2当量)和三苯基膦(0.5g 1.99mmol,2.3当量)溶解在7.5ml thf中。将i2(0.32g 1.67mmol,2.0当量)缓慢添加到溶液中。在室温下搅拌4h后,添加250mg nahco3和1ml水以淬灭反应。反应混合物的颜色消失。将溶剂蒸发并用4ml水洗涤残余物。将悬浮液离心并倾析出上清液。粗产物在超声浴中用6ml meoh处理几分钟。离心后,倾析出上清液。沉淀物用6ml meoh再洗涤四次。将产物真空干燥,得到0.47g(0.69mmol,78%)作为灰白色固体的1-碘丙基-2,3-二棕榈酸酯。
[0513]
rf=0.66(氯仿/乙酸乙酯96:4);uplc-ms:tr=5.83min(梯度0-3min 40-100%d于c中,3-6min 100%d);uplc-纯度(210nm)≥90%;esi-ms:(计算值[m na]
:701.40,实测值:701.50;计算值[m-ococ
15h31
]
·
:423.18,实测值:423.28)。
[0514]1h nmr(400mhz,cdcl3)δ5.00(m,1h),4.26(ddd,j=17.6,11.8,5.0hz,2h),3.31(ddd,j=27.4,10.7,5.8hz,2h),2.33(m,4h),1.63(m,4h),1.28(m,48h),0.88(t,j=6.8hz,6h)。
[0515]
1-甲苯磺酰基丙基-2,3-二棕榈酸酯(pam
2-ots)的合成
[0516]
将4-甲苯磺酰氯(2g,10.5mmol,10当量)溶解在50ml thf中。用冰浴将溶液冷却至0℃。在室温下将1,2-二棕榈酰基-sn-甘油(0.6g,1.05mmol,1当量)溶解在14.4ml thf中,并添加2.84ml 15w%naoh水溶液(10.7mmol,10当量)。缓慢添加4-甲苯磺酰氯溶液并将反应混合物在室温搅拌4h。在减压下蒸发溶剂并将残余物吸收在氯仿中。将有机相用盐水洗涤三次,用水洗涤三次,并然后用na2so4干燥。过滤后,减压除去溶剂,得到作为黄色液体的粗产物,其在真空干燥后转变为固体。添加5ml冷却的meoh并将所得混合物超声处理10min。离心后,倾析出上清液。将残余物用meoh再处理五次以除去过量的甲苯磺酰氯。将产物真空干燥,得到0.47g(0.64mmol,61%)灰白色固体。
[0517]
rf=0.64(氯仿/乙酸乙酯96:4);uplc-ms:tr=4.99min(梯度0-3min 40-100%d于c中,3-6min 100%d);uplc-纯度(210nm)=93%;esi-ms:(计算值[m na]
:745.51,实测值:745.68)。
[0518]1h nmr(400mhz,cdcl3)δ7.80(t,j=8.0hz,2h),7.35(dd,j=8.2,3.1hz,2h),4.88(m,1h),4.18(m,4h),2.45(s,3h),2.23(m,4h),1.56(m,4h),1.27(m,48h),0.88(t,j=7.0hz,6h)。
[0519]
用于合成2-碘乙基棕榈酸酯(pam-et-i)的合成步骤
[0520]
棕榈酰氯
[0521]
将亚硫酰氯(7.2ml,100mmol,10当量)缓慢滴加到圆底烧瓶中的棕榈酸(2.6g,9.9mmol,1当量)中。在室温下搅拌30min后,将反应混合物在75℃下搅拌2h。溶液用dcm稀释并用水洗涤3次。有机层用na2so4干燥。通过过滤除去盐,并且在减压下除去溶剂。将所得溶液真空干燥,得到作为无色固体的产物(2.47g,9mmol,90%)。
[0522]
rf=0.52(氯仿/乙酸乙酯96:4)。
[0523]
2-碘乙基棕榈酸酯(pam-et-i)
[0524]
在氮气气氛下,向2-碘乙醇(0.71ml,9.1mmol,5当量)在18ml dcm中的溶液中添加三乙胺(0.5ml,3.6mmol,3当量)。将溶液在0℃搅拌30min。在0℃下添加棕榈酰氯(0.5g,1.8mmol,1当量)。在室温下继续搅拌4h。将溶液依次洗涤3次,每次用水和饱和nahco3水溶液洗涤。在用na2so4干燥并过滤后,在真空下除去溶剂。将所得粗产物在超声浴中用meoh处理并将悬浮液离心。倾出上清液,并将残余物再用meoh洗涤两次。合并来自第二次和第三次洗涤的meoh溶液并在室温下保持过夜以使产物结晶为无色针状物。除去溶剂并将晶体真空干燥,得到0.15g(0.36mmol,20%)产物。
[0525]
rf=0.43(氯仿/乙酸乙酯96:4。
[0526]1h nmr(400mhz,cdcl3)δ4.33(t,j=6.8hz,2h),3.29(t,j=6.8hz,2h),2.33(t,j=7.5hz,2h),1.64(p,j=7.4hz,2h),1.26(m,24h),0.88(t,j=6.9hz,3h)。
[0527]
肉豆蔻酸n-羟基琥珀酰亚胺酯(myr-osu)的合成
[0528]
向1g肉豆蔻酸(4.33mmol,1当量)和554mg n-羟基琥珀酰亚胺(4.77mmol,1.1当量)在44ml乙腈中的搅拌溶液中添加994mg二环己基碳二亚胺(dcc,4.77mmol,1.1当量)并将混合物搅拌1.5h。通过过滤除去形成的沉淀,并将滤液用50ml乙腈洗涤。然后通过在减压下蒸发溶剂并干燥获得1.430g(4.33mmol,定量产率)期望的白色结晶标题化合物。esi-ms:(计算值[m na]
:348.22,实测值:348.28)。
[0529]
22-(叔丁氧基羰基)-43,43-二甲基-10,19,24,41-四氧亚基-3,6,12,15,42-五氧杂-9,18,23-三氮杂四十四烷酸n-羟基琥珀酰亚胺酯(tbuoc(o)-ste-glu(aeea-aeea-osu)-otbu)的合成
[0530]
向260g 22-(叔丁氧基羰基)-43,43-二甲基-10,19,24,41-四氧亚基-3,6,12,15,42-五氧杂-9,18,23-三氮杂四十四烷酸(0.3mmol,1当量)和39mg n-羟基琥珀酰亚胺(0.33mmol,1.1当量)在6ml乙腈中的搅拌溶液中添加67mg dcc(0.33mmol,1.1当量)并将混合物搅拌1.5h。通过过滤除去形成的沉淀,并将滤液用10ml乙腈洗涤。然后在蒸发溶剂并在减压下干燥后获得0.305g(0.30mmol,定量产率)的作为无色油的期望标题化合物。esi-ms:(计算值[m h]
:943.59,实测值:943.72)。
[0531]
实施例1:利用棕榈酰基-l-glu(oh)-tbu-构建单元的与纯化固体载体结合的脂化肽p1-p2a的形成
[0532]
将本发明的肽修饰和纯化方法应用于两种不同长度和极性的肽,它们是h-akefiawlvrgrg-nh2(seq id no:1)(p1),其是胰高血糖素样肽-1(glp-1)的片段25-37(k34r),和h-haegtftsdvssylegqaakefiawlvrgrg-nh2(seq id no:2)(p2a),其是胰高血糖素样肽-1(glp-1)的更长序列7-37(k34r)。
[0533]
根据一般方法以5μmol规模固定和洗涤肽,作为与一般方法的不同,在固定和去除固定上清液后,添加固定缓冲液1(0.1m柠檬酸/na2co3ph 4.5)中的o-甲基羟胺盐酸盐溶液(4q.,0.1m)并摇动20min。在根据一般方法洗涤后,用在dmf和3x dmf中的10vol.%吡啶溶液洗涤3次。然后添加由dmf中的2-(6-氯-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲鎓六氟磷酸盐(hctu)或二异丙基碳二亚胺(dic)、10当量oxyma和12当量的棕榈酰基-l-glu(oh)-tbu构建单元组成的0.3m偶联溶液。在添加至琼脂糖珠之前,将该溶液预活化20min。在添加后,将珠摇动2小时,然后过滤上清液,并用3x dmf、3x h2o和3x mecn洗涤固体载体,然后在一般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放经修饰的肽。为了去除引入的棕榈酰基-l-glu-tbu基团的tbu保护,将释放的肽沉淀溶解在tfa/tis/h2o(96:2:2,v/v/v)中,并在2h后在10倍体积的et2o中沉淀。
[0534]
h-ak(palm-γe-oh)efiawlvrgrg-nh2:肽前体p1已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元palm-γglu(oh)-otbu修饰并纯化。结果如图2和表1所示。
[0535]
h-haegtftsdvssylegqaak(palm-γe-oh)efiawlvrgr g-nh2:肽前体p2已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元palm-γglu(oh)-otbu修饰并纯化。结果如图3和表1所示。
[0536]
实施例2:利用间二溴苄的与纯化固体载体结合的肽p3-p5的大环的形成(分子间环化)
[0537]
将本发明的肽修饰和纯化方法应用于三种半胱氨酸位置和极性的肽,它们是h-crvpgdahhadslc-nh2(seq id no:3)(p3)、h-vrcpgaahhadslc-nh2(seq id no:4)(p4)和h-vrvpgcahcadsly-nh2(seq id no:5)(p5)。
[0538]
根据一般方法以25μmol规模固定和洗涤肽。向固定的肽中添加h2o中的dtt(4当量,0.3m),并将反应器摇动15min。在通过过滤除去dtt溶液后,将珠材料用3x h2o和3x mecn洗涤。随后,添加乙腈中的间二溴苄(mdbx)(4当量,0.6m),并随后添加相同体积的环化
缓冲液(200mm nh4hco3,ph 7.9)。将注射器反应器摇动45min,将反应混合物滤出并用3x mecn和3x h2o洗涤珠材料。然后在dtt处理后重复该方案两次,并且最后在一般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放环化肽。
[0539]
h-crvpgdahhadslc-nh2(带下划线的c残基通过支架连接):肽前体p3已按照以上spps段落中的描述合成。其已根据上述方法固定并且用间二溴苄(mdbx)支架修饰并纯化。结果如图4和表1所示。
[0540]
h-vrcpgaahhadslc-nh2(带下划线的c残基通过支架连接):肽前体p4已按照以上spps段落中的描述合成。其已根据上述方法固定并且用mdbx支架修饰并纯化。结果如图5和表1所示。
[0541]
h-vrvpgcahcadsly-nh2(带下划线的c残基通过支架连接):肽前体p4已按照以上spps段落中的描述合成。其已根据上述方法固定并且用mdbx支架修饰并纯化。结果如图5和表1所示。
[0542]
实施例3:利用1,3,5-三(溴甲基)苯的与纯化固体载体结合的肽p6-p7的双环大环的形成(分子间环化)
[0543]
将本发明的肽修饰和纯化方法应用于两种不同的肽,它们是h-acswparclhqdlca-nh2(seq id no:6)(p6)和h-acregflrclhrptvcg-nh2(seq id no:7)(p7)。
[0544]
根据一般方法以5μmol规模固定和洗涤肽。向固定的肽中添加h2o中的dtt(4当量,0.3m),并将反应器摇动15min。在通过过滤除去dtt溶液后,将珠材料用3x h2o和3x dmf洗涤。随后,添加二甲基甲酰胺中的1,3,5-三(溴甲基)苯(tbmb)(4当量,0.45m),并随后添加一半该体积的环化缓冲液(400mm nh4hco3,8m gdmcl,ph 8.0)。将注射器反应器摇动45min,将反应混合物滤出并用3x dmf和3x h2o洗涤珠材料。然后在dtt处理后重复该方案两次,并且最后在一般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放环化肽。
[0545]
h-acswparclhqdlca-nh2(带下划线的c残基通过支架连接):肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法固定并且用1,3,5-三(溴甲基)苯(tbmt)支架修饰并纯化。结果如图7和表1所示。
[0546]
h-acregflrclhrptvcg-nh2(带下划线的c残基通过支架连接):肽前体p7已按照以上spps段落中的描述合成。其已根据上述方法固定并且用1,3,5-三(溴甲基)苯(tbmt)支架修饰并纯化。结果如图8和表1所示。
[0547]
实施例4:利用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)的与纯化固体载体结合的肽p8a的双环大环的形成(分子间环化)
[0548]
将本发明的肽修饰和纯化方法应用于肽h-acynefgcedfydica-nh2(seq id no:8)(p8a)。
[0549]
根据一般方法以5μmol规模固定和洗涤肽。向固定的肽中添加h2o中的dtt(4当量,0.3m),并将反应器摇动15min。在通过过滤除去dtt溶液后,将珠材料用3x h2o和3x mecn洗涤。随后,添加mecn/环化缓冲液(400mm nh4hco3,8m gdmcl,ph7.1;9:1)中的1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)。将注射器反应器摇动120min,将反应混合物滤出并用3x h2o和3x mecn洗涤珠材料。然后在dtt处理后重复该方案两次,并且最后在一
般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放环化肽。
[0550]
h-acynefgcedfydica-nh2(带下划线的c残基通过支架连接):肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法固定并且用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tbmt)支架修饰并纯化。结果如图9和表1所示。
[0551]
实施例5:利用1,3,5-三丙烯酰基-1,3,5-三嗪烷的与纯化固体载体结合的肽p8b的双环大环的形成(分子间环化)
[0552]
将本发明的肽修饰和纯化方法应用于肽h-acynefgcedfydica-nh2(seq id no:8)(p8b)。
[0553]
根据一般方法以5μmol规模固定和洗涤肽。向固定的肽中添加h2o中的dtt(4当量,0.3m),并将反应器摇动15min。在通过过滤除去dtt溶液后,将珠材料用3x h2o和3x mecn洗涤。随后,添加mecn/环化缓冲液(400mm nh4hco3,8m gdmcl,ph7.1;9:1)中的1,3,5-三丙烯酰基-1,3,5-三嗪烷(tata)。将注射器反应器摇动120min,将反应混合物滤出并用3x h2o和3x mecn洗涤珠材料。然后在dtt处理后重复该方案两次,并且最后在一般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放环化肽。
[0554]
h-acynefgcedfydica-nh2(带下划线的c残基通过支架连接):肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法固定并且用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tbmt)支架修饰并纯化。结果如图10和表1所示。
[0555]
实施例6:通过二硫化物的与纯化固体载体结合的肽p3b的大环的形成(分子内环化)
[0556]
将本发明的肽修饰和纯化方法应用于肽h-crvpgdahhadslc-nh2(seq id no:3)(p3b)。
[0557]
根据一般方法以10μmol规模固定和洗涤肽。随后添加dmso和0.4m(nh4)2co3,6m gdncl,ph 8.7的一比一混合物并将注射器反应器摇动120min,过滤出反应混合物并用3x h2o洗涤珠材料。在一般方法\经修饰的肽的释放中给出的条件下使用mecn/acoh/h2o(9:0.5:0.5,v/v/v)中的pph3代替dtt释放环化肽,产生22%的二硫化物环化肽。
[0558]
h-crvpgdahhadslc-nh2(带下划线的c残基通过支架连接):肽前体p3已按照以上spps段落中的描述合成。其已根据上述方法固定并且通过空气氧化修饰并纯化。结果如图11和表1所示。
[0559]
实施例7:利用构建单元1-溴丙基-2,3-二棕榈酸酯(a)、1-碘丙基-2,3-二棕榈酸酯(b)、1-甲苯磺酰基-2,3-二棕榈酸酯(c)或palm-oc2h4i(d)的与纯化固体载体结合的脂化肽p1
–
p3的形成
[0560]
将本发明的肽修饰和纯化方法应用于两种不同长度和极性的肽,它们是模型肽h-kkkksc-nh2(seq id no:12)(p12)、h-kekfsinsednngc-nh2(seq id no:13)(p13)和h-crg-nh2(seq id no:14)(p14)。
[0561]
根据一般方法以5μmol规模固定接头标记的肽。在除去固定溶液后,将琼脂糖珠用dmso洗涤3x。添加250μl的2w%l-半胱氨酸(5mg)在缓冲液1中的溶液并摇动15min。将溶液抽吸滤出,并如一般方法中所述对用接头连接到肽的珠进行洗涤。为了还原接头和去除肽
中半胱氨酸残基的stbu保护基团,制备了25mg(162μmol,32当量)dtt在250μl 5w%nahco3水溶液中的还原溶液。将250μl mecn添加到琼脂糖珠中,然后添加还原溶液。将在半胱氨酸上具有stbu保护基团的肽(p1-p2)的混合物摇动60min,没有stbu的(p3)摇动15min,然后将溶液抽滤。将具有接头连接的肽的琼脂糖珠用水洗涤3x,用mecn洗涤2x,并且用dmf洗涤3x。添加3.2mg(10μmol,2当量)cs2co3在200μldmf中的超声悬浮液。添加20μmol棕榈酰基构建单元(4当量,a)palm
2-丙基-br=12.6mg,b)palm
2-丙基-i=13.6mg,c)palm
2-丙基-ots=14.5mg,d)palm-oc2h4i)在300μl dmf中的溶液。将混合物摇动18-76h。在随着时间形成一些沉淀的情况下,再添加200
–
400μl dmf。去除上清液,然后将珠用dmf洗涤5x,用水洗涤3x,并用mecn洗涤3x。添加200μl tfa/水(40:60)并摇动60min以释放肽。将200μl tfa添加到筒中,并将溶液收集在15ml离心管中。将琼脂糖珠用200μl tfa/水(95:5)洗脱2x到同一管中。将10l冷却的et2o添加到含有脂化肽p1或p2的tfa/水溶液中以使肽沉淀。收集沉淀物并用乙醚洗涤一次。将肽溶解在水/mecn(1:1)中并冻干。对于含有脂化肽p3的样品,将tfa/水溶液在气流下浓缩。添加水/mecn(1:1),并且将样品冻干。
[0562]
h-kkkksc(c3h5o
2-二palm)-nh2(p12a):肽前体p12a已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-溴丙基-2,3-二棕榈酸酯(棕榈酰化时间=18h)修饰。结果如表1和图12所示。
[0563]
h-kkkksc(c3h5o
2-二palm)-nh2(p12b):肽前体p12b已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-碘丙基-2,3-二棕榈酸酯(棕榈酰化时间=18h)修饰。结果如表1、图1和图13所示。
[0564]
h-kkkksc(c2h4o-palm)-nh2(p12d):肽前体p12d已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元palm-oc2h4i(棕榈酰化时间=18h)修饰。结果如表1和图14所示。
[0565]
h-kekfsinsednngc(c3h5o
2-二palm)-nh2(p13a):肽前体p13a已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-溴丙基-2,3-二棕榈酸酯(棕榈酰化时间=18h)修饰。结果如表1和图15所示。
[0566]
h-kekfsinsednngc(c3h5o
2-二palm)-nh2(p13b):肽前体p13b已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-碘丙基-2,3-二棕榈酸酯(棕榈酰化时间=18h)修饰。结果如表1和图16所示。
[0567]
h-kekfsinsednngc(c2h4o-palm)-nh2(p13d):肽前体p13d已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元palm-oc2h4i(棕榈酰化时间=18h)修饰。结果如表1和图17所示。
[0568]
h-c(c3h5o
2-二palm)rg-nh2(p14b):肽前体p14b已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-碘丙基-2,3-二棕榈酸酯(棕榈酰化时间=76h)修饰。结果如表1和图18所示。
[0569]
h-c(c3h5o
2-二palm)rg-nh2(p14b):肽前体p14c已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元1-甲苯磺酰基丙基-2,3-二棕榈酸酯(棕榈酰化时间=76h)修饰。结果如表1和图19所示。
[0570]
h-c(c2h4o-palm)rg-nh2(p14d):肽前体p13c已按照以上spps段落中的描述合成。其已根据上述方法固定并且用棕榈酸(palm)构建单元palm-oc2h4i(棕榈酰化时间=18h)修
5w%nahco3水溶液(0.6m;ph 8)中的1.9mg tcep并继续摇动15min。此后,过滤掉上清液并用3x h2o、2x mecn和3x5w%nahco3水溶液(0.6m;ph 8)洗涤固体载体。将125μl 5w%nahco3水溶液(0.6m;ph 8)添加到固体载体,然后添加125μl mecn中的tatb(1-2当量)。将珠摇动60min,然后用3x h2o和3x mecn洗涤。按照一般方法的条件释放经修饰的肽。
[0594]
h-acswparclhqdlca-nh2:肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法以1.3μmol规模固定并且用tatb修饰。结果如表lus1和图26 3.)所示。得到1.1mg纯度为69%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:941.1m/z,实测值:940.7m/z)。
[0595]
h-acynefgcedfydica-nh2:肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法以1.0μmol规模固定并且用tatb修饰。结果如表lus1和图27 3.)所示。得到3.0mg纯度为45%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:1035.6m/z,实测值:1035.5m/z)。
[0596]
实施例13:利用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)的与纯化固体载体(醛修饰的聚(丙烯酸甲酯))结合的肽p6和p8a的大环的形成(分子内双环化)
[0597]
将本发明的肽修饰和纯化方法应用于两种不同长度、半胱氨酸位置和极性的肽,它们是h-acswparclhqdlca-nh2(seq id no:x)(p6)和h-acynefgcedfydica-nh2(seq id no:x)(p8)。
[0598]
将粗接头标记的肽溶解于纯hfip中,并在作为固体载体的醛修饰的聚(丙烯酸甲酯)上固定16h并洗涤。在固定并去除固定上清液后,添加o-甲基羟胺盐酸盐溶液(h2o中5w%,250μl),并将固定的肽摇动15min。在根据一般方法洗涤后,将接头还原,并且通过添加250μl 5w%nahco3水溶液(0.6m;ph 8)中的12.5mg dtt并摇动60min来去除stbu保护基团。随后,添加溶解于30μl 5w%nahco3水溶液(0.6m;ph 8)中的1.9mg tcep并继续摇动15min。此后,过滤掉上清液并用3x h2o、2x mecn和3x 5w%nahco3水溶液(0.6m;ph 8)洗涤固体载体。将125μl5w%nahco3水溶液(0.6m;ph 8)添加到固体载体,然后添加125μl mecn中的tatb(1-2当量)。将珠摇动60min,然后用3x h2o和3x mecn洗涤。通过用0.4ml tfa/h2o(95:5)处理固体载体1h,随后添加0.4ml tfa并用2x0.4ml tfa/h2o(95:5)洗脱肽,从而释放经修饰的肽。释放的经修饰的肽用10ml冷et2o沉淀,并且在将混合物在冰箱中冷却15-30min后,对其进行离心,并倾析出上清液。
[0599]
h-acswparclhqdlca-nh2:肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法以1.3μmol规模固定并且用tatb修饰。结果如表lus1和图26 4.)所示。得到1.5mg纯度为70%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:941.1m/z,实测值:941.0m/z)。
[0600]
h-acynefgcedfydica-nh2:肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法以1.0μmol规模固定并且用tatb修饰。结果如表lus1和图27所示。得到4.7mg纯度为44%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:1035.6m/z,实测值:1035.3m/z)。
[0601]
实施例14:以十二烷基硫酸钠作为用于肽溶解的添加剂的利用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)的与纯化固体载体(醛修饰的琼脂糖)结合的肽p6和p8的大环的形成(分子内双环化)
[0602]
将本发明的肽修饰和纯化方法应用于两种不同长度、半胱氨酸位置和极性的肽,它们是h-acswparclhqdlca-nh2(seq id no:x)(p6)和h-acynefgcedfydica-nh2(seq id no:x)(p8)。
[0603]
将粗接头标记的肽根据一般方法固定16h并洗涤,作为与一般方法的不同,使用dmso 10vol.%固定缓冲液2中的1m sds进行肽溶解,并且在固定并去除固定上清液后,添加o-甲基羟胺盐酸盐溶液(h2o中5w%,250μl),并将固定的肽摇动15min。在根据一般方法洗涤并用h2o/meoh(9:1)中的3x 8m尿素额外洗涤后,将接头还原,并且通过添加250μl 5w%nahco3水溶液(0.6m;ph 8)中的12.5mg dtt并摇动60min来去除stbu保护基团。随后,添加溶解于30μl 5w%nahco3水溶液(0.6m;ph 8)中的1.9mg tcep并继续摇动15min。此后,过滤掉上清液并用3x h2o、2x mecn和3x 5w%nahco3水溶液(0.6m;ph 8)洗涤固体载体。将125μl 5w%nahco3水溶液(0.6m;ph 8)添加到固体载体,然后添加125μl mecn中的tatb(1-2当量)。将珠摇动60min,然后用3x h2o和3x mecn洗涤。按照一般方法的条件释放经修饰的肽。
[0604]
h-acswparclhqdlca-nh2:肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法以1.3μmol规模固定并且用tatb修饰。结果如表lus1和图26 5.)所示。得到5.8mg纯度为61%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:941.1m/z,实测值:940.7m/z)。
[0605]
h-acynefgcedfydica-nh2:肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法以1.0μmol规模固定并且用tatb修饰。结果如表lus1和图27 5.)所示。得到6.3mg纯度为43%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:1035.6m/z,实测值:1034.9m/z)。
[0606]
实施例15:以十二烷基硫酸钠作为用于肽溶解的添加剂的利用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)的与纯化固体载体(醛修饰的聚(丙烯酸甲酯))结合的肽p6和p8a的大环的形成(分子内双环化)
[0607]
如实施例13所述,将粗接头标记的肽固定在作为固体载体的醛修饰的聚(丙烯酸甲酯)上,而如实施例14所述,使用dmso 10vol.%固定缓冲液2中的1m sds而不是纯hfip进行肽溶解。作为不同,将40vol.%的珠体积的苯胺缓冲溶液(h2o/acoh(9:1)中0.79w%nh4oac中的0.46vol.%苯胺)添加到固体载体中,然后添加溶解的肽。如实施例13中所述,将固定的肽洗涤,用tatb修饰并释放。作为不同,在固定和洗涤肽之后,将其另外用h2o/meoh(9:1)中的3x 8m尿素洗涤。
[0608]
h-acswparclhqdlca-nh2:肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法以1.3μmol规模固定并且用tatb修饰。获得了与实施例3类似的结果,并示出在表lus1中。得到3.9mg纯度为55%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:941.1m/z,实测值:940.7m/z)。
[0609]
h-acynefgcedfydica-nh2:肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法以1.0μmol规模固定并且用tatb修饰。获得了与实施例3类似的结果,并示出在表lus1中。得到3.7mg纯度为48%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:1035.6m/z,实测值:1035.3m/z)。
[0610]
实施例16:在冷却的同时利用1,1’,1
”‑
(1,3,5-三嗪烷-1,3,5-三基)三(2-溴乙酮)(tatb)的与纯化固体载体(醛修饰的琼脂糖或聚(丙烯酸甲酯))结合的肽p6和p8的大环的形成(分子内双环化)
[0611]
将本发明的肽修饰和纯化方法应用于两种不同长度、半胱氨酸位置和极性的肽,它们是h-acswparclhqdlca-nh2(seq id no:x)(p6)和h-acynefgcedfydica-nh2(seq id no:x)(p8)。
[0612]
如实施例lus1或lus2中所述,将粗接头标记的肽分别在作为固体载体的醛修饰的琼脂糖或聚(丙烯酸甲酯)上固定、洗涤、用tatb修饰和释放,作为与该方法的不同,用tatb的修饰通过将反应容器保持在冰水浴中在1℃的温度下进行。
[0613]
h-acswparclhqdlca-nh2:肽前体p6已按照以上spps段落中的描述合成。其已根据上述方法以1.3μmol规模在醛修饰的聚(丙烯酸甲酯)上固定并用tatb修饰。结果如表lus1和图266.)所示。得到6.2mg纯度为69%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:941.1 m/z,实测值:940.5 m/z)。
[0614]
h-acynefgcedfydica-nh2:肽前体p8已按照以上spps段落中的描述合成。其已根据上述方法以1.0μmol规模在醛修饰的聚(丙烯酸甲酯)上固定并用tatb修饰。结果如表lus1和图276.)所示。得到7.1mg纯度为44%的经修饰的肽,为白色粉末。esi-ms:(计算值mh
2
:1035.6 m/z,实测值:1035.2 m/z)。
[0615]
实施例17:通过二硫化物的与纯化固体载体结合的肽p3的大环的形成(分子内环化)
[0616]
将本发明的肽固定、修饰和纯化方法应用于肽h-crvpgdahhadslc-nh2(seq id no:3)(p3)、h-vrcpgaahhadslc-nh2(seq id no:?)(p4)、h-cyfqncprg-nh2(seq id no:9)(p9)、h-kcntatcatqrlanflvhssnfgpilpptnvgsnty-nh2(seqid no:10)(p10)、h-cceyccnpactgcy-nh2(seq id no:?)(p11)。
[0617]
h-crvpgdahhadslc-nh2(带下划线的c残基通过支架连接):将接头标记的肽固定在1.5倍量的以152.6μmol/1gm珠负载的醛修饰的聚甲基丙烯酸酯上。在转移后,将珠材料用3x milli-q水和3x固定缓冲液1(0.1m柠檬酸/na2co3 ph 4.5)洗涤。将113μl dmso添加到珠中并浸泡5min。将粗接头标记的肽溶解在223μl dmso和26μl缓冲液2中,然后将混合物加入聚甲基丙烯酸酯珠中并摇动。值得注意的是,珠在固定溶液中应具有自由和良好的波动。在72h的反应时间后,吸滤出固定溶液。在用各种量的珠时,固定同样有效。利用1.5倍-15倍(相对于接头标记的肽)量的以152.6μmol/1gm负载的醛修饰的聚甲基丙烯酸酯,珠成功地定量固定了接头标记的肽(1.5倍-72小时,3倍-48小时,7.5倍需要300分钟,而15倍需要180分钟)。
[0618]
洗涤:固定后,将用接头连接到肽的珠各用5ml(用于2.5μmol规模)以下溶剂和溶液洗涤3次。
[0619]
1)dmso中的0.9m盐酸胍
[0620]
3)0.1m nacl milli-q水中的70%乙醇
[0621]
还原:向固定的肽中添加5ml乙腈。添加dtt于5wt%的nahco3溶液中的新鲜溶液(33.6当量,0.26m),并将反应器摇动60min。在通过过滤除去dtt溶液后,将珠材料用3x h2o和3xmecn洗涤。
[0622]
氧化:然后,将500μl h2o/mecn(1:1)添加到珠中,然后多次添加20μl碘(10mg/ml),直到溶液呈淡黄色,并将筒摇动总共10min。将珠用水中的抗坏血酸(15mg/ml)洗涤3x,用水洗涤3x,并用mecn洗涤两次。
[0623]
肽的释放:向该小瓶中添加166.6μl 95%tfa,并且在30min并用2x 166.6μl的水
中的95%tfa洗脱后,在预先称重的冷醚小瓶中,通过离心和倾析醚沉淀肽得到纯肽。
[0624]
通过用166μl的80:10:10(h2o:mecn:tfa)或90:05:05(h2o:mecn:tfa)处理氧化珠18小时,并然后用2.5x体积h2o/mecn(7:3) 0.1%tfa和1.5x体积h2o/mecn(3:7) 0.1%tfa洗脱,释放也同样有效。将所得溶液冻干,得到纯度为95%的期望的肽。esi-ms:(计算值mh
2
:774.13g/mol,实测值:773.91m/z)。
[0625]
h-vrcpgaahhadslc-nh2(带下划线的c残基通过支架连接):将接头标记的肽固定在3倍量的以152.6μmol/1g珠负载的醛修饰的聚甲基丙烯酸酯上。在转移后,将珠材料用3x milli-q水和3x固定缓冲液1(0.1m柠檬酸/na2co3 ph 4.5)洗涤。将226μl83%tfa添加到珠中。将粗接头标记的肽溶解在498μl 83%tfa中,并然后将混合物加入聚甲基丙烯酸酯珠中并摇动。值得注意的是,珠在固定溶液中应具有自由和良好的波动。在150分钟的反应时间后,吸滤出固定溶液。利用溶剂如hfip(150分钟),固定同样有效。还利用对应于肽(肽具有1.5、3和5醛基)的各种量的珠,如p3肽中所述在dmso中进行固定。在固定16小时后,在1.5倍醛的情况下固定了55%肽,在3倍醛的情况下固定了70%肽,并且在5倍醛的情况下定量固定了肽。在3倍的醛中添加催化剂(50mm苯胺)使固定率提高4倍。
[0626]
洗涤:在tfa作为固定溶剂的情况下,在固定后,将用接头连接到肽的珠各用3ml(用于2.5μmol规模)以下溶剂和溶液洗涤3次。
[0627]
1)milli-q水
[0628]
2)dmso中的0.9m盐酸胍
[0629]
3)0.1m nacl milli-q水中的70%乙醇
[0630]
在hfip作为固定溶剂的情况下,在固定后,将用接头连接到肽的珠各用3ml(用于2.5μmol规模)以下溶剂和溶液洗涤3次。
[0631]
1)hfip
[0632]
2)milli-q水
[0633]
在所有其他情况下,根据p3肽情况所述的方法洗涤肽。
[0634]
还原:根据p3肽情况所述的方法进行还原程序。
[0635]
氧化:然后,将1000μl dmso添加到珠中,然后向珠溶液中吹扫空气(5min)并摇动24小时,过滤,洗涤(3x h2o,1x ch3cn)并干燥。
[0636]
肽的释放:根据p3肽情况所述的方法进行肽的释放程序,得到纯度为79%的期望肽。esi-ms:(计算值mh
2
:717.43g/mol,实测值:717.71m/z)。
[0637]
h-cyfqncprg-nh2(带下划线的c残基通过支架连接):根据p4肽所述的方法进行tfa固定、洗涤和还原程序。
[0638]
氧化:然后,将1000μl的0.1m磷酸氢二钠溶液中的20%dmso添加到珠中,然后向珠溶液中吹扫空气(5min)并摇动4小时,过滤,洗涤(3x h2o,1x ch3cn)并干燥。
[0639]
肽的释放:根据p3肽情况所述的方法进行肽的释放程序,得到纯度为85%的期望肽(计算值mh
2
:542.72g/mol,实测值:543.12m/z)。
[0640]
h-kcntatcatqrlanflvhssnfgpilpptnvgsnty-nh2(带下划线的c残基通过支架连接):根据p9肽所述的方法进行tfa固定、洗涤和还原、氧化、肽的释放,得到纯度为10%的期望肽(计算值mh
4 计算值
:959.48m/z,实测值:mh
4 实测值
:959.84m/z)
[0641]
h-cceyccnpactgcy-nh2(带下划线的c残基通过支架连接):根据p9肽所述的方法
进行tfa固定、洗涤和还原、氧化、肽的释放,得到纯度为10%的期望肽(计算值mh
2 计算值
:763.21m/z,实测值:mh
2 实测值
:763.85m/z)。
[0642]
[0643]
[0644]
[0645]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。