1.本发明属于生物工程技术领域,具体涉及一种以芳香族羧酸或杂环羧酸为原料生物合成伯胺的方法。
背景技术:
2.芳香族或杂环族伯胺,应用广泛,如4-氟苄胺是镇痛药“氟吡汀”的中间体。糠胺可制成强利尿剂“呋塞米”,利尿作用强。2,4-二氟苄胺是葛兰素史克(gsk)旗下新型抗hiv药物“度鲁特韦”的关键中间体。肉桂胺可用于合成抗真菌剂“萘替芬”,用于治疗癣、毛癣菌和表皮癣菌的感染。目前合成芳香族或杂环族伯胺的方法几乎都是化学合成法,如苄胺的合成主要以苯甲腈、苯甲醛为原料。例如,在水/乙醇混合物中,以次磷酸钙和镍络合物做催化剂,催化苯甲腈以生成苄胺;在80℃,2.5bar h2下,以负载含氮中孔碳(mc)的镍纳米颗粒(缩写为mc/ni)为催化剂,催化苯甲腈的氢化或苯甲醛还原胺化来合成苄胺。但是化学合成法存在多种弊端,如镍等金属对环境污染严重,底物苯甲腈具有高毒性,还有需要高温、加氢条件等使得成本较高,这导致产品质量跟不上应用行业的发展。以微生物发酵法生产芳香族或杂环族伯胺具有绿色、安全、低成本等优势,已成为芳香族或杂环族伯胺的发展趋势。然而关于芳香族或杂环族伯胺生物合成文献报导较少。例如,yi zhou等人曾以可再生原料为底物,在代谢工程化改造的大肠杆菌中构建九步人工酶的级联反应实现苄胺的生成,但该方法并不适用于其他芳香族或杂环族伯胺。
技术实现要素:
3.本发明的目的是为了提供一种生物合成芳香族或杂环族伯胺的方法。
4.本发明提供了一种以芳香族羧酸或杂环羧酸为原料生物合成伯胺的方法,以芳香族羧酸或杂环羧酸为底物,以基因工程菌为生物催化剂进行发酵反应;所述基因工程菌被敲除dna结合转录双调节因子arca,并过表达羧酸还原酶基因nccar、磷酸泛酰巯基乙胺转移酶基因pptase和ω-转氨酶基因oata。
5.进一步地限定,反应的条件为温度30℃,ph7.0,时间至少2小时。
6.进一步地限定,基因工程菌:底物量之比od600nm=10-150:5-60mm。
7.进一步地限定,催化反应体系中添加mgso4、l-丙氨酸、芳香族羧酸或杂环羧酸和缓冲液。
8.进一步地限定,所述芳香族羧酸或杂环羧酸为2-吡啶羧酸、糠酸、4-氟苯甲酸、2,4-二氟苯甲酸和2,4-二甲氧基苯甲酸其中任意一个或多个。
9.进一步地限定,所述基因工程菌的出发菌为大肠杆菌k-12mg1655 rare,即敲除了3个醛酮还原酶基因和3个醇脱氢酶基因的大肠杆菌k-12mg1655。
10.进一步地限定,所述醛酮还原酶基因为dkgb基因、yeae基因和dkga基因;所述醇脱氢酶基因为yqhd基因、yahk基因和yjgb基因。
11.进一步地限定,所述dna结合转录双调节因子arca的genebank id为qjz27444.1;
所述羧酸还原酶基因nccar的genebank id为xm_950727.2、磷酸泛酰巯基乙胺转移酶基因pptase的genebank id为cp024090.1和ω-转氨酶基因oata基因的genebank id为cp000758.1。
12.本发明提供上述的方法在制备芳香伯胺或杂环伯胺中的领域的应用。
13.有益效果:构建了芳香族或杂环族伯胺在大肠杆菌中的生物合成途径,使芳香族或杂环族伯胺的生成更温和,而且无环境污染,除了2,4-二甲氧基苄胺,该全细胞催化体系生产其他4种伯胺的产率可达90%左右,证明该合成途径具有通用性。这为其他芳香类或杂环类伯胺的生物合成提供了新思路。
附图说明
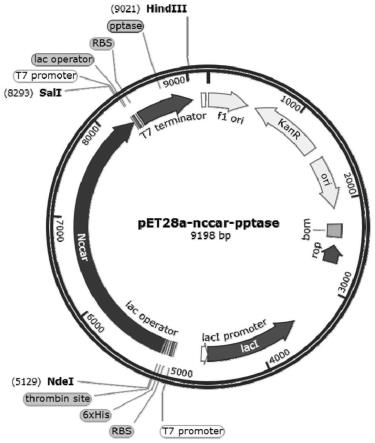
14.图1为pet28a-nccar-pptase重组质粒结构示意图;
15.图2为pacycduet1-oata重组质粒结构示意图;
16.图3为凝胶电泳检测结果,其中,m:marker,1-2:阴性对照rare,3-4:阳性对照jw4364,5-19:挑取单菌落进行pcr验证,目的条带约为1000bp。
17.图4为5mm的2,4-二氟苄胺标品gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
18.图5为2小时出峰时间的2,4-二氟苄胺样品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
19.图6为5mm 4-氟苄胺标品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
20.图7为2小时出峰时间的4-氟苄胺样品gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
21.图8为2,4-二甲氧基苄胺标品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
22.图9为2小时出峰时间的2,4-二甲氧基苄胺样品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
23.图10为5mm的糠胺标品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
24.图11为2小时出峰时间的糠胺样品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
25.图12为5mm的2-吡啶甲胺标品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相
gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
26.图13为2小时出峰时间的2-吡啶甲胺样品的gc-ms检测结果,gc-ms检测结果,其中,图a是气相gc,横坐标是出峰时间,纵坐标是响应强度;图b是质谱ms,横坐标是离子碎片,纵坐标是响应强度;出峰时间min,横坐标是m/z;
具体实施方式
27.pet28a载体商业购买addgene;
28.pacycduet-1载体商业购买addgene。
29.pcp20质粒载体商业购买。
30.肉桂胺(3-(aminomethyl)pyridine):ca
31.异丙基硫代半乳糖苷:iptg
32.卡那霉素:km
33.氯霉素:cm
34.dna结合转录双调节因子:arca
35.羧酸还原酶基因:nccar
36.转氨酶基因:oata
37.磷酸泛酰巯基乙胺转移酶基因:pptase
38.大肠埃希氏杆菌(escherichia coli):e.coli
39.mg1655(de3)δdkgbδyeaeδ(yqhc-dkga)δyahkδyjgb:rare(de3)(k-12mg1655rare)
[0040]“过量表达”或“过表达”指细胞内特定基因受到各种信号调控后,在生物体中超过原有水平表达,可以通过增强内源表达或引入外源基因来实现。
[0041]
质粒提取及胶回收所用试剂盒购自美国omega公司,操作步骤按照产品说明书进行;菌株rare(de3)购买自美国addgene公司;所有培养基如无特别说明均用去离子水配制。
[0042]
培养基配方:
[0043]
1)lb培养基:酵母粉5g/l,nacl 10g/l,蛋白胨10g/l,接种时补加卡那霉素50μg/ml,氯霉素50μg/ml。
[0044]
2)m9缓冲液:nh4cl 1.0g/l,na2hpo4·
12h2o 15.2g/l,kh2po
4 3.0g/l,nacl 0.5g/l。
[0045]
实施例1.构建重组质粒
[0046]
dna结合转录双调节因子arca的genebank id为qjz27444.1;羧酸还原酶基因nccar的genebank id为xm_950727.2、磷酸泛酰巯基乙胺转移酶基因pptase的genebank id为cp024090.1和ω-转氨酶基因oata基因的genebank id为cp000758.1。
[0047]
1)首先,先对来自neurospora crassa的羧酸还原酶基因nccar进行e.coli密码子优化,优化后的序列如seq id no.1所示,然后将基因序列交给华大基因合成,将合成的优化后的nccar连接到pet28a载体上,酶切位点为ncoi和sali,得到重组质粒pet28a-nccar;将来自大肠杆菌的pptase的dna序列连接到重组质粒pet28a-nccar,酶切位点是bamhi和hindiii,得到重组质粒pet28a-nccar-pptase;图1为pet28a-nccar-pptase重组质粒结构
示意图;
[0048]
2)其次,先对来自ochrobactrum anthropi的ω-转氨酶基因oata进行e.coli密码子优化,优化后的序列如seq id no.2所示,然后将基因序列交给华大基因合成,将合成的优化后的oata连接到pacycduet-1载体上,酶切位点为ncoi和sali,得到重组质粒pacycduet1-oata。图2为pacycduet-1-oata重组质粒结构示意图,pet28a-nccar-pptase重组质粒序列:(seq id no.5),pacycduet1-oata质粒序列:(seq id no.6)。
[0049]
实施例2.敲除大肠杆菌k-12 mg1655 rare中的arca基因
[0050]
利用文章baba t.construction of escherichia coli k-12 in-frame,single-gene knockout mutants:the keio collection[j].mol.syst.biol,2006,2.中记载的噬菌体敲除系统的方法敲除大肠杆菌k-12 mg1655 rare中的arca基因。
[0051]
1)供体菌制备
[0052]
(1)接种来自keio collection(大肠杆菌供体菌)是bw25113突变文库的供体菌编号jw4364单克隆菌株(记载在liu m,fu y,gao w,et al.highly efficient biosynthesis of hypoxanthine in escherichia coli and transcriptome-based analysis of the purine metabolism[j].acs synthetic biology,2020,表1中记载jw4364),过夜培养,37℃,220rpm;
[0053]
(2)lb中过夜培养5ml供体菌;
[0054]
(3)按1:100的比例将供体菌过夜培养物加入5ml lb中;
[0055]
(4)37℃,220rpm培养,至od
600nm
=0.6-0.8,加入100μl的噬菌体p1;
[0056]
(5)37℃继续培养2-4h,直至出现碎片,培养基逐渐透明。
[0057]
(6)向管中加入50μl左右氯仿。混匀后,离心(4℃,6000rpm,10min)收集上清,过0.22um滤膜至另一无菌ep管,此溶液即为噬菌体裂解液,4℃保存待用。
[0058]
2)转导:
[0059]
(1)接种k-12 mg1655 rare的单克隆,过夜培养,37℃,220rpm;
[0060]
(2)次日收菌,6000rpm,2min,每1ml菌液利用300μl悬浮液重悬,悬浮液的成分为lb 100mm mgso4 5mm cacl2,(300μl包括:268.5μl lb 30μl 1m mgso4 1.5μl1m cacl2),获得的细胞悬浮液。
[0061]
(3)噬菌体裂解液与细胞悬浮液混合,采用150μl、100μl、50μl、和0μl四个梯度(梯度根据噬菌体效价决定)。150μl裂解液 100μl受体细胞悬浮液,0μl裂解液 150μl lb 100μl受体细胞悬浮液。
[0062]
(4)37℃孵育30min。
[0063]
(5)加入200μl 1m柠檬酸钠(ph 5.5),加入1ml lb,37℃生长1h。
[0064]
(6)6000rpm离心5min。
[0065]
(7)重悬细胞,100μl重悬液含有99μl lb 1μl 1m柠檬酸钠(ph5.5),涡旋振荡细胞,涂布平板(含50μg/ml)。
[0066]
(8)阳性克隆验证。利用基因上游引物arca-f:ttttgacactgtcgggtcctg如seq id no.3与卡那霉素抗性基因中间引物pkd4-km300:ggtgagatgacaggagatcc如seq id no.4验证。
[0067]
单菌落pcr验证:
[0068]
表1 单菌落验证的pcr体系
[0069]
名称用量(μl)2*rapid taq master mix25arca-f2pkd4-km3002单菌落1ddh2o20总体积50
[0070]
pcr体系如表1所示,pcr程序:95℃3min
→
【95℃15s,56℃15s,72℃1min】26cycles
→
72℃5min
→
12℃。pcr后进行琼脂糖凝胶电泳,结果如图3所示,挑选阳性单菌落保存。m:marker,1-2:阴性对照rare,3-4:阳性对照jw4364,5-19:挑取单菌落进行pcr验证,目的条带约为1000bp。得到成功敲除arca的敲除大肠杆菌k-12mg1655rare一株。
[0071]
3)pcp20质粒消除km抗性基因:
[0072]
将成功敲除arca的敲除大肠杆菌k-12mg1655 rare中的arca基因的菌株,利用cacl2化学法做热激感受态,再热激转化导入质粒pcp20,涂布amp抗性(100μg/ml)和cm抗性(50μg/ml)平板,置于30℃培养过夜。然后将克隆子划线于无抗性平板,提高到42℃培养过夜,热诱导flp重组酶表达,质粒逐渐丢失。将长出的单克隆分别划线卡那霉素、氨苄青霉素、无抗平板观察抗性消除与pcp20质粒丢失结果,同一单克隆在卡那霉素、氨苄青霉素平板不生长,无抗平板生长表明对卡那霉素抗性消除,pcp20质粒丢失获得大肠杆菌。再利用cacl2化学法将pcp20质粒丢失获得大肠杆菌做成rare
△
arca感受态。
[0073]
将重组质粒pet28a-nccar-pptase和pacycduet1-oata利用热激转化法共同转化进大肠杆菌rare
△
arca感受态,得到rare
△
arca/pet28a-nccar-pptase/pacycduet1-oata单菌落。
[0074]
实施例3.全细胞催化芳香族或杂环族羧酸转化成相应伯胺
[0075]
1.全细胞催化体系:
[0076]
1)将获得的rare
△
arca/pet28a-nccar-pptase/pacycduet1-oata基因工程菌种子液按照接种量为培养基体积的1.6%接种于lb培养基,培养温度为37℃,培养基转速为220rpm,ph6.0-8.0,然后加入诱导剂iptg至终浓度0.2mm,转至20℃继续培养15-20h;
[0077]
2)将步骤1)得到的发酵液6000rpm,4℃离心5min后去上清,将得到的菌体用m9缓冲液洗1-2次后,最后用8ml m9缓冲液重悬菌体;
[0078]
3)全细胞催化体系:10mm羧酸(2-吡啶羧酸、糠酸、4-氟苯甲酸、2,4-二氟苯甲酸或2,4-二甲氧基苯甲酸),20mmmgso4,20mm l-ala,菌株od
600nm
=30。混匀后30℃,200rpm,反应2h后取样,稀释2倍后进行gc-ms和hplc检测。
[0079]
2.伯胺样品的gc-ms检测
[0080]
伯胺的定性检测:gc-ms。gc-ms:气相-质谱联用。检测方法:色谱柱:db-5;载气:氦气(纯度》99.999%),载气流量:1.0ml/min;进样方式:不分流;进样口温度:200℃;程序升温步骤:50℃,保持2min,以30℃/min上升到280℃,保持10min;色谱-质谱接口温度:280℃;四级杆温度:150℃;离子源温度:200℃。
[0081]
3.伯胺样品的hplc检测
[0082]
糠胺、糠酸的检测波长为230nm。在254nm处检测到2-氨甲基吡啶、2-吡啶甲酸。在261nm处检测4-氟苄胺、2,4-二氟苄胺、2,4-二甲氧基苄胺及其相应的酸。4-氟苄胺、2,4-二氟苄胺、2,4-二甲氧基苄胺、2-氨基甲基吡啶、糠胺及其相应的酸色谱条件为zorabx-c18色谱柱(安捷伦),流动相为h2o 0.1%tfa(a泵)和甲醇/乙腈=1:1 0.1%tfa(b泵),线性梯度:5%b,0-5min;5%-90%b,5-10min,90%b,10-20min;90%-5%b,20-21min;5%b,21-30min,流速0.5ml/min,柱温50℃。
[0083]
gc-ms检测结果如表2和图4-图13所示。结果表明,以2-吡啶甲酸为底物的催化反应产物为2-氨基甲基吡啶,以糠酸为底物的催化反应为糠胺,以4-氟苯甲酸为底物的催化反应为4-氟苄胺,以2,4-二氟苯甲酸为底物的催化反应为2,4-二氟苄胺,以2,4-二甲氧基苯甲酸为底物的催化反应为2,4-二甲氧基苄胺,全细胞催化体系可以产糠胺、2-吡啶甲胺、4-氟苯甲胺、2,4-二氟苯甲胺和2,4-二甲氧基苯甲胺。
[0084]
hplc检测结果:
[0085]
表2 各类伯胺的产率及转化率
[0086][0087][0088]
产率=产物的摩尔浓度/投入底物的摩尔浓度*100%;
[0089]
转化率=消耗的底物的摩尔浓度/投入的底物浓度*100%。
[0090]
结果表明,除了2,4-二甲氧基苄胺,该全细胞催化体系生产其他4种伯胺的产率可达90%左右,证明该合成途径具有通用性。这为其他芳香类或杂环类伯胺的生物合成提供了新思路。
[0091]
本实施例所列数据为多次重复试验的平均数值。虽然本发明已经公开了示例性示范方案,但是本领域人员应该理解,在不背离由后附的权利要求所定义的本发明的精神和范围的条件下,可以进行各种形式和细节的变化,可以进行各种实施方案的任意组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。