植物中的目标dna的甲基化的抑制方法
技术领域
1.本发明涉及抑制植物中的目标dna的甲基化的方法。
背景技术:
2.植物的基因表达通过被称为表观遗传学控制的dna甲基化、组蛋白的化学修饰而被调节。这是由rna沉默引起的现象,rna沉默大致分为转录后基因沉默(ptgs)和转录基因沉默(tgs)2类。植物依赖于该表观遗传学控制而调节功能性成分的蓄积水平,为了使植物高水平地蓄积这些有用成分,需要自由操控该表观遗传学的技术。然而,表观遗传学控制过于复杂,特异性地解除目标dna的甲基化被认为不可能。
3.到目前为止,dna序列特异性地诱导去甲基化的技术基本不存在,近年也只不过勉强报告了使用dcas融合tet1来诱导去甲基化的技术(非专利文献1)。然而,在使用dcas融合tet1来诱导去甲基化的情况下,重组技术是必不可少的,存在不能简便且迅速地诱导去甲基化这样的问题。
4.现有技术文献
5.专利文献
6.专利文献1:国际公开第2014/129560号
7.非专利文献
8.非专利文献1:gallego-bartolome j et al.,proceedings of the national academy of sciences of the united states of america 55,e2125-e2134(2018)
9.非专利文献2:gallusci p et al.,trends in plant science 22,610-623(2017)
10.非专利文献3:matzke m.a and mosher r.a,nature reviews genetics 15,394-408(2014)
11.非专利文献4:philips j.g et al.,plos one,12(2),e0171311(2017)
12.非专利文献5:otagaki s et al.,plant biotechnology 23,259-265(2006)
技术实现要素:
13.发明要解决的课题
14.本发明的目的是使用重组技术,或者不使用重组技术,简便且迅速地抑制植物中的目标dna的甲基化,由此制作出具有所期望的性状的植物。
15.用于解决课题的手段
16.本发明者鉴于上述课题而进行了深入研究,结果发现了如下令人惊讶的知识:通过在rna指导的dna甲基化机制中,阻碍由目标dna的转录而产生的脚手架rna与sirna-ago4复合体的结合,从而能够在植物中特异性地抑制目标dna的甲基化。
17.即,本发明的主旨在于以下。
18.[1]在植物细胞中抑制目标dna的甲基化的方法,该方法包括:在rna指导的dna甲
基化机制中,阻碍由所述目标dna的转录产生的脚手架rna与sirna-ago4复合体的结合。
[0019]
[2]根据1所述的方法,所述脚手架rna与sirna-ago4复合体的结合的阻碍,通过将短仿制rna(short dummy rna)导入到所述植物细胞中来实现,所述短仿制rna包含与被装入到所述sirna-ago4复合体中的sirna互补的序列。
[0020]
[3]根据1所述的方法,所述脚手架rna与sirna-ago4复合体的结合的阻碍,通过将短仿制rna导入到所述植物细胞中来实现,所述短仿制rna包含与所述脚手架rna的至少一部分互补的序列。
[0021]
[4]根据1~3的任一项所述的方法,所述目标dna是在植物细胞中控制表达所期望的性状的基因的启动子。
[0022]
[5]根据4所述的方法,所述表达所期望的性状的基因,是编码酶的氨基酸序列的基因,所述酶控制植物来源的功能性成分的合成或蓄积。
[0023]
[6]根据1~5的任一项所述的方法,所述短仿制rna向植物细胞的导入,通过植物病毒载体法、农杆菌渗透法、magnicon(注册商标)系统、或粒子枪法来进行。
[0024]
[7]根据1~6的任一项所述的方法,所述植物细胞是植物体的非分离细胞。
[0025]
[8]根据1~6的任一项所述的方法,所述植物细胞是培养细胞。
[0026]
[9]制作出具有所期望的性状的植物的方法,该方法包括:使用1~8的任一项所述的方法,在植物中抑制与所期望的性状的表达有关的dna的甲基化。
[0027]
[10]制造植物来源的功能性成分的方法,该方法包括:使用1~8的任一项所述的方法,通过抑制与植物来源的功能性成分的合成或蓄积有关的dna的甲基化,从而在所述植物细胞内使功能性成分蓄积,然后从所述植物细胞回收所述功能性成分。
[0028]
[11]用于使植物来源的功能性成分蓄积的表达系统,该表达系统包含:
[0029]
(a)在rna指导的dna甲基化机制中产生脚手架rna和sirna-ago4复合体的植物体或植物细胞,所述脚手架rna是由与植物来源的功能性成分的合成或蓄积有关的dna的转录产生的,和
[0030]
(b)包含与被装入到所述sirna-ago4复合体中的sirna互补的序列、或与所述脚手架rna的至少一部分互补的序列的短仿制rna。
[0031]
发明的效果
[0032]
根据本发明,通过抑制植物中的目标dna的甲基化,从而能够简便且迅速地特异性地控制目标dna的tgs。由此能够获得具有所期望的性状的植物,例如,对植物中的有用蛋白质的生产、功能性成分的蓄积水平的提高有大贡献。
附图说明
[0033]
图1显示rddm途径中的dna甲基化模式。
[0034]
图2显示基于利用短仿制rna捕捉sirna-ago4复合体的dna甲基化解除模式。
[0035]
图3显示基于利用短仿制rna阻断脚手架rna与sirna-ago4结合的dna甲基化解除模式。
[0036]
图4显示成为短仿制rna的目标的35s启动子的序列、和以脚手架rna大量被检出的(-51至-76)部分为目标制成的短仿制rna构建体(sd-51)的序列。
[0037]
图5显示与对照(16c和208red)比较后的、通过cmv-a1载体而表达sd-51的本烟草
methyltransferase,drm2)被募集,将dna甲基化。认为ago4、drm2、和具有与甲基化的dna的结合能力的rna指导的dna甲基化1(rdm1)、有缺陷的rna指导的dna甲基化1(defective in rna-directed dna methylation 1,drd1)以及有缺陷的分生组织沉默(defective in meristem silencing 3,dms3)对募集发挥重要的作用。
[0048]
由目标dna通过poliv、polv转录的rna(它们由相同区域转录因而序列大致相同,但将通过polv转录的rna特别称为脚手架rna)介由与sirna-ago4复合体的结合,具有向目标dna呼叫甲基转移酶drm2的作用。因此,通过包含与被整合到具有将drm2募集到目标序列的作用的sirna-ago4复合体中的sirna互补的序列的短rna(以下称为“短仿制rna”),捕捉sirna-ago4复合体(图2),或者使脚手架rna先结合短仿制rna而阻断与sirna-ago4的结合(图3),从而防止drm2被募集到目标序列,由此能够阻碍dna的甲基化。
[0049]
[2.在植物细胞中抑制目标dna的甲基化的方法]
[0050]
根据本发明的第1观点,提供在植物细胞中抑制目标dna的甲基化的方法,该方法包括:在rna指导的dna甲基化机制中,阻碍由所述目标dna的转录而产生的脚手架rna与sirna-ago4复合体的结合。
[0051]
通过阻碍在植物中成为抑制所期望的性状的表达的dna甲基化的主要原因的脚手架rna与sirna-ago4复合体的结合,从而drm2对sirna所对应的dna的区域的募集被阻碍,因而能够在植物中特异性地抑制目标dna的甲基化。所述脚手架rna与sirna-ago4复合体的结合的阻碍可以如下实现:例如,将包含与被装入到所述sirna-ago4复合体中的sirna互补的序列的短仿制rna导入到所述植物细胞中;将包含与所述脚手架rna的至少一部分互补的序列的短仿制rna导入到所述植物细胞中。
[0052]
本发明中使用的所谓“短仿制rna”,是指以不诱发rddm的程度短、并且能够与被装入sirna-ago4复合体的sirna和/或脚手架rna的至少一部分结合的rna。短仿制rna优选由与目标dna具有至少80%以上、或85%以上、或90%以上、或92%以上、或94%以上、或95%以上、或96%以上、或97%以上、或98%以上、或99%以上的同一性的碱基序列组成。这样的序列是与被装入到所述sirna-ago4复合体中的sirna和/或脚手架rna的至少一部分互补的序列,因而短仿制rna在基于捕捉sirna-ago4复合体的dna甲基化解除模式(图2)、和/或基于利用短仿制rna阻断脚手架rna与sirna-ago4的结合的dna甲基化解除模式(图3)中,防止drm2被募集到目标序列,由此能够阻碍目标dna的甲基化。如上所述,由目标dna通过poliv转录的rna与通过polv转录的rna由相同的区域转录,因而序列大致相同,因此在任何dna甲基化解除模式中,都可以使用具有相同的序列的短仿制rna。短仿制rna典型地由病毒载体供应,在不使用病毒载体的情况下,可以通过制成由插入到植物表达载体的启动子的下游的序列转录那样的重组植物来供应。然而,认为短仿制rna的供应量在由病毒载体供应的情况下要远远更优。
[0053]
所述短仿制rna的长度的上限可以为例如200bp以下、190bp以下、180bp以下、170bp以下、160bp以下、150bp以下、140bp以下、130bp以下、120bp以下、110bp以下、100bp以下、90bp以下、80bp以下、70bp以下、60bp以下、或50bp以下,所述短仿制rna的长度的下限可以为例如19bp以上、20bp以上、21bp以上、22bp以上、23bp以上、24bp以上、25bp以上、30bp以上、35bp以上、40bp以上、或45bp以上。所述短仿制rna的长度典型地为19bp~200bp,优选为20bp~80bp,最优选为20bp~50bp。
[0054]
所述目标dna只要是参与植物中的所期望的性状的表达、且通过甲基化而被抑制的dna就不特别限制,可列举例如,在植物细胞中控制表达所期望的性状的基因的启动子。所期望的性状包括,例如,形、色、大小等作为外观(形态)被观察的性质,开花期等能观察的生理性质,以及对病原菌、温度的抵抗性等生理性质等,优选为与植物内中的功能性成分(代谢成分)的蓄积有关的性质。因此,所述表达所期望的性状的基因优选为编码控制植物来源的功能性成分的合成或者蓄积的酶的氨基酸序列的基因。
[0055]
植物来源的功能性成分可列举例如,乙炔、噻吩、糖苷、
グルコシネート
(glucosinate)、嘌呤、嘧啶、生物碱、酚类物质(例如,醌)、精油、维生素类、萜类化合物(例如,戊环并吡喃萜类化合物、倍半萜类化合物、二萜类化合物和三萜类化合物)、木酚素和黄酮类化合物等。
[0056]
对植物细胞的短仿制rna的导入优选使用重组技术,或者为了将其简便且迅速地进行而使用瞬时表达系统。例如,通过植物病毒载体法、农杆菌渗透法、magnicon(注册商标)系统、粒子枪法、或将它们组合而进行。
[0057]
植物病毒载体法是将插入有目的dna的植物病毒基因组的cdna进行试管内转录,以所得的rna作为载体接种到植物中使其感染,利用病毒自身的增殖能力和全身转移能力使植物表达目的基因的方法。因为该方法利用病毒的自我复制能力表达目的基因,因而如果使用基于增殖能力特别高的cmv、tmv的载体,则能够提高每单位植物细胞的目的基因的表达量。
[0058]
农杆菌渗透法是将经插入有目的基因的t-dna载体转化而得的农杆菌的培养液利用物理方法(利用注射器等的注入、利用减压等的渗透等方法)导入植物组织内,使植物感染,从而使植物瞬时表达目的基因的方法。根据该方法,使感染能力强的农杆菌通过物理方法(注入或渗透)普遍地移动到植物体的全身并使其感染,能够使植物的全部组织中一样地表达目的基因。农杆菌(agrobacterium)是作为属于革兰氏阴性菌的土壤细菌的根瘤菌属(rhizobium)中对植物具有病原性的菌的总称,作为农杆菌的例子,可列举与冠瘿瘤病有关的根癌农杆菌(agrobacterium tumefaciens)。在利用农杆菌来源的载体使植物瞬时表达外来基因的情况下,通常将载体通过物理方法(利用注射器等的注入、利用减压等的渗透等方法)导入植物组织内,使植物感染。农杆菌来源的载体由于通过t-dna区域的作用而具有强的感染能力,因而如果通过物理方法(注入、渗透等)普遍地移动到植物体的全身并使其感染,则能够在植物的全部组织中没有偏差地一样地表达外来基因。
[0059]
magnicon(注册商标)系统是将插入有目的基因的tmv或pvx基因组的cdna插入到t-dna载体内,将经所得的t-dna载体转化的农杆菌的培养液通过物理方法(利用注射器等的注入或利用减压的渗透)导入植物组织内,使植物感染,从而使植物瞬时表达目的基因的方法。即,能够通过物理方法(注入或渗透)使载体遍及植物体的全身而使其感染,在植物的全部组织中表达目的基因。另外,由于利用病毒(tmv或pvx)的自我复制能力表达目的基因,因而能够提高每单位植物细胞的目的基因的表达量。这样,本方法是兼有上述的植物病毒载体法和农杆菌渗透法的优点的方法。
[0060]
另外,将编码2b蛋白质的基因的一部或全部被替换成了外来基因的相当于黄瓜花叶病毒(cmv)的rna2基因组的序列与农杆菌的t-dna序列功能性地组合而得的核酸分子,导入以另一途径功能性地表达cmv的rna1基因组和rna3基因组以及蛋白质2b的宿主植物中,
栽培该植物而使外来基因表达,从而能够使外来基因普遍地转移到植物体的全身的细胞而表达,并且提高各细胞中的外来基因的表达效率,作为植物体全体而实现高表达(专利文献1)。通过使用本方法,形成与利用tmv、pvx的上述magnicon(注册商标)系统匹敌的技术,能够提高宿主植物的种类、能够导入的外来基因大小的自由度。
[0061]
粒子枪(粒子轰击)法是通过将涂布有dna或载体的金、钨等金属微粒高速射出,从而将目的dna导入细胞内的方法。
[0062]
用于导入本发明中使用的短仿制rna的载体只要能够在植物细胞内导入短仿制rna,就不特别限制,典型地为植物病毒载体或t-dna载体,特别优选为植物病毒载体。植物病毒载体只要能够侵入植物细胞的核就不特别限制,可列举烟草花叶病毒(tmv)、黄瓜花叶病毒(cmv)、马铃薯x病毒(pvx)、三叶草黄脉病毒(clyvv)等各种单链rna病毒、菜豆黄花叶病毒(bean yellow dwarf virus)(beydv)、甜菜曲顶病毒(beet curly top virus)(bctv)、甘蓝曲叶病毒(cabbage leaf-curl virus)(calcuv)、小麦矮缩病毒(wheat dwarf virus)(wdv)、中国番茄黄化曲叶病毒(tomato yellow leaf curl china virus)(tylccnv)等各种单链dna病毒和花椰菜花叶病毒病毒(camv)等双链dna病毒来源的载体等。其中,特别优选作为rna病毒的黄瓜花叶病毒(cmv)来源的载体,可列举例如cmv-a1载体等。
[0063]
能够应用本发明的植物种不特别限制,典型可列举禾本科、豆科、十字花科、菊科、茄科、蔷薇科、葫芦科、旋花科等的植物。作为优选的植物,可列举例如,苜蓿、大麦、菜豆、加拿大油菜(canola)、豇豆、棉、玉米、三叶草、莲、扁豆、羽扇豆、粟、燕麦、豌豆、花生、稻、黑麦、草木犀、向日葵、香豌豆、大豆、高粱、黑小麦、豆薯、茸毛黧豆、蚕豆、小麦、藤、坚果植物等、拟南芥、剪股颖、葱、金鱼草、旱芹、花生(
ナンキンマメ
)、芦笋、颠茄(
ロウトウ
)、野燕麦、凤尾竹、油菜、雀麦、布洛华丽(
ルリマガリバナ
)、山茶、大麻、辣椒、鹰嘴豆、藜、菊苣、柑橘、咖啡树、薏苡、黄瓜、南瓜、狗牙根、鸭茅、曼陀罗、洋地黄、日本薯蓣、油椰子、
オオシバ
、牛毛草、草莓、老鹳草(
フクロウソウ
)、大豆、向日葵、黄花菜(
キスゲ
)、橡胶树、莨菪、红薯、莴苣、兵豆、百合、亚麻、黑麦草、莲、番茄、甘牛至、苹果、芒果、芋树(
イモノキ
)、南苜蓿、龙面花、烟草、驴食草、天竺葵(
テンジクアオイ
)、狼尾草、碧冬茄、梯牧草、硬质早熟禾、樱、金凤花、樱桃萝卜(
ラディッシュ
)、醋栗(
スグリ
)、蓖麻、覆盆子、甘蔗、喇叭舌草、瓜叶菊、狗尾草、白芥、茄子、高粱、侧钝叶草、可可、野火球、蓝胡卢巴、葡萄等。
[0064]
植物细胞的形态是任意的,可以是存在于植物体内的非分离的细胞,也可以是由植物体分离的组织培养物等培养细胞。在培养细胞的情况下,可以是分化了的状态的细胞,也可以是产生了去分化的细胞,也可以是再分化了的细胞。
[0065]
[3.制作出具有所期望的性状的植物的方法]
[0066]
通过使用上述的抑制目标dna的甲基化的方法,在植物中抑制与所期望的性状的表达有关的dna的甲基化,从而能够制作出具有所期望的性状的植物。因此,在本发明的第2观点中,提供制作出具有所期望的性状的植物的方法,该方法包括使用上述的方法在植物中抑制与所期望的性状的表达有关的dna的甲基化。
[0067]
[4.制作植物来源的功能性成分的方法]
[0068]
另外,通过使用上述的抑制目标dna的甲基化的方法,抑制与植物来源的功能性成分的合成/蓄积有关的dna的甲基化,从而能够简便且迅速地制造植物来源的功能性成分。
因此,在本发明的第3观点中,提供:制造植物来源的功能性成分的方法,该方法包括使用上述的方法抑制与植物来源的功能性成分的合成/蓄积有关的dna的甲基化,从而在所述植物细胞内使功能性成分蓄积,然后由所述植物细胞回收所述功能性成分;以及,用于蓄积植物来源的功能性成分的表达系统,该表达系统包括:(a)在rna指导的dna甲基化机制中产生由与植物来源的功能性成分的合成或蓄积有关的dna的转录产生的脚手架rna和sirna-ago4复合体的植物体或植物细胞;和(b)包含与被装入到所述sirna-ago4复合体中的sirna互补的序列、或包含与所述脚手架rna的至少一部分互补的序列的短仿制rna。
[0069]
以下,显示实施例,更详细地说明本发明。但是,本发明不限于以下的实施例,可以施加适当变更而实施。
[0070]
实施例
[0071]
[实验1]短仿制rna构建体的制成
[0072]
将合成与短仿制rna构建体同源的sirna的35s启动子(序列号1)上的序列(下划线部分)示于图4。设想基于sirna-ago4复合体的捕捉的dna甲基化解除模式(图2)、和/或基于利用短仿制rna阻断脚手架rna与sirna-ago4的结合的dna甲基化解除模式(图3)中的使用,为了克隆表达与该序列同源的sirna的sd-51(5
’‑
taagggaggacgcacaatccccctat-3’:序列号2),合成在5’末端分别添加了stui和mlui限制性位点的寡聚dna35s(-)-sdrna-(-51)-5st(5
’‑
cgaggccttaagggatgacgcacaatcccacta-3’:序列号3)、35s(-)-sdrna-(-51)-3ml(5
’‑
cgcacgcgtatagtgggattgtgcgtcatccctta-3’:序列号4),将它们通过pcr制成双链dna。将其按照常规方法装入到cmv-a1载体的感染性cdna克隆质粒的克隆位点(stui和mlui限制性位点)。
[0073]
[实验2]短仿制rna构建体的接种
[0074]
(1)短仿制rna(sd-51)接种当代
[0075]
本实验中,使用由本发明者们制成的本烟草208red系统作为材料。208red的制成过程和特性如下。首先,使由被导入的gfp基因发出gfp荧光的本烟草16c系统(参照非专利文献4),感染装入了与该gfp基因所连接的35s启动子同源的序列的cmv-a1载体(参照非专利文献5)。通过该cmv-a1载体的感染,在35s启动子序列内发生介由rddm途径的胞嘧啶甲基化,其结果对gfp基因诱导转录基因沉默(tgs)而gfp荧光消失。对于感染个体的自体繁殖后代每一代筛选维持着gfp基因的tgs的个体,将在自体繁殖第3代(s3)稳定地维持着tgs的系统作为208red系统在本实验中使用。
[0076]
对该gfp荧光消失了的208red接种包含短仿制rna(sd-51)构建体的cmv-a1载体(cmv-a1-sd-51),结果在所接种的个体的30%左右中gfp的荧光恢复(图5)。另一方面,在未接种cmv-a1-sd-51的208red中,在供试实验的全部个体中荧光没有恢复(图5)。由以上的结果认为,在通过cmv-a1-sd-51的感染而荧光恢复的个体中,是通过短仿制rna(sd-51)而gfp基因的tgs被解除的。
[0077]
(2)短仿制rna(sd-51)接种后代
[0078]
从通过cmv-a1-sd-51的感染而荧光恢复到与16c(最初的gfp表达本烟草)同程度的208red的个体(16c型)采种,培育出子一代(s1)和子二代(s2),观察各代中的gfp荧光。两代都由茎观察到gfp荧光的恢复,缓缓扩展到植物体全体(图6)。gfp荧光的表型分类为red(不显示荧光)、茎、叶柄、叶、和16c型(显示与16c同等水平的gfp荧光)的5组(图7)。
[0079]
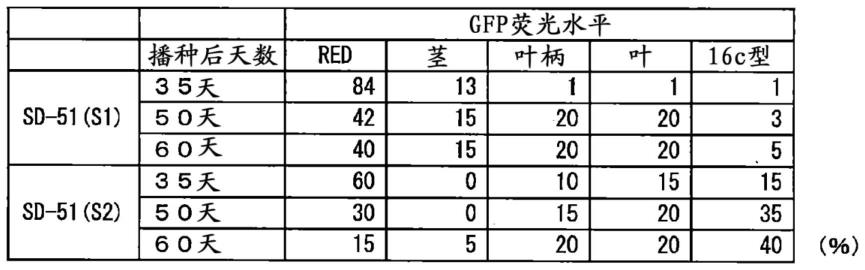
在gfp的荧光恢复的个体的s1和s2中,随着生长gfp的荧光缓缓恢复起来,在s2中40%左右的个体显示与16c同等水平的gfp荧光(表1)。
[0080]
表1
[0081][0082]
(3)在短仿制rna(sd-51)接种当代和子一代中的35s启动子中的dna甲基化率
[0083]
由208red的个体和对208red个体接种了cmv-a1-sd-51的当代和子一代的个体的叶使用illustra dna extraction kit nucleon phytopure(ge healthcare)提取dna,对所提取出的dna使用ez dna methylation-lightning kit(zymo research)进行亚硫酸氢盐处理,进行未被甲基化的胞嘧啶向尿嘧啶的转换。使用takara epitaq hs for bisulfite-treated dna(takara)由进行了亚硫酸氢盐处理的dna通过pcr扩增35s启动子区域。作为正链检测用的pcr用的引物使用35s-346f-bisut(5
’‑
attgagayttttyaayaaagggta-3’:序列号5)和35s 1a-bisua(5
’‑
ctctccaaatgaaatgaacttc-3’:序列号6)。作为负链检测用的pcr用的引物,使用35s(-)-5-bs(5
’‑
ttatatagaggaagggtyttgygaag-3’:序列号7)、35s(-)-3-bs(5
’‑
caattraracttttcaacaaar-3’:序列号8)。所得的pcr产物使用dyna express ta pcr cloning kit(bio dynamics laboratory)连接到ptac1载体中。将其转化到e.coli jm109 competent cells(takara)中,提取增殖后质粒。将提取的质粒按照常规方法测序。基于测序结果,将35s启动子区域的胞嘧啶中的甲基化频率在cg、chg(h=a/c/t)和chh分别进行比较,结果确认在任意位点都在sd-51接种个体中诱导了胞嘧啶的去甲基化(表2)。
[0084]
表2
[0085][0086]
※
数值是以成为tgs对照的208red的甲基化率作为1时的相对值。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。