atp在lamp中的新用途、lamp扩增体系和试剂盒
技术领域
1.本发明涉及等温扩增技术领域,具体涉及atp在lamp中的新用途,还涉及一种lamp扩增体系和试剂盒。
背景技术:
2.lamp(loop-mediated isothermal amplification,环介导等温扩增)技术,其特点是对靶基因的6个部位设计特异性的内引物、外引物,如有需要还可增设环引物,利用链置换反应在恒温条件下使靶基因在短时间内进行的高效扩增,是一种“简便、快速、高效、灵敏、精确、经济”的核酸扩增方法。
3.lamp技术在分子生物学检测领域的应用非常广泛,较之pcr(polymerase chain reaction,聚合酶链式反应)等现有的其他核酸扩增技术,lamp具有其独特之处:(1)lamp技术可以在等温条件下实现扩增,不需进行模板的预变性,减少了变温对扩增结果的影响,降低了对实验仪器精密度的要求,同时扩增效率得以提高;(2)lamp技术使用外引物、内引物和环引物,对目的序列的识别特异性增强。lamp技术现已应用于病原菌、寄生虫、病毒、疾病和转基因产品检测等领域,且在临床诊断、环境监测、食源安全等领域具有更为广阔的发展应用前景。
4.然而,目前在lamp反应中亟待解决的问题之一是非特异性扩增。由于lamp在等温条件下进行,非特异性扩增不仅会与特异性扩增产生试剂的竞争性消耗,而且能够产生较多非目标扩增产物,而这些非目标扩增产物的存在会对结果分析的灵敏度(可检测到的最少模板分子)及特异性(在存在竞争反应的情况下检测目标模板的能力)产生不利影响,进而限制分析的检测限(lod)。因此,抑制lamp反应的非特异性扩增在对扩增结果的分析优化非常重要。
5.因此,提供一种能简便高效去除lamp反应中的非特异性扩增的方法具有十分重要的意义。
技术实现要素:
6.发明目的:针对当前的技术问题,本发明的目的之一在于提供了atp在lamp中抑制非特异性扩增的应用。本发明的目的之二在于提供了一种基于lamp的核酸扩增体系,通过在其中添加适量的atp,从而抑制了扩增过程中的非特异性扩增。本发明的目的之三在于提供了一种使用上述核酸扩增体系的试剂盒,其检测灵敏度高、特异性好、操作简便快速、结果准确可靠。
7.为实现上述目的,本发明提供如下技术方案:
8.本发明提供了atp在lamp中抑制非特异性扩增的应用,即atp可以作为lamp中的非特异性扩增抑制剂,效果显著。
9.在一些技术方案中,所述atp的浓度选自0.1~3mmol/l,优选1.5~2.5mmol/l,更优选1.6mmol/l、2mmol/l、2.5mmol/l。所述核酸扩增体系中添加了适量的atp,抑制了扩增
过程中的非特异性扩增,同时,也在一定程度上加快了扩增速度。
10.在一些技术方案中,扩增模板为dna模板,优选为λdna或gp130,本领域技术人员也可根据实际情况选用其它类型的核酸种类。
11.本发明还提供了一种lamp扩增体系,所述体系包括:atp、核酸模板、引物、核酸聚合酶、缓冲液、dntps、硫酸镁。
12.在一些技术方案中,所述体系还包括解旋酶,所述解旋酶选择uvrd酶,浓度为0.1ng/μl~0.6ng/μl,优选0.15ng/μl~0.55ng/μl,更优选自0.16ng/μl、0.32ng/μl、0.4ng/μl、0.48ng/μl。
13.在一些技术方案中,所述核酸模板为dna模板,优选为λdna或gp130,本领域技术人员也可根据实际情况选用其它类型的核酸种类。
14.在一些技术方案中,所述核酸模板为λdna,所述引物包括上游内引物、下游内引物、上游外引物、下游外引物、环引物;所述上游内引物的序列如seq no.1所示,所述下游内引物的序列如seq no.2所示;所述上游外引物的序列如seq no.3所示,所述下游外引物的序列如seq no.4所示;所述环引物的序列如seq no.5所示。
15.在一些技术方案中,所述核酸模板为gp130,所述引物包括上游内引物、下游内引物、上游外引物、下游外引物、环引物;所述上游内引物的序列如seq no.6所示,所述下游内引物的序列如seq no.7所示;所述上游外引物的序列如seq no.8所示,所述下游外引物的序列如seq no.9所示;所述环引物的序列如seq no.10所示。
16.在另一些技术方案中,本领域技术人员可根据需扩增的核酸模板,选择设计对应的内引物、外引物、环引物。
17.在一些技术方案中,所述核酸聚合酶为dna聚合酶或其功能活性片段,优选为bst dna聚合酶或其功能活性片段。在另一些技术方案中,所述dna聚合酶还可选自bsm dna聚合酶、phi29 dna聚合酶、equiphi29 dna聚合酶或其功能活性片段,也可选自其它能在lamp中实现dntps聚合功能的蛋白或其活性片段。
18.体系中的缓冲液能为dna合成过程中的dna聚合酶及其它酶活性提供适宜的化学环境。在一些技术方案中,所述缓冲液包括tris-hcl、kcl、(nh4)2so4、mgso4、triton x-100中的一种或几种。
19.tris-hcl为缓冲液中主要的缓冲物质,用以进行ph的调节;kcl提供的k
可促进引物的吸附;(nh4)2so4所提供的nh4
可作用于错配引物-模板复合物碱基对之间的弱氢键以去除其稳定性,从而在一定程度上增强了反应的特异性。
20.硫酸镁可为dna合成过程提供mg
2
,mg
2
作为dna聚合酶活性的辅助因子,有助于合成期间dntps的聚合。酶活性位点处的mg
2
可催化引物的3
’‑
oh与dntps的磷酸基团间形成磷酸二酯键。而且,mg
2
还能够稳定磷酸盐骨架上的负电荷,从而促进引物与dna模板形成复合物。由于mg
2
能够与dntp、引物和dna模板结合,因此,通常需要对mg
2
浓度进行优化,以尽量提高扩增产物的得率,并保持其扩增特异性。mg
2
浓度过低会降低聚合酶活性,导致pcr产物较少或无pcr产物;而mg
2
浓度过高则会提高引物-模板复合物的稳定性,产生非特异性pcr产物,并增加由dntp错误插入导致的复制错误。此外,由于mg
2
还能与dna合成时从dntp中析出的焦磷酸离子反应生成焦磷酸镁沉淀,从而影响反应溶液的浑浊度。因此,如果mg
2
浓度过高,可能消耗过多的焦磷酸离子,令dna合成时所需的能量减少,从而影响目标产物的得
率;而产生的焦磷酸酶沉淀引起的溶液浑浊程度,则可能对后续的检测环节产生影响。
21.在一些技术方案中,本领域技术人员还可以根据具体实验需求,对所述缓冲液的组分进行调整,向其中添加一种或多种其它添加剂或辅助溶剂,例如二甲基亚砜(dmso)、甘油、甲酰胺、牛血清白蛋白(bsa)、聚乙二醇(peg)、明胶、甜菜碱(n,n,n-三甲基甘氨酸)、盐酸胍等。可选地,triton x-100还可被替换为tween 20等非离子去污剂。
22.在一些技术方案中,为了实验效果更为稳定,虽然缓冲液中已有部分mgso4,但仍需在体系中额外添加硫酸镁,以使体系中的总硫酸镁浓度选自4~15mmol/l,优选6~13mmol/l,更优选8mmol/l、10mmol/l、12mmol/l。可选地,所述硫酸镁还可替换为氯化镁或其它镁盐。
23.在一些技术方案中,所述体系包括:atp 0.1~3mmol/l,引物包括:上游内引物0.5~2.5μmol/l、下游内引物0.5~2.5μmol/l、上游外引物0.05~0.4μmol/l、下游内引物0.05~0.4μmol/l、环引物0.4~1.2μmol/l;核酸聚合酶为bst dna聚合酶4~10u/μl,硫酸镁3.9~11mmol/l,dna模板4~4x106 copies/μl;缓冲液的ph为7.5~9.4,包括:tris-hcl 10~40mmol/l,kcl 4~20mmol/l,(nh4)2so
4 4~20mmol/l,mgso
4 0.1~5mmol/l,triton x-100 0.01w/w%~1w/w%;dntps包括:datp 0.1~3mmol/l,dgtp 0.1~3mmol/l,dctp 0.1~3mmol/l,dttp 0.1~3mmol/l。
24.在一些技术方案中,所述体系包括:atp 1.5~2.5mmol/l,引物包括:上游内引物1.0~2.0μmol/l,下游内引物1.0~2.0μmol/l,上游外引物0.1~0.3μmol/l,下游内引物0.1~0.3μmol/l,环引物0.6~1.0μmol/l;核酸聚合酶为bst dna聚合酶5~9u/μl,硫酸镁5~10mmol/l,dna模板4x101~4x105copies/μl;缓冲液的ph为8.0~9.0,包括:tris-hcl 15~30mmol/l,kcl 7~15mmol/l,(nh4)2so
4 7~15mmol/l,mgso
4 1~3mmol/l,triton x-100 0.05w/w%~0.5w/w%;dntps包括:datp 0.5~2mmol/l,dgtp 0.5~2mmol/l,dctp 0.5~2mmol/l,dttp 0.5~2mmol/l。
25.在一些技术方案中,所述体系包括:atp 1.6mmol/l,引物包括:上游内引物1.6μmol/l,下游内引物1.6μmol/l,上游外引物0.2μmol/l,下游内引物0.2μmol/l,环引物0.8μmol/l;核酸聚合酶为bst dna聚合酶6~8u/μl,硫酸镁6mmol/l,dna模板4x102~4x104copies/μl;缓冲液的ph为8.8,包括:tris-hcl 20mmol/l,kcl 10mmol/l,(nh4)2so
4 10mmol/l,mgso
4 2mmol/l,triton x-100 0.1w/w%;dntps包括:datp 1~1.4mmol/l,dgtp 1~1.4mmol/l,dctp 1~1.4mmol/l,dttp 1~1.4mmol/l。
26.dntps在反应体系中的终浓度对核酸的扩增过程十分重要。在存在高浓度mg
2
的情况下,如果dntps的浓度过低,由于mg
2
与dntps的结合,dna合成时可被引入的dntps数量减少,降低扩增效率;同时,如果dntps的浓度超过最佳浓度时,同样会抑制扩增反应。
27.在一些技术方案中,所述环引物可以是成对或单条的。在lamp扩增体系中添加环引物,是为了加快扩增速度。
28.本发明还提供了一种包括上述扩增体系的lamp扩增试剂盒。
29.在一些技术方案中,所述试剂盒还包括荧光染料。所述荧光染料可以选自sybr green i、miami yellow、eva green、nucgreen、gelgreen、super gelblue中的一种或几种,能实现核酸的荧光定量即可。
30.本发明还提供了一种用所述试剂盒进行lamp扩增检测的方法,包括以下步骤:
31.1)将atp、引物、核酸聚合酶、缓冲液、dntps、硫酸镁、核酸模板在反应管中混合,加入荧光染料,得到混合液;
32.2)将所述混合液恒温扩增反应,进行检测。
33.在一些技术方案中,在所述恒温扩增反应的温度范围为30~75℃,优选50~70℃,更优选60~65℃。
34.有益效果:相比较于现有技术,本发明提供了atp在lamp中抑制非特异性扩增的应用,为atp在生物技术领域的应用提供了新方向。
35.本发明还提供一种lamp扩增体系,在其中添加了适量的atp,能够显著抑制扩增过程中的非特异扩增;同时,还能缩短反应时间,节约试验成本,提高反应灵敏度和准确性。
36.本发明还提供了可用于制备上述扩增体系的试剂盒,检测时受非靶序列的影响小、灵敏度高、准确性好;检测周期短,在1h内即可快速检测靶标,此试剂盒适合中小型单位和现场检测应用。
附图说明
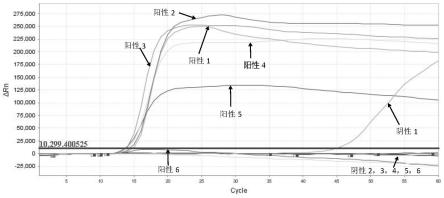
37.图1是实施例1中106λdna不同uvrd酶和不同atp浓度的lamp扩增曲线图;
38.图2是实施例2中104λdna不同uvrd酶和不同atp浓度的lamp扩增曲线图。
具体实施方式
39.为了使本发明易于理解,下面结合具体实施例对本发明的实施方案进行详细描述。
40.本领域技术人员可以理解,以下实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,均为按照本领域内常规技术或条件,或按照产品说明书进行。所用材料、试剂或仪器未注明生产厂商者,均为市售产品。
41.以下提供了本发明实施方式中所使用的具体材料及其来源。但本领域技术人员可以理解,这些仅仅是示例性的,并不意图限制本发明,与如下试剂和仪器的类型、型号、品质、性质或功能相同或相似的材料均可以用于实施本发明。
42.除非另有定义,本文所使用的所有技术、科学术语,均与本发明技术领域技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例目的,并非用于本发明的限定。
43.术语
44.下面是用于下列说明书和权利要求书的术语。然而,这个术语不应分离地考虑,要完全理解各种术语和这些术语在本发明上下文中的意义,术语应结合本说明书的其余部分阅读。
45.应该注意的是,除非上下文清楚地指明,否则本文和所附权利要求中所用的单数形式“一个/一种”和“所述/该”包括复数引用物。
46.术语“核酸”是一种生物大分子,由多个核苷酸分子组成。每一核苷酸分子包括1个五碳糖、1个含氮碱基和若干磷酸基。如果五碳糖为脱氧核糖,则该核苷酸为脱氧核糖核苷酸,其聚合物为脱氧核糖核酸(dna);如果五碳糖为核糖,则该核苷酸为核糖核苷酸,其聚合物为核糖核酸(rna)。“核酸”可以是链状分子,也可以是环状分子;可以是单链分子,也可以
是双链分子;可以是全长基因组,也可以是基因片段。“核酸”可以是从动物、植物、病毒等生物中直接提取所得,也可以是人工合成的序列。
47.术语“atp”意指“腺嘌呤核苷三磷酸”(简称“三磷酸腺苷”或“腺苷三磷酸”),化学式为c
10h16
n5o
13
p3,分子量为507.18,是一种不稳定的高能磷酸化合物,由1分子腺嘌呤,1分子核糖和3分子磷酸基团组成。atp的元素组成为:c、h、o、n、p,分子简式a-p~p~p,式中的a表示腺苷,t表示三个(英文的triple的开头字母t),p代表磷酸基团,
“‑”
表示普通的磷酸键,“~”代表一种特殊的化学键,称为高能磷酸键(能量大于29.32kj/mol的磷酸键称为高能磷酸键)。1个“atp”有2个高能磷酸键、1个普通磷酸键。
48.术语“dntp”意指“脱氧核糖核苷酸三磷酸”(deoxy-ribonucleosidetriphosphate),是包括datp(三磷酸腺嘌呤脱氧核苷酸)、dgtp(三磷酸鸟嘌呤脱氧核苷酸)、dttp(三磷酸胸腺嘧啶脱氧核苷酸)、dctp(三磷酸胞嘧啶脱氧核苷酸)、dutp(三磷酸尿嘧啶脱氧核苷酸)等在内的统称,n是指含氮碱基,代表变量指代a、t、g、c、u等中的一种。在生物dna合成以及各种pcr(rt-pcr、real-time pcr)过程中起原料作用。
49.在本技术中,术语“dna聚合酶或其功能活性片段”通常是指具有催化dntps分子聚合形成子代dna功能的蛋白。
50.在本技术中,术语“bst dna聚合酶或其功能活性片段”通常是指bacillus stearothermophilus dna聚合酶中具有5
′→3′
dna聚合酶活性和很强的链置换活性,但缺失5
′→3′
核酸外切酶活性的功能蛋白。
51.在本技术中,术语“功能活性片段”通常是指保留与其更大对应物相同活性或能力的较大多肽或多核苷酸的片段。功能活性片段的活性水平可以与所述更大对应物的活性相同,或比它更小或更大。例如,bst dna聚合酶的功能活性片段可以是这样的多肽,组成其的氨基酸数量比全长bst dna聚合酶蛋白的氨基酸数量更少,但仍然可以保留全长bst dna聚合酶的活性。
52.实验材料和仪器
53.表1 实施例中涉及的材料和仪器
54.材料或仪器品牌与货号/型号atpsigma,a2383-25gbst dna聚合酶vazyme,p701-02-aa硫酸镁vazyme,p701-02-ac10
×
thermopol buffervazyme,p701-02-abdntp mixvazyme,p031-0210
×
sybr green ithermo,s7567uvrd酶neb,m1202sλdnaneb,n3011sgp130质粒ppl,ppl00004s大肠杆菌vazyme,c505质粒提取试剂盒vazyme,dc201qpcr仪abi,quantstudio 3
55.表2 实施例中涉及的序列
[0056][0057]
其中,10
×
thermopol buffer(vazyme,p701-02-ab)中包括:初始浓度为200mmol/l、ph为8.8的tris-hcl水溶液,初始浓度为100mmol/l的kcl水溶液,初始浓度为100mmol/l的(nh4)2so4水溶液,初始浓度为20mmol/l的mgso4水溶液,初始质量分数为1%的triton x-100水溶液。
[0058]
dntp mix(vazyme,p031-02)中包括:浓度各为10mmol/l的datp、dctp、dttp、dgtp。
[0059]
实施例1
[0060]
使用上述试剂利用lamp检测106copiesλdna,包括如下步骤:
[0061]
1.实验组别的设置:
[0062]
本实施例同时设置实验组和对比检测组,每组体系均为25μl。实验组需加入atp,对比检测组用等量ddh2o代替atp,其中模板均为106copiesλdna。实验组和对比检测组均需设置阴性对照,阴性对照由等量水代替模板,其余条件与实验组一致(表3)。
[0063]
表3 实施例1的实验条件列表
[0064][0065]
2.λdna的环介导等温扩增:
[0066]
(1)lamp反应体系(25μl)的配制:
[0067]
按照表4配制实验组和对比检测组的阳性反应体系,每一体系置于单个反应管。表4所示阳性1~阳性6均需设置阴性对照,仅用5μl水代替λdna模板即可。
[0068]
表4 106copiesλdna阳性反应体系
[0069][0070]
(2)环介导等温扩增:将装有反应体系的反应管置于qpcr仪中,在63℃恒温反应1h,反应结束后,所得结果如图1所示。
[0071]
3.反应结果:
[0072]
由图1可知,在实施例1的反应条件下,当体系中不含uvrd酶和atp时,阳性扩增速度较慢,阴性扩增速度较快。当体系中不含uvrd酶、加入1.6mmol/latp后,阳性扩增速度变快,阴性不发生扩增。当在含1.6mmol/latp的体系中加入uvrd酶后,阴性不发生扩增;加入4~8ng uvrd酶时,与不加uvrd酶相比,扩增速度不变,阳性平台略有下降;当uvrd增加到
10ng时,阳性平台明显下降;当uvrd增加到12ng时,阳性不扩增。
[0073]
实施例2
[0074]
使用上述试剂利用lamp检测104copiesλdna,包括如下步骤:
[0075]
1.实验组别的设置:
[0076]
本实施例同时设置实验组和对比检测组,每组体系均为25μl。实验组需加入atp,对比检测组用等量水代替atp,其中模板均为104copiesλdna。实验组和对比检测组均需设置阴性对照,阴性对照由等量ddh2o代替模板,其余条件与实验组一致(表5)。
[0077]
表5 实施例2的实验条件列表
[0078][0079]
2.λdna的环介导等温扩增:
[0080]
(1)lamp反应体系(25μl)的配置:
[0081]
按照表6配制实验组和对比检测组的阳性反应体系,每一体系置于单个反应管。表6所示阳性1~阳性5均需设置阴性对照,仅用5μl水代替λdna模板即可。
[0082]
表6 104copiesλdna阳性反应体系
[0083][0084]
(2)环介导等温扩增:将装有反应体系的反应管置于qpcr仪中,在63℃恒温反应1h,反应结束后,所得结果如图2所示。
[0085]
3.反应结果:
[0086]
由图2可知,在实施例2的反应条件下,当体系中不含uvrd酶和atp时,阳性扩增速度较慢,阴性扩增速度较快。当体系中不含uvrd酶、加入1.6mmol/latp后,阳性扩增速度变快,阴性不发生扩增。当在含1.6mmol/latp的体系中加入uvrd酶后,阴性不发生扩增;加入4ng uvrd酶时,与不加uvrd酶相比,扩增速度不变;当uvrd增加到8ng时,阳性平台明显下
降,阴性不扩增;当uvrd增加到10ng时,阳性不发生扩增。
[0087]
实施例3
[0088]
本实施例在不添加uvrd酶的情况下,使用上述试剂筛选适合lamp最佳的atp和mgso4浓度,包括如下步骤:
[0089]
1.gp130的提取:
[0090]
将gp130质粒直接转到大肠杆菌中,在kan抗性下培养,培养完成后用质粒提取试剂盒提取gp130。
[0091]
2.实验组别的设置:
[0092]
本实施例设置三组变量:(1)不同种类和数量的模板:104copies gp130、106copies gp130、104copiesλdna和106copiesλdna;(2)不同浓度的atp:0mmol/l、1.6mmol/l、2mmol/l、2.5mmol/l;(3)不同总浓度的mgso4:8mmol/l、10mmol/l、12mmol/l。利用上述三种变量设置交叉实验,得到64个阳性实验组(如表7、表8),每组体系均为25μl。
[0093]
该阳性实验组均需设置阴性对照,阴性对照由等量ddh2o代替模板,其余条件与阳性实验组一致,即得64个阴性对照组(ntc)。
[0094]
3.环介导等温扩增:
[0095]
(1)lamp反应体系(25μl)的配置:
[0096]
按照表4配制反应体系,区别在于:不添加uvrd酶,添加适量mgso4、atp和模板至满足表7或表8对应体系中的浓度即可,gp130对应的引物将seq no.1~5分别对应更换作seq no.6~10,体积不足的以ddh2o补足。
[0097]
上述的所有阳性对照均需设置阴性对照,仅用5μl水代替对应的模板即可。
[0098]
(2)环介导等温扩增:将装有反应体系的反应管置于qpcr仪中,在63℃恒温反应1h。
[0099]
(3)ct值的计算:反应结束后,计算反应的ct值,结果如表7、表8所示。
[0100]
表7 以gp130为模板的atp/mgso4浓度交叉筛选实验
[0101]
[0102]
表8 以λdna为模板的atp/mgso4浓度交叉筛选实验
[0103][0104]
最后所应当说明的是,以上实施例仅展示一部分用结果以说明本发明的技术方案并非全部,而非对本发明保护范围的限制,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。