1.本发明涉及生物技术领域,具体涉及一种用于肠癌原代细胞的快速扩增的培养基及培养方法,及其在药物的疗效评估和筛选中的应用。
背景技术:
2.肠癌是由遗传和环境因素相互作用引起的疾病,是世界范围内最常见的消化道肿瘤之一。调查数据表明(郑树等,结直肠癌的预防,中华肿瘤杂志,2004,vol.13,no.1,pp1~2),肠癌为最常见的肿瘤之一,且发病率和死亡率整体呈上升趋势,是当前严重威胁生命健康的恶性肿瘤。手术结合术后化疗是肠癌目前的主要治疗方式,虽然近些年来外科技术的不断进步,肠癌患者的生存率得到了提高,但是肿瘤的转移和复发仍给病人带来不良预后。在结直肠癌的精准治疗方面,靶向药物的出现为晚期结直肠癌患者带来了希望,未来的发展方向是如何合理的选择靶向药物和制定个体化治疗方案。而药敏试验技术的不断革新为靶向药物、化疗药物以及靶向药物联合的疗效预测提供了有力的技术支持,为实现肠癌患者的个体化治疗奠定坚实的基础。
3.现有的体外培养的肠癌细胞系主要通过将正常细胞长期培养而自发永生化或者转染促使正常细胞永生化的癌基因获得。传统方法建立的细胞系依然是细胞、分子和癌生物学研究的主要支柱。但是,这些方法改变了细胞的遗传背景,长期培养的细胞系,也容易造成基因组不稳定,可能导致肿瘤细胞系的表型和体内肿瘤细胞发生人为的改变。这些细胞系中通常缺乏原发肿瘤的复杂异质性,从而限制了这些细胞系对于预测肿瘤细胞反应的应用,影响肠癌的科学研究和药物研发的准确性。另外,从肠癌组织获得的细胞培养成癌细胞的过程中,常规培养方法较难得到癌细胞,培养过程中存在被成纤维细胞干扰,形成的克隆无法传代等问题,限制了人肠癌原代细胞的应用。
4.2017年xuefeng liu等人使用辐照的小鼠成纤维细胞和rho相关激酶抑制剂(y-27632)来扩增上皮来源的细胞,该体系具有无需基因操作就能实现上皮来源细胞无限增长的能力(xuefeng liu等,conditional reprogramming and long-term expansion of normal and tumor cells from human biospecimens.nat.protoc.2017,12,439)。但是,xuefeng liu等人建立的方法的培养周期较长,不能实现细胞的快速扩增,限制了该技术的应用。
技术实现要素:
5.为了解决上述技术问题,本发明提供了一种用于在体外快速扩增肠癌原代细胞的培养基及培养方法。
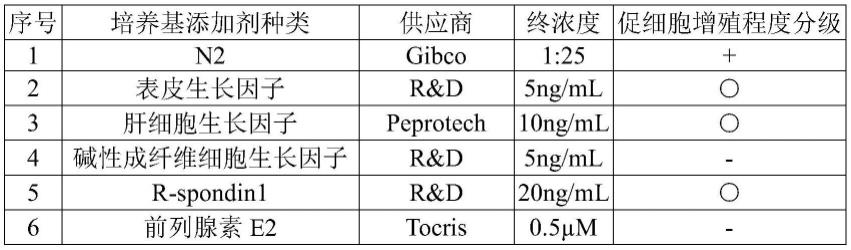
6.本发明的一个方面在于提供一种肠癌原代细胞的培养基,所述培养基包含初始培养基、rho蛋白酶抑制剂、抗生素、胃泌素、a8301、非必需氨基酸、霍乱毒素、胰岛素样生长因子-1、烟酰胺、胰岛素、胎牛血清、以及选自b27添加剂和n2添加剂中的至少一种的添加剂。所述初始培养基选自dmem/f12、dmem、f12或rpmi-1640。
primocin(购自invivogen公司,0.2%(v/v),市售产品浓度50mg/ml);步骤1中所述的组织消化液的配制方法为:1640培养基(corning,10-040-cvr)、胶原酶ⅱ(2mg/ml)、胶原酶ⅳ(2mg/ml)、dna酶(50u/ml)、透明质酸酶(0.75mg/ml)、氯化钙(3.3mm)、bsa(10mg/ml);步骤2中所述的滋养细胞例如可以为辐照后的nih-3t3细胞,辐照源为x射线或者γ射线,优选为γ射线,辐照剂量为20~50gy,优选为30gy。
28.本发明还提供一种肠癌疾病的药物筛选方法,其包括以下步骤:
29.(1)使用本发明的肠癌原代细胞的培养方法培养肠癌原代细胞,用于药物筛选;
30.(2)选定需要检测的药物并按照所需浓度梯度进行稀释;
31.(3)对(1)中培养得到的细胞添加各浓度梯度的所述药物;
32.(4)进行细胞活性测试。
33.本发明的技术方案能够取得以下技术效果:
34.(1)提高肠癌原代细胞培养的成功率,成功率达到80%以上;
35.(2)体外原代培养的肠癌原代细胞能够保持病人的病理特性;
36.(3)所培养的原代肠癌细胞不受成纤维细胞、脂肪细胞等间质细胞的干扰;
37.(4)扩增效率高,只要有105级别的细胞数量就可在一周左右时间内成功扩增出106数量级的肠癌原代细胞,扩增出的肠癌原代细胞还可以连续传代;
38.(5)培养成本可控:培养基无需加入价格昂贵的wnt激动剂、r-spondin家族蛋白、bmp抑制剂、fgf10等因子;
39.(6)所述技术培养获得的肠癌原代细胞数量大,均一化程度高,适合高通量筛选新候选化合物和为病人提供高通量药物体外敏感性功能测试。
附图说明
40.图1为表示肠癌原代细胞培养基中不同添加因子组合对癌肠代细胞增殖的影响的图。
41.图2a-2j为显示本发明的肠癌原代细胞培养基的添加因子的不同浓度对肠癌原代细胞培养的影响的图。
42.图3a-3h为利用显微镜观察使用本发明的肠癌原代细胞培养基培养得到的肠癌原代细胞的照片。
43.图4a-4d为原始肠癌组织细胞的免疫组化结果。
44.图5a-5d是以本发明的培养基ca-1培养肠癌原代细胞的免疫组化结果。
45.图6为对使用本发明的肠癌原代细胞培养基培养得到的肠癌原代细胞进行细胞免疫荧光染色的结果。
46.图7为使用本发明的肠癌原代细胞培养基对肠癌原代细胞进行培养的细胞生长曲线。
47.图8a和8b为使用本发明的肠癌原代细胞培养基ca-1和现有培养基lxf对肠癌原代细胞进行培养的比较结果。
48.图9a和9b为使用本发明的肠癌原代细胞培养基培养得到的不同代数的肠癌细胞用于药物筛选的结果。
具体实施方式
49.为更好理解本发明,下面结合实施例及附图对本发明作进一步描述,以下实施例仅是对本发明进行说明而非对其加以限定。
50.实施例1肠癌原代细胞培养基中各添加因子对肠癌原代细胞增殖的影响
51.(1)肠癌原代细胞培养基的配制
52.首先配制基础培养基。基础培养基的配方为:dmem/f12培养基(购自corning公司) 5μm y27632(购自mce公司) 5%(v/v)胎牛血清(购自excell bio公司) 100μg/ml primocin(购自invivogen公司,0.2%(v/v),市售产品浓度50mg/ml)。
53.在基础培养基内分别加入不同种类的添加剂(参见表1)配制成含有不同添加成分的肠癌原代细胞培养基。
54.(2)肠癌原代细胞的分离和处理
55.1样品选择
56.肠癌实体瘤组织样品(术中/内镜)由专业医疗机构的专业医务人员从患者获取,患者均签署了知情同意书。术中样本0.25cm3,内镜样本0.025cm3;采用商品化组织保存液(生产厂家:miltenyi biotec)存储运输。
57.2材料准备
58.15ml无菌离心管、移液枪、10ml移液管、无菌枪头等表面消毒后放入超净工作台中紫外照射30分钟。提前30分钟从4℃冰箱取出清洗培养基,提前30分钟从-20℃冰箱取出组织消化液。
59.清洗培养基:dmem/f12培养基含100μg/ml primocin(购自invivogen公司,0.2%(v/v),市售产品浓度50mg/ml)。
60.组织消化液:1640培养基(corning,10-040-cvr)、胶原酶ⅱ(2mg/ml)、胶原酶ⅳ(2mg/ml)、dna酶(50u/ml)、透明质酸酶(0.75mg/ml)、氯化钙(3.3mm)、bsa(10mg/ml)。
61.以上提及的胶原酶ⅱ、胶原酶ⅳ、dna酶、和透明质酸酶均购自sigma公司;氯化钙购自生工生物工程(上海)股份有限公司;bsa购自biofroxx公司。
62.3样品分离
63.3.1超净台中取组织样品于培养皿中,去除带血液的组织,用清洗培养基冲洗2次,将组织转移至另一培养皿中用无菌手术刀进行机械分离,将组织块分割为1*1*1mm3大小;
64.3.2将切割后的术中或内镜组织吸至15ml离心管中,加入5ml清洗培养基,混匀,于1500rpm离心4分钟;
65.3.3弃上清,按1:3比例加入清洗培养基和组织消化液(注:组织消化液的加入量是1g肿瘤组织使用约10ml组织消化液),标记样品名称及编号,用封口膜密封,在37℃下于300rpm摇床(知楚仪器zqly-180n)中进行消化,期间每30分钟观察消化是否完成,判断依据为无肉眼可见的颗粒物,消化时间4小时;
66.3.4消化完成后,经100μm滤网过滤掉未消化的组织团块,滤网上的组织团块用清洗培养基冲洗入离心管中以减少细胞损失,于25℃下1500rpm离心4分钟;
67.3.5弃上清,观察是否有血细胞,若有血细胞,加8ml血细胞裂解液(购自sigma公司),混匀,4℃裂解20分钟,期间颠倒混匀一次,25℃下1500rpm离心4分钟;
68.3.6弃上清,加入2ml含10%血清(excell bio,fnd500)的dmem/f12培养基重悬细
胞,备用。
69.4细胞计数及处理
70.4.1镜下观察:移取少量重悬细胞平铺于培养皿中,显微镜(cnoptec,bds400)下观察癌细胞密度和形态;
71.4.2活细胞计数:取重悬的细胞悬液12μl,12μl台盼蓝染液(生工生物工程(上海)股份有限公司)充分混合后,取20μl加入细胞计数板(countstar,规格:50片/盒),细胞计数仪(countstar,ic1000)下计算出活的大细胞(细胞粒径》10μm)百分率=活细胞数/总细胞数*100%。
72.(3)肠癌原代细胞的培养
73.将表1中不同成分的培养基按1ml/孔体积加入48孔板内。将按照上述步骤(2)从两例肠癌组织(编号为oe0042、oe(e)003)分离得到的肠癌原代细胞以3
×
104个/孔的细胞密度接种在48孔培养板内,以37℃、5%co2浓度的条件进行培养。培养7~10天后,细胞长至85%,弃培养基,使用每孔100μl 0.05%胰蛋白酶(购自gibco公司)润洗1遍,吸去后再每孔加入200μl 0.05%胰蛋白酶。置于37℃、5%co2培养箱中反应10分钟,显微镜(cnoptec,bds400)下观察细胞已完全消化,加入300μl含10%血清(excell bio,fnd500)的dmem/f12培养基终止消化,取20μl加入细胞计数板(countstar,规格:50片/盒),细胞计数仪(countstar,ic1000)计出细胞总数。其中,作为实验对照,使用未添加任何添加剂的基础培养基,将实验结果示于表1。
74.表1
75.[0076][0077]
其中,“ ”表示与基础培养基相比,加入该添加剂的培养基对从肠癌组织分离出的肠癌原代细胞中的至少两例有促进增殖的作用;“-”表示添加该添加剂的培养基对从肠癌组织分离出的肠癌原代细胞中的至少一例显示有抑制增殖的作用;
“○”
表示添加该添加剂的培养基对从肠癌组织分离出的肠癌原代细胞中的至少两例的增殖没有明显的影响。
[0078]
根据以上结果,拟选择非必需氨基酸、霍乱毒素、胰岛素样生长因子-1、b27或n2、烟酰胺、胰岛素、以及前列腺素e2、a8301和胃泌素等因子进行进一步培养实验。
[0079]
实施例2肠癌原代细胞培养基中不同添加因子的组合对肠癌原代细胞增殖的影响
[0080]
根据表2中的成分配制不同添加因子组合的肠癌原代细胞培养基,考察不同添加因子组合对肠癌原代细胞的促增殖作用。
[0081]
表2不同组分培养基的配制(浓度为终浓度)
[0082]
[0083][0084]
按照实施例1的步骤(2)之3的方法从肠癌组织(编号为oe0042、oe(e)006)获得肠癌原代细胞,将所获得的细胞悬液平均分成11份,1500rpm离心4分钟。离心后分别使用200μl bm、no.1~10号培养基重悬,分别按照活细胞密度2
×
104个/cm2接种于48孔板中(每孔2万细胞数),随后按照细胞密度2
×
104个/cm2加入经γ射线辐照(辐照剂量为30gy)的培养的nih-3t3细胞(购自atcc,使用基础培养基(bm)进行重悬),最后分别使用对应的培养基补齐48孔板中各孔体积至1ml,充分混匀。表面消毒后置于37℃、5%co2培养箱(购自赛默飞)培养。
[0085]
48孔板中细胞长至85%以上,弃培养基,使用100μl 0.05%胰蛋白酶(购自gibco公司)润洗1遍,吸去后再每孔加入200μl 0.05%胰蛋白酶。置于37℃、5%co2培养箱中反应10分钟,显微镜(cnoptec,bds400)下观察细胞已完全消化,加入300μl含10%血清(excell bio,fnd500)的dmem/f12培养基终止消化,取20μl加入细胞计数板(countstar,规格:50片/盒),细胞计数仪(countstar,ic1000)计出细胞总数。将由分离自术中、内镜组织样本oe0042、样本oe(e)006的肠癌原代细胞得到的结果示于图1。
[0086]
根据图1的结果可知,与基础培养基相比,在使用上述no.1~no.10培养基时,均能够不同程度地促进肠癌原代细胞的增殖。在使用含有y27632、胎牛血清、胃泌素、a8301、非必需氨基酸、霍乱毒素、胰岛素样生长因子-1、b27、烟酰胺、胰岛素(即no.2培养基,下文称为“ca-1培养基”)培养肠癌原代细胞时,增殖效果最高。
[0087]
实施例3ca-1培养基所添加因子的不同浓度对肠癌原代细胞的增殖作用
[0088]
按照实施例1的步骤(2)之3的方法从内镜组织样本(编号为oe(e)042、oe(e)050、oe(e)060)获得肠癌原代细胞。并使用实施例2中的ca-1培养基进行培养。所获得的肠癌原代细胞,按照活细胞密度1
×
104个/cm2接种于6孔板中(每孔10万细胞数),按照细胞密度2
×
104个/cm2加入经γ射线辐照(辐照剂量30gy)的nih-3t3细胞,混匀。表面消毒后置于37℃、5%co2培养箱(购自赛默飞)培养。在ca-1的基础之上培养扩增,至细胞长至85%以上,加入500μl 0.05%胰蛋白酶(购自gibco公司)润洗1分钟,吸去后再每孔加入500μl0.05%胰蛋白酶,置于37℃、5%co2培养箱中反应2~10分钟,直至细胞已经消化完全,加入500μl含10%血清(excell bio,fnd500)的dmem/f12培养基终止消化。1500rpm离心4分钟后,弃上清。dmem/f12重悬细胞沉淀。取20μl加入细胞计数板(生产厂家:countstar,规格:50片/
27632每孔1ml,y-27632的终浓度分别为2.5μm、5μm、10μm、20μm、40μm;并使用配方9的培养基设置对照孔(bc)。
[0110]
在使用配方10的培养基时,在接种有原代细胞的48孔板中分别添加配制好的胎牛血清每孔1ml,胎牛血清的添加比例分别为2.5%(v/v)、5%(v/v)、10%(v/v)、20%(v/v)、40%(v/v);并使用配方10的培养基设置对照孔(bc)。
[0111]
待细胞扩增至48孔的85%左右消化计数,分别参比对照孔(bc)细胞数计算增殖倍数,将结果分别示于图2a~2j。图2a~2j中,比值为使用各培养基培养一代得到的细胞数与对应的对照孔培养一代得到的细胞数的比。比值大于1说明配制的含不同浓度的因子或小分子化合物的培养基促增殖效果优于对照孔培养基;比值小于1,则说明配制的含不同浓度的因子或小分子化合物的培养基促增殖效果较对照孔培养基促增殖效果弱。
[0112]
根据图2a~2j的结果,胃泌素的含量优选为1.25~20nm,更优选为2.5~10nm,特别优选为5nm;a8301的含量优选为25~200nm,更优选为200nm;非必需氨基酸的含量优选为25~400μm,更优选为50μm;霍乱毒素的含量优选为1.25~20ng/ml,更优选为2.5~5ng/ml,特别优选为5ng/ml;胰岛素样生长因子-1的含量优选为5~405ng/ml,更优选为45ng/ml;b27的体积浓度优选为25~200x,更优选为25~50x,特别优选为25x;烟酰胺在培养基中的含量优选为2~8mm,更优选4~8mm,特别优选4mm;胰岛素的含量优选为0.5~4μg/ml,更优选为1~2μg/ml,特别优选为2μg/ml;y-27632的含量优选为2.5~40μm,更优选为2.5~5μm,特别优选为5μm;胎牛血清的体积含量优选为2.5~5%(v/v),更优选5%(v/v)。
[0113]
实施例4肠癌原代细胞培养及鉴定
[0114]
(1)肠癌原代细胞培养
[0115]
按照实施例1的步骤(2)之3的方法从内镜组织样本(编号为oe(e)019、oe(e)028、oe(e)021、oe(e)023、oe(e)026、oe(e)025、oe(e)024、oe(e)004)获得肠癌原代细胞,并使用实施例2中的ca-1培养基进行培养,所获得的肠癌原代细胞,按照活细胞密度1
×
104个/cm2接种于6孔板中(每孔10万细胞数),按照细胞密度2
×
104个/cm2加入经γ射线辐照(辐照剂量30gy)的nih-3t3细胞,混匀。表面消毒后置于37℃、5%co2培养箱(购自赛默飞)培养。
[0116]
使用显微镜(invitrogen公司evos m500)观察培养得到的肠癌原代细胞,图3a-3h是10倍物镜下拍摄得到的照片,细胞在镜下呈紧密排列,形态略不规则。
[0117]
(2)肠癌组织传代培养后的肠癌细胞免疫组化鉴定
[0118]
从一例肠癌患者的术中组织(样本编号oe(o)001)取出约0.25cm3大小的癌组织,浸泡在1ml 4%多聚甲醛中固定。使用实施例3的方法采用本发明的培养基ca-1将样本oe(o)001持续培养至第5代。4%多聚甲醛固定后的组织或细胞,经石蜡包埋,用切片机切成4μm厚的组织切片。随后进行常规的免疫组织化学检测(具体步骤参见li等,nature communication,(2018)9:2983)。所使用的一抗为ki-67、ck20、cdx-2、villin(均购自cst)。
[0119]
图4a-4d和5a-5d分别是原始组织细胞和采用该细胞以本发明的培养基ca-1培养而获得的肠癌肿瘤细胞的免疫组化结果对比图。图4a和图5a分别是肠癌组织和扩增培养后得到的细胞标记ki-67抗体的图片,图4b和图5b分别是肠癌组织和扩增培养后得到的细胞标记ck20抗体的图片,图4c和图5c分别是肠癌组织和扩增培养后得到的细胞标记cdx-2抗体的图片,图4d和图5d分别是肠癌组织和扩增培养后得到的细胞标记villin抗体的图片。由此可以确认,采用本发明技术培养的肠癌肿瘤细胞(样本编号oe(o)001)培养至第5代时,
细胞上与肠癌相关的生物标记物的表达情况与细胞来源的原始组织切片的标记物表达情况基本一致。说明采用本发明技术所培养的细胞保持了肠癌病人癌组织的原始病理特性。
[0120]
(3)传代培养后的肠癌原代细胞免疫荧光鉴定
[0121]
使用实施例2中的ca-1培养基培养样本oe(o)001直至细胞长至85%以上,加入500μl 0.05%胰蛋白酶(购自gibco公司)润洗1分钟,吸去后再每孔加入500μl 0.05%胰蛋白酶,置于37℃、5%co2培养箱中反应2~10分钟,直至细胞已经消化完全,加入500μl含10%血清(excell bio,fnd500)的dmem/f12培养基终止消化。1500rpm离心4分钟后,弃上清,加入500μl ca-1培养基重悬,对培养得到的肠癌原代细胞进行免疫荧光染色鉴定。
[0122]
将培养后的肠癌原代细胞种于细胞玻片(购自赛默飞公司)上,置于37℃、5%co2培养箱培养,待细胞贴壁,再培养2~3天。
[0123]
细胞扩增80%底面积时,弃培养液,pbs(购自上海生工)洗一次,加入300微升4%多聚甲醛(biosharp,bl539a),室温静置固定细胞20分钟。pbs洗5分钟,重复3次。随后使用pbs 0.3%triton x-100(购自上海生工)配制5%体积浓度的bsa(购自上海生工)溶液用于封闭,37℃水浴锅封闭30分钟。一抗稀释液(beyotime,p0023a)稀释抗体,按照1:50比例稀释特异性抗体ki-67、ck20、cdx-2、villin(均购自cst公司)。弃封闭液,加入配制好的一抗,置4℃冰箱孵育过夜,其中,ck20几乎在全部肠道腺癌中表达,cdx-2( )和villin( )鉴定结肠腺癌。
[0124]
次日,4℃冰箱取出,平衡至室温,37℃继续孵育1小时,pbs洗5分钟,重复3次。配制一抗稀释液用于二抗稀释,按照1:1000比例稀释激发光为488nm且种属为兔或鼠的荧光二抗(购自赛默飞公司),常温避光孵育1小时,pbs洗5分钟,重复3次。
[0125]
1:1000pbs稀释dapi(购自sigma公司),常温避光染色5分钟,pbs洗5分钟,重复3次。显微镜(invitrogen公司evos m500)下成像,拍照记录。
[0126]
图6为样本oe(o)001体外培养后的肠癌原代细胞进行免疫荧光染色鉴定的结果,分别为20倍物镜下荧光拍照的图片。如图6所示,ki-67、ck20、cdx-2、villin表达,提示该样本为结直肠腺癌细胞,且使用本发明培养基ca-1培养的原代细胞与肠癌组织诊断结果一致,采用本发明技术所培养的细胞保持了肠癌癌病人的原始病理特性。
[0127]
实施例5肠癌原代细胞初次培养周期和细胞数统计及population doubling(pd)值计算
[0128]
按照实施例1步骤(2)之3的方法从4例样本肠癌组织样本(编号为oe0042、oe(e)003、oe(e)006、oe(o)001获得肠癌原代细胞。对于所获得的肠癌原代细胞,使用实施例2中的ca-1培养基培养,按照活细胞密度2
×
104个/cm2将细胞接种在t25瓶中并进行培养,待细胞扩增至95%后消化并计数,同时记录直至消化时培养的天数,将该直至消化时培养的天数作为一个培养周期。在该实验条件下持续培养,将扩增所得的细胞进行不同代数扩增,每一代进行消化后计数并记录相应培养的周期,根据公式population doubling(pd)=3.32*log10(消化后细胞总数/初始种入细胞数)计算pd,公式参见chapman等,stem cell research&therapy 2014,5:60。
[0129]
图7显示采用graphpad prism软件绘制的,使用本发明的肠癌原代细胞培养条件下4例原代细胞的生长曲线,横坐标表示细胞培养的天数,纵坐标是累计的细胞增殖倍数,表示细胞在培养周期内扩增的倍数,数值越大表示细胞在一定周期内扩增的次数越多,即
扩增得到的细胞数也就越多,斜率代表的是细胞扩增的速率。从图7中可以确认,本发明培养基ca-1培养的肠癌原代细胞持续培养扩增至少80天时,细胞扩增速率基本保持不变,仍具有继续扩增的能力。
[0130]
实施例6与现有培养基培养效果的比较
[0131]
(1)培养基配制
[0132]
文献培养基(xuefeng liu等,nat.protoc.,12(2):439-451,2017)),其配方为dmem/f12培养基 250ng/ml两性霉素b(购自selleck公司) 10μg/ml庆大霉素(购自mce公司) 0.1nm霍乱毒素 0.125ng/ml egf 25ng/ml氢化可的松 10μm y27632 10%fbs(以下简称为“lxf”培养基)。
[0133]
(2)肠癌原代细胞的获取和培养
[0134]
按照实施例1的步骤(2)之3的方法从术中组织样本(oe(e)003、oe0042)获得肠癌原代细胞,分别进行有滋养细胞条件的培养和无滋养细胞条件的培养。
[0135]
在有滋养细胞时,分别使用上述配方lxf培养基和实施例2中的ca-1培养基按照活细胞密度3
×
104个/cm2接种于48孔板中(每孔3万细胞数),随后按照细胞密度2
×
104个/cm2加入经γ射线辐照(辐照剂量30gy)的nih-3t3细胞,最后分别使用对应的培养基补齐48孔板中各孔体积至500微升,充分混匀。表面消毒后置于37℃、5%co2培养箱(购自赛默飞)培养。直至48孔板中细胞长至85%以上,进行传代。
[0136]
在无滋养细胞时,分别使用上述lxf培养基和实施例2中的ca-1培养基按照活细胞密度3
×
104个/cm2接种于48孔板中(每孔3万细胞数),再分别使用对应的培养基补齐48孔板中各孔体积至500微升,充分混匀。表面消毒后置于37℃、5%co2培养箱(购自赛默飞)培养。直至48孔板中细胞长至85%以上,进行传代。
[0137]
在培养第7天,取出48孔板,弃培养基,使用100μl 0.05%胰蛋白酶(购自gibco公司)润洗1遍,吸去后再每孔加入200μl 0.05%胰蛋白酶。置于37℃、5%co2培养箱中反应10分钟,置于37℃、5%co2培养箱中反应10分钟,显微镜(cnoptec,bds400)下观察细胞已完全消化,加入300μl含10%血清(excell bio,fnd500)的dmem/f12培养基终止消化。取20μl加入细胞计数板(countstar,规格:50片/盒),细胞计数仪(countstar,ic1000)计出细胞总数,将计数结果示于图8a和8b。
[0138]
根据图8a和8b的结果可知,与lxf培养基相比,不管有无滋养细胞,ca-1能显著促进肠癌原代细胞扩增,其效果优于现有技术采用的lxf培养基。并且,在有滋养细胞的条件下(图8b),对于肠癌原代细胞的扩增促进效果更为明显。
[0139]
实施例7使用本发明培养基扩增得到的肠癌原代细胞用于药物筛选
[0140]
1、细胞培养和铺板
[0141]
从得到的肠癌术中/内镜样本(oe(e)003、oe0042)按照实施例1同样的方法分离得到肠癌原代细胞,并使用ca-1培养基进行培养,待细胞扩增至85%,进行消化传代,作为一代。按照实施例1中步骤将细胞消化计数,将细胞按照活细胞密度5.76
×
104个/ml细胞置于加样槽(购自康宁公司)中充分混匀后,种植384孔不透明白色细胞培养板(购自康宁公司)进行培养,每孔体积50μl,细胞数目为3000个/孔。从孔板边缘加入ca-1培养基封板,板上标注样品名称及celltiter-glo(购自promega公司)检测时间。表面75%酒精(购自利尔康)消毒,置37℃、5%co2培养箱培养。分别获取培养第1代、第2代、第3代、第4代、第5代细胞进行
药物筛选,测试使用本发明培养基培养的原代细胞连续传代药物敏感性的。
[0142]
2、筛选药物配制
[0143]
按照下表配制7个浓度梯度的2种药物(柔红霉素、达沙替尼;均购自mce公司),在384孔药板(购自赛默飞公司)每孔中添加30μl,保存待用。
[0144]
表4柔红霉素、达沙替尼药物添加液的配制
[0145][0146]
3、高通量加药
[0147]
取出配制好的药板,置于室温,于离心机(贝克曼)中室温1000rpm离心1分钟后取出。采用高通量自动化加样系统(perkin elmer公司janus)进行高通量加药。对培养有肠癌细胞的384孔板在每孔加入0.1μl对应浓度的筛选药物。加药结束后,384孔板表面消毒后移至培养箱中,72小时后测定细胞活性。
[0148]
4、细胞活性测试
[0149]
4℃冰箱取出celltiter-glo发光试剂(购自promega公司),取10毫升试剂置于加样槽中。培养箱中取出待检测384孔板,每孔加入10μl celltiter-glo发光试剂,静置10分钟后混匀,使用多功能酶标仪(perkin elmer公司envision)检测。
[0150]
5、数据处理
[0151]
按照公式细胞抑制率(%)=100%-加药孔化学发光数值/对照孔化学发光数值*100%,计算得到不同药物作用细胞后的细胞抑制率,使用graphpad prism软件计算药物对细胞作用的半数抑制率(ic
50
)。将结果示于图9a和9b。
[0152]
由图9a和9b可以确认,使用本发明的肠癌原代细胞培养基培养得到的肠癌细胞进行药物筛选,相同药物对于培养的不同代数细胞抑制效果基本保持一致(抑制曲线基本保持一致)。同一病人的细胞对不同药物在人体内最大血药浓度时的敏感性不同。根据结果可以判断肠癌病人在临床使用该种药物时的有效性,同时可以说明根据本专利培养方法得到不同代数的肿瘤细胞对药物的敏感性是稳定的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。