一种流行性腮腺炎病毒的mnp标记位点、引物组合物、试剂盒及其应用
技术领域
1.本发明实施例涉及生物技术领域,特别涉及一种流行性腮腺炎病毒的mnp标记位点、引物组合物、试剂盒及其应用。
背景技术:
2.流行性腮腺炎病毒(mumps virus)是一种rna病毒,人是腮腺炎病毒唯一宿主,病毒经飞沫传播,易感者为学龄期儿童。临床表现主要为一侧或双侧腮腺肿大,伴发热、乏力、肌肉疼痛等,约0.1%的患儿可并发病毒性脑膜炎。腮腺炎也是导致儿童期获得性耳聋的常见原因。疫苗接种是有效的预防措施。腮腺炎病后可获牢固的免疫力。腮腺炎病毒仅有一个血清型,毒株的变异会影响临床医学的诊断方案。另外,对于流行性腮腺炎病毒的实验研究来说,毒株的变异会导致不同实验室或同一实验室不同时期相同命名的毒株实际上并不相同,导致实验结果的不可重现和不可比较。人hella细胞实验室间的异质性已经导致大量的实验结果的不可比较和数据浪费。因此,开发快速、准确的、可监测变异的流行性腮腺炎病毒检测方法对于流行性腮腺炎病毒的监测和科学研究都具有重要意义。
3.经典的流行性腮腺炎病毒检测方法,包括分离培养、pcr技术、全基因组和宏基因组测序等,在依赖于病毒的培养、时长、操作复杂度、检测通量、检测变异的准确性和灵敏度、成本等方面存在一个或多个局限。融合超多重pcr扩增和高通量测序的靶向分子标记检测技术,可以在低微生物含量的样本中靶向的富集目标微生物,避免了全基因组依赖于病原菌的分离培养和宏基因组测序带来的大量数据浪费和背景噪音的局限,具有样本需要量少、诊断结果精确,节约数据量、检测低频变异和免培养的优势。现有的靶向检测技术检测的分子标记主要包括snp和ssr标记。ssr标记是公认的多态性最高的标记,但在微生物中数量少;snp标记数量巨大,分布密集,是二态性标记,单个snp标记的多态性不足以捕获微生物种群中潜在的等位基因多样性。
4.因此,开发流行性腮腺炎病毒的高多态性的新型分子标记及其检测技术,成为亟待解决的技术问题。
技术实现要素:
5.本发明目的是提供一种流行性腮腺炎病毒特异的mnp标记位点、引物组合物、试剂盒及其应用,可以对流行性腮腺炎病毒进行定性的鉴定和变异检测,具有多靶标、高通量、高灵敏和精细分型的效果。
6.为了实现上述目的,本发明采用如下技术方案:
7.在本发明的第一方面,提供了一种流行性腮腺炎病毒特异的mnp标记位点,所述mnp标记位点是指在流行性腮腺炎病毒基因组上筛选的区分于其他物种且在物种内部具有多个核苷酸多态性的基因组区域,包括流行性腮腺炎病毒参考序列上mnp-1~mnp-15的标记位点。
8.上述技术方案中,mnp-1~mnp-15的标记位点具体如说明书表1所示,表1中标注的所述mnp标记的起始和终止位置是基于表1中mnp同一行对应的参考序列确定的。
9.在本发明的第二方面,提供了一种用于检测所述mnp标记位点的多重pcr引物组合物,所述多重pcr引物组合物包括15对引物,具体的引物序列如seq id no.1-seq id no.30所示。
10.上述技术方案中,每个mnp标记位点的引物包括上引物和下引物,具体如说明书表1所示。
11.在本发明的第三方面,提供了一种用于检测所述流行性腮腺炎病毒mnp标记位点的检测试剂盒,所述试剂盒包括所述的引物组合物。
12.进一步地,所述试剂盒还包括多重pcr预混液。
13.在本发明的第四方面,提供了所述的流行性腮腺炎病毒的mnp标记位点或者所述的多重pcr引物组合物或者所述的检测试剂盒在在非诊断目的的流行性腮腺炎病毒定性检测和制备流行性腮腺炎病毒定性检测产品中的应用。
14.在本发明的第五方面,提供了所述的流行性腮腺炎病毒的mnp标记位点或者所述的多重pcr引物组合物或者所述的检测试剂盒在检测流行性腮腺炎病毒毒株内部和毒株间遗传变异中的应用。
15.在本发明的第六方面,提供了所述的流行性腮腺炎病毒的mnp标记位点或者所述的多重pcr引物组合物或者所述的检测试剂盒在构建流行性腮腺炎病毒数据库中的应用。
16.在本发明的第七方面,提供了所述的流行性腮腺炎病毒的mnp标记位点或者所述的多重pcr引物组合物或者所述的检测试剂盒在流行性腮腺炎病毒精细分型检测中的应用。
17.以上所述的应用中,具体操作步骤为:
18.首先是获取待测样本的病毒的总rna;利用商业化的反转录试剂盒反转录成cdna;利用本发明的试剂盒对所述cdna和空白对照进行第一轮多重pcr扩增,循环数不高于25个;
19.对扩增产物进行纯化后,进行基于第二轮pcr扩增的样本标签和二代测序接头添加;对第二轮扩增产物纯化后定量;
20.检测多个毒株时通过将第二轮扩增产物等量混合后进行高通量测序;
21.测序结果比对到所述的流行性腮腺炎病毒的参考序列上,获取在所述cdna的检测序列数目和基因型数据。根据在所述cdna和所述空白对照获得的流行性腮腺炎病毒测序序列数量和检出mnp标记的数目,对所述cdna的测序数据进行数据质量控制和数据分析,获得检出mnp标记数目、覆盖每个所述mnp标记的测序序列数目和所述mnp标记基因型数据。
22.当用于流行性腮腺炎病毒鉴定时,根据在待测样品和空白对照中检出的流行性腮腺炎病毒的测序序列数量和检出mnp标记的数目,进行质控后判定待测样品中是否含有流行性腮腺炎病毒的核酸。其中,所述的质控方案和判定方法是以拷贝数已知的流行性腮腺炎病毒的rna为检测样本,评估所述试剂盒检测流行性腮腺炎病毒的灵敏度、准确性和特异性,制定所述试剂盒检测流行性腮腺炎病毒时的质控方案和判定方法。
23.当用于流行性腮腺炎病毒遗传变异检测时,包括毒株间和毒株内部的遗传变异检测。毒株间的遗传变异检测包括利用所述的试剂盒和方法,获得待比较毒株各自在所述mnp标记的基因型数据。通过基因型比对,分析待比较毒株在所述mnp标记上的主基因型(即在
一个mnp标记具有超过50%测序片段支持的基因型)是否存在差异。若待比较毒株在至少一个mnp标记的主基因型存在变异,则判定两者存在遗传变异。作为一种备选方案,也可以通过单重pcr对待比较毒株的15个位点分别进行扩增,然后对扩增产物进行sanger测序,获得序列后,对待比较毒株每个mnp标记的基因型进行比对。如果存在主基因型不一致的mnp标记,则待比较毒株之间存在变异。当检测毒株内部的遗传变异时,则通过统计模型判定在待测毒株所述的mnp标记是否检出主基因型以外的次基因型。若待测毒株在至少一个mnp标记存在次基因型,则判定待测毒株内部存在遗传变异。
24.当用于构建流行性腮腺炎病毒mnp指纹数据库时,将从样本中鉴定的流行性腮腺炎病毒的所述mnp标记的基因型数据,录入数据库文件,构成流行性腮腺炎病毒的mnp指纹数据库;每次鉴定不同的样本时,通过和所述流行性腮腺炎病毒的mnp指纹数据库比对,鉴定样本中的流行性腮腺炎病毒是否和数据库中的毒株在所述mnp标记存在主基因型mnp标记的差异,在至少1个mnp标记存在主基因型差异的流行性腮腺炎病毒即为新的变异类型,收录进mnp指纹数据库。
25.当用于流行性腮腺炎病毒分型时,是对待测样本中的流行性腮腺炎病毒进行鉴定,获得每个所述mnp标记的基因型;收集网上公开的流行性腮腺炎病毒的基因组序列和已构建的流行性腮腺炎病毒mnp指纹数据库组成流行性腮腺炎病毒参考序列库;将待测样本中流行性腮腺炎病毒的基因型和所述流行性腮腺炎病毒的参考序列库进行比对,筛选遗传上一致或最接近的毒株,获得待测样本中流行性腮腺炎病毒的分型。根据同所述参考序列库的比对结果,鉴定样品中的流行性腮腺炎病毒是已有的毒株还是新的变异株,实现对流行性腮腺炎病毒的精细分型。
26.本发明在流行性腮腺炎病毒领域属于首创,并未见相关文献报道;mnp标记主要基于参考序列开发,根据已报道的流行性腮腺炎病毒代表小种的重测序数据可以挖掘大规模的区分于其他物种、在流行性腮腺炎病毒物种内部多态、两侧序列保守的mnp标记;通过mnp标记两侧的保守序列可以设计适用于于多重pcr扩增的mnp标记检测引物;再根据标准品的测试结果,可筛选出一套多态性最大、特异性高的一套mnp标记、兼容性最好的引物组合以及检测试剂盒。
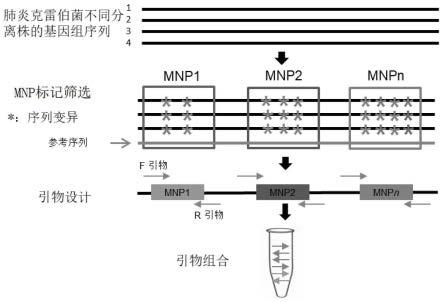
27.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
28.本发明提供了一种流行性腮腺炎病毒的mnp标记位点、引物组合物、试剂盒及其应用。所提供的流行性腮腺炎病毒的15个mnp标记和其引物组合,可进行多重pcr扩增,融合二代测序平台进行扩增产物的测序,满足对结合分枝杆菌进行高通量、高效率、高准确性和高灵敏度检测的需求,满足流行性腮腺炎病毒标准的、可共享的指纹数据构建的要求;准确检测流行性腮腺炎病毒毒株间遗传变异的需求;鉴定流行性腮腺炎病毒纯合和杂合的需求,为流行性腮腺炎病毒的科学研究、科学监测和防治提供技术支撑。
附图说明
29.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明实施例的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
30.图1为mnp标记多态性原理图;
31.图2为流行性腮腺炎病毒mnp标记位点的筛选和引物设计流程图;
32.图3为mnp标记位点的检测流程图。
具体实施方式
33.下文将结合具体实施方式和实施例,具体阐述本发明实施例,本发明实施例的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明实施例,而非限制本发明实施例。
34.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明实施例所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
35.除非另有特别说明,本发明实施例中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
36.本技术实施例的技术方案为解决上述技术问题,总体思路如下:
37.本发明开发适应于检测群体生物的、物种特异的新型分子标记-mnp标记。mnp标记是指在基因组上一段区域内由多个核苷酸引起的多态性标记。与ssr标记和snp标记相比,mnp标记具有以下优势:(1)等位基因丰富,单个mnp标记上有2n种等位基因,高于ssr和snp;(2)物种区分能力强,只需要少量的mnp标记就能实现物种鉴定,减少了检测错误率。基于超多重pcr结合二代高通量测序技术检测mnp标记的mnp标记法具有以下优势:(1)输出的是碱基序列,无需平行实验,可构建标准化的数据库进行共享共用;(2)高效率,利用样品rna条形码,突破测序样品数量的局限,可一次性对成百上千份样本的数万个mnp标记分型;(3)高灵敏度,利用多重pcr一次检测多个靶标,避免单个靶标扩增失败导致高的假阴性和低的灵敏度;(4)高准确性,利用二代高通量测序仪对扩增产物测序数百次。
38.鉴于以上优点和特性,mnp标记及其检测技术mnp标记法可实现群体生物多等位基因型的分类与溯源,在病原微生物的鉴定、指纹数据库构建、遗传变异检测等方面都具有应用潜力。目前在微生物中,尚未有关于mnp标记的报道,也缺乏相应的技术。因此,本发明开发了流行性腮腺炎病毒的mnp标记位点,所述mnp标记位点为在流行性腮腺炎病毒基因组上筛选的区分于其他物种且在物种内部具有多个核苷酸多态性的基因组区域,包括以mg986460.1为参考基因组的mnp-1~mnp-15的标记位点。
39.接着,本发明开发了用于检测所述流行性腮腺炎病毒mnp标记位点的多重pcr引物组合物,其特征在于,所述多重pcr引物组合物包括15对引物,所述15对引物的核苷酸序列如seq id no.1~seq id no.30所示。所述引物互相间不冲突,可以通过多重pcr进行高效的扩增。
40.所述多重pcr引物组合物可以作为用于检测所述流行性腮腺炎病毒mnp标记位点的检测试剂盒。
41.本发明实施例所提供的试剂盒能灵敏的检测到低至10拷贝/反应的流行性腮腺炎病毒。
42.本发明的mnp标记和所述试剂盒在复杂模板中检测流行性腮腺炎病毒的高特异性。
43.下面将结合实施例、对比例及实验数据对本技术的一种流行性腮腺炎病毒的mnp标记位点、引物组合物、试剂盒及其应用进行详细说明。
44.实施例1、流行性腮腺炎病毒mnp标记位点的筛选和多重pcr扩增引物的设计
45.s1、流行性腮腺炎病毒mnp标记位点的筛选
46.基于网上公开的3794个流行性腮腺炎病毒不同分离株的基因组完整或部分序列,通过序列比对,获得15个mnp标记位点。对于网上不存在基因组数据的物种,也可以通过高通量测序获得待检测微生物物种代表小种的基因组序列信息,其中高通量测序可以是全基因组或简化基因组测序。为了保证所筛选标记的多态性,一般使用至少10个遗传上有代表性的分离株的基因组序列作为参考。筛选的15个mnp标记位点如表1所示:
47.表1-所述mnp标记位点以及检测引物在参考序列上的起始位置
[0048][0049]
所述步骤s1具体包括:
[0050]
选择所述流行性腮腺炎病毒的一个代表株的基因组序列作为参考基因组,将所述基因组序列和所述参考基因组进行序列比对,获得所述流行性腮腺炎病毒各毒株的单核酸多态性位点;
[0051]
在所述参考基因组上,以100~300bp为窗口,以1bp为步长进行窗口平移,筛选获得多个候选mnp标记区域,其中,所述候选mnp标记区域含有≥2个所述单核苷酸变异位点,且两端各30bp的序列上均不存在所述单核酸多态性位点;
[0052]
在所述候选多核苷酸多态性位点区域中筛选区分度dp≥0.2的区域作为mnp标记位点;其中,dp=d/t,t是在所述候选多核苷酸多态性位点区域中所有小种两两比较时的比较对数,d是在所述候选多核苷酸多态性位点区域中至少两个单核酸多态性差异的样品对数。
[0053]
作为一种可选的实施方式,在所述参考基因组上,以100~300bp为窗口进行筛选时,也可选用其他步长,本实施方式采用步长为1bp,有利于全面的筛选。
[0054]
s2、多重pcr扩增引物的设计
[0055]
通过引物设计软件设计所述mnp标记的多重pcr扩增引物,引物设计遵循引物间互不干扰,所有引物可以组合成引物池进行多重pcr扩增,即所有设计的引物可以在一个扩增反应中均正常扩增。
[0056]
该实施方式中,用于鉴定所述mnp标记位点的引物,如表1所示。
[0057]
s3、引物组合的检测效率评估
[0058]
所述mnp标记的检测方法是通过多重pcr对所有mnp标记一次性进行扩增,通过二代高通量测序对扩增产物进行测序,对测序数据进行分析,根据检出的位点评价所述引物组合的兼容性。
[0059]
使用购买的拷贝数已知的流行性腮腺炎病毒rna质控品(货物编号:vip(vc)040),经商业化反转录试剂盒反转录成cdna后,加入到人基因组dna(2ng/反应)中,制备成1000拷贝/反应的模板,使用所述的引物组合,根据在4个文库中mnp标记的检出情况筛查物种区分度高且特异的mnp标记和扩增均匀、兼容性最优的引物组合,最终筛选出本发明所所述的15个mnp标记及其引物组合物。
[0060]
实施例2所述mnp标记和引物鉴定流行性腮腺炎病毒的阈值设置和性能评估
[0061]
1、mnp标记的检测
[0062]
使用购买的拷贝数已知的流行性腮腺炎病毒rna质控品(货物编号:vip(vc)040),经商业化反转录试剂盒反转录成cdna后,加入到人基因组dna中,制备1拷贝/反应、10拷贝/反应和100拷贝/反应的流行性腮腺炎病毒模拟样本。同时设置的等体积的无菌水作为空白对照。共计4个样本,每个样本每天构建3个重复文库,连续检测4天,即每个样本获得12组测序数据,具体如表2所示。根据在12次重复实验中,在空白对照和流行性腮腺炎病毒核酸质控品中检出的流行性腮腺炎病毒mnp标记的测序片段数和位点数,评估检测方法的重现性、准确性、灵敏度,制定质控体系污染和目标病原体检出的阈值。mnp标记的检测流程如图3所示。
[0063]
表2-流行性腮腺炎病毒的mnp标记法的检测灵敏度、稳定性分析
[0064][0065]
如表2所示,所述试剂盒能在10拷贝/反应的样本中稳定的检出6个以上mnp标记,而在0拷贝/反应的样本中最多检出2个mnp标记,所述试剂盒能够明显区分10拷贝/反应和0
拷贝/反应的样品,具有技术稳定性和低至10拷贝/反应的检测灵敏度。
[0066]
2、mnp标记检测试剂盒检测流行性腮腺炎病毒的重现性和准确性评估
[0067]
基于两次重复中,共同检出位点的基因型是否可重现,评估mnp标记检测方法检测流行性腮腺炎病毒的重现性和准确性。具体地,对100拷贝/反应的样品的12组数据分别进行成对比较,结果如表3所示,
[0068]
表3-流行性腮腺炎病毒mnp标记检出方法的重现性和准确率评估
[0069]
重复1重复2共同位点数可重复位点数重现率r准确率as-1s-21515100%100%s-1s-31515100%100%s-1s-41515100%100%s-1s-51515100%100%s-1s-61515100%100%s-1s-71515100%100%s-1s-81515100%100%s-1s-91515100%100%s-1s-101515100%100%s-1s-111515100%100%s-1s-121515100%100%
[0070]
由表3可知,主基因型存在差异的mnp标记数目都为0;依据2次重复实验间可重现的基因型认为是准确的原则,准确率a=1-(1-r)/2=0.5 0.5r,r代表重现率,即主基因型可重现的位点数目占共有位点数目的比率。本项目重现性试验中每个样品不同文库间、不同建库批次间mnp标记主基因型的差异对数为0,重现率r=100%,准确率a=100%。因此,本发明的试剂盒能够准确检测低至10拷贝/反应的流行性腮腺炎病毒。
[0071]
3、mnp标记检测试剂盒检出流行性腮腺炎病毒的阈值判定
[0072]
在1个拷贝/反应的样本中能检出比对到流行性腮腺炎病毒的序列,至少覆盖1个mnp标记。而在部分空白对照中也检出了流行性腮腺炎病毒的序列。由于mnp标记检测方法的极度灵敏,因此检测过中的数据污染容易导致假阳性的产生。因此本实例中制定质控方案,具体如下:
[0073]
1)测序数据量大于4.5百万碱基。测算依据是每个样品检测mnp标记的数目是15个,一条测序片段的长度是300个碱基,所以当数据量大于4.5百万碱基时,大部分样品一次实验可以保证覆盖每个位点的测序片段数量达到1000倍,保证对每个mnp标记碱基序列的精准分析。
[0074]
2)根据测试样品中的流行性腮腺炎病毒的信号指数s和空白对照中流行性腮腺炎病毒的噪音指数p判定污染是否可接受,其中:
[0075]
空白对照噪音指数p=nc/nc,其中nc和nc分别代表空白对照中,流行性腮腺炎病毒的测序片段的数量和总测序片段数量。
[0076]
测试样品的信号指数s=nt/nt,其中nt和nt分别代表测试样品中,流行性腮腺炎病毒的测序片段的数量和总测序片段数量。
[0077]
3)计算测试样品中mnp标记位点的检出率,指的是检出位点数和总设计位点数的
比值。
[0078]
表4-4个样本12次检测中流行性腮腺炎病毒的信噪比
[0079][0080]
结果如表4所示,流行性腮腺炎病毒在空白对照中的噪音指数平均值是0.04%,而在1拷贝/反应的样品中的信号指数平均值是0.33%,1拷贝/反应的样品和空白对照的信噪比的平均值是8.3,因此,本发明规定当信噪比大于10倍时,可判定检测体系中的污染是可接受的。
[0081]
在10拷贝/反应的样品和空白对照的信噪比的平均值是75.3,最小值是62.5,在10拷贝/反应的12组数据中,能稳定的检出至少6个mnp标记,占总位点的40.0%。因此,在保证准确性的情况下,本标准规定流行性腮腺炎病毒的信噪比判定阈值是62.5,即当样品中流行性腮腺炎病毒的信噪比大于62.5,且位点检出率大于等于40%时,判定样本中检出了流行性腮腺炎病毒的核酸。
[0082]
因此本发明所提供的试剂盒能准确、灵敏的检测到低至10拷贝/反应的流行性腮腺炎病毒。
[0083]
4、mnp标记检测方法检测流行性腮腺炎病毒的特异性评估
[0084]
人为的将流行性腮腺炎病毒和寨卡病毒、冠状病毒、流感病毒、结核分枝杆菌、不动杆菌属菌株、百日咳鲍特菌、霍氏鲍特菌、肺炎衣原体、肺炎支原体、eb病毒、流感嗜血杆菌、水痘-带状疱疹病毒、巨细胞病毒、单纯疱疹病毒、人博卡病毒、肺炎克雷伯杆菌、军团菌属、卡他莫拉菌、铜绿假单胞菌、立克次氏体属、金黄色葡萄球菌、肺炎链球菌、酿脓链球菌的核酸混在一起,制备混合模板,以空白模板作为对照,采用本发明所提供的方法对混合模板中的流行性腮腺炎病毒进行检测,进行3个重复实验,在3个重复实验中都能特异的检出所述的流行性腮腺炎病毒的的15个mnp标记。经序列比对和按照所述的质控方案和判定阈值进行分析后,在3个重复实验中流行性腮腺炎病毒均判为阳性表明所述mnp标记和所述试剂盒在复杂模板中检测目标微生物的高特异性。
[0085]
实施例3、流行性腮腺炎病毒毒株间的遗传变异检测
[0086]
利用所述的试剂盒和mnp标记位点检测方法对湖北省疾控提供的1份流行性腮腺炎病毒毒株不同时期的6份拷贝毒株进行检测,样本依次命名为s1-s6,每个样品的测序平均覆盖倍数达3641倍,每个毒株均可以检出全部15个mnp标记(表5)。将6个毒株的指纹图谱进行两两比对,结果如表5所示,s3和同批次一起检测的其他5份流行性腮腺炎病毒均在5个mnp标记的主基因型存在差异(表5),表明存在毒株间变异。
[0087]
表5-6个流行性腮腺炎病毒的检测分析
[0088][0089][0090]
由表5可知,本发明的试剂盒通过检测mnp标记鉴定毒株间遗传变异的应用可以用于保证不同实验室相同命名流行性腮腺炎病毒毒株的遗传一致性,从而保证研究结果的可比较性,这对于流行性腮腺炎病毒的科学研究具有重要意义。而在临床上,可针对差异位点是否影响抗药性斟酌诊断方案。
[0091]
实施例4、流行性腮腺炎病毒毒株内部的遗传变异检测
[0092]
作为群体生物,流行性腮腺炎病毒群体内部部分个体发生变异,使群体不再纯合,形成异质的杂合群体,影响尤其是试验用流行性腮腺炎病毒表型的稳定性和一致性。这种变异体在对群体进行分子标记检测时,表现为位点的主基因型外的等位基因型。当变异个体还未累积时,只占群体的极少部分,表现为低频率的等位基因型。低频率的等位基因型往往和技术错误混在一起,导致现有技术难以区分。本发明检测的是高多态性的mnp标记。基于多个错误同时发生的几率低于一个错误发生的几率,mnp标记的技术错误率显著低于snp标记。
[0093]
本实施例次等位基因型的真实性评估按如下进行:首先按照以下规则排除具有链偏好性(在rna双链上覆盖的测序序列数的比值)的等位基因型:链偏好性大于10倍,或者与主等位基因型的链偏好性之差大于5倍。
[0094]
不存在链偏好性的基因型基于表6测序序列数目和比例判定其真实性。表6列出了基于binom.inv函数计算在α=99.9999%的概率保障下,e
max
(n=1)和e
max
(n≥2)分别为1.03%和0.0994%时,在各个位点中次等位基因型测序序列数目的临界值,只有次等位基因型的测序序列数目超过临界值时判定为真实的次等位基因型。当存在多个候选次等位基因时,对各候选等位基因型的p值进行多重校正,fdr《0.5%的候选等位基因判定是真实的次等位基因型。
[0095]
表6涉及到的参数e
max
(n=1)和e
max
(n≥2)指的是携带n个snp的错误等位基因的测序序列数占该位点总测序序列数的最高比例。e
max
(n=1)和e
max
(n≥2)分别为1.03%和0.0994%是根据在930个纯合mnp标记检测到的所有次等位基因型的频率获得。
[0096]
表6-部分测序深度下进行判定次等位基因型的临界值
[0097][0098]
按照上述参数,将基因型存在差异的s3和s1两个毒株的核酸按照以下8个比例1/1000,3/1000,5/1000,7/1000,1/100,3/100,5/100,7/100混合,制备人工杂合样本,每个样本检测3次重复,获得共计24个测序数据。通过和所述两个毒株的mnp标记的基因型进行精准比对,在24个人工杂合样本中均检测到了存在杂合基因型的位点,说明了所开发的肺炎支原体的mnp标记检测方法在检测毒株群体内部遗传变异的适用性。
[0099]
实施例5、流行性腮腺炎病毒rna指纹数据库的构建
[0100]
利用常规ctab法、商业化试剂盒等方法提取用于构建流行性腮腺炎病毒mnp指纹数据库的所有毒株或是样本的rna,采用琼脂糖凝胶和紫外分光光度计检测rna的质量。
[0101]
将上述6个毒株的测序数据同参考基因型进行序列比对后,获得每个毒株每个mnp标记的主基因型,形成每个毒株的mnp指纹图谱。将获得的每个毒株的mnp指纹图谱录入数据库文件,形成流行性腮腺炎病毒mnp指纹数据库。
[0102]
所构建的mnp指纹数据库基于检测的毒株的基因序列,因此和所有的高通量测序数据兼容,具有完全可共建共享、随时可更新的特征。将每次检测获得的毒株的mnp指纹图
谱同基于已有基因组数据构建的mnp指纹数据库进行比对,将主基因型存在差异的毒株的mnp指纹图谱录入所构建的mnp指纹数据库,达到数据库的实时更新和共建共享。
[0103]
实施例6、在流行性腮腺炎病毒精细分型中的应用
[0104]
首先构建流行性腮腺炎病毒的参考序列库,由已经公开的流行性腮腺炎病毒的基因组序列和已构建的流行性腮腺炎病毒的指纹数据库组成;利用实施例2所述的引物组合和mnp标记位点检测方法,获得每个待测样品中流行性腮腺炎病毒的mnp指纹图谱;将每个毒株的mnp指纹图谱同构建的参考序列库进行比对;和已有毒株的基因型相同的,为已有的毒株的极近似株,在至少一个mnp标记存在主基因型差异的为新的变异株。
[0105]
本实施例对6份流行性腮腺炎病毒株的分型结果如表5所示,6份毒株可被分为2个类型,和参考序列库的菌株均存在1个以上mnp标记的主基因型差异,判定为2个新的变异株,实现对流行性腮腺炎病毒的精细分型。
[0106]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0107]
尽管已描述了本发明实施例的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明实施例范围的所有变更和修改。
[0108]
显然,本领域的技术人员可以对本发明实施例进行各种改动和变型而不脱离本发明实施例的精神和范围。这样,倘若本发明实施例的这些修改和变型属于本发明实施例权利要求及其等同技术的范围之内,则本发明实施例也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。