植物乳杆菌lp11、其发酵液及制备方法和应用
技术领域
1.本技术涉及微生物技术领域,具体涉及植物乳杆菌lp11、其发酵液及制备方法和应用。
背景技术:
2.近年来,由于在食品和饲料中使用化学添加剂的情况多来越多,给消费者带来的危害越来越大。因此,人们对不含化学防腐剂的天然新鲜食品需求越来越高。乳酸菌具有良好的安全性和抗菌活性,在食品和饲料中得到了广泛的应用,是公认的食品级安全微生物。在乳酸菌中,最大的类群是乳杆菌属,它有150多个不同的物种,其中包括一些对宿主健康有益的乳杆菌属。植物乳杆菌就是一种重要的工业微生物,其分布广泛,范围包括乳制品和发酵食品;牛粪、青贮饲料和污水等环境;以及人和动物口腔、肠道和粪便等。
3.植物乳杆菌具有重要的抗菌活性和益生菌特性,已被用于开发功能性食品和大规模生产,在以往研究中乳杆菌的抗菌物质主要是有机酸、脂肪酸、短肽等物质。据报导,乳酸菌产六种有机酸,可抑制霉菌的生长,包括乳酸、乙酸和丙酸等。后来,许多研究发现脂肪酸也具有抗菌特性,如植物乳杆菌milab14中的3-羟基脂肪酸,而副酸杆菌所产生的细菌素对丙酸杆菌有明显的抑制作用。
4.但大多数乳杆菌的活力极弱,它们只能在特定的环境中存活,一旦这些环境发生改变,其自身将会灭亡,在复杂的肠道微生物中无法长时间占据主导地位。植物乳杆菌在胃肠道系统中常常会伴随各种不利环境的胁迫,同时存在抑菌效率低、抑菌活性不稳定等问题,因此,通过体外试验,以研究植物乳杆菌在机体消化道的生存能力,以突出其益生菌潜力,发挥植物乳杆菌最大的益生效果,具有重要意义。
技术实现要素:
5.针对现有技术存在的不足,本技术提供植物乳杆菌lp11、其发酵液及制备方法和应用,其具有良好的耐胆盐、耐酸及耐人工胃肠液性能,具有独特的益生特性,且产酸速率快,产乳酸量大的特点,对etec和sa具有优异的抑制作用。
6.第一方面,本技术提供植物乳杆菌lp11,采用如下的技术方案:植物乳杆菌lp11,所述菌株为植物乳杆菌(lactobacillus plantarum,lp),命名为植物乳杆菌lp11,保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.22600,保藏时间为:2021年5月25日。
7.通过采用上述技术方案,本技术中的植物乳杆菌lp11经过纯化并通过产酸性能、耐受性和抑菌作用筛选得到,更加耐受酸性环境,有利于饲料发酵,而且对sa和etec具有拮抗抑制作用,应用于生物饲料时,可代替抗生素起到对sa和etec的抑制作用,且由于其从健康仔猪肠道内容物及粪便中分离筛选得到,来源安全,而且更加适合动物肠道特点,更加有利于饲料的制备和应用。
8.优选的,所述植物乳杆菌lp11菌落表面光滑,边缘整齐,呈乳白色,在含碳酸钙的mrs固体培养基中可看到有明显的溶钙圈,革兰氏染色后菌株呈杆状。
9.进一步地,所述植物乳杆菌lp11发酵后的上清液(2%添加量)对致病菌产肠毒素性大肠杆菌(enterotoxic escherichia coli,etec)和/或金黄色葡萄球菌(staphylococcus aureus,sa)抑菌率≥99%。
10.进一步地,所述植物乳杆菌lp11具有耐酸性,在ph2.0的条件下能够生长,存活率为112.95%。
11.进一步地,所述植物乳杆菌lp11具有耐胆盐能力,在0.5%高胆盐条件下存活率在58.94%;进一步地,所述植物乳杆菌lp11耐受人工胃肠液,经人工胃肠液处理后,存活率≥95.95%。
12.第二方面,本技术提供发酵液,由上述植物乳杆菌lp11发酵得到。
13.由上述植物乳杆菌lp11发酵得到的发酵液不仅具有良好的耐热、耐酸性能,而且耐蛋白酶类,有利于在生物饲料中应用。
14.进一步地,所述发酵液具有热稳定性,在100℃高温时,发酵液的抑菌活性没有影响。
15.进一步地,所述发酵液具有耐酸性,在ph3环境下,发酵液的抑菌活性没有影响。
16.进一步地,所述发酵液经过氧化氢酶处理,发酵液抑菌活性没有影响。
17.进一步地,所述发酵液经蛋白酶处理,发酵液仍然能够抑菌。
18.进一步地,所述蛋白酶选用胃蛋白酶。
19.进一步地,所述发酵液经胃蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于产肠毒素性大肠杆菌的抑菌率≥99%。
20.进一步地,所述发酵液经胃蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于金黄色葡萄球菌的抑菌率≥99%。
21.进一步地,所述蛋白酶选用胰蛋白酶。
22.进一步地,所述发酵液经胰蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于产肠毒素性大肠杆菌的抑菌率≥99%。
23.进一步地,所述发酵液经胰蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于金黄色葡萄球菌的抑菌率≥99%。
24.进一步地,所述蛋白酶选用木瓜蛋白酶。
25.进一步地,所述发酵液经木瓜蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于产肠毒素性大肠杆菌的抑菌率≥99%。
26.进一步地,所述发酵液经木瓜蛋白酶处理后,发酵液抑菌活性没有影响,发酵液对于金黄色葡萄球菌的抑菌率≥99%。
27.进一步地,所述蛋白酶选用蛋白酶k。
28.进一步地,所述发酵液经蛋白酶k处理后,发酵液抑菌活性没有影响,发酵液对于产肠毒素性大肠杆菌的抑菌率≥99%。
29.进一步地,所述发酵液经蛋白酶k处理后,发酵液抑菌活性没有影响,发酵液对于金黄色葡萄球菌的抑菌率≥99%。
30.第三方面,本技术提供发酵液的制备方法,采用如下的技术方案:发酵液的制备方法,其特征在于,所述发酵液由植物乳杆菌lp11通过下述步骤培养发酵得到:(1)植物乳杆菌lp11种子液制备:将植物乳杆菌lp11菌种接种于含碳酸钙的mrs固体培养基中,25-40℃静置培养18-24h,筛选溶钙圈较大的单菌落,接种于mrs液体培养基中,25-40℃振荡培养24-32h;(2)植物乳杆菌lp11发酵液制备:将活化的种子液,按体积百分比为0.5-10%接种于mrs液体培养基,振荡培养36-52h后,8000-12000rpm/min离心1-5min,取上清液,用0.22μm滤器过滤,即得。
31.进一步地,所述发酵液由植物乳杆菌lp11通过下述步骤培养发酵得到:(1)植物乳杆菌lp11种子液制备:将植物乳杆菌lp11菌种接种于含碳酸钙的mrs固体培养基中,37℃静置培养18-24h,筛选溶钙圈较大的单菌落,接种于mrs液体培养基中,37℃振荡培养24-32h;(2)植物乳杆菌lp11发酵液制备:将活化的种子液,按体积百分比为2%接种于mrs液体培养基,振荡培养48h后,10000rpm/min离心2min,取上清液,用0.22μm滤器过滤,即得。
32.本技术中对由植物乳杆菌lp11发酵得到的发酵液离心后的上清液,经过高温、蛋白酶处理后的抑菌性进行探究,由探究结果可知,上清液经过上述环境处理后,对抑菌性能没有影响,说明得到的上清液性能稳定,上清液中可能存在发挥抑菌作用的抑菌物质,且上清液中含有的抑菌物质耐高温、耐强酸以及耐蛋白酶,更具体的说,温度和蛋白酶类对上清液中的抑菌物质的活性没有影响,在100℃高温处理后,其活性基本可以完全保留,经过胃蛋白酶和胰蛋白酶处理后,抑菌活性不发生改变,更加有利于其应用于生物饲料中。自然地,抑菌物质存在于发酵液离心后得到的上清液中,自然也存在于活化的种子液接种于mrs液体培养基培养发酵后得到的原始发酵液,因此,本技术中由植物乳杆菌lp11发酵得到的发酵液可以是指种子液接种于mrs液体培养基培养发酵后得到的原始发酵液,也可以是原始发酵液离心后得到的上清液。且本技术的发酵液的制备方法简单,易于实现产业化。
33.第四方面,本技术提供生物制剂,采用如下的技术方案:生物制剂,包括上述的植物乳杆菌lp11,和/或上述的发酵液,和/或通过上述发酵液的制备方法制得的发酵液。
34.通过采用上述技术方案,该生物制剂具有优异的稳定性,耐热、耐酸且耐蛋白酶类,不会被蛋白酶类水解,对于etec和sa具有优异的抑制作用。
35.第五方面,本技术提供一种植物乳杆菌lp11在生物制剂中的应用。
36.第六方面,本技术提供一种发酵液在生物制剂中的应用。
37.第七方面,本技术提供一种发酵液的制备方法所制备的发酵液在生物制剂中的应用。
38.本技术的植物乳杆菌lp11和/或发酵液应用于生物饲料中,具有优异的稳定性,耐热、耐酸且耐蛋白酶类,其发酵产生的抑菌物质还对etec和sa具有优异的抑制作用,代替抗生素应用于生物制剂中,特别是应用于预防仔猪感染肠毒素性大肠杆菌方面。
39.综上所述,本技术具有以下有益效果:1、本技术中得到的植物乳杆菌lp11具有优异的耐酸、耐胆盐性能,在强酸条件下,存活率达112.95%以上,而且产酸速率快,产乳酸量高,发酵4h即开始产酸,14h发酵液ph到
达3.5以下,24h乳酸含量达147mmol/l。发酵后的上清液对致病菌产肠毒素性大肠杆菌(enterotoxic escherichia coli,etec)和/或金黄色葡萄球菌(staphylococcus aureus,sa)抑菌率≥99%。作为抗生素替代物应用于生物制剂,尤其是生物饲料中具有极大的意义,尤其是预防仔猪感染产肠毒素性大肠杆菌方面的作用极强,具有很高的经济意义。
40.2、本技术中得到的植物乳杆菌lp11从健康仔猪肠道内容物中分离筛选得到,来源安全,而且更加适合动物肠道特点,具有独特的益生特性和安全性。
41.3、本技术中通过植物乳杆菌lp11发酵得到的发酵液性质稳定,温度和蛋白酶类对其活性没有影响,在100℃高温下,其活性基本可以完全保留,更有利于生物饲料中的应用。
附图说明
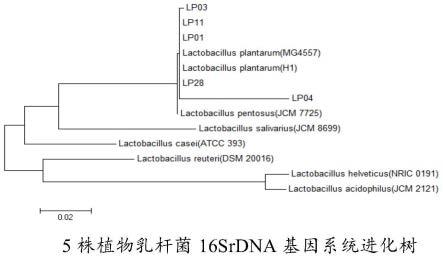
42.图1是本技术中5株植物乳杆菌16srdna基因系统进化树;图2是本技术中5株植物乳杆菌菌株的生长曲线及产酸速度的变化;图3是本技术中植物乳杆菌lp11的生长曲线及发酵过程中抑菌活性的变化。
具体实施方式
43.以下结合附图和实施例对本技术作进一步详细说明,予以特别说明的是:以下实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行,以下实施例中所用仪器、材料、试剂等,如无特殊说明,均可通过商业途径获得。
44.本技术提供了一种植物乳杆菌lp11,从健康仔猪肠道内容物及粪便中分离筛选得到,经16s rdna鉴定该菌株为植物乳杆菌(lactobacillus plantarum),命名为植物乳杆菌lp11,保藏于中国普通微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.22600,保藏时间为:2021年5月25日。
45.本技术还提供了由上述保藏编号为cgmcc no.22600的植物乳杆菌lp11发酵制得的发酵液,具体通过下述步骤培养发酵得到:(1)植物乳杆菌lp11种子液制备:将植物乳杆菌lp11菌种接种于含碳酸钙的mrs固体培养基中,25-40℃(如25-28℃、25-35℃、28-35℃、28-40℃、35-40℃、25℃、28℃、35℃、40℃)静置培养18-24h(如18-20h、18-22h、20-22h、20-24h、22-24h、18h、20h、22h、24h),筛选溶钙圈较大的单菌落,接种于mrs液体培养基中,25-40℃(如25-28℃、25-35℃、28-35℃、28-40℃、35-40℃、25℃、28℃、35℃、40℃)振荡培养24-32h(如24-28h、24-30h、28-30h、28-32h、30-32h、24h、28h、30h、32h);(2)植物乳杆菌lp11发酵液制备:将活化的种子液,按体积百分比为0.5-10%(如0.5-2%、0.5-5%、2-5%、2-10%、5-10%、0.5%、2%、5%、10%)接种于mrs液体培养基,振荡培养36-52h(如36-42h、36-48h、42-48h、42-52h、48-52h、36h、42h、48h、52h)后,8000-12000rpm/min(如8000-10000rpm/min、10000-12000rpm/min、8000rpm/min、10000rpm/min、12000rpm/min)离心1-5min(如1-3min、3-5min、1min、3min、5min),取上清液,用0.22μm滤器过滤,即得含抑菌物质的发酵液。
46.以下实施例中涉及到的培养基以及原料来源如下:mrs固体培养基:蛋白胨10.0g/l、牛肉粉5.0g/l、酵母粉4.0g/l、葡萄糖20.0g/l、
硫酸镁0.2g/l、醋酸钠5.0g/l、柠檬酸三铵2.0g/l、磷酸氢二钾2.0g/l、硫酸锰0.05g/l、吐温80 1.0g/l和琼脂15.0g/l,ph6.2
±
0.2;mrs肉汤培养基:蛋白胨10.0g/l、牛肉粉10.0g/l、酵母粉5.0g/l、葡萄糖20.0g/l、硫酸镁0.1g/l、醋酸钠5.0g/l、柠檬酸铵2.0g/l、磷酸氢二钾2.0g/l、硫酸锰0.05g/l和吐温80 1.0g/l,ph6.2
±
0.2;耐酸mrs肉汤培养基:蛋白胨10.0g/l、牛肉粉10.0g/l、酵母粉5.0g/l、葡萄糖20.0g/l、硫酸镁0.1g/l、醋酸钠5.0g/l、柠檬酸铵2.0g/l、磷酸氢二钾2.0g/l、硫酸锰0.05g/l和吐温80 1.0g/l,ph2.0/3.0;耐胆盐mrs肉汤培养基:蛋白胨10.0g/l、牛肉粉10.0g/l、酵母粉5.0g/l、葡萄糖20.0g/l、硫酸镁0.1g/l、醋酸钠5.0g/l、柠檬酸铵2.0g/l、磷酸氢二钾2.0g/l、硫酸锰0.05g/l和吐温80 1.0g/l,猪胆盐3/5g。
47.以下实施例中涉及的指示菌产肠毒素性大肠杆菌(型号为atcc35401)和金黄色葡萄球菌(型号为atcc29213)来源于普通市售;以下实施例中涉及的人工胃肠液购于北京雷根生物技术有限公司;以下实施例中涉及的乳酸(ld)测试盒购于南京建成生物工程研究所;以下实施例中涉及的过氧化氢酶、胃蛋白酶、胰蛋白酶、蛋白酶k购于上海源叶生物科技有限公司;以下实施例中涉及的碳酸钙购于国药集团化学试剂有限公司;以下实施例中涉及的仔猪肠道内容物及新鲜粪便采于法库康达生态农业有限公司;以下实施例中所指的菌株活化是指:将菌株由保存管中划线入固体培养基平板,并长出单菌落的过程。实施例
48.实施例1植物乳杆菌lp11菌株的分离筛选如下:(1)富集:取5g样品与100ml mrs肉汤培养基中富集,37℃培养36-48h。
49.(2)分离:取1ml富集的菌液置于10ml mrs肉汤培养基(ph3.0)中,37℃培养12h后,取1ml置于10ml 0.2%胆盐mrs肉汤培养基中,37℃培养12h,稀释后涂caco3mrs平板,挑选溶钙圈大,生长快的菌落进行划线分离。
50.目标菌株的生物学鉴定:将分离菌株接种于mrs肉汤培养基中,用37℃培养18-24h,进行形态学鉴定。根据《伯杰氏细菌鉴定手册》对筛选的菌株,用乳酸杆菌生化鉴定套盒进行生理生化鉴定及16s rdna分子生物学鉴定,由华大基因科技有限公司进行菌种鉴定。将测序的结果在美国国家生物信息中心(ncbi)数据库中进行blast分析,采用mega 5.0软件构建系统发育树。
51.从健康的仔猪肠道和新鲜粪便中共筛选出12株有溶钙圈的菌落,形态学鉴定表明,有9株是革兰氏阳性杆菌。根据《伯杰氏细菌鉴定手册》对菌株进行生理生化试验鉴定,有5株符合植物乳杆菌生理生化特性,如表1。将5株菌株用16s rdna序列扩增测序,序列用genbank的blast进行比对。图1结果表明,这5株菌株均属植物乳杆菌属,与植物乳杆菌(lactobacillus plantarum,lp)有99%的相似性。分别命名为植物乳杆菌01(lp01),植物
乳杆菌03(lp03),植物乳杆菌04(lp04),植物乳杆菌11(lp11),植物乳杆菌28(lp28)。
52.表1 5株植物乳杆菌分离菌生化鉴定结果注:“ ”90%菌株阳性;
“‑”
90%菌株阴性;“d”11%-89%菌株阳性。
53.实施例2植物乳杆菌lp11菌株的益生特性分析:(1)耐酸试验:根据maragkoudakis等人所描述的方法,将供试菌株接种于mrs肉汤培养基中,活化培养24-36h,10000rpm离心10min,收集菌体。用无菌pbs(ph-7.4)洗涤两次,获得菌体。将菌体用ph为1.0和2.0的mrs肉汤培养基进行重悬,37℃培养,使用平板计数法在培养0h、4h活菌计数,计算存活率。
54.存活率(%)=(4h的活菌数/0h的活菌数)
×
100表2数据表明,5株菌株在ph-2下4小时具有良好的生存能力,其中lp11在ph-2的酸性条件下生存能力最强,4h后仍保持在正常生长状态,活菌数提高12.95%。
55.表2 5株植物乳杆菌耐酸试验结果菌株编号lp01lp03lp04lp11lp28存活率ph-10.51%1.08%1.02%1.76%0.45%存活率ph-297.15%82.81%82.02%112.95%81.03%(2)耐胆汁的试验:将培养好的菌液用pbs重悬,菌株按2%(108cfu/ml)接种到含0.4%和0.5%胆汁的mrs肉汤培养基中,37℃培养5小时后,通过平板法记录5h前后活菌数,计算存活率。
56.如表3所示,在0.4%胆汁中,5株植物乳杆菌生长良好,这表明这些菌株对胆汁的具有一定的耐受性。lp11表现出较高的耐受性,在0.5%胆汁中,存活率可达58.94%,明显高于其他4株植物乳杆菌。
57.表3 5株植物乳杆菌耐胆汁试验结果菌株编号lp01lp03lp04lp11lp280.4%胆盐存活率66.54%58.09%57.74%79.06%60.81%0.5%胆盐存活率31.76%26.17%0.03%58.94%28.05%(3)耐人工胃肠液试验:离心、冲洗获得菌体,用等体积的人工动物胃液重悬菌体,模拟胃液的消化作用,37℃80rpm培养4h后,把人工胃液离心,获取消化处理过后的菌体,随后用相同体积的人工动物肠液重悬,培养条件同胃液,过夜培养12h,取样计活菌数,计算存活率。
58.胃肠道中的恶劣环境不仅是ph和胆盐等因素造成的,胃肠液中各种消化酶,如胃蛋白酶、胰蛋白酶等,都对微生物有较强的抑制和致死作用。在体外模拟胃肠道实验,研究植物乳杆菌的生存能力。如表4所示,植物乳杆菌在胃液培养4h及肠液过夜处理后,活菌数
虽有不同程度的下降,但各菌株对胃肠道的耐受能力很强,在胃肠道内能够一直保持较高的菌浓度,都在109cfu/m以上,可以在肠道内发挥作用。
59.表4 5株植物乳杆菌耐人工胃肠液试验结果实施例3植物乳杆菌的产酸速度和产酸能力测定分析将菌株按2%的接种量接种于200ml无菌mrs肉汤培养基中,37℃培养,分别在0、4、8、12、16、20、24、28、32、36、40、44、48h处取样,测od600值,并记录个时间段的ph值,24h测定乳酸浓度,每株菌做3个重复。乳酸的浓度用乳酸(ld)测试盒测定。
60.由图2可见,5株植物乳杆菌生长速度和产酸无明显差异,从2-4h进入对数生长期,16-20h后开始趋于平稳生长。发酵液在初始阶段(0~2小时)ph没有明显变化,从4h开始降低,14h发酵液ph达到3.5左右。由表5可知,lp11的产乳酸能力最高,培养24h乳酸含量可达147.18mmol/l。
61.表5 5株植物乳杆菌乳酸含量实施例4植物乳杆菌lp11菌株的抑菌实验(1)抑菌圈检测将本技术的植物乳杆菌lp11菌株采用牛津杯平板法测定对于产肠毒素性大肠杆菌和金黄色葡萄球菌的抑菌圈直径,分别做3组平行试验,分别计算抑菌圈直径平均值。
62.用牛津杯方法测定5种植物乳杆菌的抗菌能力,结果表明,5株植物乳杆菌对指示菌均具有良好的抗菌活性。由表6所示,根据各菌株对大肠杆菌和金黄色葡萄球菌的抑菌作用,lp-11具有最高的抗菌活性,抑菌圈直径分别为18.88mm和19.57mm。因此,选择此菌进行下一步试验。
63.表6植物乳杆菌抑菌实验菌株编号大肠杆菌金黄色葡萄球菌lp0118.18
±
0.2318.93
±
0.26lp0316.61
±
0.2818.75
±
0.09lp0416.93
±
0.2218.07
±
0.36lp1118.88
±
0.3319.57
±
0.27
lp2816.32
±
0.2518.08
±
0.31(2)不同发酵时间上清液的抑菌活性研究植物乳杆菌lp11菌株按照2%的接种量转接100ml的mrs肉汤培养基中,37℃、200r/min培养48h,分别在0、4、8、12、16、20、24、32、40、48h,每4h取一次样,取发酵液,测定其od600值;用牛津杯法测定发酵上清液在每个时间段对指示菌的抑菌活性。
64.由图3可见,植物乳杆菌lp11从2h进入对数生长期,16-20h后开始趋于平稳生长。发酵上清液在初始阶段(0~4小时)没有明显的抑菌活性,从8h开始明显改善,抑菌活性随着时间增加逐渐增强。到20h抑菌活性趋于稳定,对大肠杆菌和金黄色葡萄球菌指示菌抑菌圈直径分别达到18.73mm和19.32mm。同时,从图3可直观的看出表明发酵上清液的抗菌作用与细菌的生长情况呈正相关。
65.(3)抑菌率检测本技术中还通过吸光度来测定发酵上清液的抑菌性,这一方法比传统的测量抑菌圈方法更为直观、准确,且操作鉴定,出结果快,可在细菌实验广泛应用,检测方法如下:1、植物乳杆菌lp11种子液制备:将植物乳杆菌lp11菌株接种于含碳酸钙的mrs固体培养基中,37℃静置培养18-24h,挑取溶钙圈较大的单菌落,接种于mrs肉汤培养基中,37℃振荡培养24-32h;2、植物乳杆菌lp11发酵液制备:将得到的植物乳杆菌lp11种子液按体积百分比2%接种于mrs肉汤培养基中,37℃下摇床培养48h,将细菌培养液10000r/min离心2min,取上清液,用0.22μm滤器过滤,备用,得到发酵上清液。
66.3、指示菌浓度的调整:取指示菌菌液加入lb液体培养基中(一般情况1ml菌液加到100ml lb液体培养基中),测定600nm处吸光度,使其吸光度约为od600=0.05。
67.4、抑菌性测定:将细菌的发酵上清液以体积分数为2%与10ml的lb液体培养基(已加入指示菌)混合,做3个平行组;同时设立空白对照a
空
(不加细菌发酵上清液),37℃摇床200r/min培养12h,利用分光光度计测波长600nm时各样品的od值,记录读数(用无菌lb培养基调零)。
68.抑菌率(%)=[(a
空-a
空0
)-(a
样-a
样0
)/(a
空-a
空0
)]
×
100%。
[0069]
根据od600进行抑菌活性分析,由于发酵上清液有一定的基底颜色,因此将发酵上清液与lb培养基(含指示菌)混合液0h为初始的od600,即a
样0
;培养12h后混合液od600作为指示菌增长值,即a
样
。空白对照组0h的初始od600,即a
空0
;培养12h后混合液od600作为对照组指示菌增长值,即a
空
。
[0070]
表7 lp11发酵上清液抑菌率/%菌株编号抑产肠毒素性大肠杆菌率抑金黄色葡萄球菌率lp1199.99
±
0.0499.99
±
0.05由上可知,植物乳杆菌的上清液对etec和sa均表现出很高的抑制作用,综合耐酸、耐胆盐及耐热等试验可知,lp11具备益生菌的潜在应用价值。
[0071]
实施例5侧孢短芽孢杆菌bl11的发酵液抑菌稳定性试验(1)过氧化氢抑菌作用的消除:在发酵上清液中加入1.5mg/m l的过氧化氢酶,对照组不用过氧化氢酶处理,在37℃水浴作用2h,排除发酵液中过氧化氢的作用,用etec和sa
作为指示菌,lp11的发酵上清液以体积分数为2%与10ml的lb液体培养基(已加入指示菌)混合,做三个平行组,进行抑菌能力的测定。具体方法参照上述植物乳杆菌lp11菌株的抑菌实验中抑菌试验的抑菌率检测。
[0072]
(2)温度对发酵上清液抑菌性能的影响:将植物乳杆菌lp11发酵液制备中制备好的无菌上清液分别置于65℃、85℃、100℃条件下水浴20min,用未经过高温处理的无菌上清液作为空白对照,用etec和sa作为指示菌,lp11的发酵上清液以体积分数为2%与10ml的lb液体培养基(已加入指示菌)混合,做三个平行组,进行抑菌能力的测定。具体方法参照上述植物乳杆菌lp11菌株的抑菌实验中抑菌试验的抑菌率检测。
[0073]
(3)蛋白酶对发酵上清液抑菌性能的影响:将植物乳杆菌lp11发酵液制备中制备好的无菌上清液分别用胃蛋白酶(反应条件37℃、ph3)、胰蛋白酶(反应条件37℃、ph8)、蛋白酶k(反应条件37℃、ph8)、木瓜蛋白酶(反应条件50-60℃、ph6-7)处理2h,酶浓度均为3mg/ml,处理完毕后将无菌上清液调回至最初的ph值,以未加酶并且进行相同处理的无菌上清液作为空白对照组,用上述同种病原菌作为指示菌,lp11无菌上清液以体积分数为2%与10ml的lb液体培养基(已加入指示菌)混合,做三个平行组,测定抑菌能力。具体方法上述植物乳杆菌lp11菌株的抑菌实验中抑菌试验的抑菌率检测。
[0074]
(4)ph对抑菌物质的影响:在发酵上清液中起到抑菌作用的可能是细菌素,或是有机酸等物质。为排除酸性物质的干扰,用2mol/l的naoh将发酵上清液调至ph7.0,37℃恒温水浴3h,测试其抑菌活性。
[0075]
表8不同条件处理下lp11的抑菌率(%) 大肠杆菌金黄色葡萄球菌未处理99.08
±
0.2399.93
±
0.22过氧化物酶99.82
±
0.2999.53
±
0.28ph3.099.34
±
0.6499.88
±
0.84ph7.0
‑‑
65℃20min99.92
±
0.2699.73
±
0.2285℃20min99.54
±
0.3399.79
±
0.16100℃20min99.43
±
0.1599.67
±
0.37胃蛋白酶99.62
±
0.4699.54
±
0.75胰蛋白酶99.94
±
0.6399.39
±
0.43蛋白酶k99.81
±
0.3299.87
±
0.31木瓜蛋白酶99.75
±
0.2699.88
±
0.35lp11菌株发酵上清液用不同条件处理,大肠杆菌和金黄色葡萄球菌作为指示菌株,测定了ph、温度和蛋白酶对lp11发酵上清液抑菌活性的影响,其抑菌效果如表8所示。结果表明,在100℃处理20min后,发酵上清液抑菌活性无显著变化,说明抑菌物质具有非常好的耐热性;当发酵液ph7.0时,抑菌活性彻底丧失,表明抑菌物质只有在酸性条件下才有良好的抑菌作用,应该是有机酸类物质,上面已表明,该菌株lp11乳酸含量可达147.18mmol/l;另外,考虑到若是植物乳杆菌lp11发酵过程中可能产生过氧化氢,也会起到抑菌的作用,对上清液经过过氧化氢酶处理后的抑菌率进行探究,探究发现,加入过氧化氢酶后,对于etec和sa的抑菌率没有影响,说明发酵过程中没有产生过氧化氢;同时,用胃蛋白酶,胰蛋
白酶,蛋白酶k和木瓜蛋白酶处理的发酵上清液与对照组相比没有出现明显差异(p》0.05),对发酵上清液抑菌活性没有影响。
[0076]
综上,可以看出,本技术中得到的植物乳杆菌lp11耐酸、耐盐胆、耐人工胃肠液,产酸速度快产酸量高,而且对于etec和sa具有很好的抑制作用,抑菌率达99%以上;lp11在0.5%胆盐条件下依然有50%以上的存活率,在ph2.0的条件下能够生长繁殖,且经人工胃肠液处理后,存活率≥99%;由植物乳杆菌lp11发酵得到的发酵液性质稳定,温度和蛋白酶类对其活性没有影响,发酵液在100℃高温处理后,对etec和sa的抑菌率≥99%;经过蛋白酶处理后,抑菌活性仍然没有影响,对etec和sa的抑菌率≥99%。
[0077]
此外,本技术中得到的植物乳杆菌lp11自健康仔猪肠道内容物及粪便中分离筛选得到,来源安全,而且更加适合动物肠道特点,具有独特的益生特性和安全性,作为抗生素替代物应用于生物制剂,尤其是生物饲料中具有极大的意义,对于预防仔猪感染产肠毒素性大肠杆菌方面的作用极强,具有很高的经济意义;同时,lp11产酸速度快,产酸量高,更有利于饲料的发酵,减低发酵时间,提高发酵效率,降低成本。将本技术中得到的植物乳杆菌lp11应用于生物制剂(如饲料)的时候,可以是将其制作菌株干粉直接添加于生物制剂中,也可以是将植物乳杆菌lp11按照本技术中提供的发酵方法发酵后得到的发酵液加入生物制剂中应用,当然也可以是两者结合应用。
[0078]
可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
