1.本发明属于有机化合物合成与医药应用技术领域,具体涉及一种川芎嗪衍生物、制备方法及其在抗流感药物领域的应用。
背景技术:
2.流感作为世界范围的流行性传染疾病,每年可造成全球范围内数百万人的感染,并导致约50万人的死亡。其病原体流感病毒根据其核蛋白和基质蛋白抗原决定簇的不同可分为甲型、乙型、丙型、丁型,其中甲型流感病毒造成的感染是流感发病及死亡的主要原因,因此对甲型流感病毒的研究具有重要意义。甲型流感病毒是由8个可编码蛋白质的rna序列和脂质双分子层构成的,这8个基因组片段可编码的病毒蛋白有碱性聚合酶2(pb2)、碱性聚合酶1(pb1)、酸性内切酶(pa)、血凝素(ha)、核蛋白(np)、神经氨酸酶(na)以及非结构蛋白(ns)。其中核蛋白是流感病毒中十分重要的功能蛋白,贯穿病毒基因组复制的整个过程,是目前抗流感药物研发的一个热门靶点。
3.近年来不少研究发现,许多天然产物具有不同程度的抗流感作用,因此天然来源的单体化合物是抗流感药物研发的重要来源。川芎是伞形科植物川芎的根茎经风干制成的一种中药。其性温,味辛,具有行气开郁、桂风燥湿等功效。川芎嗪即2,3,5,6-四甲基哌嗪(tetramethylpyrazine,tmp)是川芎的一种主要活性成分,己被当作治疗脑血栓、冠心病和心绞痛的临床药物,并且对动脉粥样硬化和氧化损伤有明显的治疗作用,此外,它还具有一定的抗炎症作用(包括病毒感染诱导的炎症)。
4.将具有生物活性的天然产物提取物进行化学改造和修饰,是获取抗病毒药物的有效方法。鉴于川芎嗪广泛的生物活性,同时为发现具有全新作用机制的新一代抗流感抑制剂,本发明公开了一类具有较强抗流感活性的川芎嗪衍生物,现有技术中未见相关报道。
技术实现要素:
5.本发明提供了一种川芎嗪查尔酮衍生物及其制备方法,本发明还提供了上述化合物的部分活性筛选结果及其用途。本发明的技术方案如下:
6.一、川芎嗪查尔酮衍生物
7.本发明的川芎嗪查尔酮衍生物,或其药学上可接受的盐或酯,具有如下通式i所示的结构:
[0008][0009]
其中,
[0010]
r为c
3-c6环烷基、取代苯环、取代萘环、各种取代的六元杂环、各种取代的五元杂环,所述的取代基选自卤素、烷基、硝基、烷氧基、羟基。
[0011]
根据本发明优选的,
[0012]
r为卤素、甲基、硝基、甲氧基、羟基取代的苯环。
[0013]
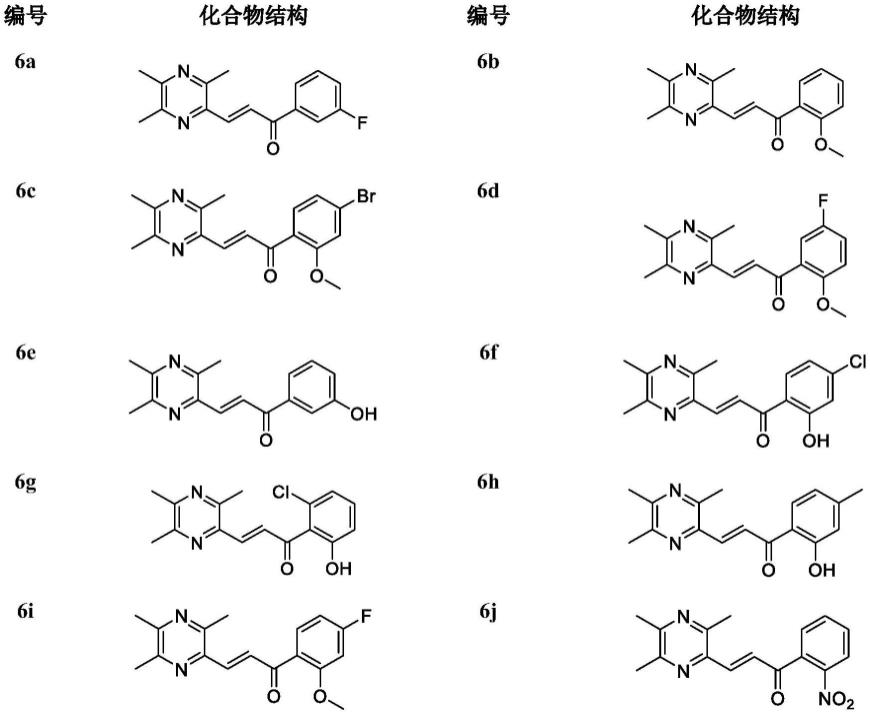
根据本发明进一步优选的,川芎嗪衍生物,是下表中化合物之一:
[0014]
[0015][0016]
二、川芎嗪查尔酮衍生物的制备方法
[0017]
川芎嗪查尔酮衍生物的制备方法,步骤如下:以四甲基吡嗪a作为起始原料,经过单氮氧化得到中间体b,b与乙酸酐进行重排反应得中间体c,再经水解获得中间体d,中间体d通过二氧化锰氧化,得到中间体e,最后与含不同取代基的苯乙酮经claisen-schmidt反应,最终得到通式i目标化合物;
[0018]
合成路线如下:
[0019][0020]
反应试剂与反应条件:i)30%v:v过氧化氢,冰醋酸,94℃,2h;ii)乙酸酐,150℃,2h;iii)20%v:v氢氧化钠,室温,12h;iv)二氧化锰,乙醇,75℃,4h;v)20%v:v氢氧化钠,取代苯乙酮,0℃,2h。
[0021]
其中,r同上述通式i所述;
[0022]
所述的取代基为卤素取代的苯乙酮、甲基取代的苯乙酮、甲氧基取代的苯乙酮、硝基取代的苯乙酮、羟基取代的苯乙酮,其中取代基位于苯环上的化学上可取代位点。
[0023]
本发明所述的室温为20-30℃。
[0024]
本发明川芎嗪查尔酮衍生物的制备方法,具体步骤如下:
[0025]
(1)称取四甲基吡嗪a(6.80g,50mmol),置于圆底烧瓶中,加入30ml冰醋酸溶解,再加入30%过氧化氢溶液(11.25ml,100mmol),于90℃回流反应2h后再加入等量过氧化氢,回流反应至完全;将反应液倒入烧杯中,冷却至室温,加入氢氧化钠溶液将ph调至10,用二氯甲烷萃取3次后合并有机相,用无水硫酸钠干燥过夜,过滤二氯甲烷溶液,用旋转蒸发仪蒸干,得到白色固体化合物b粗品。
[0026]
(2)取7.61g(50mmol)川芎嗪单氮氧化物倒入圆底烧瓶中,加入乙酸酐(30ml),加热回流2h,薄层层析监测反应完全后,减压蒸除溶剂,得深褐色油状物c。
[0027]
(3)上述中间体c用氢氧化钠溶液将ph调至14,于20℃下搅拌过夜,硅藻土过滤后,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥过夜,过滤,滤液蒸干得到淡黄色固体,柱层析分离(乙酸乙酯:石油醚=1:3v:v),得淡黄色针状结晶,即为d纯品;
[0028]
(4)将化合物d(3.04g,20mmol)置于圆底烧瓶,溶解于50ml无水乙醇,再加入二氧化锰粉末(3.48g,40mmol),于75℃下回流4h,经硅藻土过滤后拌样,柱层析分离(乙酸乙酯:石油醚=1:10v:v),得淡黄色固体e。
[0029]
(5)将化合物e(0.15g,1mmol)置于圆底烧瓶中,加入10ml无水乙醇溶解,冰浴搅拌下加入各种取代的苯乙酮(1mmol),继续搅拌5min,缓慢滴加20%的氢氧化钠溶液2.0ml,继续反应30-120min,薄层层析监测反应完全后,用1m稀盐酸将ph调至5,加入50ml水溶析,减压过滤,干燥滤饼,经柱层析分离(乙酸乙酯:石油醚=1:3v:v),甲醇-水体系重结晶,得到通式i目标化合物。
[0030]
三、川芎嗪查尔酮衍生物的应用
[0031]
活性测试结果表明,上述结构新颖的川芎嗪查尔酮衍生物是流感病毒核蛋白抑制剂,可以通过抑制np的合成和核输出来发挥作用,部分化合物在细胞水平表现出显著的抗流感病毒活性,其中化合物6s活性最优,对多个甲型和乙型流感毒株的抑制活性与上市药物奥司他韦相当,且对奥司他韦耐药毒株的活性明显优于奥司他韦。
[0032]
综上,该类化合物作为新靶标新机制的抗流感化合物,具有进一步研究的价值。
[0033]
因此,本发明所提供的川芎嗪查尔酮衍生物可作为核蛋白抑制剂用于制备抗流感药物。
[0034]
一种抗流感的药物组合物,含有上述的川芎嗪查尔酮衍生物及其药学上可接受的盐与药用辅料,制成不同剂型的药物。
附图说明
[0035]
图1是化合物6s的免疫荧光机制图(6h)。
具体实施方式
[0036]
通过下述实例有助于理解本发明,但是不能限制本发明的内容。
[0037]
实例中所涉及的合成路线如下:
[0038][0039]
反应试剂与反应条件:i)30%v:v过氧化氢,冰醋酸,94℃,2h;ii)乙酸酐,150℃,2h;iii)20%v:v氢氧化钠,室温,12h;iv)二氧化锰,乙醇,75℃,4h;v)20%v:v氢氧化钠,取代苯乙酮,0℃,2h。
[0040]
实施例1:(e)-1-(3-氟苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6a)的制备
[0041][0042]
称取四甲基吡嗪1(6.80g,50mmol),置于圆底烧瓶中,加入30ml冰醋酸溶解,再加入30%过氧化氢溶液(11.25ml,100mmol),于90℃回流反应2h后再加入等量过氧化氢,回流反应至完全;将反应液倒入烧杯中,冷却至室温,加入氢氧化钠溶液将ph调至10,用二氯甲烷萃取3次,合并有机层,用无水硫酸钠干燥过夜,过滤二氯甲烷溶液,用旋转蒸发仪蒸干,得到白色固体化合物2粗品。取7.61g(50mmol)川芎嗪单氮氧化物倒入圆底烧瓶中,加入乙酸酐(30ml),加热回流2h,薄层层析监测至反应完全后,减压蒸除溶剂,得深褐色油状物3;上述中间体3用氢氧化钠溶液将ph调至14,于20℃下搅拌过夜,硅藻土过滤后,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥过夜,过滤,滤液蒸干得到淡黄色固体,柱层析分离(乙酸乙酯:石油醚=1:3),得淡黄色针状结晶,即为4纯品;将化合物4(3.04g,20mmol)置于圆底烧瓶,溶解于50ml无水乙醇,再加入二氧化锰粉末(3.48g,40mmol),于75℃下回流4h,经硅藻土过滤拌样,柱层析分离(乙酸乙酯:石油醚=1:10),得淡黄色固体5;将化合物5(0.15g,1mmol)置于圆底烧瓶中,加入10ml无水乙醇溶解,冰浴搅拌下加入3-氟苯乙酮(0.14g,1mmol),继续搅拌5min,缓慢滴加20%的氢氧化钠溶液2.0ml,继续反应30-120min,薄层层析监测反应完全后,用1m稀盐酸将ph调至5,加入50ml水溶析,减压过滤,干燥滤饼,经柱层析分离(乙酸乙酯:石油醚=1:3),甲醇-水体系重结晶,得到目标化合物6a。
[0043]
淡黄色针状结晶,总收率33%,mp:141~144℃。
[0044]
波谱数据:1h nmr(400mhz,dmso-d6)δ8.04(d,j=15.0hz,1h,-ch=ch-),7.92(d,j=7.8hz,1h,ar-h),7.87(s,j=15.0hz,1h,-ch=ch-),7.79(dt,j=9.8,2.1hz,1h,ar-h),7.64(dd,j=7.9,5.8hz,1h,ar-h),7.55(dt,j=8.4,4.2hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 271.3[m h]
,c
16h15
fn2o(270.3).
[0045]
实施例2:(e)-1-(2-甲氧基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6b)的制备
[0046][0047]
化合物6b的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-甲氧基苯乙酮制备6b。
[0048]
白黄色粉末,总收率30%,mp:120~124℃。
[0049]
波谱数据:1h nmr(400mhz,dmso-d6)δ7.94(d,j=15.1hz,1h,-ch=ch-),7.84(d,j=15.1hz,1h,-ch=ch-),7.56(d,j=8.2hz,1h,ar-h),7.19(d,j=8.2hz,1h,ar-h),7.16(s,2h,ar-h),3.93(s,3h,o-ch3),2.63(s,3h,-ch3),2.53(s,3h,-ch3),ms:m/z 283.3[m h]
,c
17h18
n2o2(282.3).
[0050]
实施例3:(e)-1-(4-溴-2-甲氧基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6c)的制备
[0051][0052]
化合物6c的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为4-溴-2-甲氧基苯乙酮制备6c。
[0053]
淡黄色粉末,总收率30%,mp:100~104℃。
[0054]
波谱数据:1h nmr(400mhz,dmso-d6)δ7.94(d,j=15.1hz,1h,-ch=ch-),7.84(d,j=15.1hz,1h,-ch=ch-),7.56(d,j=8.2hz,1h,ar-h),7.19(d,j=8.2hz,1h,ar-h),7.16(s,1h,ar-h),3.93(s,3h,o-ch3),2.63(s,3h,-ch3),2.53(s,3h,-ch3),ms:m/z 363.2[m h]
,c
17h17
brn2o2(362.2).
[0055]
实施例4:(e)-1-(5-氟-2-甲氧基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6d)的制备
[0056][0057]
化合物6d的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为5-氟-2-甲氧基苯乙酮制备6d。
[0058]
淡黄色粉末,总收率30%,mp:135~139℃。
[0059]
波谱数据:1h nmr(400mhz,ccl3d)δ7.97(d,j=15.1hz,1h,-ch=ch-),7.85(d,j=15.1hz,1h,-ch=ch-),7.39(dd,j=8.6,3.2hz,1h,ar-h),7.18(ddd,j=9.2,7.6,3.2hz,1h,ar-h),6.96(dd,j=9.1,4.0hz,1h,ar-h),3.91(s,3h,o-ch3),2.63(s,3h,-ch3),2.54(s,6h,-ch3),ms:m/z 301.4[m h]
,c
17h17
fn2o2(300.4).
[0060]
实施例5:(e)-1-(3-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6e)的制备
[0061][0062]
化合物6e的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为3-羟基苯乙酮制备6e。
[0063]
白粉末状固体,总收率36%,mp:132~136℃。
[0064]
波谱数据:1h nmr(400mhz,dmso-d6)δ11.57(s,1h,-oh),8.10(d,j=15.0hz,1h,-ch=ch-),7.87(d,j=2.6hz,1h,ar-h),7.84(s,j=15.0hz,1h,-ch=ch-),7.64(dd,j=8.8,2.6hz,1h,ar-h),6.99(d,j=8.8hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 269.2[m h]
,c
16h15
n2o2(268.3).
[0065]
实施例6:(e)-1-(4-氯-2-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6f)的制备
[0066][0067]
化合物6f的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为4-氯-2-羟基苯乙酮制备6f。
[0068]
黄色粉末状固体,总收率35%,mp:165~166℃。
[0069]
波谱数据:1h nmr(400mhz,dmso-d6)δ10.40(s,1h,-oh),7.50(d,j=15.4hz,1h,-ch=ch-),7.31(s,j=4.6hz,1h,-ch=ch-),7.28(d,j=2.7hz,1h,ar-h),6.99(d,j=8.0hz,1h,ar-h),6.93(d,j=8.2hz,1h,ar-h),2.51(s,3h,-ch3),2.47(t,j=5.2hz,6h,-ch3),ms:m/z 303.4[m h]
,c
16h15
cln2o2(302.7).
[0070]
实施例7:(e)-1-(2-氯-6-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6g)的制备
[0071][0072]
化合物6g的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-氯-6-羟基苯乙酮制备6g。
[0073]
黄色粉末状固体,总收率35%,mp:168~169℃。
[0074]
波谱数据:1h nmr(400mhz,dmso-d6)δ10.40(s,1h,-oh),7.50(d,j=15.4hz,1h,-ch=ch-),7.31(s,j=4.6hz,1h,-ch=ch-),7.28(d,j=2.7hz,1h,ar-h),6.99(d,j=8.0hz,1h,ar-h),6.93(d,j=8.2hz,1h,ar-h),2.51(s,3h,-ch3),2.47(t,j=5.2hz,6h,-ch3),ms:m/z 303.4[m h]
,c
16h15
cln2o2(302.7).
[0075]
实施例8:(e)-1-(2-羟基-4-甲基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6h)的制备
[0076][0077]
化合物6h的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-羟基-4-甲基苯乙酮制备6h。
[0078]
黄色晶体,总收率42%,mp:148~152℃。
[0079]
波谱数据:1h nmr(400mhz,ccl3d)δ12.63(s,1h,-oh),8.28(d,j=14.8hz,1h,-ch=ch-),8.06(d,j=14.7hz,1h,-ch=ch-),7.85-7.71(m,1h,ar-h),7.34(dd,j=8.4,2.1hz,1h,ar-h),6.49(d,j=8.5hz,1h,ar-h),2.68(s,3h,-ch3),2.60(s,3h,-ch3),2.56(s,3h,-ch3),2.37(s,3h,-ch3),ms:m/z 283.3[m h]
,c
17h18
n2o3(282.3).
[0080]
实施例9:(e)-1-(4-氟-2-甲氧基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6i)的制备
[0081][0082]
化合物6i的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为4-氟-2-甲氧基苯乙酮制备6i。
[0083]
淡黄色粉末,总收率40%,mp:102~106℃。
[0084]
波谱数据:1h nmr(400mhz,ccl3d)δ7.99(d,j=15.1hz,1h,-ch=ch-),7.86(d,j=15.1hz,1h,-ch=ch-),7.75(dd,j=8.5,6.9hz,1h,ar-h),6.85
–
6.64(m,2h,ar-h),3.93(s,3h,o-ch3),2.64(s,3h,-ch3),2.54(s,6h,-ch3),ms:m/z 301.5[m h]
,c
17h17
fn2o2(300.3).
[0085]
实施例10:(e)-1-(2-硝基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6j)的制备
[0086][0087]
化合物6j的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-硝基苯乙酮制备6j。
[0088]
白色固体粉末,总收率33%,mp:196~197℃。
[0089]
波谱数据:1h nmr(400mhz,dmso-d6)δ8.04(d,j=15.0hz,1h,-ch=ch-),7.92(d,j=7.8hz,1h,ar-h),7.87(s,j=15.0hz,1h,-ch=ch-),7.79(dt,j=9.8,2.1hz,1h,ar-h),7.64(dd,j=7.9,5.8hz,1h,ar-h),7.55(dt,j=8.4,4.2hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 298.3[m h]
,c
16h15
n3o3(297.3).
[0090]
实施例11:(e)-1-(2-氟苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6k)的制备
[0091][0092]
化合物6k的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-氟苯乙酮制备6k。
[0093]
淡黄色针状结晶,总收率33%,mp:141~144℃。
[0094]
波谱数据:1h nmr(400mhz,dmso-d6)δ8.04(d,j=15.0hz,1h,-ch=ch-),7.92(d,j=7.8hz,1h,ar-h),7.87(s,j=15.0hz,1h,-ch=ch-),7.79(dt,j=9.8,2.1hz,1h,ar-h),7.64(dd,j=7.9,5.8hz,1h,ar-h),7.55(dt,j=8.4,4.2hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 271.3[m h]
,c
16h15
fn2o(270.3).
[0095]
实施例12:(e)-1-(邻甲苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6l)的制备
[0096][0097]
化合物6l的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为邻甲苯乙酮制备6l。
[0098]
黄色粉末,总收率32%,mp:102~105℃。
[0099]
波谱数据:1h nmr(400mhz,dmso-d6)δ7.83(d,j=15.2hz,1h,-ch=ch-),7.76(d,j=15.2hz,1h,-ch=ch-),7.65(d,j=7.3hz,1h,ar-h),7.40(td,j=7.4,1.4hz,1h,ar-h),7.34
–
7.24(m,2h,ar-h),2.60(s,3h,-ch3),2.53(s,6h,-ch3),2.50(s,3h,-ch3),hrms:m/z267.3[m h]
,c
17h18
n2o(266.3).
[0100]
实施例13:(e)-1-(3-氯苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6m)的制备
[0101][0102]
化合物6m的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为3-氯苯乙酮制备6m。
[0103]
淡黄色针状结晶,总收率33%,mp:156~157℃。
[0104]
波谱数据:
[0105]1h nmr(400mhz,dmso-d6)δ8.04(d,j=15.0hz,1h,-ch=ch-),7.92(d,j=7.8hz,1h,ar-h),7.87(s,j=15.0hz,1h,-ch=ch-),7.79(dt,j=9.8,2.1hz,1h,ar-h),7.64(dd,j=7.9,5.8hz,1h,ar-h),7.55(dt,j=8.4,4.2hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 287.8[m h]
,c
16h15
cln2o(286.8).
[0106]
实施例14:(e)-1-(4-氯苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6n)的制备
[0107][0108]
化合物6n的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为4-氯苯乙酮制备6n。
[0109]
淡黄色针状结晶,总收率33%,mp:156~158℃。
[0110]
波谱数据:1h nmr(400mhz,dmso-d6)δ8.04(d,j=15.0hz,1h,-ch=ch-),7.92(d,j=7.8hz,1h,ar-h),7.87(s,j=15.0hz,1h,-ch=ch-),7.79(dt,j=9.8,2.1hz,1h,ar-h),7.64(dd,j=7.9,5.8hz,1h,ar-h),7.55(dt,j=8.4,4.2hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 287.8[m h]
,c
16h15
cln2o(286.8).
[0111]
实施例15:(e)-1-(4-溴-2-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6o)的制备
[0112][0113]
化合物6o的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为4-溴-2-羟基苯乙酮制备6o。
[0114]
淡黄色粉末,总收率41%,mp:88~93℃。
[0115]
波谱数据:1h nmr(400mhz,ccl3d)δ12.94(s,1h,-oh),8.22(d,j=14.7hz,1h,-ch=ch-),8.08(d,j=14.7hz,1h,-ch=ch-),7.88(d,j=8.6hz,1h,ar-h),7.23(dt,j=1.9hz,1h,ar-h),7.10(dd,j=8.6,1.9hz,1h,ar-h),2.68(s,3h,-ch3),2.57(t,j=5.2hz,6h,-ch3),ms:m/z 375.2[m h]
,c
16h15
brn2o2(347.2).
[0116]
实施例16:(e)-1-(2,4,6-三羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6p)的制备
[0117][0118]
化合物6p的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2,4,6-三羟基苯乙酮制备6p。
[0119]
白色粉末状固体,总收率36%,mp:132~136℃。
[0120]
波谱数据:1h nmr(400mhz,dmso-d6)δ11.57(s,3h,-oh),8.10(d,j=15.0hz,1h,-ch=ch-),7.87(d,j=2.6hz,1h,ar-h),7.84(s,j=15.0hz,1h,-ch=ch-),6.99(d,j=8.8hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 301.3[m h]
,c
16h15
n2o3(300.3).
[0121]
实施例17:(e)-1-(5-溴-2-羟基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6q)的制备
[0122][0123]
化合物6q的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为5-溴-2-羟基苯乙酮制备6q。
[0124]
淡黄色粉末状固体,总收率36%,mp:132~136℃。
[0125]
波谱数据:1h nmr(400mhz,dmso-d6)δ11.57(s,1h,-oh),8.10(d,j=15.0hz,1h,-ch=ch-),7.87(d,j=2.6hz,1h,ar-h),7.84(s,j=15.0hz,1h,-ch=ch-),7.64(dd,j=8.8,2.6hz,1h,ar-h),6.99(d,j=8.8hz,1h,ar-h),2.59(s,3h,-ch3),2.50(t,j=5.2hz,6h,-ch3),ms:m/z 348.2[m h]
,c
16h15
brn2o2(347.2).
[0126]
实施例18:(e)-1-(2-羟基-5-甲基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6r)的制备
[0127][0128]
化合物6r的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2-羟基-5-甲基苯乙酮制备6r。
[0129]
淡黄色粉末,总收率31%,mp:115~118℃。
[0130]
波谱数据:1h nmr(400mhz,dmso-d6)δ13.10(s,1h,-oh),8.41(d,j=14.9hz,1h,-ch=ch-),7.94(d,j=15.0hz,1h,-ch=ch-),7.38(t,j=8.3hz,1h,ar-h),6.62(d,j=8.3hz,1h,ar-h),6.44(d,j=8.3hz,1h,ar-h),3.96(s,3h,o-ch3),2.66(s,3h,-ch3),2.55(d,j=2.9hz,6h,-ch3),ms:m/z 299.3[m h]
,c
17h18
n2o3(298.3).
[0131]
实施例19:(e)-1-(2,6-二甲氧基苯基)-3-(3,5,6-三甲基吡嗪-2-基)-2-丙烯-1-酮(6s)的制备
[0132][0133]
化合物6s的制备,操作步骤同实施例1,所不同的是将实施例1中的制备化合物6a的原料替换为2,6-二甲氧基苯乙酮制备6s。
[0134]
淡黄色粉末,总收率31%,mp:152~156℃。
[0135]
波谱数据:1h nmr(400mhz,dmso-d6)δ7.42(d,j=8.1hz,1h,-ch=ch-),7.39(s,1h,ar-h),7.22(d,j=15.4hz,1h,-ch=ch-),6.77(d,j=8.4hz,2h,ar-h),3.74(s,6h,o-ch3),2.45(d,j=11.8hz,9h,-ch3),ms:m/z 313.4[m h]
,c
18h20
n2o3(312.4).
[0136]
实施例20:基于流感荧光素酶报告病毒的表型筛选
[0137]
实验材料:犬肾传代细胞(mdck)细胞;流感病毒h1n1/pr8;重组的报告病毒pr8-pb2-gluc;dmem、opti-mem及pbs均购于美国gibco公司;胎牛血清(fbs)购于美国abw公司;
二甲基亚砜(dmso)购于美国amresco公司;tpck-trypsin购于美国sigma公司;奥司他韦羧酸盐(osc)购于美国mce公司;荧光素酶检测试剂盒购于美国thermofisher公司;cell counting kit-8试剂盒购于美国mce公司。
[0138]
测试方法:在96孔细胞培养板中铺入单层mdck细胞,用pr8-pb2-gluc以moi=0.01(moi=有感染力的病毒颗粒/细胞个数)感染96孔板中的mdck细胞,加入10μm川芎嗪衍生物溶液,同时设空白组和对照组。37℃条件下孵育36h后,用荧光素酶检测试剂盒检测荧光素酶活性,用于病毒载量的确定。阴性对照为病毒与dmso的检测数据。同时设置不加入病毒感染细胞而只加入10μm川芎嗪衍生物溶液的实验组,以测定衍生物自身对细胞的影响。
[0139]
实验结果:活性结果见表1。
[0140]
表1.川芎嗪衍生物的体外抗流感活性
[0141][0142][0143]
如表1所示,化合物6s显示出高效的抗病毒能力,在10μm的浓度下将病毒的感染力减低到14%。且该类化合物无明显的细胞毒性(细胞存活率》80%)。
[0144]
实施例21:量效关系研究和广谱抗病毒活性测试
[0145]
实验材料:犬肾传代细胞(mdck)细胞;流感病毒h1n1/pr8;a(h1n1)pdm09;a(h1n1)pr8;a(h3n1)brisbane;ibv yamagata;ibv victoria;重组的报告病毒pr8-pb2-gluc;dmem、opti-mem及pbs均购于美国gibco公司;胎牛血清(fbs)购于美国abw公司;二甲基亚砜(dmso)购于美国amresco公司;tpck-trypsin购于美国sigma公司;荧光素酶检测试剂盒购于美国thermofisher公司;cell counting kit-8试剂盒购于美国mce公司。
[0146]
测试方法:在96孔细胞培养板中铺入单层mdck细胞,用流感病毒h1n1/pr8;a(h1n1)pdm09;a(h1n1)pr8;a(h3n1)brisbane;ibv yamagata;ibv victoria毒株以moi=0.01感染96孔板中的mdck细胞,对于筛选出的活性较高的6s,从100μm开始,5倍稀释,做5个稀释度,检测它们在不同浓度下对流感病毒的抑制效果以及细胞毒性,同时以奥司他韦的活性形式osc为阳性对照。利用graphpad prism软件,通过拟合剂量依赖性曲线得出单体的半数抑制浓度(ic
50
)。同时设空白组和对照组。37℃条件下孵育36h后,用荧光素酶检测试剂盒检测荧光素酶活性,用于病毒载量的确定。阴性对照为病毒与dmso的检测数据。
[0147]
实验结果:活性结果见表2。
[0148]
表2.6s体外抗流感活性
[0149][0150]
注:
a ic
50
:半数抑制浓度;阳性药物为奥司他韦羧酸形式。
[0151]
如表2所示,目标化合物6s对各个a型和b型的野生型流感病毒株表现出了广谱抑制活性,且活性与上市药物奥司他韦相当。此外,该化合物对奥司他韦的耐药株a(h1n1)pdm09的抑制活性(ic
50
=1.34μm)远超奥司他韦(ic
50
》100μm),值得深入研究。
[0152]
实施例22:川芎嗪查尔酮衍生物的抗流感机制研究
[0153]
在确定川芎嗪查尔酮衍生物对流感病毒呈剂量依赖性抑制后,选择活性最好的化合物6s进行了机制研究。
[0154]
测试方法:分别在6s(30μm)存在或不存在的情况下,用pr8-pb2-gluc病毒感染24孔板中的mdck细胞。培养6h后,用4%的甲醛固定细胞30min,并用0.5%triton x-100渗透15min。用5%牛血清白蛋白封闭后,用兔抗np抗体(genetex)和与alexa-488(proteintech)缀合的抗兔二抗对细胞进行染色(白色)。细胞核用dapi染色(灰色)。通过共聚焦显微镜观察,由olympus ix73成像。
[0155]
实验结果:如图1所示,川芎嗪衍生物6s能够显著抑制病毒np的表达。值得注意的是,在感染病毒后6h时,经过6s处理的实验组的病毒核蛋白都滞留在宿主细胞核中,并没有正常释放出来,以致于np无法在病毒生命周期的后续阶段发挥正常功能。这些结果表明,川芎嗪衍生物能够抑制流感病毒核蛋白的表达和阻止核蛋白的核输出过程,从而干扰流感病
毒正常增殖。
[0156]
实施例23:川芎嗪查尔酮衍生物的药代动力学实验
[0157]
目的:本研究旨在观察大鼠分别灌胃和静脉注射给予供试品6s后,6s的血药浓度经时过程,估算相应的药代动力学参数和绝对生物利用度。
[0158]
材料和仪器:
[0159]
sciex triple quad 5500 三重四级杆液质联用仪,操作软件为analyst 1.7.2(美国应用生物系统有限公司);exionlc液相系统;精密天平(赛多利斯,型号:gl124-1scn);低温高速冷冻离心机(eppendorf,型号:5424r);超纯水仪(thermo,型号:msdopure uv/uf);混匀振荡器(其林贝尔,型号:be-3100);移液枪(ika);大鼠灌胃针。6只spf级雄性sd大鼠,6-8周龄,体重180-200g,动物购于北京维通利华实验动物技术有限公司,动物许可证号:scxk(京)2021-0011;实验动物接收后进行一周的适应性饲养,随后进行药动学研究。动物房的温度为20~26℃;湿度为40-70%;12小时光照黑暗交替;自由饮水和取食;动物实验开始前禁食12h。实验完毕后所有动物均按照医药科学委员会动物实验职业道德的规定处死动物。
[0160]
试验方法:
[0161]
6只sd大鼠分为两组,分别灌胃和尾静脉注射给予6s,静脉注射组于给药后5min、15min、30min、1h、2h、4h、6h、8h、24h;灌胃组于给药后5min、15min、30min、1h、2h、4h、6h、8h、24h自颈静脉采集血样约0.25ml。采用lc-ms/ms法测定大鼠血浆样本中6s的浓度,用winnolin软件计算药代动力学参数。
[0162]
选用excel 2010电子表格软件进行数据管理,用winnolin 8.2软件计算药代动力学参数。
[0163]
绝对生物利用度计算公式:
[0164]
f(%)=(dose
iv
×
auc
oral(0-∞)
)/(dose
oral
×
auc
iv(0-∞)
)
×
100%。
[0165]
药代动力学参数计算:根据试验中测得的各受试动物的血药浓度-时间数据,求得受试物的主要药代动力学参数。包括t
max
(达峰时间)、c
max
(峰浓度)、t
1/2
(消除半衰期)、auc(血药浓度-时间曲线下面积)等参数值。
[0166]
实验结果如表3所示。
[0167]
表3.6s的药代动力学研究
[0168][0169]a口服剂量为20mg/kg.b尾静脉注射剂量为2mg/kg.
[0170]
结果显示,在口服给药后,6s具有中等血浆半衰期(t
1/2
=2.49h),并且化合物的生物利用度为4.07%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
