1.本发明涉及一种无扩增时间分辨荧光侧向层析检测方法检测沙门氏菌及耐药菌,属于快速检测技术领域。
背景技术:
2.沙门氏菌(s.aureus)被认为是最严重的传染性食源性病原体之一,在国际食品安全事件(efsa.2021)中,它几乎处于公共安全问题的首位或第二位,由于其侵袭性、毒力和抗生素耐药性,可导致严重的食物中毒。此外,随着抗生素在医药和农业中的滥用,细菌耐药性问题变得越来越严重。世界卫生组织将抗生素耐药性列为当前对全球健康、粮食安全和发展的威胁之一(who,2020)。因此,一种快速、廉价且灵敏的沙门氏菌及其耐药菌的检测方法对于确保食品安全和人类健康至关重要。
3.为了实现对病原菌的简单快速检测,crispr/cas12a系统因其能够识别双链dna(dsdna)并激活dna的顺式和反式切割活性而受到研究人员的青睐。例如,陈等人,开发了一种基于四标签的crispr/cas12a系统,用于基于荧光信号检测鼠疫耶尔森氏菌。李等人,开发了一种基于crispr/cas12a的荧光和电化学生物传感器,用于检测单核细胞增生李斯特菌。这些crispr/cas生物传感器在实验室标准化测试中表现出优异的性能。但这些方法的读数主要基于荧光和电化学信号,严重依赖专业操作和精密仪器(如荧光读数仪和电化学工作站),给实际检测带来不便,降低了基层监测的性能。因此,开发低成本、简单、准确的crispr/cas12a检测平台迫在眉睫。
4.侧向流动检测(lfb)是一种很有前途的即时检测(poct)平台,已广泛应用于核酸检测。然而,传统的基于分子的lfb通常使用环介导等温扩增(lamp)或重组酶聚合酶扩增(rpa)获得的扩增子作为连接介质,容易出现引物和引物二聚体引起的假阳性。
5.crispr/cas系统与lfb相结合可以解决当前的限制。例如,穆卡马等人,开发了基于crispr/cas等温扩增的lfb(cialfb)平台,实现了人乳头瘤病毒(hpv)和铜绿假单胞菌的快速灵敏检测。
6.然而,大多数基于crispr/cas的lfb仍然使用金纳米颗粒(aunp)标记的抗体,以抗体作为信号和内控探针,检测成本高,产生的信号微弱,并且难以实现精准定量;这阻碍了它在poct领域的应用。迫切需要开发一种基于crispr/cas12a的低成本、简单、强信号和高性能的lfb平台。为了解决这些问题,基于crispr/cas12a的lfb平台可以基于以下主要因素进行改进:1)选择用于lfb的高强度和稳定的信号输出材料,2)选择捕获探针和报告探针;3)改进了lfb上探针的修改方法。与金纳米颗粒或荧光染料相比,斯托克斯位移长,时间分辨荧光微球(trfm)标记的lfb表现出更高的灵敏度和更低的背景干扰。
7.作为一种常见的分子探针,单链dna(ssdna)因其简单、低成本和强特异性而满足lfb的需求。基于crispr/cas12a的lfb平台结合qd和ssdna探针的检测方法可能实现显着增强的性能。该检测方法可以成功检测食源性病原体,成本低、快速、灵敏、专一;它的用途可
以扩展到监测poct的临床诊断和环境。
技术实现要素:
8.为了克服现有技术的缺点和不足,本发明的首要目的在于提供一种基于crispr/casl2a技术,并通过组合crrna的方法实现在无扩增的条件下快速灵敏的检测耐药沙门氏菌。
9.本发明的另一目的在于提供一种基于crispr/casl2a技术的时间分辩荧光试纸方法。该方法是一种利用ascas12a(cpf1)-nls酶/组合crrna系统进行沙门氏菌及耐药菌检测的方法。
10.本发明的目的通过以下技术方案实现:
11.本发明的第一个目的是提供一种基于crispr/cas12a技术快速检测沙门氏菌及耐药沙门氏菌的试剂盒,包括cas12a核酸酶,crrna和荧光素标记的报告单链dna分子。
12.在本发明的一种实施方式中,检测沙门氏菌的crrna的序列如seq id no.1~seq id no.8任一所示。
13.在本发明的一种实施方式中,检测沙门氏菌及耐药沙门氏菌的crrna的序列如seq id no.5和seq id no.6所示。
14.在本发明的一种实施方式中,检测耐药沙门氏菌的crrna的序列如seq id no.9~seq id no.14任一所示。
15.在本发明的一种实施方式中,检测耐药沙门氏菌的crrna的序列如seq id no.9和seq id no.12所示。
16.在本发明的一种实施方式中,所述报告单链dna分子的序列为5'-ttttttt-3'。
17.在本发明的一种实施方式中,所述的报告单连dna分子5'端用fam标记,3'端用bhq1标记。
18.在本发明的一种实施方式中,所述耐药沙门氏菌为耐喹诺酮沙门氏菌突变株。
19.在本发明的一种实施方式中,所述cas12a核酸酶包括as cas12a(cpf1)-nls核酸酶。
20.本发明的第二个目的是提供利用上述试剂盒进行沙门氏菌及耐药沙门氏菌检测的方法,所述方法为将as cas12a(cpf1)-nls酶、crrna、报告单链dna分子和待测样本的dna在缓冲液中反应并测定荧光值。
21.在一种实施方式中,所述crrna的工作浓度为80~120nm。
22.在一种实施方式中,所述as cas12a(cpf1)-nls酶的工作浓度为120~180nm。
23.在本发明的一种实施方式中,所述缓冲液中包括40~60mmnacl、5~15mmt ris-hcl、5~15mm mgcl2和80~120ug/ml bsa,ph7.9。
24.本发明的第三个目的是提供一种检测沙门氏菌及耐药沙门氏菌的无扩增时间分辨层析定量试剂盒,所述试剂盒包括侧向层析试纸条、链霉亲和素修饰的时间分辨荧光微球、5’端经生物素修饰的核酸探针、cas12a核酸酶、crrna,所述侧向层析试纸条上包括捕获探针。
25.在本发明的一种实施方式中,检测沙门氏菌的crrna的序列如seq id no.1~seq id no.8任一所示。
26.在本发明的一种实施方式中,检测沙门氏菌及耐药沙门氏菌的crrna的序列如seq id no.5和seq id no.6所示。
27.在本发明的一种实施方式中,检测耐药沙门氏菌的crrna的序列如seq id no.9~seq id no.14任一所示。
28.在本发明的一种实施方式中,检测耐药沙门氏菌的crrna的序列如seq id no.9和seq id no.12所示。
29.在本发明的一种实施方式中,所述核酸探针的序列为5'-ttttttttatt-3'。
30.在本发明的一种实施方式中,所述cas12a核酸酶包括as cas12a(cpf1)-nls核酸酶。
31.在本发明的一种实施方式中,所述侧向层析试纸条设置有背板、玻璃纤维样品垫、硝酸纤维素膜(nc膜)和吸水垫;样品垫、nc膜和吸水纸,所述nc膜上设有检测线和质控线,所述检测线上包被捕获探针;所述质控线上包被牛血清白蛋白偶联的生物素。
32.在本发明的一种实施方式中,所述捕获探针的序列如seq id no.15所示。
33.在本发明的一种实施方式中,所述捕获探针的工作浓度为20~50nm,所述牛血清白蛋白偶联的生物素的工作浓度为0.1-0.5mg/ml。
34.在本发明的一种实施方式中,所述捕获探针利用含有0.6~1.0m kcl的pbs溶液作为稀释缓冲液。
35.在本发明的一种实施方式中,所述捕获探针和牛血清白蛋白偶联的生物素的喷涂量均为1μl/cm。
36.在本发明的一种实施方式中,所述检测线和质控线之间相距4-6mm;所述试纸条的宽度为3-5mm。
37.在本发明的一种实施方式中,所述的玻璃纤维样品垫的制备方法为,将宽18~22mm的玻璃纤维样品垫浸入缓冲液中4.5~5.5min完成饱和,然后在45~55℃下干燥20~30h
38.在本发明的一种实施方式中,所述缓冲液为0.05m tris-hcl,2%(w/v)peg8000和1.5%(v/v)tween-20,ph=8.0。
39.在本发明的一种实施方式中,所述样品垫与nc膜重叠部位长度为2-4mm,样品垫置于nc膜上方;吸水纸与nc膜间重叠部位长度为2-4mm,吸水纸置于nc膜上方。
40.在本发明的一种实施方式中,所述检测线距离样品垫4-6mm,质控线距离吸水纸4-6mm。
41.在本发明的一种实施方式中,所述试剂盒中还含有阳性标准品和反应缓冲液。
42.在本发明的一种实施方式中,所述反应缓冲液为0.02mm edta、0.4mm tris-hcl和1mm mgcl2。
43.本发明的第四个目的是提供一种基于时间分辨荧光微球的检测沙门氏菌及耐药沙门氏菌的方法,所述方法为采用上述无扩增时间分辨层析定量试剂盒进行测试,具体步骤如下:
44.(1)将链霉亲和素修饰的时间分辨荧光微球和5’端经生物素修饰的核酸探针进行偶联获得荧光探针;
45.(2)提取待测样本的dna;
46.(3)将步骤(1)的荧光探针、步骤(2)的dna、cas12a核酸酶和crrna室温静置10~30min获得混合液;
47.(4)将步骤(3)的混合液滴加到样品垫上,孵育,使用免疫定量分析仪并结合标准曲线进行定量。
48.在本发明的一种实施方式中,步骤(1)中,所述偶联的条件为20~27℃下偶联10~20min。
49.在本发明的一种实施方式中,步骤(1)中,所述链霉亲和素修饰的时间分辨荧光微球的终浓度为1~10ng/ml,5’端经生物素修饰的核酸探针的终浓度为10~80nm。
50.在本发明的一种实施方式中,步骤(3)中,将20μl的dna、50nm的cas12a核酸酶和100nm crrna和50μl的荧光探针混合。
51.在本发明的一种实施方式中,步骤(4)中,所述孵育的条件为35~38℃层析10~20min。
52.在本发明的一种实施方式中,所述方法在ph6.5~7.5的条件下进行反应。
53.在本发明的一种实施方式中,所述标准曲线的制备方法为针对含有不同浓度的沙门氏菌或耐药菌株的阴性溶液进行核酸提取获得dna,将链霉亲和素修饰的时间分辨荧光微球和5’端经生物素修饰的核酸探针混合获得荧光探针,将荧光探针、dna、cas12a核酸酶和crrna室温静置10~30min后滴加到样品垫上,孵育,使用免疫定量分析仪进行定量分析,将数据进行拟合得到标准曲线。
54.当目标dna存在时,cas12a酶的反式切割活性被激活,任意降解生物素-ssdna探针,导致t线上的捕获探针捕获失败;因此,没有产生荧光信号。反应液到达c线后,牛血清白蛋白偶联的生物素可以直接捕获游离的链霉亲和素修饰的时间分辨荧光微球(trfm-sa),形成明显的荧光信号。相反,在样品中没有目标dna的情况下,cas12a酶的反式切割活性没有被激活;t线上的捕获探针与完整的bio-ssdna探针互补以捕获trfm-sa,从而产生明显的荧光信号。然后测定标准品在检测线和质控线处相应的荧光强度值,分别得到t值和c值;设置阴性对照,即样品中不含有待测样品,测得荧光强度t0值;取t/t0作为参数,与浓度的对数值建立线性模型,得到沙门氏菌及其耐喹诺酮突变株相应的标准曲线。
55.有益效果:
56.1、本发明基于crispr/casl2a技术设计得到针对沙门氏菌和沙门氏菌耐药菌株(耐喹诺酮沙门氏菌突变株)的crrna,其中,seq id no.1~seq id no.8所示的crrna可以特异性的用于检测沙门氏菌和沙门氏菌耐药菌株,seq id no.9~seq id no.14所示的crrna可以特异性的用于检测沙门氏菌耐药菌株,有效区分沙门氏菌和沙门氏菌耐药菌株。
57.2、本发明提供的crrna组合crrna5 6-s和crrna1 4-q可以有效提高检测的灵敏度,发现crrna5 6-s组合的平均斜率相比独立crrna5-s和crrna6-s分别增长了89.5%和123.7%;crrna1 4-q组合的平均斜率相比crrna1-q和crrna4-q分别增长了85.1%和119.5%。
58.3、本发明通过针对时间分辨荧光微球的反应ph、捕获探针ssdna的稀释缓冲液以及trfm-sa和bio-ssdna探针的添加量的优化,以提高时间分辨荧光试剂盒的反应灵敏度;结合crrna1 4-q组合,针对沙门氏菌耐药菌株检测限lod可达到1.8
×
102cfu/ml,并且本发明提供的时间分辨荧光试剂盒精密度和准确度高,可以实现有效的快速筛查和检测。
附图说明
59.图1:所采用crrna核苷酸序列和位置。
60.图2为crrna序列的筛选及液体环境检测方法的构建(纵坐标为荧光强度,横坐标为孵育时间)。
61.图3为独立crrna的荧光检测,a:crrna不同浓度下随时间荧光恢复图,b:不同浓度下斜率(酶活力)对比图。
62.图4为组合crrna与独立crrna荧光恢复能力对比图。
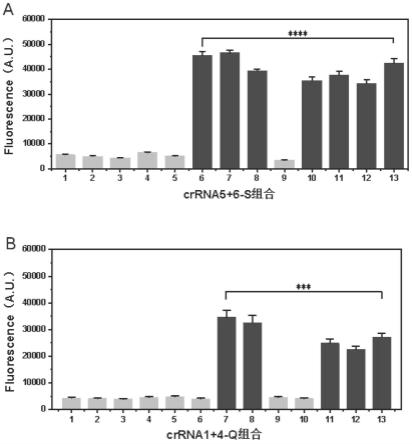
63.图5为该检测方法特异性分析图,a:crrna5 6-s组合特异性分析,b:crrna1 4-q组合特异性分析。
64.图6为时间分辨荧光微球检测试纸的优化,a:无扩增耐药沙门氏菌时间分辨荧光试纸t线ph优化,b:无扩增耐药沙门氏菌时间分辨荧光试纸t线缓冲液优化,c:无扩增耐药沙门氏菌时间分辨荧光试纸时间分辨荧光微球结合率优化,d:无扩增耐药沙门氏菌时间分辨荧光试纸bio-ssdna添加量的优化。
65.图7为无扩增耐药沙门氏菌时间分辨荧光试纸标准曲线。
具体实施方式
66.实施例1:crrna的筛选及液体环境检测方法构建
67.本发明实施例中,基于crispr/casl2a技术快速检测沙门氏菌及其沙门氏菌耐喹诺酮类类突变株,该方法用于非诊断或治疗目的,包括如下步骤:
68.通过vmatch筛选和blast比对,筛选其保守特异性的核酸序列,分别针对沙门氏菌标准菌株以及沙门氏菌qnrs基因,作为cas12a核酸酶(ascas12a(cpf1)-nls酶)及crrna识别的靶序列,靶序列前含有“tttn”pam识别位点。
69.首先针对靶序列设计靶点特异性的crrna,针对沙门氏菌标准菌株设计并合成4个低重复度序列crrna-salmonella1(crrna1-s)到crrna-salmonella4(crrna4-s)、4个高重复度序列crrna5-s到crrna8-s,针对耐药沙门氏菌qnrs基因的序列设计并合成crrna-qnrs1(crrna1-q)到crrna-qnrs6(crrna6-q)(图1)。然后进行转录并纯化。合成的cas12a的crrna总共包含两部分,一部分为5’端20bp的重复序列,该段序列可以于ascas12a(cpf1)-nls酶结合,重复序列为5
’‑
ggauuuagacuaaacuaagau-3’;第二部分为21bp的间隔序列,可以与靶基因互补配对;cas12a的pam序列在靶dna的非结合链的5’端,位于重复序列和间隔序列之间。
70.报告单链dna分子的设计(ssdna-fq):两端分别带有fam和bhq1基团的7个t碱基单链。5
’‑
fam-ttttttt-bhq1-3’。
71.表1.crispr/cas12a检测中所用的寡核苷酸序列
[0072][0073][0074]
测定前先将沙门氏菌标准菌及耐药沙门氏菌在营养肉汤中于37℃孵育过夜,以获得纯细菌培养物,通过标准平板计数测定每种细菌种类的浓度。
[0075]
通过加热裂解法或称水提法提取dna,将1ml细菌溶液重悬于200μltris-edta(te)缓冲液中,并在100℃下加热裂解8min。裂解后菌液在12000
×
g下离心2min,上清液作为核酸样品进行后续实验,测定前使用超微分光光度计(kaiao technology development co.,let,beijing china)测量dna浓度。
[0076]
荧光检测反应体系:cas12a裂解试验由1
×
neb buffer 2.1μl(50mm nacl、10mm tris-hcl、10mm mgcl2、100ug/ml bsa,ph7.9,在25℃)、150nm ascas12a(cpf1)-nls酶、
100nm crrna、300nm ssdna-fq报告探针和4μl核酸样品,最后使用无核酸酶的水添加到最终体积25μl。
[0077]
荧光检测反应条件:将荧光检测反应体系置于37℃反应30min后检测荧光强度。
[0078]
反应产物在酶标仪中,使用波长492nm的激发光激发荧光,在波长525nm处检测荧光强度以获得检测结果。
[0079]
通过图2可知,针对沙门氏菌设计的crrna序列crrna5-s和crrna6-s具有最好荧光恢复的,针对耐药沙门氏菌qnrs基因设计的crrna序列crrna1-q和crrna4-q具有最好荧光恢复的,可用于后续检测。
[0080]
实施例2:组合crrna提高crispr-cas12a检测的灵敏度
[0081]
利用细菌dna核酸提取试剂盒分别提取菌浓为101~104cfu/ml沙门氏菌和耐药沙门氏菌的dna,利用实施例1中的方法对目标dna进行荧光检测,以独立确定实施例1中筛选到的crrna5-s、crrna6-s、crrna1-q和crrna4-q的检测限,结果从图3a所示,cas12a核酸酶切割产生的荧光恢复信号与测定中靶dna的浓度成正比,分别添加添加crrna5-s或crrna6-s,针对沙门氏菌标准菌株的组别,当目标菌活度为102cfu/ml时可以检出,但荧光恢复并不明显;分别添加crrna1-q或crrna4-q,针对沙门氏菌耐药菌株的组别,只有当菌活度达到103cfu/ml时才可以检出。
[0082]
接下来,将对沙门氏菌设计的crrna序列crrna和crrna进行组合(crrna5 6-s),以及,将针对耐药沙门氏菌qnrs基因设计的crrna序列crrna-q1和crrna-q4进行组合(crrna1 4-q),测定在同一反应中组合crrna以形成两个不同的crispr-cas12a体系是否可以增强整体切割的活化,从而提高检测的灵敏度。
[0083]
荧光检测反应体系总共25μl,150nm cas12a核酸酶,100nm crrna组合(crrna5 6-s组合或crrna1 4-q组合),2nm报告单链dna分子,10u rnase inhibitor(takara),5μl不同菌活度下对应的目标dna,1
×
neb buffer 2.1μl,反应体系在37℃下反应30分钟。
[0084]
当菌活度在1.4
×
104(cfu/ml)时。结合crrna显著增加了检测反应的斜率和反应的灵敏度。结果如图4所示,对于针对沙门氏菌的组合crrna(crrna5 6-s)和针对耐药沙门氏菌的组合crrna(crrna1 4-q)而言,其荧光恢复明显高于单条crrna,尤其在低浓度下较背景荧光明显增加,显著降低了其检测限(lod)。我们对荧光恢复的数据进行线性回归计算,并显示为斜率
±
95%置信区间。通过协方差分析(ancova)将斜率与单独的rnp对照进行比较:****p《0.0001,***p《0.001,ns=不显着高于rnp对照。发现crrna5 6-s组合的平均斜率相比独立crrna5-s和crrna6-s分别增长了89.5%和123.7%;crrna1 4-q组合的平均斜率相比crrna1-q和crrna4-q分别增长了85.1%和119.5%,检测灵敏度显著增加。
[0085]
将待测核酸样品梯度稀释,对比crrna5-s组合crrna6-s或者crrna1-q组合crrna4-q两组组合crrna的检测结果和单独crrna检测结果,发现组合crrna可以将沙门氏菌标准菌株检测灵敏度从103cfu/ml降低到102cfu/ml,在不改变检测时间及其他条件的情况下显著提高其检测灵敏度。
[0086]
实施例3组合crrna检测特异性的判断
[0087]
荧光检测反应体系为总共25μl,50nm cas12a核酸酶,100nm crrna组合(crrna5 6-s组合或crrna1 4-q组合),2nm报告单链dna分子,10u rnase inhibitor(takara),5μl核酸样品,1
×
neb buffer 2.1μl,反应体系在37℃下反应30分钟。
[0088]
分别提取大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、嗜水气单胞菌、副溶血性弧菌、沙门氏菌标准菌株、耐药沙门氏菌的dna作为核酸样品,并全部稀释至103cfu/ml后分别进行荧光检测反应,如图5所示,图5a为样品中添加crrna5 6-s组合后的荧光恢复,图5b为添加crrna1 4-q组合后在不同样品中的荧光恢复。样品编号如下:1.大肠杆菌、2.金黄色葡萄球菌、3.铜绿假单胞菌、4.嗜水气单胞菌、5.副溶血性弧菌、6.沙门氏菌标准菌株、7.耐药沙门氏菌、8.大肠杆菌 金黄色葡萄球菌 耐药沙门氏菌、9.副溶血性弧菌 大肠杆菌 铜绿假单胞菌 金黄色葡萄球菌 嗜水气单胞菌,10.大肠杆菌 铜绿假单胞菌 沙门氏菌标准菌株 金黄色葡萄球菌;11.大肠杆菌 金黄色葡萄球菌 铜绿假单胞菌 副溶血性弧菌 嗜水气单胞菌 耐药沙门氏菌;12.大肠杆菌 金黄色葡萄球菌 铜绿假单胞菌 嗜水气单胞菌 耐药沙门氏菌 沙门氏菌标准菌株;13.沙门氏菌标准菌株 耐药沙门氏菌。
[0089]
可知使用crrna5 6-s组合时,只有含沙门氏菌标准菌株和耐药沙门氏菌的样品出现荧光恢复,当使用crrna1 4-q组合时,只有含耐药沙门氏菌的样品出现明显荧光恢复,证明具有良好的特异性,能够特异性的检测沙门氏菌,且能够区分敏感性菌株及耐药菌。
[0090]
实施例4链霉亲和素(sa)修饰的时间分辨荧光微球(trfm-sa)探针制备
[0091]
相关溶液的制备:
[0092]
活化缓冲液:ph 4.5-6.50.05m的2-(n-吗啡啉)乙磺酸(mes,c6h
13
no4s
·
h2o)溶液;
[0093]
偶联缓冲液:ph 7.0-8.00.01m的磷酸缓冲液(pbs)(避免使用存在游离胺的溶剂);
[0094]
活化剂:10mg/ml的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc,c8h
17
n3·
hcl)溶液以及10mg/ml的n-羟基琥珀酰亚胺(nhs,c4h5no3)溶液;
[0095]
封闭缓冲液:含1%bsa、0.05%tween-20的ph 6.0-7.00.01m的磷酸缓冲液(pbs);
[0096]
标记洗涤液:含0.1%tween-20的ph 6.0-7.00.05m的tris-hcl;
[0097]
链霉亲和素修饰的时间分辨荧光微球(trfm-sa)复溶液/反应缓释液:含有5%蔗糖,1%牛血清白蛋白,1%tween-20的ph6.0-7.00.05m的tris-hcl;
[0098]
trfm-sa具体制备方法如下:
[0099]
(1)取4℃放置的内部包裹eu3 的时间分辨荧光微球(trfm)(购于厦门迪佰生物科技有限公司,粒径300nm)50μl(1%固形物含量),超声分散,加入800-1000μl活化缓冲液,15000rpm于4℃离心10-15min;
[0100]
(2)弃上清,加入500-800μl活化缓冲液,超声重悬,重复离心清洗2-3次;
[0101]
(3)弃上清,加入200μl活化缓冲液超声重悬,加入50μl 10mg/ml edc溶液、50μl10mg/ml的nhs溶液作为活化剂,室温摇床500rpm避光振荡活化40min;
[0102]
(4)活化完成后离心,弃上清,加入pbs缓冲液清洗2-3次;
[0103]
(5)弃上清,加入400μl偶联缓冲液超声重悬,再加入30μg链霉亲和素,室温避光振荡标记2h;
[0104]
(6)标记结束后加入10%(v/v)的封闭缓冲液,室温避光振荡40min;
[0105]
(7)封闭后离心弃上清,用800-1000μl的标记洗涤液清洗2-3次;
[0106]
(8)弃上清,加入200μl荧光微球复溶液,得到链霉亲和素标记的时间分辨荧光微球(trfm-sa),4℃保存备用。
[0107]
实施例5时间分辨荧光微球检测试纸条的制备
[0108]
(1)合成标记探针:合成生物素探针(bio-ssdna)探针(见表1),将bio-ssdna探针与实施例4中合成的trfm-sa在25℃下偶联10~20min得到标记探针,在试纸条使用时现配现用。
[0109]
(2)样品垫制备:将玻璃纤维样品垫(宽20mm)浸入缓冲液(0.05m tris-hcl,2%(w/v)peg8000和1.5%(v/v)tween-20,ph=8.0)中5min完成饱和,然后在50℃下干燥24h。
[0110]
(3)nc膜包被:在nc膜上分别喷涂如表1所示捕获探针(50nm)、牛血清白蛋白偶联的生物素(0.25mg/ml)分别作为检测线(t线)和质控线(c线),喷涂量均为1μl/cm,t线和c线的宽度取决于喷膜仪管路的直径约2mm,t线距离样品垫约5mm,c线距离吸水纸约为5mm,两线之间相距约4-6mm,37℃干燥2-3h。
[0111]
(4)试纸条的组装:将样品垫,nc膜和吸水纸粘贴在pvc底板上组装成试纸条,试纸条组装的关键是要保证各部分之间具有一致的传递性,其中样品垫叠在nc膜上,二者重叠约3mm,类似地,吸水纸叠在nc膜上,二者重叠约3mm,用切条机将粘贴好的板切成约4mm宽的试纸条,用塑料底座和卡壳组装,4℃密封保存备用。
[0112]
实施例6耐药沙门氏时间分辩荧光试剂盒的优化
[0113]
(1)如图6a所示,eu3 荧光微球在水溶液中不稳定。因此,反应体系的高浓度、颗粒表面带电基团的浓度、电解质浓度等都会导致水溶液中的颗粒聚集。溶液的ph值极大地影响trfm-sa的灵敏度、fi和稳定性。试纸t线荧光值和fi
t
/fic值随着tris-hcl缓冲液ph值的增加而增加。再ph达到7时达到最大值,在极高的ph值下,荧光值开始下降。当ph值在6.5和7.0之间时,试纸的荧光值达到40w(a.u.),且fi
t
/fic比值接近1满足检测要求。
[0114]
(2)如图6b所示,虽然捕获探针ssdna成本低且设计简单,但在nc膜上修饰不稳定的缺点也不容忽视。因此进行了捕获探针链接剂的筛选:制备了6种连接试剂,包括c2h5oh、c3h8o3、tween20、pbs、kcl、kcl tween20和kcl pbs。我们发现三种含有kcl的连接试剂可以有效地锚定dna探针并在t线中产生更亮的条带,而其他连接试剂则显著扩散。如图6b所示,kcl和pbs的混合连接剂产生更强的荧光峰和最大的fi
t
/fic比率。选择kcl(0.8m)和pbs的混合物作为t线缓冲液和连接剂。
[0115]
(3)如图6c所示,不同的trfm-sa的添加量对于检测灵敏度影响显著,具体来说,少量会降低样品检出量,大量会导致系统分散不良。测试了不同trfm-sa剂量的效果。我们根据以往文献将fi
t
/fic比率定义为最接近1的最佳条件,发现3μg/ml的trfm-sa浓度满足要求,具有适当的fi
t
/fic比率和可比的t和c线之间的亮度带。因此,选择3μg/ml的浓度为最佳浓度
[0116]
(4)如图6d所示,bio-ssdna探针的浓度:报告探针的浓度决定了cfa-lfb检测平台的灵敏度。选择不同的浓度(0、10、15、20、25、30、50和80nm)进行测试,结果表明fit/fic比率随着bio-ssdna探针添加量的增加而逐渐增加,并且该比率在20nm时接近1。最后,选择20nm的bio-ssdna探针作为最佳浓度。
[0117]
实施例7耐药沙门氏时间分辩荧光试剂盒的标准曲线绘制
[0118]
标准曲线的绘制方法是:
[0119]
取耐药菌株加入阴性牛奶样品中配制成菌活度分别为0、6.4
×
101、5.4
×
102、2.7
×
103、1.4
×
104、6.7
×
104、3.3
×
105cfu/ml的加标样品溶液用于荧光试纸条检测(其中稀释液为0.01m ph 7.4的pbs溶液;trfm-sa溶液:0.05μg/μl trfm-sa,含有1.5%牛血清白蛋
白,1%tween-20,ph6.70.05m的tris-hcl溶液),使用核酸提取试剂盒将不同浓度的标准溶液进行核酸提取,获得对应的核酸样品,将实施例4制得的终浓度4ng/ml trfm-sa和终浓度20nm bio-ssdna混合作为荧光探针,将20μl的核酸样品、50nm的cas12a核酸酶和100nm crrna组合(crrna1 4-q)和50μl的荧光探针混合均匀后室温孵育15min,缓慢滴入试纸条加样孔,37℃层析15min后用hg-98免疫定量分析仪记录试纸条的t线荧光值,每个浓度测定六个平行,设定菌活度为0cfu/ml加标样品溶液的t线荧光值为t0,其他加标样品溶液的t线荧光值为t,以耐药沙门氏菌的菌活度的对数值为横坐标,t/t0
×
100(%)为纵坐标绘制标准曲线,抑制率设为(1-t/t0)
×
100%。
[0120]
如图7可以看出,随着耐药沙门氏菌浓度的增大,试纸条t线条带上的荧光会越来越浅,所以t/t0会越来越小,如图7所示为t/t0随耐药沙门氏菌浓度的变化曲线,当耐药沙门氏菌的浓度为5.4
×
10
2-3.3
×
105时,耐药沙门氏菌浓度的对数值与t/t0成线性关系,线性方程为y=-22.532x 254.89,r2=0.9854,检测限lod可达到1.8
×
102cfu/ml。
[0121]
实施例8耐药沙门氏时间分辩荧光试剂盒的性能测试
[0122]
(1)精密度试验,以耐药沙门氏菌检测为例检测
[0123]
从同一批次内取出8个时间分辨免疫层析试剂盒分别检测阴性对照组(ph=6.7pbs)检测线处的荧光强度值(t0)和阳性试验组(耐药沙门氏菌104cfu//ml)t线处的荧光强度值(t)分析批内差异。通过8个不同批次的时间分辨免疫层析试剂盒分别检测阴性对照组(ph=6.7pbs)检测线处的荧光强度值(t0)和阳性试验组(耐药沙门氏菌104cfu/ml)t线处的荧光强度值(t)分析批间差异。由表2可知,通过变异系数计算公式分析得到t0、t和t/t0(%)的批内变异系数分别为3.36%、5.74%和2.81%,t0、t和t/t0(%)的批间变异系数分别为4.26%、5.80%和5.54%,表明该试剂盒的批内和批间变异系数小,精密度高,准确性好,基本符合定量检测试剂盒的要求。
[0124]
表2耐药沙门氏菌时间分辨试纸条的精密度检测结果
[0125][0126]
(2)准确度试验
[0127]
为了验证耐药沙门氏菌试纸条的准确性与灵敏度,对几种阴性乳及乳制品样本(生乳、巴士杀菌乳、酸奶、奶粉)分别进行加标回收试验,每种样本的添加浓度均设置高、
中、低三组不同的加标浓度,每组浓度梯度均设置三组平行试验。以加标回收率作为准确度评价指标,重复测定某一浓度样品的检测结果相对标准偏差(rsd%)作为精密度评价指标。加标回收率和相对标准偏差的计算公式如下:
[0128][0129][0130]
经确证为阴性的乳制品样本分别按照1
×
102、1
×
103、1
×
104cfu/ml三个浓度梯度进行耐药沙门氏菌加标回收实验。每个浓度重复10次,取t/t0的平均值并计算变异系数,结果如表1所示,测定结果cv均小于5.7%,表明在线性范围内,该试剂盒具有较好的准确性。本研究以含0.05%吐温-20的pbs溶液作为样品稀释液以确保该方法的性能。
[0131]
准确称量5g奶粉样品,加入40ml 60-80℃的超纯水,超声或者震荡待充分溶解,通过加热裂解法或称水提法提取样品dna用于免疫层析检测。
[0132]
准确吸取10ml巴士杀菌乳样品,6000rpm,4℃离心10min,取中下层液体,用含0.05%吐温-20的pbs稀释5倍后采用加热裂解法提取样品dna用于免疫层析检测。
[0133]
取适量生乳样品,可直接加样并通过加热裂解法提取样品dna用于免疫层析检测。
[0134]
表3时间分辨免疫层析试剂盒的准确度检测结果
[0135][0136]
由表3可知,将制备的时间分辨免疫层析试剂盒用于检测加标的牛奶样品中,最终得出牛奶的加标回收率在79.69%-128.74%之间,变异系数低于5.7%,表明制备的耐药沙门氏菌免疫荧光定量试剂盒能够用于现场快速筛查与检测。
[0137]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。