1.本发明涉及基因工程技术领域,具体而言,涉及一种重组载体质粒、水杨酸生物传感器及构建方法和应用。
背景技术:
2.水杨酸作为多环芳烃(pahs)代谢的中间产物,在多环芳烃的检测上具有重要的意义。多环芳烃是一类持久性有机污染物,广泛存在于环境中,具有半挥发性、生物累积性和环境持久性;同时具有致癌、致突变和致畸作用。目前常用的多环芳烃检测方法有着各种各样的不足,因此寻找一种简单快速、高效灵敏的方法迫在眉睫。
3.全细胞生物传感器已成为环境污染物监测分子工具中最新领域之一。由于微生物的低成本以及合适的ph和温度范围,已被广泛用作生物传感器的构造中的生物传感元件。全细胞生物传感器通过将应答启动子与报告基因进行组合,得到易被识别的信号。其中调控蛋白或启动子需要能够对待检测物的浓度变化做出响应,然后将信号转换成易于检测的报告蛋白信号。与环境污染物传统的化学和电子检测方法相比,全细胞微生物传感器具有成本低、体积小、可降解、分析速度快、可在线或原位分析等优点,在生物制造过程监控、环境监测与食品安全、医疗诊断与监护等领域有极高的应用价值。
4.pseudomonas putida g7是目前研究最为广泛的pahs降解菌株之一,多环芳烃经该菌株中上游基因簇可被氧化开环得到中间产物水杨酸,而nahr可将水杨酸作为该调控蛋白的效应物,通过易于被检测的报告基因得到信号,从而间接实现对pahs的检测。
5.但是目前生物传感法对多坏芳烃的检测在其敏感度方面性能不佳,仍未实现实际应用。
技术实现要素:
6.本发明所要解决的技术问题是提供一种重组载体质粒、水杨酸生物传感器及构建方法和应用。
7.本发明解决上述技术问题的技术方案如下:
8.本发明提供一种水杨酸生物传感器的重组载体质粒,包括改造的nahr蛋白的编码基因、pr启动子、报告标记蛋白的编码基因、改造的psal启动子及质粒骨架;所述pr启动子和所述改造的psal启动子方向相反;所述改造的nahr蛋白的氨基酸序列如seq id no.6所示;所述改造的psal启动子的核苷酸序列如seq id no.5所示。
9.进一步,所述pr启动子和所述改造的psal启动子的-35区核苷酸序列重叠。
10.进一步,所述报告标记蛋白为绿色荧光蛋白egfp,其氨基酸序列如seq id no.4所示。
11.进一步,所述质粒骨架为大肠杆菌高拷贝载体puc57。
12.本发明提供一种水杨酸生物传感器,包括宿主细胞及位于所述宿主细胞内的如上述的重组载体质粒;所述宿主细胞为大肠杆菌。
13.进一步,所述大肠杆菌为e.coli dh5α。
14.本发明提供一种如上述的水杨酸生物传感器的构建方法,包括以下步骤:
15.先构建含有野生型nahr蛋白的编码基因及野生型psal启动子的载体,再分别对所述野生型nahr蛋白的编码基因及所述野生型psal启动子进行改造,得到含有所述改造的nahr蛋白的编码基因和所述改造的psal启动子的重组质粒载体;最后将所述重组质粒载体转入宿主细胞,得到所述水杨酸生物传感器。
16.进一步,所述野生型psal启动子的核苷酸序列如seq id no.3所示,所述野生型nahr蛋白的氨基酸序列如seq id no.1。
17.本发明提供如上述的水杨酸生物传感器在检测水杨酸中的应用。
18.本发明提供一种水杨酸的检测方法,采用上述的水杨酸生物传感器进行检测。
19.本发明的有益效果在于:
20.(1)本发明的水杨酸生物传感器的重组载体质粒,含有改造的psal启动子;改造的psal启动子的-35区由ttatcaa变成ttgtca;-10区由tatcgt变成tataat,与野生型的psal启动子相比,具有更强的感应效果。
21.(2)本发明的水杨酸生物传感器的重组载体质粒,含有改造的nahr蛋白的编码基因,该编码基因编码的改造的nahr蛋白,169位点由谷氨酸变成甘氨酸,248位点由半胱氨酸变为苏氨酸,进一步提高了生物传感器对水杨酸的响应灵敏度。
22.(3)本发明水杨酸生物传感器,与传统的生物传感器相比,对水杨酸的相应灵敏度更高,降低了对水杨酸的检出限。
23.(4)本发明的水杨酸检测方法,采用本发明的水杨酸生物传感器进行检测,具有快速、便捷、准确、灵敏性高的优点。
附图说明
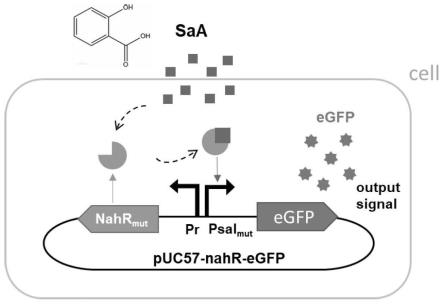
24.图1为本发明的水杨酸生物传感器的结构示意图;
25.图2为本发明的水杨酸生物传感器中,实施例2的突变体w10与野生型菌体在不同浓度的水杨酸的相对荧光强度;其中,横坐标为水杨酸的浓度,纵坐标为荧光强度和od
600
的比值;
26.图3为本发明的水杨酸生物传感器中,实施例3的突变体e169gc248t与仅含有改造的psal启动子的菌体在不同浓度的水杨酸的相对荧光强度;其中,横坐标为水杨酸的浓度,纵坐标为荧光强度和od
600
的比值。
具体实施方式
27.以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
28.本发明的水杨酸生物传感器的重组载体质粒,包括改造的nahr蛋白的编码基因、pr启动子、报告标记蛋白的编码基因、改造的psal启动子及质粒骨架;pr启动子和改造的psal启动子方向相反;改造的psal启动子的核苷酸序列如seq id no.5所示,改造的nahr蛋白的氨基酸序列如seq id no.6所示。
29.seq id no.5:
30.tatttgtcaatattgtttgctccgttataattattaacaagtcatcaataaagccatcacgagtaccatag
31.seq id no.6:
32.melrdldlnllvvfnqllvdrrvsitaenlgltqpavsnalkrlrtslqdplfvrthqgmeptpyaahlaepvtsamhalrnalqhhesfdpltsertftlamtdigeiyfmprlmdvlahqapncvistvrdssmslmqalqngtvdlavgllpnlqtgffqrrllqghyvclcrkdhpvtrepltlerfcsyghvrviaagtghgevdtymtrvgirrdirlevphfaavghilqrtdllatvpitladccvepfglsalphpvvlpeiainmfwhakyhkdlaniwlrqlmfdlftd*。
33.本发明的上述重组载体质粒中,改造的psal启动子和改造的nahr蛋白对水杨酸具有更加灵敏的响应。
34.如图1所示,优选的,本发明的重组载体质粒中,上述各基因片段的顺序为,改造的nahr蛋白的编码基因(nahr
mut
)、pr启动子、改造的psal启动子(psal
mut
)及报告标记蛋白的编码基因。优选的,pr启动子和改造的psal启动子的-35区核苷酸序列重叠,两者可共用-35区核苷酸序列。
35.pr启动子能够控制改造的nahr蛋白的编码基因转录,得到改造的nahr蛋白;水杨酸(saa)分子进入细胞并与改造的nahr蛋白结合,结合后的分子能够调控改造的psal启动子(psal
mut
),使报告标记蛋白的编码基因转录得到报告标记蛋白,报告标记蛋白发出信号,从而提示检测到水杨酸分子。
36.优选的,本发明的报告标记蛋白为绿色荧光蛋白egfp,其氨基酸序列如seq id no.4所示。
37.seq id no.4:
38.mvskgeelftgvvpilveldgdvnghkfsvrgegegdatngkltlkficttgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertisfkddgtyktraevkfegdtlvnrielkgidfkedgnilghkleynfnshnvyitadkqkngikanfkirhnvedgsvqladhyqqntpigdgpvllpdnhylstqsvlskdpnekrdhmvllefvtaagitlgmdelyk*
39.优选的,本发明的pr启动子为野生型,其核苷酸序列如seq id no.2所示。
40.seq id no.2:
41.tattgacaaatacaccactcgatatataataaatcatcaacatgaatattgcgcccggccgggcaccagcaataacccaagcgaggcccc
42.优选的,本发明的质粒骨架为大肠杆菌高拷贝载体puc57。
43.本发明的水杨酸生物传感器,包括宿主细胞及位于宿主细胞内的上述的重组载体质粒;宿主细胞为大肠杆菌。
44.优选的,大肠杆菌为e.coli dh5α。
45.如图1所示,本发明的水杨酸生物传感器的感应过程为,nahr转录调节因子能够特异性结合psal启动子区域,进而诱导激活报告标记蛋白的表达。
46.本发明的的水杨酸生物传感器的构建方法为,先构建含有野生型nahr蛋白的编码基因及野生型psal启动子的载体,再分别对所述野生型nahr蛋白的编码基因及所述野生型psal启动子进行改造,得到含有所述改造的nahr蛋白的编码基因和所述改造的psal启动子的重组质粒载体,最后将重组质粒载体转入宿主细胞,得到水杨酸生物传感器。
47.本发明构建方法中,具体的质粒载体构建过程、基因的改造以及转入宿主菌的方式均可采用常规的基因工程方法进行。
48.具体包括以下步骤:
49.(1)构建含有野生型nahr蛋白的编码基因及野生型psal启动子的第一载体质粒。
50.具体的,将野生型nahr蛋白的编码基因、所述pr启动子、报告标记蛋白的编码基因、野生型psal启动子连接在载体上并得到含有野生型psal启动子的第一载体质粒。
51.(2)改造野生型psal启动子;
52.根据野生型psal启动子的核苷酸序列设计psal点突变引物,以第一载体质粒为模板,采用点突变引物进行pcr扩增,使野生型psal启动子的核苷酸序列经过突变为改造的psal启动子的核苷酸序列,并得到含有改造的psal启动子的第二载体质粒。
53.(3)改造野生型nahr蛋白的编码基因。
54.根据野生型nahr蛋白的编码基因设计nahr点突变引物,制备nahr蛋白的编码基因的突变片段;再将突变片段通过同源重组连接至第二载体质粒上,得到重组载体质粒。
55.本发明所指的野生型nahr蛋白的编码基因,是根据文献(park hh,lee h y,lim w k,et al.nahr:effects of replacements at asn 169and arg 248on promoter binding and inducer recognition[j].archives of biochemistry&biophysics,2005,434(1):67-74.)报道n169e/r248c突变体显示出低本底和高诱导活性,因此合成序列时将该突变体nahr蛋白氨基酸序列作为出发氨基酸序列,即本发明的野生型nahr蛋白的编码基因。
[0056]
(4)将含有重组载体质粒转化到宿主细胞中,得到水杨酸生物传感器。
[0057]
本发明的上述构建方法中,对野生型psal启动子的改造和对野生型nahr蛋白的编码基因的改造的步骤顺序可以互换,只要最终获得的重组载体质粒上同时含有两者的改造基因即可。
[0058]
优选的,野生型psal启动子的核苷酸序列如seq id no.3所示,野生型nahr蛋白的氨基酸序列如seq id no.1。
[0059]
seq id no.3:
[0060]
tatttatcaatattgtttgctccgttatcgttattaacaagtcatcaataaagccatcacgagtaccatag。
[0061]
seq id no.4:
[0062]
melrdldlnllvvfnqllvdrrvsitaenlgltqpavsnalkrlrtslqdplfvrthqgmeptpyaahlaepvtsamhalrnalqhhesfdpltsertftlamtdigeiyfmprlmdvlahqapncvistvrdssmslmqalqngtvdlavgllpnlqtgffqrrllqehyvclcrkdhpvtrepltlerfcsyghvrviaagtghgevdtymtrvgirrdirlevphfaavghilqrtdllatvpicladccvepfglsalphpvvlpeiainmfwhakyhkdlaniwlrqlmfdlftd*
[0063]
本发明的水杨酸生物传感器可应用在对水杨酸的检测中。
[0064]
本发明的检测水杨酸的方法,采用上述的水杨酸生物传感器进行检测。
[0065]
具体而言,该水杨酸生物传感器可检测水溶液中的水杨酸含量。将该水杨酸生物传感器加入待测的水溶液中,通过测量水杨酸传感器的荧光强度,可以定性或定量的检测该水溶液中的水杨酸含量情况。
[0066]
下面通过具体实施例对本发明做进一步的阐述,以期更好的理解本发明,但并不
构成对本发明的限制。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0067]
实施例1构建含有野生型psal启动子的第一载体质粒
[0068]
将野生型nahr蛋白的编码基因、pr启动子、报告标记蛋白的编码基因、野生型psal启动子连接在载体上并得到含有野生型psal启动子的第一载体质粒。
[0069]
其中,野生型nahr蛋白的氨基酸序列如seq id no.1所示,pr启动子的核苷酸序列如seq id no.2所示,psal启动子的核苷酸序列如seq id no.3所示。
[0070]
具体的,将上述序列由生工生物合成并构建在puc57载体上,得到载体puc57-kanr-pr-nahr-psal。
[0071]
以pdg1730-egfp质粒为模板进行pcr,使用如seq id no.7和seq id no.8所示的引物进行pcr扩增。
[0072]
egfp-f:5’tcggatcccggatggtgagcaagggcg3’(seq id no.7);
[0073]
egfp-r:5’agtcgacgggccaaaaaacccctcaagacccg3’(seq id no.8)。
[0074]
pcr反应体系:
[0075][0076]
pcr反应条件:98℃预变性30s,然后98℃变性10s,55℃退火5s,72℃延伸5s,25个循环,最后72℃延伸30s。
[0077]
将得到的pcr产物用0.7%琼脂糖凝胶电泳检测产量和特异性,并用dna纯化试剂盒纯化。再用bamhι和salι双酶切处理载体puc57-kanr-pr-nahr-psal和egfp片段,并将两者进行酶连接。
[0078]
其中,酶切体系为,回收产物:25μl,buffer:5μl,bamh i:1.5μl,sal i:1.5μl,加水至50μl,37℃水浴,酶切2个小时,胶回收后进行酶连接。
[0079]
酶连接体系如下:处理后的片段3μl,处理后的载体1μl,buffer 0.5μl,solutioni连接酶0.5μl,混合均匀后在22℃连接两个小时。
[0080]
然后,将连接产物转入e.coli dh5α感受态细胞中,得到puc57-kanr-pr-nahr-psal-egfp,测序验证正确,完成第一载体质粒的构建。
[0081]
实施例2:psal启动子的改造
[0082]
启动子的强度直接影响报告基因的转录水平,动态范围主要由启动子的-35和-10位点的序列控制。
[0083]
本发明的水杨酸生物传感器中,将psal启动子的-35区的ttatcaa变成ttgtca;-10区tatcgt变为tataat,具体的改造过程如下:
[0084]
根据野生型psal的核苷酸序列设计如seq id no.9和seq id no.10所示的psal点
突变引物,以实施例1中得到的第一载体质粒puc57-kanr-pr-nahr-psal-egfp为模板进行pcr扩增。
[0085]
psal-f:5’tgtcaatattgtttgctccgttaaattattaac3’(seq id no.9);
[0086]
psal-r:5’ataattataacggagcaaacaatattgacaaatac3’(seq id no.10)。
[0087]
pcr反应体系:
[0088][0089]
pcr反应条件:98℃预变性30s,然后98℃变性10s,55℃退火5s,72℃延伸25s,25个循环,最后72℃延伸30s。
[0090]
将得到的pcr产物用0.7%琼脂糖凝胶电泳检测产量和特异性,并用dna纯化试剂盒纯化。将纯化后的pcr产物用dpni进行去甲基化,体系为,回收产物:25μl;dpnι:1μl;buffer:5μl;加水至50μl;37℃水浴锅中处理两个小时后80℃加热10min使dpnι酶灭活。
[0091]
去甲基化后,将溶液回收至10μl,取3-5μl转化到e.coli dh5α克隆感受态细胞中,挑选两个转化子进行测序,得到正确点突变的重组载体,即为含有改造的psal启动子的第二载体质粒。
[0092]
然后将第二载体质粒转入e.coli dh5α感受态细胞,之后长出的转化子在平板上划线即为含有第二载体质粒的突变体菌体,将其命名为w10。
[0093]
挑取单个菌落,用终浓度为0、10、20、50、100μm的水杨酸诱导10h,使用多功能酶标仪测定其相对荧光强度,其中设定激发波长为488nm,发射波长为511nm,同时测量菌体od
600
值,将荧光强度和od
600
的比值作定义为相对荧光强度的数值。
[0094]
测量结果如图2所示,结果发现,含有改造的psal启动子(psal mutant)的突变体菌体w10感应水杨酸的下限提高到了20μm,且与野生型(wt)相比,用100μm水杨酸诱导时,感应效果增强4倍。
[0095]
本实施例的测量结果说明,本发明的改造后的psal启动子能够有效提高生物传感器对水杨酸的感应效果。
[0096]
实施例3:转录调控因子nahr蛋白的改造及其效果的验证
[0097]
本实施例在实施例2得到的第二载体质粒的基础上继续对nahr蛋白进行改造。
[0098]
转录因子包含配体结合域和dna结合域两大功能域,与配体和dna直接相互作用,从而间接影响rna聚合酶的结合,在全细胞微生物传感器中发挥着关键作用。因此,通过随机/点饱和突变、理性设计等蛋白质工程手段改造转录因子可有效改变其与配体以及dna的亲和力,从而调节全细胞微生物传感器的传感性能参数。
[0099]
nahr蛋白的n169位点和r248位点可能与dna以及诱导物的识别与结合有关。因此对169和248位点做两点组合突变体库,再通过高通量筛选,在突变体库中筛选出传感效率
最强的突变体。
[0100]
具体包括以下步骤:
[0101]
1)、169/248饱和突变体库构建方法:
[0102]
首先,制备含169-248突变片段。
[0103]
根据野生型nahr蛋白的编码基因上的169位点及248位点设计一对引物,并在在突变的氨基酸位置以nnk简并密码子进行编码设计。其中,前引物设计包含169位点突变,后引物设计包含248位点突变。
[0104]
采用上述引物并以实施例2得到的第二载体质粒puc57-kanr-pr-nahr-psal-egfp为模板,进行pcr扩增,得到含有169和248位点突变的基因片段169-248,跑胶验证大小后正确后,做胶回收。
[0105]
其中,根据野生型nahr的核苷酸序列设计点突变引物对如seq id no.11和seq id no.12所示,其中,s为g或c,n为任意碱基。
[0106]
1-f:5’gcagcagtccgccagsnngatcggaacggtcgccagcag3’(seq id no.11);
[0107]
2-r:5’cgccgtctgctgcagnnscactacgtttgcctgtgccg3’(seq id no.12)。
[0108]
pcr反应体系为:
[0109][0110]
pcr反应条件:98℃预变性30s,然后98℃变性10s,55℃退火5s,72℃延伸5s,25个循环,最后72℃延伸30s。
[0111]
得到的pcr产物用0.7%琼脂糖凝胶电泳检测产量和特异性,并用dna纯化试剂盒纯化。
[0112]
制备含有改造的nahr蛋白的基因的重组载体质粒:将突变片段通过同源重组连接至第二载体质粒上,得到重组载体质粒,引物如seq id no.13和seq id no.14所示:
[0113]
2-f:5’ctgcagcagacggcgctggaagaagccggtctg3’(seq id no.13);
[0114]
2-r:5’ctggcggactgctgcgttgaaccgttcggtc3’(seq id no.14)。
[0115]
具体步骤为:以第二载体质粒为模板和上述引物进行pcr扩增,并且也要进行dpni去模板处理,引物设计需要注意的是与片段有20bp同源臂。方法和体系与实施例2中的dpni去甲基化过程一致。然后通过同源重组将载体和片段连接,连接体系:5
×
ce ii;buffer:1μl;exnase ii:1μl;线性化片段与载体摩尔浓度比为2:1;72℃连接30min;之后将连接产物转入e.coli dh5α克隆感受态细胞中,得到的转化子细胞大约有1400个。
[0116]
理论上,nahr蛋白的169和248两个位点突变体库应该有400个突变体;实际得到1400个左右,大概是理论值的三倍,说明文库的量足够覆盖所有突变组合。
[0117]
然后随机挑选10个转化子抽提质粒测序,当9个质粒中含有169/248位点的突变氨
基酸,且均不一致时,该突变体库构建成功,该突变体库即为169/248位点的饱和突变体库。
[0118]
2)、在得到的饱和突变体库里筛选灵敏度高的突变体:
[0119]
将平板上所有的转化子用无菌水洗下,选择合适的稀释梯度,涂布到0.1mm水杨酸固体平板上,37℃培养过夜,用蓝光仪挑选出荧光强度高的转化子,然后用终浓度为100μm水杨酸诱导,37℃,200rpm振荡培养10h。
[0120]
通过酶标仪测定其荧光值进行复筛,得到灵敏度高的突变体。
[0121]
通过生工测序发现,得到的灵敏度高的突变体中,nahr蛋白的169位点已由谷氨酸变成甘氨酸,248位点已由半胱氨酸变为苏氨酸。将该突变体命名为e169g/c248t。
[0122]
根据169位点为甘氨酸、248位点为苏氨酸,可以设计用于改造nahr蛋白的引物,如序列seq id no.15、seq id no.16、seq id no.17和seq id no.18所示:
[0123]
169位点定点突变引物:
[0124]
169-f:5’gtctgctgcaggggcactacgtttgcctg3’(seq id no.15);
[0125]
169-r:5’gtagtgcccctgcagcagacggcgctggaag3’(seq id no.16)。
[0126]
248位点定点突变引物:
[0127]
248-f:5’tccgatcaccctggcggactgctgcg3’(seq id no.17);
[0128]
248-r:5’agtccgccagggtgatcggaacggtcgc3’(seq id no.18)。
[0129]
将含有改造的nahr蛋白和改造的psal启动子的突变体e169g/c248t与含有野生型nahr蛋白和改造的psal启动子的菌体(psal mutant)分别进行菌体od
600
值测量,并计算荧光强度和od
600
的比值作定义为相对荧光强度的数值相比具有明显增强的水杨酸酸响应灵敏度。
[0130]
测量的结果如图3所示。通过图3可以看出,突变体e169g/c248t在0~1μm水杨酸浓度下表现出更加优良的线性响应关系。
[0131]
因此,含有改造的nahr蛋白和改造的psal启动子的水杨酸生物传感器对水杨酸的响应灵敏度显著的优于仅含有改造的psal启动子的水杨酸生物传感器。
[0132]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。