1.本发明属于生物工程技术领域,具体地讲,涉及一种质粒重组单核细胞增多性李斯特菌及其构建方法和应用。
背景技术:
2.动物源细菌的抗生素抗性相当严重,已引发动物生产安全风险和公关卫生安全风险,弄清抗生素抗性基因的来源和传播途径是防控动物源细菌抗生素抗性的前提 (holmes ah,moore l s p and sundsfjord a,et.al.2016.understanding themechanisms and drivers of antimicrobial resistance.the lancet,387,176-87)。肠道是细菌的主要储存场所。因此,动物粪便中的耐药菌是研究动物源细菌耐药性的主要对象。细菌耐药表型的遗传基础是细菌所携带的抗生素抗性基因。抗生素抗性基因依其定位,可分为质粒介导和染色体介导两种类型,其中,质粒介导的抗性基因可在同种或不同种细菌之间进行水平传播,其危害性和传播性都很强,是细菌耐药性研究的重点。然而,肠道粪便中的细菌种类众多,且存在特性差异(如革兰阳性和革兰阴性、厌氧和好氧、可培养和未可培养等),使用常规的细菌培养分离鉴定方法获得抗性质粒,不仅工作量巨大,而且导致很多遗漏。采用组学
‑‑‑
质粒组学的策略,则可以更全面地覆盖粪便样品中的细菌所携带的抗性质粒,而且还可以更方便地发现新的抗性质粒。
3.已有很多商品化的细菌质粒dna提取试剂盒,但都是用于纯菌的质粒提取,还没有用于粪便这样复杂样品中的细菌质粒提取的试剂盒。而且,已有的用于纯菌的质粒dna提取试剂盒通常使用过柱的方法去除杂质,这会降低质粒dna的提取率,而质粒dna的提取率是准确反映粪便样品中细菌质粒多样性的一个关键因素。
4.因此,为了研究动物粪便中的细菌抗性质粒组,建立一种粪便样品中细菌质粒的提取方法至关重要。
技术实现要素:
5.为了解决上述问题,本发明先将绿色荧光蛋白gfp基因克隆到pksv7质粒上得到重组质粒pksv7-gfp。然后将重组质粒pksv7-gfp电转化lm后,得到质粒重组单核细胞增多性李斯特菌lm-gfp。结果发现,本发明的质粒重组单核细胞增多性李斯特菌lm-gfp作为内标菌用于检测动物粪便中的细菌质粒组dna提取率具有特异性,实现了对动物粪便中细菌质粒组dna提取率的计算和提取过程的监测。因此,本发明的第一个目的是提供一种质粒重组单核细胞增多性李斯特菌,保存于中国典型培养物保藏中心,保藏编号为cctcc no:m20211306,listeria monocytogenescctcc-lm1055。本发明的第二个目的是提供一种质粒重组单核细胞增多性李斯特菌的构建方法。本发明的第三个目的是提供一种质粒重组单核细胞增多性李斯特菌作为内标菌的应用,用于评估质粒的提取率。本发明的第四个目的是提供一种从动物粪便样品中提取细菌质粒dna的提取方法。
6.为实现上述目的,本发明采用以下技术方案:
7.作为本发明的第一个方面,一种质粒重组单核细胞增多性李斯特菌,其所携带的质粒上克隆有绿色荧光蛋白基因gfp。
8.根据本发明,所述绿色荧光蛋白基因gfp的基因序列如seq id no.1所示。
9.根据本发明,所述质粒重组单核细胞增多性李斯特菌为listeria monocytogenescctcc-lm1055,保藏编号为cctcc no:m20211306。
10.作为本发明的第二方面,一种上述所述的质粒重组单核细胞增多性李斯特菌的构建方法,包括如下步骤:
11.步骤一、pcr扩增gfp基因,获得的pcr扩增产物与pksv7质粒连接获得重组质粒pksv7-gfp;
12.步骤二、将所述的重组质粒pksv7-gfp转化至单核细胞增多性李斯特菌,获得所述的质粒重组单核细胞增多性李斯特菌lm1055,
13.其中,用于pcr扩增的反应体系中包括gfp基因和扩增引物对,gfp基因的序列如seq id no.1所示,扩增引物对的序列分别如seq id no.2和seq id no.3所示。
14.根据本发明,步骤一的pcr扩增产物与pksv7质粒均通过kpnⅰ和bamhⅰ双酶切后,通过t4 dna连接酶进行连接反应,获得重组质粒pksv7-gfp。
15.作为本发明的第三个方面,一种上述所述的质粒重组单核细胞增多性李斯特菌用作内标菌的应用。
16.根据本发明,所述的质粒重组单核细胞增多性李斯特菌在作为从动物粪便中提取细菌质粒组dna中的内标菌中的应用。
17.根据本发明,所述质粒重组单核细胞增多性李斯特菌的应用,其在用于计算和/ 或监测动物粪便中的细菌质粒组dna的提取率中的应用。
18.作为本发明的第四个方面,一种从动物粪便样品中提取细菌质粒dna的提取方法,包括如下步骤:
19.1)将上述所述的质粒重组单核细胞增多性李斯特菌与动物粪便混合,裂解提取并得到细菌质粒组dna;
20.2)检测所提取质粒组dna中gfp基因的拷贝量,计算得到粪便样品中细菌质粒组dna的提取率。
21.根据本发明,步骤1)中,以动物粪便的总质量为基准计,所述的质粒重组单核细胞增多性李斯特菌的添加量为1
×
107cfu/g;
22.和/或,步骤2)中,gfp基因的拷贝量采用荧光定量pcr检测,采用的pcr引物的序列分别如seq id no.4所示序列和seq id no.5所示。
23.根据本发明,步骤1)的混合质粒重组单核细胞增多性李斯特菌与动物粪便后,还包括如下步骤:
24.(1)均质处理;滤膜过滤,过滤液离心,收集沉淀a;
25.(2)沉淀a与溶菌酶在缓冲液中作细胞壁裂解反应,固液分离,收集沉淀b;
26.(3)沉淀b与sds、醋酸钾和rnase a在缓冲液中进行裂解、凝聚,固液分离,收集质粒组dna粗提物上清液;
27.(4)粗提物上清液用苯酚、氯仿和异戊醇纯化后,用异丙醇沉淀,沉淀用无水乙醇洗涤后,灭菌水溶解,获得纯化的质粒组dna溶液。
28.本发明的质粒重组单核细胞增多性李斯特菌,其有益效果在于:其质粒上克隆了 gfp基因。可以作为内标菌从动物粪便中提取细菌质粒组dna。且作为内标菌检测粪便中的细菌质粒组dna提取率具有特异性。
29.本发明的从动物粪便中提取细菌质粒组dna的提取方法,其有益效果是:该方法通过将sds、溶菌酶、醋酸钠、苯酚、氯仿和异丙醇等化学及生物方法组合,使动物粪便中不同的细菌细胞破裂并使质粒dna充分释放暴露出来,质粒dna提取率达75%以上,提取的细菌dna的od260/od280可达到1.80,od260/od230可达到2.0,纯度比较高,可用于后续分子生物学研究。
附图说明
30.图1为本发明的实施例1中的gfp基因的pcr扩增产物的电泳图。其中,图1 中的m为标准dna分子量,2为阴性对照;3为gfp基因扩增产物。
31.图2为本发明的实施例1中的重组质粒上的gfp基因测序波形图的截图。
32.图3为本发明的实施例2中的猪粪便样品中提取的质粒组dna电泳图。其中,图3中的1为粪便样品1中提取的质粒组dna;2为粪便样品2中提取的质粒组dna; 3为粪便样品3中提取的质粒组dna。
33.图4为本发明的实施例2中的实时荧光定量pcr标准曲线图。
34.菌种保藏说明
35.本发明构建得到的质粒重组单核细胞增多性李斯特菌(listeria monocytogenescctcc-lm1055)已于2021年10月22日提交中国典型培养物保藏中心(地址:中国.武汉.武汉大学)保藏,保藏编号为cctcc no:m20211306。
具体实施方式
36.下面结合具体实施例,进一步阐述本发明。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
37.粪便样品成分复杂,从中提取细菌质粒组dna,目前无法确定细菌质粒dna的提取率,而细菌质粒dna提取率的高低会影响质粒组的覆盖度。因此,需要添加内标菌以检测细菌质粒组dna的提取率。
38.细菌可分为革兰阳性菌和革兰阴性菌,革兰阳性菌的细胞壁坚韧,提取质粒dna 比较困难;而阴性菌则容易得多。因此,能够提取阳性菌质粒dna的方法通常都可以提取阴性菌质粒dna,反之,则不行。因此,本发明选择单核细胞增多性李斯特菌(lm)这个革兰阳性菌为亲本构建了内标菌,以确保提取方法对阳性菌和阴性菌均适用。
39.由于粪便中也存在lm,直接使用lm作为内标菌是不行的,因此必需对该菌进行标记,使其携带动物粪便中没有的基因,标记后的内标菌就有别于粪便中原来可能含有的lm和其他细菌。
40.将绿色荧光蛋白gfp基因克隆到pksv7质粒上得到重组质粒pksv7-gfp。pksv7为大肠杆菌-李斯特菌穿梭质粒,即该质粒既可以在大肠杆菌中复制,也可以在lm中复制,且分
别表现氨苄青霉素抗性和氯霉素抗性。因此,重组质粒pksv7-gfp 电转化lm后,得到质粒重组单核细胞增多性李斯特菌lm-gfp。通过研究发现,本发明的质粒重组单核细胞增多性李斯特菌lm-gfp作为内标菌用于检测动物粪便中的细菌质粒组dna提取率具有特异性,实现了对动物粪便中细菌质粒组dna提取率的计算和提取过程的监测。
41.1、生物材料来源
42.(1)脑心浸液肉汤(bhi液体培养基)(400ml)配制如下:bhi粉末14.8g,溶解于400ml蒸馏水中,转移至试剂瓶中,121℃灭菌15min。
43.(2)脑心浸液琼脂(bhi固体培养基)(400ml)配制如下:称取bhi粉末14.8 g、琼脂粉6g,搅拌溶解于400ml蒸馏水中,121℃灭菌15min,冷却至50℃,倒入无菌培养皿,冷却至凝固。
44.(3)bhi高渗液体培养基(400ml)配制如下:bhi粉末14.8g、蔗糖68.46g,溶解于400ml蒸馏水中,115℃高压蒸汽灭菌30min。
45.(4)甘油高渗溶液(400ml)配制如下:蔗糖68.46g、40ml甘油,用蒸馏水定容至400ml,115℃高压蒸汽灭菌30min。
46.(5)单核细胞增多性李斯特菌株lm1073,可通过上海交通大学获得。
47.实施例1重组单核细胞增多性李斯特菌的构建
48.本实施例1中,扩增gfp基因并与载体pksv7连接得到重组质粒pksv7-gfp,然后将重组质粒pksv7-gfp转化至单核细胞增多性李斯特菌株lm1073,获得质粒重组单核细胞增多性李斯特菌。获得的质粒重组单核细胞增多性李斯特菌保存于中国典型培养物保藏中心,保藏编号为cctcc no:m20211306,listeria monocytogenescctcc-lm1055。
49.具体步骤如下:
50.1、gfp基因的扩增
51.根据全长gfp基因,设计pcr扩增引物p1和p2,引物序列见表1。采用takara 公司的primestar gxlpremix试剂盒,获得pcr扩增产物。
52.pcr的反应体系见表2,其中,dna模板为seq id no.1所示的gfp基因。
53.pcr反应程序见表3。
54.本实施例的全长gfp基因为优化后的绿色荧光蛋白基因,其基因序列如seq idno.1所示。
55.全长gfp基因的pcr扩增产物的琼脂糖凝胶电泳图见附图1。
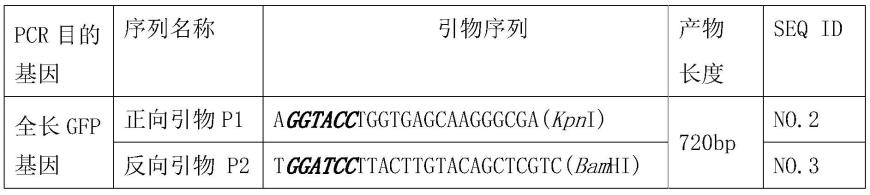
56.表1 pcr引物序列
[0057][0058]
表2 pcr的反应体系
[0059]
体系所含物加入体积/μltemplate dna(dna模板)1
forward primer p1(正向引物p1)1reverse primer p2(反向引物p2)12
×
pcr mix10ddh2o7总体积20
[0060]
表3 pcr反应程序
[0061][0062]
2、重组质粒pksv7-gfp的构建
[0063]
2.1酶切反应
[0064]
采用限制性内切酶kpnⅰ和bamhⅰ双酶切步骤1获得的pcr扩增产物以及 pksv7质粒。pcr扩增产物的酶切体系:kpnⅰ1μl、bamhⅰ1μl、pcr扩增产物2μl、酶切缓冲液5μl、超纯水41μl,共50μl,37℃水浴15min,分别胶回收后,供连接使用。pksv7质粒的酶切体系:kpnⅰ1μl、bamhⅰ1μl、pksv7质粒2μl、酶切缓冲液5μl、超纯水41μl,共50μl,37℃水浴15min,分别胶回收后,供连接使用。
[0065]
2.2连接反应
[0066]
将步骤2.1经双酶切后的pcr扩增产物和pksv7质粒,通过t4 dna连接酶进行连接反应,得到连接产物。
[0067]
连接反应:酶切后的pcr扩增产物5μl、酶切后的pksv7质粒2μl、t4 dna 连接酶1μl、连接缓冲液2μl,共10μl,置于pcr仪,22℃恒温反应30min。
[0068]
2.3筛选阳性克隆菌株,测序
[0069]
将步骤2.2得到的10μl连接产物加入50μl dh5α感受态细胞,冰浴30min。42℃热激90秒,冰浴2min。转至1ml lb液体培养基,37℃摇床,振荡培养60min。取100μl涂布含100μg/ml氨苄青霉素的lb平板,37℃温箱培养18小时。
[0070]
挑取lb平板上的菌落,制成菌悬液。使用正向引物p1和反向引物p2(见表1) 进行pcr鉴定,pcr阳性克隆抽提质粒并送上海生工公司测序。测序验证,测序正确的得到重组质粒pksv7-gfp。gfp基因测序波形图的部分截图见附图2。
[0071]
3、重组质粒pksv7-gfp电转化单核细胞增多性李斯特菌
[0072]
3.1感受态单核细胞增多性李斯特菌lm 1073的制备
[0073]
3.1.1从-80℃冰箱中取出lm 1073菌株,于bhi固体培养基上划线,置于37℃温箱培养。
[0074]
3.1.2挑单个克隆,接种5ml bhi液体培养基中,37℃温箱,培养过夜。
[0075]
3.1.3将菌液以1:100的体积比转接400ml bhi高渗液体培养基,37℃摇床,振荡培养3小时,至od600为0.2~0.25。
[0076]
3.1.4加入青霉素g(储存浓度:30mg/ml,工作浓度:6μg/ml)80μl,混匀,37℃摇床,振荡培养2小时,至od600为0.4~0.5。
[0077]
3.1.5于4℃,5000g,离心10min。弃上清,加入事先冰浴好的140ml甘油高渗溶液,轻轻振荡,悬浮沉淀。
[0078]
3.1.6于4℃,5000g,离心10min。弃上清,沉淀中加入40ml甘油高渗溶液,轻轻振荡,悬浮沉淀。
[0079]
3.1.7加入溶菌酶(储存浓度:10mg/ml,工作浓度:10μg/ml)400μl,混匀, 37℃摇床,100rpm振荡培养20min。
[0080]
3.1.8于4℃,3000g,离心10min。弃上清,加入16ml甘油高渗溶液,轻轻振荡,悬浮沉淀。
[0081]
3.1.9于4℃,5000g,离心10min。弃上清,加入1.2ml甘油高渗溶液,轻轻吹打,重悬沉淀。
[0082]
3.1.10分装所制备的感受态细胞lm 1073,每管100μl。-80℃冰箱保存备用。
[0083]
3.2重组质粒pksv7-gfp的电转化及筛选
[0084]
3.2.1提前10min将步骤3.1制备的lm 1073感受态细胞从-80℃冰箱取出,冰浴 10min,使其完全解冻。
[0085]
3.2.2将5μl实施例1得到重组载体pksv7-gfp与步骤3.2.1的lm 1073感受态细胞用移液枪轻轻混匀,冰上放置5min,得到混合物。
[0086]
3.2.3将步骤3.2.2的混合物移至电击杯,放入电转仪,进行电击转化,参数设定为:10kv/cm、40ω、25μf、7-8ms。
[0087]
3.2.4迅速将电击后的混合物移至预冷的1ml bhi高渗液体培养基中,轻轻混匀,冰上放置10min。然后,置30℃温箱,静置培养90min。取100μl涂布含有7.5μg/ml 氯霉素的bhi固体培养基平板,37℃温箱,培养30-40小时。
[0088]
3.2.5挑取单菌落,制成菌悬液,使用引物p1和p2(见表1)进行pcr鉴定。扩增产物送上海生工公司测序,序列正确的克隆保种备用,标记为重组单核细胞增多性李斯特菌,标记为lm-gfp(即lm1055),保藏编号为cctcc no:m20211306, listeria monocytogenes cctcc-lm1055。
[0089]
实施例2从猪粪便中提取细菌质粒组dna的方法
[0090]
本实施例中,采用实施例1制备的质粒重组单核细胞增多性李斯特菌lm-gfp 作为内标菌从猪粪便样品中提取细菌质粒组dna,包括如下步骤:
[0091]
1、细菌培养及细菌悬液制备
[0092]
将实施例1得到的质粒重组单核细胞增多性李斯特菌lm-gfp划线培养于bhi 平板上,挑取单克隆,接种于bhi液体培养基,置于28℃恒温振荡培养箱中振荡培养20h,得到lm-gfp菌液。将lm-gfp菌液进行连续10倍梯度稀释,共稀释9个梯度,每个梯度浓度的菌液取100μl,涂布氯霉素抗性的bhi固体培养基平板,每个浓度设置3个平行,计算获得lm-gfp菌液的浓度。并进一步将lm-gfp菌液的浓度调整为1
×
108cfu/ml。
[0093]
2、质粒组dna的提取
[0094]
(1)称取3头猪的粪便各1000mg,分别加入1
×
105、1
×
106、1
×
107cfu的上述质粒重组单核细胞增多性李斯特菌lm-gfp,再各加入10ml溶液1(50mm葡萄糖/25mm tris-cl/10mm edta,ph 8.0),漩涡器剧烈振荡悬浮;100μm滤膜过滤,收集过滤液;过滤物再次用5ml溶液1悬浮、振荡、过滤,合并两次过滤液; 10000rpm,4℃离心10min,收集沉淀a1、a2、a3。
[0095]
(2)上述沉淀a1、a2、a3分别用10ml溶液2(50mm葡萄糖/25mm tris-cl /10mm edta,ph 8.0,15mg/ml溶菌酶)振荡悬浮,55℃孵育30min,10000rpm, 4℃离心10min,收集沉淀b1、b2、b3。
[0096]
(3)上述沉淀b1、b2、b3分别用10ml溶液3(50mm葡萄糖/25mm tris-cl /10mm edta,ph 8.0,0.5-1.0mg/ml rnasea)悬浮,剧烈振荡。
[0097]
(4)步骤(3)振荡后的溶液中各加入20ml新鲜配制的溶液4(0.2m naoh, 1%sds),温和颠倒混匀,室温放置5-10min,至透明澄清。
[0098]
(5)步骤(4)获得的溶液中各加入15ml溶液5(3m醋酸钾,ph 4.8),温和颠倒混匀。
[0099]
(6)10000rpm,4℃离心10min,收集上清液a1、a2、a3。
[0100]
3、质粒组dna的纯化
[0101]
(1)步骤2所述的上清液a1、a2、a3中分别加入45ml溶液6(v
苯酚
:v
氯仿
:v 异戊醇
=25:24:1),剧烈振荡,10000rpm,4℃离心10min,收集上清液b1、b2、 b3。
[0102]
(2)所述的上清液b1、b2、b3中各加入等体积冰浴预冷的异丙醇,振荡混匀,冰浴10-30min,10000rpm,4℃离心10min,收集沉淀c1、c2、c3。
[0103]
(3)所述的沉淀c1、c2、c3分别用10ml无水乙醇振荡洗涤一次,10000rpm, 4℃离心10min,弃上清,收集沉淀d1、d2、d3,于室温晾干。
[0104]
(4)所述的沉淀d1、d2、d3分别用100μl灭菌水溶解,获得3个质粒组dna 溶液。
[0105]
4、质粒组dna的浓度和提取率测定
[0106]
利用nanodrop
tm
2000紫外分光光度计,分别测定在波长为280nm、260nm和 230nm处的吸光度(od260、od280和od230),计算od260/od280比值和 od260/od230比值。
[0107]
以提取的细菌质粒组dna为模板进行实时荧光定量pcr测定,以检测gfp基因的拷贝量,计算质粒组dna的提取率。提取率为提取的细菌质粒组dna中gfp基因的拷贝数与加入的质粒重组单核细胞增多性李斯特菌所含有的gfp基因的拷贝数的比值。
[0108]
从猪粪便样品中提取的细菌质粒组dna浓度、od260/od280比值、 od260/od230比值和提取率见表4。质粒组dna电泳图见附图3。
[0109]
表4细菌质粒组dna浓度、od260/od280比值、od260/od230比值和提取率
[0110][0111]
从表4结果可知,采用本发明的质粒重组单核细胞增多性李斯特菌作为内标菌从猪粪便中提取细菌质粒组dna时,od260/od280接近1.8且od260/od230约2.0,表明本发明的
方法提取的细菌质粒dna中的蛋白和碳水化合物的含量很低,dna浓度高,能用于后续的分子生物学研究;同时,本发明的方法从动物粪便中提取细菌质粒组dna的提取率可达到75%以上,表明本发明的方法检测的准确率、可靠性均比较高。
[0112]
5、标准曲线绘制
[0113]
利用nanodrop
tm
2000微量紫外分光光度计,同步骤4,测定重组质粒 pksv7-gfp的浓度,并计算质粒拷贝数,调整pksv7-gfp的拷贝数为5μl中含1
×
109拷贝。用灭菌水作10倍梯度稀释,共9个梯度,即9个定量pcr管中的5μl质粒溶液分别含101、102、103、104、105、106、107、108、109拷贝数的重组质粒pksv7-gfp。
[0114]
使用takara公司的tbpremix ex taq
tm
ii(tli rnaseh plus)荧光定量 pcr试剂盒,荧光定量pcr检测的具体操作如下:荧光定量pcr引物信息见表5,荧光定量pcr反应条件如表6,荧光定量pcr反应程序见表7。其中,dna模板为纯的、不同稀释浓度的pksv7-gfp质粒。
[0115]
图4为本实施例中实时荧光定量pcr标准曲线图。
[0116]
从图4可知,ct=-3.092lgc 39.247,相关系数r2=为0.996。
[0117]
表5定量pcr引物信息
[0118][0119][0120]
表6定量pcr反应条件
[0121]
体系所含物加入体积/μltemplate dna(dna模板)5forward primer p3(正向引物p3)0.8reverse primer p4(反向引物p4)0.810
×
sybr green i10参比染料rox0.4ddh2o3总体积20
[0122]
表7定量pcr反应程序
[0123][0124]
结果表明:采用该标准曲线可以计算质粒的回收率。
[0125]
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。