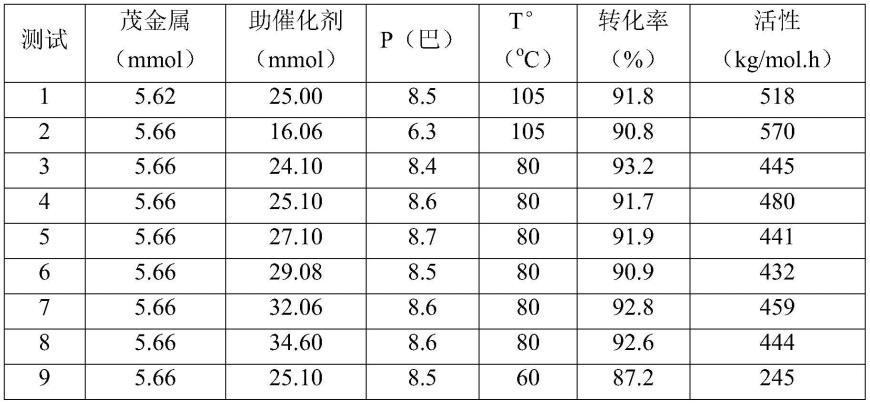
包含il-7变体的双功能分子
技术领域
1.本发明涉及免疫治疗领域。本发明提供了一种包含il-7变体的双功能分子。
背景技术:
2.白介素7是il-2超家族的免疫刺激细胞因子成员,通过促进免疫应答在适应性免疫系统中发挥重要作用。这种细胞因子通过t细胞和b细胞的存活和分化,淋巴细胞的存活,自然杀伤(nk)细胞活性的刺激来激活免疫功能。il-7还通过淋巴组织诱导(lti)细胞来调节淋巴结的发育,并促进初始t细胞或记忆t细胞的存活和分裂。此外,il-7通过促进il-2和干扰素-γ的分泌来增强人的免疫应答。il-7的受体是异二聚体,且由il-7rα(cd127)和共有的γ链(cd132)组成。γ链在所有造血细胞类型上表达,而il-7rα主要由淋巴细胞表达(包括b和t淋巴前体、初始t细胞和记忆t细胞)。相比于表达更高水平的效应/初始t细胞,在调节性t细胞上观察到il-7rα的低表达。因此,将cd127用作表面标志物以区分这两个群体。il-7rα也在先天性淋巴细胞nk和肠道相关淋巴组织(galt)衍生的t细胞上表达。il-7rα(cd127)链与tslp(肿瘤基质淋巴细胞生成素)共享,cd132(γ链)与il-2、il-4、il-9、il-15和白介素21共享。通过cd127/cd132的(1)janus激酶/stat通路(即jak-stat-3和5)和(2)磷酸肌醇-3激酶通路(即pi3k-akt)来诱导两条主要信号传导通路。il-7施用在患者中具有良好的耐受性,并导致cd8和cd4细胞扩增以及cd4 t调节性细胞的相对减少。已在临床上测试了重组裸il-7或与抗体fc的n端结构域融合的il-7,其原理是通过fc结构域的融合来增加il-7的半衰期并提高治疗的长期持续效率。
3.重组il-7细胞因子的药代动力学性质较差,限制了其在临床中的应用。注射后,重组il-7迅速分布和消除,导致在人体中(范围从6.8至9.5小时)(sportes等,clin cancer res.2010jan 15;16(2):727-35)或在小鼠中(2.5小时)(hyo jung nam等,eur.j.immunol.2010.40:351-358)il-7的糟糕的半衰期。igg fc结构域与il-7的融合延长了其半衰期,因为igg可以结合新生儿fc受体(fcrn)并参与分子的转胞吞作用和内体循环。观察到il-7fc融合分子的循环半衰期延长(t1/2=13h),在小鼠中施用后8天仍保持在可检测水平(200pg/ml)(hyo jung nam等,eur.j.immunol.2010.40:351-358)。尽管与fc结构域融合的il-7细胞因子的半衰期增加,但该分子需要频繁的体内注射才能产生生物学效应。在免疫细胞因子分子的情况下,细胞因子与抗体融合(例如,靶向癌抗原、免疫检查点阻断、共刺激分子等),以优先将细胞因子集中到靶向的抗原表达细胞。然而,il-7细胞因子对其cd127/cd132受体的亲和性(纳摩尔至皮摩尔范围)可能高于抗体对其靶点的亲和性。因此,由于靶点介导的药物处置(tmdd)机制,细胞因子将驱动产物的药代动力学,导致体内可用药物的快速消耗。已针对免疫细胞因子如il-2或il-15阐述了这种快速消除,表明融合蛋白的药代动力学性质可能直接影响药物性能(list et neri clin pharmacol.2013;5(suppl 1):29
–
45)。
4.因此,本领域仍然非常需要新的和改进的il-7变体,其允许改善il-7产物的分布并减少il-7产物的消除,特别是包含il-7的双功能分子。本发明已经在本文公开的发明方
面向前迈出了重要一步。
技术实现要素:
5.发明人提供了il-7突变和优化的fc骨架,以改善双功能分子的分布和消除,从而增强体内生物效应。发明人观察到il-7突变;特别是与igg同种型和接头长度结合使用时,允许双功能分子更好的分布和更长的体内半衰期。
6.本文提供的双功能分子特别显示出良好的体内药代动力学和药效学,特别是与包含il-7野生型的双功能分子相比。此外,有利的和预料不到的性质与这些新分子有关,如在具体实施方式的介绍中和在实施例中所详述的。
7.在第一个方面中,本发明涉及一种双功能分子,其包含与结合部分缀合的白介素7(il-7)变体,其中:
[0008]-所述结合部分结合至免疫细胞表面上特异性表达的靶点,
[0009]-所述il-7变体存在与野生型人il-7(wth-il-7)至少75%同一性,所述野生型人il-7包含或由seq id no:1所示的氨基酸序列组成,其中所述变体包含至少一个氨基酸突变,其i)与wth-il-7对il-7r的亲和性相比,降低所述il-7变体对il-7受体(il-7r)的亲和性,和ii)与包含wth-il-7的双功能分子相比,改善包含所述il-7变体的所述双功能分子的药代动力学。
[0010]
特别地,至少一个突变是选自以下的氨基酸取代或一组氨基酸取代:(i)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s,或者c47s-c92s和c34s-c129s,(ii)w142h、w142f或w142y,(iii)d74e、d74q或d74n,iv)q11e、y12f、m17l、q22e和/或k81r;或其任何组合(即,所述氨基酸编号如seq id no:1中所示)。
[0011]
特别地,本发明涉及双功能分子,其包含与结合部分缀合的白介素7(il-7)变体,其中:
[0012]-所述结合部分结合至免疫细胞表面上特异性表达的靶点,
[0013]-所述il-7变体存在与野生型人il-7(wth-il-7)至少75%同一性,所述野生型人il-7包含或由seq id no:1所示的氨基酸序列组成,其中所述变体包含至少一个选自以下的氨基酸突变:(i)w142h、w142f或w142y,(ii)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s或者c47s-c92s和c34s-c129s,(iii)d74e、d74q或d74n,iv)q11e、y12f、m17l、q22e和/或k81r;或其任何组合,所述氨基酸编号如seq id no:1中所示,其i)与wth-il-7对il-7r的亲和性相比,降低所述il-7变体对il-7受体(il-7r)的亲和性,和ii)与包含wth-il-7的双功能分子相比,改善包含所述il-7变体的所述双功能分子的药代动力学。
[0014]
在一个方面中,所述il-7变体包含选自以下的一组氨基酸取代:c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s以及c47s-c92s和c34s-c129s(即,所述氨基酸编号如seq id no:1中所示)。
[0015]
在另一个方面中,所述il-7变体包含选自以下的氨基酸取代:w142h、w142f和w142y(即,所述氨基酸编号如seq id no:1中所示)。
[0016]
在另一个方面中,所述il-7变体包含选自以下的氨基酸取代:d74e、d74q和d74n(即,所述氨基酸编号如seq id no:1中所示)。
[0017]
特别地,所述il-7变体包含或由seq id no:2-15中所示的氨基酸序列组成。
[0018]
在一个方面中,所述结合部分包含人igg1的重链恒定结构域,优选地fc结构域,其任选地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选地选自n297a任选地与m252y/s254t/t256e和l234a/l235a的组合。
[0019]
特别地,所述结合部分包含人igg4的重链恒定结构域,优选地fc结构域,其任选地具有选自以下的取代或取代的组合:s228p;l234a/l235a、s228p m252y/s254t/t256e.17和k444a。
[0020]
优选地,所述免疫细胞是t细胞,优选耗竭的t细胞。
[0021]
在一个方面中,所述靶点由t细胞表达,并且所述结合部分结合至选自以下的靶点:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8。
[0022]
优选地,所述靶点由t耗竭的细胞表达,并且所述结合部分结合至选自以下的靶点:pd-1、ctla-4、btla、tigit、lag3和tim3。
[0023]
在一个方面中,所述结合部分是抗体或其抗原片段,以及所述il-7变体的n末端融合至所述抗体或其抗体片段的重链或轻链恒定结构域的c末端,优选地融合至所述重链恒定结构域的c末端,任选地通过肽接头。
[0024]
在另一个方面中,所述il-7变体通过选自以下的肽接头融合至所述结合部分:ggggs(seq id no:68)、ggggsgggs(seq id no:67)、ggggsggggs(seq id no:69)和ggggsggggsggggs(seq id no:70),优选地是(ggggs)3(seq id no:70)。
[0025]
在一个方面中,所述分子包含第一单体,所述第一单体包含抗原结合结构域,所述抗原结合结构域通过c末端任选地通过肽接头共价连接至第一异二聚体fc链的n末端,所述第一异二聚体fc链通过所述c末端任选地通过肽接头共价连接至所述il-7变体的所述n末端,和第二单体,所述第二单体包含没有抗原结合结构域的互补的第二异二聚体fc链。优选地,在所述第二单体中,所述互补的第二异二聚体fc链任选地通过肽接头共价连接至所述il-7变体,优选地通过c末端任选地通过肽接头共价连接至所述il-7变体的n末端。
[0026]
在另一个方面中,所述分子包含第一单体,所述第一单体包含抗原结合结构域,所述抗原结合结构域通过c末端任选地通过肽接头连接至第一异二聚体fc链的n末端,所述第一异二聚体fc链没有il-7变体,和第二单体,所述第二单体包含没有抗原结合结构域的互补的第二异二聚体fc链,所述第二异二聚体fc链任选地通过肽接头共价连接至所述il-7变体,优选地通过c末端任选地通过肽接头连接至所述il-7变体的n末端。
[0027]
在另一个方面中,所述分子包含第一单体,所述第一单体包含抗原结合结构域,所述抗原结合结构域通过c末端任选地通过肽接头共价连接至第一异二聚体fc链的n末端,和第二单体,所述第二单体包含抗原结合结构域,所述抗原结合结构域通过c末端任选地通过肽接头共价连接至互补的第二异二聚体fc链的n末端,其中仅一条异二聚体fc链,优选地第一条,通过所述c末端共价连接至所述il-7变体的所述n末端。
[0028]
特别地,所述双功能分子的所述抗原结合结构域是fab结构域、fab’、单链可变片
段(scfv)或单域抗体(sdab)。
[0029]
优选地,所述抗原结合结构域包含或基本上由以下组成:(i)重链,其包含seq id no:51的cdr1、seq id no:53的cdr2和seq id no:55、56、57、58、59、60、61或62的cdr3;和(ii)轻链,其包含seq id no:64或seq id no:65的cdr1、seq id no:66的cdr2和seq id no:16的cdr3。
[0030]
特别地,所述抗原结合结构域包含或基本上由以下组成:
[0031]
(a)重链可变区(vh),其包含或由seq id no:18、19、20、21、22、23、24或25的氨基酸序列组成;
[0032]
(b)轻链可变区(vl),其包含或由seq id no:27或seq id no:28的氨基酸序列组成。
[0033]
优选地,所述抗原结合结构域包含或基本上由以下组成:seq id no:24的重链可变区(vh)和seq id no:28的轻链可变区(vl)。
[0034]
本发明还涉及分离的核酸序列或一组分离的核酸分子,其编码根据本发明的双功能分子。
[0035]
本发明还涉及一种宿主细胞,其包含根据本发明的分离的核酸。
[0036]
本发明还涉及一种药物组合物,其包含根据本发明的双功能分子、核酸或宿主细胞,以及任选地药学上可接受的载体。
[0037]
本发明最后涉及根据本发明的双功能分子、核酸、宿主细胞或药物组合物作为药物的用途,特别是用于治疗癌症或感染性疾病的药物的用途。
附图说明
[0038]
图1:pd-1结合elisa测定。将人重组pd-1(rpd1)蛋白固化并添加不同浓度的抗体。用与过氧化物酶偶联的抗人fc抗体进行揭示(revelation)。使用tmb底物在450nm处进行比色。a.pd-1与包含抗pd1抗体和在氨基酸d74、q22、m17、q11、k81上发生突变的il-7的双功能分子结合。b.pd-1与包含在氨基酸w142上发生突变的il-7的双功能分子结合。c.pd-1与在il-7的二硫键中发生突变(ss1、ss2和ss3突变体)的双功能分子结合。在该图中检测的所有分子均由igg4m同种型以及fc和il-7结构域之间的ggggsggggsggggs接头构建。
[0039]
图2:igg融合突变il-7的cd127结合elisa测定。将pd-1重组蛋白固化在板上,然后将功能抗pd-1il-7分子与cd127重组蛋白(组氨酸标记,sino ref 10975-h08h)与孵育并添加到孔中。用与生物素偶联的抗组氨酸抗体 与过氧化物酶偶联的抗生物素蛋白链菌素的混合物进行揭示。使用tmb底物在450nm处进行比色。a.cd127与包含在氨基酸d74、q22、m17、q11、k81上发生突变的il-7的双功能分子结合。b.cd127与包含在氨基酸w142上发生突变的il-7的双功能分子结合。
[0040]
图3:通过stat5磷酸化测量的不同双功能分子的il-7r信号转导通路。将从健康志愿者的外周血中分离的人pbmc与双功能抗pd-1il-7分子一起孵育15分钟。然后将细胞固定,透化并用af647标记的抗pstat5(克隆47/stat5(py694))染色。通过计算cd3 t细胞中的mfi pstat5获得数据。a.包含在氨基酸d74、q22、m17、q11、k81上发生突变的il-7的抗pd-1il-7双功能分子的pstat5激活。b.包含在氨基酸w142上发生突变的il-7的抗pd-1il-7双功能分子的pstat激活。c.包含在il-7的二硫键中发生突变的il-7的抗pd-1il-7双功能分
子的pstat5激活,ss2(
●
黑色)和ss3(
▲
)与抗pd-1il-7wt(
●
灰色)比较。在该图中检测的所有分子均由igg4m同种型以及fc和il-7结构域之间的ggggsggggsggggs接头构建。
[0041]
图4:抗pd-1il-7双功能分子在小鼠中的药代动力学。使用一剂igg融合的il-7野生型或突变的il-7对小鼠进行静脉内注射。在注射后的多个时间点通过elisa评估血清中分子的浓度。a.注射igg4-g4s3 il7 wt(
■
灰色);igg4-g4s3 il7 d74e(
●
黑色)。b.注射igg4-g4s3 il7 wt(
■
灰色)或igg4-g4s3 il7 w142h(
●
黑色)。c.注射igg4-g4s3 il7 wt(
■
灰色);igg4-g4s3 il7 ss2(
●
)或igg4-g4s3 il7 ss3(
▲
)。d.从每个分子的pk对ed50 pstat5(nm)计算的曲线下面积(auc)之间的相关性。在该图中检测的所有分子均由igg4m同种型以及fc和il-7结构域之间的ggggsggggsggggs接头构建。
[0042]
图5:在抗pd-1和il-7之间添加二硫键减少pstat5激活,但增加其在体内的药物暴露。a.在使用抗pd-1 il-7双功能分子wt(灰色
●
)或具有附加的二硫键的抗pd-1 il-7双功能分子(黑色
●
)处理后,在人pbmc上通过pstat5激活测量的il7r信号转导。b.抗pd-1 il-7双功能分子wt(灰色
●
)或具有附加的二硫键的抗pd-1 il-7双功能分子(黑色
●
)在小鼠中的药代动力学。使用一剂抗pd-1 il7双功能分子对小鼠进行静脉内注射。在注射后的多个时间点通过elisa评估血清中分子的浓度。在该图中检测的所有分子均由igg4m同种型以及fc和il-7结构域之间的ggggsggggsggggs接头构建。
[0043]
图6:pd-1结合elisa测定。将人重组pd-1(rpd1)蛋白固化并添加不同浓度的抗体。用与过氧化物酶偶联的抗人fc抗体进行揭示。使用tmb底物在450nm处进行比色。a.pd-1与具有igg4m的抗pd-1 il-7 wt双功能分子(
●
灰色),具有igg1m的抗pd-1 il-7 wt双功能分子(
▲
黑色),具有igg1m同种型的抗pd-1 il-7 d74e双功能分子(
■
)或具有igg1m的抗pd-1 il-7 w142h双功能分子(
◇
)的结合。b.在另一项实验中,测试了pd-1与具有igg4m同种型的抗pd-1 il-7 ss2双功能分子(
■
)或具有igg1m的抗pd-1 il-7 ss2双功能分子(
▲
)的结合。
[0044]
图7:使用igg1n298a或igg4同种型构建的抗pd-1 il-7双功能分子的cd127结合elisa测定。将抗体骨架靶向的重组蛋白固化,然后将与il-7融合的抗体与cd127重组蛋白(组氨酸标签,sino ref 10975-h08h)预孵育。用与生物素偶联的抗组氨酸抗体和与过氧化物酶偶联的抗生物素蛋白链菌素的混合物进行揭示。使用tmb底物在450nm处进行比色。a.cd127与具有igg4m同种型的抗pd-1 il-7 w142h双功能分子(
●
灰色),具有igg1m的抗pd-1 il-7 w142h双功能分子(
▲
黑色)或具有igg1m同种型的抗pd-1 il-7 wt双功能分子(
●
黑色)的结合。b.cd127与具有igg4m同种型的抗pd-1 il-7 ss2双功能分子(
●
灰色),具有igg1m的抗pd-1 il-7 ss2双功能分子(
▲
黑色)或具有igg1m的抗pd-1 il-7 wt双功能分子(
●
黑色)的结合。c.cd127与具有igg4m同种型的抗pd-1 il-7 ss3双功能分子(
●
灰色),具有igg1m的抗pd-1 il-7 ss3双功能分子(
▲
黑色)或具有igg1m的抗pd-1 il-7 wt双功能分子(
●
黑色)的结合。d.cd127与具有同种型igg1m(
●
黑色)或同种型igg1m yte(
●
灰色)的抗pd-1 w142h双功能分子的结合。还测试了cd127与具有同种型igg1m(
●
黑色)或同种型igg1m yte(
●
灰色)的抗pd-1 d74e双功能分子的结合。在该图中检测的所有分子均使用fc和il-7结构域之间的ggggsggggsggggs接头构建。
[0045]
图8:使用igg1n298a或igg4同种型构建的抗pd-1 il-7双功能分子的il-7r信号转导分析。使用抗pd-1 il7双功能分子孵育人pbmc或jurkat pd1 cd127 细胞15分钟。然后将
细胞固定,透化并用af647标记的抗pstat5(克隆47/stat5(py694))染色。通过计算cd3 t细胞中的pstat5%获得数据。a.使用具有突变d74e以及igg4m同种型(
●
灰色)或igg1m同种型(
▲
黑色)的双功能分子处理后在人pbmc上的pstat5信号转导。b.使用具有igg4m同种型(
●
灰色)的抗pd-1 il-7 ss2或具有igg1m(
▲
黑色)的抗pd-1il-7ss2处理后在人pbmc上的pstat5信号转导。c.使用具有igg4m同种型(
●
灰色)或igg1m(
▲
黑色)的抗pd-1 il-7 ss3处理后在人pbmc上的pstat5信号转导。d.(左图)使用利用igg4m(
●
灰色)或igg1m(
▲
黑色)同种型构建的抗pd-1 il-7 wt或抗pd-1 il7 ss2处理后在jurkat pd1 cd127 细胞上的pstat5信号转导。d.(右图)使用具有igg4同种型(
●
灰色)的抗pd-1 il-7 ss2或具有igg1m(
▲
黑色)的抗pd-1 il-7 ss2处理后的pstat5信号转导。
[0046]
图9:抗pd-1il-7突变双功能分子在体外增强t细胞活化。promega pd-1/pd-l1生物测定:将(1)效应t细胞(稳定表达pd-1,nfat诱导的荧光素酶的jurkat)与(2)激活的靶细胞(稳定表达pdl1和表面蛋白的cho k1细胞,将其设计为以不依赖于抗原的方式活化同源tcr)共培养。在添加bioglo
tm
荧光素后,对发光进行定量并反映t细胞活化。测试了抗pd1抗体 /-重组il-7(ril-7)或抗pd1il7双功能分子的系列摩尔浓度。每个点代表一个实验的ec50。a.具有igg4m同种型的抗pd-1 il-7 wt双功能分子(
●
灰色)或抗pd-1(
▲
)或抗pd-1 ril-7(
○
)的nfat激活。b.抗pd-1 il-7 d74e igg4m(
●
),pd-1 il-7 d74e igg1m(
▲
虚线)和单独的抗pd-1(黑色
▲
)的nfat激活。c.具有igg4m的抗pd-1 il-7 w142h双功能分子(
●
),具有igg1m的pd-1 il-7 w142h双功能分子(
▲
虚线)和单独的抗pd-1(黑色
▲
)的nfat激活。d.具有igg4m的抗pd-1 il-7 ss2双功能分子(
●
)和和单独的抗pd-1(黑色
▲
)的nfat激活。
[0047]
图10:使用igg1m或igg4m同种型构建的抗pd-1il-7双功能分子的药代动力学。使用一剂与il-7野生型或突变的il-7融合的igg对小鼠进行静脉内注射。在注射后的多个时间点通过elisa评估血清中的药物浓度。a.具有igg4m的抗pd-1 il-7 wt双功能分子(
●
灰色实线),具有igg1m的抗pd-1 il-7 wt双功能分子(
●
灰色虚线),具有igg1m的抗pd-1 il-7 d74e双功能分子(
▲
黑色虚线),具有igg4m的抗pd-1 il-7 w142h双功能分子(
○
黑色实线),具有igg1m的抗pd-1 il-7 w142h双功能分子(
●
黑色实线),具有igg4的抗pd-1 il-7 ss3(
■
实线)和具有igg1m的抗pd-1 il-7 ss3(
■
虚线)的药代动力学。b.具有igg1m的抗pd-1 il-7 d74e、d74q、w142h、d74e w142h突变双功能分子的药代动力学。
[0048]
图11:使用igg1 n298a k444a同种型构建的抗pd-1 il-7双功能分子的药代动力学。使用一剂具有同种型igg1n298a(
■
)或同种型igg1m k444a突变同种型(
●
)的抗pd-1il7 d74e双功能分子静脉内注射小鼠。在注射后的多个时间点通过elisa评估抗体浓度。
[0049]
图12:接头长度不会显著影响药代动力学,但会降低对il-7r信号转导的刺激。a.使用不同接头(ggggs)、(ggggs)2、(ggggs)3构建的抗pd-1 il-7 wt双功能分子的药代动力学。b.使用不同接头(ggggs)、(ggggs)2、(ggggs)3构建的抗pd-1 il-7 d74双功能分子的药代动力学。c.使用不同接头(ggggs)2、(ggggs)3构建的抗pd-1 il-7 w142h双功能分子的药代动力学。使用一剂与il-7野生型或突变的il-7融合的igg对小鼠进行静脉内注射。在注射后的多个时间点通过elisa评估与il-7融合的igg的浓度。d.不使用接头或使用(ggggs)、(ggggs)2、(ggggs)3接头构建的抗pd-1 il-7双功能分子的pstat5信号转导。
[0050]
图13:抗pd-1 il-7突变体相较于pd-1-cd127 细胞优先靶向pd-1 cd127 细胞。将
表达cd127 或共表达cd127 和pd-1 的jurkat细胞,使用45nm的抗pd-1 il-7双功能分子染色,并用抗igg-pe(biolegend,克隆hp6017)进行揭示。数据表示pd-1 cd127 jurkat细胞上的中位荧光与pd1-细胞cd127 jurkat细胞上获得的中位荧光的比值。在该测定中,检测了抗pd-1 il-7 wt双功能分子igg1m,抗pd-1 il-7 d74e双功能分子igg1m,抗pd-1il-7w142h双功能分子igg1m,抗pd-1 il-7 ss2双功能分子igg4m,抗pd-1 il-7 ss3双功能分子igg1m。
[0051]
图14:在共培养测定中抗pd-1 il-7突变体相较于pd-1-cd127 细胞优先靶向pd-1 cd127 细胞。a.在仅使用cd127或者使用cd127和pd-1受体两者转导的cho细胞中通过流式细胞术分析的人cd127和人pd-1的表达。b.在共培养测定中在表达cd127 或共表达cd127 和pd-1 的cho细胞上抗pd-1 il-7突变体的结合。使用细胞增殖染料(cpde450或cpde670)对细胞进行染色,然后在与不同浓度的抗pd-1 il-7双功能分子孵育之前以1:1的比例共培养。用抗igg-pe(biolegend,克隆hp6017)进行揭示,并通过流式细胞术进行分析。计算并报告在每种细胞类型(cho pd-1 cd127 (白色柱状图)和cho pd-1-cd127 (黑色柱状图))上每种构建体的ec50(nm)结合。柱状图代表3次独立实验的平均值 /-sd。在该测定中,检测了无关mab il7 wt(同种型对照)分子、抗pd-1 il-7 w142h双功能分子igg1m、抗pd-1 il-7 ss2双功能分子igg4m、抗pd-1 il-7 ss3双功能分子igg1m,并且在fc和il-7结构域之间包含ggggsggggsggggs接头。
[0052]
图15:在共培养测定中抗pd-1 il-7突变体相较于pd-1-cd127 细胞优先激活pstat5信号转导进入pd-1 cd127 细胞。a.在仅使用cd127或者cd127和pd-1受体转导的u937细胞上通过流式细胞术分析的人cd127、人pd-1和人cd132的表达。b.在使用表达cd127 或者共表达cd127 和pd-1 的u937细胞,在共培养测定中抗pd-1 il-7突变体的pstat5活性。细胞用细胞增殖染料(cpde450或cpde670)染色,并在与不同浓度的抗pd-1il-7双功能分子孵育(15min 37℃)之前以1:1的比例共培养。然后将细胞固定、透化并用af647标记的抗pstat5(克隆47/stat5(py694))染色。计算每种构建体和每种细胞类型(cho pd-1 cd127 (白色柱状图)和cho pd-1-cd127 (黑色柱状图))的pstat5活化的ec50(nm)。柱状图代表4次独立实验的平均值 /-sd。在该测定中,检测了ril-7(重组人il-7细胞因子)、无关mab il7 wt(同种型对照)分子igg4m、抗pd-1 il-7 d74e双功能分子igg1m、抗pd-1 il-7 w142h双功能分子igg1m、抗pd-1 il-7 ss2双功能分子igg4m、抗pd-1 il-7 ss3双功能分子igg1m,并且在fc和il-7结构域之间包含ggggsggggsggggs接头。
[0053]
图16:抗pd-1 il-7 w142h突变体优先激活pstat5信号转导进入pd-1 cd127 人t细胞,并且协同增加了pd-1 cd127 耗竭的人t细胞的增殖。在cd3/cd28涂层(3μg/ml ok3和cd28.2抗体)上刺激人pbmc以诱导pd-1表达,然后使用抗pd-1 il-7 w142h双功能分子igg1m评估pstat5的活性和增殖。a.左图。通过流式细胞术分析人cd127、人pd-1在活化的人t细胞(cd3 群)上的代表性表达;a.右图。在与重组il-7或抗pd-1 il-7 w142h突变分子孵育之前,将人活化的t细胞与同种型对照或抗pd-1竞争性抗体(200μg/ml)预孵育。在用af647标记的抗pstat5(克隆47/stat5(py694))固定和染色后,通过流式细胞术对il-7r信号转导pstat5进行量化。在具有同种型对照的条件下和在具有抗pd-1竞争性抗体的条件下计算pstat5活化(ec50)。数据表示这两个条件之间的倍数变化差异;n=在独立实验中测试的5个不同供体。b.使用同种型对照、抗pd-1 同种型il7 w142h igg1m或抗pd-1il-7w142h
双功能分子igg1m(3nm)的人耗竭的pd-1 t细胞的增殖。在用αcd3/pd-l1重组蛋白包被板再刺激后的第5天测量增殖。通过流式细胞术使用click-it edu测定对增殖进行量化(click-it edu 细胞的几何平均值和%);在独立实验中检测了n=4个独立的t细胞供体。所有测试的构建体均包含在fc和il-7结构域之间的ggggsggggsggggs接头。
[0054]
图17:实施例8和实施例9中使用的不同分子的示意图。
[0055]
图18:抗pd-1 il7 w142h突变体表现出对pd-1的高结合效率并拮抗pdl1结合。a.pd-1结合elisa测定。将人重组pd-1(rpd1)蛋白固化,并加入不同浓度的抗体。使用与过氧化物酶偶联的抗人fc抗体进行揭示。使用tmb底物在450nm处进行比色。将具有1个(抗pd-1*1
▲
灰色)或2个抗pd-1臂(抗pd-1*2
◆
)的抗pd-1作为对照进行检测。还检测了包含il7变体(抗pd-1*2 il7 w142h*2
●
黑色)、(抗pd-1*2 il7 w142h*1
■
黑色)、(抗pd-1*1 il7 w142h*2
●
灰色)、(抗pd-1*1 il7 w142h*1
▼
灰色)的双功能分子。b.通过elisa测量阻断pd-1/pd-l1的拮抗能力。将pd-l1固化,加入复合抗体 生物素化重组人pd-1。该复合物使用固定浓度的pd1(0.6μg/ml)和不同浓度抗pd1*2 il7 w142h*1(
■
实线)、抗pd1*2il7 w142h*2(虚线)、抗pd-1*1(灰色
▲
灰色虚线)、抗pd1*1il 7w142h*2(灰色
●
灰色实线)或pd1*1 il7 w142h*1(灰色
▼
灰色实线)产生。所有测试的构建体均包含在fc和il-7结构域之间的ggggsggggsggggs接头。
[0056]
图19:使用一价或两价抗pd-1和一个il-7 w142h细胞因子构建的抗pd-1 il7分子高效激活pstat5。a.pd-1/cd127结合抗pd-1 il-7 w142h双功能分子。将pd-1重组蛋白固化,然后加入不同浓度的双功能分子和固定量的cd127重组蛋白(组氨酸标记,sino ref 10975-h08h)。用与生物素偶联的抗组氨酸抗体和与过氧化物酶偶联的抗生物素蛋白链菌素的混合物进行揭示。使用tmb底物在450nm处进行比色。检测了抗pd1*2 il7 w142h1*1(
■
)或抗pd1*2il7 w142h*2(
●
灰色)。b.使用与il-7 w142*1细胞因子融合的抗pd-1*2骨架的pstat5信号转导测定。将从健康志愿者的外周血分离的人pbmc与抗pd1*2 il7 wt*2(
▼
)或抗pd1*2 il7 w142h*1(
■
虚线)孵育15分钟。然后将细胞固定,透化并用抗cd3-bv421和抗pstat5 af647(克隆47/stat5(py694))染色。通过计算pstat5 细胞占cd3 群的mfi%获得数据。c.使用抗pd-1*1 il7 w142h*1(
●
)、抗pd-1*2 il7wt*2(
■
)或抗pd1*2 il7 w142h*1(
▲
)处理后的pstat5信号转导测定。所有测试的w142h构建包含igg1m以及在fc和il-7结构域之间的ggggsggggsggggs接头。
[0057]
图20:使用一价或二价构建的抗pd-1 il7分子在体内显著促进t细胞增殖。使用一剂(34nm/kg)pd-1 il-7 w142h分子(抗pd-1*2 il7 w142h*1、抗pd-1*1 il7 w142h*1、抗pd-1*1 il7 w142h*2)或同种型对照对小鼠进行腹腔内注射。在第4天,收集血液,使用抗cd3、抗cd8、抗cd4和ki67增殖标记物对t细胞进行染色。在cd3cd4 和cd3 cd8 群中量化ki67的百分比。使用单因素anova检验针对与对照小鼠的多重比较计算统计学显著性(*p《0,05),进行2次独立实验,每组n=2至8只小鼠。
[0058]
图21:抗pd-1*2il7*1、抗pd-1*1il7*1、抗pd-1*1il7*2协同激活tcr信号转导。promega pd-1/pd-l1生物测定:将(1)效应t细胞(稳定表达pd-1,nfat诱导的荧光素酶的jurkat)和(2)活化的靶细胞(稳定表达pdl1和表面蛋白的cho k1细胞,将其设计为以不依赖于抗原的方式活化同源tcr)共培养。在添加bioglo
tm
荧光素后,对发光进行定量并反映t细胞活化。a.以系列浓度添加抗pd1*2(
●
黑色)、抗pd-1*2il7 w142h*1(
○
白色)。将同种型
抗体作为激活的阴性对照(
■
)。b.以系列浓度添加抗pd1*1 同种型il7 w142h*2对照(
○
白色虚线)、抗pd-1*1 il7 w142h*2(
●
灰色)、抗pd-1*1 il7 w142h*1(
○
灰色)的组合。所测试的所有w142h构建包含igg1m以及在fc和il-7结构域之间的ggggsggggsggggs接头。
[0059]
图22:抗pd-1*2il7*1、抗pd-1*1 il7*1、pd-1*1 il7*2 w142h突变体与pd-1-cd127 细胞相比优先结合和活化pstat5信号转导进入pd-1 cd127 细胞。将表达cd127 的u937细胞或共表达cd127 和pd-1 的细胞用细胞增殖染料(cpde450或cpde670)染色,并在与不同浓度的抗pd-1il-7双功能分子孵育之前以1:1的比例共培养。孵育后通过流式细胞术量化抗人igg pe的染色和pstat5活化。a.计算每种细胞类型和每种构建体的ec50结合(nm)。b.计算每种细胞类型和每种构建体的ec50 pstat5(nm)。使用双功能分子处理后,然后将细胞固定,透化并用af647标记的抗pstat5(克隆47/stat5(py694))染色。将pstat5活化,计算每种构建体和每种细胞类型,u937 pd-1 cd127 (白色柱状图)和u937 pd-1-cd127 (黑色柱状图)的ec50(nm),n=2个独立实验。在该测定中,对抗pd-1*2 il7 w142*1、抗pd-1*1 il7 w142*1和抗pd-1*1 il7 w142*2进行检测,并且包含igg1m同种型以及在fc和il-7结构域之间的ggggsggggsggggs接头。
[0060]
图23:腹腔内注射后抗pd-1*2 il7*1、抗pd-1*1 il7*1、抗pd-1*1 il7*2 w142h突变体分子的药代动力学。使用一剂(34nm/kg)抗pd-1*2 il7 il7*2 igg4m(
△
)、抗pd-1*2 il7 w142h*1 igg1m(
▼
)、抗pd-1*1 il7 w142h*1 igg1m(
●
灰色)或抗pd-1*1 il7 w142h*2 igg1m(
○
灰色)对人源化pd1小鼠进行腹腔内注射。注射后直至48h通过elisa评估血清中的药物浓度。
具体实施方式
[0061]
简介
[0062]
根据本发明的分子是双功能的,因为其结合了人白介素7变体的特定作用,这些变体与靶向免疫细胞上表达的特定靶点相关。
[0063]
如本领域技术人员所知,由于在许多癌症中观察到的称为t细胞耗竭的现象,t细胞可能无法充分清除肿瘤细胞。例如,如jiang,y.,li,y.和zhu,b(cell death dis 6,e1792(2015))所述,肿瘤微环境中的耗竭t细胞可导致抑制性受体的过表达、效应细胞因子产生和细胞溶解活性的减少,导致癌症消除失败并通常导致癌症免疫逃避。恢复耗竭t细胞因此是针对癌症治疗设想的临床策略。
[0064]
很多耗竭因子是本领域公知的,如程序性细胞死亡蛋白1(pd1)、细胞毒性t淋巴细胞相关蛋白(ctla-4)、t细胞膜蛋白-3(tim3)和淋巴细胞激活基因3蛋白(lag3)在免疫细胞(特别是t细胞)表面上表达。免疫抑制环境特别是由这种分子与其在肿瘤细胞表面表达的对应物的相互作用诱导的。更特别地,pd-1是调节t细胞耗竭的主要抑制受体之一。事实上,具有高pd-1表达的t细胞消除癌细胞的能力下降。抗pd1治疗化合物,特别是抗pd-1抗体,临床上用于治疗癌症,用于阻断pd1-pdl1相互作用(pd1对t细胞和pdl1对肿瘤细胞)和t细胞耗竭的抑制作用。然而,抗pd1抗体并不总是足够有效地让耗竭的t细胞“重新”活化。
[0065]
本发明人证明,包含根据本发明的il-7变体和阻断免疫抑制相互作用的结合部分(检查点抑制剂)的双功能分子令人惊奇地协同激活nfat途径,这是t细胞活化所需的主要途径。事实上,已经观察到t细胞通过tcr信号的协同激活。更特别地,已经表明,与单独的抗
pd-1相比,双功能il-7变体-抗pd-1分子可以更好地激活t细胞,尤其是耗竭的t细胞。
[0066]
发明人最新发现,双功能分子与i)在t细胞表面上表达的耗竭因子,如pd1、ctla-4、btla、tigit、lag3和tim3(用作结合部分)和ii)在同一t细胞上的il7受体(用作il7变体侧)相互作用,导致nfat通路(tcr信号转导)的这种意外激活,具有激活t细胞的积极作用,特别是耗竭的t细胞,否则这些t细胞将无法消除肿瘤细胞。这种作用此前从未公开过。
[0067]
此外,在双功能分子中使用il-7变体对于增加体内药代动力学很重要。此外,通过降低il-7变体对其受体的亲和性,其增加了双功能分子优先结合靶向免疫细胞的能力,并且与其他细胞相比对这些细胞产生特定的影响,同时也可以利用与双功能分子的两个部分对相同免疫细胞的作用相关的协同效应。更特别地,据认为,包含il-7变体和靶向耗竭因子的结合部分的双功能分子将允许il-7在t细胞浸润中累积,并且在t细胞上重新定位il-7。il-7在这些t细胞附近的这种积累在需要高剂量il-7来激活或重新激活这些t细胞的耗竭t细胞的情况下特别令人感兴趣。
[0068]
令人吃惊的是,发明人观察到与具有igg4重链恒定结构域的相同分子相比,具有igg1重链恒定结构域的双功能分子具有提高的il-7变体活性(pstat5信号、协同效应和cd127结合)。这种改善是il-7突变体所特有的,在野生型il-7中未观察到。此外,在抗体和il-7之间使用接头(ggggs)3可最大限度地提高il-7变体的活性(pstat5信号和cd127结合)。
[0069]
本发明所述的双功能分子具有以下优点中的特定一个或多个:
[0070]-双功能分子允许将il-7变体特异性定位在靠近免疫细胞(如t细胞或pd-1 细胞)的位置,特别是进入肿瘤中,靶向需要更高浓度il-7的细胞。
[0071]-与il-7野生型相比,il-7变体中的突变降低了il-7变体对il-7r的亲和性,而没有完全或显著丧失其内在生物活性。
[0072]-il-7变体中的突变改善了体内药代动力学和药效学,特别是与包含il-7野生型的双功能分子相比。更特别地,改善分子的药代动力学和药效学允许双功能分子到达靶细胞,并作用于免疫细胞表面表达的靶点。
[0073]-根据本发明的双功能分子显示出il7突变体(nfat信号转导)的协同活性。
[0074]-与包含野生型il7的抗体相比,根据本发明的双功能分子对pd-1( )细胞的选择性活性高于pd-1(-)细胞。
[0075]-包含突变的il-7w142h分子的双功能分子分选择性地和协同地顺式激活pd-1( )cd127( )耗竭的t细胞。
[0076]-il-7变体可以包含在具有一个或两个il-7分子和一个或两个抗原结合片段的双功能分子的几种结构中,同时保持结合其靶点(例如,pd-1)和激活il7r通路的能力。特别地,具有1个或2个il7 w142h变体的双功能分子在体内具有良好的药代动力学特征。
[0077]-本发明出人意料地显示了与包含两个il7变体的构建体相比,包含单个il-7变体的构建体在活性和药代动力学方面的改善的性质。
[0078]
定义
[0079]
为了更容易理解本发明,以下定义了某些术语。在整个具体实施方式中阐述了另外的定义。
[0080]
除非另有定义,本文中使用的所有技术术语、符号和其他科学术语旨在具有本发
明所属领域的技术人员通常理解的含义。在一些情况下,为了清楚和/或便于参考,本文定义具有普遍理解的含义的术语,并且本文中包含的此类定义不应被解释为代表与本领域通常理解的差异。此处描述或引用的技术和程序通常是本领域技术人员使用常规方法学充分理解和普遍采用的。
[0081]
如本文所用,术语“野生型白介素-7”、“wt-il-7”和“wt-il7”是指哺乳动物内源性分泌糖蛋白,特别是il-7多肽、其衍生物和类似物,其例如在il-7受体结合亲和性的标准生物测定或测定中,与野生型哺乳动物il-7具有实质性氨基酸序列同一性并具有基本相等的生物活性。例如,wt-il-7是指具有以下氨基酸序列的重组或非重组多肽的氨基酸序列:i)天然或天然存在的il-7多肽,ii)il-7多肽的生物活性片段,iii)il-7多肽的生物活性多肽类似物,或iv)生物活性il-7多肽。il-7可以包含其肽信号或不包含其肽信号。该分子的替代名称是“前体b细胞生长因子”和“淋巴细胞生成素-1”。优选地,术语“wt-il-7”是指人il-7(wth-il7)。例如,人wt-il-7氨基酸序列为约152个氨基酸(在不存在信号肽的情况下),并且其genbank登录号为np_000871.1,该基因位于染色体8q12-13上。例如在uniprotkb-p13232中描述了人il-7。
[0082]
如本文所用,术语“抗体”描述了一种免疫球蛋白分子类型,并且以其最广泛的意义使用。特别地,抗体包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即,包含抗原结合位点的分子。免疫球蛋白分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类。对应于不同类别免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。除非特定地指出,否则术语“抗体”包括完整免疫球蛋白以及“抗体片段”或“抗原结合片段”(例如,fab、fab’、f(ab’)2、fv)、单链(scfv)、其突变体、包含抗体部分的分子、双体、线性抗体、单链抗体和包含具有所需特异性的抗原识别位点的免疫球蛋白分子的任何其他修饰构型,包括抗体的糖基化变体、抗体的氨基酸序列变体。优选地,术语“抗体”指人源化抗体。
[0083]
如本文所用,“抗体重链”指抗体构象中存在的两种类型多肽链中较大的一种。抗体重链的cdr通常称为“hcdr1”、“hcdr2”和“hcdr3”。抗体重链的框架区通常称为“hfr1”、“hfr2”、“hfr3”和“hfr4”。
[0084]
如本文所用,“抗体轻链”指抗体构象中存在的两种类型多肽链中较小的一种,κ和λ轻链指两种主要抗体的轻链同种型。抗体轻链的cdr通常称为“lcdr1”、“lcdr2”和“lcdr3”。抗体轻链的框架区通常称为“lfr1”、“lfr2”、“lfr3”和“lfr4”。
[0085]
如本文所用,抗体的“抗原结合片段”指展现对特定抗原的抗原结合能力的抗体的一部分,亦即与本发明的抗体的结构的一部分对应的分子,可能呈其天然形式;与对应四链抗体的抗原结合特异性相比,此类片段尤其显示相同或基本上相同的对该抗原的抗原结合特异性。有利地,抗原结合片段具有与对应4链抗体类似的结合亲和性。然而,相对于相应的4链抗体具有降低的抗原结合亲和性的抗原结合片段也包括在本发明内。抗原结合能力可以通过测量抗体与目标片段之间的亲和性来确定。也可以将这些抗原结合片段称为抗体的“功能性片段”。抗体的抗原结合片段是包含其被称为cdr(互补决定区)或其部分的高变结构域的片段。
[0086]
如本文所用,术语“人源化抗体”旨在指其中来源于另一哺乳动物物种(例如小鼠)的种系的cdr序列已被移植到人框架序列的抗体(例如,包含来源于非人抗体的最少序列的
嵌合抗体)。“人源化抗体”(例如,非人抗体)还指已经历人源化的抗体。人源化抗体通常是人免疫球蛋白(受体抗体),其中一个或多个cdr的残基被非人抗体(供体抗体)的至少一个cdr的残基置换,同时保持所需的特异性、亲和性和原始抗体的能力。可以在人框架序列内进行其他框架区修饰。优选的人源化抗体具有大于80%、85%或90%的t20人性评分。抗体的“人性”可以例如使用t20评分分析仪来量化抗体可变区的人性,如在gao s h,huang k,tu h,adler a s.bmc biotechnology.2013:13:55中所描述的,或通过基于网络的工具使用t20截止人类数据库:http://abanalyzer.lakepharma.com计算抗体序列的t20评分。
[0087]“嵌合抗体”指通过来自非人来源(优选如小鼠)的遗传物质与来自人的遗传物质结合而制成的抗体。此类抗体来源于通过嵌合区连接的人和非人抗体。嵌合抗体通常包含来自人的恒定结构域和来自另一种哺乳动物物种的可变结构域,当其用于治疗性治疗时,降低了对来自非人动物的外来抗体的反应风险。
[0088]
如本文所用,术语“片段结晶区”、“fc区”或“fc结构域”可以互换使用,指与称为fc受体的细胞表面受体相互作用的抗体尾部区域。fc区或结构域通常由两个相同的结构域组成,源自抗体两条重链的第二和第三恒定结构域(即,ch2和ch3结构域)。fc结构域的部分指ch2或ch3结构域。任选地,fc区或结构域可以任选地包含ch1和ch2之间的铰链区的全部或一部分。任选地,fc结构域是来自igg1、igg2、igg3或igg4的结构域,其任选地具有igg1铰链-ch2-ch3和igg4铰链-ch2-ch3。
[0089]
在igg抗体的情况下,igg同种型各自具有三个ch区。因此,在igg上下文中的“ch”结构域如下所示:“ch1”指根据如kabat中的eu索引的位置118-215。“铰链”指根据如kabat中的eu索引的位置216-230。“ch2”指根据如kabat中的eu索引的位置231-340,和“ch3”指根据如kabat中的eu索引的位置341-447。
[0090]“氨基酸改变”或“氨基酸修饰”在本文中指多肽氨基酸序列的改变。“氨基酸修饰”包括在多肽序列中的取代、插入和/或缺失。本文中的“氨基酸取代”或“取代”指在亲本多肽序列中特定位置的氨基酸被另一氨基酸取代。“氨基酸插入”或“插入”指在亲本多肽序列的特定位置添加氨基酸。“氨基酸缺失”或“缺失”指去除亲本多肽序列中特定位置的氨基酸。氨基酸取代可以是保守的。保守性取代是用具有相似化学性质(例如,电荷、体积和/或疏水性)的侧链(“r-基团”)的另一个残基取代给定的氨基酸残基。如本文所用,“氨基酸位置”或“氨基酸位置编号”可互换使用,指氨基酸序列中特定氨基酸的位置,通常用氨基酸的单字母代码指定。在氨基酸序列中的第一个氨基酸(即,从n末端开始)应被视为具有位置1。
[0091]
保守性取代是用具有相似化学性质(例如,电荷、体积和/或疏水性)的侧链(“r-基团”)的另一个残基取代给定的氨基酸残基。在通常情况下,保守性氨基酸取代不会显著改变蛋白的功能性质。保守性取代和相应的规则在现有技术中已被很好的描述。例如,保守性取代可以通过下表中反映的氨基酸组内的取代来定义:
[0092]
表a-氨基酸残基
[0093]
氨基酸基团氨基酸残基酸性残基asp和glu碱性残基lys、arg和his亲水性不带电残基ser、thr、asn和gln脂肪族不带电残基gly、ala、val、leu和ile
非极性不带电残基cys、met和pro芳香族残基phe、tyr和trp
[0094]
表b-替代保守性氨基酸残基取代组
[0095]
1丙氨酸(a)丝氨酸(s)苏氨酸(t)2天冬氨酸(d)谷氨酸(e) 3天冬酰胺(n)谷氨酰胺(q) 4精氨酸(r)赖氨酸(k) 5异亮氨酸(i)亮氨酸(l)甲硫氨酸(m)6苯丙氨酸(f)酪氨酸(y)色氨酸(w)
[0096]
表c-氨基酸残基的其他替代物理和功能分类
[0097]
含醇基的残基s和t脂肪族残基i、l、v和m环烯基相关残基f、h、w和y疏水性残基a、c、f、g、h、i、l、m、r、t、v、w和y带负电残基d和e极性残基c、d、e、h、k、n、q、r、s和t小残基a、c、d、g、n、p、s、t和v极小残基a、g和s参与转角形成的残基a、c、d、e、g、h、k、n、q、r、s、p和t柔性残基e、q、t、k、s、g、p、d、e和r
[0098]
如本文所用,两个序列之间的“序列同一性”由参数“序列同一性”、“序列相似性”或“序列同源性”描述。出于本发明的目的,两个序列(a)和(b)之间的“同一性百分比”是通过比较窗口比较以最佳方式排列的两个序列来确定的。所述序列的比对可以通过本领域熟知的方法进行,例如,使用needleman-wunsch的全局比对算法。蛋白分析软件使用分配给各种取代、缺失和其他修饰(包括保守性氨基酸取代)的相似性度量来匹配相似序列。一旦获得总比对,则可以通过将比对的相同氨基酸残基的总数除以序列(a)和(b)之间最长序列中包含的残基的总数来获得同一性百分比。序列同一性通常使用序列分析软件确定。为了比较两个氨基酸序列,例如,可以使用embl-ebi提供的用于蛋白成对序列比对的工具“emboss needle”,可在www.ebi.ac.uk/tools/services/web/toolform.ebi?tool=emboss_needle&context=protein获得,例如使用默认设置:(i)矩阵:blosum62,(ii)空位开放:10,(iii)空位扩展:0.5,(iv)输出形式:配对,(v)结束空位罚分:假,(vi)末端空位开放:10,(vii)末端空位扩展:0.5。
[0099]
或者,通常也可以使用序列分析软件clustal omega使用hhalign算法及其默认设置作为其核心比对引擎来确定序列同一性。在j.(2005)'protein homology detection by hmm
–
hmm comparison'.bioinformatics 21,951-960中描述了该算法,使用默认设置。
[0100]
如本文所用,术语“来源于(derive from/derived from)”指具有来源于母体化合物或蛋白结构的结构的化合物,并且其结构与本文公开的那些足够相似并且基于该相似
性,本领域技术人员将预期其表现出与要求保护的化合物相同或相似的性质、活性和效用。
[0101]
如本文所用,“药物组合物”指一种或多种活性剂的制剂,如包含根据本发明所述的双功能分子与任选地其他化学组分,如生理学上适宜的载体和赋形剂。药物组合物的目的是促进将活性剂施用于生物体。本发明的组合物可以是适合于任何常规给药途径或使用的形式。在一个实施方式中,“组合物”通常指活性剂(例如,化合物或组合物)与天然存在或非天然存在的载体的组合,所述载体是惰性的(例如,检测剂或标签)或活性的,如佐剂、稀释剂、粘合剂、稳定剂、缓冲剂、盐、亲脂性溶剂、防腐剂、佐剂等,并且包括药学上可接受的载体。如本文所指,“可接受的载剂”或“可接受的载体”是本领域技术人员公知的可用于配制药物组合物的任何已知化合物或化合物的组合。
[0102]
如本文所用,“有效量”或“治疗有效量”指单独或与一种或多种其他活性剂组合,赋予受试者治疗作用所需的活性剂的量,例如,治疗目标疾病或病症或产生所需作用所需的活性剂的量。“有效量”将根据以下而改变:一种或多种药剂、疾病及其严重程度、待治疗的受试者的特征,包括年龄、身体状态、体格、性别和体重、治疗持续时间、伴随疗法的性质(如果有的话)、具体的施用途径以及健康从业者知识和专业知识范围内的类似因素。这些因素是本领域普通技术人员众所周知的,并且可以通过常规实验解决。通常优选使用单个组分或其组合的最大剂量,即根据合理的医学判断的最高安全剂量。
[0103]
如本文所用,术语“药物”指具有治愈或预防病症或疾病的性质的任何物质或组合物。
[0104]
术语“治疗”指旨在改善患者健康状况的任何行为,如疾病或疾病症状的治疗、预防、预防和延缓。其指的是对疾病的治愈性治疗和/或预防性治疗。治愈性治疗被定义为导致治愈的治疗或减轻、改善和/或消除、减轻和/或稳定疾病或疾病的症状或其直接或间接引起的痛苦的治疗。预防性治疗包括导致疾病预防的治疗和减少和/或延迟疾病的进展和/或发生或其发生的风险的治疗。在某些实施方式中,该术语是指改善或根除疾病、病症、感染或与之相关的症状。在其他实施方式中,该术语指最小化癌症的播散或恶化。根据本发明的治疗不一定意味着100%或完全治疗。相反,存在不同程度的治疗,其中本领域普通技术人员认为具有潜在获益或治疗效果。优选地,术语“治疗”指将包含一种或多种活性剂的组合物应用或施用给患有病症/疾病的受试者。
[0105]
如本文所用,术语“病症”或“疾病”是指由于遗传或发育错误、感染、毒物、营养缺乏或失衡、毒性或不利环境因素的影响而导致身体功能不正常的器官、部分、结构或系统。优选地,这些术语指监控病症或疾病,例如,破坏正常身体或精神功能的疾病。更优选地,术语病症指影响动物和/或人的免疫和/或炎症疾病,如癌症。
[0106]
如本文所用,“免疫细胞”指与先天性免疫和适应性免疫相关的细胞,例如,比如来源于骨髓中产生的造血干细胞(hsc)的白血细胞(白细胞)、淋巴细胞(t细胞、b细胞、自然杀伤(nk)细胞和自然杀伤t细胞(nkt)和髓系来源的细胞(中性粒细胞、嗜酸性细胞、嗜碱性细胞、单核细胞、巨噬细胞、树突状细胞)。特别地,免疫细胞可以在包含b细胞、t细胞、特别是cd4 t细胞和cd8 t细胞、nk细胞、nkt细胞、apc细胞、树突状细胞和单核细胞的非详尽性列表中选择。如本文所用,“t细胞”包括例如cd4 t细胞、cd8 t细胞、t辅助1型t细胞、t辅助2型t细胞、t辅助17型t细胞和抑制性t细胞。
[0107]
如本文所用,术语“t效应细胞”、“t eff”或“效应细胞”描述了一组免疫细胞,其包
括若干种对刺激(例如共刺激)积极应答的t细胞类型。其特别包括具有消除抗原功能的t细胞(例如,通过产生调节其他细胞激活的细胞因子或通过细胞毒性活性)。其尤其包括cd4 、cd8 、细胞毒性t细胞和辅助性t细胞(th1和th2)。
[0108]
如本文所用,术语“调节性t细胞”、“treg细胞”或“t reg”指调节免疫系统、维持对自身抗原的耐受性和预防自身免疫疾病的t细胞亚群体。treg具有免疫抑制作用,通常抑制或下调效应t细胞的诱导和增殖。treg表达生物标志物cd4、foxp3和cd25,并且被认为来源于与初始cd4细胞相同的谱系。
[0109]
术语“耗竭的t细胞”指处于功能障碍状态(即“耗竭”)的t细胞群体。t细胞耗竭通过功能的逐渐丧失、转录谱的变化和抑制性受体的持续表达来表征。耗竭t细胞失去其细胞因子产生能力、其高增殖能力和其细胞毒性潜力,最终导致其缺失。耗竭t细胞通常指示较高的cd43、cd69和抑制性受体水平与较低的cd62l和cd127表达的组合。
[0110]
术语“免疫应答”指例如淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞和由以上细胞或肝脏产生的可溶性大分子(包括抗体、细胞因子和补体)对侵入病原体、感染病原体的细胞或组织、癌细胞或在自身免疫性或病理性炎症的情况下正常人类细胞或组织进行选择性损害、破坏或使其从人体消除的作用。
[0111]
如本文所用,术语“拮抗剂”指阻断或降低另一种物质的活性或功能的物质。特别地,该术语指作为参考物质(例如,pd-l1和/或pd-l2)的细胞受体(例如,pd-1)结合的抗体,阻止其产生全部或部分通常的生物学效应(例如,建立免疫抑制性微环境)。可以通过竞争性elisa评估根据本发明的人源化抗体的拮抗剂活性。
[0112]
如本文所用,“激动剂”指激活激活受体功能的物质。特别地,该术语指与作为参考物质的细胞活化受体结合的抗体,并且具有与生物天然配体至少部分相同的作用(例如,诱导受体的活化作用)。
[0113]
药代动力学(pk)指药物在体内的运动,而药效学(pd)指机体对药物的生物应答。pk通过将吸收、分布、生物利用度、代谢和排泄表征为时间的函数来描述药物的暴露。pd用生化或分子相互作用来描述药物应答。pk和pd分析用于表征药物暴露、预测和评估剂量变化、估计消除率和吸收率、评估制剂的相对生物利用度/生物等效性、表征受试者内和受试者间的变异性、了解浓度-效应关系并建立安全性边界和有效性特征。“改善pk”指上述特征之一得到改善,例如,分子的半衰期增加,特别是当注射到受试者时分子的血清半衰期延长。
[0114]
如本文所用,术语“分离的”表示所述材料(例如,抗体、多肽、核酸等)与其在自然界中一起存在的其他材料基本上分离或相对于其他材料富集。特别地,“分离的”抗体是一种已经从自然环境的组分鉴别出并分离和/或回收的抗体。
[0115]
如本文所用,术语“和/或”将被视为两个特定特征或组分中的每一个的具体公开,其中包含或不包含另一个。例如,“a和/或b”将被视为(i)a、(ii)b和(iii)a和b中的每一个的具体公开,就好像每一个都是单独列出的一样。
[0116]
术语“一个/一种(a)”或“一个/一种(an)”可以指其修饰的要素中的一个或多个(例如,“一种试剂”可以表示一个或多个试剂),除非上下文清楚地描述了要素的一个或多个要素。
[0117]
如本文所用,联合任何和所有值(包括数值范围的下限和上限)的术语“约”指具有
高达 /-10%偏差的可接受范围的任何值(例如, /-0.5%、 /-1%、 /-1.5%、 /-2%、 /-2.5%、 /-3%、 /-3.5%、 /-4%、 /-4.5%、 /-5%、 /-5.5%、 /-6%、 /-6.5%、 /-7%、 /-7.5%、 /-8%、 /-8.5%、 /-9%、 /-9.5%)。在一串值开头的术语“约”的使用修饰所述值的每一个(即,“约1、2和3”指约1、约2和约3)。此外,当本文所述的是值的列表(例如,约50%、60%、70%、80%、85%或86%)使,所述列表包括其所有中间值和分数值(例如,54%、85.4%)。
[0118]
il-7突变体
[0119]
本公开内容提供了白介素7突变体(il-7m)和双功能分子,其包含含有白介素7突变体(il-7m)的第一实体和含有结合部分的第二实体。
[0120]
术语“白介素-7突变体”、“突变il-7”、“il-7突变体”、“il-7变体”、“il-7m”或il-7v”在本文中可互换使用。将il-7蛋白的“变体”或“突变体”定义为一个或多个氨基酸被改变的氨基酸序列。变体可以具有“保守性”修饰或“非保守性”修饰。此类修饰可以包括氨基酸取代、缺失和/或插入。优选地,修饰是取代,特别是保守性取代。本发明中包括的变体il-7蛋白特别涉及与野生型il-7相比不保留基本上等同的生物学特性(例如,活性、结合能力和/或结构)的il-7蛋白。il-7突变体或变体包含至少一个突变。特别地,至少一种突变降低了il-7m对il-7r的亲和力,但不导致对il-7r的识别丧失。因此,il-7突变体或变体保留激活il-7r的能力,例如如通过pstat5信号测量的,例如,如在bitar等,front.immunol.,2019,第10卷中所公开的。可以使用体外细胞增殖测定或通过elisa或facs测量进入t细胞中的p-stat5来测量il-7蛋白的生物活性。优选地,根据本发明所述的il-7变体相比于野生型il-7、优选地wth-il7,生物特性(例如,活性、结合能力和/或结构)降低至少2、5、10、20、30、40、50、100、250、500、750、1000、2500、5000或8000倍。更优选地,所述il-7变体与il-7受体的结合降低但保留激活il-7r的能力。例如,与il-7受体的结合相比于野生型il-7可以降低至少1%、5%、10%、20%、30%、40%、50%、60%,并且相比于野生型il-7保留了激活il-7r至少90%、80%、70%、60%、50%、40%、30%或20%的能力。优选地,il-7m是人野生型il-7的变体,例如如在seq id no:1中所述的。
[0121]
在一个实施方式中,与野生型人il-7相比,根据本发明的il-7变体保持至少1%、5%、10%、20%、30%、40%、50%、60%的生物活性,优选地,与野生型il-7相比,优选地至少80%、90%、95%和甚至更优选地99%。
[0122]
在一个方面中,所述il-7变体或突变体与wt-il-7有至少一个氨基酸突变的不同,其i)相比于wt-il-7对il-7r的亲和力降低了所述il-7变体对il-7受体(il-7r)的亲和力,并ii)相比于wt-il7改善了il7变体的药代动力学。更特别地,所述il-7变体或突变体进一步保留了激活il-7r的能力,特别是通过pstat5信号传导。
[0123]
在另一个方面中,包含il-7变体或突变体的双功能分子与wt-il-7有至少一个氨基酸突变的不同,其i)相比于包含wt-il-7的双功能分子对il-7r的亲和力降低了所述双功能分子对il-7受体(il-7r)的亲和力,并ii)相比于包含wt-il7的双功能分子改善了包含il-7变体或其突变体的双功能分子的药代动力学。更特别地,包含il-7变体或其突变体的双功能分子进一步保留了激活il-7r的能力,特别是通过pstat5信号传导。例如,包含il-7变体或突变体的双功能分子与所述il-7受体的结合相比于包含野生型il-7的双功能分子可以降低至少10%、20%、30%、40%、50%、60%,并且相比于包含野生型il-7的双功能分
子保留激活il-7r的能力至少90%、80%、70%、60%、50%、40%、30%或20%。
[0124]
根据本发明,与wth-il-7对il-7r的亲和力相比,il-7m对il-7受体(il-7r)的亲和力降低。特别地,与wth-il-7分别对cd127和/或cd132的亲和力相比,il-7m对cd127和/或cd132的亲和力降低。优选地,与wth-il-7对cd127的亲和力相比,il-7m对cd127的亲和力降低。
[0125]
优选地,所述至少一个氨基酸突变使il-7m对il-7r、特别是cd132或cd127的亲和力相比于wt-il-7对il-7r的亲和力降低至少10、100、1000、10,000或100,000倍。这种亲和力比较可以通过本领域技术人员已知的任何方法进行,例如elisa或biacore。
[0126]
优选地,与il-7wt相比,所述至少一个氨基酸突变降低il-7m对il-7r的亲和力,但不降低il-7m的生物学活性(特别是如通过pstat5信号测量的)。
[0127]
替代地,与il-7wt相比,所述至少一个氨基酸突变降低il-7m对il-7r的亲和力,但不显著降低il-7m的生物活性(特别是如通过pstat5信号测量的)。
[0128]
另外地或替代地,il-7m相比于野生型il-7和含野生型il-7的双功能分子,分别改善il-7变体或突变体或包含il-7变体的双功能分子的药代动力学。特别地,根据本发明所述的il-7m相比于wth-il-7将il-7变体的药代动力学提高了至少10、100或1000倍。特别地,根据本发明所述的il-7m相比于包含wth-il-7的双功能分子将包含il-7变体或突变体的双功能分子的药代动力学提高了至少10、100或1000倍。药代动力学曲线比较可以通过本领域技术人员已知的任何方法进行,如体内药物注射和多个时间点的血清中药物剂量elisa,例如如实施例2中所示。
[0129]
如本文所用,术语“药代动力学”和“pk”可互换使用,指的是向活体施用化合物、物质或药物的归宿。药代动力学特别包括adme或ladme方案,代表释放(即,物质从组合物中释放)、吸收(即,物质进入血液循环)、分布(即,物质通过身体分散或散布)、代谢(即,物质的转化或降解)和排泄(即,物质从生物体中去除或清除)。代谢和排泄这两个阶段也可以在标题消除下归为一组。本领域技术人员可以监测不同的药代动力学参数,例如消除半衰期、消除恒定速率、清除率(即,每单位时间清除药物的血浆体积)、cmax(最大血清浓度)和药物暴露(由曲线下面积确定)(参见scheff等,pharm res.,2011,28,1081-9)等。
[0130]
然后,通过使用il-7m特别是双功能分子改善药代动力学是指改善上述参数中的至少一个。优选地,其指的是双功能分子消除半衰期的改善,即半衰期持续时间或cmax的增加。
[0131]
在一个特定实施方式中,相比于包含il-7wt的双功能分子,il-7m的至少一个突变提高了包含il-7m的双功能分子的消除半衰期。
[0132]
在一个实施方式中,所述il-7m呈现出与例如seq id no:1中公开的152个氨基酸的野生型人il-7(wth-il-7)蛋白至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或至少99%同一性。优选地,所述il-7m呈现出与seq id no:1至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%或至少99%同一性。
[0133]
特别地,所述至少一个突变发生在il-7的氨基酸位置74和/或142处。另外地或替代地,所述至少一个突变发生在氨基酸位置2和141、34和129、和/或47和92处。这些位置是指seq id no:1中所示的氨基酸的位置。
[0134]
特别地,所述至少一个突变是选自以下的氨基酸取代或氨基酸取代组:c2s-c141s
和c47s-c92s、c2s-c141s和c34s-c129s、c47s-c92s和c34s-c129s、w142h、w142f、w142y、q11e、y12f、m17l、q22e、k81r、d74e、d74q和d74n或其任何组合。这些突变是指seq id no:1中所示的氨基酸的位置。然后,例如突变w142h代表wth-il7的色氨酸被取代成组氨酸以获得在氨基酸位置142中具有组氨酸的il-7m。此类突变体例如描述于seq id no:5中。
[0135]
在一个实施方式中,所述il-7m包含取代的组以破坏c2和c141、c47和c92以及c34-c129之间的二硫键。特别地,所述il-7m包含两组取代以破坏c2和c141、和c47和c92、c2和c141、和c34-c129、或c47和c92、和c34-c129之间的二硫键。例如,半胱氨酸残基可以被丝氨酸取代以防止二硫键形成。因此,氨基酸取代可以选自c2s-c141s和c47s-c92s(称为“ss2”)、c2s-c141s和c34s-c129s(称为“ss1”)、和c47s-c92s和c34s-c129s(称为“ss3”)。这些突变是指seq id no:1中所示的氨基酸的位置。此类il-7m在seq id no:2至4(分别为ss1、ss2和ss3)中所示的序列下特别描述。优选地,所述il-7m包含氨基酸取代c2s-c141s和c47s-c92s。甚至更优选地,所述il-7m呈现了seq id no:3中所示的序列。
[0136]
在另一个实施方式中,所述il-7m包含至少一个突变,其选自w142h、w142f和w142y。此类il-7m分别在seq id no:5至7中所示的序列下具体描述。优选地,所述il-7m包含突变w142h。甚至更优选地,所述il-7m呈现了seq id no:5中所示的序列。
[0137]
在另一个实施方式中,所述il-7m包含至少一个突变,其选自d74e、d74q和d74n,优选地d74e和d74q。此类il-7m分别在seq id no:12至14中所示的序列下具体描述。优选地,所述il-7m包含突变d74e。甚至更优选地,所述il-7m呈现了seq id no:12中所示的序列。
[0138]
在另一个实施方式中,所述il-7m包含至少一个突变,其选自q11e、y12f、m17l、q22e和/或k81r。这些突变是指seq id no:1中所示的氨基酸的位置。此类il-7m分别在seq id no:8、9、10、11和15中所示的序列下具体描述。
[0139]
在一个实施方式中,所述il-7m包含至少一个突变,其存在于以下中:i)w142h、w142f或w142y和/或ii)d74e、d74q或d74n,优选地d74e或d74q和/或iii)c2s-c141s和/或c47s-c92s、c2s-c141s和c34s-c129s、或c47s-c92s和c34s-c129s。
[0140]
在一个实施方式中,所述il-7m包含w142h取代和至少一个突变,其由以下组成:i)d74e、d74q或d74n,优选地d74e或d74q和/或ii)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s或c47s-c92s和c34s-c129s。
[0141]
在一个实施方式中,所述il-7m包含d74e取代和至少一个突变,其由以下组成:i)w142h、w142f或w142y和/或ii)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s或c47s-c92s和c34s-c129s。
[0142]
在一个实施方式中,所述il-7m包含突变c2s-c141s和c47s-c92s和至少一个取代,其由以下组成:i)w142h、w142f或w142y和/或ii)d74e、d74q或d74n,优选地d74e或d74q。
[0143]
在一个实施方式中,所述il-7m包含i)d74e和w142h取代和ii)突变c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s、或c47s-c92s和c34s-c129s。
[0144]
所述il-7m蛋白可以包含其肽信号或不包含其肽信号。il-7的变体还可以包括il-7改变的多肽序列(例如,氧化的、还原的、脱氨的或截短形式)。
[0145]
在一个方面中,在本发明中使用的il-7变体或突变体是重组il-7。如本文所用,术语“重组”是指所述多肽是从重组表达系统,即从宿主细胞(例如,微生物或昆虫或植物或哺乳动物)的培养物或从经工程化已获得编码il-7m多肽的核酸分子的转基因植物或动物中
获得的或来源的。优选地,所述重组il-7是人重组il-7m(例如,在重组表达系统中产生的人il-7m)。
[0146]
在一个实施方式中,il-7m呈现在seq id no:2、3、4、5、6、7、8、9、10、11、12、13、14或15中所示的序列中。优选地,根据本发明的双功能分子包含il-7变体,所述il-7变体包含或由seq id no:2-15中所示的氨基酸序列组成。甚至更优选地,根据本发明的双功能分子包含il-7变体,所述il-7变体包含或由seq id no:3、5或12中所示的氨基酸序列组成。
[0147]
在一个实施方式中,本发明提供了il-7变体和包含il-7变体的双功能分子,其与野生型il-7蛋白相比具有降低的免疫原性,特别是通过去除il-7内可能刺激免疫应答的t细胞表位。在wo 2006061219中描述了此类il-7的实例。
[0148]
本发明还涉及包含如本文所公开的il-7变体或突变体的任何融合蛋白,以及涉及包含如本文公开的il-7变体或突变体的任何缀合物。il-7变体或突变体可以通过其n末端或其c末端融合。il-7变体或突变体可以融合或缀合至肽、蛋白质(例如,抗体、其片段和衍生物、抗体模拟物、细胞因子或细胞因子受体、肿瘤或病毒抗原、白蛋白或白蛋白结合蛋白)、聚合物(例如,peg)、化合物如药物(例如,抗癌剂或抗病毒剂)、碳水化合物和核酸分子(例如,sirna、shrna、反义、gapmer)。
[0149]
可与il-7变体或突变体缀合或融合的分子的非详尽列表包括抗体,如抗cd19、抗钙网蛋白、抗肿瘤抗原;细胞因子或细胞因子受体,如il-15或il-15r;延长il-7变体半衰期的结构域,如免疫球蛋白的fc区或其部分、白蛋白、白蛋白结合多肽、pro/ala/ser(pas)、人绒毛膜促性腺激素β亚基c末端肽(ctp)、聚乙二醇(peg)、氨基酸的非结构化亲水长序列(xten)、羟乙基淀粉(hes)、白蛋白结合小分子及其组合;和纤连蛋白结合肽。
[0150]
包含il-7的融合蛋白或缀合物的特定实例例如公开在wo19222294、wo19215510、wo19178362、wo19178364、wo19144309、wo19046313、wo18215937、wo18201047、wo18064611、wo17216223、us2018319858、wo17158436、wo16200219、wo05063820。
[0151]
在一个特定方面中,il-7变体或突变体可以包含在含有结合部分的双功能分子中。
[0152]
结合部分
[0153]
根据本发明的双功能分子包含如本文所公开的il-7变体或突变体和包含结合部分的其他或第二实体。
[0154]
应当理解的是,包含在双功能分子中的结合部分不是白介素,尤其不是il-7,也不是il-7r。
[0155]
如本文所用,表述“结合部分”涉及具有与靶点结合能力的任何部分,如肽、多肽、蛋白、融合蛋白和抗体。特别地,结合部分包括抗体或其抗原结合片段和抗体类似物或模拟物。
[0156]
在一个实施方式中,结合部分选自由抗体或其片段和抗体类似物或模拟物组成的组。生物化学领域的技术人员熟悉抗体类似物或模拟物,如在gebauer和skerra,2009,curr opin chem biol 13(3):245-255中所讨论的。抗体类似物的实例包括:亲和体(也称为trinectin;nygren,2008,febs j,275,2668-2676);ctld(也称为tetranectin;innovations pharmac.technol.(2006),27-30);adnectin(单体;meth.mol.biol.,352(2007),95-109);anticalin(drug discovery today(2005),10,23-33);darpin
(ankyrins;nat.biotechnol.(2004),22,575-582);avimer(nat.biotechnol.(2005),23,1556-1561);微体(febs j,(2007),274,86-95);适体(expert.opin.biol.ther.(2005),5,783-797);kunitz结构域(j.pharmacol.exp.ther.(2006)318,803-809);affilin(trends.biotechnol.(2005),23,514-522);affitin(krehenbrink等,2008,j.mol.biol.383(5):1058
–
68),alfabody(desmet,j.等,2014,nature communications.5:5237),fynomer(grabulovski d等,2007,j biol chem.282(5):3196
–
3204)和affimer(avacta life sciences,wetherby,uk)。
[0157]
因此,结合部分可以选自以下:抗体或其抗体片段,优选地如免疫球蛋白、scfv或vhh、fab、单域抗体和抗体模拟物,优选地如亲和体、ctld、adnectin、anticalin、darpin、avimer、微体、适体、kunitz结构域、affilin、affitin、alfabody、fynomer和affimer。
[0158]
优选地,结合部分是抗体或其抗体片段。甚至更优选地,结合部分是人、人源化或嵌合抗体或者其抗原结合片段。
[0159]
结合部分的靶点
[0160]
根据本发明,结合部分特异性结合免疫细胞表面上表达的靶点,特别是仅在免疫细胞上表达或特异性表达的靶点。特别地,结合部分不针对肿瘤细胞上表达的靶点。
[0161]
关于结合部分的“结合”能力,术语“结合(bind)”或“结合(binding)”指识别和接触另一个多肽、蛋白或分子的肽、多肽、蛋白、融合蛋白、分子和抗体(包括抗体片段和抗体类似物)。在一个实施方式中,其指抗原-抗体类型的相互作用。术语“特异性结合”、“特异性结合至”、“特异性针对”、“选择性结合”和“选择性针对”特定靶点指结合部分识别并结合特定靶点,但基本上不识别或结合样品中的其他分子。例如,与抗原特异性(或优先)结合的抗体是与抗原结合的抗体,例如以比其与其他分子结合更高的亲和性、亲合力、更容易和/或更长的持续时间。优选地,术语“特异性结合”指抗体与抗原之间以等于或低于10-7
m的结合亲和性的接触。在某些方面中,抗体以等于或低于10-8
m、10-9
m或10-10
m的亲和性结合。
[0162]
如本文所用,术语“靶点”指被根据本发明的结合部分特异性识别或靶向并在免疫细胞外表面表达的碳水化合物、脂质、肽、多肽、蛋白、抗原或表位。关于靶点在免疫细胞表面的表达,术语“表达”指靶点,如存在或呈递于细胞外表面的碳水化合物、脂质、肽、多肽、蛋白、抗原或表位。术语“特异性表达”指靶点在免疫细胞上表达,但基本上不被其他细胞类型表达,特别是如肿瘤细胞。
[0163]
在一个实施方式中,靶点由健康受试者或患有基本,特别是癌症的受试者中的免疫细胞特异性表达。这意味着靶点在免疫细胞中的表达水平高于在其他细胞中的表达水平,或者表达靶点的免疫细胞占免疫细胞总数的比例高于表达靶点的其他细胞占其他细胞总数的比例。优选地,表达水平或比率高出2、5、10、20、50或100倍。更具体地,可以确定特定类型的免疫细胞,例如t细胞,更具体地是cd8 t细胞、效应t细胞或耗竭的t细胞,或者在特定情况下,例如患有疾病(如癌症或感染)的受试者。
[0164]
如本文所用,“免疫细胞”指与先天性免疫和适应性免疫相关的细胞,例如,比如来源于骨髓中产生的造血干细胞(hsc)的白血细胞(白细胞)、淋巴细胞(t细胞、b细胞、自然杀伤(nk)细胞和自然杀伤t细胞(nkt)和髓系来源的细胞(中性粒细胞、嗜酸性细胞、嗜碱性细胞、单核细胞、巨噬细胞、树突状细胞)。特别地,免疫细胞可以在包含b细胞、t细胞、特别是cd4 t细胞和cd8 t细胞、nk细胞、nkt细胞、apc细胞、巨噬细胞、树突状细胞和单核细胞的非
详尽性列表中选择。
[0165]
优选地,特异性结合至免疫细胞表达的靶点的结合部分选自以下:b细胞、t细胞、自然杀伤细胞、树突状细胞、单核细胞和先天性淋巴细胞(ilc)。
[0166]
甚至更优选地,免疫细胞是t细胞。如本文所用,“t细胞”或“t淋巴细胞”包括例如cd4 t细胞、cd8 t细胞、t辅助1型t细胞、t辅助2型t细胞、t调节、t辅助17型t细胞和抑制性t细胞。在一个非常特定的实施方式中,免疫细胞是耗竭的t细胞。
[0167]
靶点可以是在免疫细胞,尤其是t细胞表面表达的受体。受体可以是抑制性受体。或者,受体可以是活化受体。
[0168]
在一个方面中,靶点选自以下:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8。此类靶点在下表d中更具体地描述。
[0169]
[0170]
[0171]
1201、bat-1306、ak-103(hx-008)、medi-0680(也称为amp-514)medi0608、js001(参见si-yang liu等,j.hematol.oncol.10:136(2017))、bi-754091、cbt-501、incshr1210(也称为shr-1210)、tsr-042(也称为anb011)、gls-010(也称为wbp3055)、am-0001(armo)、sti-1110(参见wo 2014/194302)、agen2034(参见wo 2017/040790)、mga012(参见wo 2017/19846)或ibi308(参见wo 2017/024465、wo 2017/025016、wo 2017/132825和wo 2017/133540)、单克隆抗体5c4、17d8、2d3、4h1、4a11、7d3和5f4,在wo 2006/121168中描述的。靶向pd-1的双功能或双特异性分子也是公知的,如rg7769(roche)、xmab20717(xencor)、medi5752(astrazeneca)、fs118(f-star)、sl-279252(takeda)和xmab23104(xencor)。
[0179]
在一个特定实施方式中,抗pd1抗体可以是派姆单抗(也称为keytruda帕博利珠单抗,mk-3475)或纳武单抗(opdivo,mdx-1106,bms-936558,ono-4538)。
[0180]
针对tim3的抗体以及靶向tim3的双功能或双特异性分子也是公知的,如sym023、tsr-022、mbg453、ly3321367、incagn02390、bgtb-a425、ly3321367、rg7769(roche)。在一些实施方式中,tfm-3抗体是如在国际专利申请公开号wo2013006490、wo2016/161270、wo 2018/085469或wo 2018/129553、wo 2011/155607、u.s.8,552,156、ep 2581113和u.s 2014/044728中公开的。
[0181]
针对ctla-4的抗体以及靶向ctla-4的双功能或双特异性分子也是公知的,如伊匹单抗、曲美木单抗、mk-1308、agen-1884、xmab20717(xencor)、medi5752(astrazeneca)。在wo18025178、wo19179388、wo19179391、wo19174603、wo19148444、wo19120232、wo19056281、wo19023482、wo18209701、wo18165895、wo18160536、wo18156250、wo18106862、wo18106864、wo18068182、wo18035710、wo18025178、wo17194265、wo17106372、wo17084078、wo17087588、wo16196237、wo16130898、wo16015675、wo12120125、wo09100140和wo07008463中也公开了抗ctla-4抗体。
[0182]
针对lag-3的抗体以及靶向lag-3的双功能或双特异性分子也是公知的,如bms-986016、imp701、mgd012或mgd013(双特异性pd-1和lag-3抗体)。在wo2008132601、ep2320940、wo19152574中也公开了抗lag-3抗体。
[0183]
针对btla的抗体也是本领域公知的,如hu mab8d5、hu mab8a3、hu mab21h6、hu mab19a7或hu mab4c7。针对btla的抗体tab004目前正在晚期恶性肿瘤受试者中进行临床试验。在wo08076560、wo10106051(例如,btla8.2)、wo11014438(例如,4c7)、wo17096017和wo17144668(例如,629.3)中也公开了抗btla抗体。
[0184]
针对tigit的抗体也是本领域公知的,如bms-986207或ab154、bms-986207cpa.9.086、cha.9.547.18、cpa.9.018、cpa.9.027、cpa.9.049、cpa.9.057、cpa.9.059、cpa.9.083、cpa.9.089、cpa.9.093、cpa.9.101、cpa.9.103、cha.9.536.1、cha.9.536.3、cha.9.536.4、cha.9.536.5、cha.9.536.6、cha.9.536.7、cha.9.536.8、cha.9.560.1、cha.9.560.3、cha.9.560.4、cha.9.560.5、cha.9.560.6、cha.9.560.7、cha.9.560.8、cha.9.546.1、cha.9.547.1、cha.9.547.2、cha.9.547.3、cha.9.547.4、cha.9.547.6、cha.9.547.7、cha.9.547.8、cha.9.547.9、cha.9.547.13、cha.9.541.1、cha.9.541.3、cha.9.541.4、cha.9.541.5、cha.9.541.6、cha.9.541.7和cha.9.541.8,如在wo19232484中公开的。在wo16028656、wo16106302、wo16191643、wo17030823、wo17037707、wo17053748、wo17152088、wo18033798、wo18102536、wo18102746、wo18160704、wo18200430、
wo18204363、wo19023504、wo19062832、wo19129221、wo19129261、wo19137548、wo19152574、wo19154415、wo19168382和wo19215728中也公开了抗tigit抗体。
[0185]
针对cd160的抗体也是本领域公知的,如cl1-r2 cncm i-3204,如在wo06015886中所公开的,或其他,如在wo10006071、wo10084158、wo18077926中所公开的。
[0186]
在一个优选的方面中,双功能分子的结合部分是抗体,其片段或衍生物,或抗体模拟物,其特异性针对pd-1、ctla-4、btla、tigit、lag3和tim3。
[0187]
在另一个特定方面中,靶点是pd-1,以及双功能分子的结合部分是特异性针对pd-1的抗体,其片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗pd1抗体或其抗原结合片段,优选地人、人源化或嵌合抗pd1抗体或其抗原结合部分。优选地,结合部分是pd-1的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断pd-1的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0188]
在另一个特定方面中,靶点是ctla-4,以及双功能分子的结合部分是特异性针对ctla-4的抗体,抗体的片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗ctla-4抗体或其抗原结合片段,优选地人、人源化或嵌合抗ctla-4抗体或其抗原结合部分。优选地,结合部分是ctla-4的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断ctla-4的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0189]
在另一个特定方面中,靶点是btla,以及双功能分子的结合部分是特异性针对btla的抗体,其片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗btla抗体或其抗原结合片段,优选地人、人源化或嵌合抗btla抗体或其抗原结合部分。优选地,结合部分是btla的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断btla的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0190]
在另一个特定方面中,靶点是tigit,以及双功能分子的结合部分是特异性针对tigit的抗体,其片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗tigit抗体或其抗原结合片段,优选地人、人源化或嵌合抗tigit抗体或其抗原结合部分。优选地,结合部分是tigit的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断tigit的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0191]
在另一个特定方面中,靶点是lag-3,以及双功能分子的结合部分是特异性针对lag-3的抗体,其片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗lag-3抗体或其抗原结合片段,优选地人、人源化或嵌合抗lag-3抗体或其抗原结合部分。优选地,结合部分是lag-3的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断lag-3的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0192]
在另一个特定方面中,靶点是tim3,以及双功能分子的结合部分是特异性针对tim3的抗体,其片段或衍生物,或抗体模拟物。然后,在一个特定实施方式中,在根据本发明的双功能分子中包含的结合部分是抗tim3抗体或其抗原结合片段,优选地人、人源化或嵌
合抗tim3抗体或其抗原结合部分。优选地,结合部分是tim3的拮抗剂。因此,双功能分子结合il-7变体或突变体对il-7受体的作用和阻断tim3的抑制作用,并且可能对t细胞,尤其是耗竭的t细胞,更特别地是对tcr信号转导的活化具有协同作用。
[0193]
fc结构域
[0194]
在本公开内容的一个特定方面中,双功能分子包含il-7变体或突变体、结合部分和fc结构域。当结合部分是抗体,尤其是igg免疫球蛋白时,fc结构域可以是结合部分的一部分。然而,双功能分子可以具有其他结构,包括fc结构域。例如,其可以包含与抗体衍生物如scfv或双体连接的fc结构域。
[0195]
一种改善本发明双功能分子药代动力学的方法是增加其半衰期血清持久性,从而允许更高的循环水平、更少的给药频率和更低的剂量。这种需求可以例如通过在根据本发明的双功能分子中包含fc结构域或其一部分来满足。
[0196]
然后,在一个实施方式中,根据本发明的双功能分子,特别是结合部分,包含fc结构域或其部分。
[0197]
特别地,根据本发明的结合部分包含免疫球蛋白恒定区(fc)的至少一部分,通常是哺乳动物免疫球蛋白的恒定区,甚至更优选是嵌合的、人源或人源化免疫球蛋白。结合部分可以包括免疫球蛋白的恒定区或恒定区的片段、类似物、变体、突变体或衍生物。如本领域技术人员所熟知的,重链恒定结构域的igg同种型的选择集中于是否需要特定功能以及是否需要适宜的体内半衰期。
[0198]
在一个优选实施方式中,在结合部分中包含的fc结构域或其片段包含来源于人免疫球蛋白重链的重链恒定结构域,例如,igg1、igg2、igg3、igg4或其他类别。在一个进一步的方面中,人恒定结构域选自以下:igg1、igg2、igg2、igg3和igg4。优选地,结合部分包含igg1或igg4重链恒定结构域。
[0199]
在一个实施方式中,结合部分包含截短的fc区或fc区的片段。在此类fc片段中,恒定区包含ch2或ch3结构域。在另一个实施方式中,恒定区包含ch2和ch3结构域。或者,恒定区可以包含铰链区、ch2结构域和/或ch3结构域的全部或一部分。在一些实施方式中,恒定区包含衍生自人igg4或igg1重链的ch2和/或ch3结构域。
[0200]
优选地,恒定区包含铰链区的全部或一部分。铰链区可以衍生自免疫球蛋白重链,例如,igg1、igg2、igg3、igg4或其他类别。优选地,铰链区衍生自人igg1、igg2、igg3、igg4。更优选地,铰链区衍生自人源或人源化igg1或igg4重链。
[0201]
igg1铰链区具有三个半胱氨酸,其中两个参与免疫球蛋白两条重链之间的二硫键。这些相同的半胱氨酸允许在fc部分之间形成有效和一致的二硫键。因此,本发明优选的铰链区衍生自igg1,更优选地,衍生自igg1。在一些实施方式中,将人igg1铰链区内的第一个半胱氨酸突变为另一个氨基酸,优选丝氨酸。
[0202]
已知igg4的铰链区不能有效地形成链间二硫键。然而,适用于本发明的铰链区可以衍生自igg4铰链区,优选包含增强重链衍生部分之间二硫键的正确形成的突变(angal s等,(1993)mol.immunol.,30:105-8)。更优选地,铰链区衍生自人igg4重链。
[0203]
对于靶向细胞表面分子的双功能分子,尤其是免疫细胞上的分子,需要消除效应功能。也可能需要工程化fc区以减少或增加抗体的效应功能。
[0204]
在某些实施方式中,可以将氨基酸修饰引入fc区以产生fc区变体。在某些实施方
式中,fc区变体具有一些但不是全部的效应功能。此类抗体可能是有用的,例如,在抗体在体内的半衰期很重要但某些效应功能是不必要或有害的应用中。具有改变的效应功能的很多取代或者取代或缺失是本领域公知的。
[0205]
在一个实施方式中,恒定区包含降低对fc受体的亲和性或降低fc效应功能的突变。例如,恒定区可以包含消除igg重链恒定区内糖基化位点的突变。优选地,ch2结构域包含消除ch2结构域内的糖基化位点的突变。
[0206]
在一个特定方面中,对fc结构域进行修饰以增加与fcrn的结合,从而增加双功能分子的半衰期。在另一个方面或其他方面中,对fc结构域进行修饰,以减少与fcγr的结合,从而减少adcc或cdc,或者增加与fcγr的结合,从而增加adcc或cdc。
[0207]
如wo 01/58957所示,fc部分和非fc部分连接处附近氨基酸的改变可以显著增加fc融合蛋白的血清半衰期。因此,本发明蛋白或多肽的连接区可以包含相对于免疫球蛋白重链和促红细胞生成素的天然存在的序列优选位于连接点约10个氨基酸内的改变。这些氨基酸改变会导致疏水性增加。在一个实施方式中,恒定区衍生自其中c末端赖氨酸残基被替代的igg序列。优选地,igg序列的c末端赖氨酸被非赖氨酸取代,如丙氨酸或亮氨酸,以进一步增加血清半衰期。
[0208]
在一个实施方式中,恒定区可以包含ch2和/或ch3,其具有下表e中描述的突变之一或其任何组合。
[0209]
[0210]
[0211][0212]
表e:抗体的适宜人工程化fc结构域。重链恒定区残基编号根据欧盟编号(edelman,g.m.等,proc.natl.acad.usa,63,78-85(1969);www.imgt.org/imgtscientificchart/numbering/hu_ighgnber.html#refs)
[0213]
在一个特定方面中,双功能分子,优选地结合部分,包含人igg1重链恒定结构域或igg1 fc结构域,其任选地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235a的组合。
[0214]
在另一个方面中,结合部分包含人igg4重链恒定结构域或人igg4 fc结构域,其任选地具有选自以下的取代或取代的组合:s228p;l234a/l235a、s228p m252y/s254t/t256e和k444a。甚至更优选地,双功能分子,优选地结合部分,包含具有稳定igg4的s228p的igg4 fc区。
[0215]
人igg的所有亚类都带有抗体重链(k444)的c末端赖氨酸残基,其在循环中易被切割。在血液中的这种切割可能通过将连接的il-7释放到igg上来损害或降低双功能分子的生物活性。为了避免这个问题,可以用丙氨酸取代的igg结构域中的k444氨基酸,以减少蛋白水解切割,这是抗体常用的突变。然后,在一个实施方式中,当结合部分是抗体时,该抗体包含至少一个由k444a组成的进一步的氨基酸取代。
[0216]
在一个实施方式中,当结合部分是抗体时,抗体在igg的c末端结构域中包含其他半胱氨酸残基以产生其他的二硫键并潜在地限制双功能分子的柔性。
[0217]
在一个实施方式中,结合部分包含抗体。在此类实施方式中,此类抗体具有seq id no:39或52所示的重链恒定结构域和/或seq id no:40所示的轻链恒定结构域,特别是seq id no:39或52所示的重链恒定结构域和seq id no:40所示的轻链恒定结构域,特别是如在下表f中所公开的。
[0218]
在一个优选的实施方式中,结合部分包含抗hpd1抗体,其具有seq id no:52所示的重链恒定结构域和/或seq id no:40所示的轻链恒定结构域,特别是seq id no:52所示的重链恒定结构域和seq id no:40所示的轻链恒定结构域。
[0219]
表f:适于根据本发明的人源化抗体的重链恒定结构域和轻链恒定结构域的实例
[0220][0221][0222]
肽接头
[0223]
在一个特定方面中,根据本发明的双功能分子还包含连接结合部分和il-7m的肽接头。肽接头通常具有足够的长度和柔韧性,以确保il-7m和与中间接头连接的结合部分具有足够的空间自由度以发挥其功能。
[0224]
在本公开内容的一个方面中,结合部分优选通过肽接头连接至il-7。如本文所用,术语“接头”指连接il-7m和结合部分的至少一个氨基酸的序列。此类接头可以用于防止空间位阻。接头的长度通常为3-44个氨基酸残基。优选地,接头具有3-30个氨基酸残基。在一些实施方式中,接头具有3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸残基。
[0225]
接头序列可以是天然存在的序列或非天然存在的序列。如果用于治疗目的,所述接头优选地在向其施用所述双功能分子的受试者中是非免疫原性的。一组有用的接头序列是来源于如wo 96/34103和wo 94/04678所述的重链抗体的铰链区的接头。其他实例是聚丙氨酸接头序列。接头序列的其他优选实例是不同长度的gly/ser接头,包括(gly4ser)4、(gly4ser)3、(gly4ser)2、gly4ser、gly3ser、gly3、gly2ser和(gly3ser2)3,特别是(gly4ser)3。优选地,接头选自以下:(gly4ser)4、(gly4ser)3和(gly3ser2)3。甚至更优选地,接头是(ggggs)3。
[0226]
在一个实施方式中,包含在双功能分子中的接头选自以下:(gly4ser)4、(gly4ser)3、(gly4ser)2、gly4ser、gly3ser、gly3、gly2ser和(gly3ser2)3,优选是(gly4ser)3。优选地,接头选自以下:(gly4ser)4、(gly4ser)3和(gly3ser2)3。
[0227]
双功能分子
[0228]
本发明特别地提供了双功能分子,其包含il-7m,结合部分,其任选地包含fc片段,以及任选地肽接头,如上文所述的。
[0229]
特别地,双功能分子包含或由如上文所公开的结合部分和il-7m组成,结合部分共价缀合至(例如,通过基因融合或化学偶联)il-7,优选地通过如上文所公开的肽接头。
[0230]
特别地,il-7m与结合部分的缀合是共价的、直接的或非直接的(即,通过接头)和/或化学的、酶促的或遗传的。考虑到结合部分的化学性质,可以通过本领域公知的任何可接受的结合方式进行缀合。在这一点上,因此可以通过一种或多种在生理介质或细胞内可切割的或不可切割的共价、离子、氢、疏水或范德华键进行偶联。
[0231]
特别地,化学缀合可以通过暴露的巯基(cys),将亲和标签(例如,6个组氨酸,flag标签,strep标签,spycatcher)附接到结合部分或il7-m,或引入非天然氨基酸或用于点击化学缀合的化合物进行。
[0232]
在一个优选的实施方式中,缀合是通过基因融合(例如,通过在适宜系统中表达编码结合部分的核酸构建体和作为基因融合的il-7)获得的。
[0233]
在一个方面中,本发明涉及一种融合蛋白,所述融合蛋白包含第一部分,其包含免疫球蛋白(ig)链,特别是fc结构域,和第二部分,其包含白介素-7(il-7)。
[0234]
在一个实施方式中,本发明涉及一种双功能分子,其包含与il-7m融合的结合部分。特别地,在此类融合分子中,结合部分是抗体,其中抗体的链,例如,轻链或重链,优选地重链,甚至更优选地,重链或轻链的c末端连接至il-7m,优选地il-7m的n末端,任选地通过肽接头。
[0235]
在一个特定方面中,本发明涉及一种双功能分子,其包含抗体或其抗原结合片段和il-7m,其中il-7m连接至所述抗体重链的c末端(例如,重链恒定结构域的c末端),优选通过肽接头。
[0236]
优选地,重链,优选抗体重链的c末端,通过柔性(gly4ser)3接头与il-7m的n末端基因融合。在融合连接处,抗体重链的c末端赖氨酸残基可以突变为丙氨酸以减少蛋白水解切割(即,突变k444a)。
[0237]
在一个实施方式中,根据本发明的双功能分子包含一个或多个il-7m分子。特别地,根据本发明的双功能分子可以包含一个、两个、三个或四个il-7m分子。特别地,双功能分子可以仅包含一个il-7分子,其与抗体的仅一条轻链或重链连接。优选地,双功能分子可以仅包含一个il-7m分子,优选连接至抗体的仅一条重链,更优选地,连接至抗体fc结构域的c末端。双功能分子还可以包含两个il-7m分子,其连接至抗体的轻链或重链。双功能分子还可以包含两个il-7m分子,第一个与抗体的轻链连接,第二个与抗体的重链连接。
[0238]
在一个实施方式中,根据本发明的双功能分子包含或由以下组成:
[0239]
(a)特异性结合至在免疫细胞表面上表达的如上文所述靶点的结合部分,其缀合至
[0240]
(b)存在与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)至少75%同一性的il-7m,此类il-7变体包含至少一个减少突变,其i)与wth-il-7对il-7r的亲和性相比,降低了il-7变体与il-7受体(il-7r)的亲和性,和ii)与包含wth-il-7的双功能分子相比,改善了包含il-7变体的双功能分子的药代动力学。
[0241]
特别地,至少一个氨基酸突变如上文“il-7突变体”段落中所述。
[0242]
优选地,根据本发明的双功能分子包含或由以下组成:
[0243]
(a)特异性结合至在免疫细胞表面上表达的如上文所述靶点的结合部分,其缀合至
[0244]
(b)存在与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)至少75%同一性的il-7m,此类il-7变体包含至少一个选自以下的突变:(i)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s,或c47s-c92s和c34s-c129s,(ii)w142h、w142f或w142y,(iii)d74e、d74q或d74n,优选地d74e或d74q;iv)q11e、y12f、m17l、q22e和/或k81r;或其任何组合。
[0245]
优选地,此类突变i)与wth-il-7对il-7r的亲和性相比,降低了il-7变体与il-7受体(il-7r)的亲和性,和ii)与包含wth-il-7的双功能分子相比,改善了包含il-7变体的双功能分子的药代动力学。更优选地,此类突变i)与wth-il-7对il-7r的亲和性相比,降低了il-7变体与il-7受体(il-7r)的亲和性,ii)保留激活il-7r的能力;和iii)与包含wth-il-7的双功能分子相比,改善了包含il-7变体的双功能分子的药代动力学;
[0246]
在一个特定方面中,免疫细胞表面表达的靶点是t细胞表面表达的耗竭因子。
[0247]
优选地,结合部分是抗体或其抗体片段。
[0248]
优选地,结合部分通过基因融合与il-7m缀合,并且双功能分子任选地包含至少一个肽接头,其将il-7m的n末端连接至抗体重链的c末端,肽接头优选地选自以下:(ggggs)3、(ggggs)4、(ggggs)2、ggggs、gggs、ggg、ggs和(gggs)3,甚至更优选地是(ggggs)3。
[0249]
优选地,根据本发明的双功能分子是包含或由以下组成的融合蛋白:
[0250]
(a)如上文所述的抗体或其抗体片段,其特异性结合至免疫细胞(特别是t细胞)表面上表达的靶点,
[0251]
(b)存在与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)至少75%同一性的il-7m,如包含以下氨基酸取代的il-7变体:(i)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s或c47s-c92s和c34s-c129s,(ii)w142h、w142f或w142y,(iii)d74e、d74q或d74n,优选地d74e或d74q;iv)q11e、y12f、m17l、q22e和/或k81r;或其任何组合,和
[0252]
(c)任选地选自以下的肽接头:(ggggs)3、(ggggs)4、(ggggs)2、ggggs、gggs、ggg、ggs和(gggs)3,优选地(ggggs)3。
[0253]
优选地,抗体是针对选自以下的靶点的抗体:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,优选地pd-1、tim3、cd244、lag-3、btla、tigit和cd160。
[0254]
优选地,抗体或其抗体片段具有igg1或igg4 fc结构域。
[0255]
在一个方面中,抗体或其抗体片段具有igg1 fc结构域,其任选地具有选自以下的取代或取代的组合:k444a、t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;和k322a,优选地选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235的组合,甚至更优选地,具有如上
所述的突变n297a的igg1 fc结构域。
[0256]
令人吃惊的是,发明人观察到与具有igg重链恒定结构域的相同分子相比,具有igg1重链恒定结构域的双功能分子具有改善的il-7变体活性(pstat5信号、协同效应和cd127结合)。这种改善是il-7突变体特有的,在野生型il-7中未观察到。此外,在抗体和il-7之间使用长接头如(ggggs)3可最大限度地提高il-7变体的活性(pstat5信号和cd127结合)。
[0257]
因此,本发明更特别地涉及双功能分子,其中如上文所述的抗体或其抗体片段特异性结合至在免疫细胞(优选地t细胞)表面上表达的靶点,更优选地,靶点选自以下:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,优选地pd-1、tim3、cd244、lag-3、btla、tigit和cd160;和,抗体或其抗体片段具有igg1 fc结构域,其任选地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选地选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235的组合,甚至更优选地,igg1 fc结构域具有如上文所述的突变n297a。优选地,抗体或其片段通过选自以下的接头连接至il-7或其变体:(ggggs)3、(ggggs)4和(gggs)3,更优选地,(ggggs)3。优选地,il-7变体包含一组选自以下的氨基酸取代:c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s、c47s-c92s和c34s-c129s、w142h、w142f、w142y、d74e、d74q和d74n。更优选地,il-7变体包含一组选自以下的氨基酸取代:c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s、w142h、w142f、w142y、d74e、d74q和d74n。甚至更优选地,il-7变体包含一组选自以下的氨基酸取代:c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s、w142h和d74e。
[0258]
在另一个方面中,抗体或其抗体片段具有igg4 fc结构域,其任选地具有选自以下的取代或取代的组合:k444a、s228p;l234a/l235a、s228p m252y/s254t/t256e,甚至更优选地,igg4 fc结构域具有如上文所述的突变s228p。
[0259]
在一个特定方面中,根据本发明的双功能分子是包含或由以下组成的融合蛋白:
[0260]
(a)如上文所述的抗体或其抗体片段,其特异性结合至免疫细胞(特别是t细胞)表面上表达的靶点,更优选地,选自以下的靶点:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,优选地pd-1、tim3、cd244、lag-3、btla、tigit和cd160;
[0261]
(b)与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)具有至少75%同一性的il-7m,此类il-7变体包含选自以下的氨基酸取代:(i)c2s-c141s和c47s-c92s、c2s-c141s和c34s-c129s或c47s-c92s和c34s-c129s,(ii)w142h、w142f或w142y,(iii)d74e、d74q或d74n,优选地d74e或d74q;iv)q11e、y12f、m17l、q22e和/或k81r;或其任何组合,和
[0262]
(c)任选地选自以下的肽接头:(ggggs)3、(ggggs)4、(ggggs)2、gggs、ggg、ggs和(gggs)3,优选地(ggggs)3。
[0263]
在该方面的一个优选实施方式中,抗体或其抗体片段具有igg1fc结构域,其任选地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选地选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235的组合,甚至更优选地,igg1 fc结构域具有如上文所述的突变n297a。
[0264]
或者,根据本发明的双功能分子是包含或由以下组成的融合蛋白:
[0265]
(a)如上文所述的抗体或其抗体片段,其特异性结合至免疫细胞(特别是t细胞)表面上表达的靶点,更优选地,选自以下的靶点:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,优选地pd-1、tim3、cd244、lag-3、btla、tigit和cd160;
[0266]
(b)存在与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)至少75%同一性的il-7m,此类il-7变体包含氨基酸取代w142h、w142f或w142y,优选地w142h;和
[0267]
(c)任选地选自以下的肽接头:(ggggs)3、(ggggs)4、(ggggs)2、ggggs、gggs、ggg、ggs和(gggs)3,任选地(ggggs)3。
[0268]
优选地,抗体或其抗体片段具有igg1或igg4 fc结构域,其任选地具有上文详述的取代。
[0269]
在该方面的一个优选实施方式中,抗体或其抗体片段具有igg1 fc结构域,其任选地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选地选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235的组合,甚至更优选地,igg1 fc结构域具有如上文所述的突变n297a。
[0270]
或者,根据本发明的双功能分子包含或由以下组成:
[0271]
(a)如上文所述的抗体或其抗体片段,其特异性结合至免疫细胞(特别是t细胞)表面上表达的靶点;更优选地,选自以下的靶点:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,优选地pd-1、tim3、cd244、lag-3、btla、tigit和cd160;
[0272]
(b)与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)具有至少75%同一性的il-7m,此类il-7变体包含选自以下的氨基酸取代:d74e、d74q或d74n,优选地d74e;和
[0273]
(c)任选地选自以下的肽接头:(ggggs)3、(ggggs)4、(ggggs)2、ggggs、gggs、ggg、ggs和(gggs)3,任选地(ggggs)3。
[0274]
优选地,抗体或其抗体片段具有igg1或igg4 fc结构域,其任选地具有如上文所详述的取代。
[0275]
在该方面的一个优选实施方式中,抗体或其抗体片段具有igg1 fc结构域,其任选
地具有选自以下的取代或取代的组合:t250q/m428l;m252y/s254t/t256e h433k/n434f;e233p/l234v/l235a/g236a a327g/a330s/p331s;e333a;s239d/a330l/i332e;p257i/q311;k326w/e333s;s239d/i332e/g236a;n297a;l234a/l235a;n297a m252y/s254t/t256e;k322a和k444a,优选地选自以下:n297a任选地与m252y/s254t/t256e和l234a/l235的组合,甚至更优选地,igg1 fc结构域具有如上文所述的突变n297a。
[0276]
或者,根据本发明的双功能分子包含或由以下组成:
[0277]
(a)特异性结合pd-1的抗pd1抗体或其抗体片段,
[0278]
(b)存在与包含seq id no:1所示的氨基酸序列或由其组成的野生型人il-7(wth-il-7)至少75%同一性的il-7m,此类il-7变体包含氨基酸取代d74e、w142h和/或c2s-c141s c47s-c92s,和
[0279]
(c)任选地选自以下的肽接头:(ggggs)3、(ggggs)4、(ggggs)2、ggggs、gggs、ggg、ggs和(gggs)3,任选地(ggggs)3。
[0280]
优选地,抗体或其抗体片段具有igg1或igg4 fc结构域,其任选地具有如上文所详述的取代。
[0281]
优选地,抗体重链的c末端通过柔性接,优选(gly4ser)3基因融合至il-7m的n末端。在融合连接处,抗体重链的c末端赖氨酸残基(即,k444)可以突变为丙氨酸以减少蛋白水解切割。
[0282]
任选地,双功能分子还可以包含其他部分,如其他细胞因子或其他结合部分。
[0283]
在一个特定方面中,分子具有二聚体fc结构域,其上连接着单一il-7变体和单一抗原结合结构域。在另一个特定方面中,分子具有二聚体fc结构域,其上连接这单一il-7变体和两个抗原结合结构域。如本文所公开的,抗原结合结构域结合免疫细胞表面上特异性表达的任何靶点。更具体地,靶点可以选自以下:pd-1、cd28、cd80、ctla-4、btla、tigit、cd160、cd40l、icos、cd27、ox40、4-1bb、gitr、hvem、tim-1、lfa-1、tim3、cd39、cd30、nkg2d、lag3、b7-1、2b4、dr3、cd101、cd44、sirpg、cd28h、cd38、cxcr5、cd3、pdl2、cd4和cd8,更具体地选自以下:pd-1、ctla-4、btla、tigit、lag3和tim3。在一个非常特定的方面中,抗原结合结构域结合至pd-1。
[0284]
在一个特定方面中,所述分子包含第一单体,所述第一单体包含任选地通过肽接头共价连接至第一fc链的抗原结合结构域,所述第一fc链任选地通过肽接头共价连接至il-7变体,和第二单体,所述第二单体包含互补的第二fc链,优选地没有抗原结合结构域和/或il-7变体,所述第一和第二fc链形成二聚fc结构域。任选地,所述二聚fc结构域是异二聚fc结构域。更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头共价连接至第一异二聚fc链的n末端的抗原结合结构域,所述第一异二聚体fc链通过其c末端共价连接至il-7变体,任选地通过肽接头,和第二单体,所述第二单体包含没有抗原结合结构域的互补的第二异二聚fc链。任选地,所述第二单体包含没有il-7变体,优选地没有任何其他分子的互补的第二异二聚fc链。任选地,所述第二单体包含任选地在fc链的c末端与il-7变体的n末端共价连接的互补的第二异二聚fc链,任选地通过肽接头。甚至更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头通过c末端共价连接到第一异二聚fc链的n末端的抗原结合结构域,所述第一异二聚fc链任选地通过肽接头通过其c末端共价连接到il-7变体的n末端,和第二单体,所述第二单体包含互补的第二异二聚fc链,
其没有抗原结合结构域和il-7变体,优选地没有任何其他分子。例如,此类在图17中显示为“构建体3”。
[0285]
在另一个特定方面中,所述分子包含第一单体,所述第一单体包含任选地通过肽接头通过其c末端共价连接到第一异二聚fc链的n末端的抗原结合结构域,所述第一异二聚fc链任选地通过肽接头通过其c末端共价连接到il-7变体的n末端,和第二单体,所述第二单体包含互补的第二异二聚fc链,其没有抗原结合结构域并且任选地通过肽接头任选地在fc链的c末端与il-7变体的n末端共价连接。例如,此类在图17中显示为“构建体4”。
[0286]
任选地,互补的第二异二聚fc链任选地通过肽接头通过其c末端共价连接至il-7变体的n末端。
[0287]
在一个其他方面中,所述分子包含第一单体,所述第一单体包含任选地通过肽接头与第一fc链共价连接的抗原结合结构域,所述第一fc链任选地没有il-7变体,和第二单体,所述第二单体没有抗原结合结构域的互补的第二fc链的第二单体,所述第二fc链任选地通过肽接头与il-7变体共价连接,所述第二和第二fc链形成二聚fc结构域。任选地,二聚fc结构域是异二聚fc结构域。更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头与第一异二聚fc链的n末端共价连接的抗原结合结构域,所述第一异二聚fc链没有il-7变体,和第二单体,所述第二单体包含没有抗原结合结构域的互补的第二异二聚fc链的第二单体,所述第二异二聚fc链任选地通过肽接头通过c末端共价连接至il-7变体。甚至更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头通过c末端共价连接到第一异二聚fc链的n末端的抗原结合结构域,所述第一异二聚fc链没有il-7变体,和第二单体,所述第二单体包含没有抗原结合结构域的互补的第二异二聚fc链,所述第二异二聚fc链任选地通过肽接头通过c末端共价连接到il-7变体的n末端。
[0288]
在另一个特定方面中,所述分子包含第一单体,所述第一单体包含任选地通过肽接头与第一fc链共价连接的抗原结合结构域,所述第一fc链任选地通过肽接头共价连接至il-7变体,和第二单体,所述第二单体包含没有il-7变体且与抗原结合结构域连接的互补的第二fc链,所述第一和第二fc链形成二聚fc结构域。例如,此类在图17中显示为“构建体2”。任选地,所述二聚fc结构域是异二聚fc结构域。更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头与第一异二聚fc链的n末端共价连接的抗原结合结构域,所述第一异二聚fc链任选地通过肽接头通过其c末端共价连接至il-7变体,和第二单体,所述第二单体包含没有il-7变体的互补的第二异二聚fc链,并且包含任选地通过肽接头与第二异二聚fc链的n末端共价连接的抗原结合结构域。更特别地,所述分子包含第一单体,所述第一单体包含任选地通过肽接头通过c末端共价连接到第一异二聚fc链的n末端的抗原结合结构域,所述第一异二聚fc链任选地通过肽接头通过其c末端共价连接到il-7变体的n末端,和第二单体,所述第二单体包含不含il-7变体的互补的第二异二聚fc链并且包含任选地通过肽接头通过c末端共价连接到所述第二异二聚fc链的n末端的抗原结合结构域。
[0289]
接头如果存在的话可以选自本文公开的接头。
[0290]
优选地,两个单体分别包含一条fc链,所述fc链能够形成二聚fc结构域。
[0291]
在一个方面中,二聚fc融合蛋白是同二聚fc融合蛋白。在另一个方面中,二聚fc融合蛋白是异二聚fc融合蛋白。
[0292]
更具体地,fc结构域是异二聚fc结构域。通过改变每个单体的氨基酸序列来制备
异二聚fc结构域。异二聚fc结构域依赖于每条链上不同的恒定区中的氨基酸变体,以促进异二聚体形成和/或使异二聚体在同源二聚体中的纯化变得容易。有很多机制可用于产生本发明的异二聚体。此外,如本领域技术人员将理解的,可以将这些机制组合以确保高度异二聚化。因此,将导致异二聚体产生的氨基酸变体称为“异二聚变体”。异二聚变体可以包括空间变体(例如,下文描述的“杵和臼”或“倾斜”变体以及下文描述的“电荷对”变体)以及“pi变体”,其允许从异二聚体中纯化同源二聚体。wo2014/145806,其全部内容通过引用并入,公开了用于异二聚化的有用机制,包括“杵和臼”、“静电转向”或“电荷对”、pi变体和一般附加的fc变体。亦参见,ridgway等,protein engineering 9(7):617(1996);atwell等,j.mol.biol.1997 270:26;美国专利号8,216,805,merchant等,nature biotech.16:677(1998),其全部的全部内容均通过引用并入本文。对于“静电转向”,参见gunasekaran等,j.biol.chem.285(25):19637(2010),其全部内容通过引用并入本文。对于pi变体,参见美国2012/0149876,其全部内容通过引用并入本文。
[0293]
然后,在一个优选的方面中,基于“杵和臼”技术,异二聚体fc结构域包含第一fc链和互补的第二fc链。例如,第一fc链是“杵”或k链,指其包含表征杵链的取代,并且第二f链是“臼”或h链,指其包含表征臼链的取代。反之亦然,第一fc链是“臼”或h链,指其包含表征臼链的取代,第二fc链是“杵”或k链,指其包含表征杵链的取代。在一个优选的方面中,第一fc链是“臼”或h链和第二fc链是“杵”或k链。
[0294]
图17提供了根据本发明的双功能分子结构的实例。
[0295]
任选地,异二聚fc结构域可以包含一个异二聚fc链,其包含下表中所示的取代,和另一个二聚fc链,其包含下表中所示的取代。
[0296]
表g(根据eu索引编号)
[0297]
[0298]
在一个优选的方面中,第一fc链是“臼”或h链并且包含取代t366s/l368a/y407v/y349c,和第二fc链是“杵”或k链并且包含取代t366w/s354c。
[0299]
任选地,所述fc链可以进一步包含其他取代。
[0300]
在一个方面中,根据本发明的双功能分子包含fc结构域的异二聚体,其包含如上文所述的“杵在臼中”的修饰。优选地,此类fc结构域是如上文所述的igg1或igg4 fc结构域,甚至更优选地,igg1 fc结构域包含如上文所述的突变n297a。
[0301]
例如,第一fc链是“臼”或h链并且包含取代t366s/l368a/y407v/y349c和n297a,和第二fc链是“杵”或k链并且包含取代t366w/s354c和n297a。更特别地,第二fc链可以包含seq id no:75或由其组成和/或第一fc链可以包含seq id no:77或由其组成。
[0302]
更具体地,根据本发明的il7变体连接至异二聚体fc结构域的杵链和/或臼链。因此,根据本发明的双功能分子可以包含i)连接至fc结构域的臼链或杵链的单一il7变体,或ii)两个il7变体,一个连接至fc结构域的臼链和一个连接至fc结构域的杵链。优选地,根据本发明的双功能分子包含连接至fc结构域的臼链的单一il7变体。
[0303]
在第一个方面中,双功能分子包含连接至fc结构域的杵链的c末端或n末端的il7变体。任选地,此类fc结构域未连接至抗原结合结构域。或者,此类fc结构域连接至抗原结合结构域。
[0304]
在第二个方面中,双功能分子包含连接至臼链fc结构域的c末端的il7变体。优选地,此类fc结构域在其n末端连接至抗原结合结构域。
[0305]
任选地,双功能分子包含连接至fc结构域臼链的c末端的单一il7变体,其中所述双功能分子仅包含在fc结构域的臼链的n末端中连接的单一抗原结合结构域。在此类方面中,杵链结构域没有il7变体,并且有或没有抗原结合结构域。
[0306]
更特别地,双功能分子包含优选地通过其n末端,任选地通过接头,连接至fc结构域的臼链的c末端的单一il7变体,其中所述双功能分子仅包含在fc结构域臼链的n末端处连接的单一抗原结合结构域,和杵链没有il7变体和抗原结合结构域。
[0307]
因此,本发明的一个目的涉及一种多肽,其从n末端到c末端包含抗原结合结构域(或至少其对应于重链的部分)、fc链(杵或臼fc链),优选地fc结构域的臼链和il7变体。互补链包含没有il7变体和抗原结合结构域的互补的fc链,优选fc结构域的杵链。
[0308]
在另一个特定方面中,所述双功能分子包含单一il7变体,所述单一il7变体任选地通过肽接头通过其n末端连接至fc结构域臼链的c末端,其中所述双功能分子包含在fc结构域的臼链的n末端连接的抗原结合结构域,和不含il7变体的杵链,以及包含通过其c末端连接至杵链的n末端的抗原结合结构域。
[0309]
因此,本发明的一个目的涉及一种多肽,其从n末端到c末端包含抗原结合结构域(或至少其对应于重链的部分)、fc结构域(杵或臼fc链),优选地fc结构域的臼链和il7变体。互补链从n末端到c末端包含抗原结合结构域(或至少其对应于重链的部分)和没有il7变体的互补的fc链,优选fc结构域的杵链。
[0310]
在另一个特定方面中,双功能分子包含单一il7变体,所述单一il7变体任选地通过接头连接至杵链的n末端或c末端,和双功能分子包含通过其c末端在fc结构域的臼链的n末端连接的抗原结合结构域,臼链没有il7变体。
[0311]
任选地,抗原结合结构域可以是fab结构域、fab’、单链可变片段(scfv)或单结构
域抗体(sdab)。抗原结合结构域优选地包含重链可变区(vh)和轻链可变区(vl)。当抗原结合结构域是fab或fab’时,所述分子还包含重链和轻链恒定结构域(即,ch和cl)。
[0312]
当抗原结合结构域是fab或fab’时,双功能分子还可以包含连接至抗原结合结构域的vl结构域的c末端的il-7变体。
[0313]
根据本发明的双功能分子可以包含一个或两个抗原结合结构域。任选地,一个抗原结合结构域可以连接至杵fc链的n末端和一个抗原结合结构域可以连接至臼fc链的n末端。或者,单一抗原结合结构域连接至杵fc链或臼fc链的n末端。优选地,il-7变体连接至fc链,所述fc链连接至抗原结合结构域。在一个特定方面中,抗原结合结构域靶向pd-1。
[0314]
例如,靶向pd-1的抗原结合结构域可以衍生自选自以下的抗pd1抗体:派姆单抗(也称为keytruda帕博利珠单抗,mk-3475)、纳武单抗(opdivo,mdx-1106,bms-936558,ono-4538)、匹地利珠单抗(ct-011)、西米普利单抗(libtayo)、卡瑞利珠单抗、aunp12、amp-224、agen-2034、bgb-a317(替雷利珠单抗)、pdr001(斯巴达珠单抗)、mk-3477、sch-900475、pf-06801591、jnj-63723283、杰诺单抗(cbt-501)、lzm-009、bcd-100、shr-1201、bat-1306、ak-103(hx-008)、medi-0680(也称为amp-514)medi0608、js001(参见si-yang liu等,j.hematol.oncol.10:136(2017))、bi-754091、cbt-501、incshr1210(也称为shr-1210)、tsr-042(也称为anb011)、gls-010(也称为wbp3055)、am-0001(armo)、sti-1110(参见wo 2014/194302)、agen2034(参见wo 2017/040790)、mga012(参见wo 2017/19846)或ibi308(参见wo 2017/024465、wo 2017/025016、wo 2017/132825和wo 2017/133540)、单克隆抗体5c4、17d8、2d3、4h1、4a11、7d3和5f4,在wo 2006/121168中描述的。靶向pd-1的双功能或双特异性分子也是公知的,如rg7769(roche)、xmab20717(xencor)、medi5752(astrazeneca)、fs118(f-star)、sl-279252(takeda)和xmab23104(xencor)。特别地,靶向pd-1的抗原结合结构域包含在该列表中选择的抗pd1抗体的6个cdr或者vh和vl。此类抗原结合结构域尤其可以是源自该抗体的fab或svfc结构域。在一个优选的方面中,靶向pd-1的抗原结合结构域包含选自以下的抗pd1抗体的6个cdr或者vh和vl:派姆单抗(也称为keytruda帕博利珠单抗,mk-3475)或纳武单抗(opdivo,mdx-1106,bms-936558,ono-4538),并且可以是例如fab或scfc结构域。
[0315]
在一个特定方面中,靶向pd-1的抗原结合结构域衍生自在wo2020/127366中公开的抗体,其公开内容通过引用并入本文。
[0316]
然后,抗原结合结构域包含:
[0317]
(i)重链可变结构域,其包含hcdr1、hcdr2和hcdr3,和
[0318]
(ii)轻链可变结构域,其包含lcdr1、lcdr2和lcdr3,
[0319]
其中:
[0320]-重链cdr1(hcdr1)包含或由seq id no:51的氨基酸序列组成,其任选地在seq id no:51的任何位置而非位置3具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0321]-重链cdr2(hcdr2)包含或由seq id no:53的氨基酸序列组成,其任选地在seq id no:53的任何位置而非位置13、14和16具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0322]-重链cdr3(hcdr3)包含或由seq id no:54的氨基酸序列组成,其中x1是d或e和x2
选自以下:t、h、a、y、n、e和s,优选地选自以下:h、a、y、n、e;其任选地在seq id no:54的任何位置而非位置2、3、7和8具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0323]-轻链cdr1(lcdr1)包含或由seq id no:63的氨基酸序列组成,其中x是g或t,其任选地在seq id no:63的任何位置而非位置5、6、10、11和16具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0324]-轻链cdr2(lcdr2)包含或由seq id no:66的氨基酸序列组成,其任选地具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;和
[0325]-轻链cdr3(lcdr3)包含或由seq id no:16的氨基酸序列组成,其任选地在seq id no:16的任何位置而非位置1、4和6具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。
[0326]
在一个方面中,抗原结合结构域包含:
[0327]
(i)重链可变结构域,其包含hcdr1、hcdr2和hcdr3,和
[0328]
(ii)轻链可变结构域,其包含lcdr1、lcdr2和lcdr3,
[0329]
其中:
[0330]-重链cdr1(hcdr1)包含或由seq id no:51的氨基酸序列组成,其任选地在seq id no:51的任何位置而非位置3具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0331]-重链cdr2(hcdr2)包含或由seq id no:53的氨基酸序列组成,其任选地在seq id no:53的任何位置而非位置13、14和16具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0332]-重链cdr3(hcdr3)包含或由seq id no:54的氨基酸序列组成,其中x1是d和x2选自以下:t、h、a、y、n、e和s,优选地选自以下:h、a、y、n、e;或者x1是e和x2选自以下:t、h、a、y、n、e和s,优选地选自以下:h、a、y、n、e、和s;其任选地在seq id no:54的任何位置而非位置2、3、7和8具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0333]-轻链cdr1(lcdr1)包含或由seq id no:63的氨基酸序列组成,其中x是g或t,其任选地在seq id no:63的任何位置而非位置5、6、10、11和16具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0334]-轻链cdr2(lcdr2)包含或由seq id no:66的氨基酸序列组成,其任选地具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;和
[0335]-轻链cdr3(lcdr3)包含或由seq id no:16的氨基酸序列组成,其任选地在seq id no:16的任何位置而非位置1、4和6具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。
[0336]
在另一个实施方式中,抗原结合结构域包含或基本上由以下组成:(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:55、56、57、58、59、60、61或62的cdr3;和(ii)轻链,包含seq id no:64或seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3。
[0337]
在另一个方面中,抗原结合结构域包含或基本上由以下组成:
[0338]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:55的
cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0339]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:56的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0340]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:57的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0341]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:58的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0342]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:59的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0343]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:60的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0344]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:61的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0345]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:62的cdr3;和(ii)轻链,包含seq id no:64的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0346]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:55的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0347]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:56的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0348]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:57的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0349]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:58的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0350]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:59的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0351]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:60的
cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0352]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:61的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3;或者
[0353]
(i)重链,包含seq id no:51的cdr1,seq id no:53的cdr2和seq id no:62的cdr3;和(ii)轻链,包含seq id no:65的cdr1,seq id no:66的cdr2和seq id no:16的cdr3。
[0354]
在一个方面中,根据本发明的抗pd1抗体或抗原结合片段包含框架区,特别是重链可变区框架区(hfr)hfr1、hfr2、hfr3和hfr4和轻链可变区框架区(lfr)lfr1、lfr2、lfr3和lfr4。
[0355]
优选地,根据本发明的抗pd1抗体或抗原结合片段包含人源或人源化框架区。用于本文目的的“人受体框架”是包含衍生自人免疫球蛋白框架或人共有框架的轻链可变结构域(vl)框架或重链可变结构域(vh)框架的氨基酸序列的框架,如下文所定义的。衍生自人免疫球蛋白框架或人共有框架的人受体框架可以包含其相同的氨基酸序列,或者其可以包含氨基酸序列变化。在一些实施方式中,氨基酸变化的数量是10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少或者2个或更少。在一些实施方式中,vl受体人框架在序列上与vl人免疫球蛋白框架序列或人共有框架序列相同。“人共有框架”是代表在选择的人免疫球蛋白vl或vh框架序列中最常见的氨基酸残基的框架。
[0356]
特别地,抗pd1抗体或抗原结合片段包含重链可变区框架区(hfr)hfr1、hfr2、hfr3和hfr4,其分别包含氨基酸序列seq id no:41、42、43和44,其任选地在hfr(即,seq id no:43)的任何位置而非位置27、29和32具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。优选地,抗pd1抗体或抗原结合片段包含seq id no:41的hfr1、seq id no:42的hfr2、seq id no:43的hfr3和seq id no:44的hfr4。
[0357]
或者或另外地,抗pd1抗体或抗原结合片段包含轻链可变区框架区(lfr)lfr1、lfr2、lfr3和lfr4,其分别包含氨基酸序列seq id no:45、46、47和48,其任选地具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。优选地,人源化抗pd1抗体或抗原结合片段包含seq id no:45的lfr1、seq id no:46的lfr2、seq id no:47的lfr3和seq id no:48的lfr4。
[0358]
在根据本发明的双功能分子中包含的抗hpd1抗体的vl和vh结构域可以包含被三个互补决定区中断的四个框架区,优选地以以下顺序可操作地连接:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4(从氨基末端到羧基末端)。
[0359]
在一个方面中,抗原结合结构域包含或基本上由以下组成:
[0360]
(a)重链可变区(vh),其包含或由seq id no:17的氨基酸序列组成,其中x1是d或e和x2选自以下:t、h、a、y、n、e和s,优选地选自以下:h、a、y、n、e;其任选地在seq id no:17的任何位置而非位置7、16、17、20、33、38、43、46、62、63、65、69、73、76、78、80、84、85、88、93、95、96、97、98、100、101、105、106和112具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0361]
(b)轻链可变区(vl),其包含或由seq id no:26的氨基酸序列组成,其中x是g或t,其任选地在seq id no:26的任何位置而非位置3、4、7、14、17、18、28、29、33、34、39、42、44、50、81、88、94、97、99和105具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。
[0362]
在另一个方面中,抗原结合结构域包含或基本上由以下组成:
[0363]
(a)重链可变区(vh),其包含或由seq id no:18、19、20、21、22、23、24或25的氨基酸序列组成,其任选地分别在seq id no:18、19、20、21、22、23、24或25的任何位置而非位置7、16、17、20、33、38、43、46、62、63、65、69、73、76、78、80、84、85、88、93、95、96、97、98、100、101、105、106和112具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合;
[0364]
(b)轻链可变区(vl),其包含或由seq id no:27或seq id no:28的氨基酸序列组成,其任选地在seq id no:27或seq id no:28的任何位置而非位置3、4、7、14、17、18、28、29、33、34、39、42、44、50、81、88、94、97、99和105具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。
[0365]
在另一个方面中,抗原结合结构域包含或基本上由以下组成:
[0366]
(a)重链可变区(vh),其包含或由seq id no:18、19、20、21、22、23、24或25的氨基酸序列组成;
[0367]
(b)轻链可变区(vl),其包含或由seq id no:27或seq id no:28的氨基酸序列组成。
[0368]
在另一个方面中,抗原结合结构域包含或基本上由以下任何重链可变区(vh)和轻链可变区(vl)的组合组成:
[0369]
[0370][0371]
在一个非常特定的方面中,抗原结合结构域包含或基本上由seq id no:24的重链可变区(vh)和seq id no:28的轻链可变区(vl)组成:
[0372]
在一个特定实施方式中,双功能分子包含:
[0373]
(a)重链,其包含或由选自以下的氨基酸序列组成:seq id no:29、30、31、32、33、34、35或36,其任选地分别在seq id no:29、30、31、32、33、34、35或36的任何位置而非位置7、16、17、20、33、38、43、46、62、63、65、69、73、76、78、80、84、85、88、93、95、96、97、98、100、101、105、106和112具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合,并且取代对应于臼或杵链,优选地臼链,更具体地如在表g中所公开的,特别地,在seq id no:29、30、31、32、33、34、35或36中,在任何seq id no:29、30、31、32、33、34、35或36中的t363s/l365a/y4047v/y346c或t363w/s351c,优选地t363s/l365a/y4047v/y346c和任选地n294a;
[0374]
(b)轻链,其包含或由选自以下的氨基酸序列组成:seq id no:37或seq id no:38,其任选地在seq id no:37或seq id no:38的任何位置而非位置3、4、7、14、17、18、28、29、33、34、39、42、44、50、81、88、94、97、99和105具有选自以下的一种、两种或三种修饰:取代、添加、缺失及其任何组合。
[0375]
在另一个方面中,双功能分子包含或由重链(ch)和轻链(cl)的任何下述组合组成:
[0376][0377]
重链包含对应于臼链或杵链的取代,优选臼链,更具体地如在表g中所公开的,特别地,在seq id no:29、30、31、32、33、34、35或36中,特别地在seq id no:29、30、31、32、33、34、35或36中任一个的t366s/l368a/y407v/y349c或t366w/s354c,优选地t366s/l368a/y407v/y349c,和任选地n297a,取代的位置根据eu编号定义。
[0378]
因此,在一个方面中,根据本发明的双功能分子包含或由以下组成:
[0379]
(a)抗人pd-1抗原结合结构域,其包含(i)具有第一fc链的一个重链,和(ii)一个轻链,
[0380]
(b)il-7变体,和
[0381]
(c)互补的第二fc链,
[0382]
其中il-7变体任选地通过肽接头共价连接,优选通过其n末端与第一fc链的c末端
和/或与第二fc链的n末端或c末端共价连接。
[0383]
il-7变体可以是如上文公开的任何il-7变体。
[0384]
第一和第二fc链可以是如上文所公开的。优选地,fc链优选地是来自igg1或igg4抗体的fc链。
[0385]
抗人pd-1抗原结合结构域是如上文所公开的。
[0386]
在一个方面中,双功能分子包含单一抗人pd-1抗原结合结构域(只有一个)。优选地,双功能分子包含选自以下的单一抗人pd-1抗原结合结构域:抗人pd-1fab、抗人pd-1fab’、抗人pd-1scfv和抗人pd-1sdab。
[0387]
双功能分子包含一个或两个il-7变体,优选单一il-7变体。
[0388]
双功能分子可以包含轻链,其包含或由seq id no:37或38组成。
[0389]
双功能分子可以包含重链,其包含或由seq id no:29、30、31、32、33、34、35和36的任一个组成,fc链被任选地修饰以促进fc链的异二聚化以形成异二聚fc结构域。更具体地,重链包含对应于臼或杵链的取代,优选地臼链,更具体地如在表g中所公开的,特别地在seq id no:29、30、31、32、33、34、35或36中任一个的t366s/l368a/y407v/y349c或t366w/s354c,优选地t366s/l368a/y407v/y349c,和任选地n297a,取代的位置根据eu编号定义。
[0390]
在一个非常特定的方面中,双功能分子包含轻链,其包含或由seq id no:38组成,和重链,其包含或由seq id no:35组成,fc链被任选地修饰以促进fc链的异二聚化以形成异二聚fc结构域。
[0391]
在一个非常特定的方面中,双功能分子可以包含seq id no:75的第一单体和第二单体,所述第二单体包含seq id no:77的fc链,其在n末端任选通过接头连接至抗原结合结构域(特别是seq id no:79),并且在c末端任选通过接头连接至任何如本文所公开的il-7变体。更特别地,双功能分子包含seq id no:75的第一单体,seq id no:83的第二单体和seq id no:37、38或80的第三单体,优选地seq id no:38或80。
[0392]
在另一个非常特定的方面中,双功能分子可以包含seq id no:77的第一单体和包含fc链seq id no:75的第二单体,其在n末端任选通过接头连接至抗原结合结构域(特别是seq id no:79),并且在c末端任选通过接头连接至任何如本文所公开的il-7变体。更特别地,双功能分子包含seq id no:77的第一单体,seq id no:82的第二单体和seq id no:37、38或80的第三单体,优选地seq id no:38或80。
[0393]
在另一个非常特定的方面中,双功能分子可以包含seq id no:75的第一单体,其在n末端任选地通过接头连接至抗原结合结构域(特别是seq id no:79),和第二单体,其包含fc链seq id no:77,其在n末端任选通过接头连接至抗原结合结构域(特别是seq id no:79),并且在c末端任选通过接头连接至任何如本文所公开的il-7变体。更特别地,双功能分子包含seq id no:81的第一单体,seq id no:83的第二单体和seq id no:37、38或80的第三单体,优选地seq id no:38或80。
[0394]
在另一个非常特定的方面中,双功能分子可以包含seq id no:77的第一单体,其在n末端任选地通过接头连接至抗原结合结构域(特别是seq id no:79),和第二单体,其包含fc链seq id no:75,其在n末端任选通过接头连接至抗原结合结构域(特别是seq id no:79),并且在c末端任选通过接头连接至任何如本文所公开的il-7变体。
[0395]
双功能分子的制备-编码il-7变体或突变体的核酸分子或者包含其的融合蛋白和
双功能分子,包含其的重组表达载体和宿主细胞
[0396]
为生产根据本发明的il-7变体或突变体、融合蛋白或双功能分子,特别是通过哺乳动物细胞,将编码il-7变体或突变体、融合蛋白或双功能分子的核酸序列或核酸序列的组亚克隆到一个或多个表达载体中。此类载体通常用于转染哺乳动物细胞。用于生产包含抗体序列的分子的一般技术描述于coligan等(编著),current protocols in immunology,第10.19.1-10.19.11页(wiley interscience 1992),其内容通过引用并入本文中和来自w.h.freeman和company的“antibody engineering:a practical guide”(1992),其中与分子生产相关的评述散布在各个文本中。
[0397]
通常,此类方法包括以下步骤:
[0398]
(1)使用编码本发明的il-7变体或突变体、融合蛋白或重组双功能分子的一个或多个多核苷酸或其变体或者包含所述一个或多个多核苷酸的载体转染或转化适当宿主细胞;
[0399]
(2)在合适的培养基中培养所述宿主细胞;和
[0400]
(3)任选地从所述培养基或宿主细胞中分离或纯化所述蛋白。
[0401]
本发明进一步涉及编码如上文所公开的il-7变体或突变体、融合蛋白或双功能分子的核酸,包括本发明的核酸的载体,优选表达载体,用本发明的载体或直接用编码il-7变体或突变体、融合蛋白或重组双功能分子的序列转化的基因工程化宿主细胞,和用于通过重组技术来生产本发明的蛋白的方法。
[0402]
下文将更具体地描述核酸、载体和宿主细胞。
[0403]
核酸序列
[0404]
本发明还涉及编码如上文所定义的il-7变体或突变体、融合蛋白或双功能分子的核酸分子,或者编码如上文所定义的il-7变体或突变体、融合蛋白或双功能分子的核酸分子组。可以通过本领域公知的任何技术扩增编码本文公开的il-7变体或突变体、融合蛋白或双功能分子的核酸,如pcr。可以使用常规程序容易地分离和测量此类核酸。
[0405]
特别地,编码如本文定义的双功能分子的核酸分子包含:
[0406]-第一核酸分子,其编码如本文所公开的结合部分,和
[0407]-第二核酸分子,其编码il-7m,优选人il-7m。
[0408]
在一个非常特定的实施方式中,编码结合部分的核酸分子包含可变重链结构域,其具有seq id no:73中所示的序列,和/或可变轻链结构域,其具有seq id no:74中所示的序列。
[0409]
在一个实施方式中,第二核酸分子可操作地连接至第一核酸,其任选地通过编码肽接头的核酸连接。可操作地连接指核酸编码蛋白融合。然后,在一个特定方面中,核酸编码融合蛋白,所述融合蛋白包含结合部分,任选地肽接头和本文公开的il-7变体。优选地,在此类核酸分子中,当结合部分包含fc结构域时,il-7变体的n末端与重链恒定结构域的c末端融合,优选地通过肽接头融合。
[0410]
在一个实施方式中,核酸分子是分离的,特别是非天然的核酸分子。
[0411]
在一个方面中,核酸编码il-7m,其具有seq id no:2至15中所示的氨基酸序列。
[0412]
载体
[0413]
在另一个方面中,本发明涉及包含如上文定义的核酸分子或核酸分子组的载体。
[0414]
如本文所用,“载体”是用作载剂的核酸分子,其将遗传物质转移至细胞中。术语“载体”包含质粒、病毒、粘粒和人工染色体。在通常情况下,工程化的载体包含复制原点、多克隆位点和选择性标志物。载体本身通常是一个核苷酸序列,通常是一个dna序列,其包含一个插入片段(转基因)和一个更大的序列,作为载体的“骨架”。除了转基因插入物和骨架之外,现代载体可能还包含其他特征:启动子、遗传标志物、抗生素抗性、报告基因、靶向序列、蛋白纯化标签。称为表达载体(表达构建体)的载体特定用于在目标细胞中表达转基因,并且通常具有控制序列。
[0415]
本领域技术人员可以将编码双功能分子、融合蛋白、结合部分或il-7变体的核酸分子克隆到载体中,然后转化到宿主细胞中。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。本领域技术人员公知的方法可用于构建表达载体,所述表达载体含有本文所述的双功能分子、融合蛋白、结合部分或il-7变体的核酸序列以及用于转录/翻译的适当调控成分。
[0416]
因此,本发明还提供了一种重组载体,其包含编码本发明的双功能分子、融合蛋白、结合部分或il-7变体的核酸分子。在一个优选实施方式中,表达载体还包含启动子和编码分泌信号肽的核酸序列,以及任选的至少一种用于筛选的耐药基因。表达载体还可以包含用于启动翻译、转录终止子等的核糖体结合位点。
[0417]
适宜的表达载体通常包含(1)编码细菌复制原点和抗生素抗性标记的原核dna元件,以提供表达载体在细菌宿主中的生长和选择;(2)控制转录起始的真核dna元件,如启动子;和(3)控制转录物加工的dna元件,如转录终止/多聚腺苷酸化序列。
[0418]
可以使用多种技术将表达载体引入宿主细胞,包括磷酸钙转染、脂质体介导的转染、电穿孔等。优选地,对转染细胞进行选择和增殖,其中将表达载体稳定整合至宿主细胞基因组中以产生稳定的转化体。
[0419]
宿主细胞
[0420]
在另一个方面中,本发明涉及包含如上文定义地载体或核酸分子或核酸分子组的宿主细胞,例如其用于双功能分子产生目的。
[0421]
如本文所用,术语“宿主细胞”旨在包括可以是或曾经是载体、外源核酸分子和多核苷酸,其编码根据本发明的双功能分子、融合蛋白、结合部分或il-7变体。术语“宿主细胞”还旨在包括单个细胞的后代或可能后代。适宜宿主细胞包括原核细胞或真核细胞,并且还包括但不限于细菌、酵母细胞、真菌细胞、植物细胞和动物细胞,如昆虫细胞和哺乳动物细胞,例如,小鼠、家兔、猕猴或人
[0422]
适宜的宿主细胞尤其是提供适宜的翻译后修饰如糖基化的真核宿主细胞。优选地,此类适宜的真核宿主细胞可以是真菌,如毕赤酵母、酿酒酵母、粟酒裂殖酵母;昆虫细胞,如粘虫;植物细胞如烟草,和哺乳动物细胞如bhk细胞、293细胞、cho细胞、nso细胞和cos细胞。
[0423]
优选地,本发明的宿主细胞选自以下:cho细胞、cos细胞、nso细胞和hek细胞。
[0424]
然后,宿主细胞稳定或瞬时表达根据本发明的双功能分子、融合蛋白、结合部分和/或il-7变体。此类表达方法是本领域技术人员公知的。
[0425]
本文还提供了产生il-7变体或突变体、融合蛋白或双功能分子的方法。该方法包括在适合其表达的条件下培养包含编码如上文提供的双功能分子、融合蛋白、结合部分和/
或il-7变体的核酸的宿主细胞,并且任选地从宿主细胞(或宿主细胞培养基)回收双功能分子、融合蛋白、结合部分和/或il-7变体。特别地,对于双功能分子的重组生产,分离编码双功能分子的核酸,例如,如上文所述的,并将其插入一个或多个载体中,用于在宿主细胞中进一步克隆和/或表达。然后通过本领域公知的任何方法分离和/或纯化il-7变体或突变体、融合蛋白双功能分子。这些方法包括但不限于常规复性处理、蛋白沉淀剂(例如盐沉淀)处理、离心、通过渗透的细胞裂解、超声、超速离心、分子筛层析法或凝胶层析法、吸附层析法、离子交换层析法、hplc、任何其他液相层析法及其组合。如例如coligan所描述的,双功能分子分离技术可以特别地包括使用蛋白a琼脂糖的亲和层析法、体积排阻层析法和离子交换层析法。优选地将蛋白a用于分离本发明所述的双功能分子。
[0426]
药物组合物及其施用方法
[0427]
本发明还涉及药物组合物,其包含本文所述的任何il-7变体或突变体、融合蛋白或双功能分子,如上所述的核酸分子、核酸分子组、载体和/或宿主细胞,优选作为活性成分或化合物。可以将制剂灭菌,如果需要,可以与辅助剂混合,如药学上可接受的载体、赋形剂、盐、抗氧化剂和/或稳定剂,其不会与本发明的双功能分子,本发明的核酸、载体和/或宿主细胞发生有害相互作用,并且不赋予任何不希望的毒理学作用。任选地,药物组合物可以进一步包含其他治疗剂。
[0428]
特别地,可以将根据本发明的药物组合物配制用于任何常规施用途径,包括局部、肠内、口服、胃肠外、鼻内、静脉内、肌内、皮下或眼内施用等。为了便于施用,本文所述的双功能分子可以制成药物组合物用于体内施用。制备此类组合物的方法已在本领域中描述(参见,例如,remington:the science and practice of pharmacy,lippincott williams&wilkins,第21版(2005)。
[0429]
药物组合物可以通过将具有所需纯度的双功能分子与任选的药学上可接受的载体、赋形剂、抗氧化剂和/或冻干制剂或水溶液形式的稳定剂混合来制备。此类适宜的载体、赋形剂、抗氧化剂和/或稳定剂是本领域众所周知的,并且例如已描述在remington's pharmaceutical sciences第16版,osol,a.ed.(1980)中。
[0430]
为了便于递送,可以将任何双功能分子或其编码核酸与伴侣剂缀合。伴侣剂可以是天然存在的物质,如蛋白(例如,人血清白蛋白、低密度脂蛋白或球蛋白)、碳水化合物(例如,葡聚糖、支链淀粉、几丁质、壳聚糖、菊粉、环糊精或透明质酸)或脂质。其也可以是重组或合成分子,如合成聚合物,例如,合成多肽。
[0431]
根据本发明的药物组合物可以配制成在施用后基本上立即或在施用后的任何预定时间或时间段释放活性成分(例如,本发明的双功能分子)。在一些方面中,药物组合物可以采用定时释放、延迟释放和持续释放递送系统,使得组合物的递送发生在待治疗部位之前并且有足够的时间引起待治疗部位的致敏。本领域公知的方法可用于防止或最小化组合物的释放和吸收,直至其到达靶组织或器官,或确保组合物的定时释放。此类系统可以避免组合物的重复施用,从而增加受试者和医师的便利。
[0432]
本领域技术人员将理解,本发明的制剂可以与人血等渗,即本发明的制剂具有与人血基本相同的渗透压。这种等渗制剂通常具有约250mosm至约350mosm的渗透压。等渗性可以通过例如蒸汽压或冰冻型渗透压计来测量。
[0433]
药物组合物在制造和储存条件下通常必须是无菌和稳定的。可以通过灭菌程序
(例如通过微滤)和/或通过加入各种抗菌剂和抗真菌剂来确保防止微生物的存在。
[0434]
可与载体材料组合以产生单一剂型的活性成分的量将根据所治疗的受试者和特定的施用方式而变化。可与载体材料组合以产生单一剂型的活性成分的量通常是产生治疗效果的组合物的量。
[0435]
受试者、方案和施用
[0436]
本发明涉及如本文公开的il-7变体或突变体、融合蛋白或双功能分子;核酸或编码其的载体、宿主细胞或药物组合物、核酸、载体或宿主细胞,其用作药物或者用于治疗疾病或者用于在受试者中施用或用作药物。还涉及在受试者中治疗疾病或病症的方法,其包括向受试者施用治疗有效量的药物组合物或双功能分子。在下文“方法和用途”部分下更具体地描述了治疗的实例。
[0437]
待治疗的受试者可以是人,尤其是处于产前阶段的人、新生儿、儿童、婴儿、青少年或成年人,特别是至少30岁、40岁的成年人,优选至少50岁的成年人,甚至更优选地,至少60岁的成年人,甚至更优选地,至少70岁的的成年人。
[0438]
在一个特定方面中,受试者可能是免疫抑制的或免疫功能低下的。
[0439]
可使用本领域普通技术人员公知的常规方法向受试者施用双功能分子或本文公开的药物组合物,其取决于要治疗的疾病类型或疾病部位,例如,口服、胃肠外、肠内、通过吸入喷雾、局部、直肠、鼻腔、口腔、阴道或通过植入的储库施用。优选地,双功能分子或药物组合物通过皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、肿瘤内、胸骨内、鞘内、病灶内和颅内注射或输注技术施用。
[0440]
本发明的药物组合物或双功能分子的药物组合物的形式、施用途径和施用剂量可以由本领域技术人员根据感染类型和严重程度,以及患者,特别是其年龄、体重、体型、性别和/或一般身体状况进行调整。本发明的组合物可以多种方式施用,这取决于是否需要局部或全身治疗。
[0441]
在治疗疾病中的用途
[0442]
本发明的双功能分子、核酸、载体、宿主细胞、组合物和方法具有很多体外和体内效用和应用。特别地,本文提供的任何il-7变体或突变体、融合蛋白或双功能分子、核酸分子、核酸分子组、载体、宿主细胞或药物组合物可用于治疗方法和/或用于治疗目的。
[0443]
本发明还涉及il-7变体或突变体、融合蛋白或双功能分子、核酸或编码其的载体、或包含其的药物组合物,其用于治疗受试者的病况和/或病症和/或用作药物或疫苗。其还涉及如本文所述的il-7变体或突变体、融合蛋白或双功能分子;编码其的核酸或载体,或包含其的药物组合物的用途,其用于在受试者中治疗疾病和/或病症。最后,本发明涉及在受试者中治疗疾病或病症的方法,其包括向受试者施用治疗有效量的药物组合物或il-7变体或突变体、融合蛋白或双功能分子,或编码其的核酸或载体。
[0444]
在一个实施方式中,本发明涉及一种在有需要的受试者中治疗选自癌症、感染性疾病和慢性病毒感染的疾病和/或病症的方法,其包括向所述受试者施用有效量的如上文定义的il-7变体或突变体、融合蛋白或双功能分子或药物组合物。此类疾病的实例在下文中更具体地描述。
[0445]
在一个方面中,治疗方法包括:(a)鉴定需要治疗的患者;和(b)向患者施用治疗有效量的本文所述的il-7变体或突变体、融合蛋白或双功能分子、核酸、载体或药物组合物的
任何一种。
[0446]
需要治疗的受试者可以是患有疾病,处于患病风险中或疑似患有疾病的人。此类患者可以通过常规医学检查来鉴定。
[0447]
在另一个方面中,本文公开的双功能分子可以例如在体内向受试者施用,以增强免疫力,优选地为了治疗病症和/或疾病。因此,在一个方面中,本发明提供了一种在受试者中改变免疫应答的方法,其包括向所述受试者施用本发明的双功能分子、核酸、载体或药物组合物,从而改善在所述受试者中的免疫应答。优选地,免疫应答被增强、增加、刺激或上调。双功能分子或药物组合物可用于增强需要治疗的受试者的免疫应答,如t细胞激活。在一个特定实施方式中,双功能分子或药物组合物可用于减少t细胞耗竭或重新激活耗竭的t细胞。
[0448]
本发明特别提供了增强受试者的免疫应答的方法,包括向受试者施用治疗有效量的任何包含本文所述的双功能分子、核酸、载体或药物组合物,以使得在受试者中的免疫应答得到增强。在一个特定实施方式中,双功能分子或药物组合物可用于减少t细胞耗竭或重新激活耗竭的t细胞。
[0449]
根据本发明所述的双功能分子靶向cd127 免疫细胞,特别是cd127 t细胞。这种细胞可在以下特别感兴趣的区域中发现:淋巴结中的常驻淋巴细胞(主要在副皮质内,偶尔有细胞在滤泡中),扁桃体(滤泡间区域),脾脏(主要在白髓的小动脉周围淋巴鞘(pals)和红髓中的一些分散细胞中),胸腺(主要在髓质中;也在皮质中),骨髓(分散分布),整个消化道(胃、十二指肠、空肠、回肠、盲肠结肠、直肠)的galt(肠道相关淋巴组织,主要在毛囊间区域和固有层中)中,胆囊的malt(粘膜相关淋巴组织)中。因此,本发明所述的双功能分子对于治疗位于或涉及这些区域的疾病(特别是癌症)具有特别的意义。
[0450]
癌症
[0451]
在另一个实施方式中,本发明提供了如本文所公开的il-7变体或突变体、融合蛋白或双功能分子或药物组合物在制备用于治疗癌症的药物中的用途,例如用于抑制受试者中肿瘤细胞的生长。
[0452]
如本文所用,术语“癌症”定义为以异常细胞快速且不受控制的生长为特征的疾病。癌细胞可以在局部或通过血流和淋巴系统扩散到身体的其他部位。
[0453]
因此,在一个实施方式中,本发明提供了一种在受试者中治疗癌症,例如用于抑制肿瘤细胞生长的方法,其包括向受试者施用治疗有效量的根据本发明的双功能分子或药物组合物。特别地,本发明涉及使用双功能分子治疗受试者,从而抑制癌细胞生长。
[0454]
在本公开内容的一个方面中,待治疗的癌症与耗竭的t细胞相关。
[0455]
可以使用本文提供的双功能分子来治疗的任何适宜癌症可以是造血系统癌症或实体癌。此类癌症包括癌瘤、宫颈癌、结肠直肠癌、食管癌、胃癌、胃肠癌、头颈癌、肾癌、肝癌、肺癌、淋巴瘤、胶质瘤、间皮瘤、黑色素瘤、胃癌、尿道癌、环境诱发的癌症以及所述癌症的任何组合。此外,本发明包括难治性或复发性恶性肿瘤。优选地,待治疗或预防的癌症选自转移性或非转移性黑色素瘤、恶性间皮瘤、非小细胞肺癌、肾细胞癌、霍奇金氏淋巴瘤、头颈癌、尿道上皮癌、结直肠癌、肝细胞癌、小细胞肺癌、转移性梅克尔细胞癌、胃癌或食道癌和宫颈癌。
[0456]
在一个特定方面中,癌症是血液系统恶性肿瘤或实体瘤。此类癌症可以选自以下:
review of clinical experience and future prospects.clin.cancer res.off.j.am.assoc.cancer res.20,6258
–
6268,2014的表1)。这种与根据本发明所述的双功能分子的组合可特别用于:
[0468]
1-逆转适应性免疫的抑制(阻断t细胞检查点途径);
[0469]
2-开启适应性免疫(使用激动剂分子(特别是抗体)促进t细胞共刺激受体信号传导);
[0470]
3-改善先天性免疫细胞的功能;
[0471]
4-激活免疫系统(增强免疫细胞效应功能),例如通过基于疫苗的策略。
[0472]
因此,本文还提供了与任何双功能分子或药物组合物的联合疗法,所述药物组合物包含如本文所述的此类分子和适宜的第二药剂,其用于治疗疾病或病症。在一个方面中,所述双功能分子和所述第二药剂可存在于如上文所述的单一药物组合物中。或者,如本文所用,术语“联合疗法”或“联合的疗法”包括以顺序方式施用这些药剂(例如,如本文所述的双功能分子和另外或第二适宜治疗剂),即,其中每种治疗剂在不同时间施用,以及这些治疗剂或至少两种药剂以基本上同时的方式施用。顺序或基本上同时施用每种药剂可以通过任何适当途径实现。药剂可以通过相同途径或通过不同途径施用。例如,第一药剂(例如,双功能分子)可以口服施用,且另一治疗剂(例如,抗癌剂、抗感染剂或免疫调节剂)可以静脉内施用。或者,所选组合的药剂可以通过静脉内注射施用,而组合的其他药剂可以口服施用。
[0473]
在一个方面中,其他药剂可在包含以下的非穷尽列表中选择:烷化剂、血管生成抑制剂、抗体、抗代谢物、抗有丝分裂剂、抗增殖剂、抗病毒剂、极光激酶抑制剂、凋亡促进剂(例如,bcl-2家族抑制剂)、死亡受体通路激活剂、bcr-abl激酶抑制剂、bite(双特异性t细胞接合剂)抗体、抗体药物缀合物、生物应答调节剂、布鲁顿氏酪氨酸激酶(btk)抑制剂、细胞周期蛋白依赖性激酶抑制剂、细胞周期抑制剂、环氧合酶-2抑制剂、dvd、白血病病毒癌基因同源物(erbb2)受体抑制剂、生长因子抑制剂、热休克蛋白(hsp)-90抑制剂、组蛋白去乙酰化酶(hdac)抑制剂、激素疗法、免疫药、凋亡蛋白抑制剂(iap)的抑制剂、嵌入型抗生素、激酶抑制剂、驱动蛋白抑制剂、jak2抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂、microrna、丝裂原激活的胞外信号调节激酶抑制剂、多价结合蛋白、非甾体抗炎药(nsaid)、聚adp(二磷酸腺苷)-核糖聚合酶(parp)抑制剂、铂类化学治疗剂、polo样激酶(plk)抑制剂、磷酸肌醇-3激酶(pi3k)抑制剂、蛋白酶体抑制剂、嘌呤类似物、嘧啶类似物、受体酪氨酸激酶抑制剂、类视黄醇/类维生素d植物生物碱、小抑制性核糖核酸(sirna)、拓扑异构酶抑制剂、泛素连接酶抑制剂、低甲基化剂、检查点抑制剂、肽疫苗等、来自肿瘤抗原的表位或新表位以及这些药剂的一种或多种的组合。
[0474]
例如,其他治疗剂可以选自以下:化学治疗剂、放射疗法药剂、靶向疗法、抗血管生成剂、低甲基化剂、癌症疫苗、来自肿瘤抗原的表位或新表位、骨髓检查点抑制剂、其他免疫疗法和hdac抑制剂。
[0475]
本发明还涉及治疗受试者疾病的方法,其包括向所述受试者施用治疗有效量的本文所述的双功能分子或药物组合物,以及治疗有效量的其他或第二治疗剂。
[0476]
在wo 2018/053106,第36-43页中提供了其他或第二治疗剂的具体实例。
[0477]
在一个优选的实施方式中,第二治疗剂选自以下:化学治疗剂、放射疗法药剂、免
疫治疗剂、细胞治疗剂(如car-t细胞)、抗生素和益生菌。
[0478]
联合疗法也可以依赖于双功能分子的施用与手术的结合。
[0479]
试剂盒
[0480]
本文所述的任何双功能分子或组合物可以包括在本发明提供的试剂盒中。本公开内容特别地提供了用于增强免疫应答和/或治疗疾病或病症(例如,癌症和/或感染)的试剂盒。
[0481]
在本发明的背景下,术语“试剂盒”指包装在容器、受体或其他中的两种或更多种组分(其中之一对应于本发明所述的双功能分子、核酸分子、载体或细胞)。因此,可以将试剂盒描述为足以达成某一目标的一组产品和/或用具,其可作为单个单元销售。本发明的试剂盒在适宜包装中。
[0482]
特别地,根据本发明的试剂盒可以包括:
[0483]-如上文所定义的il-7变体或突变体、融合蛋白或双功能分子,
[0484]-编码所述il-7变体或突变体、融合蛋白或双功能分子的核酸分子或核酸分子组,
[0485]-包含所述核酸分子或核酸分子组的载体,和/或
[0486]-包含所述载体或核酸分子或核酸分子组的细胞。
[0487]
因此,在合适的容器手段中,所述试剂盒可以包含药物组合物和/或il-7变体或突变体、融合蛋白或双功能分子,和/或本发明的宿主细胞,和/或编码本发明的核酸分子的载体,和/或本发明的核酸分子或相关试剂。在一些实施方式中,可以提供从个体获取样品和/或测定样品的手段。包含在根据本发明的试剂盒中的组合物可以特别配制成与注射器相容的组合物。
[0488]
在一些实施方式中,试剂盒还包含用于治疗癌症或感染性疾病的其他药剂,并且其他药剂可以与本发明试剂盒的il-7变体或突变体、融合蛋白或双功能分子或者其他组分组合,或者可以在试剂盒中单独提供。特别地,本文所述的试剂盒可以包含一种或多种其他治疗剂,例如上文所述的“联合疗法”中所述的那些。所述试剂盒可以针对个体的特定癌症进行定制,并且包括如上文所述的针对个体的相应的第二癌症疗法。
[0489]
与本文所述的双功能分子或药物组合物的使用相关的说明书通常包括关于剂量、给药方案、预期治疗的施用途径、用于重构所述双功能分子的手段和/或稀释本发明所述的双功能分子的手段的信息。在本发明所述的试剂盒中提供的说明书通常是标签或包装说明书上的书面说明(例如,以传单或说明书形式包含在试剂盒中的纸页)。
[0490]
实施例
[0491]
实施例1:fc融合il-7的突变修饰与il-7r的结合和pstat5信号转导并且改善体内药代动力学
[0492]
为获得il-7突变体,将涉及il7与cd127相互作用的氨基酸取代为具有相似特性和性质的氨基酸。产生了若干突变体,即q11e、y12f、m17l、q22e、d74e、d74q、d74n、k81r、w142h、w142f和w142y。
[0493]
il-7二硫键通过用丝氨酸残基取代半胱氨酸残基而被破坏,导致产生取代c2s-c141s c34s-c129s(突变体命名为“ss1”),或c2s-c141s c47s-c92s(突变体命名为“ss2”),或c47s-c92s c34s-c129s(突变体命名为“ss3”)。
[0494]
样品ec50ng/ml
igg4 g4s3 il7 wt18.4igg4 g4s3 il7 q11e18.49igg4 g4s3 il7 y12f22.27igg4 g4s3 il7 m17l20.96igg4 g4s3 il7 q22e17.44igg4 g4s3 il7 d74e103.94igg4 g4s3 il7 k81r20.18igg4 il7 g4s3 w142f34.86igg4 g4s3 il7 w142h136.32igg4 g4s3 il7 w142y44.6
[0495]
表1:图1a、图1b和图1c中的ed50测定是指与cd127受体结合达到50%所需的浓度。每个表代表不同的实验,可以与阳性对照igg4 g4s3 il7wt进行比较。
[0496][0497][0498]
表2:wt对比突变的il-7与cd127受体的结合。通过biacore对融合抗pd-1il-7对cd127的亲和性评估。使用两态反应模型进行分析。
[0499][0500]
表3:wt对比突变的il-7与cd132受体的结合。通过biacore对复合的cd127 igg融合il-7对cd132的亲和性评估。使用两态反应模型进行分析。
[0501][0502]
表4:图2a、图2b和图2c中的ed50测定是指在该测定中,对于每个抗pd-1il-7分子,达到pstat5信号的50%所需的浓度。每个表代表不同供体的不同实验,每个表可以与阳性对照igg4 g4s3 il7wt进行比较。
[0503][0504][0505]
表5:从图3中确定的cmax、曲线下面积和半衰期。在抗pd-1 il7注射后15分钟时间点计算cmax。在抗pd-1 il-7注射后0至144小时计算auc。
[0506]
在il7序列中一个氨基酸的取代不会改变其结合pd-1受体的能力(图1a、图1b和图1c)。然而,这些突变改变了其生物活性,如离体t细胞测定中的cd127结合和pstat5信号转导所示(图2和图3以及表1和表4)。突变d74e和w142h是在t淋巴细胞中减少il-7与cd127结合和pstat5活化的最有效突变(图2a、图2b和图3a、图3b以及表1和表5)。在另一项实验中,分析了二硫键破坏的影响(图2c)。在高浓度(10μg/ml)下,ss2或ss3能够激活t淋巴细胞中的pstat5,与il-7 wt有3log偏差(图2c和表4)。
[0507]
为确认这些突变体的结合能力,进行了biacore测定以确定kd(受体与其抗原之间的平衡解离常数,见表2)。突变体ss2和w142h对cd127的亲和性较低,kd接近7至57nm。ss3突
变体对cd127的亲和性最低,kd接近3μm。还评估了对cd132受体的亲和性,如表3所示。在该实验中,将单独的igg4用作基线kd亲和性,因为在没有il-7的情况下cd127与cd132二聚化。il-7突变体w142h与cd132结合,但亲和性比igg il-7wt高5倍。该数据表明突变w142h降低了与cd127的结合并将il-7与cd132受体的结合重定向,导致t细胞中pstat5激活的丧失,如图2所示。而相反的是,发明人在测试条件下观察到ss2突变体失去结合cd132受体的能力,表明ss2突变体优先结合cd127而不是cd132受体,导致t细胞中pstat5活性降低(图3)。
[0508]
为确定抗pd-1il-7在体内的药代动力学/药效学,向小鼠静脉内注射一剂igg-il-7(34,4nm/kg)。通过特异性针对人igg的elisa分析血浆药物浓度。图3和表5显示igg4 il-7 wt分子具有快速分布,因为获得的cmax(注射后15分钟的最大浓度)比理论浓度低30倍。所有测试的w142y、f、h突变体都描绘了更好的分布曲线,其cmax比il-7 wt高5到10倍(图3a和表5)。w142h突变体呈现最佳cmax。抗pd-1 il-7 d74e突变体也表现出良好的cmax。突变体ss2和ss3表现出最好的pk曲线,其cmax比il-7 wt高7到13倍,并且具有良好的线性性质曲线。同时,测定了auc(曲线下面积)(表5和图4d),auc可以深入了解药物暴露程度及其从体内的清除率。这些数据表明auc随着il-7突变体的增加而增加,这意味着il-7突变体具有改善的药物暴露。如图4d所示,发明人观察到药物暴露与突变体的il-7效力相关(通过pstat5 ec50测量)。总之,il-7的亲和性与产品的药代动力学相关。降低il-7与其受体cd127和cd132的亲和性可改善il-7双功能分子在体内的吸收和分布。
[0509]
实施例2:在igg的c末端结构域添加半胱氨酸降低il7分子的柔性并改善体内药代动力学
[0510]
还测试了在igg的c末端结构域添加半胱氨酸产生一个额外的二硫键并可能限制il-7分子的柔性。将该突变体命名为“c-il-7”。图5显示,与抗pd-1 il7 wt双功能分子(图5a)相比,在igg结构中添加二硫键会降低il-7的pstat5活性,并在体内药代动力学测定中增加cmax(5倍)。
[0511]
实施例3:用igg1n298a同种型构建的抗pd-1il-7突变体与il-7r具有更好的结合,更高的pstat5信号传导和良好的体内药代动力学特征
[0512]
用igg4m(s228p)或igg1m(n298a或n297a,取决于编号方法)测试了抗pd-1 il-7双功能分子的不同同种型。igg4同种型包含s228p突变以防止体内fab臂交换,igg1同种型包含n298a突变,该突变消除igg1同种型与fcγr受体的结合,这可能减少免疫细胞因子的非特异性结合(突变体命名为“igg4m”或“igg1n298a”)。然后,用2种不同的同种型构建抗pd-1 il-7双功能分子,在n297a(称为igg1m)中突变的igg1同种型与igg4 s288p同种型(称为igg4m),以确定同种型结构是否改变il-7的生物活性及其药代动力学特征。
[0513]
图6a和图6b证明了用igg4m或igg1m同种型构建的抗pd-1il7双功能分子与pd-1受体具有相同的结合特性,表明同种型不改变vh和vl的构象以及抗pd-1抗体对pd-1的亲和性。然而,发明人观察到igg1m同种型出人意料地提高了cd127上的il-7 d74、ss2和轻微ss3的结合(图7a、b、c和d)和人pbmc上的pstat5活化(图8a、b和c)。pstat5信号的这种增加在另一个t细胞系(表达pd-1和cd127的jurkat细胞,参见图8d)上的ss2突变体中得到证实,但令人惊讶的是,igg1m同种型不改变抗pd-1 il-7 wt双功能分子的pstat5活性,表明igg1m同种型仅提高il-7突变体的活性。为了确定包含抗pd1抗体和il7突变体的双功能分子重新激活tcr介导的信号传导的能力,进行了nfat生物测定。图9a所示的结果表明,双功能分子比
抗pd1或抗pd1 ril7(作为单独的化合物)更能激活tcr介导的信号转导(nfat),证明了双功能分子对pd1 t细胞的协同作用。发明人接下来评估了包含抗pd-1抗体和用igg4m构建的il-7突变体(具有突变d74e、w142h或ss2)的双功能分子与igg1m同种型的协同能力(图9b、c、d)。所有测试的突变体对激活nfat信号转导具有协同作用,其激活水平与其激活pstat5信号传导的能力相关,特别是对于具有il-7 d74e和igg4m的双功能分子。
[0514]
在小鼠中的药代动力学研究表明,igg1同种型不会改变il7wt和ss3分子的药物暴露,并且对w142h分子的影响最小(图10a)。总之,这些数据表明优化的同种型(igg1m)足以增强突变体的生物活性,同时保持产品在体内的良好药代动力学。对于igg1m同种型,测试了其他il-7突变体:d74n、d74q和d74e w142h突变的组合。在pstat5激活(图9b)和药代动力学(图10b)上未观察到与抗pd-1 il-7 d74e突变体的差异。
[0515]
发明人特别测试了包含具有不同氨基酸取代d74e、d74q和d74n的il-7 d74突变体的抗pd-1双功能分子。这构建体包含ggggs接头和igg1n298a同种型。如表6中所详述的,所有构建体对结合pd-1的功效相似,但与d74e突变体相比,d74q和d74n突变体与双pd-1/cd127的结合降低,表明取代q和n略微减弱了突变体对cd127受体的亲和性。
[0516][0517]
表6:d74e、d74q和d74n突变体的pd-1和cd127结合的ed50测定。ed50(ng/ml)是指通过elisa测量达到50%与pd-1和cd127受体结合所需的浓度。pd-1结合通过人pd-1受体的固化来测量,pd-1/cd127双结合通过pd-1的固化和使用cd127受体揭示来测量,如材料和方法中详述的。测试的所有构建体都包含ggggs接头和igg1 n298a同种型。
[0518]
与w124h igg1相比,双突变体d74e w142h显示出相似的特征,与d74e突变体相比,d74q显示出相似的特征。本发明人还构建了具有igg1m同种型 yte突变的双功能分子(m252y/s254t/t256e)。该突变已被描述为通过增加与fcrn受体的结合来增加抗体的半衰期。如在图7d中所示,yte突变不改变包含d74或w142h突变体的双功能分子的pstat5信号转导。
[0519]
实施例4:将k444a突变为c末端赖氨酸残基不影响体内药代动力学
[0520]
人igg的所有亚类都带有抗体重链(k444)的c末端赖氨酸残基,其可在循环中被切割掉。血液中的这种切割可能会通过将连接的il-7释放到igg上而损害免疫细胞因子的生物活性。为了规避这个问题,igg结构域中的k444氨基酸被丙氨酸取代,以减少蛋白水解切割,这是抗体常用的突变。如在图11中所示,在igg wt il-7与igg k444a il-7之间获得了相似的曲线,表明突变不影响药物的药代动力学性质。
[0521]
实施例5:igg抗体之间的接头不会改变体内药代动力学,但会改善pstat5信号转导的激活
[0522]
测试了igg fc结构域和il-7m之间的不同接头以改善柔性。测试了几个条件(例如,无接头、ggggs、ggggsgggs、ggggsggggs、ggggsggggsggggs)。
[0523]
对于实施例1和实施例2,fc的c端结构域和il-7的n端结构域之间的接头(g4s)3分别用于igg4m-il7和igg1m-il-7的构建。该接头允许il7激活信号的高柔性和改善。为了降低il7对cd127的亲和性并改善药代动力学,测试了不同构建体的不同接头长度(无接头、g4s、(g4s)2或(g4s)3)。为了比较,还用各种接头产生了igg1m或igg4m fc il-7wt。
[0524]
药代动力学研究表明,接头的长度对所测构建体的产物的分布、吸收和消除没有影响:抗pd-1 il7 wt(图12a)、抗pd-1 il-7 d74(图12b)和抗pd-1 il-7 w142h(图12c)。然而,接头的长度影响pstat5的激活,如图12d所示。事实上,与用(g4s)2或g4s3接头构建的抗pd-1 il-7相比,用接头(g4s)3构建的抗pd-1 il7在激活pstat5信号传导方面更有效,甚至比无接头构建的抗pd-1 il-7更有效。这些数据强调了使用(g4s)3接头以允许il-7的柔性而不损害药物的体内药代动力学。
[0525]
实施例6:抗pd-1 il-7突变体允许优先结合pd-1 cd127 细胞而不是pd-1-cd127 细胞
[0526]
接下来,发明人评估了抗pd-1 il-7双功能分子靶向pd-1 t细胞的能力。用45nm以下双功能分子对表达cd127 或共表达cd127 和pd-1 的jurkat细胞进行染色:抗pd-1 il-7wt、d74、w142h、ss2和ss3。用抗igg-pe(biolegend,克隆hp6017)检测结合并通过流式细胞术分析。
[0527]
结果:图13显示抗pd-1 il-7 wt和d74突变体结合pd-1 /cd127 细胞与pd-1-/cd127 细胞具有相似的有效性,而抗pd-1 il-7突变体ss2、ss3与pd-1 /cd127 细胞的结合有效性比pd-1-/cd127 细胞高2到3倍。抗pd-1 il-7 w142h双功能分子显示出中等效果,与pd-1 /cd127 细胞的结合有效性高出1.4倍。
[0528]
为了确认抗pd-1 il-7突变体在异源细胞模型中对pd-1 t细胞的特异性靶向,发明人接下来混合pd-1( )细胞和pd-1(-)细胞并分析其对每个细胞亚群的结合。在该测定中,共表达人cd127 和人pd-1 细胞的cho细胞与仅表达人cd127 受体的cho以1:1的比例共培养(图14a),然后用递增剂量的双功能抗pd-1 il-7突变体d74e、w142h、ss2和ss3分子、单独的抗pd-1或无关同种型il-7抗体染色。用抗igg-pe(biolegend,克隆hp6017)显示结合并通过流式细胞术分析。确定每个构建体和每个pd-1( )和pd-1(-)细胞群的ec50结合(nm)(图14b)。将无关同种型il-7对照用作阴性对照,表明pd-1( )与pd-1(-)细胞的结合相同。尽管在该共培养测定中所有双功能抗pd-1 il-7分子优先结合pd-1( )细胞而不是pd-1(-)细胞,但发明人观察到il-7突变提高了分子对pd-1 细胞的选择性顺式结合。如在图14b中所示,与抗pd-1 il-7野生型相比,抗pd-1 il-7 w142h、ss2和ss3突变体对pd-1(-)cd127( )细胞的结合表现出强烈减弱,而抗pd-1 il-7突变体在pd-1( )cd127( )细胞上保留了与抗pd-1 il-7野生型相似的有效结合(ec50~300pm)。特别地,抗pd-1 il-7w142h和ss3突变体显示出最高的选择性活性,pd-1( )细胞与pd-1(-)细胞之间的结合差异分别为62倍和311倍。
[0529]
总之,这些数据表明,il-7突变不仅使药物具有更好的药代动力学,而且使il-7优先结合pd-1 细胞,即药物靶向同一细胞。这方面对药物在体内的生物活性很感兴趣,因为相比cd127 初始t细胞,抗pd-1 il-7会将il-7集中到pd-1 cd127 耗竭的t细胞,进入肿瘤
微环境中。
[0530]
实施例7:抗pd-1 il-7突变双功能分子优先激活pd-1 细胞上的il7r,协同促进人活化t细胞增殖
[0531]
还在混合u937 pd-1( )cd127( )和pd-1(-)cd127( )细胞的共培养模型中测试了il-7r信号转导的激活(pstat5)。u937细胞还表达转导il-7r信号转导所需的内源性cd132受体(图15a)。pstat5信号转导数据表明,pd-1 il-7突变体w142h、ss2和ss3在pd-1( )细胞中的选择性活性比pd-1(-)细胞高得多。在含有抗il7突变体的抗pd-1双功能分子与含有il-7野生型的抗pd-1双功能分子相比,在pd-1(-)细胞中观察到活性降低10至50倍(图15b)。虽然在pd-1(-)细胞中诱导了非常低的pstat5活性,在pd-1( )细胞中获得了包含il-7突变体的抗pd-1双功能分子的恢复活性,与重组il-7野生型细胞因子相似,ec50 pstat5活性接近10pm。特别地,与pd-1-细胞相比,w142h突变体在pd1 细胞中的结合/活性高出450倍以上。
[0532]
由于抗pd-1 il-7双功能分子的设计非常有利,特别是针对pd-1( )cd127( )耗竭的t细胞,发明人接下来分析了抗pd-1 il-7 w142h双功能分子优先激活pstat5信号转导和增殖进入原代人耗竭的t细胞的能力。为了产生pd-1( )cd127( )耗竭的t细胞,将人外周血t细胞在体外反复刺激(αcd3/αcd28)以模拟发生在肿瘤微环境中的慢性抗原刺激。
[0533]
为评估双功能抗pd-1 il-7分子对pd-1( )t细胞的靶向作用,用高浓度的抗pd-1竞争性抗体孵育耗竭的t细胞,以阻断抗pd-1 il-7双功能分子的抗pd-1部分的结合。孵育后,用抗pd-1 il-7 w142h双功能分子或重组il-7野生型细胞因子处理耗竭的t细胞。然后通过流式细胞术对pstat5激活进行量化。计算两种条件(pd-1阻断与非阻断同种型)之间的pstat5活化比(ec50)并报告在图16a中。在该测定中使用非靶向il-7重组细胞因子作为阴性对照,获得的比率1显示非靶向il-7在pd-1( )和pd-1(-)t细胞中的相似活性。在用抗pd-1 il-7 w142h分子处理后获得了显著的差异活性(活性降低了2到4倍),表明该分子允许优先顺式激活il-7r信号转导进入pd-1( )耗竭的原代t细胞,而不是pd-1(-)耗竭的t细胞。
[0534]
此外,发明人证明了抗pd-1 il-7 w142h的特异性顺式靶向允许耗竭的t细胞在体外协同增殖,而两种分离的药剂(抗pd-1抗体 同种型il-7 w142h)的组合诱导耗竭的t细胞的增殖刺激显著降低(图16b)。总之,这些数据证实了包含突变的il-7 w142h分子和抗pd-1抗体的双功能分子的优势,以选择性和协同顺式激活pd-1( )cd127( )耗竭的t细胞。
[0535]
实施例8:具有一个il-7 w142h细胞因子和一个或两个抗pd-1臂的抗pd-1 il-7分子显示出在促进pd-1 il-7r 细胞中的顺式活性和在体内刺激il-7r t细胞增殖以及重新激活tcr信号传导的协同能力方面的高效性
[0536]
发明人接下来设计并比较了包含一个或两个抗pd-1结合结构域和一个或两个il7 w142h突变体的双功能分子的多种结构的生物学活性,如图17中所述。
[0537]
构建体1包含两个抗pd-1抗原结合结构域和两个il-7 w142h变体(构建体1也称为抗pd-1*2 il-7 w142h*2),该分子对应于实施例1至7中测试的构建体。该分子也称为bicki-il-7 w142h。在该实施例中,称为bicki-il-7 wt的对照分子对应于构建体1,但具有野生型il-7。
[0538]
构建体1包含两个抗pd-1抗原结合结构域和单一il-7 w142h变体(构建体2也称为pd-1*2 il-7 w142h*1)。
il-7 w142h*2(bicki-il-7 w142h)相比,抗pd-1*2 il-7 w142h*1分子对cd127受体具有相似的亲和性,并且与包含il-7野生型形式的抗pd-1il7双功能分子相比具有更低的亲和性(图19a和表9)。令人吃惊的是,抗pd-1*2 il7 w142h*1分子表现出与包含il-7野生型形式的pd-1 il7双功能分子相似的高pstat5活性(图19b)。基于这些观察结果,可以假设il-7的单体形式与w142h il-7突变结合允许il-7分子的最佳构象以促进il-7信号转导进入人t细胞。即使只有一种il7,具有w142h il-7突变的分子也具有与具有两种细胞因子的il7 wt的分子一样好的激活效果(pstat5)。在il-7变体对其受体的亲和性低于野生型il-7的情况下,这一结果令人吃惊。
[0549]
用一个与一个il-7 w142h突变体融合的抗pd-1臂构建的抗pd-1 il7分子得出了类似的结论。使用抗pd-1*2 il-7wt*2、抗pd-1*2 il-7 w142h*1和抗pd-1*1 il-7 w142h*1构建体获得了相似且相当的高pstat5活性(图19c)。
[0550] kd cd127(m)抗pd-1*2 il7野生型*28.7e-10抗pd-1*2 il7 w142h*23.73e-8抗pd-1*2 il7 w142h*14.52e-8
[0551]
表9:使用1个或2个il7构建的抗pd1 il7野生型或抗pd1 il7 w142h突变体的结合。将cd127固化在传感器芯片上,并以递增剂量添加抗pd-1 il-7双功能分子以测量亲和性。
[0552]
进行体内实验以确定不同抗pd-1 il-7构建体的有效性。将一剂抗pd-1 il-7分子以等效摩尔浓度(34nm/kg)注射到小鼠体内。在治疗后的第4天,使用ki67标记通过流式细胞术对cd4和cd8 t细胞增殖进行量化。图20显示了具有单一w142h突变体(抗pd-1*2 il-7 w142h*1和抗pd-1*1 il-7 w142h*1)或具有单一pd-1价和两个il7 w142h细胞因子(抗pd-1*1 il7 w142h*2)的抗pd-1 il7分子在促进cd8和较小程度的cd4 t细胞增殖方面表现出高效率。
[0553]
为了确定包含抗pd1抗体(一或二价)和一或两种il7突变细胞因子的双功能分子重新激活tcr介导的信号传导的能力,进行了nfat生物测定。图21a显示与单独的抗pd-1抗体相比,由2个抗pd-1臂和一个il-7细胞因子构建的双功能分子增强了nfat的活化,证明药物增强tcr介导的信号转导的协同活性与仅由一个il-7细胞因子构建的抗pd-1 il-7双功能分子保持一致。如图9a中所示,当用抗pd1加il7的组合处理细胞时,没有这种协同作用。
[0554]
此外,发明人接下来评估了设计为仅具有一种抗pd-1价的抗pd-1il-7分子(抗pd-1*1)的活性,并证明了抗pd-1*1 il-7 w142h构建体(抗pd-1*1 il7 w142h*1和*2)保留其协同活性,而pd-1*1 同种型il-7 w142h*2的组合治疗在刺激tcr信号转导(nfat激活)方面表现出较低的有效性(图21b)。
[0555]
最后,在共培养测试中分析了不同抗pd-1 il-7构建体的特异性顺式靶向和顺式活性。将u937 pd-1 cd127 细胞与pd-1-cd127 细胞(比例1:1)混合,然后以递增剂量与不同构建体一起孵育。通过流式细胞术对结合和il-7r信号转导(pstat5)进行量化。确定每个构建体和每个pd-1 和pd-1-细胞群的结合和pstat5活化的ec50(nm)(图22a和图22b)。发明人证实了抗pd-1 il-7突变分子(抗pd-1*2 il7 w142h*1、抗pd-1*1 il7 w142h*1、抗pd-1*1 il7 w142h*2)的多样性优先将il-7r结合至pd-1 细胞中,并通过il7r信号转导pstat5进
入pd-1 细胞,进而形成不同的代表性结构。实施例9:使用1或2个抗pd-1臂和1或2个il7 w142h细胞因子构建的抗pd-1 il-7分子在体内具有良好的药代动力学性质
[0556]
评估了如图17中描述的抗pd-1 il-7双功能分子构建体2、3和4的药代动力学研究。向人源化pd1 ki小鼠腹膜内注射一剂抗pd-1il-7分子(34.4nm/kg)。通过特异性针对人igg的elisa分析血浆药物浓度(图23)。还计算了曲线下面积(见表10),并代表每种构建体的总药物暴露时间。与抗pd-1*2 il7wt*1相比,抗pd-1*2il-7 w142h*1、pd-1*1 il-7 w142h*1和pd-1*1 il-7 w142h*2构建体显示出非常有利地增强的pk性质。与抗pd-1*1 il7wt*2相比,观察到cmax高出2,8至19倍。重要的是,抗pd-1*1 il7 w142h*1抗pd-1*1 il7 w142h*分子的对应于令人免疫的体内pk值的高药物浓度(11-15nm)维持至少96小时,而在血浆中仅检测到2nm抗pd-1*2 il7wt*2分子。抗pd-1*2 il-7 w142h*1的残留药物浓度是抗pd-1*2 il7wt*2浓度的2.5倍。血浆药物暴露通常与体内有效性相关。在此,本发明人证明,所有用抗pd-1臂构建的所有抗pd-1 il-7 w142h分子都使得在单次注射后产生长期药物暴露,这表明这些构建体将在体内诱导更高的生物活性。
[0557] auccmax(nm)抗pd1*1 il7w142h*1159742.4抗pd-1*1 il7w142h*22024248.6
[0558]
表10:根据图23确定的曲线下面积。在腹膜内注射一剂抗pd-1il-7(34nm/kg)后0至96小时计算auc。
[0559]
还提及,即使与il7 w142h相比,某些具有il7野生型的分子pd-1*2il7wt*2也可能具有良好的pk(特别是对于静脉内注射),具有il7 w142h的分子具有更好的其他性质:t细胞的增殖更好(如图20中所示的cd4、cd8)以及与pd1-细胞相比更好的特异性靶向pd1 细胞(如图15b中解释的10至50倍)。
[0560]
综上所述,已经获得了多个具有突变il7(特别是w142h)的双功能分子构建体,其具有用于有效药物用途的非常令人满意的pk(优选地,24小时后至少10nm),并且进一步具有:
[0561]-对lt增殖有实质性的有利影响,
[0562]-由于双功能分子的抗pd1部分和双功能分子的il7部分之间对t细胞的惊人协同作用,通过il7r将pstat5信号转导到pd-1 细胞中,在lt激活方面具有高性能,
[0563]-与pd1-t细胞相比,高特异性靶向pd1 t细胞(远高于没有突变的il7的双功能分子),且与pd-1-t细胞相比,顺式激活il-7r信号转导进入pd-1 耗竭的原代t细胞,这对于肿瘤治疗具有重大优势;和
[0564]-pd-1/pd-l1相互作用的有效拮抗作用(不仅与pd1结合)。
[0565]
材料和方法
[0566]
结合pd1的elisa
[0567]
对于活性elisa测定,将重组hpd1(sino biologicals,beijing,china;参考号10377-h08h)在碳酸盐缓冲液(ph 9.2)中以0.5μg/ml固化在塑料上,并添加纯化抗体以测量结合。在孵育和洗涤后,添加过氧化物酶标记的驴抗人igg(jackson immunoresearch;usa;参考号709-035-149),并通过常规方法进行揭示。
[0568]
使用biacore法进行亲和性测量
[0569]
通过biacore对在其重链上与il-7融合的igg进行针对cd127(a)或cd132(b)的亲和性评估。cd127(sinobiological,10975-h03h-50)以20μg/ml的浓度固化在cm5生物芯片上,并以系列浓度(0.35;1.1;3.3;10;30nm)添加指定蛋白。使用二态反应模型分析亲和性。为了评估il-7对cd132的亲和性,将cd127固化在cm5生物芯片上,并以30nm的浓度注射每种il-7构建。以不同的浓度(例如31.25、52.5、125、250、500nm)添加cd132受体(sinobiological 10555-h08b)。使用稳态亲和性模型进行分析。
[0570]
结合cd127的elisa
[0571]
通过夹心elisa方法来评估cd127结合。固化抗体骨架靶向的重组蛋白,然后将与il-7融合的抗体与cd127重组蛋白(组氨酸标记的,sino目录号10975-h08h)预孵育。使用与生物素偶联的抗组氨酸抗体(mbl#d291-6)和与过氧化物酶(ji 016-030-084)偶联的链霉亲和素的混合物进行揭示。使用tmb底物在450nm处确定比色法。
[0572]
pstat5分析
[0573]
从健康的人类志愿者的外周血中分离的pbmc与重组il-7或融合igg的il-7孵育15分钟。为确定顺式活性,将用cd127 pd-1 转导的u937细胞与仅用cd127 转导的u937细胞混合。细胞以1:1的比例混合并用重组il-7或与本文所述的il-7构建体融合的不同igg处理。在共培养之间,每个细胞亚群都用细胞增殖染料(cpde450或cpde670)标记。然后,将细胞固定、透化并用af647标记的抗pstat5(克隆47/stat5(py694))染色。通过计算cd3 t细胞群中的mfi pstat5获得数据。
[0574]
细胞结合分析
[0575]
为确定与il-7分子融合的igg的顺式结合,将用cd127 pd-1 转导的u937或cho细胞与仅用cd127 转导的cho或u937混合。细胞以1:1的比例混合,并用与本文所述的il-7构建体融合的不同igg处理。在共培养之前,每个细胞亚群都用细胞增殖染料(cpde450或cpde670)标记。孵育20分钟后,用抗igg-pe抗体(biolegend,克隆hp6017)检测不同igg融合分子的结合,并通过流式细胞术进行分析。
[0576]
融合igg的il-7的体内药代动力学
[0577]
为了分析il-7免疫细胞因子的药代动力学,向balbcrj小鼠(雌性6-9周龄)或c57bl6jrj小鼠(雌性6-9周)眼眶内或腹膜内注射单剂量的分子。通过elisa,使用固化抗人轻链抗体(克隆nam76-5f3),稀释血清(包含融合igg的il-7)来测定血浆药物浓度。使用过氧化物酶标记的驴抗人igg(jackson immunoresearch;usa;目录号709-035-149)来进行检测,并通过常规方法揭示。
[0578]
使用promega的基于细胞的生物测定法进行的t细胞激活测定
[0579]
使用promega pd-1/pd-l1试剂盒(目录号j1250)测试了抗pd-1抗体恢复t细胞激活的能力。使用了两种细胞系:(1)效应t细胞(稳定表达pd-1、nfat诱导的荧光素酶的jurkat)和(2)激活靶细胞(稳定表达pdl1和设计用于以抗原独立性方式激活同源tcr的表面蛋白的cho k1细胞)。当细胞共培养时,pd-l1/pd-1相互作用直接抑制tcr介导的激活,从而阻断nfat激活和荧光素酶活性。抗pd1抗体的添加阻断了pd-1介导的抑制信号,导致nfat激活和荧光素酶合成和生物发光信号的发射。按照制造商的建议进行实验。测试了pd-1抗体的序列稀释。在pd-l1 靶细胞、pd-1效应细胞和抗pd-1抗体共培养四小时后,将bioglo
tm
荧光素底物加入孔中,并使用tecan
tm
光度计来读取板。
[0580]
体内增殖
[0581]
将单剂量的双功能分子(34nm/kg)腹膜内注射到携带皮下mc38肿瘤的c57bl6jrj小鼠(雌性6-9周)。在治疗后第4天,收集血液和mc38肿瘤并用抗cd3、抗cd8、抗cd4抗体和抗ki67抗体对t细胞进行染色,以通过流式细胞术量化增殖。
[0582]
抗体和双功能分子
[0583]
以下抗体和双功能分子已用于本文公开的不同实验中:派姆单抗(keytrudra,merck)、纳武单抗(opdivo,bristol-myers squibb),并且本文公开的双功能分子包含抗pd1人源化抗体或抗pd1嵌合抗体,所述抗pd1人源化抗体包含如seq id no:24定义的可变重链(vh)和如seq id no:28定义的可变轻链(vl),所述抗pd1嵌合抗体包含如seq id no:71定义的重链和如seq id no:72定义的轻链。
[0584]
构建体1包含两个抗pd-1抗原结合结构域和两个il-7 w142h变体(构建体1也称为抗pd-1*2 il-7 w142h*2)。该分子对应于在实施例1至7中检测的构建体。该分子也称为bicki-il-7 w142h。特别地,构建体1包含如seq id no:24中定义的可变重链(vh)和如seq id no:28中定义的可变轻链(vl),或者抗pd1嵌合抗体包含如seq id no:71中定义的重链和如seq id no:72中定义的轻链。该分子还包含il7变体,如在seq id no:5中所描述的。
[0585]
在该实施例中,称为bicki-il-7 wt的对照分子对应于构建体1,但具有野生型il-7。其包含如seq id no:24中定义的可变重链(vh)和如seq id no:28中定义的可变轻链(vl)。该分子具有igg4 s288p同种型。
[0586]
另一个对照分子是抗pd1*2(无任何il7)。该分子包含如seq id no:79中定义的重链和如seq id no:80中定义的轻链。
[0587]
构建体2包含两个抗pd-1抗原结合结构域和单一il-7w142h变体(构建体2也称为抗pd-1*2 il-7 w142h*1)。特别地,构建体2包含如seq id no:24中定义的可变重链(vh)和如seq id no:28中定义的可变轻链(vl)。该分子特别地包含如seq id no:83中定义的结合至il-7 w142h的重链(臼)或如seq id no:81中定义的重链(杵),以及如seq id no:80中定义的轻链。
[0588]
构建体3包含单一抗pd-1抗原结合结构域和单一il-7 w142h变体(构建体3也称为抗pd-1*1 il-7 w142h*1)。特别地,构建体3包含如seq id no:24中定义的可变重链(vh)和如在seq id no:28中定义的可变轻链(vl)。该分子包含如seq id no:83中定义的结合至il-7 w142h的重链,如seq id no:75中定义的fc区和如seq id no:80中定义的轻链。
[0589]
称为抗pd-1*1的对照构建体与构建体3相似,但没有il-7变体。此类对照包含如seq id no:24中定义的可变重链(vh)和如seq id no:28中定义的可变轻链(vl)。该分子包含如在seq id no:81中定义的重链,如在seq id no:75中定义的fc区和如在seq id no:80中定义的轻链。
[0590]
构建体4包含单一抗pd-1抗原结合结构域和两个il-7 w142h变体(构建体4也称为抗pd-1*1 il-w142h*2)。特别地,构建体4包含如seq id no:24中定义的可变重链(vh)和如seq id no:28中定义的可变轻链(vl)。该分子包含如seq id no:83中定义的结合至il-7 w142h的重链,如seq id no:76中定义的结合至il-7 w142h的fc区和如seq id no:80中定义的轻链。
[0591]
用igg1 n298a同种型对构建体2、3和4进行工程改造,并在fc部分突变氨基酸序
列,以便在重链a的ch2和ch3上形成一个杵,并在重链b的ch2和ch3上形成一个臼。所有抗pd-1 il-7和抗pd-1*1构建体均包含igg1n298a突变同种型,但抗pd-1*2构建体(缺乏il-7)和抗pd-1*2il7wt*2(bicki-il-7 wt)用igg4 s288p同种型构建。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。