1.本发明涉及一种制备氧化锂的新型方法。在本发明中,氧化锂的粒度和形状可在制备过程中被控制。另外,本发明涉及一种通过这种制备方法制备的粒度和形状被控制的氧化锂。
背景技术:
2.最近,高价的高纯度氧化锂(li2o)被用作合成过锂过渡金属氧化物的原料。过锂过渡金属氧化物用作用于提高锂离子电池不可逆容量提高正极添加剂(或过压抑制剂),且在锂离子电容器(lithium ion capacitor,lic)、负极材料锂化处理(lithiation)中用作高反应性锂原料。通过将金属氧化物和氧化锂混合并在非活性气氛中对其进行热处理来合成过锂金属氧化物。
3.通常,已知许多制备氧化锂的方法。作为一例,通过在干燥气氛,以及250℃以上的温度下,调节h2o和co2来氧化金属锂,从而制备氧化锂。这种方法虽然具有反应快的优点,但缺点在于,液态li被吸附到反应坩埚中,且需要调节反应中的h2o和co2的过程。
4.在通过分解氢氧化锂制备氧化锂的方法中,在真空以及700℃以上的温度下,或在真空以及200至300℃的温度下,通过下述反应式分解氢氧化锂得到液态氢氧化锂,并对其再次分解,得到氧化锂。
5.lioh-h2o(s)
→
lioh(s);2lioh(l)
→
li2o(s) h2o(g)或2lioh(s)
→
li2o(s) h2o(g)
6.当在700℃以上的温度下进行反应时,虽然具备反应快的优点,但仍具备以下缺点,液态li被吸附到反应坩埚中,且反应时难以控制co2,并且在200至300℃的温度下进行反应时,优点是需要低反应温度,但缺点是反应需要高真空状态。
7.在通过氢氧化锂湿式转化法制造氧化锂的方法中,在室温下按照下述反应式得到过氧化锂,并对其再次分解,得到氧化锂。
8.2lioh-xh2o(s)
→
li2o2(s);li2o2(s)
→
li2o(s) 1/2o2(g)
9.虽然该方法的优点是需要低反应温度,但缺点是需要试剂如h2o2、meoh等。
10.在通过碳酸锂分解法制备氧化锂的方法中,根据反应式li2co3(s)
→
li2o(s) co2(g),在pco2气氛下,以900℃以上的温度进行反应,其优点在于,原料费用低,但缺点在于反应速度慢,且在实际使用时需要1200℃以上的高温。
11.在通过硝酸锂分解法制备氧化锂的方法中,根据反应式2lino3(s)
→
li2o(s) 2no2(g) 1/2o2(g),在900℃以上的温度下进行,虽然有反应速度快的优点,但也有原材料昂贵和涉及nox去除过程的缺点。
12.上述的由金属锂制备氧化锂的方法、氢氧化锂分解法、碳酸锂分解法和硝酸锂分解法中,反应在高于原料熔点的温度下进行,因此无论原料粉末的粒度如何,氧化锂都是以巨大块状的形式合成。因此,为了将其用作合成过锂过渡金属氧化物的原料,需要对所生成的锂氧化物块进行粉碎/分级的工序作为后续工序。另外,在用于调节粒度的粉碎/分级工
序中会发生粉末损失,并且难以屏蔽大气。另外,很难控制以这种方法生产的粉末的最终粒度。
技术实现要素:
13.要解决的技术课题
14.本发明人发现,为了提高合成反应中的反应收率,氧化锂的形状优选为球形且粒度分布均匀,且调节氧化锂与金属氧化物的平均直径比非常重要。另外,为此,开发了可调节所生成的氧化锂的粒度的氧化锂的制备方法。
15.解决技术问题的手段
16.本发明采用两步氢氧化锂湿法转化法制备氧化锂。第一步骤,使氢氧化锂与双氧水反应,合成li2o2作为中间物质;第二步骤,将所合成的li2o2在非活性气氛中高温分解,转化为氧化锂(li2o)。
17.第一步骤:2lioh-xh2o h2o2→
li2o2 yh2o,x为0以上的整数。
18.第二步骤:li2o2→
li2o 1/2o2(g)
19.在所述第二步骤中,在中间产物li2o2转化为li2o的期间,li2o2的直径减少约10~40%,但能够合成与中间产物相同形状的li2o。因此,球形li2o的目标直径尺寸可通过控制li2o2中间物质的粒度来获得。
附图说明
20.图1是本发明的两步工序的流程图。
21.图2是根据本发明制备的li2o2粉末的sem照片。
22.图3示出根据本发明制备的li2o2的粒度与反应器的线速度之间的关系图表。
23.图4示出根据本发明制备的li2o2的粒度与反应器的线速度之间的关系图表。
24.图5示出根据本发明制备的li2o2的粒度与反应器的线速度之间的关系图表。
25.图6是根据本发明制备的li2o的sem照片。
26.图7示出根据本发明制备的li2o粉末的xrd结果。
27.图8示出根据本发明制备的li2o粉末的xrd结果。
28.图9示出根据本发明制备的li2o粉末的xrd结果。
29.图10示出根据本发明制备的li2o粉末的xrd结果。
30.图11示出根据本发明制备的li2o的粒度与反应器的线速度之间的关系图表。
31.图12示出根据本发明制备的li2o的粒度与反应器的线速度之间的关系图表。
32.图13示出根据本发明制备的li2o的粒度与反应器的线速度之间的关系图表。
33.图14是根据本发明制备的li2o粉末的sem照片。
34.图15是根据本发明制备的li2nio2粉末的sem照片。
35.图16是根据本发明制备的三个纽扣电池的充放电关系图。
具体实施方式
36.在本发明中,氧化锂通过两步骤的氢氧化锂湿式转化法而生成。本发明的氧化锂是通过在第一步骤中生成过氧化锂并在第二步骤中对所生成的过氧化锂用氧分解而制备。
所生成的氧化锂颗粒的形状与作为中间产物的过氧化锂颗粒的形状相同,但其粒度减少至约50至80%,优选减少至约60至75%,更优选减少至约65至70%。因此,可通过控制过氧化锂的颗粒的形状、尺寸、粒度或直径,来获得所需的氧化锂的形状、尺寸、粒度或直径。
37.在第一步骤中,氢氧化锂在水溶液内解离而生成锂离子,其与过氧化氢反应,合成为过氧化锂(li2o2)后沉淀。可通过调节过氧化锂合成时生成的颗粒间的碰撞率和碰撞能量,来控制所生成的过氧化锂颗粒的粒度。颗粒间的碰撞能量根据反应器的内部形状、反应物的流动现象、溶液的移动速度等而变化,作为导致这一点的变量,搅拌器的tip velocity可以如下定义,并进行调节。
38.tip velocity:v_tip=2pi
×
r_impellor*(rpm)/60
39.本发明的氧化锂制备工序包括两步骤反应,即下述氢氧化锂原料湿式反应以及非活性气氛高温分解反应。
40.第一步骤:2lioh-xh2o h2o2→
li2o2 yh2o,x为0以上的整数。
41.第二步骤:li2o2→
li2o 1/2o2(g)
42.本发明的两步骤工序的流程图在图1中示出。
43.在所述各步骤中,为防止由于大气中的水分和co2导致的污染且促进物质转化,优选维持非活性气氛。
44.1)第一步骤
45.1-1)原料物质的混合
46.在本步骤中,将含有一水合氢氧化锂或氢氧化锂的锂原料与双氧水混合。氢氧化锂与双氧水的理论反应比为锂当量:双氧水当量为2:1,但可以调整比例以提高反应收率。优选的反应当量比可以是氢氧化锂比双氧水为4:1至1:1的比例。
47.作为起始原料,可以使用一水合氢氧化锂(lioh-h2o)、无水氢氧化锂(lioh)或多水合氢氧化锂(lioh-xh2o)。为了提高反应收率,优选使用无水氢氧化锂。
48.过氧化氢可以作为水溶液使用(h2o
2-zh2o,z为0以上的整数)。为了提高反应收率,优选使用纯过氧化氢,但出于保存和安全的原因,优选使用浓度为35%的水溶液。
49.1-2)通过反应器叶轮搅拌调节中间物质的析出和粒度
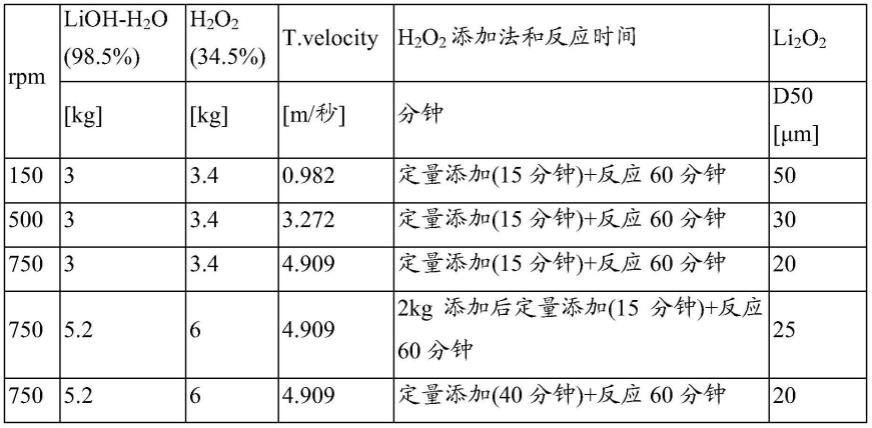
50.可通过调节反应器的形状、内部挡板以及叶轮的形状和长度(dimension)、叶轮转速、反应器温度等,来调节所生成的li2o2中间物质粒度。通常,随着叶轮转速增加,颗粒的平均尺寸减小,且形成为形状接近球形的颗粒。
51.反应器温度越高,颗粒的平均尺寸越大,形状从球形变为无定形。反应器温度越低,颗粒的平均尺寸越小,形状从无定形变为接近球形。
52.反应时间为添加原料后一分钟以上,优选为30分钟~90分钟。反应器的温度无需必须调节,但为调节反应率,优选在30~60℃范围内被调节。
53.可通过调节过氧化锂合成时生成的颗粒间的碰撞率和碰撞能量,来控制所生成的过氧化锂颗粒的粒度。颗粒间的碰撞能量根据反应器的内部形状、反应物的流动现象、溶液的移动速度等而变化,作为导致这一点的变量,搅拌器的tip velocity可以如下定义,并进行调节。
54.tip velocity:v_tip=2pi
×
r_impellor*(rpm)/60
55.在上述式中,pi表示圆周率(3.41592
…
),r_impellor表示搅拌器叶轮的半径,rpm
表示搅拌器叶轮的每分钟转速。
56.在本发明中,r_impellor受限于反应器的形状和电机的可动范围,本领域技术人员可以通过考虑电机规格来确定该值以符合所需叶端速度(tip velocity)。
57.在本发明中,搅拌器的叶端速度可以为0.2m/秒至20m/秒范围,优选为1m/秒至10m/秒范围。
58.在本发明中,叶端速度与所生成的颗粒的尺寸成反比例,这表示叶端速度越快,颗粒的尺寸越小。
59.1-3)所制备的浆料析出物回收和干燥
60.通过反应器内叶轮的搅拌,可制备中间物质的浆料。可将所制备的浆料沉降,或通过过滤器,或通过离心等方法,分离为溶液和固体成分。回收的溶液为溶解有过量的锂的氢氧化锂水溶液,可用于锂化合物制备。回收的li2o2固体成分可通过真空干燥对表面吸附水进行干燥。
61.在所述步骤中制备的li2o2颗粒为接近球形或几乎为球形,或是球形。所生成的过氧化锂的颗粒尺寸为1μm至130μm范围,优选为,5μm至50μm范围。
62.2)第二步骤
63.2-1)非活性气氛下的热处理
64.在1)步骤中制备的固体成分为li2o2,在非活性气氛或真空气氛的高温下可转化为li2o。转化温度为300℃以上,优选为350℃~650℃。转化时间(反应时间)根据转化温度(反应温度)而变化,转化时间与转化温度成反比例。转化时间与转化温度成反比例是指,在相同的反应中转化时间越长转化温度越低。在一实施例中,转化时间可以为10分钟以上,优选为30分钟以上,更优选为1小时以上,更具体为30分钟至3小时,或1小时至2小时。当转化温度为420℃时,转化时间优选为30分钟以上。
65.所生成的氧化锂的颗粒形状与1)步骤中间产物,即过氧化锂颗粒的形状相同,但其粒度(颗粒的尺寸、直径)减少至约50至80%,优选减少至约60至75%,更优选减少至约65至70%。在本步骤中生成的氧化锂的粒度可由下述式确定:
66.(氧化锂粒度)=a
×
exp(b
×
tip velocity),a、b为工序常数
67.(在所述式中,a和b为工序常数值,20《a《60,-0.3《b《-0.1)。
68.在所述式中,a是一个参数,用能量来解释叶端速度对颗粒的尺寸的影响,并且在相同叶端速度下,随着碰撞次数和能量的增加而增加。a值可能是挡板数量和挡板截面积对粒径影响的参数,具体值可能因溶液粘度、颗粒尺寸、温度等各种因素而异。本领域技术人员可以考虑这样的工序条件在上述范围内确定a值。
69.b是一个参数,用颗粒破碎和再生长活化能来解释叶端速度对颗粒尺寸的影响,并且与相同的叶端速度相比,根据颗粒缺陷能量和再结晶能量而变化。详细值可能因溶液浓度、温度、物质类型和杂质含量等各种因素而异。本领域技术人员可以考虑这样的工序条件在上述范围内确定b值。
70.2-2)li2o粉末回收和包装
71.为防止转化的li2o在大气中变性,可对其进行充氮及真空包装。尤其,li2o与大气中的水分和co2同时接触时,可变性为氢氧化锂和碳酸锂,因此存放时需要注意。
72.在所述步骤中制备的li2o颗粒为接近球形或几乎为球形,或是球形。氧化锂的颗
粒尺寸为1μm至100μm范围,优选为5μm至50μm范围。
73.在下文中,将通过以下实施例更详细地描述本发明的实施例。然而,这仅作为示例呈现,并且本发明不限于此,并且本发明仅由权利要求的范围来限定。
74.实施例
75.实施例1
76.在反应器中混合3kg的试剂级一水合氢氧化锂(98%,samchun chemical)和3.4kg的双氧水(samchun chemical,34.5%)。反应器内部装有四个矩形挡板,反应器转子为双层结构。使机械叶轮的转速为150至750rpm,并进行1小时反应。回收约1.2kg的米色浆料,并通过安装有金属过滤器的锥形过滤干燥器(cone-type filter dryer)以分离固体和液体。回收1.7kg湿li2o2粉末和4.7kg水溶液。将湿li2o2粉末在130℃的真空干燥箱中储存3小时后,回收1.2kg的干燥li2o2粉末。作为xrd物相分析结果,被分析为98.5%的li2o2、1.3%的li2co3和0.2%的lioh-h2o。li2co3推断为在运输和xrd测量过程中通过大气中的co2而产生。
77.回收的li2o2粉末的sem照片在图2中示出。如图2所示,颗粒的尺寸随着rpm的增加而减小。平均颗粒尺寸d50在150rpm下为约50
±
20μm,在500rpm下为约30
±
15μm,在750rpm下为约20
±
10μm。
78.实施例2
79.在反应器中混合5.2kg的试剂级一水合氢氧化锂(98%,samchun chemical)和6.0kg的双氧水(samchun chemical,34.5%)。反应器内部装有四个矩形挡板,反应器转子为双层结构。使机械叶轮的转速为150至750rpm,并进行1小时反应。回收约11.2kg的米色浆料,并通过安装有金属过滤器的锥形过滤干燥器(cone-type filter dryer)以分离固体和液体。回收2.5kg湿li2o2粉末和8.7kg水溶液。将湿li2o2粉末在130℃的真空干燥箱中储存3小时后,回收2.1kg的干燥li2o2粉末。作为xrd物相分析结果,被分析为98.5%的li2o2、1.3%的li2co3和0.2%的lioh-h2o。
80.将通过实施例1和2的合成方法制备的li2o2的粒度与合成反应时反应器的线速度之间的关系示于下表中。
81.表1
[0082][0083]
以上述表的数值为基础,将通过实施例1和2的合成方法制备的li2o2的粒度与合成
反应时反应器的线速度之间的关系以图表形式示于图3中。
[0084]
实施例3
[0085]
在反应器中混合30kg的试剂级一水合氢氧化锂(98%,samchun chemical)和32kg的双氧水(samchun chemical,34.5%)。合成反应器内部装有四个矩形挡板,反应器转子为双层结构。使机械叶轮的转速为150至500rpm,并进行1小时反应。回收约12.7kg的米色浆料,并通过安装有金属过滤器的锥形过滤干燥器(cone-type filter dryer)以分离固体和液体。回收14kg湿li2o2粉末和48kg水溶液。将湿li2o2粉末在130℃的真空干燥箱中储存3小时后,回收12.7kg的干燥li2o2粉末。作为xrd物相分析结果,被分析为98.5%的li2o2。
[0086]
将通过实施例3的合成方法制备的li2o2的粒度与合成反应时反应器的线速度之间的关系示于下表中。
[0087]
表2
[0088][0089][0090]
以上述表的数值为基础,将通过实施例3的合成方法制备的li2o2的粒度与合成反应时反应器的线速度之间的关系以图表形式示于图4中。
[0091]
实施例1~3的结果分析
[0092]
分析实施例1至3的数据的结果,确认到,与反应器尺寸无关,叶端速度(tip velocity)和li2o2的平均粒度(d50)具有以下关系。
[0093]
表3
[0094]
[0095][0096]
以上述表的数值为基础,将li2o2的粒度与合成反应时反应器的线速度之间的关系以图表形式示于图5中。
[0097]
实施例4-li2o2转化为li2o
[0098]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在425℃的氮气气氛炉中暴露7小时。回收粉末,得到6.5g的li2o。
[0099]
通过sem观察制备的li2o的形状。图6示出制备的li2o的sem图像。如图6所示,其形状为球形。
[0100]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在400℃的氮气氛中暴露1小时30分钟以转化为li2o。转化率为91.2%,并鉴定出一些lioh。回收的li2o为6.8g。
[0101]
回收的粉末的xrd结果如图7所示。
[0102]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在600℃的氮气氛中暴露1小时30分钟以转化为li2o。回收的li2o为6.5g。
[0103]
制备的粉末的xrd结果如图8所示。
[0104]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在700℃的氮气氛中暴露14小时以转化为li2o。回收的li2o为6.5g。
[0105]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在750℃的氮气氛中暴露12小时以转化为li2o。回收的li2o为6.5g。
[0106]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在425℃的氮气氛中暴露3小时,之后在950℃中暴露1小时,以转化为li2o。回收的li2o为6.5g。
[0107]
将10g的干燥li2o2粉末置于氧化铝坩埚中,然后在425℃的氮气氛中暴露3小时,之后在950℃中暴露2小时,以转化为li2o。回收的li2o为6.5g。
[0108]
将500g的干燥li2o2粉末置于氧化铝坩埚中,然后在425℃的氮气氛中暴露3小时以转化为li2o。回收的粉末为320g。
[0109]
将10g干燥的li2o2粉末置于氧化铝坩埚中,然后在600℃的电炉中暴露1小时30分钟以回收li2o。提供200cc/分钟的高纯度氧气(99.98%)和800cc/分钟的高纯度氮气(99.98%)。回收的粉末为6.5g。
[0110]
制备的粉末的xrd结果如图9所示。
[0111]
将10g干燥的li2o2粉末置于氧化铝坩埚中,然后在600℃的电炉中暴露1小时30分钟以回收li2o。提供500cc/分钟的高纯度氧气(99.98%)和500cc/分钟的高纯度氮气(99.98%)。回收的粉末为6.5g。
[0112]
制备的粉末的xrd结果如图10所示。
[0113]
将在实施例4中制备的li2o2和li2o的粒度与合成反应时反应器的线速度之间的关系示于下表中。
[0114]
表4
[0115]
[0116][0117]
以上述表的数值为基础,将li2o的粒度与合成反应时反应器的线速度之间的关系以图表形式示于图11-图13中。如上所示,叶端速度(tip velocity)遵循以下关系式,因此,可通过调节叶端速度来调节氧化锂的粒度。
[0118]
(氧化锂粒度)=a
×
exp(b
×
tip velocity),a、b为工序常数,
[0119]
a、b为工序常数值,可以根据设备的实验值获得。
[0120]
实施例5-以li2o为原料合成过锂过渡金属氧化物的实施例
[0121]
使用小型混合器将20g的nio和8.85g的制备的li2o混合5分钟。通过将混合的粉末在氮气气氛炉中在700℃下暴露12小时来合成li2nio2。合成的粉末为28.86g。
[0122]
如图14所示,混合物的形状为球形。尤其,如图14所示,发现粉碎的li2o细粉均匀地分布在球形nio的表面上。
[0123]
高温热处理后合成的li2nio2的形状如图15所示。如图15所示,形成了球形
li2nio2,没有观察到未反应的nio和li2o。
[0124]
使用制备的li2nio2制造了cr2032纽扣电池,并评估其电化学性能。电极涂在14mm厚的铝板上。涂层厚度为50~80μm。
[0125]
电极浆料由li2nio2:denka black(d.b.):pvdf以85:10:5重量%混合而成,将制备的电极真空干燥后压制,最终涂层厚度为40~60μm。电解质溶液是一种有机溶液,其中,lipf6盐以1m的浓度溶解在ec:emc=1:2的溶剂中。
[0126]
将制造的纽扣电池在4.25~3.0v区间以0.1c倍率(rate)和1%的条件进行cc/cv模式充放电。三个纽扣电池的充放电曲线如图16所示。
[0127]
总共进行了3次充放电测试,每次测试都显示相同的结果。
[0128]
1红色:纽扣电池的平均电化学特性测量为:充电容量为389.88mah/g、放电容量为130.99mah/g、不可逆容量为258.88mah/g、可逆效率为33.60%。
[0129]
2绿色:纽扣电池的平均电化学特性测量为:充电容量388.19mah/g、放电容量130.82mah/g、不可逆容量257.38mah/g、可逆效率33.70%。
[0130]
实施例6
[0131]
使用小型混合器将100g的nio和41.2g的研发品li2o混合10分钟。通过将混合的粉末在氮气气氛炉中在700℃下暴露12小时来合成li2nio2。回收了140g合成的粉末。
[0132]
使用小型混合器将100g的nio和41.2g的作为比较材料购买的li2o混合10分钟。通过将混合的粉末在氮气气氛炉中在700℃下暴露12小时来合成li2nio2。回收了140g合成的粉末。
[0133]
制备的粉末的粒度分析结果如下。如经过所示,以d50为基准,研发品增加了4.1μm,dmin和dmax均增加。这是因为研发品促进了lno合成过程中的烧结(sintering)效应。
[0134]
表5
[0135][0136]
为对制备的粉末进行相分析,而测定了xrd,基于测定结果的相分析结果示于下表6。如结果所示,当使用研发品时,确认到lno相分数提高了3.6重量%,残余nio含量减少了2.7重量%。
[0137]
表6
[0138][0139]
通过中和滴定法测量制备的粉末中的残余锂量。如下表7所示,在研发品中测得的lioh含量减少了58.2%。li2co3含量被判断为因暴露在大气中而变性。
[0140]
表7
[0141][0142][0143]
以回收的粉末为原料制造了cr2032纽扣电池,并评估其电化学性能。将制备的li2nio2诱导粉碎后,通过#325目(mesh)去除杂质和大颗粒。电极涂在14mm厚的铝板上。涂层厚度为50~80μm。电极浆料由li2nio2:denka black(d.b.):pvdf以85:10:5重量%混合而成,将制备的电极真空干燥后压制,最终涂层厚度为40~60μm。电解质溶液是一种有机溶液,其中,lipf6盐以1m的浓度溶解在ec:emc=1:2的溶剂中。将制造的纽扣电池在4.25~3.0v区间以0.1c倍率(rate)和1%的条件进行cc/cv模式充放电。
[0144]
结果表明,研发品充电容量提高了2.7%,放电容量提高了3.6%,不可逆容量提高了2.2%。上述结果是因为反应率提高的研发品,从而提高了lno的合成率。
[0145]
表8
[0146][0147]
如纽扣电池制造实验所示,与传统的li2o相比,在lno合成过程中的转化率提高,因此证实电化学容量增加,残留锂含量减少,物质效率提高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
