非洲猪瘟病毒抗原重组串联表位蛋白及其构建方法、应用和抗体elisa试剂盒
技术领域
1.本发明属于生物检测技术领域,尤其涉及一种非洲猪瘟病毒抗原重组串联表位蛋白 mgf360-505r-cd2v及其构建方法、应用和抗体elisa试剂盒。
背景技术:
2.非洲猪瘟(african swine fever,asf)是一种由非洲猪瘟病毒(african swine fever virus, asfv)引起的猪高致死性传染病。非洲猪瘟病毒颗粒结构与虹彩病毒相似,复制方式与痘病 毒具有相同的特点,是非洲猪瘟病毒科的唯一成员,根据国际病毒分类委员会(internationalcommittee of taxonomy of viruses,ictv)发布的2019年分类报告,非洲猪瘟病毒科已被归 入阿福病毒目(asfuvirales)和痘疹病毒纲(pokkesviricetes)。
3.asf血清学诊断靶点相关深入研究有助于其感染检测、致病机理和机体免疫系统反应等 探究。asfv重要蛋白(p30、p72、cd2v等)的高保守性及其抗原性具有实验室诊断学意义。 自asfv发现以来,陆续有利用p30和p72等候选蛋白研发不同形式的asfv抗体血清学检 测方法。
4.asfv p30蛋白为早期病毒蛋白(cp204l基因编码),是asfv感染过程中引起体液免 疫应答重要的抗原蛋白,p30抗体可阻止asfv病毒内吞,能够在病毒与细胞吸附之前或之 后中和病毒,是重要的病毒早期诊断靶点。
5.asfv p72是在asfv感染后期表达的主要结构蛋白(b646l基因编码),是asfv二 十面体衣壳的主要成分,是asfv高免疫原性蛋白之一,亦是elisa等血清学诊断的重要靶 点,p72抗体也可阻止asfv吸附到巨噬细胞,但不能在抗体介导的免疫保护中起决定性作 用;
6.cd2v在asfv感染后期表达(ep402r基因编码),是cd2的同系物,可引起病毒毒 力增强、红细胞吸附现象。cd2v和c型凝集素蛋白介导asfv的血凝抑制(hemagglutinationinhibition,hai)血清学特异性,cd2v和c型凝集素特征序列为asfv血清型分组提供了一 种简单方法。先前研究认为cd2v免疫原性较弱,但近期研究发现cd2v蛋白或其多克隆抗 体均表现出良好的免疫反应性,这提示cd2v蛋白可能是潜在的血清学诊断靶点。
7.asfv mgf基因(如mgf360与mgf505等)编码多基因家族(mgf)蛋白,有报道 mgf360与mgf505基因参与抑制干扰素(ifn)的产生;mgf基因的缺失可降低asfv ba71 病毒株在猪巨噬细胞中的复制能力。
技术实现要素:
8.本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷,提供一种非洲 猪瘟病毒抗原重组串联表位蛋白mgf360-505r-cd2v及其构建方法、应用和抗体elisa试 剂盒。
9.为解决上述技术问题,本发明提出的技术方案为:
10.一种非洲猪瘟病毒抗原重组串联表位蛋白,由非洲猪瘟病毒cd2v蛋白与mgf360-505r 蛋白的b细胞表位以柔性肽串联后形成,即mgf360-505r-cd2v。
11.进一步的,所述非洲猪瘟病毒抗原重组串联表位蛋白(mgf360-505r-cd2v)的氨基酸 序列如seq id no:1所示。
12.基于一个总的发明构思,本发明还提供一种非洲猪瘟病毒抗原重组串联表位蛋白的构建 方法,包括如下步骤:将所述非洲猪瘟病毒抗原重组串联表位蛋白的编码基因进行xhoi及 xbai酶切位点酶切后,利用t4 dna连接酶将酶切后的基因片段亚克隆至pet28a载体,构 建重组质粒,然后使用大肠杆菌bl21进行表达,得到非洲猪瘟病毒抗原重组串联表位蛋白。
13.进一步的,所述非洲猪瘟病毒抗原重组串联表位蛋白的编码基因通过以下方法设计筛选 得到:用python运行程序对非洲猪瘟病毒p30蛋白、p72蛋白、cd2v蛋白、mgf360-505r 蛋白的b细胞表位以柔性肽串联并进行自动化排列组合,然后利用蛋白可溶性预测工具对自 动化排列组合形成的序列逐一进行蛋白可溶性预测,根据需求筛选蛋白可溶性预测值合格的 蛋白序列,通过分析得到其编码基因。其中采用的python运行程序的程序代码见附录所示。
14.进一步的,所述非洲猪瘟病毒抗原重组串联表位蛋白的编码基因的核苷酸序列如seq idno:2所示。
15.基于一个总的发明构思,本发明还提供一种非洲猪瘟病毒抗原重组串联表位蛋白在抗体 elisa检测中的应用。
16.进一步的,利用所述的非洲猪瘟病毒抗原重组串联表位蛋白进行抗体elisa检测,其方 法包括如下步骤:
17.(1)将所述的非洲猪瘟病毒抗原重组串联表位蛋白稀释后加入至elisa板进行包被;
18.(2)在所述所述elisa板中加入bsa封闭液进行封闭孵育;
19.(3)将待测血清样品稀释后加入至所述elisa板进行一抗孵育;
20.(4)将hrp-抗猪lgg稀释后加入至所述elisa板进行酶标二抗孵育;
21.(5)用tmb底物进行显色反应,用浓硫酸终止反应,采用分光光度计测量od
450
数值, 进行结果判定。
22.更进一步的,在步骤(1)中,所述非洲猪瘟病毒抗原重组串联表位蛋白稀释后的浓度为 1-6ng/μl;在步骤(2)中,所述待测血清样品按体积比1∶25-200进行稀释;在步骤(3) 中,所述酶标二抗按体积比1∶5000-8000进行稀释。
23.更进一步的,在步骤(2)中,所述一抗孵育的时间为30-90min;在步骤(5)中,所述 显色反应的时间为5-15min。
24.更进一步的,在步骤(5)中,按照以下标准进行结果判定:若待测血清样品的od
450
值 大于0.551,则判断为阳性,若待测血清样品的od
450
值低于0.551,则判定为阴性。
25.基于一个总的发明构思,本发明还提供一种基于所述非洲猪瘟病毒抗原重组串联表位蛋 白的抗体elisa检测试剂盒,包括:包被有抗原的96孔可拆卸酶联反应板、阳性对照血清、 阴性对照血清、辣根过氧化物酶标记的羊抗猪二抗(购自kpl公司,货号14-14-06)、10 倍浓缩的pbst洗涤液、tmb显色液(购自kpl公司,货号5120-0076)和终止液,所述抗 原
为所述的非洲猪瘟病毒抗原重组串联表位蛋白。
26.进一步的,所述阳性对照血清为所述非洲猪瘟病毒抗原重组串联表位蛋白的免疫血清, 所述阴性对照血清为无特定病原体的猪血清,所述辣根过氧化物酶标记的羊抗猪二抗由其原 液按1:7000倍体积稀释得到,所述10倍浓缩的pbst洗涤液为含有0.05%吐温20的0.01mol/l、 ph值为7.4的磷酸盐缓冲液,所述终止液为2mol/l的硫酸溶液。
27.与现有技术相比,本发明的有益效果为:
28.1、本发明的非洲猪瘟病毒抗原重组串联表位蛋白,由非洲猪瘟病毒cd2v蛋白与 mgf360-505r蛋白的b细胞表位以柔性肽串联后形成mgf360-505r-cd2v,相较于p30、p72、 p30-p72等其他串联表位蛋白,mgf360-505r-cd2v串联表位蛋白表达量与包涵体含量更高, 且具有一定的可溶性,与血清抗体具有反应性,能够用于抗体elisa的检测。
29.2、本发明的构建方法,操作简单,成本低廉,合成效率高。
30.3、本发明的应用和抗体elisa检测试剂盒,将mgf360-505r-cd2v串联表位蛋白用于 间接elisa igg抗体的检测,特异性良好,重复性与稳定性好,灵敏度高,能准确识别asfv 野生型和cd2v基因缺失型毒株免疫后产生的血清样本,对asf检测具有一定的参考价值, 基于保守表位的血清学检测方法有望提供更广泛的诊断范围。
附图说明
31.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术 描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实 施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图 获得其他的附图。
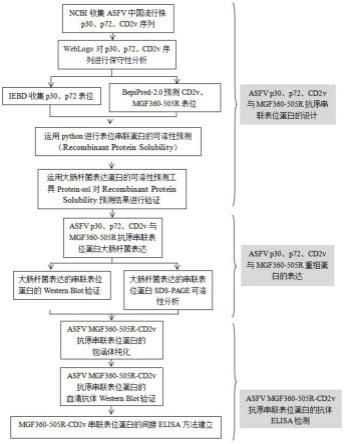
32.图1是本发明的技术流程图。
33.图2是asfv中国流行毒株p30序列比对及其b细胞表位(表位中红色部分代表与asfv 中国流行株p30序列差异的氨基酸)。
34.图3是asfv中国流行毒株p72序列比对及其b细胞表位(表位中红色部分代表与asfv 中国流行株p72序列差异的氨基酸)。
35.图4是asfv中国流行毒株cd2v序列比对及其b细胞表位的预测(表位中红色部分代 表与asfv中国流行株cd2v序列差异的氨基酸)。
36.图5是western blot his-tag抗体实验鉴定重组串联表位蛋白的表达;其中,m:蛋白质 标准marker;n:阴性对照;1:iptg未诱导的蛋白表达;2:iptg诱导蛋白表达1h;3:iptg 诱导蛋白表达3h;a:p30重组串联表位蛋白的表达;b:p72重组串联表位蛋白的表达;c: p30-p72重组串联表位蛋白的表达;d:mgf360-505r-cd2v重组串联表位蛋白的表达。
37.图6是sds-page鉴定重组串联表位蛋白的可溶性分析;其中,m:蛋白质标准marker 1:总蛋白;2:裂解后上清液蛋白;3:裂解后沉淀蛋白;a:p30重组串联表位蛋白的可溶 性分析;b:p72重组串联表位蛋白的可溶性分析;c:p30-p72重组串联表位蛋白的可溶性 分析;d:mgf360-505r-cd2v重组串联表位蛋白的可溶性分析。
38.图7是mgf360-505r-cd2v串联表位蛋白的包涵体纯化;其中,m:蛋白质标准marker 1:总蛋白;2:裂解离心上清蛋白;3:2mol尿素处理离心上清蛋白;4:4mol尿素处理离 心上清蛋白;5:6mol尿素处理离心上清蛋白;6:8mol尿素处理离心上清蛋白。
anaconda,用python运行程序(见附录)对上述p30、p72、cd2v、mgf360-505r的b细胞 表位以柔性肽(ggggs)串联并进行自动化排列组合,然后利用现有的可溶性预测工具对自 动化排列组合形成的序列逐一进行蛋白可溶性预测,进而得到可溶性预测值高的蛋白序列设 计方案,在程序经过运算后,所有影响蛋白可溶性的表位在程序执行时剔除。
52.选择重组蛋白大肠杆菌表达的可溶性预测protein-sol工具:(https://protein-sol.manchester.ac.uk/),该网站提供了一种基于序列的快速预测大肠杆菌表达 蛋白质溶解度的方法,对recombinant protein solubility预测结果进行验证。
53.3.非洲猪瘟病毒p30、p72、cd2v与mgf360-505r抗原串联表位蛋白的表达
54.本发明将设计并由金斯瑞生物科技技术有限公司合成的p30、p72、p30-p72及 mgf360-505r-cd2v抗原串联表位蛋白的编码基因,经xhoi及xbai酶切位点酶切后,利用 t4 dna连接酶分别将酶切后的基因片段亚克隆至pet28a载体,并分别命名为pet28-p30、 pet28a-p72、pet28a-p30-p72及pet28a-mgf360-505r-cd2v重组质粒,使用大肠杆菌表达 系统bl21表达菌株进行表达,利用his-tag抗体(cst公司)进行western blot验证,通过 sds-page蛋白胶进行可溶性分析。
55.其中,p30的编码基因核苷酸序列如seq id no:3所示,p72的编码基因核苷酸序列如 seq id no:4所示),p30-p72的编码基因核苷酸序列如seq id no:5所示, mgf360-505r-cd2v的编码基因核苷酸序列如seq id no:2所示。
56.4.mgf360-505r-cd2v抗原串联表位蛋白的抗体elisa检测应用
57.4.1非洲猪瘟病毒cd2v与mgf360-505r抗原串联表位蛋白的纯化与鉴定
58.对表达的mgf360-505r-cd2v蛋白包涵体进行尿素纯化,mgf360-505r-cd2v蛋白包涵 体纯化操作步骤:(1)取mgf360-505r-cd2v 40ml菌液的沉淀,加入裂解液,重悬包涵体 沉淀,超声波细胞粉碎机条件200w,5s,5s共10min工作条件。(2)条件20000xg 20min 10℃离心,获取包涵体沉淀,加入tritonx-100至1%分解细胞膜和溶解膜蛋白,将裂解物于 冰上孵育10min,然后20000xg离心20min以沉淀包涵体,最后移走可溶性上清液记作s。 (3)沉淀中加入2m尿素浓度的缓冲液孵育20min,条件20000xg 20min 10℃以沉淀包涵 体,移走可溶性上清液记作2s,然后按照这个步骤再以4m、6m、8m浓度的尿素处理包涵 体,分别取上清记作4s、6s、8s。(4)进行sds-page蛋白胶并拍照分析,确定目的蛋白 的纯化,并进行western blot鉴定其免疫原性。
59.4.2抗体elisa检测方法的操作步骤
60.采用的抗体elisa检测试剂盒,包括以下组分:包被有抗原的96孔可拆卸酶联反应板 (抗原为mgf360-505r-cd2v重组串联表位蛋白)、阳性对照血清(mgf360-505r-cd2v 重组串联表位蛋白的免疫血清)、阴性对照血清(无特定病原体猪血清)、辣根过氧化物酶 标记的羊抗猪二抗(购自kpl公司,货号14-14-06,原液1:7000倍稀释)、10倍浓缩的pbst 洗涤液(含有0.05%吐温20的0.01mol/l、ph值为7.4的磷酸盐缓冲液)、tmb显色液(购 自kpl公司,货号5120-0076)、终止液(2mol/l的硫酸溶液)。
61.抗体elisa检测方法的步骤具体如下:
62.(1)包被:将mgf360-505r-cd2v重组串联表位蛋白稀释至使用浓度,每孔100μl,4℃ 12h孵育,pbst(0.05%吐温)洗涤5次,每次300μl。
63.(2)封闭:配置bsa封闭液,每孔200μl,室温(24℃)孵育3h,pbst(0.05%吐温) 洗
涤5次。
64.(3)一抗(血清):稀释后每孔100μl,室温(24℃)孵育,pbst(0.05%吐温)洗涤 5次。
65.(4)酶标二抗(hrp-抗猪lgg):稀释后每孔100μl,室温(24℃)孵育,pbst(0.05% 吐温)洗涤5次。
66.(5)显色与终止:tmb底物每孔50μl,于室温(24℃)显色,浓硫酸终止液每孔50μl 终止反应,分光光度计测量od
450
数值,进行结果判定。
67.4.3 mgf360-505r-cd2v蛋白最佳包被浓度的确定
68.mgf360-505r-cd2v蛋白浓度分别稀释至1、2、4、6ng/μl,每孔100μl,依次纵向包 被elisa板进行实验,保持其他实验条件不变,根据计算阳性血清与阴性血清复孔平均值的 比值p/n,判断mgf360-505r-cd2v蛋白最佳包被浓度。
69.4.4血清样品最适稀释度的确定
70.将血清按1:25、1:50、1:100、1:200进行稀释。每孔100μl加到elisa酶标板, 设置复孔,室温(24℃)孵育。保持其他实验条件不变,根据计算阳性血清与阴性血清复孔 平均值的比值p/n,判断血清抗体最适稀释度。
71.4.5酶标二抗最适稀释倍数的确定
72.将酶标二抗按1:5000、1:6000、1:7000、1:8000进行稀释,每孔100μl加到elisa 酶标板,设置复孔,室温(24℃)孵育。保持其他实验条件不变,根据计算阳性血清与阴性 血清复孔平均值的比值p/n,判断二抗最适稀释倍度。
73.4.6血清最适反应时间的确定
74.稀释后的血清加入elisa酶标板,设置不同的反应时间:30min,45min,1h,1.5h进行 反应,设置复孔,(24℃),室温(24℃)孵育。保持其他实验条件不变,根据计算阳性血 清与阴性血清复孔平均值的比值p/n,判断血清最适反应时间。
75.4.7 tmb最适作用时间的确定
76.设置tmb反应时:5min、10min、15min,每孔50μl,室温(24℃)孵育。保持其他实 验条件不变,根据计算阳性血清与阴性血清复孔平均值的比值p/n,判断tmb最适作用时间。
77.4.8阴阳性临界值的确定
78.使用初步建立的asfv抗体elisa方法对30份阴性对照猪血清进行检测,测定其od
450
值,并计算出30份阴性血清的平均值(av)与标准差(sd),根据统计学公式:平均值(av) 3
×
标准差(sd)计算其阴阳性临界值。
79.4.9特异性试验
80.选取来源2017年采集于湖南某猪场并由商业化试剂盒检测为猪瘟(csfv)、猪伪狂(prv)、 猪蓝耳(prrsv)、猪圆环2型(pcv2)、猪流行性腹泻(pedv)的阳性血清各3份,共 15份血清。使用建立的抗体elisa方法进行检测设置副孔,并计算平均值。与临界值比较来 判断该方法的特异性。
81.4.10重复性试验
82.4.10.1批内差异
83.选取16临床猪血清样本,使用同一块elisa板,使用mgf360-505r-cd2v蛋白的抗体 elisa方法对应每份血清做3个重复,根据od
450
值结果,计算平均值(av)与标准差(sd), 并
根据公式计算变异系数:变异系数cv(%)=标准差(sd)/平均值(av)
×
100%。
84.4.10.2批间差异
85.选取16份临床猪血清样本,隔天三批包被elisa板,使用mgf360-505r-cd2v蛋白的 抗体elisa方法对应每份血清做3个重复,根据od
450
值结果,计算平均值(av),标准差 (sd),并根据公式计算变异系数:变异系数cv(%)=标准差(sd)/平均值(av)
×
100%。
86.4.11 elisa临床样本的检测初步应用
87.2份标准血清样本(asfv 8型野生株和cd2v基因缺失株)购自中国兽医药品监察所, 作为标准阳性对照;30份阴性对照猪血清采集于2017年期间在湖南某猪场;使用99份临床 猪血清样本在湖南省动物疫病预防控制中心进行mgf360-505r-cd2v蛋白的抗体elisa试 剂盒检测,并与法国id-vet试剂盒比对试验,验证mgf360-505r-cd2v蛋白的抗体elisa 方法的可行性和准确性。
88.5.实验结果
89.5.1中国asfv流行毒株抗原表位的选择(收集或预测)
90.经过分析发现,中国asfv流行毒株p72和cd2v同源性均达100%;p30除在wuhan1 与wuhan2毒株中缺失前8位氨基酸(mdfinis),在sy18毒株中第194位氨基酸差异(k 差异为i),并多出第195到201位氨基酸(sffltyi),其余序列区域的同源性仍可达100%。 总体来看,中国流行株的p30、p72和cd2v蛋白序列保守性较高。
91.通过iebd与文献报道的asfv b细胞表位对比分析发现,有5个p30表位(11-30、24-60、 84-90、116-125、146-160aa)在中国流行株中保守存在(同源性100%)。另有13个表位(40-80、 61-84、61-93、61-110、91-103、91-130、96-105、120-204、123-137、111-160、143-182、175-194、161-201aa)部分氨基酸具有差异(同源性达77%以上)(图2);
92.有10个p72表位(37-48、156-165、179-210、242-269、265-280、280-294、290-303、 400-404、518-552、586-595aa)在中国流行株中保守存在(同源性100%),另有1个表位 (364-395aa)单个氨基酸差异(图3);
93.根据分析得知cd2v蛋白胞外域为16-206aa,用bepipred-2.0(http://www.cbs.dtu.dk/services/bepipred/)及iedb(http://www.iedb.org/)采用不同分析选项对cd2v与mgf360-505 r进行b细胞表位预测,综合多种方法,对预测得到b细胞表位进行统一调整,获得7个调 整过的b细胞表位(图4);同理,mgf360-505r家族基因片段b细胞表位如表1所示。
94.表1 asfv中国流行毒株mgf360-505r b细胞表位的预测
[0095][0096]
5.2非洲猪瘟病毒抗原串联表位蛋白的设计
[0097]
asfv p30重组串联表位蛋白在程序运算后,最终选取8个表位,使用柔性肽连接而成, previous model(1991)可溶性预测结果为100%,此预测工具的可溶性结果大于75%时,则 重组蛋白不需要融合其他促融标签(或促融分子伴侣),即可以可溶性表达,并且综合正确 率为86%。以protein-sol可溶性预测工具作为进一步验证时(该方法满分为1,大于0.45时 具有可溶性),预测结果为0.846。previous model(1991)和protein-sol预测结果符合(表2), 后续应用中,同一蛋白上具有多个表位互相接近的情况,为了保证不影响抗原性,表位之间 间隔的氨基酸不会被删除,直接保留形成完整表位。
[0098]
asfv p72重组串联表位蛋白在程序运算后,最终选取8个表位,由柔性肽连接而成, previous model(1991)可溶性预测结果为100%,protein-sol验证预测结果为0.565,previousmodel(1991)和protein-sol预测结果符合(表2)。
[0099]
asfv p30-p72重组串联表位蛋白在程序运算后,最终选取12个表位经柔性肽连接而成, previous model(1991)可溶性预测结果为100%,protein-sol验证预测结果为0.773,预测结 果符合(表3)。
[0100]
asfv mgf360-505r-cd2v重组串联表位蛋白在程序运算后,最终选取19个表位经柔性 肽连接而成,previous model(1991)可溶性预测结果为99.9%,protein-sol验证预测结果为 0.775,预测结果符合(表4)。
[0101]
表2 asfv p30、p72重组串联表位蛋白的表位序列与溶解度预测
[0102][0103][0104]
表3 asfv p30-p72重组串联表位蛋白的表位序列与溶解度预测
[0105][0106]
表4 asfv mgf360-505r-cd2v重组串联表位蛋白的表位序列与溶解度预测
[0107]
析显示,二抗稀释倍数为1:7000稀释时,其p/n最高(7.6067)。
[0129]
表7酶标记抗体最适稀释倍数的确定
[0130][0131]
5.4.4 tmb最适作用时间的确定
[0132]
改变tmb作用时间,保持其他条件不变,检测od值结果见表8,计算p/n值。结果分 析显示,tmb作用时间为5min时,其p/n高(8.2675)。
[0133]
表8最佳显色时间的确定
[0134][0135]
5.4.5血清最适反应时间的确定
[0136]
改变血清反应时间,保持其他条件不变,检测od值结果见表9,计算p/n值。结果分 析显示,一抗作用时间30min时,其p/n最高(12.6273)。
[0137]
表9血清抗体最适反应时间的确定
[0138][0139]
5.4.6临界值的确定
[0140]
选取30份于2017年采集于湖南某猪场的阴性猪血清样本,利用建立的抗体elisa方法 进行检测,结果如表10,30份asfv阴性血清的平均od
450
值(av)是0.224,标准差(sd) 是0.109,根据公式:平均值(av) 标准差(sd)
×
3计算阈值为0.551。检测样品od
450
值大于0.551,则判断为阳性,低于0.551,判定为阴性。
[0141]
表10临界值的确定
[0142]
样本序号od
450
样本序号od
450
样本序号od
450
10.0588110.2713210.462320.1017120.2373220.183230.1460130.3736230.376540.1321140.0703240.312150.1603150.2925250.133060.3099160.2176260.440670.2284170.2126270.369980.0801180.2722280.129990.1692190.1360290.1122100.1457200.2966300.2943
[0143]
5.4.7特异性试验
[0144]
猪瘟(csfv)、猪伪狂(prv)、猪蓝耳(prrsv)、猪圆环2型(pcv2)、猪流行 性腹泻(pedv)阳性血清共15份,使用建立的抗体elisa方法进行检测,并设置阴性对照 与阳性对照,结果如表11所示,猪瘟(csfv)、猪伪狂(prv)、猪蓝耳(prrsv)、猪 圆环2型(pcv2)、猪流行性腹泻(pedv)阳性血清od
450
均值都小于阈值0.551,判断为 阴性,表明建立的elisa方法特异性良好。
[0145]
表11间接elisa特异性实验结果
[0146][0147]
5.4.8重复性试验
[0148]
5.4.8.1批内重复试验
[0149]
16份猪血清样本,每份血清做3个重复,在酶标仪中得到的结果如表12,计算平均值(av), 标准差(sd),并根据公式计算变异系数:变异系数cv(%)=标准差(sd)/平均值(av)
ꢀ×
100%,结果批间变异系数在0.9611%-6.6319%,小于10%,表明所建立的抗体elisa方 法批间重复性与稳定性较好。
[0150]
表12间接elisa批内重复试验
[0151][0152][0153]
5.4.8.2批间重复试验
[0154]
选取16份猪血清样本,三批elisa板,对应每份血清做3个重复,在酶标仪中得到的 结果如表13,计算平均值(av),标准差(sd),并根据公式计算变异系数:变异系数cv (%)=标准差(sd)/平均值(av)
×
100%,结果批间变异系数在0.8723%-7.7009%,小 于10%,表明所建立的抗体elisa方法批间重复性与稳定性较好。
[0155]
表13间接elisa批间重复试验
[0156][0157]
5.4.9 elisa的样本检测
[0158]
标准血清验证结果如图9所示,能准确识别asfv野生型和cd2v基因缺失型毒株免疫 后产生的血清样本,mgf360-505r-cd2v原核表达串联表位蛋白与法国id-vet检测试剂盒 的符合率为92.93%(92/99),其中阳性符合率:82.6%(19/23),阴性符合率:96.05%(73/76)。
[0159]
综上所述,本发明的非洲猪瘟病毒抗原重组串联表位蛋白,由非洲猪瘟病毒cd2v蛋白 与mgf360-505r蛋白的b细胞表位以柔性肽串联后形成mgf360-505r-cd2v,相较于p30、 p72、p30-p72等其他串联表位蛋白,mgf360-505r-cd2v串联表位蛋白表达量与包涵体含量 更高,且具有一定的可溶性,与血清抗体具有反应性,能够用于抗体elisa的检测。
[0160]
附录:
[0161]
python运行程序代码
[0162]
[0163]
[0164]
[0165]
[0166]
[0167]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。