过表达dll4基因的内皮细胞系及其构建方法和应用
技术领域
1.本发明涉及生物医药领域。具体地,本发明涉及过表达dll4基因的内皮细胞系及其构建方法和应用。
背景技术:
2.正常的血管系统是维持内环境稳定和细胞生长代谢的基础,其功能的维持由多个内外因素共同决定,其中notch信号通路作为人体内一条进化上十分保守的传导通路,在血管功能调控中起着特殊的作用。dll4是notch的dsl(delta/serrste/lag2)配体家族5种配体(dll1、dll3、dll4、jagged1、jagged2)之一,表达在血管发展的网络之中,参与血管的生成,对维持血管正常发育生成是必须的。除了对生理性血管生成的影响,notch信号也参与了缺血后损伤血管的修复以及肿瘤组织血管的形成过程,为临床治疗提供了新靶点。
3.肝脏是损伤后能够快速再生的实质性器官,但是这种再生能力并不是无限的。在许多疾病条件下,由于各种病理因素的影响,其再生能力并不能完全代偿肝细胞及肝功能的缺失,这使得移植仍是治疗爆发性肝衰竭及末期慢性肝病的最终选择,在肝源愈发短缺的今天研究肝再生非常必要。
4.目前,dll4在疾病如肝损伤后再生以及肿瘤发生发展特别是在血管发生及生长中的分子机制仍有待研究。
技术实现要素:
5.本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提出了一种构建细胞系的方法、细胞系及其应用和培养基,本发明的细胞系过表达dll4 基因,能够促进内皮细胞的增殖、减少内皮细胞血管化、促进肝祖细胞向胆管细胞分化等,有助于构建血管发育、肝再生和肿瘤血管生成等模型,可应用于基因缺陷性血管疾病、肝损伤和肿瘤等疾病的机制研究以及临床前靶向药物的研发和筛选等,具有广阔的应用前景。在本发明的第一方面,本发明提出了一种构建细胞系的方法。根据本发明的实施例,所述方法包括:将内皮细胞的dll4基因进行过表达。由此,根据本发明实施例的方法构建的细胞系过表达dll4基因,能够促进内皮细胞的增殖、减少内皮细胞血管化、促进肝祖细胞向胆管细胞分化等,有助于构建血管发育、肝再生和肿瘤血管生成等模型,可应用于基因缺陷性血管疾病、肝损伤和肿瘤等疾病的机制研究以及临床前靶向药物的研发和筛选等,具有广阔的应用前景。
6.根据本发明的实施例,所述构建细胞系的方法还可以具有下列附加技术特征:
7.根据本发明的实施例,所述内皮细胞选自sk-hep-1、huvec或原代内皮细胞。
8.根据本发明的实施例,所述方法包括:1)将构建有dll4基因过表达的质粒进行扩增;
9.2)将上步所得的质粒进行慢病毒包装,获得dll4基因过表达慢病毒;3)使用所述dll4 基因过表达慢病毒感染内皮细胞,得到dll4基因过表达的细胞系。
10.根据本发明的实施例,所述质粒选自plv-dll4-gfpspark。该质粒购买自北京义翘神州科技股份有限公司(cat:hg10171-acgln),其扩增的过程包括质粒转化大肠感受态细胞、挑单克隆菌落、菌体扩增和质粒提取。
11.根据本发明的实施例,所述慢病毒选自hek-293t或hek-293ft。hek-293t细胞可用于逆转录病毒的生产、基因表达和蛋白生产,hek-293ft能获得高低度的慢病毒。
12.根据本发明的实施例,所述慢病毒包装采用的质粒选自pspax2和pmd2.g。这两种质粒与plv-dll4-gfpspark共同构成三质粒系统,增加载体稳定性,安全生产高滴度、高感染力的慢病毒颗粒。
13.根据本发明的实施例,所述方法进一步包括:4)将所得dll4基因过表达的细胞系进行流式细胞分选。由此,通过细胞分选可以获得dll4基因高表达的内皮细胞。
14.在本发明的第二方面,本发明提出了一种细胞系。根据本发明的实施例,所述细胞系中dll4基因过表达。由此,根据本发明实施例的细胞系能够促进内皮细胞的增殖、减少内皮细胞血管化、促进肝祖细胞向胆管细胞分化等,有助于构建血管发育、肝再生和肿瘤血管生成等模型,可应用于基因缺陷性血管疾病、肝损伤和肿瘤等疾病的机制研究以及临床前靶向药物的研发和筛选等,具有广阔的应用前景。
15.根据本发明的实施例,所述细胞系于2021年10月12日保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址为北京市朝阳区北辰西路1号院3号,保藏编号为cgmccno:23037,科学描述为细胞株。
16.根据本发明的实施例,所述细胞系是通过前面所述构建细胞系的方法获得的。
17.在本发明的第三方面,本发明提出了前面第二方面所述细胞系的应用。本发明的细胞系过表达dll4基因,能够促进内皮细胞的增殖、减少内皮细胞血管化、促进肝祖细胞向胆管细胞分化等,有助于构建血管发育、肝再生和肿瘤血管生成等模型,可应用于基因缺陷性血管疾病、肝损伤和肿瘤等疾病的机制研究以及临床前靶向药物的研发和筛选等,具有广阔的应用前景。
18.根据本发明的实施例,所述细胞系用于构建疾病模型,所述疾病模型用于基因缺陷性血管疾病、肝损伤、肿瘤疾病的机制研究、靶向药物的研发和/或筛选。
19.根据本发明的实施例,所述细胞系用于使肝祖细胞向胆管方向分化。
20.根据本发明的实施例,所述细胞系用于使肝祖细胞的bsep基因、hes1基因、ck19 基因、mrp1-6基因表达上调。
21.在本发明的第四方面,本发明提出了一种培养基。根据本发明的实施例,所述培养基含有第一方面所述构建细胞系的方法获得的细胞系或第二方面所述细胞系所分泌的代谢物。由此,促进了肝祖细胞向胆管方向分化。
22.在本发明的第五方面,本发明提出了一种促进内皮细胞增殖的方法。根据本发明的实施例,所述方法包括:将内皮细胞的dll4基因进行过表达。发明人发现,内皮细胞的dll4 基因过表达可以促进内皮细胞增殖。
23.在本发明的第六方面,本发明提出了一种降低内皮细胞成管能力的方法。根据本发明的实施例,所述方法包括:将内皮细胞的dll4基因进行过表达。发明人发现,内皮细胞的dll4基因过表达可以降低内皮细胞成管能力。
24.在本发明的第七方面,本发明提出了一种使肝祖细胞向胆管方向分化的方法、使
肝祖细胞的bsep基因、hes1基因、ck19基因和/或mrp1-6基因表达上调的方法。根据本发明的实施例,所述方法包括:将前面第二方面所述细胞系与肝祖细胞进行共培养;或者将肝祖细胞培养于前面第四方面所述培养基中。
25.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
26.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
27.图1为dll4基因表达质粒图谱;
28.图2为质粒转染hek-293ft第三天荧光图;
29.图3为慢病毒感染内皮细胞sk-hep-1第十天荧光图;
30.图4为病毒感染后的sk-hep-1细胞流式分选方案图;
31.图5为qpcr过表达鉴定结果;
32.图6为wb过表达鉴定结果;
33.图7为dll4基因高表达sk-hep-1细胞(sk-hep-1-dll4)增殖曲线;
34.图8为sk-hep-1-dll4细胞成管实验结果;
35.图9为sk-hep-1-dll4细胞与肝祖细胞heparg三维共培养10天后胆管向分化指标ck19、mrp2和cx32表达量变化;
36.图10为sk-hep-1-dll4细胞分泌物对heparg胆管向分化相关基因表达的影响。
具体实施方式
37.下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
38.本发明旨在提供一种dll4基因过表达细胞系,本发明将通过以下具体实施例详细说明本发明内容。
39.实施例中所用引物由北京睿博兴科生物技术有限公司合成。
40.实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但不应作为对本发明内容的限制。
41.下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecular cloning:a laboratory manual》sambrook,j.,russell,david w., molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
42.实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
43.本发明实施例中使用的细胞及培养方法为:
44.内皮细胞源性人肝癌细胞系sk-hep-1购自中国医学科学院细胞中心,以含10%胎
牛血清(fetal bovine serum,fbs)的mem培养基进行贴壁培养;hek-293ft细胞:sv40大t 转化的人胚肾上皮细胞系为实验室自备,以含10%fbs的dmem培养基进行贴壁培养,用于慢病毒的包装;终末分化人肝细胞系heparg为实验室自备,以含10%fbs的william'e 培养基进行贴壁培养。
45.本发明实施例中使用的菌株和质粒载体为:
46.大肠杆菌dh5α感受态细胞:用于一般质粒及重组连接产物的转化,购于北京全式金生物技术有限公司。
47.dll4表达质粒plv-dll4-gfpspark,用于在哺乳动物细胞中对dll4进行真核表达,购于北京义翘神州科技股份有限公司,其质粒图谱如图1所示。
48.pspax2及pmd2.g(参见cn102174471a):属于慢病毒包装质粒,利用三质粒慢病毒包装系统增加载体稳定性,安全生产高滴度、高感染力的慢病毒颗粒。
49.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
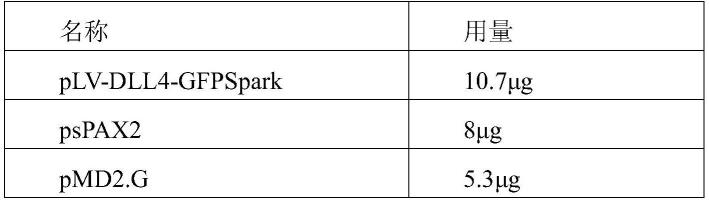
50.实施例1:质粒的扩增
51.该实施例适用于表达质粒(plv-dll4-gfpspark)和包装质粒(pspax2、pmd2.g) 的扩增,包括以下步骤:
52.1)转化:按全式金trans5αchemically competent cell(货号cd201)说明书进行。取 1μl溶解的质粒加入50μl刚刚溶解的感受态细胞中,冰上放置30min,42℃金属浴45秒后立即转到冰上放置2min,加入500μl无抗生素的液体lb培养基,置于37℃摇床200转速 1小时使感受态细胞复苏。1000rpm/min离心1min,去掉400μl上清,重悬剩余感受态细胞,将其均匀涂在含有氨苄抗性的固体lb培养板上,将平板在37℃倒置培养12-14小时。挑取lb平板内的单个克隆菌落到含有氨苄青霉素的lb液体培养基中,37℃、200r/min摇菌培养过夜。
53.2)质粒抽提:根据以上获得的阳性克隆菌落将相应菌液1ml加入50ml含氨苄抗性的液体lb培养基中培养过夜,按天根生化科技(北京)有限公司dp108-无内毒素质粒中量提取试剂盒说明书进行质粒提取。
54.实施例2:慢病毒包装
55.该实施例采用上述实施例1获得的质粒进行慢病毒包装和纯化,以获得携带有目的基因dll4的慢病毒浓缩液,具体包装和纯化步骤为:
56.1)转染前一天,将hek-293ft慢病毒包装细胞接种于10cm培养皿中,使第二天细胞密度达到70%左右可进行转染。
57.2)转染体系如下:
58.[0059][0060]
3)用枪头以吹泡泡的形式反复吹打至少100次,可见液体中出现絮状沉淀,室温放置 20分钟,以“z”字形加入hek-293ft细胞中。37℃培养箱培养6-8h后更换新的培养基,并加入丁酸钠使其终浓度为5mm。在培养过程中通过荧光显微镜对hek-293ft细胞进行gfp 表达效果观察,如图2所示,转染第三天hek-293ft细胞绿色荧光强度高,产毒效果好,可见表达质粒可以成功转染hek-293ft细胞。
[0061]
5)转染72h后收取培养上清作为病毒原液,并将收集的病毒原液用0.45μm滤膜过滤到50ml离心管中,4℃、12000
×
g离心15分钟去除细胞碎片,获得病毒粗提液。
[0062]
6)按全式金translv lentivirus precipitation solution(5x)说明书进行病毒液浓缩,获得 dll4慢病毒浓缩液。
[0063]
实施例3:构建dll4过表达sk-hep-1内皮细胞系(sk-hep-1-dll4)
[0064]
该实施例利用实施例2获得的dll4慢病毒浓缩液感染sk-hep-1细胞,并检测目的质粒对sk-hep-1细胞的感染效果,具体包括以下步骤:
[0065]
1)病毒包装第三天,可接种目的细胞sk-hep-1于6cm皿中,使第二天细胞密度达到 30%-50%即可感染。
[0066]
2)将刚收集的或者从-80℃取出化冻的病毒浓缩液200μl加入sk-hep-1培养基中,同时加入4μg/ml的polybrene以增加感染效率。
[0067]
3)48小时后,对sk-hep-1细胞的病毒感染情况进行荧光观察,期间可重复以上步骤 2)增强感染效率。病毒感染sk-hep-1细胞第十天荧光显微镜观察结果如图3所示,可见绿色荧光蛋白稳定表达,感染效果良好,证实sk-hep-1细胞可被目的质粒 plv-dll4-gfpspark成功感染。将上述确认经慢病毒感染的sk-hep-1细胞命名为 psk-hep-1-dll4细胞。
[0068]
4)流式分选:待psk-hep-1-dll4细胞在荧光显微镜下gfp阳性细胞达到80-90%时,用1ml mem(2xfbs 2xps 10μm y-27)重悬细胞,准备1*107个sk-hep-1和 psk-hep-1-dll4细胞,70μm滤器过滤细胞到无菌流式管中,放于冰上,准备上机。按图 4流式分选方案设置分选程序,接收管内提前加入1ml mem(2xfbs 2xps 10μm y-27) 收集gfp高表达的psk-hep-1-dll4细胞,对应dll4高表达的psk-hep-1-dll4细胞,命名为sk-hep-1-dll4细胞。
[0069]
5)dll4过表达验证:
[0070]
过表达验证主要从mrna转录水平和蛋白翻译水平进行验证,分别通过qpcr和wb 实现,具体步骤如下:
[0071]
a)qpcr:
[0072]
利用trizol法提取rna,按东洋纺逆转录试剂盒说明书逆转录为cdna,然后进行qpcr 检测:
[0073]
1.cdna的稀释:向逆转录后的20μl cdna中加入180μl ddh2o,混匀离心,10倍稀释后的cdna用于实时定量pcr反应。
[0074]
2.引物的准备:先将引物用ddh2o稀释至100μm,然后按10μl forward 10μl reverse 380μl ddh2o配成引物混合物400μl,混匀离心后用于实时定量pcr反应。
[0075]
3.实时定量pcr反应体系的配制:
[0076]
cdna模板2μl双向引物混合物2μltransstart tip green qpcr supermix10μlddh2o6μltotal20μl
[0077]
4.qpcr反应程序
[0078][0079]
5.引物特异性检测:追加溶解曲线反应检测引物特异性,从退火温度开始每10sec上升0.5℃直到90℃,观察峰形图从而检测引物特异性。
[0080]
6.结果分析:由仪器配套专用软件进行结果分析,检测不同细胞中目的基因mrna相对内参基因的表达情况。
[0081]
qpcr结果如图5所示,可见dll4在sk-hep-1-dll4细胞中mrna水平的表达较对照质粒组细胞sk-hep-1-ctrl明显增高,说明经过目的质粒感染改造的sk-hep-1-dll4 细胞在转录水平成功过表达dll4。
[0082]
b)wstern blot:
[0083]
1.蛋白裂解:裂解液配方如下
[0084]
20%sds5mldtt(1m)5mltris(1m,ph6.8)3ml100%甘油5mlh2o32ml蛋白酶抑制剂(100x)可选磷酸酶抑制剂(100x)可选溴酚蓝按需总体积50ml
[0085]
吸尽6cm培养皿中的培养基,用预冷的l
×
pbs洗两遍,加入400μl细胞裂解液(含溴酚蓝),搅动细胞收集于1.5ml的ep管中,98℃金属浴l0分钟使蛋白变性,4℃,12000rpm/min 离心5min,去除细胞碎片,上清用于电泳或储存于-20℃备用。
[0086]
2.sds聚丙烯酰胺凝胶的配方如下:
[0087] 分离胶(10%)浓缩胶h2o4.8ml2.85ml30%聚丙烯酰胺4ml0.85ml4
×
分离/浓缩胶缓冲液3ml1.25ml10%aps0.3ml0.1mltemed9μl10μl总体积12ml5ml
[0088]
3.经过电泳、转膜、5%脱脂牛奶pbst溶液封闭,一抗4℃孵育过夜,洗涤后,以与一抗对应的辣根过氧化物酶标记的igg抗体进行二抗孵育,最后在化学发光仪上显色。wb检测结果如图6所示,可见dll4在sk-hep-1-dll4蛋白水平的表达较sk-hep-1-ctrl 细胞明显增高,说明经过目的质粒感染改造的sk-hep-1-dll4细胞在蛋白水平成功过表达 dll4。
[0089]
实施例4:dll4基因过表达对内皮细胞系sk-hep-1的影响
[0090]
1.对细胞增殖的影响:
[0091]
将sk-hep-1-ctrl、sk-hep-1-dll4细胞按1000个/孔种于96孔板中,每种细胞设置 3个复孔,分别检测1、2、3、4天细胞活性,检测前2h每孔加入10μl cck8,37℃孵育2h 后在酶标仪上检测450nm处吸收光值,待4天均检测完毕后计算相对第一天均一化的细胞活性,利用graphpad绘制增殖曲线。
[0092]
增殖曲线如图7所示,可见sk-hep-1-dll4较sk-hep-1-ctrl细胞增殖速率明显增加,说明dll4过表达促进了sk-hep-1细胞的增殖。
[0093]
2.对细胞成管的影响:
[0094]
将sk-hep-1-ctrl和sk-hep-1-dll4细胞提前一天用基础培养基饥饿24h,bme(一种来源于engelbreth-holm-swarm肿瘤的减生长因子基质成分)原液50μl预先包被96孔板,37℃成膜后,胰酶消化细胞,完全培养基重悬,以1*104/孔细胞数接种细胞于bme包被的96孔板中,从接种开始每隔2小时显微镜下观察成管情况并拍照记录。
[0095]
成管结果如图8所示,可见sk-hep-1-dll4细胞成管持续时间较sk-hep-1-ctrl细胞短,成管能力较差,说明dll4过表达降低了sk-hep-1细胞的成管能力。
[0096]
实施例5:sk-hep-1-dll4对肝祖细胞heparg功能的影响
[0097]
本实施例将sk-hep-1-ctrl和sk-hep-1-dll4细胞分别与heparg细胞进行三维共培养,通过共聚焦成像和高内涵成像观察共培养后heparg基因表达情况,包括以下步骤:
[0098]
1)8%琼脂糖加热沸腾后,以50μl/孔预包被96孔板,开盖紫外照射30min,形成u 形96孔板。
[0099]
2)提前2h用10μg/ml丝裂霉素(mmc)处理sk-hep-1-ctrl和sk-hep-1-dll4细胞抑制细胞分裂使细胞停止生长,以总细胞数600/孔,按 sk-hep-1-ctrl/sk-hep-1-dll4:heparg=1:2比例将细胞接种于琼脂糖包被的96 孔板中。
[0100]
3)每2-3天将培养基半换液一次,继续培养10天。
[0101]
4)收集细胞球于96孔板(u形底),4%多聚甲醛室温固定30min。
[0102]
5)pbs洗三遍,0.25%triton x-100细胞破膜15min。
[0103]
6)pbs洗三遍,1%bsa封闭1小时。
[0104]
7)一抗4℃孵育过夜。
[0105]
8)pbs洗三遍,二抗室温避光孵育1小时。
[0106]
9)pbs洗三遍,0.1-1μg/ml hochest或dapi孵育细胞30min.
[0107]
10)pbs洗三遍,上机拍照成像。
[0108]
检测结果如图9所示,可见sk-hep-1-dll4共培养的heparg中ck19、mrp2和cx32 表达明显较对照组增高,说明过表达dll4的内皮细胞sk-hep-1-dll4有助于肝祖细胞胆管向功能的建立。
[0109]
实施例6
[0110]
利用transwell共培养形式将mmc处理过的sk-hep-1-ctrl/sk-hep-1-dll4以40000 个细胞/孔接种于上室,将heparg以300个细胞/孔接种于下室,每2-3天换液一次,用 heparg的完全培养基共培养10天后收集下室的heparg细胞进行胆管向分化基因的实时定量pcr表达检测,结果如图10所示。可见,sk-hep-1-dll4细胞的分泌物对heparg 细胞胆管向分化指标bsep、hes1、ck19、mrp1-6都具有上调作用。
[0111]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0112]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。