1.本发明属于培养基制备技术领域,具体涉及一种脐带间充质干细胞培养基。
背景技术:
2.脐带间充质干细胞(mscs)在体内或体外诱导条件下,可分化为脂肪、骨、软骨、肌肉、神经、肝、心肌、内皮等多种组织细胞,连续传代培养仍具有多向分化潜能,是理想的种子细胞可用于衰老和病变引起的组织器官损伤修复,人脐带间充质干细胞已成为细胞治疗的重要候选种子细胞,特别在组织修复和免疫调节方面有良好的应用前景。
3.目前市场上的无血清培养基制备培养脐带间充质干细胞存在随着传代、培养时间的延长,会表现增殖、黏附能力下降,细胞衰老或凋亡,且长期体外培养易发生自发分化,多潜能分化能力减弱或失去多分化潜能的问题。mscs对培养密度非常敏感,在低密度接种条件下可保持良好的增殖能力而不发生分化,生长到一定密度后由于接触性抑制,增殖能力降低,细胞易于发生分化。
4.体外长期培养msc,易导致msc的dna损伤,积累,增殖减慢,分化能力减弱,细胞表型改变,功能下降。在体外扩增或放射治疗过程中,干预措施可减轻msc中dna损伤的积累,对于获得功能良好的msc至关重要,具有临床重要意义。同时,富含血小板血浆激活后,超过90%预先合成的生长因子会在l小时内释放完毕,而生长因子半衰期短,体内容易被降解。
5.本发明的目的在于克服现有无血清培养基技术的不足之处,提供一种干细胞制备所需培养基的配制方法:干细胞无血清培养基的配制,适用于稳定的大规模间充质干细胞的培养体系;本发明能够建立稳定的干细胞制备流程;能够保持、促进间充质干细胞的增殖和多潜能分化能力。富含血小板血浆(prp)中含有丰富的复合生长因子,而且各种生长因子的浓度和配比符合生理需求,能显著促进mscs的增殖、分化和局部新生血管的形成。同时,通过调整培养基的组成,有效克服了生长因子半衰期短,体内容易被降解的技术问题。
技术实现要素:
6.为克服以上技术问题,本发明提供了一种优化的脐带间充质干细胞培养基,能够制备的脐带间充质干细胞,增殖速度快、数量多、表型稳定且多次传代后,仍能保持多潜能分化能力。
7.为实现以上目的,本发明提供的技术方案如下:一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基(dulbecco's modified eagle medium)、f12基础培养基(ham's f 12 nutrient medium)、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、人血小板裂解物(platelet-rich plasma,prp)。
8.优选地,所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为1-200um。
9.优选地,所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为1-3:5-10:0.5-2:
1-2。
10.优选地,所述培养基中dmem基础培养基和f12基础培养基的体积比为1-3:1,优选为1:1。
11.优选地,所述间充质干细胞培养基中维生素c的浓度为10-500um。
12.优选地,所述间充质干细胞培养基中唑来膦酸钠的浓度为0.1-50um。
13.优选地,所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的5-20%。
14.本发明的另一目的在于提供所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠,最后加入人血小板裂解物即可。
15.本发明的目的还在于提供所述脐带间充质干细胞培养基的应用,所述应用为将培养基应用于培养脐带间充质干细胞。
16.本发明的另一目的在于提供所述脐带间充质干细胞的制备方法,包括如下步骤:(1)将脐带经清洗、浸泡、分段处理后加入所述培养基中进行培养;(2)培养至待组织块细胞爬出且生长至70-80%融合时,对脐带间充质干细胞原代传代;(3)传代培养并收集p4,p10,p15细胞。
17.优选地,(1)中,所述清洗为先使用酒精消毒后再使用pbs清洗。
18.优选地,(1)中,所述浸泡为使用酒精浸泡0.5-3min。
19.优选地,(1)中,所述分段为将脐带分为2-3cm的脐带。
20.优选地,(1)或(3)中,所述培养在温度30-40℃,含体积百分比为3-7% co2的培养箱中进行。
21.优选地,(1)或(3)中,所述培养在温度37℃,含体积百分比为5% co2的培养箱中进行。
22.优选地,(3)中,所述传代培养的具体过程为:传至p3代时,按5000-10000 个细胞/平方厘米的密度接种于培养瓶中,加入30-60ml的配制好的培养基;将培养瓶水平放入培养箱中培养;p4,p10和p15代细胞接种96孔培养板,做细胞生长曲线检测。
23.与现有技术比,本发明的技术优势在于:(1)本发明提供了一种脐带间充质干细胞的培养基,该培养基能够制备脐带间充质干细胞,增殖速度快,数量多,表型稳定,多次传代后,仍能保持多潜能分化能力。
24.(2)本发明通过调整培养基的组成,有效克服了生长因子半衰期短,体内容易被降解的技术问题。
25.(3)本发明提供的无血清培养基以低浓度的人血小板裂解物与维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠复合使用,即可满足间充质干细胞的体外传代连续培养;试验结果表明,采用本发明提供的无血清培养基培养的人脐带间充质干细胞形态均一,且均能诱导分化为成骨细胞和脂肪细胞,细胞表面标志物表达符合标准,增殖效率高,培养效果与胎牛血清培养无明显差异。
26.(4)本发明提供的培养基中,芦丁、海藻多糖、舒伐他丁、依达拉奉具有较好的协同抗氧化作用,促进培养基对人脐带间充质干细胞的体外传代连续培养。
附图说明
27.图1:人脐带间充质干细胞生长血球计数板计数(细胞生长情况计数);图2:人脐带间充质干细胞生长曲线;图3:人脐带间充质干细胞多潜能分化(成骨分化)实验茜素红染色面积;图4:人脐带间充质干细胞多潜能分化(成脂分化)实验油红o染色面积;图5:人脐带间充质干细胞多潜能分化(成软骨分化)实验阿新蓝染色面积;现结合附图和实施例对本发明作进一步说明。
具体实施方式
28.下面通过具体实施例对本发明进行说明,以使本发明技术方案更易于理解、掌握,但本发明并不局限于此。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得;且不同来源对产品性能不具有显著性影响。
29.实施例1一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、人血小板裂解物。
30.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
31.所述间充质干细胞培养基中维生素c的浓度为200um。
32.所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为100um。所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为2:8:1:1。
33.所述间充质干细胞培养基中唑来膦酸钠的浓度为30um。
34.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的10%。
35.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸盐,最后加入人血小板裂解物即可。
36.实施例2一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、人血小板裂解物。
37.所述培养基中dmem基础培养基和f12基础培养基的体积比为3:1。
38.所述间充质干细胞培养基中维生素c的浓度为10um。
39.所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为10um。
40.所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为1:5:0.5:1。
41.所述间充质干细胞培养基中唑来膦酸钠的浓度为50um。
42.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的5%。
43.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠,最后加入人血小板裂解物即可。
44.实施例3
一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、人血小板裂解物。
45.所述培养基中dmem基础培养基和f12基础培养基的体积比为2:1。
46.所述间充质干细胞培养基中维生素c的浓度为500um。
47.所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为50um。
48.所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为3:10:2:2。
49.所述间充质干细胞培养基中唑来膦酸钠的浓度为0.1um。
50.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的20%。
51.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸盐,最后加入人血小板裂解物即可。
52.对比例1与实施例1的不同在于使用fbs替换人血小板裂解物。
53.一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、胎牛血清(fbs)。
54.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
55.所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为100um。所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为2:8:1:1。
56.所述间充质干细胞培养基中唑来膦酸钠的浓度为30um。
57.所述fbs为dmem基础培养基和f12基础培养基总体积的10%。
58.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸盐,最后加入fbs即可。
59.对比例2与实施例1相比,区别在于使用阿伦膦酸钠替换唑来膦酸盐。
60.一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、阿伦膦酸钠、人血小板裂解物。
61.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
62.所述间充质干细胞培养基中维生素c的浓度为200um。
63.所述间充质干细胞培养基中所述芦丁、海藻多糖、舒伐他丁和依达拉奉的总浓度为100um。所述芦丁、海藻多糖、舒伐他丁和依达拉奉的质量比为2:8:1:1。
64.所述间充质干细胞培养基中阿伦膦酸钠的浓度为30um。
65.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的10%。
66.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、舒伐他丁、依达拉奉、阿伦膦酸盐,最后加入人血小板裂解物即可。
67.对比例3与实施例1相比,区别在于使用海藻多糖替换芦丁。
68.一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠、人血小板裂解物。
69.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
70.所述间充质干细胞培养基中维生素c的浓度为200um。
71.所述间充质干细胞培养基中所述海藻多糖、舒伐他丁和依达拉奉的总浓度为100um。所述海藻多糖、舒伐他丁和依达拉奉的质量比为10:1:1。
72.所述间充质干细胞培养基中唑来膦酸钠的浓度为30um。
73.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的10%。
74.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、海藻多糖、舒伐他丁、依达拉奉、唑来膦酸钠,最后加入人血小板裂解物即可。
75.对比例4与实施例1相比,区别在于使用舒伐他丁替换依达拉奉。
76.一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、芦丁、海藻多糖、舒伐他丁、唑来膦酸钠、人血小板裂解物。
77.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
78.所述间充质干细胞培养基中所述芦丁、海藻多糖和舒伐他丁的总浓度为100um。所述芦丁、海藻多糖、舒伐他丁的质量比为2:8:2。
79.所述间充质干细胞培养基中唑来膦酸钠的浓度为30um。
80.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的10%。
81.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入芦丁、海藻多糖、舒伐他丁、唑来膦酸盐,最后加入人血小板裂解物即可。
82.对比例5与实施例1相比,区别在于使用依达拉奉替换舒伐他丁。
83.一种脐带间充质干细胞培养基,包括如下组分:dmem基础培养基、f12基础培养基、维生素c、芦丁、海藻多糖、依达拉奉、唑来膦酸钠、人血小板裂解物。
84.所述培养基中dmem基础培养基和f12基础培养基的体积比为1:1。
85.所述间充质干细胞培养基中维生素c的浓度为200um。
86.所述间充质干细胞培养基中所述芦丁、海藻多糖、依达拉奉的总浓度为100um。所述芦丁、海藻多糖、依达拉奉的质量比为2:8:2。
87.所述间充质干细胞培养基中唑来膦酸钠的浓度为30um。
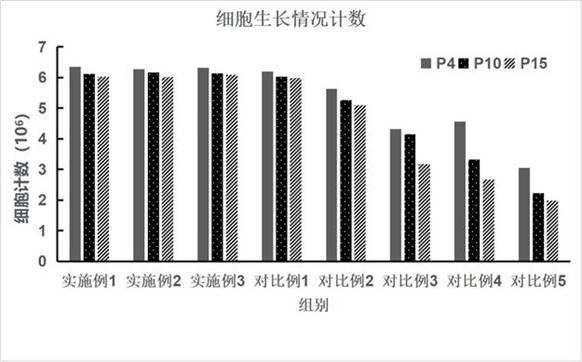
88.所述人血小板裂解物为dmem基础培养基和f12基础培养基总体积的10%。
89.所述培养基的制备方法,包括如下步骤:先将dmem基础培养基和f12基础培养基按比例混合,再依次加入维生素c、芦丁、海藻多糖、依达拉奉、唑来膦酸盐,最后加入人血小板裂解物即可。
90.1. 人脐带间充质干细胞分离培养(1)脐带的清洗与处理清洗:75%的酒精消毒脐带保存瓶后,放入安全柜内,取出脐带,用pbs清洗2遍;
浸泡:加入75%的酒精浸泡脐带30秒;分段:将脐带置于无菌培养皿中,用无菌手术剪剪成2-3 cm的小段;处理:去除动脉、静脉和外膜,剪碎;铺瓶:均匀平铺到t75培养瓶底部;培养:将平铺好脐带组织块的培养瓶放入二氧化碳培养箱内,倒置6小时;(2)培养往培养瓶中缓慢加入配置好的各组培养基5-10ml;将培养瓶水平放入37
°
c,体积百分比为5%的co2培养箱中培养;每4天换液1次,观察组织块边缘细胞生长情况,待组织块细胞爬出且生长至70-80%融合时,可对脐带间充质干细胞原代传代;(3)传代传至p3代时,按5000-10000个细胞/平方厘米的密度接种于t175培养瓶中,加入30ml的配制好的培养基;将培养瓶水平放入37
°
c,体积百分比为5%的co2培养箱中培养。
91.(4)收集p4,p10,p15待细胞长至70-90%融合时,弃去培养基,用10ml pbs缓冲液冲洗细胞表面1次;弃去pbs,加入6ml胰蛋白酶消化,轻轻晃动培养瓶使胰蛋白酶覆盖瓶底,迅速在镜下观察,待细胞皱缩成球状时轻轻拍打培养瓶外侧使细胞漂浮起来;加入等量的培养基,终止消化;收集细胞悬液,1200rpm,6升6降,离心5min;弃去上清液,加10mlpbs重悬细胞,注意轻轻吹打,避免产生气泡,离心;最后一次离心后,弃去上清液,用10mlpbs重悬细胞。
92.(5)分别取p4,p10,p15细胞0.1ml细胞悬液,用血球计数板计数,进行细胞生长情况计数;按照以上方法对各实施例和对比例制备的培养基进行人脐带间充质干细胞分离培养。
93.结果显示:实施例1培养方案培养的细胞传至p15,细胞增殖能力仍然很强,数量较多,与对比例1含10�s的相当,好于对比例2含阿仑膦酸钠及其它各组的方案。细胞生长情况计数,见图1。
94.(6)分别取p4,p10,p15细胞1*107/ml细胞悬液做细胞表型流式鉴定;收集p4、p10和 p15细胞,调整细胞浓度为1
×
107个/ml,加入抗体cd73、cd90、cd105、cd34和cd45,室温避光孵育30min,采用pbs代替一抗(一抗指的是抗体cd73、cd90、cd105、cd34和cd45)作为空白对照组,采用流式细胞仪检测细胞表面抗原的表达,结果如下表1所示。
95.表1 人脐带间充质干细胞表型鉴定
由上表可知,各组细胞表面抗原cd73、cd90和cd105呈阳性表达,cd34和cd45呈阴性表达,其中,实施例1培养获得的细胞cd73、cd90和cd105阳性率均在95%以上,cd45和cd34阳性率低于2%,符合人脐带间充质干细胞的表型特征,且与10�s培养的人脐带间充质干细胞表面抗原表达无明显差异,好于对比例2,更优于对比例3-5。显示本发明提供的无血清培养基适于培养人脐带间充质干细胞。同时,培养基的组成对其性能具有一定的影响。
96.(7)分别做p4,p10,p15细胞生长曲线检测。
97.按照以下方法对各实施例和对比例制备的培养基进行人脐带间充质干细胞进行细胞生长曲线检测。
98.人脐带间充质干细胞增殖能力检测:收集p4、p10、p15代对数生长期的人脐带间充质干细胞悬液,调整细胞浓度为1
×
104个/ml,接种于96孔板中,每块分为8组,每组设3个复孔。24h后每天取一组,吸去培养液,加入cck-8溶液,继续在于37℃、5% co2的培养箱下避光孵育4h,于酶标仪490nm波长处测吸光度(a)值,重复3次,取平均值。以细胞培养时间为横轴、吸光度a值为纵轴绘制细胞生长曲线,结果如图2所示。
99.从图2可看出,实施例1与10%胎牛血清培养组(对比例1)细胞生长曲线大致呈现“s”型,包含典型的潜伏期、对数生长期及平台期;其中,实施例1和对比例1相当,较其它各组生长更好,从第二天开始细胞增殖加速,进入对数生长期,第7天进入平台期。对比例组间充质干细胞潜伏期更长,且增殖较慢。
100.(8)分别取p4,p10,p15细胞,进行多潜能分化实验检测。
101.按照以下方法,评价各实施例和对比例制备的培养基进行人脐带间充质干细胞分离培养获得的间充质干细胞的成骨诱导、成脂诱导及成软骨诱导的分化能力。
102.①
成骨诱导:使用oricell
®
人脐带间充质干细胞成骨诱导分化试剂盒(赛业(广州)生物科技有限公司,huxuc-90021,200ml/kit)进行成骨诱导。
103.成骨诱导组:收集p4、p10、p15细胞,按1
×
104/cm2的密度分别接种到6孔板,2ml/孔,于37℃、5%co2的培养箱中静置培养,至细胞长至80%时,吸弃原培养液,加入成骨诱导分化液(试剂盒中成分,也称成骨诱导分化物),每隔3d换液1次,培养21天后,采用4%多聚甲醛
固定后进行茜素红染色观察,显微镜下观察结果,统计染色面积。
104.同时,按同样方法做阴性对照组,阴性对照组的区别仅在于未加成骨诱导分化液,成骨诱导组与阴性对照组的茜素红染色面积相对值的结果如附图3所示。
105.②
成脂诱导:oricell
®
人脐带间充质干细胞成脂诱导分化试剂盒(赛业(广州)生物科技有限公司,huxuc-90031,300ml/kit)进行成脂诱导。
106.诱导组:收集p4、p10、p15细胞,按1
×
104/cm2的密度分别接种到6孔板,2ml/孔,于37℃、5% co2的培养箱中静置培养,至细胞长至70%时,吸弃原培养液,加入成脂诱导分化液(试剂盒中成分,也称成脂诱导分化物),每隔3d换液1次,培养21天后,采用4%多聚甲醛固定后进行油红o染色观察,显微镜下观察结果,统计染色面积。
107.同时,按同样方法做阴性对照组,阴性对照组的区别仅在于未加成脂诱导分化液,成脂诱导组与阴性对照组的油红o染色面积相对值的结果如附图4所示。
108.③
成软骨诱导:使用oricell
®
人脐带间充质干细胞成软骨诱导分化试剂盒(赛业(广州)生物科技有限公司,huxuc-90041,100ml/kit)进行成软骨诱导。
109.成软骨诱导组:收集p4、p10、p15细胞,调整细胞浓度为1.5
×
105/ml,取2ml接种到6孔板中,于37℃、5%co2的培养箱中静置培养,2h后加入预热的成软骨诱导分化液 (试剂盒中成分,也称成软骨诱导分化物),每隔3d换液1次,培养14天后,4%多聚甲醛固定、石蜡包埋、切片,阿新蓝染色观察,显微镜下观察结果,统计染色面积。
110.同时,按同样方法做阴性对照组,阴性对照组的区别仅在于未加成软骨诱导分化液,成软骨诱导组与阴性对照组的阿新蓝染色面积相对值的结果如附图5所示。
111.结果显示:各组细胞传代至p15,实施例1培养获得的间充质干细胞在成骨诱导、成脂诱导及成软骨诱导分化能力与对比例1含10%胎牛血清组培养的人脐带间充质干细胞无统计学差异。好于对比例2,更好于对比例3-5。
112.上述详细说明是针对本发明其中之一可行实施例的具体说明,该实施例并非用以限制本发明的专利范围,凡未脱离本发明所为的等效实施或变更,均应包含于本发明技术方案的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。