黄瓜csivp基因在高温耐受性方面的应用
技术领域
1.本发明属于分子生物学技术领域,更具体地,涉及黄瓜csivp基因在高温耐受性方面的应用。
背景技术:
2.大田作物一直在逆境中生长,会影响其产量和品质。这些胁迫包括非生物胁迫,如氮缺乏和高温,以及各种生物胁迫,包括真菌和细菌的感染。不像动物,植物无法移动,面对多变的环境,它必须在形态、生理和分子水平上做出迅速响应。例如,在缺氮条件下生长的植物发育延缓,具有细茎和改变根系结构。植物可以通过结构的变化来减少热造成的损害,包括胚轴伸长增加、叶片的次生生长和木质部维管扩大。研究表明植物对多种胁迫的反应不同于单个种胁迫,但植物对多种胁迫的抵御机制鲜有研究。
3.高温阻碍生长,导致低光合速率、活性氧产生和代谢物积累变化,从而导致生命周期缩短和植物生产力下降。因此,植物进化出了多种应对高温的反应机制;在这些机制中,植物热休克转录因子在调控网络中起着关键作用。在高温下,hsfa1接收热应激信号,然后刺激许多转录因子的表达,这些转录因子参与了植物耐热性的关键转录调节级联。erf/ap2家族转录因子dreb2a作为hsfa1的直接靶标,在高温下快速上调。在对高温的反应中,bzip家族基因参与内质网中未折叠蛋白反应的反应。bhlh转录因子光敏色素相互作用因子4(pif4)已被证明能控制形态对高温的适应。
4.csivp参与了植物发育、营养运输等过程,但是对于高温胁迫的相应相关的研究和报道还暂未发现。
技术实现要素:
5.本发明所要解决的技术问题是克服现有技术中存在的上述问题,首先提供黄瓜csivp基因在开发、筛选提高植物对高温胁迫的耐受的功能产品方面的应用。
6.本发明的第二个目的是提供一种构建耐高温胁迫的黄瓜的方法。
7.本发明的目的通过以下技术方案实现:
8.黄瓜csivp基因在开发、筛选提高植物对高温胁迫的耐受的功能产品方面的应用,所述功能产品对csivp基因或其表达产物具有抑制作用。
9.优选的,所述功能产品具有下调csivp基因的表达、转录、或其表达产物的功能。
10.更优选的,所述功能产品选自csivp核酸抑制剂、csivp蛋白抑制剂、csivp基因缺陷或者沉默的基因重组构建体中的一种或多种。
11.作为一种具体的实施方式,所述功能产品包括以下任一种:
12.(i)以csivp转录本为靶序列,且能够抑制csivp基因表达产物表达或者基因转录的小干扰rna、dsrna、shrna、微小rna、反义核酸;
13.(ii)含有csivp互补序列,且能够在转入体内后形成抑制csivp基因表达产物表达或者基因转录的干扰分子的构建体;
14.(iii)抑制或者敲除csivp基因序列后的基因重组构建体。
15.本发明还探索了csivp介导高温反应的调控网络,对转录组数据进行了分析,先前的研究表明,先前的研究表明,植物中经典的热休克反应(hsr)调节因子是热休克因子(hsfs)转录因子家族的成员,它调节许多编码热休克蛋白(hsps)和其他因子的基因的表达。与wt叶脉相比,r5叶脉中有9个热休克蛋白和相应的8个热休克蛋白上调。此外,部分转录因子,包括dreb2c、mbf1b和wrky33,在r5植物中也有高积累。这些结果表明,csivp可能通过与hsr核心调控者及其直接靶标的相互作用来调控高温反应。
16.因此,优选的,上述csivp基因通过于hsr核心调控者及其直接靶标的相互作用来调控植物对高温的反应。具体的,csivp介导了的关键高温调节因子,如热休克蛋白、热休克蛋白、dreb2c、mbf1b和wrky33。
17.因此,更优选的,所述hsr核心调控者包括转录因子dreb2c、mbf1b和wrky33。
18.本发明还提供一种构建耐高温胁迫的黄瓜的方法,包括以下步骤:
19.(1)构建以csivp基因作为靶基因的rna干扰载体;
20.(2)将构建的rna干扰载体转化到植物中,和;
21.(3)筛选获得阳性转基因植物;
22.其中,所述阳性转基因植物与未转入rna干扰载体的植物相比,具有如下性状中的至少一种性状:(a)对高温的抗性增强;(b)植物叶片表皮细胞角质层增厚;(c)植物细胞水分稳态相关基因显著上调。
23.与现有技术相比,本发明具有以下有益效果:
24.本发明通过rna干扰(rnai)敲除csivp来增强黄瓜对高温胁迫的抗性。在对高温的响应过程中,csivp介导了的关键高温调节因子,如热休克蛋白、热休克蛋白、dreb2c、mbf1b和wrky33。因此,csivp参与了植物发育、营养运输和抵御高温的过程,为选育富含营养和耐热品种提供了一个潜在的有价值的目标。鉴定或者创造产量、养分利用率及高温耐受性高的等位基因将带来巨大的科技和经济效应。
附图说明
25.图1为csivp同源物的蛋白质分析和β
‑
葡萄糖醛酸酶(gus)分析;
26.图2为拟南芥csivp转基因植株的果实表型;
27.图3为野生型和csivp
‑
rnai转基因植物的表型和转录组分析;
28.图4为csivp
‑
rnai植物对氮缺乏的反应和相关的生理测量;
29.图5为对照和缺氮条件下野生型和r5植物中选择的硝酸盐转运体的表达水平;
30.图6为csivp
‑
rnai植物对高温和相关生理测量的响应;
31.图7为拟南芥csivp转基因植株的csivp表达量检测和花表型观察;
32.图8为csivp
‑
rnai植株和野生型中显著差异的转录因子表达模式分析;
33.图9为csivp
‑
rnai植株和野生型中显著差异的转运基因表达模式分析。
具体实施方式
34.下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明
各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
35.下述实施例以及实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料;所用的设备,如无特殊说明,均为常规实验设备。
36.实施例1
37.一、在ncbi子程序nucleotide(https://www.ncbi.nlm.nih.gov/nuccore/?term=)中查找到黄瓜(cucumis sativus l.)的bhlh家族相关基因序列,通过进化树分析,鉴定到一个与十字花科中ind基因高度同源的bhlh基因,命名为csivp,并且根据数据库中csivp基因的完整cds(coding sequence)的序列作为参考序列,在开放阅读框两端设计特异pcr引物,以黄瓜品种“新泰密刺”cdna为模板,克隆出csivp基因片段。
38.扩增引物:
39.csivp
‑
clone
‑
f atggacccccatcacctctcaa;
40.csivp
‑
clone
‑
r tcaccatcctgttggtgtaatagca。
41.pcr反应体系:
42.dna模板1μl;
[0043]2×
hifitaq pcr starmix(genstar)25μl;
[0044]
正向引物(10μm)1μl;
[0045]
反向引物(10μm)1μl;
[0046]
ddh2o up to 50μl。
[0047]
pcr扩增程序为:
[0048]
94℃预变性2min;
[0049]
94℃变性30s,55℃退火30s,72℃延伸50s,35个循环;
[0050]
72℃延伸5min。
[0051]
对获得的黄瓜csivp基因序列进行同源性分析,通过ncbi blastp(https://blast.ncbi.nlm.nih.gov/blast.cgi)获得其他物种的同源氨基酸序列,使用dnaman进行序列比对分析。
[0052]
结果:之前,我们鉴定了bhlh转录因子csivp,它与边缘组织木质化的调节因子ind具有高度的序列同一性。序列比对显示,在十字花科植物和蔬菜作物如黄瓜、甜瓜和番茄之间的bhlh结构域中有6个保守氨基酸不同(图1a)。为了研究csivp在拟南芥中的表达,获得了表达pcsivp
‑
gus的拟南芥品系。gus活性集中在根、茎和叶维管组织中。
[0053]
二、为了研究csivp在功能上是否与拟南芥中的ind相似,构建了过表达载体35s:csivp,并成功转化拟南芥野生型col和ind
‑
2突变体拟南芥,对转基因拟南芥进行组织染色鉴定。方法如下:
[0054]
35s:csivp载体引物如下:
[0055]
csivp
‑
oe
‑
f:gctctagagcatggacccccatcacctctc;
[0056]
csivp
‑
oe
‑
r:tcccccgggggatcaccatcctgttggtgtaatagc。
[0057]
重组载体构建方法及拟南芥转化方法如上。对过表达csivp基因的拟南芥株系进行荧光定量检测,荧光定量引物如下:
[0058]
csivp
‑
q
‑
f:ccattcggaagcctaagc;
[0059]
csivp
‑
q
‑
r:gcggttgacttgactgtag。
[0060]
对新鲜组织进行固定,制作成石蜡切片,并染色观察,使用间苯三酚法染色观察木质素细胞情况,使用番红固绿法观察组织细胞结构。方法如下:
[0061]
样品的处理:对样品使用faa固定,通过脱水脱色浸蜡包埋等石蜡切片的一系列操作手段,将材料制成石蜡薄片。对样品石蜡切片进行脱蜡处理:50%二甲苯,5分钟,二甲苯 50%乙醇,5分钟,100%、95%、85%、70%、50%、30%酒精梯度各5分钟,超纯水清洗5分钟后,进行染色处理。
[0062]
间苯三酚法染色:将脱蜡的切片材料置于载玻片上,滴加50
‑
100μl木质素酸化液,放置浸透材料5分钟,在上述酸化材料滴加等量间苯三酚染色液,放置5分钟,无水乙醇脱水5min,50%二甲苯 50%乙醇透明5min,二甲苯5min。中性树脂封片烘干,显微镜观察。
[0063]
番红固绿法染色:脱蜡切片材料入番红染色液染色1
‑
12h,酸性乙醇分化液分化15s,使用35%、50%、70%、80%乙醇梯度脱色,各2min,超纯水洗1min。入固绿染色液内浸染10
‑
40s,超纯水洗1min。无水乙醇脱水3
‑
5min,再无水乙醇脱水5min,50%二甲苯 50%乙醇透明5min,二甲苯5min。使用中性树脂封片,42℃烘干后,在显微镜下观察。
[0064]
结果:为了研究csivp在功能上是否与拟南芥中的ind相似,我们首先将csivp转化野生型(wt)col生态型和ind
‑
2突变体拟南芥,使其由35s启动子驱动。ind调节拟南芥木质化层和分离层的发育,ind
‑
2突变体长角果在成熟时不能打开,这阻止了种子的分散。获得了三种代表性的35s:csivp/ind
‑
2转基因植物,通过荧光定量分析得知rna转录水平显著增加,经快速定量聚合酶链反应验证(图2a
‑
d,7a)。ind
‑
2果实的不裂表型不能通过csivp的异位表达来挽救(图2e)。由于ind通过影响瓣缘木质化层来控制角果开裂,因此我们使用间苯三酚对ind
‑
2突变体和转基因果实的瓣缘进行了检测,间苯三酚对木质素细胞进行了特殊染色(图2f
‑
g)。与ind
‑
2突变体一样,在转基因果实系21的整个边缘没有观察到木质化细胞(图2f
‑
g)。用藏红o和阿奇蓝染色的瓣膜组织的横截面也证明了ind
‑
2突变体和品系21中的木质化和分离细胞不明显(图2h
‑
i),而复制子的维管束与野生型植物相比变得更小(图2f
‑
i)。这些结果表明拟南芥的ind和黄瓜的csivp之间存在功能差异。
[0065]
为了进一步研究csivp在拟南芥中的作用,将csivp的过表达的载体转到拟南芥中,获得了三个有代表性的35s:csivp/col株系,其中,相对于atind在拟南芥中的过表达,ic13株系在心皮状萼片和柱头组织的雄蕊中上调了30,000倍。一些转基因植物产生了具有粗糙外部瓣膜表面的角果(图2j),如:35s:csivp/ind
‑
2株系中(图2a
‑
d)。扫描电子显微镜显示,来自两个转基因系的果实与野生型果实相比,在瓣膜表面具有明显的凸起(图2k
‑
m)。用阿尔钦蓝染色的瓣膜组织的横截面显示,与野生型瓣膜相比,瓣膜变薄,表皮细胞趋向于小且不规则(图2n
‑
p)。木质化细胞在转基因水果品系的边缘不受影响,如在野生型品系中(图2q
‑
s)。这些结果表明,csivp在黄瓜果实发育的调控中起作用。
[0066]
三、为了进一步验证黄瓜csivp基因的功能,构建了csivp
‑
rnai干涉载体,载体引物如下:
[0067]
csivp
‑
sense
‑
f ggactagtccatcacctctcaaaccctcc;
[0068]
csivp
‑
sense
‑
r cgggatcccgatacatcatctccttcatcgc;
[0069]
csivp
‑
antisense
‑
f ttggcgcgccaaatcacctctcaaaccctcc;
[0070]
csivp
‑
antisense
‑
r gcgatttaaatcggatacatcatctccttcatcgc。
[0071]
通过黄瓜组培方法,成功获得沉默csivp的黄瓜阳性植株,使用透射电子显微镜(tem)观察野生型和沉默株系的表皮细胞,并对两者进行转录组测序,并对差异基因进行数据分析。通过氮素限制实验,使用li
‑
6400xt便携式光合作用测量系统测定了黄瓜野生型和沉默株系的叶片的光合速率、细胞间co2浓度、电导率和蒸腾速率等指标。
[0072]
对氮素运输相关基因进行了荧光定量检测,荧光引物如下:
[0073]
csnrt1.7
‑
f tcgtcccgactctccgtaaa;
[0074]
csnrt1.7
‑
r ttggcttgattccttctctgc;
[0075]
csnrt2.1
‑
f accttcaacatcacccattt;
[0076]
csnrt2.1
‑
r ttctggctctatttgacttcg;
[0077]
csnrt2.5
‑
f ggggaaaaggcaaaagaca;
[0078]
csnrt2.5
‑
r gacgaaaggaacgacacca;
[0079]
csnrt1.2
‑
f tctcctgggcttctctgg;
[0080]
csnrt1.2
‑
r gaatctctcaaggtgataatggt;
[0081]
csnrt1.1
‑
f tccacctccttgccatcctat;
[0082]
csnrt1.1
‑
r aagtcccactgctgacgaaca;
[0083]
csnrt3.1
‑
f cttggctgctctctttctgtctt;
[0084]
csnrt3.1
‑
r gcttcgccttgatgttcttgtaa;
[0085]
csnrt1.9
‑
f ggggctatttcagcgatgt;
[0086]
csnrt1.9
‑
r ttgaccctccaatgctcctc;
[0087]
csnrt1.12
‑
f gagaaggtggggagttacgga;
[0088]
csnrt1.12
‑
r cagcagaccaaaaaaacagga。
[0089]
为了研究csivp
‑
rnai转基因植物的耐热性,对野生型和沉默株系进行了高温43℃处理,暗处理半小时后,在叶绿素荧光成像仪(plantexplorer,phenovation,the netherlands)测定了其叶绿素荧光各参数(fv/fm,npq,etr,qn,qp,psii)的变化情况。
[0090]
结果:敲除csivp导致矮化植物具有扩大的维管组织和向下卷曲的叶子(图3a
‑
d)。前期研究表明csivp介导的维管功能在生物胁迫反应中发挥重要作用,特别是对霜霉病。植物表皮在减少水分流失、保护植物免受热胁迫和减少病原体入侵方面起着至关重要的作用。通过透射电子显微镜(tem)观察表皮细胞表明,与wt叶相比,在csivp
‑
rnai植物的成熟叶中,角质层显著增厚(图3e
‑
h)。转录组数据的功能类别富集分析表明,在csivp
‑
rnai植物叶脉中上调的基因中,与对温度刺激的反应、对高光强度的反应、细胞水分稳态、韧皮部运输和对营养水平的反应的调节相关的基因显著富集(图3i
‑
j),表明csivp可能参与非生物胁迫反应。聚类分析表明,与野生型植物相比,在csivp
‑
rnai植物的叶脉中,蛋白激酶在细胞水分稳态中的表达、hsf家族基因对高光强度的反应、wrky家族基因对营养水平的反应的调节以及rlp家族基因在韧皮部运输中的表达显著增加(图8a
‑
d)。这些结果表明,csivp可能通过与这些调节因子的相互作用来调节对非生物胁迫的反应。
[0091]
在转录组数据中转运和营养相关基因明显改变(图3),为了研究csivp如何影响营养转运,对野生型和转基因品系进行了限氮处理。观察到,转基因植株中褪色绿叶比野生型株系少,这表明转基因植物对氮限制的抗性更强。氮限制4天后,野生型植物的三片老叶变成淡绿色,这是典型的早期氮缺乏症状,而在csivp
‑
rnai植物中,只有第三片真叶表现出这
种症状(图4a
‑
b)。玉米和水稻幼苗可以增强根伸长,以增加对氮素的吸收。在目前的研究中,野生型幼苗对氮限制敏感,并且经历了异常的根纵向生长,而csivp
‑
rnai植物对氮缺乏的耐受性强得多,并且与对照植物相比,根长度仅表现出微小的差异(图4c)。当在全营养液中生长时,与野生型植物相比,csivp
‑
rnai转基因植物在幼叶中的氮、磷和钾浓度较高,在老叶中的浓度较低(图4d
‑
f)。在氮限制下,csivp
‑
rnai植物的幼叶、老叶和根中的氮浓度显著高于野生型植物(图4d),表明转基因植物具有更大的运输或吸收能力。在氮限制下,野生型和转基因植株叶片的光合速率、细胞间co2浓度、对h2o的电导和蒸腾速率均降低,但r5株系叶片的始终高于转基因植株(图4g
‑
j),表明转基因植株的光合系统更稳定。
[0092]
在csivp
‑
rnai叶脉中有29个转运蛋白基因的表达水平上调(图9a
‑
e;表1),表明在csivp
‑
rnai维管组织中转运增强。然后,基因表达分析表明十三个转运蛋白中的九个(九个硝酸盐转运蛋白,nrts两个铵转运蛋白,amts一个磷酸盐转运体,pt;和一种钾转运蛋白hak5)在csivp
‑
rnai植物中具有较高的表达(图5)。具体而言,拟南芥中高亲和力硝酸盐吸收/转运的两个主要贡献者nrt2.1和nrt2.5在缺氮转基因植物中的表达显著增加(图5)。nrt1.7、nrt1.9和nrt1.12调节硝酸盐从老叶到幼叶的再分配,在氮限制下,它们在csivp
‑
rnai植物中也表现出显著的上调,csnrt1.7的表达增加了近20倍。
[0093]
表1 csivp
‑
rnai植株和野生型的差异表达转运基因id和基因名称注释
[0094][0095]
为了研究csivp
‑
rnai转基因植物的耐热性,将野生型和品系r5植物置于高温条件下。高温处理1d后,wt植物的叶子显示出典型的热敏症状,即向下卷曲的叶子具有棕色边缘,而r5植物仍然保持正常和绿色的叶子(图6a)。为探讨高温胁迫下的光合系统,测定了叶片叶绿素荧光和光合系统参数。与r5植物相比,wt植物的psii光化学的最大量子效率(fv/fm)和相对电子转移速率(etr)都降低了(图6b
‑
d),表明csivp
‑
rnai转基因植物在高温胁迫下表现出增强的光系统活性。r5植物的耐热表型在高温胁迫2天后得到证实(图6e
‑
h)。wt植物的所有叶片都枯萎并显著降低了光合能力,而r5植物底部只有几片老叶枯萎(图6e
‑
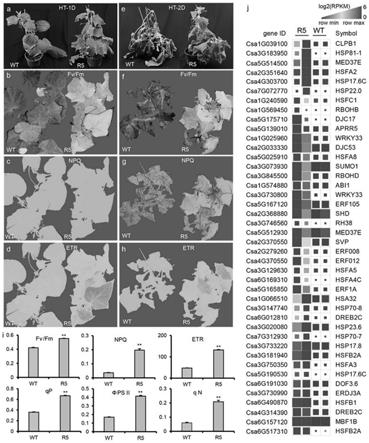
h)。正如预期的那样,与r5植物相比,wt植物的fv/fm、非光化学猝灭(npq)和etr显著下降(图6i)。此外,其他三个光合系统参数[即光化学猝灭(qp)、光系统ii的量子产量(psii)、非225光化学猝灭(qn)]也与r5植物的光合能力提高一致(图6i)。为了探索csivp介导高温反应的调控网络,对转录组数据进行了分析。先前的研究表明,植物中经典的热休克反应(hsr)调
节因子是热休克因子(hsfs)转录因子家族的成员,它调节许多编码热休克蛋白(hsps)和其他因子的基因的表达。与wt叶脉相比,r5叶脉中有9个热休克蛋白和相应的8个热休克蛋白上调(图6j)。此外,部分转录因子,包括dreb2c、mbf1b和wrky33,在r5植物中也有高积累。这些结果表明,csivp可能通过与hsr核心调控者及其直接靶标的相互作用来调控高温反应。
[0096]
黄瓜中csivp基因对高温的响应
[0097]
植物进化出了多种反应机制,其中许多机制使它们能够避免和忍受高温。叶片缺氧、失水减少、木质部导管扩大和膜脂组成变化是对高温做出反应的典型特征。我们发现csivp功能的丧失导致叶子向下卷曲(图3)。此外,在csivp
‑
rnai转基因叶片的表皮细胞中,角质层变得增厚(图3e
‑
h)。叶片方向的变化和叶片表面角质层的增厚有助于减少太阳辐射的吸收
37
。事实上,csivp
‑
rnai转基因植物对高温的抗性增强(图6)。此外,光合作用对高温高度敏感,并且在其他生理过程受损之前被抑制,在csivp
‑
rnai植物中比在wt植物中更稳定(图6)。csivp
‑
rnai植物中的这种表型变化有可能防止在升高的温度下对光合器官的损害。高温对植物的不利影响也与水分流失有关,水分流失会导致植物死亡。角质层是阻止叶片、果实和维管植物其他组织水分流失的高效屏障,尽管角质层水渗透性和角质层厚度之间的相关性存在争议。考虑到r5植物角质层的变化,高温胁迫下csivp
‑
rnai植物的水分状况可能与表皮细胞角质层的厚度或组成有关。与野生型植物相比,csivp
‑
rnai植物的细胞水分稳态相关基因显著上调(图8a)。这表明csivp参与了高温条件下的水分动态平衡。
[0098]
为了研究耐高温机制,必须研究潜在的分子反应机制。在这些机制中,热休克蛋白和热休克蛋白对于保护细胞免受高温是重要的。三种热休克因子在调节番茄热应激中起核心作用。原初反应受热休克蛋白1a调节,热休克蛋白2控制获得性耐热性;然而,hsfb1是hsfa1a的辅激活剂,也是hsfa1b和hsfa238的转录阻遏物。热胁迫条件下,在番茄花药组织中诱导产生热休克蛋白a2和热休克蛋白17
‑
cii
39
。脱水反应元件结合蛋白(dreb)家族在调节植物对非生物胁迫的反应中起重要作用。drb2c和hsfa3是耐热性反应的关键调节因子,drb2c作为hsfa340的转录激活因子发挥作用。与野生型植物相比,hsfa2、hsfa3、hsfb1和dreb2c在csivp
‑
rnai转基因植物中明显上调(图6j)。此外,转录因子,如wrky家族中的转录因子,参与植物对热胁迫的反应。wrky25、wrky26和wrky33的组成型表达增强了拟南芥对热胁迫的抗性,类似于wrky33在r5植物中的表达模式(图6)。因此,我们猜想csivp通过调节hsfa介导的途径或以其他方式协调多个转录因子的表达来调节高温反应。
[0099]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。